Reakcje związku są następujące. Wprowadzenie do chemii ogólnej
Reakcja chemiczna- jest to „przekształcenie” jednej lub większej liczby substancji w inną substancję o innej strukturze i składzie chemicznym. Powstałą substancję lub substancje nazywa się „produktami reakcji”. Podczas reakcji chemicznych jądra i elektrony tworzą nowe związki (redystrybuowane), ale ich ilość się nie zmienia, a skład izotopowy pierwiastków chemicznych pozostaje taki sam.
Wszystkie reakcje chemiczne dzielą się na proste i złożone.
Na podstawie liczby i składu substancji wyjściowych i powstałych proste reakcje chemiczne można podzielić na kilka głównych typów.
Reakcje rozkładu to reakcje, podczas których z jednej substancji złożonej otrzymuje się kilka innych substancji. Jednocześnie utworzone substancje mogą być zarówno proste, jak i złożone. Z reguły do zajścia reakcji rozkładu chemicznego konieczne jest ogrzewanie (jest to proces endotermiczny, absorpcja ciepła).
Na przykład podczas ogrzewania proszku malachitowego powstają trzy nowe substancje: tlenek miedzi, woda i dwutlenek węgla:
Cu 2 CH 2 O 5 = 2CuO + H 2 O + CO 2
malachit → tlenek miedzi + woda + dwutlenek węgla
Gdyby w przyrodzie zachodziły tylko reakcje rozkładu, wówczas wszystkie złożone substancje, które mogą się rozłożyć, uległyby rozkładowi i zjawiska chemiczne nie mogłyby już zachodzić. Ale są inne reakcje.
W reakcjach złożonych kilka prostych lub złożonych substancji tworzy jedną złożoną substancję. Okazuje się, że reakcje złożone są odwrotnością reakcji rozkładu.
Na przykład, gdy miedź jest podgrzewana na powietrzu, pokrywa się ona czarną powłoką. Miedź przekształca się w tlenek miedzi:
2Cu + O2 = 2CuO
miedź + tlen → tlenek miedzi
Reakcje chemiczne pomiędzy substancją prostą i złożoną, podczas których atomy tworzące substancję prostą zastępują atomy jednego z pierwiastków substancji złożonej, nazywane są reakcjami podstawienia.
 Na przykład, jeśli zanurzysz żelazny gwóźdź w roztworze chlorku miedzi (CuCl2), to (gwóźdź) zacznie pokrywać się miedzią uwolnioną na jego powierzchni. Pod koniec reakcji roztwór zmienia kolor z niebieskiego na zielonkawy: zamiast chlorku miedzi zawiera teraz chlorek żelaza:
Na przykład, jeśli zanurzysz żelazny gwóźdź w roztworze chlorku miedzi (CuCl2), to (gwóźdź) zacznie pokrywać się miedzią uwolnioną na jego powierzchni. Pod koniec reakcji roztwór zmienia kolor z niebieskiego na zielonkawy: zamiast chlorku miedzi zawiera teraz chlorek żelaza:
Fe + CuCl 2 = Cu + FeCl 2
Żelazo + chlorek miedzi → miedź + chlorek żelaza
Atomy miedzi w chlorku miedzi zostały zastąpione atomami żelaza.
Reakcja wymiany to reakcja, podczas której dwie złożone substancje wymieniają swoje części składowe. Najczęściej takie reakcje zachodzą w roztworach wodnych.
W reakcjach tlenków metali z kwasami dwie złożone substancje - tlenek i kwas - wymieniają swoje części składowe: atomy tlenu na reszty kwasowe i atomy wodoru na atomy metalu.
Na przykład, jeśli tlenek miedzi (CuO) połączy się z kwasem siarkowym H2SO4 i podgrzeje, otrzyma się roztwór, z którego można wydzielić siarczan miedzi:
CuO + H 2 SO 4 = CuSO 4 + H 2 O
tlenek miedzi + kwas siarkowy → siarczan miedzi + woda
blog.site, przy kopiowaniu materiału w całości lub w części wymagany jest link do oryginalnego źródła.
7.1. Podstawowe typy reakcji chemicznych
Przekształcenia substancji, którym towarzyszą zmiany ich składu i właściwości, nazywane są reakcjami chemicznymi lub interakcjami chemicznymi. Podczas reakcji chemicznych skład jąder atomowych nie ulega zmianie.
Zjawiska, w których zmienia się kształt lub stan fizyczny substancji lub zmienia się skład jąder atomowych, nazywane są fizycznymi. Przykładem zjawisk fizycznych jest obróbka cieplna metali, podczas której zmienia się ich kształt (kucie), topienie metalu, sublimacja jodu, przemiana wody w lód lub parę itp., a także reakcje jądrowe, w wyniku czego atomy powstają z atomów niektórych pierwiastków innych pierwiastków.
Zjawiskom chemicznym mogą towarzyszyć przemiany fizyczne. Na przykład w wyniku reakcji chemicznych zachodzących w ogniwie galwanicznym powstaje prąd elektryczny.
Reakcje chemiczne są klasyfikowane według różnych kryteriów.
1. Zgodnie ze znakiem efektu termicznego wszystkie reakcje są podzielone na endotermiczny(postępując zgodnie z absorpcją ciepła) i egzotermiczny(przepływający wraz z wydzielaniem ciepła) (patrz § 6.1).
2. Na podstawie stanu skupienia substancji wyjściowych i produktów reakcji wyróżnia się:
reakcje jednorodne, w którym wszystkie substancje są w tej samej fazie:
2 KOH (p-p) + H 2 SO 4 (p-p) = K 2 SO (p-p) + 2 H 2 O (l),
CO (g) + Cl 2 (g) = COCl 2 (g),
SiO 2(k) + 2 Mg (k) = Si (k) + 2 MgO (k).
reakcje heterogeniczne, substancje, w których znajdują się w różnych fazach:
CaO (k) + CO 2 (g) = CaCO 3 (k),
CuSO 4 (roztwór) + 2 NaOH (roztwór) = Cu(OH) 2 (k) + Na 2 SO 4 (roztwór),
Na 2 SO 3 (roztwór) + 2HCl (roztwór) = 2 NaCl (roztwór) + SO 2 (g) + H 2 O (l).
3. Rozróżniają zdolność przepływu tylko w kierunku do przodu, a także do przodu i do tyłu nieodwracalny I odwracalny reakcje chemiczne (patrz § 6.5).
4. Rozróżniają na podstawie obecności lub braku katalizatorów katalityczny I niekatalityczny reakcje (patrz § 6.5).
5. Ze względu na mechanizm ich występowania reakcje chemiczne dzielą się na joński, rodnik itp. (mechanizm reakcji chemicznych zachodzących z udziałem związków organicznych omawiany jest na lekcjach chemii organicznej).
6. W zależności od stanu utlenienia atomów wchodzących w skład reagujących substancji zachodzą reakcje bez zmiany stopnia utlenienia atomów i ze zmianą stopnia utlenienia atomów ( reakcje redoks) (patrz § 7.2).
7. Reakcje wyróżniają się zmianami w składzie substancji wyjściowych i produktów reakcji łączenie, rozkład, substytucja i wymiana. Reakcje te mogą zachodzić zarówno ze zmianami stopni utlenienia pierwiastków, jak i bez nich, tabela . 7.1.
Tabela 7.1
Rodzaje reakcji chemicznych
Schemat ogólny |
Przykłady reakcji zachodzących bez zmiany stopnia utlenienia pierwiastków |
Przykłady reakcji redoks |
|
Znajomości (jedna nowa substancja powstaje z dwóch lub więcej substancji) |
HCl + NH3 = NH4Cl; SO 3 + H 2 O = H 2 SO 4 |
H2 + Cl2 = 2HCl; 2Fe + 3Cl2 = 2FeCl3 |
|
Rozkłady (z jednej substancji powstaje kilka nowych substancji) |
A = B + C + D |
MgCO3MgO + CO2; H 2 SiO 3 SiO 2 + H 2 O |
2AgNO 3 2Ag + 2NO 2 + O 2 |
Zastępstwa (kiedy substancje oddziałują, atomy jednej substancji zastępują atomy innej substancji w cząsteczce) |
A + BC = AB + C |
CaCO 3 + SiO 2 CaSiO 3 + CO 2 |
Pb(NO 3) 2 + Zn = Mg + 2HCl = MgCl2 + H2 |
|
(dwie substancje wymieniają swoje części składowe, tworząc dwie nowe substancje) |
AB + CD = AD + CB |
AlCl3 + 3NaOH = Ca(OH) 2 + 2HCl = CaCl 2 + 2H 2 O |
7.2. Reakcje redoks
Jak wspomniano powyżej, wszystkie reakcje chemiczne dzielą się na dwie grupy:
Reakcje chemiczne zachodzące wraz ze zmianą stopnia utlenienia atomów tworzących reagenty nazywane są reakcjami redoks.
Utlenianie to proces oddawania elektronów przez atom, cząsteczkę lub jon:
Na o – 1e = Na + ;
Fe 2+ – e = Fe 3+ ;
H2o – 2e = 2H + ;
2 Br – – 2e = Br 2 o.
Powrót do zdrowia to proces dodawania elektronów do atomu, cząsteczki lub jonu:
S o + 2e = S 2– ;
Cr3+ + e = Cr2+;
Cl2o + 2e = 2Cl – ;
Mn 7+ + 5e = Mn 2+ .
Nazywa się atomy, cząsteczki lub jony, które przyjmują elektrony utleniacze. Konserwatorzy to atomy, cząsteczki lub jony oddające elektrony.
Przyjmując elektrony, utleniacz ulega redukcji podczas reakcji, a środek redukujący ulega utlenieniu. Utlenianiu zawsze towarzyszy redukcja i odwrotnie. Zatem, liczba elektronów oddanych przez środek redukujący jest zawsze równa liczbie elektronów przyjętych przez środek utleniający.
7.2.1. Stan utlenienia
Stopień utlenienia to warunkowy (formalny) ładunek atomu w związku, obliczony przy założeniu, że składa się on wyłącznie z jonów. Stopień utlenienia jest zwykle oznaczony cyfrą arabską nad symbolem pierwiastka ze znakiem „+” lub „–”. Na przykład Al 3+, S 2–.
Aby znaleźć stopnie utlenienia, stosuje się następujące zasady:
stopień utlenienia atomów w prostych substancjach wynosi zero;
suma algebraiczna stopni utlenienia atomów w cząsteczce jest równa zeru, w jonie zespolonym - ładunek jonu;
stopień utlenienia atomów metali alkalicznych wynosi zawsze +1;
atom wodoru w związkach z niemetalami (CH 4, NH 3 itp.) wykazuje stopień utlenienia +1, a w przypadku metali aktywnych stopień utlenienia wynosi –1 (NaH, CaH 2 itp.);
Atom fluoru w związkach zawsze wykazuje stopień utlenienia –1;
Stopień utlenienia atomu tlenu w związkach wynosi zwykle –2, z wyjątkiem nadtlenków (H 2 O 2, Na 2 O 2), w których stopień utlenienia tlenu wynosi –1, oraz niektórych innych substancji (nadtlenki, ozonki, tlen fluorki).
Maksymalny dodatni stopień utlenienia pierwiastków w grupie jest zwykle równy numerowi grupy. Wyjątkami są fluor i tlen, ponieważ ich najwyższy stopień utlenienia jest niższy niż numer grupy, w której się znajdują. Pierwiastki podgrupy miedzi tworzą związki, w których stopień utlenienia przekracza numer grupy (CuO, AgF 5, AuCl 3).
Maksymalny ujemny stopień utlenienia pierwiastków znajdujących się w głównych podgrupach układu okresowego można wyznaczyć odejmując numer grupy od ośmiu. Dla węgla jest to 8 – 4 = 4, dla fosforu – 8 – 5 = 3.
W podgrupach głównych przy przechodzeniu od pierwiastków z góry na dół stabilność najwyższego dodatniego stopnia utlenienia maleje, w podgrupach wtórnych natomiast, z góry na dół, wzrasta stabilność wyższych stopni utlenienia.
Umowność koncepcji stopnia utlenienia można wykazać na przykładzie niektórych związków nieorganicznych i organicznych. W szczególności w kwasach fosfinowych (fosforowych) H 3 PO 2, fosfonowych (fosforowych) H 3 PO 3 i fosforowych H 3 PO 4 stopnie utlenienia fosforu wynoszą odpowiednio +1, +3 i +5, podczas gdy we wszystkich tych związkach fosfor jest pięciowartościowy. W przypadku węgla w metanie CH 4, metanolu CH 3 OH, formaldehydzie CH 2 O, kwasie mrówkowym HCOOH i tlenku węgla (IV) CO 2 stopnie utlenienia węgla wynoszą odpowiednio –4, –2, 0, +2 i +4 , podczas gdy wartościowość atomu węgla we wszystkich tych związkach wynosi cztery.
Pomimo tego, że stopień utlenienia jest pojęciem konwencjonalnym, jest on szeroko stosowany w tworzeniu reakcji redoks.
7.2.2. Najważniejsze utleniacze i reduktory
Typowe utleniacze to:
1. Proste substancje, których atomy mają wysoką elektroujemność. Są to przede wszystkim pierwiastki głównych podgrup VI i VII grup układu okresowego: tlen, halogeny. Spośród substancji prostych najsilniejszym utleniaczem jest fluor.
2. Związki zawierające niektóre kationy metali na wysokich stopniach utlenienia: Pb 4+, Fe 3+, Au 3+ itp.
3. Związki zawierające pewne złożone aniony, których pierwiastki znajdują się na wysokich dodatnich stopniach utlenienia: 2–, – itp.
Do środków redukujących zalicza się:
1. Proste substancje, których atomy mają niską elektroujemność, to metale aktywne. Niemetale, takie jak wodór i węgiel, mogą również wykazywać właściwości redukujące.
2. Niektóre związki metali zawierające kationy (Sn 2+, Fe 2+, Cr 2+), które oddając elektrony, mogą zwiększać swój stopień utlenienia.
3. Niektóre związki zawierające proste jony, takie jak I – , S 2– .
4. Związki zawierające jony złożone (S 4+ O 3) 2–, (НР 3+ O 3) 2–, w których pierwiastki mogą, oddając elektrony, zwiększać swój dodatni stopień utlenienia.
W praktyce laboratoryjnej najczęściej stosuje się następujące utleniacze:
nadmanganian potasu (KMnO 4);
dichromian potasu (K 2 Cr 2 O 7);
kwas azotowy (HNO 3);
stężony kwas siarkowy (H2SO4);
nadtlenek wodoru (H 2 O 2);
tlenki manganu (IV) i ołowiu (IV) (MnO 2, PbO 2);
stopiony azotan potasu (KNO 3) i stopione inne azotany.
Do środków redukujących stosowanych w praktyce laboratoryjnej należą:
- magnez (Mg), aluminium (Al) i inne metale aktywne;
- wodór (H2) i węgiel (C);
- jodek potasu (KI);
- siarczek sodu (Na2S) i siarkowodór (H2S);
- siarczyn sodu (Na2SO3);
- chlorek cyny (SnCl2).
7.2.3. Klasyfikacja reakcji redoks
Reakcje redoks dzieli się zwykle na trzy typy: reakcje międzycząsteczkowe, wewnątrzcząsteczkowe i reakcje dysproporcjonowania (samoutlenianie-samoredukcja).
Reakcje międzycząsteczkowe występują wraz ze zmianą stopnia utlenienia atomów znajdujących się w różnych cząsteczkach. Na przykład:
2 Al + Fe 2 O 3 Al 2 O 3 + 2 Fe,
C + 4 HNO 3(stęż.) = CO 2 + 4 NO 2 + 2 H 2 O.
DO reakcje wewnątrzcząsteczkowe Są to reakcje, w których środek utleniający i reduktor stanowią części tej samej cząsteczki, na przykład:
(NH 4) 2 Cr 2 O 7 N 2 + Cr 2 O 3 + 4 H 2 O,
2 KNO 3 2 KNO 2 + O 2 .
W reakcje dysproporcjonalne(samoutlenianie-samoredukcja) atom (jon) tego samego pierwiastka jest zarówno utleniaczem, jak i reduktorem:
Cl 2 + 2 KOH KCl + KClO + H 2 O,
2NO 2 + 2 NaOH = NaNO 2 + NaNO 3 + H 2 O.
7.2.4. Podstawowe zasady komponowania reakcji redoks
Skład reakcji redoks przeprowadza się zgodnie z etapami przedstawionymi w tabeli. 7.2.
Tabela 7.2
Etapy układania równań reakcji redoks
Działanie |
|
Określ utleniacz i reduktor. |
|
Wskaż produkty reakcji redoks. |
|
Utwórz bilans elektronowy i na jego podstawie przypisz współczynniki substancjom zmieniającym stopień utlenienia. |
|
Uporządkuj współczynniki dla innych substancji, które biorą udział i powstają w reakcji redoks. |
|
Sprawdź poprawność współczynników, licząc ilość substancji atomów (najczęściej wodoru i tlenu) znajdujących się po lewej i prawej stronie równania reakcji. |
Rozważmy zasady komponowania reakcji redoks na przykładzie oddziaływania siarczynu potasu z nadmanganianem potasu w środowisku kwaśnym:
1. Oznaczanie utleniacza i reduktora
Mangan, który znajduje się na najwyższym stopniu utlenienia, nie może oddawać elektronów. Mn 7+ przyjmie elektrony, tj. jest środkiem utleniającym.
Jon S 4+ może oddać dwa elektrony i przejść do S 6+, tj. jest środkiem redukującym. Zatem w rozważanej reakcji K 2 SO 3 jest środkiem redukującym, a KMnO 4 jest środkiem utleniającym.
2. Ustalanie produktów reakcji
K2SO3 + KMnO4 + H2SO4?
Oddając dwa elektrony elektronowi, S 4+ staje się S 6+. W ten sposób siarczyn potasu (K 2 SO 3) zamienia się w siarczan (K 2 SO 4). W środowisku kwaśnym Mn 7+ przyjmuje 5 elektronów, a w roztworze kwasu siarkowego (medium) tworzy siarczan manganu (MnSO 4). W wyniku tej reakcji powstają także dodatkowe cząsteczki siarczanu potasu (za sprawą jonów potasu zawartych w nadmanganianie) oraz cząsteczki wody. Zatem rozważana reakcja zostanie zapisana jako:
K 2 SO 3 + KMnO 4 + H 2 SO 4 = K 2 SO 4 + MnSO 4 + H 2 O.
3. Sporządzanie bilansu elektronowego
Aby sporządzić bilans elektronowy, należy wskazać te stopnie utlenienia, które zmieniają się w rozpatrywanej reakcji:
K 2 S 4+ O 3 + KMn 7+ O 4 + H 2 SO 4 = K 2 S 6+ O 4 + Mn 2+ SO 4 + H 2 O.
Mn 7+ + 5 e = Mn 2+ ;
S 4+ – 2 mi = S 6+.
Liczba elektronów oddanych przez środek redukujący musi być równa liczbie elektronów przyjętych przez środek utleniający. Dlatego w reakcji muszą brać udział dwa Mn 7+ i pięć S 4+:
Mn 7+ + 5 mi = Mn 2+ 2,
S 4+ – 2 mi = S 6+ 5.
Zatem liczba elektronów oddanych przez środek redukujący (10) będzie równa liczbie elektronów przyjętych przez środek utleniający (10).
4. Układ współczynników w równaniu reakcji
Zgodnie z równowagą elektronów należy umieścić współczynnik 5 przed K 2 SO 3 i 2 przed KMnO 4. Po prawej stronie, przed siarczanem potasu, ustawiamy współczynnik 6, ponieważ jedna cząsteczka jest dodawana do pięciu cząsteczek K 2 SO 4 powstałych podczas utleniania siarczynu potasu K 2 SO 4 w wyniku wiązania jonów potasu zawartych w nadmanganianie. Ponieważ reakcja obejmuje dwa powstają również cząsteczki nadmanganianu po prawej stronie dwa cząsteczki siarczanu manganu. Konieczne jest związanie produktów reakcji (jonów potasu i manganu zawartych w nadmanganianie). trzy cząsteczki kwasu siarkowego, dlatego w wyniku reakcji trzy cząsteczki wody. Wreszcie otrzymujemy:
5 K 2 SO 3 + 2 KMnO 4 + 3 H 2 SO 4 = 6 K 2 SO 4 + 2 MnSO 4 + 3 H 2 O.
5. Sprawdzenie poprawności współczynników w równaniu reakcji
Liczba atomów tlenu po lewej stronie równania reakcji wynosi:
5 3 + 2 4 + 3 4 = 35.
Po prawej stronie będzie to liczba:
6 4 + 2 4 + 3 1 = 35.
Liczba atomów wodoru po lewej stronie równania reakcji wynosi sześć i odpowiada liczbie tych atomów po prawej stronie równania reakcji.
7.2.5. Przykłady reakcji redoks z udziałem typowych środków utleniających i redukujących
7.2.5.1. Międzycząsteczkowe reakcje utleniania i redukcji
Poniżej jako przykłady rozważymy reakcje redoks z udziałem nadmanganianu potasu, dwuchromianu potasu, nadtlenku wodoru, azotynu potasu, jodku potasu i siarczku potasu. Reakcje redoks z udziałem innych typowych środków utleniających i redukujących omówiono w drugiej części podręcznika („Chemia nieorganiczna”).
Reakcje redoks z udziałem nadmanganianu potasu
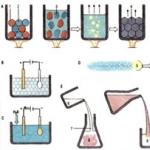
W zależności od środowiska (kwaśne, obojętne, zasadowe) nadmanganian potasu pełniąc funkcję utleniacza, daje różne produkty redukcji, ryc. 7.1.

Ryż. 7.1. Tworzenie produktów redukcji nadmanganianu potasu w różnych mediach
Poniżej przedstawiono reakcje KMnO 4 z siarczkiem potasu jako reduktorem w różnych środowiskach, ilustrujące schemat, rys. 7.1. W tych reakcjach produktem utleniania jonów siarczkowych jest wolna siarka. W środowisku zasadowym cząsteczki KOH nie biorą udziału w reakcji, a jedynie determinują produkt redukcji nadmanganianu potasu.
5 K 2 S + 2 KMnO 4 + 8 H 2 SO 4 = 5 S + 2 MnSO 4 + 6 K 2 SO 4 + 8 H 2 O,
3 K 2 S + 2 KMnO 4 + 4 H 2 O 2 MnO 2 + 3 S + 8 KOH,
K 2 S + 2 KMnO 4 – (KOH) 2 K 2 MnO 4 + S.
Reakcje redoks z udziałem dichromianu potasu
W środowisku kwaśnym dwuchromian potasu jest silnym utleniaczem. Mieszanina K 2 Cr 2 O 7 i stężonego H 2 SO 4 (chrom) jest szeroko stosowana w praktyce laboratoryjnej jako środek utleniający. Oddziałując ze środkiem redukującym, jedna cząsteczka dwuchromianu potasu przyjmuje sześć elektronów, tworząc trójwartościowe związki chromu:
6 FeSO 4 +K 2 Cr 2 O 7 +7 H 2 SO 4 = 3 Fe 2 (SO 4) 3 +Cr 2 (SO 4) 3 +K 2 SO 4 +7 H 2 O;
6 KI + K 2 Cr 2 O 7 + 7 H 2 SO 4 = 3 I 2 + Cr 2 (SO 4) 3 + 4 K 2 SO 4 + 7 H 2 O.
Reakcje redoks z udziałem nadtlenku wodoru i azotynu potasu
Nadtlenek wodoru i azotyn potasu wykazują głównie właściwości utleniające:
H. 2 S + H. 2 O 2 = S + 2 H. 2 O,
2 KI + 2 KNO 2 + 2 H 2 SO 4 = Ja 2 + 2 K 2 SO 4 + H 2 O,
Jednak podczas interakcji z silnymi utleniaczami (takimi jak na przykład KMnO 4) nadtlenek wodoru i azotyn potasu działają jako środki redukujące:
5 H 2 O 2 + 2 KMnO 4 + 3 H 2 SO 4 = 5 O 2 + 2 MnSO 4 + K 2 SO 4 + 8 H 2 O,
5 KNO 2 + 2 KMnO 4 + 3 H 2 SO 4 = 5 KNO 3 + 2 MnSO 4 + K 2 SO 4 + 3 H 2 O.
Należy zaznaczyć, że nadtlenek wodoru w zależności od środowiska ulega redukcji według schematu rys. 7.2.

Ryż. 7.2. Możliwe produkty redukcji nadtlenku wodoru
W tym przypadku w wyniku reakcji powstają jony wodne lub wodorotlenkowe:
2 FeSO 4 + H 2 O 2 + H 2 SO 4 = Fe 2 (SO 4) 3 + 2 H 2 O,
2 KI + H 2 O 2 = Ja 2 + 2 KOH.
7.2.5.2. Wewnątrzcząsteczkowe reakcje utleniania i redukcji
Wewnątrzcząsteczkowe reakcje redoks zwykle zachodzą podczas ogrzewania substancji, których cząsteczki zawierają środek redukujący i utleniacz. Przykładami wewnątrzcząsteczkowych reakcji redukcji-utleniania są procesy termicznego rozkładu azotanów i nadmanganianu potasu:
2 NaNO 3 2 NaNO 2 + O 2,
2 Cu(NO 3) 2 2 CuO + 4 NO 2 + O 2,
Hg(NO 3) 2 Hg + NO 2 + O 2,
2 KMnO 4 K 2 MnO 4 + MnO 2 + O 2.
7.2.5.3. Reakcje dysproporcji
Jak zauważono powyżej, w reakcjach dysproporcjonowania ten sam atom (jon) jest zarówno środkiem utleniającym, jak i środkiem redukującym. Rozważmy proces komponowania tego typu reakcji na przykładzie oddziaływania siarki z zasadą.
Charakterystyczne stopnie utlenienia siarki: – 2, 0, +4 i +6. Działając jako środek redukujący, siarka elementarna oddaje 4 elektrony:
Więc – 4e = S 4+.
Siarka – Utleniacz przyjmuje dwa elektrony:
Zatem o + 2е = S 2– .
Zatem w wyniku reakcji dysproporcjonowania siarki powstają związki, których stopnie utlenienia pierwiastka są – 2 i prawe +4:
3 S + 6 KOH = 2 K 2 S + K 2 SO 3 + 3 H 2 O.
Kiedy tlenek azotu (IV) jest dysproporcjonowany w zasadach, otrzymuje się azotyn i azotan - związki, w których stopnie utlenienia azotu wynoszą odpowiednio +3 i +5:
2 N 4+ O 2 + 2 KOH = KN 3+ O 2 + KN 5+ O 3 + H 2 O,
Dysproporcja chloru w zimnym roztworze alkalicznym prowadzi do powstania podchlorynu, a w gorącym roztworze alkalicznym - chloranu:
Cl 0 2 + 2 KOH = KCl – + KCl + O + H 2 O,
Cl 0 2 + 6 KOH 5 KCl – + KCl 5+ O 3 + 3H 2 O.
7.3. Elektroliza
Proces redoks zachodzący w roztworach lub topi się pod wpływem przepływu przez nie stałego prądu elektrycznego nazywa się elektrolizą. W tym przypadku utlenianie anionów następuje na elektrodzie dodatniej (anodzie). Kationy ulegają redukcji na elektrodzie ujemnej (katodzie).
2 Na 2 CO 3 4 Na + O 2 + 2 CO 2 .
Podczas elektrolizy wodnych roztworów elektrolitów wraz z przemianami substancji rozpuszczonej mogą zachodzić procesy elektrochemiczne z udziałem jonów wodorowych i jonów wodorotlenkowych wody:
katoda (–): 2 Н + + 2е = Н 2,
anoda (+): 4 OH – – 4e = O 2 + 2 H 2 O.
W tym przypadku proces redukcji na katodzie przebiega następująco:
1. Kationy metali aktywnych (do Al 3+ włącznie) nie ulegają redukcji na katodzie, zamiast tego ulega redukcji wodór.
2. Kationy metali znajdujące się w szeregu potencjałów elektrody standardowej (w szeregu napięcia) na prawo od wodoru ulegają podczas elektrolizy redukcji do wolnych metali na katodzie.
3. Kationy metali znajdujące się pomiędzy Al 3+ i H + ulegają redukcji na katodzie jednocześnie z kationem wodoru.
Procesy zachodzące w roztworach wodnych na anodzie zależą od substancji, z której wykonana jest anoda. Istnieją nierozpuszczalne anody ( obojętny) i rozpuszczalne ( aktywny). Jako materiał anod obojętnych stosuje się grafit lub platynę. Rozpuszczalne anody wykonane są z miedzi, cynku i innych metali.
Podczas elektrolizy roztworów z obojętną anodą mogą powstawać następujące produkty:
1. Podczas utleniania jonów halogenkowych uwalniają się wolne halogeny.
2. Podczas elektrolizy roztworów zawierających aniony SO 2 2–, NO 3 –, PO 4 3– wydziela się tlen, tj. Na anodzie utleniają się nie te jony, ale cząsteczki wody.
Biorąc pod uwagę powyższe zasady, rozważmy jako przykład elektrolizę wodnych roztworów NaCl, CuSO 4 i KOH za pomocą elektrod obojętnych.
1). W roztworze chlorek sodu dysocjuje na jony.




1. Podaj poprawną definicję reakcji złożonej: A. Reakcja powstania kilku substancji z jednej substancji prostej; B. Reakcja, podczas której z kilku substancji prostych lub złożonych powstaje jedna substancja złożona. B. Reakcja, podczas której substancje wymieniają swoje składniki.

2. Podaj poprawną definicję reakcji podstawienia: A. Reakcja pomiędzy zasadą i kwasem; B. Reakcja oddziaływania dwóch prostych substancji; B. Reakcja między substancjami, podczas której atomy substancji prostej zastępują atomy jednego z pierwiastków substancji złożonej.

3. Podaj poprawną definicję reakcji rozkładu: A. Reakcja, podczas której z jednej substancji złożonej powstaje kilka substancji prostych lub złożonych; B. Reakcja, podczas której substancje wymieniają swoje składniki; B. Reakcja z utworzeniem cząsteczek tlenu i wodoru.


5. Jakim rodzajem reakcji jest oddziaływanie tlenków kwasowych z tlenkami zasadowymi: 5. Jakim rodzajem reakcji jest oddziaływanie tlenków kwasowych z tlenkami zasadowymi: A. Reakcja wymiany; B. Reakcja złożona; B. Reakcja rozkładu; D. Reakcja podstawienia.


7. Substancje o wzorach KNO 3 FeCl 2, Na 2 SO 4 nazywane są: 7. Substancje o wzorach KNO 3 FeCl 2, Na 2 SO 4 nazywane są: A) solami; B) powody; B) kwasy; D) tlenki. A) sole; B) powody; B) kwasy; D) tlenki. 8. Substancje o wzorach HNO 3, HCl, H 2 SO 4 nazywane są: 8. Substancje o wzorach HNO 3, HCl, H 2 SO 4 nazywane są: A) solami; B) kwasy; B) powody; D) tlenki. A) sole; B) kwasy; B) powody; D) tlenki. 9. Substancje o wzorach KOH, Fe(OH) 2, NaOH nazywane są: 9. Substancje o wzorach KOH, Fe(OH) 2, NaOH nazywane są: A) solami; B) kwasy; B) powody; D) tlenki. 10. Substancje, których wzory to NO 2, Fe 2 O 3, Na 2 O, nazywane są: A) solami; B) kwasy; B) powody; D) tlenki. 10. Substancje, których wzory to NO 2, Fe 2 O 3, Na 2 O, nazywane są: A) solami; B) kwasy; B) powody; D) tlenki. A) sole; B) kwasy; B) powody; D) tlenki. 11. Wskaż metale tworzące zasady: 11. Wskaż metale tworzące zasady: Cu, Fe, Na, K, Zn, Li. Cu, Fe, Na, K, Zn, Li.


Pojęcie „reakcja związku” jest antonimem pojęcia „reakcja rozkładu”. Spróbuj, stosując technikę kontrastu, zdefiniować pojęcie „reakcji złożonej”. Prawidłowy! Masz następujący preparat.
Rozważmy ten typ reakcji wykorzystując inną, dla Ciebie nową formę rejestracji procesów chemicznych - tzw. łańcuchy przejść, czyli przemian. Na przykład obwód
pokazuje przemianę fosforu w tlenek fosforu (V) P 2 O 5, który z kolei przekształca się w kwas fosforowy H 3 PO 4.
Liczba strzałek na schemacie przemian substancji odpowiada minimalnej liczbie przemian chemicznych - reakcji chemicznych. W rozważanym przykładzie są to dwa procesy chemiczne.
1. proces. Otrzymywanie tlenku fosforu (V) P 2 O 5 z fosforu. Oczywiście jest to reakcja pomiędzy fosforem i tlenem.
Wsypmy trochę czerwonego fosforu do płonącej łyżki i podpalmy ją. Fosfor pali się jasnym płomieniem, wytwarzając biały dym składający się z małych cząstek tlenku fosforu (V):
4P + 5O 2 = 2P 2 O 5.
Drugi proces. Do kolby dodajmy łyżkę płonącego fosforu. Wypełnia go gęsty dym z tlenku fosforu (V). Wyjmij łyżkę z kolby, wlej do kolby wodę i wstrząśnij jej zawartością, po zamknięciu szyjki kolby korkiem. Dym stopniowo się rozrzedza, rozpuszcza w wodzie i ostatecznie znika całkowicie. Jeśli do roztworu otrzymanego w kolbie dodamy odrobinę lakmusu, zmieni on kolor na czerwony, co świadczy o powstaniu kwasu fosforowego:
R 2 O 5 + ZN 2 O = 2H 3 PO 4.
Reakcje przeprowadzane w celu przeprowadzenia rozważanych przejść zachodzą bez udziału katalizatora, dlatego nazywane są niekatalitycznymi. Omówione powyżej reakcje przebiegają tylko w jednym kierunku, tj. są nieodwracalne.
Przeanalizujmy, ile i jakie substancje weszły w reakcje omówione powyżej oraz ile i jakie substancje w nich powstały. W pierwszej reakcji z dwóch prostych substancji powstała jedna substancja złożona, w drugiej z dwóch substancji złożonych, z których każda składa się z dwóch pierwiastków, powstała jedna substancja złożona, składająca się z trzech pierwiastków.
Jedna substancja złożona może również powstać w wyniku reakcji połączenia substancji złożonej i prostej. Na przykład przy produkcji kwasu siarkowego z tlenku siarki (IV) otrzymuje się tlenek siarki (VI):
Reakcja ta przebiega zarówno w kierunku do przodu, tj. z utworzeniem produktu reakcji, jak i w kierunku odwrotnym, tj. następuje rozkład produktu reakcji na substancje wyjściowe, dlatego zamiast znaku równości stawiają znak odwracalności.
W tej reakcji bierze udział katalizator - tlenek wanadu (V) V 2 O 5, co wskazano powyżej znaku odwracalności:
![]()
Substancję złożoną można również otrzymać przez połączenie trzech substancji. Na przykład kwas azotowy wytwarza się w reakcji, której schemat jest następujący:
NO 2 + H 2 O + O 2 → HNO 3.
Zastanówmy się, jak wybrać współczynniki, aby wyrównać schemat tej reakcji chemicznej.
Nie ma potrzeby wyrównywania liczby atomów azotu: po jednym atomie azotu znajduje się zarówno w lewej, jak i prawej części diagramu. Wyrównajmy liczbę atomów wodoru - przed wzorem kwasu zapisujemy współczynnik 2:
NO 2 + H 2 O + O 2 → 2HNO 3.
ale w tym przypadku równość liczby atomów azotu zostanie naruszona - jeden atom azotu pozostanie po lewej stronie, a dwa po prawej stronie. Zapiszmy współczynnik 2 przed wzorem tlenku azotu (IV):
2NO 2 + H 2 O + O 2 → 2HNO 3.
Policzmy liczbę atomów tlenu: po lewej stronie diagramu reakcji jest ich siedem, a po prawej sześć. Aby wyrównać liczbę atomów tlenu (po sześć atomów w każdej części równania), pamiętaj, że przed wzorami prostych substancji możesz zapisać współczynnik ułamkowy 1/2:
2NO 2 + H 2 O + 1/2O 2 → 2HNO 3.
Niech współczynniki będą liczbami całkowitymi. W tym celu przepisujemy równanie, podwajając współczynniki:
4NO 2 + 2H 2 O + O 2 → 4HNO 3.
Należy zauważyć, że prawie wszystkie reakcje związku są reakcjami egzotermicznymi.
Eksperyment laboratoryjny nr 15
Kalcynacja miedzi w płomieniu lampy alkoholowej
- Zbadaj otrzymany drut miedziany (płytkę) i opisz jego wygląd. Podgrzej drut, trzymając go szczypcami do tygla, w górnej części płomienia lampy alkoholowej przez 1 minutę. Opisz warunki reakcji. Opisz znak wskazujący, że zaszła reakcja chemiczna. Napisz równanie reakcji, która zaszła. Nazwij składniki wyjściowe i produkty reakcji.
Wyjaśnij, czy masa drutu miedzianego (płytki) zmieniła się po zakończeniu doświadczenia. Odpowiedź uzasadnij, wykorzystując znajomość prawa zachowania masy substancji.
Słowa i wyrażenia kluczowe
- Reakcje łączenia są antonimami reakcji rozkładu.
- Reakcje katalityczne (w tym enzymatyczne) i niekatalityczne.
- Łańcuchy przejść lub transformacji.
- Reakcje odwracalne i nieodwracalne.
Pracuj z komputerem
- Zapoznaj się z wnioskiem elektronicznym. Zapoznaj się z materiałem lekcyjnym i wykonaj przydzielone zadania.
- Znajdź w Internecie adresy e-mail, które mogą posłużyć jako dodatkowe źródła ujawniające treść słów kluczowych i wyrażeń występujących w akapicie. Zaoferuj nauczycielowi pomoc w przygotowaniu nowej lekcji - sporządź raport na temat kluczowych słów i zwrotów z następnego akapitu.
Pytania i zadania

9.1. Jakie są reakcje chemiczne?
Pamiętajmy, że wszelkie zjawiska chemiczne w przyrodzie nazywamy reakcjami chemicznymi. Podczas reakcji chemicznej niektóre wiązania chemiczne zostają zerwane, a inne powstają. W wyniku reakcji z niektórych substancji chemicznych powstają inne substancje (patrz rozdział 1).
Odrabiając pracę domową z § 2.5 zapoznałeś się z tradycyjnym wyborem czterech głównych typów reakcji z całego zestawu przemian chemicznych, a następnie zaproponowałeś ich nazwy: reakcje łączenia, rozkładu, podstawienia i wymiany.
Przykłady reakcji złożonych:
C + O2 = CO2; (1)
Na2O + CO2 = Na2CO3; (2)
NH 3 + CO 2 + H 2 O = NH 4 HCO 3. (3)
Przykłady reakcji rozkładu:
2Ag2O4Ag + O2; (4)
CaCO3CaO + CO2; (5)
(NH 4) 2 Cr 2 O 7 N 2 + Cr 2 O 3 + 4H 2 O. (6)
Przykłady reakcji podstawienia:
CuSO4 + Fe = FeSO4 + Cu; (7)
2NaI + Cl2 = 2NaCl + I2; (8)
CaCO 3 + SiO 2 = CaSiO 3 + CO 2. (9)
| Reakcje wymiany- reakcje chemiczne, w których substancje wyjściowe wymieniają swoje części składowe. |
Przykłady reakcji wymiany:
Ba(OH)2 + H2SO4 = BaSO4 + 2H2O; (10)
HCl + KNO2 = KCl + HNO2; (jedenaście)
AgNO 3 + NaCl = AgCl + NaNO 3. (12)
Tradycyjna klasyfikacja reakcji chemicznych nie obejmuje całej ich różnorodności – oprócz czterech głównych typów reakcji istnieje również wiele reakcji bardziej złożonych.
Identyfikacja dwóch pozostałych typów reakcji chemicznych opiera się na udziale w nich dwóch ważnych cząstek niechemicznych: elektronu i protonu.
Podczas niektórych reakcji następuje całkowite lub częściowe przeniesienie elektronów z jednego atomu na drugi. W tym przypadku zmieniają się stopnie utlenienia atomów pierwiastków tworzących substancje wyjściowe; z podanych przykładów są to reakcje 1, 4, 6, 7 i 8. Reakcje te nazywane są redoks.
W innej grupie reakcji jon wodoru (H +), czyli proton, przechodzi z jednej reagującej cząstki na drugą. Takie reakcje nazywane są reakcje kwasowo-zasadowe Lub reakcje przeniesienia protonu.
Wśród podanych przykładów takimi reakcjami są reakcje 3, 10 i 11. Przez analogię do tych reakcji, czasami nazywane są reakcjami redoks reakcje przeniesienia elektronu. Z OVR zapoznasz się w § 2, a z KOR w kolejnych rozdziałach.
REAKCJE ŁĄCZENIA, REAKCJE ROZKŁADU, REAKCJE PODSTAWIENIA, REAKCJE WYMIANY, REAKCJE REDOKS, REAKCJE KWAS-ZASADA.
Zapisz równania reakcji odpowiadające następującym schematom:
a) HgO Hg + O 2 ( T); b) Li2O + SO2Li2SO3; c) Cu(OH) 2 CuO + H 2 O ( T);
d) Al + I2AlI3; e) CuCl2 + Fe FeCl2 + Cu; e) Mg + H3PO4 Mg3(PO4)2 + H2;
g) Al + O 2 Al 2 O 3 ( T); i) KClO 3 + P P 2 O 5 + KCl ( T); j) CuSO 4 + Al Al 2 (SO 4) 3 + Cu;
l) Fe + Cl 2 FeCl 3 ( T); m) NH3 + O2N2 + H2O ( T); m) H 2 SO 4 + CuO CuSO 4 + H 2 O.
Wskaż tradycyjny typ reakcji. Oznacz reakcje redoks i kwasowo-zasadowe. W reakcjach redoks wskaż, które atomy pierwiastków zmieniają swój stopień utlenienia.
9.2. Reakcje redoks
Rozważmy reakcję redoks zachodzącą w wielkich piecach podczas przemysłowej produkcji żelaza (a dokładniej żeliwa) z rudy żelaza:
Fe 2 O 3 + 3CO = 2Fe + 3CO 2.
Określmy stopnie utlenienia atomów tworzących zarówno substancje wyjściowe, jak i produkty reakcji
| Fe2O3 | + | = | 2Fe | + |
Jak widać, w wyniku reakcji stopień utlenienia atomów węgla wzrósł, stopień utlenienia atomów żelaza zmniejszył się, a stopień utlenienia atomów tlenu pozostał niezmieniony. W konsekwencji atomy węgla w tej reakcji uległy utlenieniu, czyli utraciły elektrony ( utleniony), a atomy żelaza – redukcja, czyli dodanie elektronów ( odzyskany) (patrz § 7.16). Aby scharakteryzować OVR, stosuje się pojęcia utleniacz I Środek redukujący.

Zatem w naszej reakcji atomami utleniającymi są atomy żelaza, a atomami redukującymi są atomy węgla.
W naszej reakcji utleniaczem jest tlenek żelaza(III), a reduktorem tlenek węgla(II).
W przypadkach, gdy atomy utleniające i atomy redukujące są częścią tej samej substancji (przykład: reakcja 6 z poprzedniego akapitu), nie stosuje się pojęć „substancja utleniająca” i „substancja redukująca”.
Zatem typowymi utleniaczami są substancje zawierające atomy, które mają tendencję do przyjmowania elektronów (w całości lub w części), obniżając ich stopień utlenienia. Z substancji prostych są to przede wszystkim halogeny i tlen, w mniejszym stopniu siarka i azot. Z substancji złożonych - substancje zawierające atomy na wyższych stopniach utlenienia, które nie mają skłonności do tworzenia prostych jonów na tych stopniach utlenienia: HNO 3 (N +V), KMnO 4 (Mn +VII), CrO 3 (Cr +VI), KClO 3 (Cl + V), KClO 4 (Cl + VII) itp.
Typowymi środkami redukującymi są substancje zawierające atomy, które mają tendencję do całkowitego lub częściowego oddawania elektronów, zwiększając ich stopień utlenienia. Substancje proste obejmują wodór, metale alkaliczne i ziem alkalicznych oraz aluminium. Z substancji złożonych - H2S i siarczki (S –II), SO2 i siarczyny (S +IV), jodki (I –I), CO (C +II), NH3 (N –III) itp.
Ogólnie rzecz biorąc, prawie wszystkie złożone i wiele prostych substancji mogą wykazywać zarówno właściwości utleniające, jak i redukujące. Na przykład:
SO 2 + Cl 2 = S + Cl 2 O 2 (SO 2 jest silnym środkiem redukującym);
SO 2 + C = S + CO 2 (t) (SO 2 jest słabym utleniaczem);
C + O 2 = CO 2 (t) (C jest środkiem redukującym);
C + 2Ca = Ca 2 C (t) (C jest środkiem utleniającym).
Wróćmy do reakcji, którą omawialiśmy na początku tej sekcji.
| Fe2O3 | + | = | 2Fe | + |
Należy pamiętać, że w wyniku reakcji atomy utleniające (Fe + III) zamieniły się w atomy redukujące (Fe 0), a atomy redukujące (C + II) zamieniły się w atomy utleniające (C + IV). Ale CO 2 jest bardzo słabym utleniaczem w każdych warunkach, a żelazo, chociaż jest czynnikiem redukującym, jest w tych warunkach znacznie słabsze niż CO. Dlatego produkty reakcji nie reagują ze sobą i nie zachodzi reakcja odwrotna. Podany przykład ilustruje ogólną zasadę określającą kierunek przepływu OVR:
Reakcje redoks przebiegają w kierunku tworzenia słabszego środka utleniającego i słabszego środka redukującego.
Właściwości redoks substancji można porównywać jedynie w identycznych warunkach. W niektórych przypadkach porównania tego można dokonać ilościowo.
Odrabiając pracę domową z pierwszego akapitu tego rozdziału, przekonałeś się, że dobór współczynników w niektórych równaniach reakcji (zwłaszcza ORR) jest dość trudny. Aby uprościć to zadanie w przypadku reakcji redoks, stosuje się dwie metody:
A) metoda wagi elektronicznej I
B) metoda równowagi elektronowo-jonowej.
Nauczysz się teraz metody równowagi elektronowej, a metoda równowagi elektronowo-jonowej jest zwykle studiowana w szkołach wyższych.
Obie te metody opierają się na fakcie, że elektrony w reakcjach chemicznych ani nie znikają, ani nigdzie się nie pojawiają, czyli liczba elektronów przyjętych przez atomy jest równa liczbie elektronów oddanych przez inne atomy.
Liczbę oddanych i przyjętych elektronów w metodzie bilansu elektronowego określa się poprzez zmianę stopnia utlenienia atomów. Stosując tę metodę należy znać skład zarówno substancji wyjściowych jak i produktów reakcji.
Przyjrzyjmy się zastosowaniu metody wagi elektronicznej na przykładach.
Przykład 1. Stwórzmy równanie reakcji żelaza z chlorem. Wiadomo, że produktem tej reakcji jest chlorek żelaza(III). Zapiszmy schemat reakcji:
Fe + Cl 2 FeCl 3 .
Określmy stopnie utlenienia atomów wszystkich pierwiastków tworzących substancje biorące udział w reakcji:
Atomy żelaza oddają elektrony, a cząsteczki chloru je przyjmują. Wyraźmy te procesy równania elektroniczne:
Fe – 3 mi– = Fe + III,
Cl2+2 e –= 2Cl –I.
Aby liczba elektronów podanych była równa liczbie elektronów otrzymanych, pierwsze równanie elektroniczne należy pomnożyć przez dwa, a drugie przez trzy:
| Fe – 3 mi– = Fe + III, Cl2+2 mi– = 2Cl –I |
2Fe – 6 mi– = 2Fe +III, 3Cl 2 + 6 mi– = 6Cl –I. |
Wprowadzając do schematu reakcji współczynniki 2 i 3, otrzymujemy równanie reakcji:
2Fe + 3Cl2 = 2FeCl3.
Przykład 2. Utwórzmy równanie reakcji spalania białego fosforu w nadmiarze chloru. Wiadomo, że chlorek fosforu (V) powstaje w następujących warunkach:
| +V –I | ||||
| P 4 | + | Cl2 | PCl 5. |
Cząsteczki białego fosforu oddają elektrony (utleniają), a cząsteczki chloru je przyjmują (redukują):
| Str. 4 – 20 mi– = 4P + V Cl2+2 mi– = 2Cl –I |
1 10 |
2 20 |
Str. 4 – 20 mi– = 4P + V Cl2+2 mi– = 2Cl –I |
Str. 4 – 20 mi– = 4P + V 10Cl 2 + 20 mi– = 20Cl –I |
Otrzymane początkowo współczynniki (2 i 20) miały wspólny dzielnik, przez który (podobnie jak przyszłe współczynniki w równaniu reakcji) zostały podzielone. Równanie reakcji:
P4 + 10Cl2 = 4PCl5.
Przykład 3. Utwórzmy równanie reakcji zachodzącej podczas prażenia siarczku żelaza(II) w tlenie.
Schemat reakcji:
| +III –II | +IV –II | |||||
| + | O2 | + |
Utlenieniu ulegają w tym przypadku zarówno atomy żelaza(II), jak i siarki(–II). W składzie siarczku żelaza(II) atomy tych pierwiastków występują w stosunku 1:1 (patrz wskaźniki w najprostszym wzorze).
Waga elektroniczna:
| 4 | Fe+II – mi– = Fe + III S–II–6 mi– = S + IV |
W sumie dają 7 mi – |
| 7 | O 2 + 4e – = 2O –II |
Równanie reakcji: 4FeS + 7O 2 = 2Fe 2 O 3 + 4SO 2.
Przykład 4. Stwórzmy równanie reakcji zachodzącej podczas prażenia w tlenie dwusiarczku żelaza(II) (pirytu).
Schemat reakcji:
| +III –II | +IV –II | |||||
| + | O2 | + |
Podobnie jak w poprzednim przykładzie, zarówno atomy żelaza(II), jak i atomy siarki są tu również utlenione, ale na stopniu utlenienia I. Atomy tych pierwiastków wchodzą w skład pirytu w stosunku 1:2 (patrz indeksy w najprostszej formule). Pod tym względem reagują atomy żelaza i siarki, co jest brane pod uwagę przy zestawieniu wagi elektronicznej:
| Fe+III – mi– = Fe + III 2S–I – 10 mi– = 2S +IV |
W sumie dają 11 mi – | |
| O2+4 mi– = 2O –II |
Równanie reakcji: 4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2.
Istnieją również bardziej złożone przypadki ODD, z niektórymi z nich zapoznasz się podczas odrabiania pracy domowej.
ATOM UTLENIAJĄCY, ATOM REDUKUJĄCY, SUBSTANCJA UTLENIAJĄCA, SUBSTANCJA REDUKUJĄCA, METODA BILANSU ELEKTRONICZNEGO, RÓWNANIA ELEKTRONICZNE.
1. Dla każdego równania OVR podanego w treści § 1 niniejszego rozdziału sporządzić wagę elektroniczną.
2. Ułóż równania dla ORR, które odkryłeś wykonując zadanie z § 1 tego rozdziału. Tym razem użyj metody wagi elektronicznej, aby ustawić kursy. 3.Korzystając z metody bilansu elektronowego, utwórz równania reakcji odpowiadające schematom: a) Na + I 2 NaI;
b) Na + O2 Na 2 O 2;
c) Na2O2 + Na Na2O;
d) Al + Br2AlBr3;
e) Fe + O 2 Fe 3 O 4 ( T);
e) Fe 3 O 4 + H 2 FeO + H 2 O ( T);
g) FeO + O 2 Fe 2 O 3 ( T);
i) Fe 2 O 3 + CO Fe + CO 2 ( T);
j) Cr + O 2 Cr 2 O 3 ( T);
l) CrO 3 + NH 3 Cr 2 O 3 + H 2 O + N 2 ( T);
l) Mn 2 O 7 + NH 3 MnO 2 + N 2 + H 2 O;
m) MnO 2 + H 2 Mn + H 2 O ( T);
n) MnS + O 2 MnO 2 + SO 2 ( T)
p) PbO 2 + CO Pb + CO 2 ( T);
c) Cu 2 O + Cu 2 S Cu + SO 2 ( T);
t) CuS + O 2 Cu 2 O + SO 2 ( T);
y) Pb 3 O 4 + H 2 Pb + H 2 O ( T).
9.3. Reakcje egzotermiczne. Entalpia
Dlaczego zachodzą reakcje chemiczne?
Aby odpowiedzieć na to pytanie, przypomnijmy sobie, dlaczego poszczególne atomy łączą się w cząsteczki, dlaczego kryształ jonowy powstaje z izolowanych jonów i dlaczego przy tworzeniu powłoki elektronowej atomu obowiązuje zasada najmniejszej energii. Odpowiedź na wszystkie te pytania jest taka sama: ponieważ jest to korzystne energetycznie. Oznacza to, że podczas takich procesów uwalniana jest energia. Wydawałoby się, że reakcje chemiczne powinny zachodzić z tego samego powodu. Rzeczywiście można przeprowadzić wiele reakcji, podczas których uwalniana jest energia. Wydzielana jest energia, zwykle w postaci ciepła.
Jeśli podczas reakcji egzotermicznej ciepło nie ma czasu na usunięcie, wówczas układ reakcyjny nagrzewa się.
Na przykład w reakcji spalania metanu
CH 4 (g) + 2O 2 (g) = CO 2 (g) + 2H 2 O (g)
wydziela się tak dużo ciepła, że jako paliwo wykorzystuje się metan.
Fakt, że w tej reakcji wydziela się ciepło, można odzwierciedlić w równaniu reakcji:
CH 4 (g) + 2O 2 (g) = CO 2 (g) + 2H 2 O (g) + Q.
Jest to tzw równanie termochemiczne. Tutaj symbol „+ Q" oznacza, że podczas spalania metanu wydziela się ciepło. Ciepło to nazywa się Efekt termiczny reakcji.
Skąd pochodzi wydzielane ciepło?
Wiesz, że podczas reakcji chemicznych wiązania chemiczne ulegają zerwaniu i utworzeniu. W tym przypadku rozrywane są wiązania między atomami węgla i wodoru w cząsteczkach CH 4, a także między atomami tlenu w cząsteczkach O 2. W tym przypadku powstają nowe wiązania: między atomami węgla i tlenu w cząsteczkach CO 2 oraz między atomami tlenu i wodoru w cząsteczkach H 2 O. Aby rozerwać wiązania, należy wydać energię (patrz „energia wiązania”, „energia atomizacji” ), a podczas tworzenia wiązań uwalniana jest energia. Oczywiście, jeśli „nowe” wiązania będą silniejsze niż „stare”, wówczas więcej energii zostanie uwolnione niż pochłonięte. Różnica pomiędzy energią uwolnioną i pochłoniętą to efekt termiczny reakcji.
Efekt termiczny (ilość ciepła) mierzony jest w kilodżulach, na przykład:
2H 2 (g) + O 2 (g) = 2H 2 O (g) + 484 kJ.
Zapis ten oznacza, że 484 kilodżule ciepła zostaną uwolnione, jeśli dwa mole wodoru zareagują z jednym molem tlenu, tworząc dwa mole wody w stanie gazowym (pary wodnej).
Zatem, w równaniach termochemicznych współczynniki są liczbowo równe ilościom substancji reagentów i produktów reakcji.
Co decyduje o efekcie termicznym każdej konkretnej reakcji?
Efekt termiczny reakcji zależy
a) o stanach skupienia substancji wyjściowych i produktów reakcji,
b) na temperaturę i
c) od tego, czy przemiana chemiczna zachodzi przy stałej objętości, czy przy stałym ciśnieniu.
Zależność efektu termicznego reakcji od stanu skupienia substancji wynika z faktu, że procesom przejścia z jednego stanu skupienia do drugiego (podobnie jak niektóre inne procesy fizyczne) towarzyszy wydzielanie lub absorpcja ciepła. Można to również wyrazić równaniem termochemicznym. Przykład – równanie termochemiczne kondensacji pary wodnej:
H 2 O (g) = H 2 O (l) + Q.
W równaniach termochemicznych i, jeśli to konieczne, w zwykłych równaniach chemicznych, stany skupienia substancji są oznaczane za pomocą indeksów literowych:
d) – gaz,
(g) – ciecz,
(t) lub (cr) – substancja stała lub krystaliczna.
Zależność efektu cieplnego od temperatury wiąże się z różnicami pojemności cieplnych
materiały wyjściowe i produkty reakcji.
Ponieważ objętość układu zawsze wzrasta w wyniku reakcji egzotermicznej przy stałym ciśnieniu, część energii zostanie wydana na wykonanie pracy zwiększającej objętość, a uwolnione ciepło będzie mniejsze, niż gdyby ta sama reakcja zachodziła przy stałej objętości .
Efekty termiczne reakcji są zwykle obliczane dla reakcji zachodzących przy stałej objętości w temperaturze 25 °C i są oznaczone symbolem Q o.
Jeśli energia jest uwalniana tylko w postaci ciepła, a reakcja chemiczna przebiega przy stałej objętości, wówczas efekt termiczny reakcji ( Pytanie V) jest równa zmianie energia wewnętrzna(D U) substancje biorące udział w reakcji, ale z przeciwnym znakiem:
Q V = – U.
Przez energię wewnętrzną ciała rozumie się sumę energii oddziaływań międzycząsteczkowych, wiązań chemicznych, energię jonizacji wszystkich elektronów, energię wiązań nukleonów w jądrach oraz wszystkie inne znane i nieznane rodzaje energii „magazynowane” przez to ciało. Znak „–” wynika z faktu, że wraz z wydzielaniem ciepła energia wewnętrzna maleje. To jest
U= – Pytanie V .
Jeśli reakcja zachodzi przy stałym ciśnieniu, wówczas objętość układu może się zmienić. Wykonywanie pracy polegającej na zwiększeniu objętości również bierze udział w energii wewnętrznej. W tym przypadku
U = –(Pytanie + Odp) = –(QP+PV),
Gdzie Pytanie str– efekt termiczny reakcji zachodzącej pod stałym ciśnieniem. Stąd
P = – W GÓRĘV .
Wartość równa U+PV dostałem to imię zmiana entalpii i oznaczone przez D H.
H=U+PV.
Stąd
P = – H.
Zatem w miarę uwalniania ciepła entalpia układu maleje. Stąd stara nazwa tej wielkości: „zawartość ciepła”.
W przeciwieństwie do efektu termicznego, zmiana entalpii charakteryzuje reakcję niezależnie od tego, czy zachodzi ona przy stałej objętości, czy przy stałym ciśnieniu. Nazywa się równania termochemiczne zapisane przy użyciu zmiany entalpii równania termochemiczne w postaci termodynamicznej. W tym przypadku podana jest wartość zmiany entalpii w warunkach standardowych (25°C, 101,3 kPa), oznaczona H o. Na przykład:
2H 2 (g) + O 2 (g) = 2H 2 O (g) H o= – 484 kJ;
CaO (cr) + H 2 O (l) = Ca(OH) 2 (cr) H o= – 65 kJ.
Zależność ilości ciepła wydzielonego w reakcji ( Q) z efektu termicznego reakcji ( Q o) i ilość substancji ( N B) jeden z uczestników reakcji (substancja B - substancja wyjściowa lub produkt reakcji) wyraża się równaniem:
Tutaj B jest ilością substancji B, określoną przez współczynnik znajdujący się przed wzorem substancji B w równaniu termochemicznym.
Zadanie
Określ ilość substancji wodorowej spalonej w tlenie, jeśli wydzieli się ciepło 1694 kJ.
Rozwiązanie
2H 2 (g) + O 2 (g) = 2H 2 O (g) + 484 kJ. |
|
|
Q = 1694 kJ, 6. Efekt cieplny reakcji krystalicznego aluminium z gazowym chlorem wynosi 1408 kJ. Zapisz równanie termochemiczne tej reakcji i określ masę glinu potrzebną do wytworzenia w tej reakcji 2816 kJ ciepła. 9.4. Reakcje endotermiczne. Entropia Oprócz reakcji egzotermicznych możliwe są reakcje, w których ciepło jest pochłaniane, a jeśli nie jest ono dostarczane, układ reakcyjny jest chłodzony. Takie reakcje nazywane są endotermiczny. Efekt termiczny takich reakcji jest ujemny. Na przykład: Zatem energia uwolniona podczas tworzenia wiązań w produktach tych i podobnych reakcji jest mniejsza niż energia potrzebna do rozerwania wiązań w substancjach wyjściowych.
Weźmy dwie kolby i napełnijmy jedną z nich azotem (bezbarwny gaz), a drugą dwutlenkiem azotu (brązowy gaz), tak aby zarówno ciśnienie, jak i temperatura w kolbach były takie same. Wiadomo, że substancje te nie reagują ze sobą chemicznie. Połączmy szczelnie kolby szyjkami i zamontujmy je pionowo, tak aby kolba z cięższym dwutlenkiem azotu znalazła się na dole (ryc. 9.1). Po pewnym czasie zobaczymy, że do górnej kolby stopniowo przedostaje się brązowy dwutlenek azotu, a do dolnej bezbarwny azot. W rezultacie gazy mieszają się, a kolor zawartości kolb staje się taki sam. Zatem,
Równania związku między entropią ( S) i innych wielkości uczy się na kursach fizyki i chemii fizycznej. Jednostka entropii [ S] = 1 J/K. G= H–T S Warunek spontanicznej reakcji: G< 0. W niskich temperaturach czynnikiem decydującym o możliwości zajścia reakcji jest w dużej mierze współczynnik energii, a w wysokich temperaturach – współczynnik entropii. W szczególności z powyższego równania jasno wynika, dlaczego reakcje rozkładu, które nie zachodzą w temperaturze pokojowej (wzrost entropii), zaczynają zachodzić w podwyższonych temperaturach. REAKCJA ENDOTERMICZNA, ENTROPIA, WSPÓŁCZYNNIK ENERGII, WSPÓŁCZYNNIK ENTROPII, ENERGIA GIBBSA. 2CuO (cr) + C (grafit) = 2Cu (cr) + CO 2 (g) wynosi –46 kJ. Zapisz równanie termochemiczne i oblicz, ile energii potrzeba, aby w tej reakcji wytworzyć 1 kg miedzi. CaCO 3 (cr) = CaO (cr) + CO 2 (g) – 179 kJ Powstało 24,6 litrów dwutlenku węgla. Określ, ile ciepła zostało bezużytecznie zmarnowane. Ile gramów tlenku wapnia powstało? |