Allmänna egenskaper hos element i grupp V-A. P-element i grupp V Maximal valens för element i grupp 5 i huvudundergruppen
Likheter mellan element:
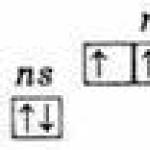
Identisk struktur för det yttre elektroniska lagret av atomer ns 2 np 3;
P-element;
Högre by O. lika med +5;
Nedre s. O. lika med -3 (okarakteristiskt för Sb och Bi).
För element i huvudundergruppen i grupp V används ibland gruppnamnet "pnictogens", introducerat i analogi med termerna "halogener" och "kalkogener" och härlett från symbolerna för elementen fosfor P och kväve N.
Valenstillstånd för atomer
För P, As, Sb, Bi-atomer är 2 valenstillstånd möjliga:
Grundläggande ns 2 np 3
Kåta ns 1 np 3:a 1
Skillnaden mellan kväve och andra element i undergruppen
1. På grund av frånvaron av d-orbitaler i det yttre elektroniska lagret i kväveatomen kan antalet kovalenta bindningar som bildas av kväveatomen enligt utbytesmekanismen inte vara fler än 3.
2. Närvaron av ett ensamt elektronpar på 2s subnivå av kväveatomen gör det möjligt att bilda en kovalent bindning via donator-acceptor-mekanismen. Den högsta valensen av N är alltså IV.
3. I föreningar med syre uppvisar kväve oxidationstillstånd +1, +2, +3, +4, +5.
Vertikal förändring av grundämnenas egenskaper och de ämnen de bildar
Till skillnad från halogener och kalkogener sker i huvudundergruppen av grupp V en mer dramatisk förändring av egenskaperna hos elementen och de enkla ämnen de bildar när kärnans laddning och atomernas radie ökar:
Vertikal förändring av grundämnenas egenskaper och de enkla ämnen de bildar |
|||||
icke-metaller |
metall med vissa tecken på icke-metallicitet |
||||
Oxider och hydroxider |
Kväve och dess syreföreningar betraktas separat på grund av ett antal skillnader. |
||||
E 2 O 3 och motsvarande hydroxider |
P 2 O 3 (P 4 O 6) sur oxid |
Som 2 O 3 sur oxid med tecken på amfotericitet |
Sb2O3 amfoter oxid |
Bi 2 O 3 basisk oxid |
|
E 2 O 5 och motsvarande hydroxider |
P 2 O 5 (P 4 O 10) syraoxid |
Som 2 O 5 syraoxid |
Sb 2 O 5 syraoxid |
Bi 2 O 5 amfoterisk ömtålig |
|
HPO 3 (H 3 PO 4) |
|||||
svaga syror |
|||||
Syra egenskaper försvagas |
|||||
Grundläggande egenskaper förbättras |
|||||
Väteföreningar EN 3
Elementen i huvudundergruppen i grupp V bildar flyktiga föreningar med väte, som är giftiga gaser med karakteristiska lukter. De är starka reduktionsmedel. Till skillnad från väteföreningar av icke-metaller i grupperna VII och VI, bildar de inte H+-joner i vattenlösningar, d.v.s. de uppvisar inte sura egenskaper.
ALLMÄNNA KARAKTERISTIKA FÖR DEN 5:E GRUPPERN AV ELEMENT.
Huvudundergruppen V 0 01 F i det periodiska systemet inkluderar kväve, fosfor, arsenik, antimon och vismut. Dessa element, som har fem elektroner i det yttre lagret av atomen, karakteriseras generellt
som icke-metaller. Deras förmåga att lägga till elektroner är dock mycket mindre uttalad än den för motsvarande element i grupperna VI och VII. På grund av närvaron av fem yttre elektroner är den högsta positiva oxidationen av elementen i denna undergrupp -5, och den negativa - 3. På grund av den relativt lägre elektronegativiteten är bindningen av elementen i fråga med väte mindre polär än bindning med väte av element i grupperna VI och VII. Därför eliminerar väteföreningar av dessa grundämnen inte vätejoner H i en vattenlösning och har därför inte sura egenskaper. De fysikaliska och kemiska egenskaperna hos grundämnena i kväveundergruppen förändras med
0 0 1 Finökning av serienumret i samma sekvens som observerades i
0 0 1 För de tidigare betraktade grupperna, Men eftersom icke-metalliska egenskaper uttrycks i
svagare än syre och speciellt fluor, då försvagningen av dessa egenskaper under övergången till 0 0 1 F medför följande element uppkomsten och ökningen av metalliska egenskaper.
De senare märks redan i arsenik, antimon har båda egenskaperna ungefär lika, och i vismut dominerar de metalliska egenskaperna framför de icke-metalliska. BESKRIVNING AV ELEMENT. KVÄVE(från grekiska ázōos - livlös, lat. Nitrogenium), N, kemiskt grundämne V
grupper av det periodiska systemet av Mendeleev, atomnummer 7, atommassa 14,0067; färglös gas, luktfri och smaklös. Historisk referens. Kväveföreningar - salpeter, salpetersyra, ammoniak - var
känd långt före produktionen av kväve i det fria tillståndet. År 1772 visade D. Rutherford, som bränner fosfor och andra ämnen i en glasklocka, att gasen som finns kvar efter förbränning, som han kallade "kvävande luft", inte stöder andning och förbränning. År 1787 slog A. Lavoisier fast att de "vitala" och "kvävande" gaserna som utgör luften är enkla ämnen, och föreslog namnet "kväve". År 1784 visade G. Cavendish att kväve är en del av salpetern; Det är härifrån det latinska namnet kväve kommer (från det sena latinska nitrum - salpeter och det grekiska gennao - jag föder, jag producerar), föreslog 1790 av J. A. Chaptal. I början av 1800-talet. Kvävets kemiska tröghet i fritt tillstånd och dess exklusiva roll i föreningar med andra grundämnen som bundet kväve klargjordes. Sedan dess har "bindningen" av luftkväve blivit ett av kemins viktigaste tekniska problem. Prevalens i naturen. Kväve är ett av de vanligaste grundämnena på
Jorden och dess bulk (cirka 4´1015 T) är koncentrerad i ett fritt tillstånd i atmosfären. I luften är fritt kväve (i form av N2-molekyler) 78,09 volymprocent (eller 75,6 viktprocent), utan att räkna med dess mindre föroreningar i form av ammoniak och oxider. Den genomsnittliga kvävehalten i litosfären är 1,9´10-3 viktprocent. Naturliga kväveföreningar. - ammoniumklorid NH4Cl och olika nitrater (se.
Salpeter.) Stora ansamlingar av salpeter är karakteristiska för ett torrt ökenklimat (Chile, Centralasien). Länge var nitrat huvudleverantören av kväve till industrin (nu är den industriella syntesen av ammoniak från luftkväve och väte av primär betydelse för kvävefixering). Små mängder fixerat kväve finns i kol (1-2,5%) och olja (0,02-1,5%), samt i vatten i floder, hav och hav. Kväve ansamlas i jordar (0,1 %) och i levande organismer (0,3 %).
Även om namnet "kväve" betyder "icke-livsuppehållande", är det faktiskt ett väsentligt element för livet. Animaliskt och humant protein innehåller 16 - 17 % kväve. I köttätande djurs organismer bildas protein på grund av de konsumerade proteinämnena som finns i organismerna hos växtätande djur och i växter. Växter syntetiserar protein genom att assimilera kvävehaltiga ämnen som finns i jorden, huvudsakligen oorganiska. Betydande mängder kväve kommer in i marken tack vare kvävefixerande mikroorganismer som kan omvandla fritt kväve från luften till kväveföreningar. Kvävets kretslopp förekommer i naturen, där huvudrollen spelas av
mikroorganismer - nitrofiering, denitrofiering, kvävefixering, etc. Men som ett resultat av utvinning av enorma mängder fixerat kväve från marken av växter (särskilt med intensivt jordbruk), blir marken utarmad på kväve. Kvävebrist är typiskt för jordbruket i nästan alla länder; På jordar som är fattiga på tillgängligt kväve utvecklas växter dåligt. Kvävegödsel och proteinutfodring av djur är de viktigaste medlen för att stärka jordbruket. Mänskliga ekonomiska aktiviteter stör kvävets kretslopp. Förbränning av bränsle berikar alltså atmosfären med kväve, och fabriker som producerar gödningsmedel binder kväve från luften. Transport av konstgödsel och jordbruksprodukter omfördelar kväve till jordens yta. Kväve är det fjärde vanligaste grundämnet i solsystemet (efter väte,
helium och syre). Isotoper, atom, molekyl. Naturligt kväve består av två stabila isotoper: 14N
(99,635%) och 15N (0,365%). 15N-isotopen används i kemisk och biokemisk forskning som en märkt atom. Av de konstgjorda radioaktiva isotoper av kväve har 13N den längsta halveringstiden (T1/2 - 10,08) min), resten är mycket kortlivade. I de övre lagren av atmosfären, under inverkan av neutroner från kosmisk strålning, förvandlas 14N till den radioaktiva kolisotopen 14C. Denna process används också i kärnreaktioner för att producera 14C. Kväveatomens yttre elektronskal. består av 5 elektroner (ett ensamt par och tre oparade - konfiguration 2 s 22sid 3). Oftast kväve. i föreningar är det 3-kovalent på grund av oparade elektroner (som i ammoniak NH3). Närvaron av ett ensamt elektronpar kan leda till bildandet av ytterligare en kovalent bindning, och kväve blir 4-kovalent (som i ammoniumjonen NH4+). Kväveoxidationstillstånd varierar från +5 (i N205) till -3 (i NH3). Under normala förhållanden, i fritt tillstånd, bildar kväve en N2-molekyl, där N-atomerna är förbundna med tre kovalenta bindningar. Kvävemolekylen är mycket stabil: dess dissociationsenergi till atomer är 942,9 kJ/mol (225,2 kcal/mol), därför även med t ca 3300°C grad av kvävedissociation. är bara cirka 0,1 %. Fysiska och kemiska egenskaper. Kväve är något lättare än luft; densitet 1,2506 kg/
m3(vid 0°C och 101325 n/m2 eller 760 mmHg Konst.), tpl-209,86°C, koka-195,8°C. A. kondenserar med svårighet: dess kritiska temperatur är ganska låg (-147,1 ° C), och dess kritiska tryck är högt 3,39 Mn/m2 (34,6 kgf/cm2); densitet av flytande kväve 808 kg(m3. Kväve är mindre lösligt i vatten än syre: vid 0°C i 1 m3 H2O löser sig 23.3 G kväve. Kväve är mer lösligt i vissa kolväten än i vatten. Endast med aktiva metaller som litium, kalcium, magnesium, kväve
interagerar vid upphettning till relativt låga temperaturer. Kväve reagerar med de flesta andra grundämnen vid höga temperaturer och i närvaro av katalysatorer. Föreningarna av kväve med syre N2O, NO, N2O3, NO2 och N2O5 har studerats väl. Av dessa bildas, under den direkta interaktionen av grundämnen (4000°C), NO-oxid, som vid kylning lätt oxideras vidare till NO2-dioxid. I luften bildas kväveoxider vid atmosfäriska utsläpp. De kan också erhållas genom att utsätta en blandning av kväve och syre för joniserande strålning. När kvävehaltig N2O3 och
Salpetersyraanhydrider N2O5 producerar salpetersyra HNO2 respektive salpetersyra HNO3 och bildar salter - nitriter och nitrater. Kväve kombineras med väte endast vid höga temperaturer och i närvaro av katalysatorer, och ammoniak NH3 bildas. Förutom ammoniak är många andra föreningar av kväve med väte kända, till exempel hydrazin H2N-NH2, diimid HN-NH, saltpetersyra HN3(H-N-NºN), oktazon N8H14, etc.; De flesta kväve- och väteföreningar isoleras endast i form av organiska derivat. Kväve interagerar inte direkt med halogener, därför erhålls alla kvävehalogenider endast indirekt, till exempel kvävefluorid NF3- när fluor reagerar med ammoniak. Som regel är kvävehalogenider lågstabila föreningar (med undantag för NF3); Kväveoxihalider är mer stabila - NOF, NOCI, NOBr, N02F och NO2CI. Kväve förenas inte heller direkt med svavel; kvävehaltigt svavel N4S4 erhålls som ett resultat av reaktionen av flytande svavel med ammoniak. När varm koks reagerar med kväve bildas cyanogen (CN).;. Genom att värma kväve med acetylen C2H2 till 1500°C kan vätecyanid HCN erhållas. Interaktionen av kväve med metaller vid höga temperaturer leder till bildning av nitrider (till exempel Mg3N2). När vanligt kväve utsätts för elektriska urladdningar [tryck 130 - 270 n/m2(1- 2
mmHg)] eller vid nedbrytning av B-, Ti-, Mg- och Ca-nitrider samt vid elektriska urladdningar i luften kan aktivt kväve bildas som är en blandning av kvävemolekyler och atomer med ökad energireserv. Till skillnad från molekylärt kväve interagerar aktivt kväve mycket energiskt med syre, väte, svavelånga, fosfor och vissa metaller. Kväve är en del av många viktiga organiska föreningar (aminer,
aminosyror, nitroföreningar, etc.). Kvitto och ansökan. I laboratoriet kan kväve lätt erhållas genom
upphettning av en koncentrerad lösning av ammoniumnitrit: NH4NO2 - N2 + 2H2O. Den tekniska metoden för framställning av kväve bygger på separation av förvätskad luft, som sedan utsätts för destillation. Huvuddelen av det extraherade fria kvävet används för industri
produktion av ammoniak, som sedan förädlas i betydande mängder till salpetersyra, gödningsmedel, sprängämnen etc. Förutom direkt syntes av ammoniak från grundämnen utvecklades cyanamidmetoden 1905, baserad på att vid 1000 °C karbidkalcium (erhållen genom att värma en blandning av kalk och kol i en elektrisk ugn) reagerar med fritt kväve: CaC2 + N2 = CaCN2 + C. Den resulterande kalciumcyanamiden sönderdelas under inverkan av överhettad vattenånga och frigör ammoniak:
CaCN+3H2O=CaCO3+2NH3.
Fritt kväve används i många industrier: som inert medium i olika kemiska och metallurgiska processer, för att fylla fritt utrymme i kvicksilvertermometrar, vid pumpning av brandfarliga vätskor etc. Flytande kväve används i olika kylaggregat. Den lagras och transporteras i Dewar-kärl av stål, kvävgas i komprimerad form - i cylindrar. Många kväveföreningar används i stor utsträckning produktionen av fixerat kväve började utvecklas snabbt efter 1:a världskriget och har nu nått enorma proportioner.
Fosfor(lat. Fosfor), P, kemiskt element i grupp V i Mendeleevs periodiska system, atomnummer 15, atommassa 30,97376, icke-metall. Naturlig fosfor består av en stabil isotop, 31P; sex artificiella radioaktiva isotoper erhölls: 28P ( T1/2 - 6,27 sek), 29P ( T1/2 - 4,45 sek); 30P ( T1/2 - 2,55 min), 31P ( T1/2
14,22 dagar), 32P ( T1/2 - 25 dagar), 33P ( T1/2 - 12,5 sek). 32P har störst värde , besitter betydande b-strålningsenergi och används i kemisk och biokemisk forskning som en märkt atom. Historisk referens. Enligt vissa litteraturdata, metoden för att erhålla
Fosfor var redan känt för araberna. alkemister på 1100-talet. Men det allmänt accepterade datumet för upptäckten av fosfor anses vara 1669, då H. Brand (Tyskland) genom att kalcinera den torra återstoden från urinens avdunstning med sand och efterföljande destillation utan lufttillgång, fick ett ämne som lyser i mörk, först kallad "kall eld", och senare fosfor från grekiskan. fosfor - lysande. Snart blev metoden för att erhålla fosfor känd för honom. kemister - I. Kraft, I. Kunkel; 1682 publicerades denna metod. År 1743 utvecklade A. S. Marggraf följande metod för framställning av fosfor: en blandning av blyklorid och urin indunstades till torrhet och upphettades tills utsläppet av flyktiga produkter upphörde; återstoden blandades med pulveriserat träkol och destillerades i en lerretort; Fosforånga kondenseras i behållaren med vatten. Den enklaste metoden att erhålla fosfor genom att kalcinera benaska med kol föreslogs först 1771 av K. Scheele. Fosfors elementära natur fastställdes av A. Lavoisier. Under andra hälften av 1800-talet. industriell produktion av fosfor från fosforiter i retortugnar uppstod; i början av 1900-talet. de ersattes av elektriska ugnar. Utbredning i naturen. Genomsnittlig fosforhalt i jordskorpan (clark) -
9,3 x 10-2 viktprocent; i medelstora bergarter 1,6×10-1, i basiska bergarter 1,4×10-1, mindre i graniter och andra sura magmatiska bergarter - 7×10-2 och ännu mindre i ultrabasiska bergarter (mantel) - 1, 7×10-2% ; i sedimentära bergarter från 1,7×10-2 (sandstenar) till 4×10-2 % (karbonatbergarter). Fosfor deltar i magmatiska processer och migrerar kraftigt i biosfären. Båda processerna är förknippade med dess stora ansamlingar och bildar industriella avlagringar av apatiter och fosforiter . Fosfor är ett extremt viktigt biogent element, det ackumuleras av många organismer. Många processer för fosforkoncentration i jordskorpan är förknippade med biogen migration. Fosfor fälls lätt ut från vatten i form av olösliga mineraler eller fångas upp av levande materia. Därför innehåller havsvatten endast 7 × 10-6% fosfor. Cirka 180 fosformineraler är kända, främst olika fosfater, varav kalciumfosfater är de vanligaste . Fysikaliska egenskaper. Elementär fosfor finns i form av flera
allotropa modifieringar, varav de viktigaste är vita, röda och svarta. Vit fosfor är ett vaxartat, genomskinligt ämne med en karakteristisk lukt, bildad av kondensation av fosforånga. Vit fosfor i närvaro av föroreningar - spår av röd fosfor, arsenik, järn, etc. - målad gul, så kommersiell vit fosfor. kallas gul. Det finns två former av vit fosfor: a- och b-form. a-modifiering representerar kristaller av det kubiska systemet ( A- 18,5); densitet 1,828 g/cm3, t pl 44,1 °C, t kip 280,5 °C, smältvärme 2,5 kJ/mol P4 (0,6 kcal/mol P4), förångningsvärme 58,6 kJ/mol P4(14,0 kcal/mol P4) , ångtryck vid 25 °C 5.7 n/m2 (0,043 mmHg Konst.). Den linjära expansionskoefficienten i temperaturområdet från 0 till 44 °C är 12,4 × 10-4 , värmeledningsförmåga 0,56 tis/(m xK) vid 25°C. Vit fosfors elektriska egenskaper. nära dielektrikum: bandgap ca 2,1 ev, elektrisk resistivitet 1,54×1011 ohm× centimeter, diamagnetisk, specifik magnetisk känslighet - 0,86×10-6. Brinell hårdhet 6 Mn/m2 (0,6 kgf/mm2). a-formen av vit fosfor löser sig bra i koldisulfid, mindre bra i flytande ammoniak, bensen, koltetraklorid etc. Vid -76,9 °C och ett tryck på 0,1 Mn/m2(1kgf/cm2) a-form omvandlas till lågtemperatur b-form (densitet 1,88 g/cm3). Med tryck som ökar till 1200 Mn/m2(12 tusen kgf/cm2) övergången sker vid 64,5 °C. b-form - kristaller med dubbelbrytning, deras struktur har inte definitivt fastställts. Vit fosfor är giftig: i luft vid en temperatur på cirka 40 °C
självantänder, så det bör förvaras under vatten (löslighet i vatten vid 25 °C 3,3 × 10-4%) . Genom att värma upp vit fosfor utan tillgång till luft vid 250-300 °C under flera timmar erhålls röd fosfor. Övergången är exoterm, accelererad av ultravioletta strålar, såväl som föroreningar (jod, natrium, selen). Vanlig kommersiell röd fosfor är nästan helt amorf; har en färg från mörkbrun till lila. Vid långvarig uppvärmning kan den irreversibelt omvandlas till en av de kristallina formerna (triklinisk, kubisk, etc.) med olika egenskaper: densitet från 2,0 till 2,4 g/cm 3,t pl från 585 till 610 °C vid ett tryck på flera tiotals atmosfärer, sublimeringstemperatur från 416 till 423 °C, elektrisk resistivitet från 109 till 1014 ohm× centimeter. Röd fosfor antänds inte spontant i luften; upp till en temperatur på 240-250 °C, men självantänder vid friktion eller stötar; olöslig i vatten, samt i bensen, koldisulfid, etc., löslig i fosfortribromid. Vid sublimeringstemperaturen förvandlas röd fosfor till ånga, vid kylning som huvudsakligen producerar vit fosfor. När vit fosfor värms upp till 200-220 °C under tryck (1,2-1,7) × 103 Mn/m 2
[(12-17)×103 kgf/cm 2] svart fosfor bildas. Denna omvandling kan utföras utan tryck, men i närvaro av kvicksilver och en liten mängd svarta fosforkristaller (frö) vid 370 °C i 8 dagar Svart fosfor är en kristall av en ortorombisk struktur ( A -3,31 , b - 4,38 , Med-10.50), är gallret byggt av fibrösa lager med karakteristisk fosfor. pyramidformigt arrangemang av atomer, densitet 2,69 g/cm3, t pl ca 1000 °C under tryck 1,8×103 Mn/m2(18×103 kgf/cm2). Till utseendet liknar svart fosfor grafit; halvledare: bandgap 0,33 ev vid 25°C; har en specifik elektrisk resistivitet på 1,5 ohm× centimeter, temperaturkoefficient för elektriskt motstånd är 0,0077, diamagnetisk, specifik magnetisk känslighet är 0,27×10-6. När den värms upp till 560-580 °C under trycket från sina egna ångor förvandlas den till röd fosfor. Svart fosfor är lågaktivt och svårt att antända när det antänds, så det kan säkert bearbetas i luft. Atomradien för fosfor är 1,34, jonradier: P5 + 0,35, P3 + 0,44, P3- 1,86.
Fosforatomer kombineras för att bilda diatomiska (P2), tetraatomiska (P4) och polymermolekyler. De mest stabila polymermolekylerna under normala förhållanden är de som innehåller långa kedjor av sammankopplade P4-tetraedrar. I flytande, fast (vit fosfor) och ånga under 800 °C består fosfor av P4-molekyler. Vid temperaturer över 800 °C dissocierar P4-molekyler till P2 , som i sin tur sönderfaller till atomer vid temperaturer över 2000 °C. Endast vit fosfor består av P4-molekyler, alla andra modifieringar är polymerer. Kemiska egenskaper. Konfiguration av yttre elektroner av fosforatom 3 s2 3p3, V
föreningar är de mest karakteristiska oxidationstillstånden + 5, + 3 och - 3. Liksom kväve är fosfor i föreningar huvudsakligen kovalent. Det finns väldigt få joniska föreningar som fosfider Na3P och Ca3P2. Till skillnad från kväve har fosfor fri 3 d- orbitaler med ganska låga energier, vilket leder till möjligheten att öka koordinationstalet och bildandet av donator-acceptorbindningar. Fosfor är kemiskt aktivt, vit fosfor har störst aktivitet;
röd och svart fosfor är mycket mer passiva i kemiska reaktioner. Oxidationen av vit fosfor sker via en kedjereaktionsmekanism. Fosforoxidation åtföljs vanligtvis av kemiluminescens. När fosfor brinner i ett överskott av syre, bildas pentoxid P4O10 (eller P2O5) när det finns en brist, främst trioxid P4O6 (eller P2O3). Förekomsten av P4O7, P4O8 i ångor har spektroskopiskt bevisats , P2O6, PO och andra fosforoxider. Fosforpentoxid framställs i industriell skala genom att förbränna elementärt fosfor i överskott av torr luft. Efterföljande hydratisering av P4O10 leder till produktion av orto-(H3PO4) och poly-(H) n+2 P n O3 P+ 1) fosforsyror. Bortsett från
Dessutom bildar fosfor fosforsyra H3PO3, fosforsyra H4P2O6 och hypofosforsyra H3PO2, samt persyror: perfosforsyra H4P2O8 och monoperfosforsyra H3PO5 Salter av fosforsyror (fosfater) används ofta , i mindre utsträckning - fosfiter och hypofosfiter. Fosfor kombineras direkt med alla halogener för att frigöra en stor
mängd värme och bildning av trihalider (PX3, där X är halogen), pentahalider (PX5) och oxihalider (till exempel POX3) . När fosfor smälter samman med svavel under 100 °C, bildas fasta lösningar baserade på fosfor och svavel, och över 100 °C sker en exoterm reaktion för att bilda kristallina sulfider P4S3, P4S5, P4S7, P4S10, av vilka endast P4S5 sönderfaller till P4S3. över 200 °C och P4S7, och resten smälter utan sönderdelning. Följande fosforoxisulfider är kända: P2O3S2, P2O3S3, P4O4S3, P6O10S5 och P4O4S3. Fosfor, jämfört med kväve, har mindre förmåga att bilda föreningar med väte. Fosforvätefosfin PH3 och difosfin P2H4 kan endast erhållas indirekt. Av fosfor-kväveföreningarna är nitriderna PN, P2N3, P3N5 kända - fasta, kemiskt stabila ämnen erhållna genom att leda kväve med fosforånga genom en elektrisk ljusbåge; polymera fosfonitrilhalider - (PNX2)n (till exempel polyfosfonitrilklorid) , erhållen genom att reagera pentahalider med ammoniak under olika betingelser; amidoimidofosfater är föreningar, vanligtvis polymera, som innehåller P-NH-P-bindningar tillsammans med P-O-P-bindningar. Vid temperaturer över 2000°C reagerar fosfor med kol för att bildas
PC3-karbid är ett ämne som är olösligt i vanliga lösningsmedel och som inte interagerar med vare sig syror eller alkalier. Vid upphettning med metaller bildar fosfor fosfider. Fosfor bildar många organofosforföreningar. Mottagande. produktion av elementärt fosfor utförs
elektrotermisk reduktion av det från naturliga fosfater (apatiter eller fosforiter) vid 1400-1600 °C med koks i närvaro av kiseldioxid (kvartssand):
2Ca3(PO4)2 + 10C+ n Si02 = P4 + 10CO + 6CaO× n SiO2 Förkrossad och berikad fosforhaltig malm blandas in
specificerade förhållanden med kiseldioxid och koks och laddas i en elektrisk ugn. Kiseldioxid är nödvändig för att sänka reaktionens temperatur, samt öka dess hastighet genom att binda den kalciumoxid som frigörs under reduktionsprocessen till kalciumsilikat, som kontinuerligt avlägsnas som smält slagg. Silikater och oxider av aluminium, magnesium, järn och andra föroreningar samt ferrofosfor (Fe2P, FeP, Fe3P), som bildas genom interaktionen av en del av det reducerade järnet med fosfor, passerar också in i slaggen. Ferrofosfor, såväl som små mängder manganfosfider och andra metaller lösta i den, avlägsnas från den elektriska ugnen när de ackumuleras för efterföljande användning vid tillverkning av specialstål. Fosforånga lämnar den elektriska ugnen tillsammans med gasformiga biprodukter.
produkter och flyktiga föroreningar (CO, SiF4, PH3, vattenånga, pyrolysprodukter av organiska laddningsföroreningar etc.) vid en temperatur av 250-350 °C. Efter rengöring från damm skickas gaser innehållande fosfor till kondenseringsenheter, i vilka flytande teknisk vit fosfor samlas upp under vatten vid en temperatur på minst 50 °C. Metoder utvecklas för att framställa fosfor med hjälp av gasformigt
reduktionsmedel, plasmareaktorer för att intensifiera produktionen genom att höja temperaturen till 2500-3000 °C, dvs högre än dissociationstemperaturerna för naturliga fosfater och reducerande gaser (till exempel metan) som används som transportgas i lågtemperaturplasma.
Ansökan. Huvuddelen av fosfor som produceras bearbetas till fosforsyra och fosforgödselmedel och tekniska salter (fosfater) som erhålls på basis av den. . Vit fosfor används i brand- och rökskal, bomber; röd
fosfor - i tändstickstillverkning. Fosfor används vid tillverkning av icke-järnmetallegeringar som ett deoxidationsmedel. Införandet av upp till 1 % fosfor ökar värmebeständigheten hos legeringar som fechral och chromal. Fosfor ingår i vissa bronser, eftersom ökar deras flytbarhet och motståndskraft mot nötning. Fosfider av metaller, såväl som vissa icke-metaller (B, Si, As, etc.) används vid framställning och dopning av halvledarmaterial. Fosfor används delvis för att framställa klorider och sulfider, som fungerar som utgångsmaterial för framställning av fosforhaltiga mjukgörare (till exempel trikresylfosfat, tributylfosfat, etc.), läkemedel, organiska fosforbekämpningsmedel och används även som tillsatser i smörjmedel och bränslen. Säkerhetsåtgärder. Vit fosfor och dess föreningar är mycket giftiga. Arbeta med
fosfor kräver noggrann tätning av utrustningen; lagra vit fosfor. bör vara under vatten eller i en hermetiskt tillsluten metallbehållare. Vid arbete med fosfor måste säkerhetsföreskrifterna följas strikt. Fosfor i kroppen. Fosfor är ett av de viktigaste biogena elementen,
nödvändig för alla organismers liv. Det finns i levande celler i form av orto- och pyrofosforsyror och deras derivat, och är också en del av nukleotider, nukleinsyror, fosfoproteiner, fosfolipider, fosforestrar av kolhydrater, många koenzymer och andra organiska föreningar. På grund av särdragen i deras kemiska struktur kan fosforatomer, liksom svavelatomer, bilda energirika bindningar i högenergiföreningar; adenosintrifosforsyra (ATP), kreatinfosfat etc. I den biologiska evolutionsprocessen var det fosforföreningar som blev de främsta, universella lagrarna av genetisk information och energibärare i alla levande system. Dr. Fosforföreningarnas viktiga roll i kroppen ligger i det faktum att den enzymatiska tillsatsen av en fosforylrest () till olika organiska föreningar (fosforylering) fungerar som ett "pass" för deras deltagande i ämnesomsättningen, och omvänt, klyvningen av en fosforylrest (defosforylering) utesluter dessa föreningar från aktivt utbyte. Fosformetabolism enzymer - kinaser, fosforylaser och fosfataser. Levern spelar huvudrollen i omvandlingen av fosforföreningar i kroppen hos djur och människor. Omsättningen av fosforföreningar regleras av hormoner och vitamin D. Fosforhalt (i mg per 100 G torrsubstans) i växtvävnader - 230-350,
marina djur - 400-1800, landlevande djur - 1700-4400, bakterier - cirka 3000; i människokroppen finns det särskilt mycket fosfor i benvävnad (något mer än 5000), i hjärnvävnad (cirka 4000) och i muskler (220-270). Människans dagliga behov av fosfor är 1-1,2 G(hos barn är det högre än hos vuxna). Av livsmedelsprodukterna är de rikaste på fosfor ost, kött, ägg, baljväxter (ärtor, bönor, etc.). Balansen av fosfor i kroppen beror på det allmänna tillståndet av ämnesomsättningen. Brott mot fosformetabolismen leder till djupgående biokemiska förändringar, främst i energimetabolismen. Med brist på fosfor i kroppen utvecklar djur och människor osteoporos och andra bensjukdomar, och växter utvecklar fosforsvält . Källan till fosfor i den levande naturen är dess oorganiska föreningar som finns i jorden och lösta i vatten. Fosfor utvinns ur jorden av växter i form av lösliga fosfater. Djur får vanligtvis tillräckligt med fosfor från kosten. Efter organismers död kommer fosfor igen in i marken och bottensedimenten och deltar därmed. i ämnenas kretslopp. Fosforens viktiga roll i regleringen av metaboliska processer bestämmer den höga känsligheten hos många enzymsystem av levande celler för verkan av organofosforföreningar. Denna omständighet används inom medicin vid utveckling av läkemedel, inom jordbruk vid framställning av fosfor
gödningsmedel, såväl som i skapandet av effektiva insekticider. Många fosforföreningar är extremt giftiga och några av de organiska fosforföreningarna kan klassificeras som kemiska stridsmedel (sarin, soman, tabun). Den radioaktiva isotopen av fosfor 32P används i stor utsträckning inom biologi och medicin som en indikator i studiet av alla typer av metabolism och energi i levande organismer . Läkemedel som innehåller fosfor (adenosintrifosforsyra,
fytin, kalciumglycerofosfat, fosfren, etc.), påverkar främst processerna för vävnadsmetabolism och används för sjukdomar i muskler, nervsystem, tuberkulos, näringsförlust, anemi etc. Radioaktiva isotoper av fosfor används som isotopindikatorer för att studera metabolism, diagnostik av sjukdomar, samt för strålbehandling av tumörer .
Arsenik(lat. Arsenicum), As, kemiskt element i grupp V i Mendeleevs periodiska system, atomnummer 33, atommassa 74,9216; stålgrå kristaller. Elementet består av en stabil isotop 75As. Historisk referens. Naturliga föreningar arsenik med svavel (orpiment As2S3,
realgar As4S4) var kända för folken i den antika världen, som använde dessa mineraler som mediciner och färger. Produkten från förbränning av arseniksulfider var också känd - arsenik(III)oxid As2O3 ("vit arsenik"). Namnet arsenikón finns redan hos Aristoteles; det härstammar från grekiskan. ársen - stark, modig och tjänade till att beteckna arsenikföreningar (baserat på deras starka effekt på kroppen). Det ryska namnet tros komma från "mus" (efter användning av arsenikpreparat för att utrota möss och råttor). Tillverkningen av arsenik i fritt tillstånd tillskrivs Albertus Magnus (cirka 1250). År 1789 inkluderade A. Lavoisier arsenik i listan över kemiska grundämnen. Utbredning i naturen. Genomsnittlig arsenikhalt i jordskorpan (clark)
1,7·10-4% (i massa), i sådana mängder finns det i de flesta magmatiska bergarter. Eftersom arsenikföreningar är flyktiga vid höga temperaturer, ackumuleras inte elementet under magmatiska processer; den koncentreras och faller ut från heta djupa vatten (tillsammans med S, Se, Sb, Fe, Co, Ni, Cu och andra grundämnen). Under vulkanutbrott kommer arsenik i form av dess flyktiga föreningar in i atmosfären. Eftersom arsenik är multivalent påverkas dess migration i hög grad av redoxmiljön. Under oxiderande förhållanden av jordytan bildas arsenater (As5+) och arseniter (As3+). Dessa är sällsynta mineraler som endast finns i områden med arsenikavlagringar. Native arsenik och As2+ mineraler är ännu mindre vanliga. Av de många arsenikmineralerna (cirka 180) är endast arsenopyrit FeAsS av primär industriell betydelse. Små mängder arsenik är avgörande för livet. Däremot i fyndighetens områden
arsenik och unga vulkaners aktivitet, innehåller jordar på vissa ställen upp till 1 % arsenik, vilket är förknippat med djursjukdomar och vegetationsdöd. Ansamlingen av arsenik är särskilt typisk för landskap av stäpper och öknar, i vars jordar arsenik är inaktiv. I fuktiga klimat tvättas arsenik lätt ur jorden. I levande materia finns i genomsnitt 3·10-5% arsenik, i floder 3·10-7%. Arsenik kom med
floder i havet lägger sig det relativt snabbt. I havsvatten finns det bara 1·10-7% arsenik, men i leror och skiffer är det 6,6·10-4%. Sedimentära järnmalmer och ferromanganknölar är ofta berikade med arsenik.
Fysiska och kemiska egenskaper. Arsenik har flera allotropa modifikationer. Under normala förhållanden är den mest stabila den så kallade metalliska, eller grå, arseniken (a-As) - en stålgrå spröd kristallin massa; när den är nysprucken har den en metallglans i luften, den bleknar snabbt eftersom den är täckt med en tunn film av As2O3. Kristallgittret av grå arsenik är romboedriskt ( A- 4.123 Å, vinkel a – 54®10", X- 0,226), skiktad. Densitet 5,72 g/cm3(vid 20°C), elektrisk resistivitet 35·10-8 ohm× m eller 35·10-6 ohm× centimeter, temperaturkoefficient för elektriskt motstånd 3,9·10-3 (0о-100 оC), Brinell hårdhet 1470 Mn/m2 eller 147 kgf/mm2(3-4 enligt Mohs); Arsenik är diamagnetisk. Under atmosfärstryck sublimerar arsenik vid 615 °C utan att smälta, eftersom trippelpunkten (se fasdiagram) a-As ligger vid 816 °C och ett tryck på 36 på. Arsenikånga består av As4-molekyler upp till 800?C, över 1700?C - endast As2. När arsenikånga kondenserar på en yta kyld av flytande luft bildas gul arsenik - transparenta, mjuka kristaller som vax, med en densitet på 1,97 g/cm3, liknande egenskaper som vit fosfor. När den utsätts för ljus eller låg värme förvandlas den till grå arsenik. Glasartade-amorfa modifikationer är också kända: svart arsenik och brun arsenik, som vid upphettning över 270 C förvandlas till grå M. Konfiguration av arsenikatomens yttre elektroner 3 d 104s 24sid 3. Arsenik i föreningar
har oxidationstillstånd + 5, + 3 och - 3. Grå arsenik är mycket mindre kemiskt aktiv än fosfor. Vid upphettning i luft över 400°C brinner arsenik och bildar As2O3. Arsenik kombineras direkt med halogener; under normala förhållanden är AsF5 en gas; AsF3, AsCl3, AsBr3 - färglösa, mycket flyktiga vätskor; AsI3 och As2l4 är röda kristaller. När arsenik och svavel värms upp erhålls sulfider: orangeröd As4S4 och citrongul As2S3. Blekgul sulfid As2S5 fälls ut genom att leda H2S in i en iskyld lösning av arseniksyra (eller dess salter) i rykande saltsyra: 2H3AsO4 + 5H2S = As2S5 + 8H2O; Vid cirka 500°C sönderdelas det till As2S3 och svavel. Alla M. sulfider är olösliga i vatten och utspädda syror. Starka oxidationsmedel (blandningar av HNO3 + HCl, HCl + KClO3) omvandlar dem till en blandning av H3AsO4 och H2SO4. As2S3 sulfid löser sig lätt i sulfider och polysulfider av ammonium och alkalimetaller och bildar salter av syror - tioarsen H3AsS3 och tioarsen H3AsS4. Med syre producerar arsenik oxider: oxid M. (III) As2O3 - arsensyraanhydrid och oxid M. (V) As2O5 - arsenikanhydrid. Den första av dem bildas genom inverkan av syre på metall eller dess sulfider, till exempel 2As2S3 + 9O2 - 2As2O3 + 6SO2. As2O3-ångor kondenserar till en färglös glasartad massa, som blir ogenomskinlig med tiden på grund av bildandet av små kubiska kristaller, densitet 3,865 g/cm3. Ångdensiteten motsvarar formeln As4O6: över 1800°C består ångan av As2O3. Vid 100 G vatten löser sig 2.1 G As2O3 (vid 25°C). M. oxid (III) är en amfoter förening med övervägande sura egenskaper. Salter (arseniter) som motsvarar ortoarsensyrorna H3AsO3 och metaarsensyror HAsO2 är kända; själva syrorna har inte erhållits. Endast alkalimetall- och ammoniumarseniter är lösliga i vatten. As2O3 och arseniter är vanligtvis reduktionsmedel (till exempel As2O3 + 2I2 + 5H2O - 4HI + 2H3AsO4), men kan också vara oxidationsmedel (till exempel As2O3 + 3C - 2As + 3CO). Arsenik(V)oxid framställs genom upphettning av arseniksyra H3AsO4 (ca
200oC). Den är färglös och sönderdelas vid cirka 500°C till As2O3 och O2. Arseniksyra framställs genom inverkan av koncentrerad HNO3 på As eller As2O3. Arseniksyrasalter (arsenater) är olösliga i vatten, med undantag för alkalimetall- och ammoniumsalter. Det är kända salter som motsvarar syrorna ortoarsenisk H3AsO4, metaarsenisk HAsO3 och pyroarsenisk H4As2O7; de två sista syrorna erhölls inte i fritt tillstånd. När den legeras med metaller bildar arsenik oftast föreningar (arsenider).
Kvitto och ansökan. Arsenik framställs industriellt genom att värma arsenikkis:
FeAsS - FeS + As eller (mindre ofta) reduktion av As2O3 med kol. Båda processerna utförs i repliker från
eldfast lera ansluten till en mottagare för kondensering av arsenikånga. Arsenikanhydrid erhålls genom oxidativ rostning av arsenikmalmer eller som en biprodukt från rostning av polymetalliska malmer, som nästan alltid innehåller arsenik. Vid oxidativ rostning bildas As2O3-ångor som kondenserar i uppsamlingskamrarna. Rå As2O3 renas genom sublimering vid 500-600°C. Renad As2O3 används för framställning av arsenik och dess preparat.
Små tillsatser av arsenik (0,2-1,0 viktprocent) införs i bly som används för framställning av pistolhagel (arsenik ökar ytspänningen hos smält bly, vilket gör att halet får en form nära sfärisk; arsenik ökar hårdheten något av bly). Som en delvis ersättning för antimon ingår arsenik i vissa babbitt- och trycklegeringar. Ren arsenik är inte giftig, men alla dess föreningar, lösliga i vatten eller kapabla till
gå i lösning under påverkan av magsaft, extremt giftig; Arsenikväte är särskilt farligt. Av de arsenikföreningar som används i produktionen är arsenikanhydrid den giftigaste. Nästan alla sulfidmalmer av icke-järnmetaller, såväl som järn(svavel)kis, innehåller en inblandning av arsenik. Därför, under deras oxidativa rostning, tillsammans med svaveldioxid SO2, bildas alltid As2O3; Det mesta kondenserar i rökkanalerna, men i avsaknad av eller låg effektivitet hos behandlingsanläggningar transporterar avgaserna från malmrostugnar märkbara mängder As2O3. Ren arsenik, även om den inte är giftig, är alltid täckt med en beläggning av giftig As2O3 när den förvaras i luft. I avsaknad av ordentlig ventilation är etsning av metaller (järn, zink) med industriella svavel- eller saltsyror som innehåller arsenik extremt farligt, eftersom detta producerar arsenikväte. Arsenik i kroppen. Arsenik finns överallt som ett spårämne.
i levande natur. Den genomsnittliga arsenikhalten i jordar är 4·10-4%, i växtaska - 3·10-5%. Arsenikhalten i marina organismer är högre än i landlevande organismer (i fisk 0,6-4,7 mg i 1 kg råmaterial ansamlas i levern). Den genomsnittliga arsenikhalten i människokroppen är 0,08-0,2 mg/kg. I blodet koncentreras arsenik i röda blodkroppar, där det binder till hemoglobinmolekylen (och globinfraktionen innehåller dubbelt så mycket som hem). Den största mängden av det (per 1 G vävnad) finns i njurarna och levern. Mycket arsenik finns i lungor och mjälte, hud och hår; relativt lite - i cerebrospinalvätskan, hjärnan (främst hypofysen), gonader etc. I vävnader finns arsenik i huvudproteinfraktionen, mycket mindre i den syralösliga fraktionen, och endast en liten del av den finns i lipidfraktionen. Arsenik är involverat i redoxreaktioner: oxidativ nedbrytning av komplexa kolhydrater, jäsning, glykolys, etc. Arsenikföreningar används inom biokemin som specifika enzymhämmare för att studera metaboliska reaktioner. Arsenik i medicin. Organiska arsenikföreningar (aminarson, miarsenol,
novarsenal, osarsol) används främst för behandling av syfilis och protozosjukdomar. Oorganiska preparat av arsenik - natriumarsenit (natriumarseniksyra), kaliumarsenit (kaliumarseniksyra), arsensyraanhydrid As2O3, ordineras som allmänna stärkande och toniska medel. När de appliceras topiskt kan oorganiska arsenikpreparat orsaka en nekrotiserande effekt utan föregående irritation, vilket gör denna process nästan smärtfri; denna egenskap, som är mest uttalad i As2O3, används inom tandvården för
förstörelse av tandmassan. Oorganiska arsenikpreparat används också för att behandla psoriasis. Artificiellt erhållna radioaktiva isotoper M. 74As (T1/2 - 17,5 dagar) och 76As (T1/2
26,8 h) används för diagnostiska och terapeutiska ändamål. Med deras hjälp klargörs platsen för hjärntumörer och graden av radikalitet av deras avlägsnande bestäms. Radioaktiv arsenik används ibland för blodsjukdomar etc. Enligt rekommendationerna från International Commission on Radiation Protection,
maximalt tillåtet innehåll av 76As i kroppen 11 mccurie. Enligt sanitära standarder som antagits i Sovjetunionen är de högsta tillåtna koncentrationerna av 76As i vatten och öppna reservoarer 1·10-7 curie/l, i luften av arbetslokaler 5·10-11 curie/l. Alla arsenikpreparat är mycket giftiga. Vid akut förgiftning observeras svår buksmärta, diarré och njurskador; Kollaps och kramper är möjliga. Vid kronisk förgiftning är de vanligaste gastrointestinala störningar, katarr i slemhinnorna i luftvägarna (faryngit, laryngit, bronkit), hudskador (exantem, melanos, hyperkeratos) och känslighetsrubbningar; utvecklingen av aplastisk anemi är möjlig. Vid behandling av förgiftning med arsenikpreparat är unitiol av största vikt. Åtgärder för att förhindra industriförgiftningar bör eftersträvas
främst på mekanisering, tätning och dammavlägsnande av den tekniska processen, skapa effektiv ventilation och förse arbetarna med personlig skyddsutrustning från exponering för damm. Regelbundna medicinska undersökningar av arbetare är nödvändiga. Preliminära medicinska undersökningar genomförs vid anställning och för anställda - en gång var sjätte månad.
ANTIMON(lat. Stibium), Sb, kemiskt element i grupp V i Mendeleevs periodiska system; atomnummer 51, atommassa 121,75; Metallen är silvervit med en blåaktig nyans. Två stabila isotoper är kända i naturen: 121Sb (57,25%) och 123Sb (42,75%). Av de artificiellt erhållna radioaktiva isotoperna är den viktigaste 122Sb ( T 1/2 - 2,8 cym), 124Sb ( T 1/2 - 60,2 cym) och 125Sb ( T 1/2 - 2 år).
Historisk referens. Antimon har varit känt sedan urminnes tider. I länderna i öst användes den ungefär 3000 f.Kr. e. för tillverkning av fartyg. I det antika Egypten redan på 1800-talet. före Kristus e. Antimonglitterpulver (naturligt Sb2S3) kallat mesten eller stam användes för att svärta ögonbrynen. I det antika Grekland var det känt som stími och stíbi, därav det latinska stibium. Omkring 12-14 århundraden. n. e. namnet antimonium dök upp. 1789 inkluderade A. Lavoisier antimon i listan över kemiska grundämnen som kallas antimon (modern engelsk antimon, spansk och italiensk antimon, tyska Antimon). Rysk "antimon" kommer från den turkiska sürme; det betecknade blyglitterpulvret PbS, som också användes för att svärta ögonbryn (enligt andra källor, "antimon" - från den persiska surme - metall). En detaljerad beskrivning av egenskaperna och metoderna för att framställa antimon och dess föreningar gavs först av alkemisten Vasily Valentin (Tyskland) 1604. Distribution i naturen. Genomsnittlig antimonhalt i jordskorpan (clarke) 5 ×10-5
% efter vikt. Antimon sprids i magma och biosfären. Från heta underjordiska vatten är det koncentrerat i hydrotermiska avlagringar. Antimonavlagringar i sig är kända, liksom antimon-kvicksilver, antimon-bly, guld-antimon och antimon-volframavlagringar. Av de 27 antimonmineralerna är stibnit (Sb2S3) av stor industriell betydelse. . På grund av sin affinitet med svavel finns antimon ofta som en förorening i sulfider av arsenik, vismut, nickel, bly, kvicksilver, silver och andra grundämnen. Fysiska och kemiska egenskaper. Antimon är känd i kristallin och tre
amorfa former (explosiva, svarta och gula). Explosiv antimon (densitet 5,64-5,97 g/cm 3) exploderar vid varje kontakt: bildas under elektrolys av en lösning
SbCl3; svart (densitet 5,3 g/cm 3) - med snabb kylning av antimonånga; gul - när syre leds in i flytande SbH3. Gul och svart antimon är instabila vid låga temperaturer förvandlas de till vanlig antimon. Den mest stabila kristallina antimonen , kristalliseras i trigonalsystemet, A - 4,5064; densitet 6,61-6,73 g/cm 3 (vätska - 6,55 g/cm 3); t smp 630,5°C; t kip 1635-1645°C; specifik värmekapacitet vid 20-100 °C 0,210 kJ/(kg × TILL ) ; värmeledningsförmåga vid 20 °C 17,6 W/M× K. Temperaturkoefficient för linjär expansion för polykristallin C. 11,5 × 10-6 vid 0-100 °C; för enkristall a1 - 8,1×10-a2 - 19,5×10-6 vid 0-400 °C, elektrisk resistivitet (20 °C) (43,045×10-6 ohm× centimeter). Antimon är diamagnetisk, specifik magnetisk känslighet är -0,66 × 10-6. Till skillnad från de flesta metaller är antimon skör, spricker lätt längs klyvningsplanen, mals till pulver och kan inte smidas (ibland klassas den som en halvmetall) . Mekaniska egenskaper beror på metallens renhet. Brinell hårdhet för gjuten metall 325-340 Mn/m 2 (32,5-34,0 kgf/mm 2); elasticitetsmodul 285-300; draghållfasthet 86,0 Mn/m 2 (8,6 kgf/mm 2). Konfiguration av de yttre elektronerna i Sb5s25r3-atomen. I föreningar uppvisar den oxidationstillstånd huvudsakligen +5, +3 och -3. Kemiskt sett är antimon inaktivt. Oxiderar inte i luft förrän
smält temperatur. Antimon reagerar inte med kväve och väte. Kol löses något i smält antimon. Metallen interagerar aktivt med klor och andra halogener och bildar antimonhalider. Reagerar med syre vid temperaturer över 630 °C och bildar Sb2O3 . När de smälts med svavel erhålls antimonsulfider, och det interagerar också med fosfor och arsenik. Antimon är resistent mot vatten och utspädda syror. Koncentrerade salt- och svavelsyror löser långsamt antimon för att bilda SbCl3-klorid och Sb2(SO4)3-sulfat; koncentrerad salpetersyra oxiderar antimon till en högre oxid, som bildas i form av en hydratiserad förening xSb2O5 ×yH2O. Av praktiskt intresse är svårlösliga salter av antimonsyra - antimonater (MeSbO3 × 3H2O, där Me är Na, K) och salter av icke-isolerad metaantimonsyra - metaantimoniter (MeSbO2 × 3H2O), som har reducerande egenskaper. S. förenar sig med metaller för att bilda antimonider. Mottagande. Antimon erhålls med pyrometallurgiska och hydrometallurgiska metoder
bearbetning av koncentrat eller malm innehållande 20-60 % Sb. Pyrometallurgiska metoder inkluderar utfällning och reduktionssmältning. Råvarorna för fällningssmältning är sulfidkoncentrat; processen är baserad på att antimon förskjuts från dess sulfid med järn: Sb2S3 + 3Fe Û 2Sb + 3FeS. Järn införs i laddningen i form av skrot. Smältning utförs i efterklangsugnar eller kortroterande trumugnar vid 1300-1400 °C. Återvinningen av antimon till grov metall är mer än 90 %. Reduktiv smältning av antimon bygger på reduktion av dess oxider till metall med träkol eller koldamm och slaggbildning av gråberg. Reduktionssmältning föregås av oxidativ rostning vid 550 °C med överskott av luft. Cindern innehåller icke-flyktig antimontetroxid. Elektriska ugnar kan användas för både utfällning och reduktion av smältor. Den hydrometallurgiska metoden för att framställa antimon består av två steg: bearbetning av råmaterialet med en alkalisk sulfidlösning, överföring av antimon till lösning i form av salter av antimonsyror och sulfosalter, och separering av antimon. elektrolys. Grov antimon, beroende på sammansättningen av råmaterialet och metoden för dess tillverkning, innehåller från 1,5 till 15% föroreningar: Fe, As, S, etc. För att erhålla ren antimon används pyrometallurgisk eller elektrolytisk raffinering. Under pyrometallurgisk raffinering avlägsnas järn- och kopparföroreningar i form av svavelföreningar genom att antimonit (crudum) - Sb2S3 - införs i antimonsmältan, varefter arsenik (i form av natriumarsenat) och svavel avlägsnas genom att blåsa luft under sodaslagg. Under elektrolytisk raffinering med en löslig anod renas grov antimon från järn, koppar och andra metaller som finns kvar i
elektrolyt (Cu, Ag, Au finns kvar i slammet). Elektrolyten är en lösning bestående av SbF3, H2SO4 och HF. Innehållet av föroreningar i raffinerad antimon överstiger inte 0,5-0,8%. För att erhålla högren antimon används zonsmältning i en atmosfär av inert gas eller antimon erhålls från förrenade föreningar - trioxid eller triklorid. Ansökan. Antimon används främst i form av bly och tennlegeringar
för batteriplattor, kabelmantel, lager (babbitt) , legeringar som används vid tryckning (hart) , etc. Sådana legeringar har ökad hårdhet, slitstyrka och korrosionsbeständighet. I lysrör aktiveras Sb med kalciumhalofosfat. Antimon ingår i halvledarmaterial som dopningsmedel till germanium och kisel, samt i antimonider (till exempel InSb). Den radioaktiva isotopen 12Sb används i källor för g-strålning och neutroner. Antimon i kroppen. Antimoninnehåll (per 100 G torrsubstans) finns i
växter 0,006 mg, hos marina djur 0,02 mg, hos landlevande djur 0,0006 mg. Antimon kommer in i kroppen hos djur och människor genom andningsorganen eller mag-tarmkanalen. Det utsöndras huvudsakligen i avföring och i små mängder i urin. Antimons biologiska roll är okänd. Det är selektivt koncentrerat i sköldkörteln, levern och mjälten. I erytrocyter ackumuleras antimon övervägande i oxidationstillståndet + 3, i blodplasman - i oxidationstillståndet + 5. Högsta tillåtna koncentration C. 10-5 - 10-7 G med 100 G torr trasa. Vid högre koncentrationer inaktiverar detta element ett antal enzymer av lipid-, kolhydrat- och proteinmetabolism (möjligen som ett resultat av blockerande sulfhydrylgrupper) . I medicinsk praxis används antimonpreparat (solyusurmin, etc.) i
främst för behandling av leishmaniasis och vissa helminthiaser (till exempel schistosomiasis). Antimon och dess föreningar är giftiga. Förgiftning är möjlig vid smältning av koncentrat
antimonmalmer och vid framställning av antimonlegeringar. Vid akut förgiftning - irritation av slemhinnorna i de övre luftvägarna, ögonen och huden. Dermatit, konjunktivit etc. kan utvecklas. Behandling: motgift (unitiol), diuretika och diaforetika, etc. Förebyggande: mekanisering av produktionen. processer, effektiv ventilation m.m.
VISMUT(lat. Bismuthum), Bi, kemiskt element i den periodiska gruppen V
Mendeleevs system; atomnummer 83, atommassa 208.980; silvergrå metall med en rosa nyans. Naturlig vismut består av en stabil isotop, 209Bi. V. var känd på 15-1500-talen, men länge ansågs det vara en typ av tenn,
bly eller antimon. Vismut erkändes som en oberoende metall i mitten av 1700-talet. Den franske kemisten A. Lavoisier inkluderade den i listan över enkla kroppar. Ursprunget till namnet "vismut" är inte fastställt. Vismuthalten i jordskorpan är 2·10-5 viktprocent. Vismut förekommer naturligt i
i form av talrika mineraler, av vilka de viktigaste är vismutglans Bi2S3, naturlig vismut Bi, bismit Bi2O3 etc. I större mängder, men i små koncentrationer, finns vismut som en isomorf förorening i bly-zink, koppar, molybden -kobolt- och tenn-volframmalmer . Cirka 90 % av den globala konsumtionen täcks av den tillhörande produktionen av vismut under bearbetningen av polymetalliska malmer. Fysiska och kemiska egenskaper. Vismut har ett romboedriskt galler med
period a- 4,7457 A och vinkel α-57?14 " 13"" . Densitet 9,80 g/cm 3; t pl 271,3°C; t topp 1560°C. Specifik värmekapacitet (20 °C) 123,5 J/kg K (0,0294 kal/g·MED); termisk koefficient
linjär expansion vid rumstemperatur 13,3·10-6; värmeledningsförmåga (20°C) 8,37 W/(m·TO); elektrisk resistivitet (20°C) 106,8 10-8 ohm· m(106,8·10-6 ohm· centimeter). Vismut är den mest diamagnetiska metallen. Den specifika magnetiska känsligheten är -1,35·10-6. Under påverkan av ett magnetiskt fält ökar den elektriska resistansen hos vismut i större utsträckning än hos andra metaller, som används för att mäta induktionen av starka magnetfält. Det termiska neutroninfångningstvärsnittet av vismut är litet (34 10-31 m 2 eller 0,034 barn). Vid rumstemperatur är vismut skör, spjälkas lätt längs klyvningsplanen och mals till pulver i en porslinsmortel. Smide vid en temperatur av 120-150°C; genom varmpressning (vid 240-250°C) kan den användas för att tillverka tråd med en diameter på upp till 0,1 mm, samt plattor med en tjocklek på 0,2-0,3 mm. Brinell hårdhet 93 Mn/m 2 (9,3 kgf/mm 2), enligt Mohs 2.5. Vid smältning minskar V. i volym med 3,27 %. Vismut är stabil i torr luft, men i fuktig luft är dess yta
oxidation. När den värms över 1000°C brinner den med en blåaktig låga och bildar Bi2O3-oxid . I spänningsserien står vismut mellan väte och koppar, därför löses den inte i utspädda svavel- och saltsyror; upplösning i koncentrerad svavelsyra och salpetersyra sker med frigöring av SO2 och motsvarande kväveoxider. Vismut uppvisar valenser av 2, 3 och 5. Vismutföreningar med lägre valens
har en basisk karaktär, högre är sura. Av syreföreningarna i världen är den viktigaste trioxiden Bi2O3, som ändrar sin gula färg till rödbrun vid upphettning. Bi2O3 används för att erhålla vismutsalter. I utspädda lösningar hydrolyserar vismutsalter. BiCl3-klorid hydrolyseras med utfällning av oxiklorid BiOCl, Bi-nitrat (NO3)3 - med utfällning av huvudsaltet BiONO3·BiOOH. Förmågan hos V.-salter att hydrolysera används för dess rening. Föreningar av 5-valent vismut är svåra att erhålla; de är starka oxidationsmedel. KBiO3-saltet (motsvarande anhydriden Bi2O5) bildas i form av en brunröd fällning på en platinaanod under elektrolysen av en kokande lösning av en blandning av KOH, KCl och en Bi2O3-suspension. Vismut kombineras lätt med halogener och svavel. När syror verkar på en legering av vismut och magnesium bildas bismutin (vismutväte) BiH3; Till skillnad från arsin AsH3 är vismutin en instabil förening och har inte erhållits i sin rena form (utan överskott av väte). Med vissa metaller (bly, kadmium, tenn) bildar vismut lågsmältande eutektika; med natrium, kalium, magnesium och kalcium - intermetalliska föreningar med en smältpunkt som är betydligt högre än smältpunkten för de ursprungliga komponenterna. Vismut interagerar inte med smält aluminium, krom och järn. Kvitto och ansökan. Den största mängden vismut produceras som en biprodukt
brandförädling av grovt bly (werkbley). Den pyrometallurgiska metoden bygger på vismuts förmåga att bilda eldfasta intermetalliska föreningar med K, Na, Mg och Ca. De specificerade metallerna tillsätts till smält bly och de resulterande fasta föreningarna med V. (slagg) separeras från smältan. En betydande mängd vismut utvinns från slam från elektrolytisk raffinering av bly i en hydrofluorkisellösning, samt från damm och slam från kopparproduktion. Vismuthaltiga slagg och slam smälts under alkalisk slagg. Den resulterande grova metallen innehåller föroreningar av As, Sb, Cu, Pb, Zn, Se, Te, Ag och några andra grundämnen. Vismutsmältning från egna malmer bedrivs i liten skala. Sulfidmalmer bearbetas genom fällsmältning med järnskrot. Från oxiderade malmer reduceras guld med kol under ett lager av lågsmältande flussmedel. För grov rengöring av grovt vatten används de beroende på sammansättningen av föroreningar.
olika metoder: zeigerisering, oxidativ raffinering under alkaliska flussmedel, fusion med svavel, etc. Den svåraste att separera blyföroreningen avlägsnas (upp till 0,01%) genom att blåsa klor genom den smälta metallen. Kommersiell vismut innehåller
99,9-99,98 % basmetall. V. av hög renhet erhålls genom zonomkristallisation i kvartsbåtar i en atmosfär av inert gas. En betydande mängd vismut används för framställning av lågsmältande legeringar innehållande bly, tenn, kadmium, som används i tandproteser, för tillverkning av klichéer från trämatriser, som insmältningslock i automatiska brandsläckningsanordningar, vid lödning av kapsyler på pansargenomträngande projektiler m.m. Smält vismut kan fungera som kylmedel i kärnreaktorer. Konsumtionen av vismut i föreningar med Te för
termoelektriska generatorer. Dessa föreningar, på grund av den gynnsamma kombinationen av värmeledningsförmåga, elektrisk ledningsförmåga och termoelektromotorisk kraft, gör det möjligt att omvandla termisk energi till elektrisk energi med hög effektivitet (~7%). Tillsatsen av vismut till rostfria stål förbättrar deras bearbetbarhet. Vismutföreningar används i glastillverkning, keramik, läkemedel
industri. Lösliga vismutsalter är giftiga och har liknande effekter som kvicksilver.
Litteratur
1. Skadliga ämnen inom industrin, under allmänt. ed. N.V. Lazareva, 6:e upplagan, del 2, Leningrad, 1971.
2. Ivanov V.V. Ekologisk geokemi av element. 3. Forskning inom området för att skapa en ny teknik för framställning av antimon och dess
föreningar, i samlingen: Chemistry and technology of antimon, Frankrike, 1965. 4. Brief chemical encyclopedia, vol. 5, M., 1967; 5. Nekrasov B.V., Fundamentals of General Chemistry, vol. 1, M., 1965; 6. Pogodin S.A., Arsenik, i boken: Brief chemical encyclopedia, vol 3, M., 1964 7. Remy G., Course of inorganic chemistry, trans. från German, vol 1, M., 1963, sid. 700-712; 8. Thomson J.G., Bismuth, övers. [från engelska], L., 1932; 9. Shiyanov A.G., Antimonproduktion, M., 1961; Fundamentals of metallurgy, vol. 5, M.,
1968; 10. Kemi och teknologi för bundet kväve, [M.-L.], 1934; KHE, vol. 1, M., 1961.
Kväveundergruppen består av fem grundämnen: kväve, fosfor, arsenik, antimon och vismut. Dessa är p-element i grupp V i D.I. Mendeleevs periodiska system.
På den yttre energinivån innehåller atomerna i dessa element fem elektroner, som har ns2np3-konfigurationen och är fördelade enligt följande:

Därför är det högsta oxidationstillståndet för dessa element +5, det lägsta är -3 och +3 är också typiskt.
Närvaron av tre oparade elektroner på den yttre nivån indikerar att i ett oexciterat tillstånd har elementens atomer en valens på 3. Den yttre nivån av kväveatomen består av endast två undernivåer - 2s och 2p. Atomerna i de återstående elementen i denna undergrupp har tomma celler på d-subnivån vid de yttre energinivåerna. Följaktligen kan en av s-elektronerna på den yttre nivån, vid excitation, flytta till d-subnivån på samma nivå, vilket leder till bildandet av 5 oparade elektroner.

yttre elektronskal av fosfor (oexciterad atom)

det yttre elektronskalet av en exciterad fosforatom.
Således har fosfor, arsenik, antimon och vismut i ett exciterat tillstånd 5 oparade elektroner, och deras valens i detta tillstånd är 5.
I en kväveatom är det omöjligt att excitera en elektron på detta sätt på grund av frånvaron av en d-subnivå i den andra nivån. Därför kan kväve inte vara femvärt, men det kan bilda en fjärde kovalent bindning av donator-acceptormekanismen på grund av det ensamma elektronparet 2s2. En annan process är också möjlig för kväveatomen. När en av de två 2s-elektronerna tas bort omvandlas kväve till en enkelladdad fyrvärd jon N+.

Från kväve till vismut ökar atomradierna och joniseringspotentialerna minskar. De reducerande egenskaperna hos neutrala atomer ökar från N till Bi, och de oxiderande egenskaperna försvagas (se tabell 21).
Med väte, kväve, fosfor och arsenik bildar polära föreningar RH3, som uppvisar ett negativt oxidationstillstånd på -3. RH3-molekyler har en pyramidform. I dessa föreningar är bindningarna av element med väte starkare än i motsvarande föreningar av element i syreundergruppen och speciellt halogenundergruppen. Därför bildar väteföreningar av element i kväveundergruppen i vattenlösningar inte vätejoner.

Med syre bildar element i kväveundergruppen oxider med den allmänna formeln R2O3 och R2O5. Oxider motsvarar syrorna HRO2 och HRO3 (och ortosyror H3RO4, utom kväve). Inom undergruppen ändras oxidernas natur enligt följande: N2O3 - sur oxid; Р4О6 - svagt sur oxid; As2O3 är en amfoter oxid med dominerande sura egenskaper; Sb2O3 är en amfoter oxid med övervägande basegenskaper; Bi2O3 är den huvudsakliga oxiden. Således minskar de sura egenskaperna hos oxider med sammansättningen R2O3 och R2O5 med ökande atomnummer hos elementet.
Som framgår av tabellen. 21, inom undergruppen från kväve till vismut minskar de icke-metalliska egenskaperna och de metalliska egenskaperna ökar. I antimon uttrycks dessa egenskaper lika i vismut, metalliska egenskaper dominerar i kväve, icke-metalliska egenskaper dominerar. Fosfor, arsenik och antimon bildar flera allotropa föreningar.
Kväve.
Mottagande
I laboratorier kan det erhållas genom nedbrytningsreaktionen av ammoniumnitrit:
Reaktionen är exoterm och frigör 80 kcal (335 kJ), så kärlet måste kylas medan det sker (även om ammoniumnitrit måste värmas för att starta reaktionen).
I praktiken utförs denna reaktion genom att droppvis tillsätta en mättad lösning av natriumnitrit till en uppvärmd mättad lösning av ammoniumsulfat, och ammoniumnitriten som bildas som ett resultat av utbytesreaktionen sönderdelas omedelbart.
Gasen som frigörs i detta fall är förorenad med ammoniak, kväveoxid (I) och syre, från vilken den renas genom att successivt passera genom lösningar av svavelsyra, järn(II)sulfat och över varm koppar. Kvävet torkas sedan.
En annan laboratoriemetod för att producera kväve är att värma en blandning av kaliumdikromat och ammoniumsulfat (i viktförhållandet 2:1). Reaktionen fortskrider enligt ekvationerna:
Det renaste kvävet kan erhållas genom nedbrytning av metallazider:
Det så kallade "luft" eller "atmosfäriska" kvävet, det vill säga en blandning av kväve med ädelgaser, erhålls genom att reagera luft med varm koks, som producerar den så kallade "generator" eller "luft" gas - råmaterial för kemisk syntes och bränsle . Vid behov kan kväve separeras från det genom att absorbera kolmonoxid.
Molekylärt kväve framställs industriellt genom fraktionerad destillation av flytande luft. Denna metod kan också användas för att erhålla "atmosfäriskt kväve". Kväveanläggningar och stationer som använder adsorptions- och membrangasseparationsmetoden används också i stor utsträckning.
En av laboratoriemetoderna är att föra ammoniak över koppar(II)oxid vid en temperatur på ~700 °C:
Ammoniak tas från dess mättade lösning genom uppvärmning. Mängden CuO är 2 gånger större än beräknat. Omedelbart före användning renas kväve från syre och ammoniak genom att passera över koppar och dess oxid (II) (även ~700 °C), sedan torkas med koncentrerad svavelsyra och torr alkali. Processen är ganska långsam, men det är värt det: gasen som erhålls är mycket ren.
I fig. Figur 15.12 visar placeringen av de fem grupp V-elementen i det periodiska systemet. Alla av dem är p-element, och det yttre skalet av deras atomer kännetecknas av en elektronkonfiguration. I tabell 15.10 vissa egenskaper hos element i grupp V anges. När du går till botten av denna grupp ändras egenskaperna hos dess element från icke-metalliska till metalliska. Kväve och fosfor är typiska icke-metaller. Arsenik och antimon visar tecken på metallisk karaktär, och vismut är en metall.
KVÄVE OCH FOSFOR
Dessa är de två viktigaste delarna i grupp V.
Under normala förhållanden är kväve en gas som består av diatomisk

Ris. 15.12. Placering av element i grupp V i det periodiska systemet.
Tabell 15.10. Egenskaper för grupp V-element

molekyler Den är färglös, luktfri och smaklös och har ingen märkbar reaktivitet.
Fosfor finns i tre allotropa former, varav de två vanligaste är röd fosfor och den mindre stabila vita fosforn. Strukturen av dessa allotroper diskuterades i Sect. 3.2. I tabell 15.11 jämförs några egenskaper hos röd och vit fosfor.
Även om kväve är ett av de mest elektronegativa grundämnena (se tabell 2.2), har det en relativt låg reaktivitet. Anledningen är att dess diatomiska molekyler är opolära, och trippelbindningen mellan två atomer
Tabell 15.11. Egenskaper av vit och röd fosfor


Ris. 15.13. Fyra-hybrid orbitaler av kväveatomen.
Kvävet i dem har mycket hög hållfasthet. Entalpin för denna bindning är + 944 kJ/mol.
Både kväve och fosfor kan komma in i sina föreningar med oxidationstillstånd från -3 till 4-5. Till exempel, i ammoniak har kväve ett oxidationstillstånd på +3, och i nitratjonen är dess oxidationstillstånd -1-5.
Atomer av båda dessa grundämnen är kapabla att fästa tre elektroner, vilket leder till att fylla deras yttre underskal; som ett resultat bildas nitridjoner och fosfidjoner. Båda grundämnena tenderar dock att bilda kovalenta föreningar. I detta fall bildar deras atomer fyra hybridorbitaler, som var och en har en tetraedrisk orientering (Fig. 15.13). Tre av dessa orbitaler innehåller en elektron. Det är dessa elektroner som delas under bildandet av kovalenta bindningar med elektroner från andra atomer. Den fjärde orbitalen innehåller ett ensamt elektronpar. Den kan användas för att bilda en koordinationsbindning (donator-acceptor). Till exempel, i ammoniumjonen, överlappar det ensamma paret av kväve med vätejonens lediga orbital.
ns 2 np 3.
KVÄVE och dess föreningar
I naturen finns det i fri form (innehåll i luften - 78 volym-%), i form av mineraler (saltpeter), i olja, i växt- och djurproteiner.
Fysikaliska egenskaper
Under normala förhållanden är N2 en färglös, luktfri och smaklös gas.
t o kip. = -195,8 oC.
Kväveproduktion:
a) inom industrin - flytande luft,
b) i laboratoriet: NH 4 NO 2 ® N 2 + H 2 O.
Kemiska egenskaper hos kväve och dess föreningar.
Den kemiska aktiviteten av molekylärt kväve är mycket låg, eftersom tack vare den trippelkovalenta bindningen är molekylen mycket stark (E-bindning = 946 kJ/mol). Men många olika föreningar är kända för kväve, där det uppvisar oxidationstillstånd -3, -2, -1, +1, +2, +3, +4, +5.
Kväveföreningar med negativa oxidationstillstånd.
3
1)NH 3 – ammoniak– en färglös gas med en stickande lukt, lätt flytande.
Ammoniakproduktion:
a) N2 + 3H2 «2NH3 (Kat: Fe, Al2O3, K2O)
b) 2NH4CI + Ca(OH)2 = CaCl2 + 2NH3 + 2H2O
Kemiska egenskaper hos ammoniak:
a) NH3 + H2O «NH4OH (maximal koncentration = 25%)
b) NH3 + HCI «NH4CI (don.-tillämpningsmekanism: NH3 + H+ = NH4+)
c) förbränning sker olika beroende på mängden syre:
4NH3 + 3O2 (vecka) = 2N2 + 6H2O
4NH3 + 502(g) = 2NO+ 6H2O
d) i OVR är ammoniak alltid ett reduktionsmedel:
3CuO + 2NH3 = 3Cu + N2 + 3H2O
2) NH 4 OH – ammoniumhydroxid- svag bas, instabil, bildar komplexa föreningar (ammoniak) väl:
Cu(OH)2 + 4NH4OH = (OH)2 + 4H2O
3) Ammoniumsalter:
a) lösningar på grund av hydrolys har en svagt sur reaktion:
NH 4 CI + HON « NH 4 OH + HCI (NH 4 + + HON « NH 4 OH + H +)
b) den termiska nedbrytningen av ammoniumsalter fortskrider olika beroende på anjonens natur: om anjonen är ett oxidationsmedel är nedbrytningsreaktionen irreversibel:
NH4CI «NH3 + HCl
NH4NO3 = N2O+ 2H2O
4) Amider bildas när H-atomer i ammoniak ersätts med metall:
2K + 2NH3 = 2KNH2 + H2
5) Nitrider kända för metaller och icke-metaller och, beroende på deras natur, sönderdelas olika:
a)Li3N + 3H2O = 3LiOH + NH3
Ca3N2 + 6HCl = 3CaCl2 + 2NH3
b) Cl3N + 6HCl = 3HCIO + NH3
Oxidationstillstånd - 2
N 2 H 4 – hydrazin(diamid) är en färglös vätska, ett bra lösningsmedel, mindre stabil än ammoniak.
Beredning av hydrazin:
2NH3 + NaCIO = N2H4 + NaCl + H2O
Hydrazins kemiska egenskaper:
N2H4 + H2O « + +OH -
H 2 O « 2+ + OH -
b) Bränner till kväve: N 2 H 4 + O 2 = N 2 + 2H 2 O
c) Starkt reduktionsmedel: N 2 H 4 + 2H 2 O 2 = N 2 + 4H 2 O
Oxidationstillstånd - 1
NH 2 OH – hydroxylamin, en vit kristallin substans, intar en mellanposition mellan H 2 O 2 och hydrazin N 2 H 4.
Beredning av hydroxylamin:
HNO3 + 6H = NH2OH + 2H2O
Kemiska egenskaper hos hydroxylamin:
a) Vattenlösningar – svaga baser:
NH2OH + H2O « + +OH -
b) Hydroxylammoniumsalter (stabila) ges med syror:
NH2OH + HCI = + + Cl -
c) Nedbryts (disproportioneringsreaktion):
3NH2OH = NH3 + N2 + 3H2O
d) Liksom H 2 O 2, beroende på miljön uppvisar den redoxdualitet:
ok: 2NH 2 OH + 4FeSO 4 + 3H 2 SO 4 = 2Fe 2 (SO 4) 3 + (NH 4) 2 SO 4 + 2H 2 O
återställd: 2NH2OH + I2 + 2KOH = N2 + 2KI + 4H2O
De viktigaste kväveföreningarna med positiva s. O.
Oxidationstillstånd + 3
1) N2O3- kväveoxid (III) eller "dikväveanhydrid" är en instabil blågrön vätska:
a) N2O3® NO2 (brun gas med en stickande lukt) + NO (färglös gas);
b) bildar en instabil syra med vatten: N 2 O 3 + H 2 O « 2 HNO 2
2) HNO2– salpetersyrlighet (medelstark):
HNO2 «H+ + NO2- (K = 5,1 . 10 -4).
3) Nitriter– salter av salpetersyrlighet, liksom andra N+3-föreningar i redoxreaktioner, uppvisar dualitet:
ok: KNO2 + NH3 = N2 + H2O
återställd: KNO 2 + H 2 O 2 = KNO 3 + H 2 O
Maximalt oxidationstillstånd + 5
1) N2O5- kväveoxid (V) eller "kvävesyraanhydrid" är ett färglöst kristallint ämne; När det löses i vatten ger det syra.
2) HNO3– salpetersyra, stark: HNO 3 ® H + + NO 3 - .
3) Nitrater– salpetersyrasalter:
a) i laboratoriet kan du få N 2 O genom den termiska nedbrytningsreaktionen: NH 4 NO 3 ® N 2 O + H 2 O;
b) metallnitrater, beroende på metallens position i aktivitetsserien, sönderdelas olika:
till vänster Mg: nitrat ® nitrit + O 2
Mg – Cu: nitrat ® metalloxid + NO 2 + O 2
till höger Cu: nitrat ® metall + NO 2 + O 2 .
4) alla N+5-föreningar är starka oxidationsmedel; interaktion av salpetersyra med metaller:
a) ingen metall frigör väte från HNO3;
b) vid normal t o är metallerna Al, Zn, Cr, Fe, Pb, Au, Pt passiverade;
c) när den upphettas interagerar den med de flesta metaller, och ju aktivare metallen är och ju mer utspädd syran är, desto starkare reduktion av N +5:
inaktiv Meh: Cu + 4HNO3 (konc.) = Cu (NO3)2 + 2N02 + 2H2O
3Cu + 8HNO3(utspädd) = 3Cu(NO3)2 + 2NO + 4H2O
tillgångar. Meh: 4Ca + 10HNO3(konc.) = 4Ca(NO3)2 + N2O + 5H2O
5Ca + 12HNO3(utspädd) = 5Ca(NO3)2 + N2 + 6H2O
4Ca + 9HNO3 (ultra dil.) = 4Ca(NO3)2 + NH3 (eller NH4NO3) + 3H2O
FOSFOR och dess föreningar
Det finns i naturen: a) i form av mineraler (fosforiter och apatiter), b) i växt- och djurproteiner, c) i hjärnvävnad och ben.
Fysikaliska egenskaper
Allotropen:
A) vit fosfor(P 4) – tetraedrisk struktur, giftig, lyser i mörker, löslig i koldisulfid; under lagring förvandlas det gradvis till röd fosfor, så det lagras under vatten;
b) röd fosfor(P 2 n – polymer) – det finns flera former av struktur, ogiftig, olöslig i koldisulfid, stabil under lagring, mindre reaktiv;
V) svart fosfor– pyramidformad struktur, skiktad, liknande grafit, halvledare.
Få fosfor:
Fosforitmineralet bränns med koks och sand:
Ca3 (PO 4) + 5C + 3 SiO2 = 3CaSiO3 +2P +5CO
Kemiska egenskaper hos fosfor och dess föreningar.
Den kemiska aktiviteten hos fosfor varierar beroende på dess allotropa modifiering. Huvudoxidationstillstånd: -3, +1, +3, +5.
1) Reaktioner av fosfor med enkla ämnen:
återställande egenskaper: a)P + O2® P2O3, P2O5;
b) P + CI2® PCI3, PCI 5; c) 2P + 3S® P2S 3
oxiderande egenskaper: a) 2P + 3H 2 ® 2РН 3, b) 2P + 3Ca ® Ca 3 P 2
2) Reaktioner av fosfor med komplexa ämnen:
a) reaktionen med vatten sker inte,
b) 2P + 5H2SO4 (konc.)® 2H3PO4 + 5SO2 + 2H2O,
c) P + HNO3 (konc.)® H3PO4 + NO (eller NO2).
3)Minsta oxidationstillstånd - 3
A) PH 3– fosfin, en giftig gas med en vitlökslukt,
tänd: 2РH 3 + 4О 2 = Р 2 О 5 + 3H 2 O,
med vissa syror ger det fosfoniumsalter: РH 3 + HI = РH 4 I
b) metallfosfider– jonokovalenta föreningar
Mg 3 P 2 + 6 H 2 O = Mg(OH) 2 + 2RН 3,
Ca3P2 + 6HCI = CaCl2 + 2PH3.
4)Oxidationstillstånd + 1
H 3 PO 2 eller H [PO 2 H 2 ] – hypofosforsyra, stark; salter är hypofosfiter, mycket lösliga, bra reduktionsmedel.
5)Oxidationstillstånd + 3
a) P 2 O 3 – fosforanhydrid, har flera modifikationer (P 2 O 3) n, färglösa giftiga kristaller;
b) H 3 PO 3 eller H 2 [PO 3 H] – fosforsyra, medelstark;
c) fosfitsalter, endast lösliga i alkalimetaller (K 2 [PO 3 H]),
PCI 3 + CI 2 = PCI 5,
PCI 3 + O 2 = PCI 3,
PCI 3 + HCI ® N.
6)Maximalt oxidationstillstånd +5
a) P 2 O 5 – fosforanhydrid, vitt pulver, har en modifikation (P 2 O 5) 2, ett starkt vattenavlägsnande medel: P 2 O 5 + 2H 2 O = 2HPO 3;
b) HPO3-meta, H4P2O7-pyro, H3PO4-ortofosforsyra, medelstyrka;
c) meta-, pyro-, orto-fosfatsalter;
d) halogenider är ganska aktiva:
PCI 5 + 4H 2 O = H 3 PO 4 + 5 HCI,
RF 5 + HF = N.
ALLMÄNNA KARAKTERISTIKA FÖR UNDERGRUPPEN
7 N, 15 P, 33 As, 51 Sb, 83 Bi. I undergruppen från topp till botten ökar naturligt metalliska egenskaper och detta överensstämmer med värdena för oxidationstillstånden som uppvisas av elementen i föreningarna, såväl som med vissa fysikaliska egenskaper. Även om allotropin för P, As och Sb skapar vissa svårigheter när man kombinerar fysiska egenskaper till en enda tabell:
Tabell 11
Egenskaper för element i den femte gruppen, huvudundergruppen
Kemiska egenskaper
1. Med enkla ämnen ger de en mängd olika föreningar som uppvisar olika redoxnaturer:
a) restaurerande egenskaper
2P + 3CI2 = 2PCl3 (eller PCl5);
4As + 502 = 2As2O5;
2Bi + 3Cl2 = 2BiCl3.
b) Oxiderande egenskaper
2P + 3Ca = Ca3P2;
2As + 3Mg = Mg 3 As 2.
2. De reagerar med syror olika beroende på arten av elementet i undergruppen:
2P + 5H2SO4 = 2H3PO4 + 5S02 + 2H2O;
3As + 5HNO3 + 2H2O = 3H3AsO4 + 5NO;
3Sb + 5HNO3 = 3HSbO3 + 5NO + H2O;
2Sb + 6H2SO4 konc. = Sb2 (SO4)3 + 3S02 + 6H2O;
Bi + 4HNO3 = Bi(NO3)3 + NO + 2H2O.
Man måste komma ihåg att elementen i arsenikundergruppen uppträder efter väte i aktivitetsserien.
3. Hydrolys av föreningar sker på olika sätt:
a) PCl3 + 3H2O = H3PO3 + 3HCl;
BiCl3 + H2O® BiOCl® + 2HCl.
(SbCl3) (SbOCl)
b) NaNO2 + H2O Û HNO2 + NaOH;
K3PO4 + H2O Û K2HPO4 + KOH;
K 3 AsO 4 + H 2 O Û K 2 HAsO 4 + KOH.
4. Förändringar i syra-basegenskaper hos grundämnen visar sig på olika sätt
Tabell 12
De viktigaste föreningarna av element i den femte undergruppen
5. Redoxförmågan hos föreningar beror på graden av oxidation av elementet:
A) E -3– reduktionsmedel
2NH3 + 6KМnO4 + 6KOH = 6K2MnO4 + N2 + 6H2O;
2PH3 + 4O2 = P2O5 + 3H2O.
oxidationsmedel:
2KNO2 + 4H2S = 3S + N2 + K2S + 4H2O
E +3 2BiCl3 + 3SnCl2 + 18KOH = 2Bi + 3K2SnO3 + 12KCl + 9H2O.
reduktionsmedel:
10KNO2 +4KМnO4 +11H2SO4 =10HNO3 +4MnSO4 +7K2SO4 +6H2O
V) E +5 – oxidationsmedel
Na3SbO4 + 2NaJ + H2SO4 = Na3SbO3 + J2 + Na2SO4 + H2O.
Delar av grupp 6. (Kalkogener)
Strukturen för det elektroniska skalet: ... ns 2 np 4.
8O, 16S, 34Se, 52Te, 84Po (radioaktivt).
SYRE och dess föreningar
Det vanligaste grundämnet på jorden: 21 % (i volym) i luften, är en del av H 2 O, mineraler och organiska ämnen.
Fysikaliska egenskaper
Finns i form av ämnen:
a) "syre" O 2 - en gas utan färg, smak, lukt, ogiftig; t° koka. = -183°C; ;
b) "ozon" O 3 - en blå gas med en stickande lukt, giftig, ett mycket starkt oxidationsmedel; t° koka. = -111,8°C.
Kemiska egenskaper
1. I endast en reaktion är syre ett reduktionsmedel:
О 2 + 2F 2 = 2OF 2 ().
2. I alla andra fall är syre ett oxidationsmedel, särskilt om det är i atomärt tillstånd:
a) Oxidation av enkla ämnen
2H2 + O2 = 2H2O;
S + O2 = SO2;
2Ca + O2 = 2CaO.
b) Oxidation av komplexa ämnen
R2O3 + O2 = R2O5;
2S02 + O2 = 2S03;
2PCl3 + O2 = 2POCl3.
c) Förbränning av komplexa oorganiska ämnen
2H2S + O2 otillräcklig = 2S + 2H2O;
2H2S + 3O2 g. = 2S02 + 2H2O.
d) Förbränning av organiska ämnen
CH4 + 2O2 = CO2 + 2H2O;
C2H5OH + 3O2 = 2CO2 + 3H2O.
SVAVEL och dess föreningar
Finns i naturen i sin ursprungliga form; i form av mineraler (sulfider, sulfater); i olja; i proteiner.
Fysikaliska egenskaper
Hård, spröd, gul, olöslig i H 2 O, men löslig i koldisulfid och anilin. Allotropisk: rombiskt svavel (a-form); monoklinisk (b - svavel); plast, etc. Den mest stabila modifieringen är en (t° pl. » 113°C), kompositionen S 8 tillskrivs den.
Kemiska egenskaper
Föreningar, som uppvisar olika grader av oxidation, har olika redoxförmåga.
Tabell 13
De viktigaste svavelföreningarna
1. Svavel, som interagerar med komplexa föreningar, ändrar sitt oxidationstillstånd på olika sätt:
a) S + 2H2S04 konc. = 3S02 + 2H2O ();
b) S + 6HNO3 konc. = H2SO4 + 6NO2 + 2H2O ();
c) 3S + 6NaOH = 2Na2S + Na2S03 + 3H2O
oproportionerlig reaktion
2. S-2 anslutningar
A) H2S– vätesulfid, giftig gas med lukt av ruttna ägg, starkt reduktionsmedel: 2H 2 S + O 2 = 2S + 2H 2 O;
H2S + Cl2 = 2HCl + S.
b) H 2 S-lösning – svag syra
H2S ÛN+ + HS- (Ki = 6 x 10-8).
c) Salter – sulfider; salter av alkali- och jordalkalimetaller är mycket lösliga och hydrolyserar; sulfider av p- och d-metaller är praktiskt taget olösliga.
G) Sulfider metallutställning huvud natur:
K2S + H2O Û KHS + KOH;
Icke-metallsulfider uppvisar surt natur:
SiS2 + 3H2O = H2SiO3 + 2H2S.
d) Tiosoler: liknande vanliga salter där O-atomerna är ersatta av S:
Na2S + CS2 = Na2CS3 – natriumtiokarbonat;
Na2CS3 + 2HCl = 2NaCl + H2CS3
instabil
e) Polysulfider: svavel, liksom syre i peroxider, kan bilda salter: Na 2 S lösning + ´S = Na 2 S n - natriumpolysulfid (innehåller sulfidbryggor - S - S - S - S -).
3. S+4-anslutningar
a) SO 2 – svaveldioxid med skarp lukt, giftig;
b) SO 2 lösning - svavelsyra H 2 SO 3, medelstark
H2SO3 Û H+ + HSO3- (Ki = 1,3 x 10-2);
c) Salter – sulfiter, hydrolysera väl
Na2SO3 + H2O Û NaHSO3 + NaOH.
d) I redoxreaktioner uppvisar alla dessa föreningar dualitet:
SO2 + 2H2S = 3S + 2H2O;
2SO2 + O2 = 2SO3.
e) tionylklorid: SOCl2
SOCI2 + 2H2O = H2SO3 + 2HCl.
4. S+6 anslutningar
A) SÅ 3– svavelsyraanhydrid; allotropt, starkt oxidationsmedel. Reagerar mycket kraftigt med vatten
SO3 + H2O® H2SO4 + 89,1 kJ/mol;
b) H2SO4– svavelsyra, färglös oljig vätska; stark.
H2SO4 konc. – mycket starkt oxidationsmedel; röding papper, socker, trä:
C + 2H2S04 konc. = CO2 + 2SO2 + 2H2O.
Individuellt, dess beteende med metaller:
vid vanliga temperaturer interagerar det inte med många metaller ("passiverar" Cr, Fe, Al, Zn, ...);
vid förhöjda nivåer reagerar den med nästan alla metaller utom Au och Pt.
Det är ett mycket bra vattenavlägsnande medel eftersom... med vatten bildar hydrater H 2 SO 4 × nH 2 O:
V) Salter: medium – K 2 SO 4 (sulfater);
surt – KHSO 4 (vätesulfater);
vitriol – CuSO 4 × 5H 2 O; ZnSO4 x 7H2O;
alun – dubbla salter, kristallina hydrater
KAl(SO4)2 x 12H2O; NH4Fe(SO4)2 × 12H2O.
G) Oleum– en lösning av SO 3 i H 2 SO 4, medan reaktionen sker delvis
2SO3 + H2O = H2S2O7 pyrosvavelsyra.
d) Sulfurylklorid SO2CI2
SO2CI2 + 2H2O = H2SO4 + 2HCl.
e) Peroxosvavelsyror– innehåller peroxidbryggor
H 2 SO 5 – peroxomonosvavel,
H 2 S 2 O 8 - peroxodisulfur;
starka oxidationsmedel.
och) Tiosulfater– innehåller svavel i olika oxidationstillstånd: S +6 och S -2; på grund av närvaron av S-2 är föreningarna starka reduktionsmedel.
Na2S2O3 + Br2 + H2O = 2HBr + S + Na2SO4.
Motsvarande syra H 2 S 2 O 3 (tiosvavelsyra) är instabil:
Na 2 S 2 O 3 + H 2 SO 4 = Na 2 SO 4 + H 2 S 2 O 3.
Element i grupp 7a. (Halogener )
Strukturen för det elektroniska skalet: ... ns 2 np 5.
9 F, 17 Cl, 35 Br, 53 J, 85 At (radioaktiv). I ett fritt tillstånd existerar de i form av diatomiska molekyler.
Fysikaliska egenskaper
Giftig, med en stickande lukt F 2 – blekgul gas, kokpunkt. = -188,2°C;
Cl 2 – grön-gul gas; t° koka. = -34,1°C;
Br 2 - röd vätska; t° koka. = 59,2°C;
J 2 - violetta kristaller; t° koka. = +185,5°C.
Kemiska egenskaper
1) Den mest aktiva är F 2, även glas och vatten brinner i dess atmosfär:
2F2 + Si02 = SiF4 + O2;
2F2 + 2H2O = 4HF + O2.
2) Uppströms halogener (som starkare oxidationsmedel) förskjuter nedströms från olika föreningar:
F2 + 2KCl (KBr, KJ) = 2KF + Cl2 (Br2, J2).
3) När halogener löses i vatten och alkalilösningar uppstår disproportioneringsreaktioner; Beroende på temperaturen erhålls olika reaktionsprodukter:
Cl2 + H2O = HCl + HClO;
Cl2 + 2NaOH = NaCl + NaClO;
4) Vätehalogenider– de är alla färglösa gaser (HF bildar på grund av vätebindningar associerade H x F x).
I serierna: HF – HCl – HBr – HJ minskar bindningsstyrkan och de reducerande egenskaperna ökar:
MnO2 + 4HCl = Cl2 + MnCl2 + 2H2O ().
5) Vid upplösning i vatten erhålls starka syror; HJ är den starkaste (med undantag för svag fluorvätesyra:
H 2 F 2 Û H + + HF 2 -)
6) Halider element har olika syra-baskaraktär, vilket visar sig:
a) i hydrolysreaktioner
AlCl3 + H2O Û AlOHCl2 + HCl;
PBr3 + 3H2O = H3PO3 + 3HBr.
b) vid komplexbildningsreaktioner
2NaF + SiF4® Na2;
för ett antal ligander F-; Cl-; Br-; J - stabiliteten hos komplexen minskar.
7) Halogener i högre oxidationstillstånd
a) oxider: Cl2O; (ClO2) 2; (ClO3) 2; Cl2O7;
b) syror: HClO; HCl02; HClO3; HClO4;
för ett antal syror ® ökar styrkan, för syror och deras salter i samma serie minskar de oxiderande egenskaperna.
c) syror och deras salter sönderdelas vid upphettning:
d) föreningar mellan halogener: många av dem är kända; Sammansättningen motsvarar elementens position i det periodiska systemet (fler elektronegativa element visas i slutet av formlerna):
ClF, BrF, JF; ClF3, JF3; ClF5, ClOF3; BrF 7, JO3F, etc.;
är sura till sin natur: JF7 + 4H2O = 7HF + HJO4;
ClO3F + 2NaOH = NaClO4 + NaF + H2O.
Frågor för att konsolidera materialet:
1. Vilket ämne bildas när arsenik reagerar med koncentrerad salpetersyra - a)Аs(NO3)3? b)H3AsO4? c) Som 2O3?
2.Vilket ämne reagerar med koncentrerad syra för att frigöra fritt klor – a)CaC1 2? b)MnO2? c) CrC13?