Vad är trombocytaggregationshämning? Läkemedel som påverkar blodplättshemostasen Trombocytaggregationen hämmas av en ca2-blockerare
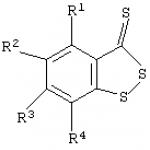
Uppfinningen hänför sig till fysiologi, farmakologi och medicinsk kemi, i synnerhet till en förbättrad metod för att hämma trombocytaggregation. Detta mål uppnås genom den beskrivna förbättrade metoden för att hämma trombocytaggregation med användning av svavelhaltiga heterocykliska föreningar, vilken består i att använda känd benso-1,2-ditiol-3-tion (BDTT) eller dess derivat med den allmänna formeln som svavelhaltig heterocykliska föreningar
 där R1-R4=H eller Ci-4-alkyl. Tekniskt resultat: gör det möjligt att mer effektivt hämma trombocytaggregation in vitro. Uppfinningen hänför sig till fysiologi, farmakologi och medicinsk kemi, i synnerhet till en förbättrad metod för att hämma trombocytaggregation nyckelroll i patogenesen många kardiovaskulära sjukdomar (t.ex. arteriell trombos, hjärtinfarkt, instabil angina). Föreningar som kan förhindra blodplättsaktivering, som kan orsakas av endogena inducerare (till exempel adenosin-5'-difosfat/ADP), används för närvarande i stor utsträckning för att effektivt påverka patologiska förändringar i det hemostatiska systemet (B.A. Sidorenko, D. .V. Preobrazhensky Klinisk användning av antitrombotiska läkemedel - M., 1998. Olika metoder för att hämma blodplättsaggregation med användning av svavelinnehållande bicykliska föreningar trombocytaggregation ,5,6,7-tetrahydrotienopyridin (tiklopidin) med formel I
där R1-R4=H eller Ci-4-alkyl. Tekniskt resultat: gör det möjligt att mer effektivt hämma trombocytaggregation in vitro. Uppfinningen hänför sig till fysiologi, farmakologi och medicinsk kemi, i synnerhet till en förbättrad metod för att hämma trombocytaggregation nyckelroll i patogenesen många kardiovaskulära sjukdomar (t.ex. arteriell trombos, hjärtinfarkt, instabil angina). Föreningar som kan förhindra blodplättsaktivering, som kan orsakas av endogena inducerare (till exempel adenosin-5'-difosfat/ADP), används för närvarande i stor utsträckning för att effektivt påverka patologiska förändringar i det hemostatiska systemet (B.A. Sidorenko, D. .V. Preobrazhensky Klinisk användning av antitrombotiska läkemedel - M., 1998. Olika metoder för att hämma blodplättsaggregation med användning av svavelinnehållande bicykliska föreningar trombocytaggregation ,5,6,7-tetrahydrotienopyridin (tiklopidin) med formel I  är en antagonist av trombocyt-P2T ADP-receptorer (US patent nr. 4963559, cl. 514-301, op. 1990. Det har också visats att kalciumkanalblockeraren är D-cis-3-acetoxi-2,3-). dihydro-5--2-(2-metoxifenyl)-1,5-bensotiazepin-4(5H)-on-hydroklorid (diltiazem) med formel II
är en antagonist av trombocyt-P2T ADP-receptorer (US patent nr. 4963559, cl. 514-301, op. 1990. Det har också visats att kalciumkanalblockeraren är D-cis-3-acetoxi-2,3-). dihydro-5--2-(2-metoxifenyl)-1,5-bensotiazepin-4(5H)-on-hydroklorid (diltiazem) med formel II  har en antitrombotisk effekt (A.R.Dehpour, T.Samadian et al. "Effects of diltiazem and verapamil on ADP-induced rabbit platelet shape change and aggregation" Gen. Pharmacol, 1995, v.26, nr. 6, s.1295-1299 Ovanstående föreningar, in vitro, hämmade trombocytaggregation orsakad av ADP vid en koncentration av >300 μM Benso-1,2-ditiol-3-tion (BDTT) och dess derivat med den allmänna formeln III.
har en antitrombotisk effekt (A.R.Dehpour, T.Samadian et al. "Effects of diltiazem and verapamil on ADP-induced rabbit platelet shape change and aggregation" Gen. Pharmacol, 1995, v.26, nr. 6, s.1295-1299 Ovanstående föreningar, in vitro, hämmade trombocytaggregation orsakad av ADP vid en koncentration av >300 μM Benso-1,2-ditiol-3-tion (BDTT) och dess derivat med den allmänna formeln III.  där R1R4=H eller Ci-6-alkyl, bensoyl, (substituerad) aminosulfonylgrupp, etc., som produkter av organisk syntes (Europeiskt patent nr. 0043936, op. 1981. Förmågan hos dessa föreningar att förhindra). Trombocytaggregation har inte studerats. Det som ligger närmast det som beskrivs är den kända metoden att hämma trombocytaggregation genom att i mediet innehållande dessa celler införa svavelhaltiga heterocykliska föreningar - substituerad 3,4-dihydro-1,2-ditiin-2. Speciellt ledde denna metod till en minskning av aggregation av blodplättar med användning av 3,4-dihydro-3-vinyl-1,2-ditiin-2-oxid med formel IV.
där R1R4=H eller Ci-6-alkyl, bensoyl, (substituerad) aminosulfonylgrupp, etc., som produkter av organisk syntes (Europeiskt patent nr. 0043936, op. 1981. Förmågan hos dessa föreningar att förhindra). Trombocytaggregation har inte studerats. Det som ligger närmast det som beskrivs är den kända metoden att hämma trombocytaggregation genom att i mediet innehållande dessa celler införa svavelhaltiga heterocykliska föreningar - substituerad 3,4-dihydro-1,2-ditiin-2. Speciellt ledde denna metod till en minskning av aggregation av blodplättar med användning av 3,4-dihydro-3-vinyl-1,2-ditiin-2-oxid med formel IV.  vid relativt höga koncentrationer (till exempel under in vitro-förhållanden för en given förening, IC 50 = 100 μM) (japanska patentet 02204487, C 07 D 339/08, op. 1991, Chem. Abstr., 1991, v. 114, s. 6523s - prototyp). Syftet med uppfinningen är att utveckla en mer effektiv metod för att hämma blodplättsaggregation. kännetecknad av att kända BDTT eller dess derivat av ovanstående allmänna formel III, där R1-R4 har de angivna värdena Föreningar med den allmänna formeln III erhölls på känt sätt - genom att reagera motsvarande osubstituerade eller substituerade o-klor. - eller o-brombensylklorid eller -bromid med svavel vid en temperatur av 50-200°C i en miljömonoalkyleter av glykol i närvaro av en alkalimetallalkoxid. Den beskrivna uppfinningen illustreras av följande exempel aggregation under inverkan av BDTT och dess derivat Effekten av produkterna enligt föreliggande uppfinning på human trombocytaggregation studerades med den välkända Born turbidimetriska metoden. För detta centrifugerades venöst blod som tagits kl. 08.00 från friska donatorer vid 450 g vid rumstemperatur i en plastbehållare under 10 minuter, med användning av natriumcitrat som antikoagulant. Supernatanten, det vill säga blodplättsrik plasma, uppsamlades och centrifugerades vid 650 g under 30 minuter för att erhålla blodplättsfattig plasma. Trombocytkoncentrationen i blodplättsrik plasma justerades till 2,510^ celler/ml genom utspädning med blodplättsfattig plasma, och den resulterande suspensionen hälldes i en 0,5 ml kyvett. Aggregation inducerades genom att lägga till ADP till en koncentration av 20 μM. ADP-koncentrationen valdes i varje experiment så att aggregering var reversibel, och maximum inträffade 2 minuter efter tillsatsen av ADP, som inte översteg 50 %. Ljusspridning av en blodplättssuspension mättes med användning av en aggregometer utvecklad vid Biologiska fakulteten vid Moscow State University. M.V. Lomonosov. Föreningen som studerades (i form av en vattenlösning, om nödvändigt, innehållande DMSO upp till 0,2%) sattes till provet före tillsats av aggregationsinduceraren (ADP) i en koncentration av 1-100 μM hämmade trombocytaggregation orsakad av 20 μM ADP, medan effektiv verkan observerades vid koncentration<30 мкМ. В частности, значение концентрации, при которой достигалось полумаксимальное ингибирование, (IC 50) для БДТТ составляло 6,4 мкМ. Согласно данным прототипа, для известного аналога (3,4-дигидро-3-винил-1,2-дитиин-2-оксида) в условиях in vitro IC 50 имела значение 100 мкМ.Пример 2. Острая токсичность БДТТ и его производных.Острую токсичность соединений настоящего изобретения определяли известным способом по ЛД 50 с использованием беспородных мышей обоего пола средней массой 21 г при комнатной температуре; стандартное питание и воду давали ad libitum в течение всего эксперимента; подвижность животных не ограничивали. Растворы соединений в ДМСО вводили с помощью стерильного шприца внутрибрюшинно. После инъекции за животными вели наблюдение в течение 48 ч по истечении этого времени за мышами наблюдали дополнительно в течение 72 ч (ни одно из животных не погибло в течение дополнительного промежутка времени). Полученные результаты свидетельствуют о том, что значение ЛД 50 для БДТТ составляет >100 mg/kg och för dess derivat inte lägre än 50 mg/kg Data som presenteras i exempel 1 visar att den beskrivna metoden gör det möjligt att hämma trombocytaggregation in vitro mer effektivt jämfört med den kända metoden.
vid relativt höga koncentrationer (till exempel under in vitro-förhållanden för en given förening, IC 50 = 100 μM) (japanska patentet 02204487, C 07 D 339/08, op. 1991, Chem. Abstr., 1991, v. 114, s. 6523s - prototyp). Syftet med uppfinningen är att utveckla en mer effektiv metod för att hämma blodplättsaggregation. kännetecknad av att kända BDTT eller dess derivat av ovanstående allmänna formel III, där R1-R4 har de angivna värdena Föreningar med den allmänna formeln III erhölls på känt sätt - genom att reagera motsvarande osubstituerade eller substituerade o-klor. - eller o-brombensylklorid eller -bromid med svavel vid en temperatur av 50-200°C i en miljömonoalkyleter av glykol i närvaro av en alkalimetallalkoxid. Den beskrivna uppfinningen illustreras av följande exempel aggregation under inverkan av BDTT och dess derivat Effekten av produkterna enligt föreliggande uppfinning på human trombocytaggregation studerades med den välkända Born turbidimetriska metoden. För detta centrifugerades venöst blod som tagits kl. 08.00 från friska donatorer vid 450 g vid rumstemperatur i en plastbehållare under 10 minuter, med användning av natriumcitrat som antikoagulant. Supernatanten, det vill säga blodplättsrik plasma, uppsamlades och centrifugerades vid 650 g under 30 minuter för att erhålla blodplättsfattig plasma. Trombocytkoncentrationen i blodplättsrik plasma justerades till 2,510^ celler/ml genom utspädning med blodplättsfattig plasma, och den resulterande suspensionen hälldes i en 0,5 ml kyvett. Aggregation inducerades genom att lägga till ADP till en koncentration av 20 μM. ADP-koncentrationen valdes i varje experiment så att aggregering var reversibel, och maximum inträffade 2 minuter efter tillsatsen av ADP, som inte översteg 50 %. Ljusspridning av en blodplättssuspension mättes med användning av en aggregometer utvecklad vid Biologiska fakulteten vid Moscow State University. M.V. Lomonosov. Föreningen som studerades (i form av en vattenlösning, om nödvändigt, innehållande DMSO upp till 0,2%) sattes till provet före tillsats av aggregationsinduceraren (ADP) i en koncentration av 1-100 μM hämmade trombocytaggregation orsakad av 20 μM ADP, medan effektiv verkan observerades vid koncentration<30 мкМ. В частности, значение концентрации, при которой достигалось полумаксимальное ингибирование, (IC 50) для БДТТ составляло 6,4 мкМ. Согласно данным прототипа, для известного аналога (3,4-дигидро-3-винил-1,2-дитиин-2-оксида) в условиях in vitro IC 50 имела значение 100 мкМ.Пример 2. Острая токсичность БДТТ и его производных.Острую токсичность соединений настоящего изобретения определяли известным способом по ЛД 50 с использованием беспородных мышей обоего пола средней массой 21 г при комнатной температуре; стандартное питание и воду давали ad libitum в течение всего эксперимента; подвижность животных не ограничивали. Растворы соединений в ДМСО вводили с помощью стерильного шприца внутрибрюшинно. После инъекции за животными вели наблюдение в течение 48 ч по истечении этого времени за мышами наблюдали дополнительно в течение 72 ч (ни одно из животных не погибло в течение дополнительного промежутка времени). Полученные результаты свидетельствуют о том, что значение ЛД 50 для БДТТ составляет >100 mg/kg och för dess derivat inte lägre än 50 mg/kg Data som presenteras i exempel 1 visar att den beskrivna metoden gör det möjligt att hämma trombocytaggregation in vitro mer effektivt jämfört med den kända metoden.
Krav
En metod för att hämma trombocytaggregation genom att införa svavelhaltiga heterocykliska föreningar i ett medium innehållande dessa celler, kännetecknat av att benso-1,2-ditiol-3-tion och dess derivat med den allmänna formeln används som svavelhaltiga heterocykliska föreningar  där R1-R4 är H eller Ci-4 är alkyl.
där R1-R4 är H eller Ci-4 är alkyl.
Liknande patent:
Uppfinningen avser organisk kemi och farmakologi, nämligen en blandning av isomerer av kaliumsaltet av 2-ättiksyra i ett molförhållande av 1:3, som uppvisar kardiotonisk aktivitet
Hemostassystemet utför följande huvudfunktioner i kroppen:
Håller blodet i kärlen i flytande tillstånd, vilket är nödvändigt för normal blodtillförsel till organ och vävnader;
Ger stoppa blödning vid skada på kärlväggen.
Stoppa blödning (hemostas - från grekiska hemo- blod, stas- stopp) uppnås med deltagande av flera mekanismer. Efter skada på kärlväggen uppstår vasospasm. Denna omedelbara reaktion på skada kan stoppa blödningen endast när små kärlskador är mindre. I grund och botten uppnås stopp av blödning genom bildandet av blodproppar, som förhindrar blodförlust genom att stänga platsen för skadan. Sådan lokal bildning av blodproppar (hemostatiska proppar) vid kärlskada är en skyddande reaktion.
Men under vissa förhållanden bildas blodproppar inuti kärlen, vilket stänger deras lumen och förhindrar normalt blodflöde. Intravaskulär trombbildning kan inträffa med patologiska förändringar i det vaskulära endotelet, inklusive dess skada förknippad med ateroskleros, förhöjt blodtryck eller andra faktorer. Orsaken till blodproppar kan också vara onormala förändringar i blodflödet (till exempel en minskning av dess hastighet) eller en brist på vissa proteiner som förhindrar blodproppar.
Trombos uppstår med deltagande av två huvudprocesser: blodplättsaggregation och blodkoagulation (hemokoagulering).
Trombocytaggregation - detta är kombinationen av blodplättar till konglomerat (aggregat) av olika storlekar och densiteter. Denna process initieras när kärlväggen är skadad. På platsen för skadan binder trombocyter först till von Willebrand-faktor och kollagen i subendotelskiktet (förekommer trombocytvidhäftning). Interaktion med kollagen orsakar blodplättsaktivering (Fig. 27-1). I det här fallet blir blodplättarna själva källor till ämnen som stimulerar aggregation, såsom tromboxan A2, ADP,
serotonin. Trombin, som bildas lokalt under blodkoagulering, inducerar också trombocytaggregation. Dessutom är katekolaminer, trombocytaktiverande faktor och vissa andra endogena ämnen inducerare av aggregation.
Trombocytaggregation förhindras av prostacyklin och endotelavslappnande faktor, som produceras av vaskulära endotelceller och släpps ut i blodomloppet. När endotelceller skadas minskar syntesen av dessa ämnen och mot denna bakgrund dominerar effekten av ämnen som stimulerar aggregation. Som ett resultat kombineras blodplättar till aggregat, från vilka en trombocyt bildas.
Trombocyttromben blir starkare tack vare fibrintrådarna som bildas i processen blodkoagulering. Huvuddeltagarna i denna process är blodplasmaproteiner som kallas blodkoaguleringsfaktorer.
Plasmakoagulationsfaktorer syntetiseras i levern och cirkulerar i blodet i en inaktiv form. När kärlväggen är skadad aktiveras faktor VII snabbt med deltagandet vävnadsfaktor- ett transmembranprotein som syntetiseras av olika celler (inklusive aktiverade endotelceller) och som normalt inte kommer i kontakt med blod. Uttryck av vävnadsfaktor på cellytan under endotelskada accelererar signifikant aktiveringen av faktor VII (dess omvandling till faktor Vila) i närvaro av Ca 2+-joner. Under påverkan av faktor VIIa (i kombination med vävnadsfaktor) sker sekventiell aktivering av andra blodkoagulationsfaktorer (IX och X) i ett komplext autokatalytiskt system som kallas blodkoagulationskaskaden. Som ett resultat, under påverkan av faktor Xa, bildas trombin (faktor Ha), som omvandlar det lösliga proteinet fibrinogen (faktor I) som cirkulerar i blodet till olösligt fibrin (fig. 27-5). Fibrin polymeriserar och fyller utrymmet mellan blodplättarna och stärker trombocyten. Fibrintrådar penetrerar blodproppen och bildar ett nätverk som fångar röda blodkroppar som cirkulerar i blodet. En röd blodpropp bildas.
Blodkoagulering motverkas av ämnen som är naturliga hämmare av aktiva blodkoaguleringsfaktorer.
Aktivering av faktor X av faktor VIIa förhindras vävnadsfaktorvägshämmare, syntetiseras av endotel
celler. En hämmare av trombin och vissa andra aktiva koagulationsfaktorer (Xa, IXa XIa, XIIa) är antitrombin III- ett protein som cirkulerar i blodplasman och som verkar i kombination med heparin eller heparinliknande ämnen (finns på ytan av intakta endotelceller). Dessa ämnen påskyndar kraftigt inaktiveringen av blodkoagulationsfaktorer under påverkan av antitrombin III.
Hämmare av faktorer VIIIa och Va nödvändig för bildandet av trombin - aktiverat protein C. Detta protein syntetiseras i levern med deltagande av vitamin K, cirkulerar i blodet i en inaktiv form och aktiveras av trombin på ytan av intakta endotelceller. Protein C-aktivering ökar med överdriven trombingenerering. När lokala blodproppar bildas på platsen för skada på kärlväggen, hjälper ovanstående inhibitorer till att hålla blodet i flytande tillstånd, vilket förhindrar tillväxten av en blodpropp inuti kärlet.
Trombocytaggregation och blodkoagulering är relaterade till varandra. Övervägandet av en eller annan process i mekanismen för trombbildning beror på kärlets kaliber och blodflödets hastighet. Trombocytaggregation är av större betydelse för bildandet av blodproppar vid höga blodflödeshastigheter, d.v.s. i artärerna. I venösa kärl, där blodflödeshastigheten är låg, dominerar processen med blodkoagulering.
Trombens efterföljande öde beror på aktiviteten hos det fibrinolytiska systemet. Om detta system fungerar normalt löses fibrin gradvis upp (fibrinolys) med deltagande av enzymet plasmin, som bildas från en inaktiv prekursor (plasminogen) under påverkan av aktivatorer. Effekten av plasmin förhindras av antiplasminer som cirkulerar i blodet. Plasminogenaktivatorer neutraliseras av specifika inhibitorer.
Avbrott i processerna för trombocytaggregation och blodkoagulation och/eller ökad aktivitet i det fibrinolytiska systemet kan leda till blödning, och överdriven aktivering av dessa processer eller hämning av fibrinolys kan leda till uppkomsten av intravaskulära blodproppar (trombos). Som ett resultat av trombos av arteriella kärl minskar blodflödet till vävnader och ischemi utvecklas. Konsekvensen av ischemi är celldöd (nekros). Trombos kan orsaka sådana allvarliga komplikationer som hjärtinfarkt (kransartärtrombos), ischemisk stroke (cerebral vaskulär trombos), etc. Venös trombos kan orsaka lungemboli.
För att förebygga tromboser används ämnen som hämmar blodplättsaggregation och blodpropp, vilket förhindrar bildandet av blodproppar. För trombos används också ämnen som orsakar lys av blodproppar - trombolytiska (fibrinolytiska) medel.
För att stoppa blödningar används medel som ökar blodets koagulering och medel som hämmar fibrinolys. Valet av en eller annan beror på orsaken till blödningen.
Följande grupper av läkemedel som påverkar trombbildning är av praktisk betydelse.
Medel som minskar blodplättsaggregationen(trombocythämmande medel).
Läkemedel som påverkar blodets koagulering.
Läkemedel som minskar blodets koagulering (antikoagulantia).
Läkemedel som ökar blodets koagulering (hemostatika).
Medel som påverkar fibrinolys.
Fibrinolytiska (trombolytiska) medel.
Antifibrinolytiska medel (fibrinolyshämmare).
27.1. LÄKEMEDEL SOM MINSKAR AGREGERING AV TROMBROMSPLATSER (ANTI-TROBLOCK)
Blodplättar är små skivformade blodelement som bildas som fragment av benmärgsmegakaryocyter. Blodplättar cirkulerar i blodet i 6-12 dagar och tas sedan upp av vävnadsmakrofager.
Vaskulärt endotel påverkar blodplättarnas funktionella aktivitet. Endotelceller frisätter prostacyklin (prostaglandin I 2) och endotelavslappnande faktor, som identifieras med kväveoxid - NO, till blodomloppet. Dessa ämnen förhindrar blodplättsaggregation. Dessutom utsöndrar endotelceller ämnen som minskar blodkoagulering och främjar koagellys. Allt detta säkerställer de antitrombogena egenskaperna hos intakt vaskulärt endotel.
När det vaskulära endotelet skadas, vilket kan orsakas av olika faktorer (mekaniskt trauma, infektioner, aterosklerotiska förändringar i kärlväggen, förhöjt blodtryck etc.) minskar endotelets antitrombogena egenskaper, vilket skapar förutsättningar för bildningen. av en blodpropp. Syntesen av prostacyklin och endotelavslappnande faktor störs och detta underlättar kontakten
trombocyter med skadad endotelyta. Blodplättar ackumuleras på platsen för skadan och interagerar med det vaskulära subendotelet: direkt eller genom von Willebrand-faktor (utsöndras av aktiverade blodplättar och endotelceller), binder de till kollagen och andra proteiner i subendotelet med deltagande av specifika glykoproteiner lokaliserade i trombocyten membran. Von Willebrand-faktor binder till glykoprotein Ib och kollagen binder till glykoprotein Ia i trombocytmembranet (se Fig. 27-1). Effekten av kollagen (liksom trombin, som bildas lokalt i små mängder redan i det inledande skedet av trombbildning) på blodplättar orsakar en förändring i deras tillstånd - aktivering. Blodplättar ändrar sin form (från skivformade sprids de ut med många processer - pseudopodia) och täcker den skadade ytan av kärlet.
När de aktiveras frisätter blodplättar olika biologiskt aktiva substanser, som i icke-aktiverade blodplättar finns i granulat (α-granulat, täta granulat). Täta granulat är ett förråd av ämnen som stimulerar trombocytaggregation: ADP och serotonin. Frisättningen av dessa substanser från blodplättsgranuler sker som ett resultat av en ökning av den intracellulära koncentrationen av Ca 2+ på grund av verkan av kollagen, trombin och andra aggregationsinducerare, inklusive ADP själv, på blodplättar. ADP som frigörs i blodomloppet stimulerar specifika (purinerga) receptorer lokaliserade i trombocytmembranet. Genom G-proteinkopplade receptorer (P2Y 12 purinerga receptorer) orsakar ADP hämning av adenylatcyklas och en minskning av cAMP-nivåer, vilket leder till en ökning av Ca 2 -nivåer i blodplättarnas cytoplasma (Fig. 27-2).
Dessutom, när blodplättar aktiveras, ökar aktiviteten hos fosfolipas A2 i trombocytmembranet, ett enzym som är involverat i bildandet av arakidonsyra från membranfosfolipider. I blodplättar syntetiseras cykliska endoperoxider (prostaglandiner G2/H2) först från arakidonsyra under påverkan av cyklooxygenas, och från dem, med deltagande av tromboxanesin-
Thetase producerar tromboxan A2, en aktiv stimulator för trombocytaggregation och en vasokonstriktor. När det väl släpps ut i blodomloppet stimulerar tromboxan A2 tromboxanreceptorer på trombocytmembran. Som ett resultat, genom C associerad med dessa receptorer q -proteiner fosfolipas C aktiveras och bildandet av
Ris.27-1. Vidhäftning och aggregering av blodplättar under skada på kärlväggen: EC - endotelcell; VW - von Willebrand faktor; TxA2 - tromboxan A2; PGI 2 - prostacyklin; NO - endotelavslappnande faktor; GP - glykoproteiner; GP llb/llla - glykoproteiner llb/llla (Från: Katzung B.G. Bazic and Clinical Pharmacology - NY, 2001, med ändringar)
inositol 1,4,5-trifosfat, som främjar frisättningen av Ca 2+ från den intracellulära depån av blodplättar (kalciumdepåns roll i blodplättar utförs av ett system av täta tubuli). Detta leder till en ökning av den cytoplasmatiska koncentrationen av Ca 2+ (Fig. 27-2). Tromboxan A 2 orsakar en ökning av koncentrationen av Ca 2+ i vaskulära glatta muskelceller, vilket leder till vasokonstriktion.

Ris. 27-2. Verkningsmekanismer för trombocythämmande medel (acetylsalicylsyra, tiklopidin och epoprostenol): EC - endotelcell; PL - fosfolipider av cellmembran; AA - arkidonsyra; PLA2 - fosfolipas A2; COX - cyklooxygenas; TS - tromboxansyntetas; PS - prostacyklinsyntetas; PGG2/H2 - cykliska endoperoxider; TxA2 - tromboxan A2; PGI 2 - prostacyklin; AC - adenylatcyklas; PLS - fosfolipas C; IP 3 - inositol-1, 4, 5-trifosfat
Således ökar ADP och tromboxan A2 nivån av Ca2+ i blodplättarnas cytoplasma. Cytoplasmatisk Ca 2+ orsakar en förändring i konformationen av glykoproteinerna IIb/IIIa i trombocytmembranet, som ett resultat av vilket de förvärvar förmågan att binda fibrinogen. En molekyl fibrinogen har två bindningsställen för glykoproteinerna IIb/IIIa och kan således förena två blodplättar (Fig. 27-3). Sammanfogningen av många blodplättar av fibrinogenbryggor leder till bildandet av blodplättsaggregat.
Prostacyklin (prostaglandin I 2) har motsatt effekt på trombocytaggregationen. Som tromboxan, prostacyklin
bildas av cykliska endoperoxider, men under verkan av ett annat enzym - prostacyklinsyntetas. Prostacyklin syntetiseras av endotelceller och släpps ut i blodomloppet, där det stimulerar prostacyklinreceptorer i trombocytmembranet och adenylatcyklas associerat med dem genom G s-proteinet. Som ett resultat ökar nivån av cAMP i blodplättar och koncentrationen av cytoplasmatisk Ca 2+ minskar (se Fig. 27-2). Detta förhindrar konformationen av glykoproteinerna IIb/IIIa från att förändras och de förlorar sin förmåga att binda fibrinogen. Således förhindrar prostacyklin trombocytaggregation. Under påverkan av prostacyklin minskar koncentrationen av Ca 2+ i vaskulära glatta muskelceller, vilket leder till vasodilatation.

Följande sekvens av huvudhändelser som leder till trombocytaggregation kan särskiljas (se diagram 27-1).
Huvudfokus för verkan av trombocythämmande medel, som för närvarande används i klinisk praxis, är associerad med elimineringen av verkan av tromboxan A 2 och ADP, såväl som med blockaden av glykoproteinerna IIb/IIIa av trombocytmembran. Ämnen med en annan verkningsmekanism används också, som ökar koncentrationen av cAMP i blodplättar och därför minskar koncentrationen av Ca 2+ i dem.
Följande grupper av medel som minskar trombocytaggregation särskiljs.
Medel som hämmar syntesen av tromboxan A2. - Cyklooxygenashämmare:
acetylsalicylsyra.

Schema 27.1. Mekanism för trombocytaggregation
Cyklooxygenas och tromboxansyntetasinhibitorer: indobufen.
Medel som stimulerar prostacyklinreceptorer:
epoprostenol**.
Medel som stör effekten av ADP på blodplättar:
tiklopidin; klopidogrel.
Medel som hämmar trombocytfosfodiesteras:
dipyridamol
Medel som blockerar glykoproteinerna IIb/IIIa i trombocytmembran.
Monoklonala antikroppar: abciximab.
Syntetiska blockerare av glykoproteiner IIb/IIIa: eptifibatid; tirofiban.
Medel som hämmar syntesen av tromboxan A 2
Acetylsalicylsyra (aspirin*) är ett välkänt antiinflammatoriskt, smärtstillande och febernedsättande medel. Används för närvarande i stor utsträckning som ett trombocythämmande medel. Den trombocytdämpande effekten av acetylsalicylsyra är associerad med dess hämmande effekt på syntesen av tromboxan A 2 i trombocyter.
Acetylsalicylsyra hämmar irreversibelt cyklooxygenas (orsakar irreversibel acetylering av enzymet) och stör därmed bildningen av cykliska endoperoxider, prekursorer till tromboxan A2 och prostaglandiner från arakidonsyra. Under påverkan av acetylsalicylsyra minskar därför inte bara syntesen av tromboxan A 2 i blodplättar, utan även syntesen av prostacyklin i vaskulära endotelceller (se fig. 27-2). Genom att välja lämpliga doser och kurer är det emellertid möjligt att uppnå en preferentiell effekt av acetylsalicylsyra på syntesen av tromboxan A2. Detta beror på betydande skillnader mellan blodplättar och endotelceller.
Blodplättar - anukleatceller - har inte ett proteinåtersyntessystem och kan därför inte syntetisera cyklooxygenas. Därför, med irreversibel hämning av detta enzym, kvarstår störningen av syntesen av tromboxan A2 under hela trombocytens liv, dvs. inom 7-10 dagar. På grund av bildandet av nya blodplättar varar den trombocytdämpande effekten av acetylsalicylsyra under en kortare tid, och därför rekommenderas att förskriva det för att uppnå en stabil effekt av läkemedlet (dvs en stabil minskning av tromboxannivåerna). en gång om dagen.
Cycloxygenas återsyntetiseras i vaskulära endotelceller, och aktiviteten av detta enzym återställs inom några timmar efter intag av acetylsalicylsyra. Därför, när du förskriver läkemedlet en gång om dagen, finns det ingen signifikant minskning av prostacyklinsyntesen.

Dessutom genomgår cirka 30% av acetylsalicylsyra first-pass metabolism i levern, så dess koncentration i den systemiska cirkulationen är lägre än i portalblodet. Som ett resultat av detta verkar acetylsalicylsyra på blodplättar som cirkulerar i det portala blodomloppet i högre koncentrationer än på endotelceller i systemiska kärl. För att undertrycka syntesen av tromboxan A2 i blodplättar krävs därför mindre doser av acetylsalicylsyra än för att undertrycka syntesen av prostacyklin i endotelceller.
Av dessa skäl, med en ökning av dosen och administreringsfrekvensen av acetylsalicylsyra, blir dess hämmande effekt på prostacyklinsyntesen mer uttalad, vilket kan leda till en minskning av den trombocythämmande effekten. I samband med dessa egenskaper rekommenderas acetylsalicylsyra som trombocythämmande medel att förskrivas i små doser (i genomsnitt 100 mg) en gång om dagen.
Som ett trombocythämmande medel används acetylsalicylsyra för instabil angina, för att förebygga hjärtinfarkt, ischemisk stroke och perifer vaskulär trombos, för att förhindra bildandet av blodproppar under kranskärlsbypasstransplantation och koronar angioplastik. Acetylsalicylsyra ordineras oralt i doser på 75-160 mg (för vissa indikationer - i dosintervallet från 50 till 325 mg) 1 gång per dag under lång tid. För närvarande har läkare till sitt förfogande acetylsalicylsyrapreparat avsedda för att förebygga trombos, som innehåller 50-325 mg av den aktiva substansen, inklusive enterodragerade tabletter - Acecardol *, Aspicor *, Cardiopyrin *, Aspirin Cardio *, Novandol *, Thrombo ACC *, etc. Den trombocythämmande effekten av acetylsalicylsyra uppträder snabbt (inom 20-30 minuter). Enteriskt belagda doseringsformer börjar verka långsammare, men vid långvarig användning skiljer sig deras effektivitet praktiskt taget inte från den för konventionella tabletter. För att uppnå snabbare effekt bör acetylsalicylsyratabletter tuggas.
De huvudsakliga biverkningarna av acetylsalicylsyra är förknippade med hämning av cyklooxygenas. Detta stör bildningen av prostaglandiner E 2 och I 2, som har en antisekretorisk och gastroskyddande effekt (minskar utsöndringen av saltsyra av magens parietalceller, ökar utsöndringen av slem och bikarbonater). Som ett resultat, även vid kortvarig användning, kan acetylsalicylsyra orsaka skador på epitelet i magen och tolvfingertarmen (ulcerogen effekt). Effekten på magslemhinnan är mindre uttalad vid användning av enterodragerade beredningsformer. Vid användning av acetylsalicylsyra är gastrointestinala blödningar och andra hemorragiska komplikationer möjliga. Risken för sådana komplikationer är lägre när acetylsalicylsyra förskrivs i en dos på 100 mg/dag eller mindre. Selektiv hämning av COX leder till aktivering av lipoxygenasvägen för omvandling av arakidonsyra och bildning av leukotriener, som har bronkokonstriktoregenskaper. Hos patienter med bronkialastma kan acetylsalicylsyra framkalla uppkomsten av en attack ("aspirinastma"). Allergiska reaktioner är möjliga.
För att minska den ulcerogena effekten av acetylsalicylsyra har ett kombinationsläkemedel Cardiomagnyl * innehållande magnesiumhydroxid föreslagits. Magnesiumhydroxid neutraliserar saltsyra i magen (antacida effekt), vilket minskar dess skadliga effekt på slemhinnan. Läkemedlet används för samma indikationer som acetylsalicylsyra, inklusive för sekundärt förebyggande av ischemisk stroke.
Indobufen (ibustrin *) minskar syntesen av tromboxan A 2, samtidigt som det hämmar cyklooxygenas och tromboxansyntetas. Till skillnad från acetylsalicylsyra orsakar indobufen reversibel hämning av cyklooxygenas. När du tar detta läkemedel sker en relativ ökning av mängden prostacyklin (prostacyklin/tromboxan A 2-förhållandet ökar). Indobufen hämmar trombocytvidhäftning och aggregation. Indikationer för användning och biverkningar är desamma som för acetylsalicylsyra.
Medel som stimulerar prostacyklinreceptorer
Ett annat sätt att minska trombocytaggregationen är stimulering av prostacyklinreceptorer. För detta ändamål använder de
prostacyklinpreparat e p o pro s t e n o l * . Effekten av prostacyklin är motsatt till effekten av tromboxan A 2, inte bara på blodplättar utan även på kärltonus. Det orsakar vasodilatation och ett sänkt blodtryck. Denna effekt av prostacyklin används vid pulmonell hypertoni. Eftersom prostacyklin snabbt förstörs i blodet (t 1/2 ca 2 minuter) och därför inte verkar länge, administreras läkemedlet genom infusion. På grund av dess korta verkan har epoprostenol* inte funnits i någon utbredd användning som trombocythämmande medel. Ett möjligt användningsområde för epoprostenols antiblodplättseffekt är att förhindra trombocytaggregation under extrakorporeal cirkulation.
Medel som stör verkan av ADP på blodplättar
Tiklopidin (ticlid*), ett tienopyridinderivat, hämmar trombocytaggregation orsakad av ADP. Tiklopidin är en prodrug, dess trombocythämmande effekt är associerad med bildningen av en aktiv metabolit med deltagande av mikrosomala leverenzymer. Tiklopidinmetaboliten innehåller tiolgrupper genom vilka den irreversibelt binder till P2Y 12 purinerga receptorer i trombocytmembranet. Detta leder till eliminering av den stimulerande effekten av ADP på blodplättar och en minskning av koncentrationen av cytoplasmatisk Ca 2+ i dem. Som ett resultat av detta minskar uttrycket av glykoproteinerna IIb/IIIa i trombocytmembranet och deras bindning till fibrinogen (se Fig. 27-2). På grund av dess irreversibla karaktär har tiklopidin en långvarig trombocythämmande effekt.
Den maximala effekten med konstant användning av tiklopidin uppnås efter 7-11 dagar (den tid som krävs för bildandet och utvecklingen av verkan av den aktiva metaboliten) och efter utsättning av läkemedlet kvarstår den under hela livslängden för trombocyter (7-10) dagar).
Tiklopidin ordineras för sekundärt förebyggande av ischemisk stroke, för att förhindra trombos i utplånande sjukdomar i de nedre extremiteterna, under kranskärlsbypasstransplantation och stenting av kransartärerna. Läkemedlet är effektivt när det tas oralt, ordinerat 2 gånger om dagen med måltider.
Användningen av tiklopidin är begränsad på grund av dess biverkningar. Eventuell aptitlöshet, illamående, kräkningar, diarré (20%), buksmärtor, hudutslag (11-14%). Noterat
ökning av blodplasmanivån av aterogena lipoproteiner. Blödning är en vanlig komplikation vid användning av trombocythämmande medel. En farlig komplikation är neutropeni, som inträffar under de första tre månaderna av behandlingen hos 1-2,4 % av patienterna. Trombocytopeni, agranulocytos och mycket sällan aplastisk anemi är möjliga. I detta avseende, under de första månaderna av behandlingen, är systematisk övervakning av blodbilden nödvändig.
Clopidogrel (Plavix*, Zilt*) liknar tiklopidin i kemisk struktur, huvudsakliga effekter och verkningsmekanism. Liksom tiklopidin är det en prodrug och genomgår omvandling i levern för att bilda en aktiv metabolit. Signifikant hämning av trombocytaggregationen noterades från den andra behandlingsdagen, maximal effekt uppnås efter 4-7 dagar. Efter avbrytande av läkemedlet varar dess effekt i 7-10 dagar. Klopidogrel är överlägset tiklopidin i aktivitet - vid en daglig dos på 75 mg orsakar det samma minskning av trombocytaggregation och förlängning av blödningstiden som tiklopidin vid en daglig dos på 500 mg.

Klopidogrel används för samma indikationer som acetylsalicylsyra, vid intolerans. Ta oralt 1 gång per dag, oavsett måltid. Klopidogrel kan kombineras med acetylsalicylsyra, eftersom läkemedlen hämmar olika mekanismer för trombocytaggregation och därför förstärker effekten av varandra (med denna kombination finns dock en högre risk för blödningskomplikationer).
Jämfört med tiklopidin är biverkningarna av klopidogrel mindre uttalade (diarré - 4,5%, utslag - 6%). Användning av klopidogrel är associerad med en lägre risk för en sådan allvarlig komplikation som neutropeni (0,1%), och trombocytopeni förekommer mer sällan. Som en sällsynt komplikation, liksom med tiklopidin, kan trombotisk trombocytopen purpura utvecklas.
Trombocytfosfodiesterashämmare
Dipyridamol (kurantyl*, persantin*) föreslogs först som en kransvidgare. Senare avslöjades dess förmåga att hämma trombocytaggregation. För närvarande används dipyridamol huvudsakligen som ett trombocythämmande medel för att förebygga trombos. Den trombocytdödande effekten av dipyridamol är associerad med en ökning av nivån av cAMP i blodplättar, som ett resultat av vilket koncentrationen av cytoplasmatisk Ca 2+ i dem minskar. Detta händer av flera anledningar. För det första hämmar dipyridamol fosfodiesteras, vilket inaktiverar cAMP. Dessutom hämmar dipyridamol endotelcellers och erytrocyters upptag av adenosin och dess metabolism (hämmar adenosindeaminas), vilket ökar nivån av adenosin i blodet (fig. 27-4). Adenosin stimulerar blodplätts A2-receptorer och ökar aktiviteten av adenylatcyklas associerat med dessa receptorer, som ett resultat ökar bildningen av cAMP i trombocyter och nivån av cytoplasmatisk Ca 2+ minskar. Dipyridamol ökar också cAMP-nivåerna i vaskulära glatta muskelceller, vilket orsakar vasorelaxation.

Dipyridamol används för att förhindra ischemisk stroke, såväl som för sjukdomar i perifera artärer (främst i kombination med acetylsalicylsyra, eftersom dipyridamol i sig har en svag trombocythämmande effekt). Förskrivs oralt 3-4 gånger om dagen 1 timme före måltid. I kombination med orala antikoagulantia ordineras dipyridamol för att förhindra bildandet av blodproppar vid mitral hjärtsjukdom.
Vid användning av dipyridamol, huvudvärk, yrsel, arteriell hypotoni, dyspeptiska symtom,
hudutslag. Risken för blödningar är mindre än vid användning av acetylsalicylsyra. Dipyridamol är kontraindicerat vid angina pectoris (möjligt "stjälsyndrom").

Ris. 27-4. Mekanism för trombocythämmande verkan av dipyridamol: EC - endotelcell; A2-P-adenosin A2-receptor; PDE - cAMP fosfodiesteras; AC - adenylatcyklas; GP IIb/IIIa - glykoproteiner IIb/IIIa
Pentoxifyllin (agapurin*, trental*), liksom dipyridamol, hämmar fosfodiesteras och ökar cAMP-nivåerna. Som ett resultat minskar nivån av cytoplasmatisk Ca 2 + i blodplättar, vilket leder till en minskning av deras aggregation. Pentoxifyllin har också andra egenskaper: det ökar deformerbarheten av röda blodkroppar, minskar blodets viskositet och har en vasodilaterande effekt, vilket förbättrar mikrocirkulationen.
Pentoxifyllin används för cerebrovaskulära olyckor, perifera cirkulationsstörningar av olika ursprung och vaskulär patologi i ögonen (se kapitlet "Läkemedel som används vid cerebrovaskulära olyckor"). Möjliga biverkningar: dyspeptiska symtom, yrsel, rodnad i ansiktet, såväl som blodtryckssänkning, takykardi, allergiska reaktioner, blödning. Liksom dipyridamol kan det framkalla attacker under angina pectoris.
Medel som blockerar glykoproteinerna IIb/IIIa i trombocytmembran
Denna grupp av antiblodplättsmedel, som direkt interagerar med glykoproteinerna IIb/IIIa i trombocytmembranen och stör deras bindning till fibrinogen, har uppträtt relativt nyligen.
Abciximab (reopro*) - det första läkemedlet från denna grupp är en "chimär" mus/human monoklonal antikropp (Fab-fragment av musantikroppar mot glykoproteinerna IIb/IIIa kombinerat med Fc-fragmentet av humant Ig). Abciximab hämmar icke-kompetitivt bindningen av fibrinogen till glykoproteinerna IIb/IIIa på trombocytmembranet, vilket stör deras aggregation (se fig. 27-3). Trombocytaggregationen normaliseras 48 timmar efter en enda injektion. Läkemedlet administreras intravenöst (som en infusion) för att förhindra trombos under angioplastik i kransartärerna. Vid användning av abciximab är blödning möjlig, inklusive inre (gastrointestinal, intrakraniell, blödning från genitourinary kanalen), illamående, kräkningar, hypotoni, bradykardi, allergiska reaktioner upp till anafylaktisk chock, trombocytopeni.
Sökandet efter mindre allergiframkallande läkemedel med samma verkningsmekanism ledde till skapandet av syntetiska blockerare av glykoproteinerna IIb/IIIa. Baserat på barborin (en peptid isolerad från giftet från pygméskallerormen) erhölls läkemedlet e p t i f i b a t i d (integrilin *) - en cyklisk hektapeptid som imiterar aminosyrasekvensen i fibrinogenkedjan, som direkt binder till glykoproteinerna IIb/IIIa. Eptifibatid förskjuter fibrinogen konkurrerande från bindning till receptorer, vilket orsakar en reversibel störning av trombocytaggregationen. Läkemedlet administreras intravenöst som en infusion; den trombocythämmande effekten uppträder inom 5 minuter och försvinner 6-12 timmar efter avslutad administrering. Läkemedlet rekommenderas för att förhindra trombbildning under perkutan kranskärlsplastik, för instabil angina och för att förebygga hjärtinfarkt. En farlig komplikation vid användning av eptifibatid är blödning; trombocytopeni är möjlig.
Tirofiban (agrastat*) är en icke-peptidblockerare av glykoproteinerna IIb/IIIa, en analog till tyrosin. Liksom eptifibatid, blockerar tirofiban kompetitivt glykoprotein IIb/IIIa-receptorer. Läkemedlet administreras intravenöst (infusion). Effektens insättande hastighet, verkningstiden och indikationerna för användning är desamma som för eptifibatid. Biverkningar - blödning, trombocytopeni.
För att utöka möjligheterna att använda läkemedel i denna grupp skapades blockerare av glykoproteinerna IIb/IIIa som är effektiva när de administreras oralt - xemilofiban *, sibrafiban *, etc. Tester av dessa läkemedel visade dock deras otillräckliga effektivitet och en biverkning i form av svår trombocytopeni.
27.2. DROGER SOM PÅVERKAR BLODKOPPLING
Skador på kärlväggen initierar inte bara blodplättsaggregation utan även blodpropp. Det finns många kända faktorer (plasma, vävnad, blodplättar) involverade i denna process. De flesta av dem är plasmaproteiner som cirkulerar i ett inaktivt tillstånd, men som därefter aktiveras under blodkoaguleringsprocessen. För att förklara effekten av läkemedel är det nödvändigt att nämna faktor VII (prokonvertin), faktor IX (jul), faktor X (Stuart-Prower), faktor II (protrombin). Dessa koagulationsfaktorer är proenzymer och, när de aktiveras, omvandlas de till proteolytiska enzymer (faktorerna GCa, Xa och Na). Faktorer VIII och V, efter aktivering, fungerar som kofaktorproteiner för enzymer (faktorer IXa respektive Xa), vilket ökar deras proteolytiska aktivitet.
Faktor VII har initialt låg proteolytisk aktivitet, men som ett resultat av interaktion med vävnadsfaktor (se s. 481) ökar den snabbt. Aktiverad faktor VII (faktor VIIa) bildar tillsammans med vävnadsfaktor och Ca 2+ ett komplex som orsakar partiell proteolys av faktorerna IX och X. Faktor IXa aktiverar i sin tur dessutom faktor X (faktor Xa bildas). Faktor Xa verkar på protrombin (faktor II) och omvandlar det till trombin (faktor Ha). Trombin orsakar partiell proteolys av fibrinogen för att bilda fibrin (Fig. 27-5).
Proteolytisk aktivering av blodkoagulationsfaktorer accelereras avsevärt om de binder genom Ca 2+-joner till negativt laddade fosfolipider i cellmembranen. Dessa fosfolipider fungerar som en slags matris på vilken koagulationsfaktorer sätts samman till komplex med deltagande av Ca 2 + -joner. Samtidigt ökar aktiveringshastigheten för faktorer i dessa komplex 10 tusen gånger eller mer. En nödvändig förutsättning för bildandet av sådana komplex är förmågan hos faktorerna II, VII, IX och X att binda till Ca2+. Dessa faktorer innehåller negativt laddade
rester av y-karboxyglutaminsyror, som säkerställer deras bindning till Ca 2+. Bildandet av γ-karboxyglutaminsyror sker i levern med deltagande av vitamin K. Med vitamin K-brist uppträder defekta blodkoagulationsfaktorer II, VII, IX och X i blodet, vilket stör bildningen av fibrin.

Ris. 27-5. Schema för aktivering av blodkoagulation vid skada på kärlväggen (Från: Katzung B. G. Basic and clinical pharmacology. - NY, 2001, med ändringar): komplex av blodkoagulationsfaktorer associerade med negativt laddade fosfolipider av cellmembran är understrukna med en fet linje. Komplex VIIa + TF + Ca 2+ aktiverar faktorerna X och IX (TF - vävnadsfaktor). Komplex IXa + VIIIa + Ca 2+ aktiverar dessutom faktor X. Komplex Xa + Va + Ca 2+ (protrombinas) främjar omvandlingen av protrombin till trombin. Faktorer inneslutna i lådor hämmas av heparin
Blodplasmaproteiner som innehåller γ-karboxyglutaminsyrarester och som bildas i levern med deltagande av vitamin K inkluderar även proteinerna C och S. Efter aktivering orsakar protein C (Ca) proteolytisk klyvning av faktorerna VIIIa och Va. Detta leder till störningar av trombinbildningen. Protein S fungerar som en kofaktor i proteolysreaktioner. Aktivering av protein C sker under påverkan av trombin på ytan av intakta (oskadade) endotelceller som uttrycker proteinet trombomodulin, som samtidigt binder protein C och trombin.
27.2.1. Antikoagulanter (antikoagulanter)
Antikoagulantia som används i klinisk praxis hämmar antingen aktiva koagulationsfaktorer direkt i blodet eller stör deras bildning i levern. Därför är de indelade i 2 grupper:
(agerar direkt i blodet).
- Heparin standard(ofraktionerad).
- Hepariner med låg molekylvikt:
enoxaparinnatrium;
Nadroparin kalcium;
Dalteparinnatrium;
Reviparinnatrium.
- Heparinoider:
Sulodexid;
Danaparoid**.
- Antitrombin III läkemedel.
- Hirudin-preparat:
Lepirudin*.
- Aktiverat protein C:
Drotrecogin alfa.
(hämma syntesen av koagulationsfaktorer i levern).
- Kumarinderivat:
Acenokumarol (synkumar*);
Warfarin (warfarex*).
- Indandionderivat:
Fenindion (fenylin*).
Direkta antikoagulantia
Heparin- sulfaterad glykosaminoglykan (mukopolysackarid), bestående av D-glukosamin och D-glukuronsyrarester. Heparin produceras av mastceller i många vävnader; det finns i stora mängder av levern, lungorna och tarmslemhinnan. För medicinska ändamål isoleras heparin från tarmslemhinnan hos grisar och från lungorna hos nötkreatur. Pågående
isoleringen ger en blandning av fraktioner med olika polysackaridkedjelängder och olika molekylvikter (från 3 000 till 40 000 D). Fraktioner med olika molekylvikter skiljer sig något i biologisk aktivitet och farmakokinetiska egenskaper. Därför kan heparinpreparat erhållna med olika metoder och från olika källor ha olika antikoagulerande aktivitet, vilket gör att det är nödvändigt att utföra deras biologiska standardisering. Heparins aktivitet bestäms av dess förmåga att förlänga blodkoagulationstiden (1 mg standardheparin innehåller 130 enheter).
Heparin har en effekt på blodkoagulationsfaktorer först efter bildandet av ett komplex med den endogena antikoagulanten antitrombin III. Antitrombin III, ett blodplasmaglykoprotein, hämmar serinproteaser, som inkluderar blodkoagulationsfaktorerna IIa (trombin), EXa och Xa (liksom XIa och XIIa). Processen med faktorinaktivering under påverkan av enbart antitrombin III fortskrider mycket långsamt. Heparin orsakar konformationsförändringar i antitrombin III-molekylen, vilket leder till en acceleration av denna process med cirka 1000 gånger.

Huvudverkan av heparin-antitrombin III-komplexet är riktad mot trombin och faktor Xa, men mekanismerna för hämning av dessa faktorer har vissa skillnader. För att inaktivera trombin måste heparin binda till både antitrombin III-molekylen och trombinmolekylen. Samtidigt kräver snabb inaktivering av faktor Xa av heparin-antitrombin III-komplexet inte bindning av denna faktor till heparin. Heparinfraktioner med en relativt kort polymerkedja (mindre än 18 sackaridenheter) kan inte samtidigt binda antitrombin III och trombin och har därför inte antitrombinaktivitet. Deras verkan är huvudsakligen förknippad med inaktiveringen av faktor Xa och därför med störningen av omvandlingen av protrombin till trombin.
Förutom sin effekt på blodkoagulering har heparin också några andra effekter: det minskar nivån av lipider i blodet på grund av aktiveringen av lipoproteinlipas (detta enzym hydrolyserar triglycerider) och undertrycker proliferationen av glatta muskelceller.
Heparin absorberas dåligt när det administreras oralt, så det administreras intravenöst, ibland subkutant. Vid intravenös administrering uppträder effekten omedelbart och varar 2-6 timmar. Vid subkutant administrering börjar heparin verka efter 1-2 timmar, varaktigheten av verkan är 8-12 timmar (ordineras 2-3 gånger om dagen). Heparin i blodet binder till många proteiner, inklusive de som neutraliserar det (trombocytfaktor 4 och några andra). Höga nivåer av dessa proteiner i blodet kan orsaka relativ resistens mot läkemedlet. Dessutom binder heparin till makrofager och endotelceller, och dess nedbrytning (depolymerisation) sker. Heparin metaboliseras också i levern och utsöndras via njurarna.
Heparin används för att förebygga och behandla djup ventrombos och lungemboli, för instabil angina och hjärtinfarkt, för att förhindra trombos i perifera artärer, för hjärtklaffsersättning och extrakorporeal cirkulation. Heparin doseras i aktionsenheter (AU).
De vanligaste komplikationerna av heparinbehandling är blödningar, som kan orsakas av hämning av trombocytfunktionen eller en minskning av deras antal (trombocytopeni). Bindningen av heparin till von Willebrand-faktor verkar förklara dess hämmande effekt på trombocytvidhäftning och aggregation. I sådana fall sätts heparin ut och vid allvarlig blödning ges även protaminsulfat intravenöst, vilket neutraliserar heparin genom att bilda ett olösligt komplex.
Trombocytopeni inträffar dag 7-14 av behandlingen hos cirka 1-5 % av patienterna som får heparin. Det orsakas av uppkomsten av antikroppar (IgG) riktade mot heparin-trombocytfaktor 4-komplexet. Detta komplex binder till trombocytmembranet vid neutralisering av heparin med faktor 4, ett blodplättshärlett glykoprotein som frisätts vid trombocytaggregation. Mindre än 1 % av patienterna med trombocytopeni upplever trombos på grund av endotelskada
celler och aktivering av blodplättar av antikroppar mot heparin-faktor 4-komplexet. Detta tillstånd kräver utsättande av heparin och utnämning av antikoagulantia som inte orsakar trombocytopeni: danaparoid** och lepirudin**.
Vid långvarig administrering av heparin (mer än 3 månader) kan osteoporos utvecklas. Detta är särskilt viktigt att tänka på vid förskrivning av heparin under graviditet. Hyperkalemi associerad med hämning av aldosteronsyntes i binjurarna är en ganska sällsynt komplikation av heparinbehandling.
Lågmolekylära (fraktionerade) hepariner består av heparinfragment med en molekylvikt från 1000 till 10 000 D (i genomsnitt 4000-5000 D). De erhålls genom fraktionering, hydrolys eller depolymerisation av konventionellt (ofraktionerat) heparin. Dessa läkemedel, som heparin, verkar på koagulationsfaktorer genom antitrombin III, men skiljer sig från heparin i följande egenskaper:
De hämmar aktiviteten av faktor Xa i större utsträckning än faktor IIa (3-4 gånger);
De har större biotillgänglighet när de administreras subkutant (hepariner med låg molekylvikt - cirka 90%, standardheparin - 20%);
De verkar under en längre tid, vilket gör att de kan administreras 1-2 gånger om dagen;
De har mindre affinitet för trombocytfaktor 4, så de är mindre benägna att orsaka trombocytopeni än standardheparin;
Mindre vanligt orsaka osteoporos.
I hushållspraxis används följande preparat av lågmolekylära hepariner: en o x a parinnatrium (Clexane *), nadroparin kalcium (Fraxiparin *), d alte parin natrium (Fragmin *), reviparinnatrium (klivarin*). Dessa läkemedel är heterogena i sin sammansättning (innehåller olika fraktioner av heparin), därför skiljer de sig något från varandra i fysikalisk-kemiska, farmakokinetiska egenskaper och aktivitet.
Hepariner med låg molekylvikt används för att förebygga och behandla djup ventrombos (särskilt efter operation), för att förhindra lungemboli, samt för instabil angina och hjärtinfarkt. Heparinpreparat med låg molekylvikt är indikerade för profylax
tics och terapi av trombos i obstetrisk praktik. Administreras endast subkutant. Dosering ges i ME (internationella enheter).
Hepariner med låg molekylvikt, som ofraktionerade heparinpreparat, kan orsaka blödningar. Under de första dagarna av behandlingen är måttlig trombocytopeni möjlig. Hepariner med låg molekylvikt ökar i vissa fall aktiviteten av leverenzymer och kan orsaka allergiska reaktioner. Protaminsulfat eliminerar inte helt effekterna av lågmolekylära hepariner.
Nyligen har läkemedlet fo n d a p a - natrium rinux - en syntetisk pentasackarid, som genom att binda till antitrombin III påskyndar inaktiveringen av faktor Xa, dykt upp i klinisk praxis. Läkemedlet produceras i form av ett natriumsalt och används för att förebygga venös trombos och lungemboli vid ortopedisk kirurgi.
Heparinoider- sulfaterade glykosaminoglykaner, strukturellt besläktade med hepariner. Liksom heparin förstärker de den hämmande effekten av antitrombin III på blodkoagulationsfaktorer. I många viktiga egenskaper skiljer de sig från heparin och lågmolekylära hepariner, så de klassificeras i en speciell grupp. Danaparoid* och sulodexid tillhör denna grupp. Dessa läkemedel erhålls från tarmslemhinnan hos grisar.
Danaparoid** (organon**) innehåller en blandning av heparansulfat, dermatansulfat och kondroitinsulfat. Danaparoid p hämmar faktor Xa mer signifikant än protrombin. Läkemedlet administreras subkutant för förebyggande och behandling av venös trombos. Danaparoid p binder inte till trombocytfaktor 4 och orsakar inte trombocytopeni. Därför är det indicerat i fall där heparinbehandling kompliceras av trombocytopeni.
Sulodexid (Wessel Due F*) består av en blandning av heparansulfat och dermatansulfat. Sulodexid minskar till stor del aktiviteten av faktor Xa, med liten effekt på protrombin. Läkemedlet ökar fibrinolytisk aktivitet, har en skyddande effekt på det vaskulära endotelet och har hypolipidemiska egenskaper. Sulodexid är indicerat för perifera kärlsjukdomar med ökad risk för trombos. Det finns beredningsformer av läkemedlet för parenteral (intravenös och intramuskulär) administrering och för oral administrering.
Antitrombin IIInödvändiga för den antikoagulerande effekten av heparin, lågmolekylära hepariner och heparinoider.
Vid ärftlig brist på antitrombin III används dess läkemedel och administreras intravenöst. Vid långvarig användning av heparin ökar konsumtionen av antitrombin III, så dess koncentration i blodet minskar markant. Detta minskar effektiviteten av heparinbehandling. I sådana fall administreras även antitrombin III.
Hirudin- ett protein med en molekylvikt på 7 kDa, först upptäckt i spottkörtlarna hos medicinska blodiglar Hirudo medicinalis. Hirudin, liksom heparin, är ett antikoagulant som verkar direkt i blodet, men till skillnad från heparin hämmar hirudin trombin direkt: det binder selektivt till det och inaktiverar det utan deltagande av antitrombin III. Hämning är irreversibel. Till skillnad från heparin har hirudin förmågan att hämma trombin i samband med blodproppen och därmed fördröja tillväxten av blodproppen. Hirudin interagerar inte med trombocytfaktor 4 och orsakar därför inte trombocytopeni.
En rekombinant beredning av hirudin - le p i r u d i n * (refludan *) erhölls för klinisk användning. Det rekommenderas att användas för att förhindra möjliga tromboemboliska komplikationer vid trombocytopeni orsakad av heparin. Lepirudin* administreras intravenöst. Blödning kan uppstå under användning. Det finns ingen specifik motgift för hirudinpreparat.
Drotrecogin alfa (Zigris*) är ett rekombinant preparat av aktiverat protein C. Det hämmar bildningen av trombin, vilket orsakar proteolytisk inaktivering av blodkoagulationsfaktorerna VIIIa och Va. Dessutom ökar drotrecogin den fibrinolytiska aktiviteten av blodplasma, vilket minskar mängden plasminogenaktivatorhämmare typ 1 som cirkulerar i blodet. Närvaron av antiinflammatorisk aktivitet i läkemedlet är förknippat med dess hämmande effekt på frisättningen av tumörnekrosfaktor alfa. från monocyter. Alla dessa egenskaper hos drotrecogin bestämmer dess effektivitet vid behandling av septisk chock (inflammation och ökad blodkoagulering är huvudsymtomen på detta tillstånd). Liksom andra antikoagulantia kan läkemedlet orsaka hemorragiska komplikationer.
Indirekta antikoagulantia
Dessa läkemedel, till skillnad från heparin, påverkar inte koaguleringsfaktorer direkt i blodet. De hämmar syn-
syntes i levern av blodplasmaproteiner beroende på vitamin K - faktor II (protrombin), faktorer VII, IX och X (se fig. 27-5). Vitamin K är nödvändigt för bildandet av funktionellt värdefulla faktorer, eftersom det fungerar som ett koenzym i reaktionen av y-karboxylering av glutaminsyrarester. Den reducerade formen av vitamin K, hydrokinon, uppvisar koenzymaktivitet. Under karboxylering oxideras vitamin K-hydrokinon för att bilda inaktiv vitamin K-epoxid. Indirekta antikoagulantia förhindrar omvandlingen (reduktionen) av inaktiv vitamin K-epoxid till aktiv vitamin K-hydrokinon av epoxidreduktas och DT-diaforas, vilket hämmar dessa enzymer. Därför klassificeras de som vitamin K-antagonister (Fig. 27-6).

Ris. 27-6.Verkningsmekanismen för vitamin K och indirekta antikoagulantia
Indirekta antikoagulantia minskar inte omedelbart koncentrationen av koagulationsfaktorer i blodet. Deras handling kännetecknas av en latent period. Således når den antikoagulerande effekten av acenocoumarol sitt maximala värde efter 48 timmar eller mer. Denna långsamma utveckling av effekten förklaras av det faktum att när dessa läkemedel administreras, cirkulerar fullfjädrade koagulationsfaktorer fortfarande i blodet under en tid (hastigheten för insättande av effekten bestäms av den tid under vilken koagulationsfaktorerna av protrombinkomplexet bryts ned). Effekten av indirekta antikoagulantia varar cirka 2-4 dagar, läkemedlen kan ackumuleras.

Indirekta antikoagulantia används för långtidsprevention och behandling av trombos och tromboembolism (djup ventrombos, lungemboli, tromboemboliska komplikationer vid förmaksflimmer, hjärtinfarkt, hjärtklaffsersättning), i kirurgisk praktik för att förhindra trombosbildning under den postoperativa perioden. Gick in. Behandlingen utförs under obligatorisk övervakning av nivån av protrombin i blodplasman genom att bestämma protrombintiden - en indikator vars värde beror på innehållet av protrombin i blodet och faktorerna IX och X.
De vanligaste komplikationerna vid användning av indirekta antikoagulantia är blödning. Risken för blödning ökar vid samtidig användning av acetylsalicylsyra * och andra trombocythämmande medel. För att stoppa blödningar orsakade av indirekta antikoagulantia bör vitamin K1-preparat och protrombinkomplexkoncentrat (innehåller faktor II, VII, IX och X) administreras. Andra biverkningar är möjliga: allergiska reaktioner, diarré, leverdysfunktion, hudnekros. Indirekta antikoagulantia är kontraindicerade under graviditeten: de penetrerar moderkakan och kan ha en teratogen effekt (störa skelettets bildning, eftersom
hämma bildningen av osteokalcin, ett vitamin K-beroende benprotein). Fenindion (fenilin*) kan orsaka hämning av hematopoiesen.
27.2.2. Blodkoaguleringsmedel
Läkemedel som ökar blodkoagulationen används för att stoppa blödningar, så de klassificeras som hemostatiska medel (hemostatika) eller antihemorragiska medel. Denna grupp inkluderar ämnen som är nödvändiga för bildandet av blodkoaguleringsfaktorer (vitamin K-preparat) och preparat av själva koaguleringsfaktorerna.
Vitamin K-preparat
Vitamin K finns i två former - vitamin K 1 (fyllokinon), som finns i växter, och vitamin K 2 - en grupp föreningar (menakinoner) som syntetiseras av mikroorganismer (särskilt människans tarmmikroflora). Vitaminerna K 1 och K 2 är fettlösliga föreningar, derivat av 2-metyl-1,4-naftokinon, som skiljer sig i längden och karaktären på sidokolkedjan. Vitamin K j erhålls syntetiskt, dess framställning är känd som fytomenadion. En vattenlöslig prekursor för vitamin K, 2-metyl-1,4-naftokinon (menadion), har syntetiserats, som har provitaminaktivitet. Denna förening kallades vitamin K 3 . Ett derivat av vitamin K 3 - menadionnatriumbisulfit - används i medicinsk praxis under namnen b och k a - sol *.
Vitamin K är nödvändigt för syntesen i levern av protrombin (faktor II) och blodkoagulationsfaktorerna VII, IX och X, samt proteinerna C och S. Vitamin K är känt för att delta i syntesen av benvävnadsproteinet osteokalcin.
Strukturen hos alla vitamin K-beroende proteiner har ett gemensamt drag: dessa proteiner innehåller γ-karboxyglutaminsyrarester som binder Ca 2+ joner. Vitamin K-hydrokinon fungerar som ett koenzym i y-karboxyleringsreaktionen av glutaminsyrarester (se fig. 27-6). Vid vitamin K-brist uppstår inaktiva prekursorer till blodkoagulationsfaktorer som inte kan binda Ca 2+. K-vitaminbrist i kroppen leder snabbast till försämrad hemokoagulering. Därför den viktigaste
och de tidigaste manifestationerna av vitamin K-brist är blödningar och blödningar.
Vitamin K-preparat används för att förhindra och stoppa blödningar och andra blödningskomplikationer orsakade av vitamin K-brist i kroppen, till exempel hemorragiskt syndrom hos nyfödda. Vitamin K-brist hos nyfödda kan orsakas av både otillräckligt intag av vitamin K 1 och frånvaron av tarmmikroflora som syntetiserar vitamin K 2 . För att förhindra sådana komplikationer rekommenderas profylaktisk administrering av vitamin K 1 till nyfödda under de första timmarna av livet.
Vitamin K-preparat är indicerade för minskad absorption av vitamin K i tarmen på grund av försämrad gallsekretion vid obstruktiv gulsot (galla är nödvändig för absorption av fettlösligt vitamin K) eller vid malabsorptionssyndrom (för sprue, enterokolit, Crohns sjukdom, etc.) .)
Vitamin K 1-preparat är effektiva för blödningar orsakade av indirekta antikoagulantia. De administreras oralt och intravenöst långsamt.
Vitamin K-preparat kan orsaka allergiska reaktioner (utslag, klåda, erytem, bronkospasm). Vid intravenös administrering finns risk för anafylaktoida reaktioner. Vid användning av vitamin K 3-preparat (Vikasol*) till nyfödda finns det risk att utveckla hemolytisk anemi och hyperbilirubinemi.
Koaguleringsfaktorpreparat
Behovet av sådana läkemedel uppstår när en eller flera blodkoagulationsfaktorer är bristfälliga.
Antihemofil blodkoagulationsfaktor VIII (hemophil M*, immunat*, etc.) är ett torrt koncentrat av faktor VIII. Läkemedlen erhålls från donatorblodplasma som har genomgått dubbel virusinaktivering och är standardiserade efter innehållet av faktor VIII. De är mer aktiva och säkrare än kryoprecipitat*.
Kryoprecipitat* är ett koncentrat av blodplasmaproteiner, vilket inkluderar faktor VIII, von Willebrand-faktor, fibronektin, samt i mindre utsträckning andra blodkoagulationsfaktorer och små mängder fibrinogen.
Läkemedlen ges intravenöst vid ärftlig (blödarsjuka A) och förvärvad faktor VIII-brist. Kryopfällning*,
Dessutom används det för ersättningsterapi för von Willebrands sjukdom (ärftlig brist på von Willebrand-faktor) och afibrinogenemi. Vid administrering är biverkningar möjliga i form av takykardi, arteriell hypotoni, andfåddhet, allergiska reaktioner (urtikaria, feber, anafylaktisk chock) såväl som hemolys av röda blodkroppar.
Alla koagulationsfaktorpreparat erhållna från blodplasma har en betydande nackdel - möjligheten att överföra virusinfektioner (HIV, hepatit). För närvarande har rekombinanta preparat av faktor VIII och von Willebrand faktor erhållits, vars användning minskar risken för infektion.
Förutom koagulationsfaktorläkemedel, för milda former av hemofili A och von Willebrands sjukdom, används argininvasopressinanalogen desmopressin. Desmopressin ökar innehållet av von Willebrand-faktor i blodplasman, främjar dess frisättning från endotelceller och ökar faktorns aktivitet
VIII. Läkemedlet administreras parenteralt.
Blodkoagulationsfaktor IX (agemphil B*, immunin*, oktanin*) är en renad fraktion av human plasma berikad med faktor IX. Används för medfödd (blödarsjuka B) och förvärvad brist på faktor IX, samt för överdosering av indirekta antikoagulantia. Biverkningar är desamma som för faktor VIII-läkemedel.
Eptacog alfa aktiverad (novoseven *) är en rekombinant blodkoagulationsfaktor VIIa. Används för brist på faktor VII och andra koagulationsfaktorer (V, II,
IX, X).
Lokalt, för att stoppa blödningar från små kapillärer och parenkymala organ, används läkemedlet thrombina (erhållen från donatorblodplasma), samt hemostatiska svampar (kollagen, gelatin).
För att stoppa livmoder-, lung-, njur-, tarm- och andra blödningar används medicinalväxtpreparat: nässelblad, rölleka, pepparknutört, knottört, viburnumbark, arnicablommor, berusande lagochilus. Medicinalväxter används i form av infusioner, tinkturer och extrakt internt och topiskt.
27.3. DROGER SOM PÅVERKAR FIBRINOLYS
När blodproppar bildas aktiveras det fibrinolytiska systemet, vilket säkerställer upplösning (lys) av fibrin och förstörelse av blodproppen. Detta leder till återställandet av normalt blodflöde.
Under fibrinolysprocessen omvandlas inaktivt plasminogen till plasmin (fibrinolysin) med deltagande av plasminogenaktivatorer. Plasmin hydrolyserar fibrin för att bilda lösliga peptider. Plasmin har ingen specificitet och orsakar även förstörelse av fibrinogen och vissa andra blodkoaguleringsfaktorer, vilket ökar risken för blödning. Plasmin som cirkulerar i blodet inaktiveras snabbt av α 2 -antiplasmin och andra hämmare, och har därför normalt ingen systemisk fibrinogenolytisk effekt. Under vissa patologiska tillstånd eller användning av fibrinolytiska medel är dock överdriven aktivering av plasmaplasminogen möjlig, vilket kan orsaka blödning.
27.3.1. Fibrinolytiska (trombolytiska) medel
Fibrinolytiska medel används för att lösa upp blodproppar vid kranskärlstrombos (akut hjärtinfarkt), djup ventrombos, akut trombos i perifera artärer och lungemboli.
Som fibrinolytiska medel används läkemedel som aktiverar plasminogen: streptokinasläkemedel, vävnadsplasminogenaktivatorläkemedel, urokinasläkemedel.
Streptokinasläkemedel
Streptokinas (cabikinas *) är ett höggradigt renat proteinpreparat erhållet från en kultur av β-hemolytiska streptokocker. Streptokinas förvärvar proteolytisk aktivitet endast i kombination med plasminogen. När streptokinas administreras bildas ett ekvimolärt streptokinas-plasminogenkomplex som omvandlar plasminogen till plasmin. Streptokinas verkar på plasminogen både i blodproppen och i blodplasman (fig. 27-7).
Streptokinas administreras intravenöst vid akut hjärtinfarkt orsakad av trombos i kranskärlen (de flesta
effektiv under de första 3-6 timmarna), för djup ventrombos, lungemboli och retinal vaskulär trombos. Streptokinas doseras vid ME (internationella enheter).
Frekventa komplikationer vid användning av streptokinas är blödning, som kan associeras både med aktiveringen av plasminogen som cirkulerar i blodet (det resulterande plasminet förstör fibrinogen, vilket resulterar i minskad trombocytaggregation), och med upplösningen av fysiologiska blodproppar. Illamående, kräkningar och arteriell hypotoni är möjliga. På grund av närvaron av antigena egenskaper kan streptokinas orsaka allergiska reaktioner, inklusive anafylaktisk chock. Deras fara ökar med upprepad administrering av läkemedlet. Antikroppar som cirkulerar i blodet kan inaktivera streptokinas och minska behandlingens effektivitet.
Anistreplase ** (eminas**) är ett komplex av streptokinas med acylerat lysinplasminogen. Acylgruppen i plasminogenmolekylen stänger det katalytiska stället, vilket förhindrar aktiveringen av plasminogen. Läkemedlet är en prodrug och förvärvar förmågan att omvandla plasminogen till plasmin först efter klyvningen av acylgruppen. Hastigheten för deacylering och därför tiden för bildning av det aktiva läkemedlet beror på acylgruppens natur och kan variera från 40 minuter till flera timmar. Anistreplase** administreras intravenöst. Efter en enda injektion varar den fibrinolytiska effekten 4-6 timmar. Indikationer för användning och biverkningar är desamma som för streptokinas.
Vävnadsplasminogenaktivator och urokinaspreparat
Vävnadsplasminogenaktivator och urokinas är de huvudsakliga fysiologiska plasminogenaktivatorerna.
Vävnadsplasminogenaktivator produceras av endotelceller. Det orsakar partiell proteolys av plasminogen, vilket resulterar i dess omvandling till plasmin. En utmärkande egenskap hos vävnadsaktivatorn är dess höga affinitet för fibrin, vilket accelererar dess effekt på plasminogen hundratals gånger. Som ett resultat aktiverar vävnadsaktivatorn i en högre hastighet de plasminogenmolekyler som adsorberas på fibrinfilament. Sålunda begränsas verkan av vävnadsplasminogenaktivator av trombusfibrin. Att komma in i blodomloppet,

Ris. 27-7.Verkningsmekanism för fibrinolytiska medel: tPA - vävnadsplasminogenaktivator; FDP - fibrinogennedbrytningsprodukter; EC - endotelcell; ? - aktivering; Θ - lys
vävnadsaktivatorn binder till en specifik hämmare, därför har den liten effekt på plasminogen som cirkulerar i blodet och minskar fibrinogennivåerna i mindre utsträckning.
Rekombinanta preparat av vävnadsplasminogenaktivator har erhållits för klinisk användning: alteplas (aktilysera *) och tenecteplas (metallisera *). Läkemedlen administreras intravenöst för akut hjärtinfarkt orsakad av trombos i kranskärlen (effektiv under de första 6-12 timmarna), för lungemboli. Trots det faktum att alteplas har liten effekt på plasminogen som cirkulerar i blodet, uppstår ofta blödningskomplikationer med dess användning. Det har inga antigena egenskaper. Tenecteplase har ökad specificitet för trombusfibrin.
Urokinas produceras av njurceller och finns i urinen. I njurarna bildas enkelkedjigt urokinas (prourokinas), som under påverkan av plasmin omvandlas till den aktiva formen - dubbelkedjigt urokinas. Dubbelkedjigt urokinas har en direkt aktiverande effekt på plasminogen (bildning av ett komplex med plasminogen krävs inte). Det dubbelkedjiga urokinaspreparatet erhålls från en kultur av humana embryonala njurceller. Används för akut hjärtinfarkt, venös och arteriell trombos, lungemboli. Administreras intravenöst. Doserad i ME. Jämfört med vävnadsplasminogenaktivator verkar urokinas i större utsträckning på plasminogen som cirkulerar i blodet, vilket gör att plasmin som bildas i blodet orsakar nedbrytningen av fibrinogen (se fig. 27-7). Samtidigt minskar trombocytaggregationen och fibrinogennedbrytningsprodukter bildas som har antikoagulerande aktivitet. De huvudsakliga biverkningarna är blödning. Har inga antigena egenskaper.
En rekombinant beredning av enkelkedjigt urokinas (prourokinas) - c a p u p la z a * - erhölls, som uppvisar större specificitet för trombfibrin än urokinas.
27.3.2. Antifibrinolytiska medel
Antifibrinolytiska läkemedel används för att stoppa blödningar orsakade av ökad aktivitet i det fibrinolytiska systemet under skador, kirurgiska ingrepp, förlossning,
leversjukdomar, prostatit, menorragi, samt överdosering av fibrinolytiska läkemedel. För dessa ändamål används läkemedel som hämmar plasminogenaktivering eller är plasminhämmare.
Aminokapronsyra binder till plasminogen och förhindrar dess omvandling till plasmin. Dessutom stör det effekten av plasmin på fibrin. Läkemedlet administreras oralt och intravenöst. Möjliga biverkningar: arteriell hypotoni, bradykardi, arytmier, yrsel, illamående, diarré. Aminometylbensoesyra (Ambene*, Pamba*) har en liknande effekt.
Tranexamsyra (tranexam*, cyklokapron*) hämmar plasminogenaktivering. Läkemedlet administreras oralt och intravenöst. Det är effektivare än aminokapronsyra och håller längre. Biverkningar inkluderar dyspeptiska symtom (anorexi, illamående, kräkningar, diarré), yrsel, dåsighet; allergiska hudreaktioner är möjliga.
Aprotinin (Gordox*, Contrical*, Trasylol*, Ingitril*) hämmar plasmin och andra proteolytiska enzymer. Läkemedlet administreras intravenöst. Biverkningar: arteriell hypotoni, takykardi, illamående, kräkningar, allergiska reaktioner.
Blodplättar, de minsta blodkropparna (jämfört med leukocyter och röda blodkroppar), utför den viktigaste funktionen - de skyddar kroppen från blodförlust. Trombocytaggregation är processen där celler limmas ihop, det inledande skedet av blodproppbildning.
Det andra steget är fastsättningen av blodplättar till väggen på det skadade kärlet. Fibrintrådar, andra element och nya vidhäftande celler läggs på blodplättsmassan. Således växer tromben till en storlek som kan blockera kärlets diameter och stoppa blödningen. Ibland beror en persons liv på processens hastighet.
Trombocytaggregationens roll i processen för blodkoagulering
Blodkoagulering beror på många faktorer. En av dem, trombocytaggregation, i en frisk kropp är av skyddande adaptiv natur. Celler håller ihop endast i ett blödande kärl. I det här fallet spelar processen en positiv roll.
Men det finns kända patologiska tillstånd där bildandet av blodproppar är oönskat, eftersom det leder till avbrott i näringen av vitala organ. Till exempel med hjärtinfarkt, stroke, trombos av ledande artärer. Aggregeringsaktiviteten hos blodplättar tar sidan av patologiska förändringar. Du måste kämpa mot det med hjälp av olika mediciner.
Det finns ett praktiskt behov av att kvantifiera bra och dålig trombocytaggregation. För att göra detta måste du använda normen och särskilja avvikelser.
Hur bestämmer man normalitet och patologi?
Kan ett blodprov visa en viss persons trombocytaggregationsförmåga? När allt kommer omkring, för att genomföra studien, tas blod från en ven, och från det ögonblicket verkar inte kroppens "order" på blodkropparna. Denna typ av analys kallas "in vitro", en bokstavlig översättning från latin "på glas, i ett provrör". Forskare försöker alltid studera reaktionen under förhållanden nära människokroppen. Endast data som erhållits på detta sätt kan anses tillförlitliga och användas i diagnostik.
Trombocytförmågor bestäms av inducerad aggregation. Det innebär att ämnen som inte är främmande för kroppen i kemisk sammansättning och som kan orsaka blodproppar används som induktorsubstans. Komponenter i kärlväggen används som inducerare: adenosindifosfat (ADP), ristocetin (ristomycin), kollagen, serotonin, arakidonsyra, adrenalin.
Spontan aggregation bestäms utan inducerare.
Kvantifieringstekniker bygger på att ljusvågor passerar genom blodplättsrik blodplasma. Graden av aggregationsaktivitet studeras genom skillnaden i plasmans ljusdensitet före koagulationsstart och efter att maximalt resultat erhållits. Aggregeringshastigheten under den första minuten, vågornas natur och form bestäms också.
Hastigheten beror på induktorsubstansen och dess koncentration.
Trombocytaggregation med ADP ordineras och bedöms vanligtvis i kombination med kollagen, ristomycin och adrenalin.
Normen för analys med ADP är från 30,7 till 77,7 %. Mängden blodplättsaggregation med adrenalin varierar från 35 till 92,5 %. I en studie med kollagen anses normala värden vara från 46,4 till 93,1%.
Regler för att förbereda analys
För att ta ett blodprov för aggregationsförmåga måste du förstå att testet kommer att vara felaktigt om förberedelsereglerna bryts. Det kommer att finnas ämnen i blodet som påverkar resultatet.
- En vecka innan bloddonation bör alla aspirinläkemedel, Dipyridamol, Indometacin, Sulfapyridazin och antidepressiva avbrytas. Användningen av dessa läkemedel hämmar (undertrycker) trombbildning. Om du inte kan sluta ta det, bör du informera laboratorieteknikern.
- Du bör inte äta på minst 12 timmar.
- Patienten ska vara så lugn som möjligt och inte utföra fysiskt arbete.
- En dag innan, uteslut kaffe, alkohol, vitlök från maten och rök inte.
- Analysen utförs inte om det finns en aktiv inflammatorisk process.
Klumpade blodplättar är synliga under ett mikroskop
Ett blodprov för trombocytaggregation ordineras av en läkare om behandling med antikoagulantia är nödvändig, övervakning av deras effektivitet, val av optimal dos för att diagnostisera ökad blödning.
Avkodning av resultaten
Skälen till att genomföra studier med tre standardinducerare samtidigt, och, om nödvändigt, lägga till nya, är den dominerande mekanismen för aktivering av en av koagulationsfaktorerna. Den identifierade förändrade normen, till exempel med ADP i frånvaro av dynamik med andra induktorer, har diagnostisk betydelse. Resultaten bedöms av en läkare.
Minskad trombocytaggregation kan orsakas av:
- framgångsrik användning av trombocythämmande terapi;
- en grupp sjukdomar som kallas trombocytopati.

Aggregationsanalysapparat
Trombocytopatis roll
Trombocytopatier kan vara ärftliga eller förvärvade till följd av andra sjukdomar. Statistik säger att upp till 10% av planetens befolkning lider av denna patologi. Alla av dem är förknippade med dysfunktion av blodplättar i ackumuleringen av vissa ämnen.
Som ett resultat uppstår inte koagulering och bildandet av blodproppar, vilket leder till ökad blödning i små sår och blåmärken (inre blödningar).
Sjukdomar uppträder redan i barndomen med blödande tandkött, frekventa näsblod, många blåmärken på barnets kropp, svullnad av lederna på grund av blåmärken. Under puberteten börjar flickor få långa och tunga menstruationer. Blödning leder till utvecklingen av anemi (anemi).
Låg aggregationskapacitet vid trombocytopati kan aktiveras av virus- och bakterieinfektioner, mediciner och fysioterapeutiska procedurer.

Näsblod i 80 % av fallen orsakas av trombocytopati och endast 20 % av sjukdomar i ÖNH-organen
Sekundära trombocytopatier
Symtomatiska (sekundära) trombocytopatier bildas vid kronisk leukemi, myelom,. Detta tillstånd är typiskt för slutskedet av njursvikt (uremi), nedsatt sköldkörtelfunktion.
Kirurger stöter på trombocytopati när det finns ökad blödning under kirurgiska ingrepp.
En ökning av trombocytaggregationen observeras med:
- utbredd vaskulär ateroskleros;
- hypertoni;
- infarkt av inre organ;
- trombos i bukartärerna;
- stroke;
- diabetes mellitus
Förändringar i aggregation under graviditeten
Trombocytaggregationen under graviditeten kan avvika från normala värden.
Aggregation minskar på grund av otillräcklig produktion av blodplättar eller en kränkning av deras kvalitativa sammansättning. Detta manifesteras av blödning och blåmärken. Under förlossningen måste möjligheten för massiv blödning beaktas.
Aggregering ökar oftast under toxikos på grund av vätskeförlust på grund av kräkningar och diarré. En ökning av blodkoncentrationen leder till ökad trombbildning. Detta kan leda till tidigt missfall. Måttlig hyperaggregation anses vara normal under graviditet och är associerad med utvecklingen av placentacirkulationen.
- vid missfall;
- infertilitetsbehandling;
- före och under användning av preventivmedel;
- innan en planerad graviditet.
Analys av trombocytaggregationsegenskaper gör att vi kan identifiera risker, förutsäga farliga komplikationer under sjukdomar och omedelbart utföra förebyggande behandling.
Blodplättar är blodkroppar som inte har någon färg. De utför en viktig funktion i kroppen och skyddar den från blodförlust. Denna process är trombocytaggregation i blodet, den har sina egna standardindikatorer.
För att förstå vad det är måste du ha en uppfattning om bildandet av en blodpropp, befintliga standarder och risken för avvikelser från normala värden.
Beskrivning och roll i människokroppen
Efter vävnadsskada fäster blodplättarna på väggarna i det skadade kärlet. Som ett resultat håller cellerna ihop. Med tiden läggs fibrintrådar, nya limmade celler och andra element till den resulterande massan.
Mot denna bakgrund växer en blodpropp, som når stora storlekar, vilket kan leda till blockering av kärlet och stoppa blödningen. Hastigheten för en sådan process är mycket viktig, eftersom bevarandet av mänskligt liv ibland beror på det.

Blodkoagulering påverkas av ett stort antal faktorer. En av dem är aggregering. I frånvaro av patologiska tillstånd utför den en skyddande adaptiv funktion.
Aggregationsegenskaper består i limning av celler endast i det skadade kärlet. I det här fallet anses processen vara positiv.
.jpg)
Det finns dock situationer där trombos är oönskat. Till exempel om en stroke eller hjärtinfarkt diagnostiseras.
Detta förklaras av det faktum att bildandet av blodproppar förhindrar det normala flödet av nödvändiga ämnen till vitala organ.
I det här fallet tar blodplättar sidan av patologiska processer. Avvikelser från normen kan endast hanteras med hjälp av mediciner.
För att identifiera normala från onormala indikatorer är det nödvändigt att utföra kvantitativ analys av positiv och negativ aggregering.
Typer
I medicinsk praxis finns det en viss klassificering av aggregering efter typ. Dessa inkluderar:

- Måttlig aggregering. Det diagnostiseras främst under graviditeten. Tillståndet kan utlösas av placentacirkulationen.
- Spontan aggregering. En induktor krävs inte för detektering. För att upptäcka aggregationsaktivitet hälls blod i ett provrör, som placeras i en speciell anordning, där det värms upp till 37 grader.
- Inducerad aggregering. För att genomföra studien läggs induktorer till plasmat. I detta fall sker aggregering med ADP, kollagen, ristomycin och adrenalin. Denna metod används i fall där det är nödvändigt att diagnostisera vissa patologier i blodvätskan.
- Ökad aggregation främjar bildandet av blodproppar. De karakteristiska symptomen på detta patologiska tillstånd är domningar och svullnad.
- Minskad aggregation upptäcks oftast i fall av störningar i cirkulationssystemets funktion. En minskning av antalet blodplättar framkallar olika blödningar. Det förekommer i det vackra könet under menstruationscykeln.
Både ökad och minskad aggregering är farliga för människors hälsa. Därför bör nivån av blodplättar i blodet övervakas regelbundet.
Symtom på avvikelser från indikatorer
Hyperaggregation åtföljs av ökad blodviskositet och en minskning av dess flödeshastighet, vilket negativt påverkar alla mänskliga system och organ.
Det finns dock patologiska tillstånd när uttalad aggregering är ett normalt fenomen, vilket i sin tur inte anses vara en anledning att vägra konstant studie av koagulationsindikatorer.
Sådana sjukdomar inkluderar:
- ökat blodtryck;
- diabetes;
- cancer;
- vaskulära patologier.
Otidig upptäckt av hyperaggregation och brist på hjälp kan leda till utveckling av hjärtinfarkt, stroke och ventrombos.
En minskning av aggregationsindikatorer åtföljs av långvarig blödning, inklusive inre blödning, som manifesteras av bildandet av hematom.
Vad är normalt
Trombocytnivånormerna hos en vuxen och ett barn kommer att vara något olika. De optimala värdena för indikatorerna presenteras i tabellen nedan.
Om vi pratar om normala aggregeringsvärden så blir det 25-75 procent. I det här fallet håller blodplättarna ihop utan avvikelser och utgör inte ett hot mot människokroppen.
Vilken forskning bedrivs?
Blodplättsaggregationsanalysatorn är ett komplett blodvärde. Det finns dock andra studier som ger mer exakta resultat. De viktigaste metoderna inkluderar följande tester:
.jpg)
- enligt Lee-White;
- koagulogram.
Deras väsen ligger i det faktum att speciella ämnen läggs till blodet som hämmar aggregation.
Dessa komponenter liknar ämnen som finns i människokroppen, som provocerar blodproppar. Sådana komponenter kallas induktorer.
Förbereder för analys
Innan du gör analysen måste du genomgå en del förberedelser. För att resultaten ska bli så exakta som möjligt bör blodvätskan inte innehålla ämnen som kan ha en negativ effekt på den.
Förberedande aktiviteter:
- En vecka före analysen är vissa aspirinläkemedel uteslutna, eftersom deras användning undertrycker trombbildning. Om det inte är möjligt att avbryta dessa mediciner ska laboratorieteknikern som genomför studien meddelas.
- Du måste sluta äta mat i 12 timmar. Produkter, särskilt de med hög fetthalt, påverkar också resultatet negativt.
- Undvik fysisk och känslomässig stress.
- Under dagen, ta inte alkoholhaltiga drycker, kaffe, vitlök eller rök.
Analysen skjuts upp om det finns en aktiv inflammatorisk process.
Utföra
Blodprov tas på morgonen, mellan klockan 7 och 10. Studien kan endast utföras på fastande mage. Det är tillåtet att dricka stillastående vatten.
För att utföra en hemotest tas blodvätska från en ven. En engångsspruta används för dessa ändamål. Därefter placeras materialet i en aggregometer innehållande en 4% natriumcitratlösning. Sedan vänds behållaren flera gånger. Därefter skickas blodröret till laboratoriet för vidare testning.
Avkodning av resultaten
Med hänsyn till det ämne som användes under studien dechiffreras analysen. För att göra detta jämförs de erhållna indikatorerna med de normala värdena, som presenteras nedan.
Om en ökning i förhållande till det normala observeras, diagnostiseras hyperaggregation. Det kan uppstå under patologiska tillstånd som:
.jpg)
- leukemi;
- patologier i mag-tarmkanalen eller njurarna;
- ateroskleros;
- diabetes;
- högt blodtryck;
- sepsis;
- lymfogranulomatos.
Om avvikelserna är nedåt, diagnostiseras hypoaggregation. Det kan orsakas av blodpatologier eller behandling med trombocythämmande medel.
Procentandelen visar nivån av ljustransmittans hos plasman efter att induktorsubstansen tillsatts till den. Om trombocytantalet är lågt är denna indikator 100 procent, och om den är hög är den noll.
Funktioner av aggregering hos gravida kvinnor
Under graviditeten tillåts avvikelser från normen, som under denna period sträcker sig från 30 till 60 procent.
Disaggregation kan observeras när det finns en brist på blodplättar, såväl som om det finns en förändring i deras kvalitativa sammansättning, vilket manifesteras av blödning och blåmärken.
Ökad aggregering uppstår under toxicos, när patienten upplever en stor förlust av vätska till följd av kräkningar eller diarré. En ökning av blodkoncentrationen framkallar ökad bildning av blodproppar. Detta hotar tidigt missfall.
Hur kan man normalisera värden?
Om en blodvätskekoaguleringsstörning diagnostiseras är det nödvändigt att omedelbart vidta åtgärder för att eliminera det patologiska tillståndet. En ökning av aggregationen kan leda till trombos, och en minskning kan leda till kraftiga och farliga blödningar.
I de inledande stadierna av hyperaggregationsutveckling ordinerar specialister mediciner som kan tunna ut blodet. Vanligt aspirin kan klara uppgiften.
Baserat på resultaten av en ytterligare undersökning ordineras ofta följande:
.jpg)
- smärtstillande medel;
- novokainblockad;
- läkemedel som främjar vasodilatation;
- antikoagulantia, som förhindrar snabb koagulering.
Ibland är traditionella metoder inte mindre effektiva. Det är värt att komma ihåg att sådan behandling måste överenskommas med den behandlande läkaren.
Bland de beprövade recepten finns följande:
- Häll en matsked sötklöver i 200 ml kokt vatten och låt det brygga i 30 minuter. Använd den beredda blandningen om dagen i flera doser. Terapiförloppet är en månad.
- Brygg en och en halv liter kokande vatten i lika stora mängder (en tesked) ingefära och grönt te. Tillsätt en nypa kanel. Låt stå i en kvart och ta hela dagen.
- Drick färskpressad apelsinjuice varje dag. Kan blandas i lika delar med pumpa.
Det är också viktigt att behålla rätt näring. Dieten bör innehålla:
- citrus;
- ingefära;
- vitlök;
- röda och gröna grönsaker;
- skaldjur.
Om du har dålig blodpropp bör du inte ta mediciner. som tunnar ut blodvätskan. Om processens gång har fått en avancerad form, utförs terapeutiska åtgärder endast under stationära förhållanden.
Följande mediciner ordineras:

- Emosint;
- Aminokapron- och tranexamsyra;
- ATP-injektion;
Kosten måste innehålla bovetegröt, ägg, rödbetor och morötter, granatäpple, nötlever och rött kött.
För att upprätthålla blod i normalt tillstånd är det nödvändigt att strikt följa dricksregimen. Minst en och en halv liter rent vatten anses vara normen per dag. Maten ska vara fräsch och balanserad.
Efterlevnad av näringsregler är förebyggande av många sjukdomar i människokroppen. Fysisk aktivitet spelar också en lika viktig roll. De hjälper inte bara att stärka kroppen utan också normalisera alla interna processer.
Med snabb diagnos av avvikelser i aggregeringsindikatorer kan många sjukdomar och komplikationer förebyggas. Nivån av trombocytaggregation måste övervakas regelbundet.
Blodplättar är små blodkroppar som är ansvariga för blodets koagulering. De hjälper till att stoppa blodförlusten om blödning uppstår.
När ett sår uppstår, flyttar blodplättarna till det skadade området. Här är de fästa på väggen på det skadade kärlet, vilket resulterar i att blödningen slutar. Denna process kallas trombocytaggregation.
Trombocytaggregation är en process där blodkroppar fäster vid varandra och fixerar dem på väggen av det skadade kärlet. Detta stoppar blödningen. Men en sådan process kan också vara farlig för kroppen. I det här fallet bildas en blodpropp som under vissa omständigheter kan orsaka hjärtinfarkt och stroke. Detta kan hända om blodplättar är överaktiva och aggregation sker för snabbt.
Dessutom lovar den långsamma processen inte heller något gott för kroppen. I detta fall kan dålig blodkoagulering uppstå på grund av långsam vidhäftning av trombocyter. Denna patologi orsakar anemi. Om blodets koagulering är dålig är det problematiskt att stoppa blödningen, vilket kan leda till hälsoproblem och till och med döden. För att förhindra att detta händer är det nödvändigt att övervaka nivån av blodplättar i blodet och deras förmåga att hålla ihop.
Processen för trombocytaggregation under graviditeten
 Det är extremt viktigt att trombocytaggregationen fortgår normalt under graviditeten. Om processen sker för långsamt, då under förlossningen eller i postpartumperioden, kan blödning från livmodern uppstå, vilket kan leda till kvinnans död. Dessutom, om blodplättsaggregation sker snabbt under graviditeten, kan blodproppar bildas, vilket under graviditeten kan leda till att det avbryts i vilket skede som helst.
Det är extremt viktigt att trombocytaggregationen fortgår normalt under graviditeten. Om processen sker för långsamt, då under förlossningen eller i postpartumperioden, kan blödning från livmodern uppstå, vilket kan leda till kvinnans död. Dessutom, om blodplättsaggregation sker snabbt under graviditeten, kan blodproppar bildas, vilket under graviditeten kan leda till att det avbryts i vilket skede som helst.
Du kan undvika denna situation om du planerar din graviditet och tar hand om din hälsa i förväg. Det är nödvändigt, även före befruktningen, att ta reda på vilket tillstånd blodplättarna är i och vid behov vidta åtgärder för att korrigera situationen. Om graviditeten inte var planerad kan aggregeringspatologin undvikas genom att registrera dig i ett tidigt skede. Då kommer läkaren att ordinera de nödvändiga testerna och hjälpa till att bli av med det patologiska tillståndet av trombocyter om en upptäcks.
Normalt antal blodplättar i blodet
För att veta tillståndet för blodplättsnivåer måste du ha en uppfattning om deras normala nivå.
Om vi talar om aggregeringsgraden är den 25-75%. I det här fallet sker processen med trombocytlimning bra och utgör ingen hälsorisk.
Om avvikelser från normen observeras, föreskrivs lämplig behandling för att korrigera situationen.Blodprov för trombocytaggregation
Ett blodprov som kallas inducerad aggregation hjälper till att studera blodplättarnas tillstånd. I det här fallet tas blod från patientens ven och blandas med speciella ämnen. Sådana medel har en sammansättning som liknar sammansättningen av de kroppsceller som deltar i aggregationsprocessen. Följande ämnen tas oftast som induktorer:
- adenosindifosfat (ADP);
- kollagen;
- serotonin;
- ristocetin;
- adrenalin;
- arakidonsyra.
Den vanligaste proceduren är trombocytaggregation med ADP. För att utföra studien tas en speciell enhet. Det kallas en blodplättsaggregationsanalysator. Med dess hjälp passerar ljusvågor genom blodet innan det börjar koagulera och efter att denna process är klar. Därefter utvärderas resultatet.
Förbereder för prov
 För att säkerställa att resultatet blir så exakt som möjligt måste du följa följande regler för att ta ett blodprov:
För att säkerställa att resultatet blir så exakt som möjligt måste du följa följande regler för att ta ett blodprov:
- Studien utförs på fastande mage. I det här fallet måste du sluta äta 12 timmar före testet. I det här fallet kan du dricka rent vatten.
- 7 dagar före testet måste du avbryta läkemedelsbehandling med vissa mediciner. Om detta inte är möjligt måste du informera läkaren som utför analysen.
- Några dagar innan analysen bör du undvika stressiga situationer och fysisk aktivitet.
- Du måste sluta dricka kaffe, röka, dricka alkohol och vitlök 24 timmar i förväg.
- Forskning kan inte utföras om en inflammatorisk process inträffar i kroppen.
Indikationer för analys
 Du kan ta ett blodplättsaggregationstest då och då på eget initiativ.
Du kan ta ett blodplättsaggregationstest då och då på eget initiativ. Tolkning av resultatet av analysen av inducerad aggregering
Tolkningen av indikatorer beror på hur studien genomfördes. För att göra detta jämförs data med normen.
Om resultaten avviker från normen uppåt, diagnostiseras ökad trombocytaggregation. Detta tillstånd uppstår när: 
- högt blodtryck;
- ateroskleros;
- leukemi;
- diabetes mellitus;
- onkologiska sjukdomar i mag-tarmkanalen eller njurarna;
- lymfogranulomatos;
- sepsis;
- kirurgiskt avlägsnande av mjälten.
Ökad trombocytaggregation kan leda till hjärtinfarkt, stroke, trombos och död på grund av blockering av ett kärl av en blodpropp.
Om resultaten avviker från normen mot en minskning, diagnostiseras en minskad aggregation av trombos. Detta beror på:
- blodsjukdomar;
- trombocytopati;
- användning av trombocythämmande medel.
Med minskad aggregering blir kärlen ömtåliga. Dessutom är processen att stoppa blödning svår, vilket kan orsaka dödsfall.
Medel som minskar aggregeringsprocessen
Vissa medel hämmar aggregationsprocessen. Dessa läkemedel inkluderar antiblodplättsmedel. Trombocytaggregationshämmare inkluderar läkemedel som acetylsalicylsyra, ibustrin, micristin och andra. Sådana läkemedel ordineras för behandling av vissa sjukdomar. Men om aggregeringsprocessen kraftigt avviker från normen, bör hämmande läkemedel ersättas med andra medel som inte leder till sådana konsekvenser. Om detta inte är möjligt kan läkaren ordinera speciella läkemedel som främjar aggregering.
Både ökad och minskad aggregering kan leda till fruktansvärda konsekvenser. Därför kan sådana situationer inte ignoreras. I sådana fall måste du konsultera en läkare för att ordinera lämplig behandling.