Caracteristicile generale ale elementelor grupei V-A. P-elemente din grupa V Valența maximă a elementelor din grupa 5 din subgrupa principală
Asemănări ale elementelor:
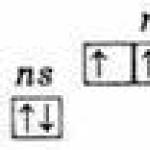
Structura identică a stratului electronic exterior de atomi ns 2 np 3;
elemente P;
Satul superior O. egal cu +5;
Inferior s. O. egal cu -3 (necaracteristic pentru Sb și Bi).
Pentru elementele subgrupului principal al grupului V, se folosește uneori numele de grup „pnictogene”, introdus prin analogie cu termenii „halogeni” și „calcogeni” și derivat din simbolurile elementelor fosfor P și azot N.
Stările de valență ale atomilor
Pentru atomii P, As, Sb, Bi sunt posibile 2 stări de valență:
De bază ns 2 np 3
Înfierbântat ns 1 np 3 nd 1
Diferența dintre azot și alte elemente ale subgrupului
1. Din cauza absenței orbitalilor d în stratul electronic exterior al atomului de azot, numărul de legături covalente formate de atomul de azot conform mecanismului de schimb nu poate fi mai mare de 3.
2. Prezența unei perechi de electroni singuri la subnivelul 2s al atomului de azot face posibilă formarea unei legături covalente prin mecanismul donor-acceptor. Astfel, cea mai mare valență a lui N este IV.
3. În compușii cu oxigen, azotul prezintă stări de oxidare +1, +2, +3, +4, +5.
Modificarea pe verticală a proprietăților elementelor și a substanțelor pe care le formează
Spre deosebire de halogeni și calcogeni, în subgrupul principal al grupului V se produce o schimbare mai dramatică a proprietăților elementelor și a substanțelor simple pe care le formează pe măsură ce sarcina nucleului și raza atomilor cresc:
Modificarea pe verticală a proprietăților elementelor și a substanțelor simple pe care le formează |
|||||
nemetale |
metal cu unele semne de nemetalicitate |
||||
Oxizi și hidroxizi |
Azotul și compușii săi de oxigen sunt considerați separat datorită unui număr de diferențe. |
||||
E 2 O 3 şi hidroxizi corespunzători |
P 2 O 3 (P 4 O 6) oxid acid |
Ca oxid acid 2 O 3 cu semne de amfoteritate |
Sb 2 O 3 oxid amfoter |
Bi 2 O 3 oxid bazic |
|
E 2 O 5 şi hidroxizi corespunzători |
P 2 O 5 (P 4 O 10) oxid acid |
Ca oxid de acid 2O5 |
Sb 2 O 5 oxid acid |
Bi 2 O 5 amfoter fragil |
|
HPO 3 (H 3 PO 4) |
|||||
acizi slabi |
|||||
Proprietățile acidului slăbesc |
|||||
Proprietățile de bază sunt îmbunătățite |
|||||
Compușii cu hidrogen EN 3
Elementele subgrupului principal din grupa V formează compuși volatili cu hidrogen, care sunt gaze otrăvitoare cu mirosuri caracteristice. Sunt agenți reducători puternici. Spre deosebire de compușii cu hidrogen ai nemetalelor din grupele VII și VI, ei nu formează ioni H + în soluții apoase, adică nu prezintă proprietăți acide.
CARACTERISTICI GENERALE ALE GRUPA A V-A DE ELEMENTE.
Subgrupul principal V 0 01 F al tabelului periodic include azot, fosfor, arsen, antimoniu și bismut. Aceste elemente, având cinci electroni în stratul exterior al atomului, sunt caracterizate în general
ca nemetalele. Cu toate acestea, capacitatea lor de a atașa electroni este mult mai puțin pronunțată decât cea a elementelor corespunzătoare din grupele VI și VII. Datorită prezenței a cinci electroni exteriori, cea mai mare oxidare pozitivă a elementelor acestui subgrup este -5, iar cea negativă - 3. Datorită electronegativității relativ mai scăzute, legătura elementelor în cauză cu hidrogenul este mai puțin polară decât legătura cu hidrogenul elementelor din grupele VI și VII. Prin urmare, compușii cu hidrogen ai acestor elemente nu elimină ionii de hidrogen H într-o soluție apoasă și, prin urmare, nu au proprietăți acide. Proprietățile fizice și chimice ale elementelor subgrupului de azot se modifică cu
0 0 1 Fincreșterea numărului de serie în aceeași secvență care a fost observată în
0 0 1 Pentru grupurile considerate anterior, Dar deoarece proprietățile nemetalice sunt exprimate în
mai slab decât cel al oxigenului și mai ales al fluorului, atunci slăbirea acestor proprietăți în timpul trecerii la 0 0 1 F următoarele elemente atrage apariția și creșterea proprietăților metalice.
Acestea din urmă sunt deja sesizabile în arsenic, antimoniul are ambele proprietăți aproximativ în mod egal, iar în bismut proprietățile metalice predomină asupra celor nemetalice. DESCRIEREA ELEMENTELOR. AZOT(din greacă ázōos - fără viață, lat. Nitrogen), N, element chimic V
grupuri ale sistemului periodic al lui Mendeleev, număr atomic 7, masă atomică 14,0067; gaz incolor, inodor și insipid. Referință istorică. Compușii de azot - salpetru, acid azotic, amoniac - au fost
cunoscut cu mult înainte de producerea azotului în stare liberă. În 1772, D. Rutherford, arzând fosforul și alte substanțe într-un clopot de sticlă, a arătat că gazul rămas după ardere, pe care l-a numit „aer sufocant”, nu sprijină respirația și arderea. În 1787, A. Lavoisier a stabilit că gazele „vitale” și „asfixiante” care alcătuiesc aerul sunt substanțe simple și a propus denumirea de „azot”. În 1784, G. Cavendish a arătat că azotul face parte din salitrul; De aici provine denumirea latină de azot (din latinescul târziu nitrum - salpeter și grecescul gennao - nasc, produc), propus în 1790 de J. A. Chaptal. Până la începutul secolului al XIX-lea. Au fost clarificate inerția chimică a azotului în stare liberă și rolul său exclusiv în compușii cu alte elemente ca azot legat. De atunci, „legarea” azotului din aer a devenit una dintre cele mai importante probleme tehnice ale chimiei. Prevalența în natură. Azotul este unul dintre cele mai comune elemente pe
Pământul și volumul său (aproximativ 4´1015 T) este concentrat în stare liberă în atmosferă. În aer, azotul liber (sub formă de molecule de N2) este de 78,09% în volum (sau 75,6% în masă), fără a număra impuritățile sale minore sub formă de amoniac și oxizi. Conținutul mediu de azot în litosferă este de 1,9´10-3% în masă. Compuși naturali de azot. - clorură de amoniu NH4Cl și diverși nitrați (vezi.
Salpetru.) Acumulările mari de salitr sunt caracteristice unui climat deșertic uscat (Chile, Asia Centrală). Pentru o lungă perioadă de timp, azotatul a fost principalul furnizor de azot pentru industrie (acum sinteza industrială a amoniacului din azotul aerului și hidrogenul are o importanță primordială pentru fixarea azotului). Cantități mici de azot fix se găsesc în cărbune (1-2,5%) și petrol (0,02-1,5%), precum și în apele râurilor, mărilor și oceanelor. Azotul se acumulează în sol (0,1%) și în organismele vii (0,3%).
Deși numele „azot” înseamnă „care nu susține viața”, este de fapt un element esențial pentru viață. Proteinele animale și umane conțin 16 - 17% azot. În organismele animalelor carnivore, proteinele se formează datorită substanțelor proteice consumate prezente în organismele animalelor ierbivore și în plante. Plantele sintetizează proteine prin asimilarea substanțelor azotate conținute în sol, în principal anorganice. Cantități semnificative de azot intră în sol datorită microorganismelor fixatoare de azot care sunt capabile să transforme azotul liber din aer în compuși de azot. Ciclul azotului are loc în natură, în care rolul principal îl joacă
microorganisme - nitrofierea, denitrofierea, fixarea azotului etc. Cu toate acestea, ca urmare a extragerii de către plante a unor cantități uriașe de azot fixat din sol (în special în agricultura intensivă), solurile se epuizează de azot. Deficitul de azot este tipic pentru agricultură în aproape toate țările; deficitul de azot este observat și în creșterea animalelor („foame de proteine”). Pe solurile sărace în azot disponibil, plantele se dezvoltă slab. Îngrășămintele cu azot și hrănirea cu proteine a animalelor sunt cele mai importante mijloace de stimulare a agriculturii. Activitățile economice umane perturbă ciclul azotului. Astfel, arderea combustibilului îmbogățește atmosfera cu azot, iar fabricile producătoare de îngrășăminte leagă azotul din aer. Transportul îngrășămintelor și produselor agricole redistribuie azotul la suprafața pământului. Azotul este al patrulea element cel mai abundent din sistemul solar (după hidrogen,
heliu și oxigen). Izotopi, atom, moleculă. Azotul natural este format din doi izotopi stabili: 14N
(99,635%) și 15N (0,365%). Izotopul 15N este utilizat în cercetarea chimică și biochimică ca atom etichetat. Dintre izotopii radioactivi artificiali ai azotului, 13N are cel mai lung timp de înjumătățire (T1/2 - 10,08 min), restul sunt de foarte scurta durata. În straturile superioare ale atmosferei, sub influența neutronilor din radiația cosmică, 14N se transformă în izotopul de carbon radioactiv 14C. Acest proces este folosit și în reacțiile nucleare pentru a produce 14C. Învelișul exterior de electroni a atomului de azot. este format din 5 electroni (o pereche singură și trei nepereche - configurația 2 s 22p 3). Cel mai adesea azot. în compuși este 3-covalent datorită electronilor neperechi (ca și în amoniacul NH3). Prezența unei perechi singure de electroni poate duce la formarea unei alte legături covalente, iar azotul devine 4-covalent (ca în ionul de amoniu NH4+). Stările de oxidare a azotului variază de la +5 (în N205) la -3 (în NH3). În condiții normale, în stare liberă, azotul formează o moleculă de N2, unde atomii de N sunt legați prin trei legături covalente. Molecula de azot este foarte stabilă: energia sa de disociere în atomi este de 942,9 kJ/mol (225,2 kcal/mol), deci chiar cu t aproximativ 3300°C grad de disociere a azotului. este de doar aproximativ 0,1%. Proprietati fizice si chimice. Azotul este puțin mai ușor decât aerul; densitate 1,2506 kg/
m3(la 0°C și 101325 n/m2 sau 760 mmHg Artă.), tpl-209,86°C, fierbe-195,8?C. A. se lichefiază cu dificultate: temperatura sa critică este destul de scăzută (-147,1 ° C), iar presiunea sa critică este mare 3,39 Mn/m2 (34,6 kgf/cm2); densitatea azotului lichid 808 kg (m3. Azotul este mai puțin solubil în apă decât oxigenul: la 0°C în 1 m3 H2O dizolvă 23,3 G azot. Azotul este mai solubil în unele hidrocarburi decât în apă. Doar cu metale active precum litiu, calciu, magneziu, azot
interacționează atunci când este încălzit la temperaturi relativ scăzute. Azotul reacționează cu majoritatea celorlalte elemente la temperaturi ridicate și în prezența catalizatorilor. Compușii azotului cu oxigenul N2O, NO, N2O3, NO2 și N2O5 au fost bine studiați. Din ele, în timpul interacțiunii directe a elementelor (4000°C), se formează NO oxid care, la răcire, este ușor oxidat în continuare la dioxid de NO2. În aer, oxizii de azot se formează în timpul descărcărilor atmosferice. Ele pot fi obținute și prin expunerea unui amestec de azot și oxigen la radiații ionizante. Când azotat N2O3 și
Anhidridele azotice N2O5 produc acid azotic HNO2 și acid azotic HNO3, formând săruri - nitriți și nitrați. Azotul se combină cu hidrogenul numai la temperaturi ridicate și în prezența catalizatorilor și se formează amoniac NH3. Pe lângă amoniac, sunt cunoscuți numeroși alți compuși ai azotului cu hidrogen, de exemplu, hidrazina H2N-NH2, diimidă HN-NH, acidul hidronitric HN3(H-N-NºN), octazona N8H14 etc.; Majoritatea compușilor de azot și hidrogen sunt izolați numai sub formă de derivați organici. Azotul nu interacționează direct cu halogenii, prin urmare toate halogenurile de azot sunt obținute numai indirect, de exemplu, fluorura de azot NF3- când fluorul reacţionează cu amoniacul. De regulă, halogenurile de azot sunt compuși slab stabili (cu excepția NF3); Oxihalogenurile de azot sunt mai stabile - NOF, NOCI, NOBr, N02F și NO2CI. Nici azotul nu se combină direct cu sulful; sulful azotat N4S4 se obţine ca urmare a reacţiei sulfului lichid cu amoniacul. Când cocsul fierbinte reacţionează cu azotul, se formează cianogen (CN). Prin încălzirea azotului cu acetilenă C2H2 la 1500°C, se poate obține acid cianhidric HCN. Interacțiunea azotului cu metalele la temperaturi ridicate duce la formarea de nitruri (de exemplu, Mg3N2). Când azotul obișnuit este expus la descărcări electrice [presiune 130 - 270 n/m2(1- 2
mmHg)] sau în timpul descompunerii nitrururilor de B, Ti, Mg și Ca, precum și în timpul descărcărilor electrice în aer se poate forma azot activ, care este un amestec de molecule de azot și atomi cu o rezervă de energie crescută. Spre deosebire de azotul molecular, azotul activ interacționează foarte energetic cu oxigenul, hidrogenul, vaporii de sulf, fosforul și unele metale. Azotul face parte din mulți compuși organici importanți (amine,
aminoacizi, compuși nitro etc.). Chitanța și cererea. În laborator, azotul poate fi obținut cu ușurință prin
încălzirea unei soluții concentrate de azotat de amoniu: NH4NO2 - N2 + 2H2O. Metoda tehnică de producere a azotului se bazează pe separarea aerului pre-lichefiat, care este apoi supus distilarii. Partea principală a azotului liber extras este utilizată în scopuri industriale
producerea de amoniac, care este apoi procesat în cantități semnificative în acid azotic, îngrășăminte, explozivi etc. Pe lângă sinteza directă a amoniacului din elemente, metoda cianamidei s-a dezvoltat în 1905, bazată pe faptul că la 1000 °C carbură de calciu (obținut prin încălzirea unui amestec de var și cărbune într-un cuptor electric) reacționează cu azotul liber: CaC2 + N2 = CaCN2 + C. Cianamida de calciu rezultată se descompune sub acțiunea vaporilor de apă supraîncălziți, eliberând amoniac:
CaCN+3H2O=CaC03+2NH3.
Azotul liber este utilizat în multe industrii: ca mediu inert în diferite procese chimice și metalurgice, pentru umplerea spațiului liber în termometrele cu mercur, la pomparea lichidelor inflamabile etc. Azotul lichid este utilizat în diferite unități frigorifice. Este depozitat și transportat în vase Dewar din oțel, gaz de azot sub formă comprimată - în cilindri. Mulți compuși de azot sunt utilizați pe scară largă, producția de azot fix a început să se dezvolte rapid după primul război mondial și a atins acum proporții enorme.
Fosfor(lat. Fosfor), P, element chimic din grupa V a sistemului periodic al lui Mendeleev, număr atomic 15, masă atomică 30,97376, nemetal. Fosforul natural constă dintr-un izotop stabil, 31P; s-au obținut șase izotopi radioactivi artificiali: 28P ( T1/2 - 6,27 sec), 29P ( T1/2 - 4,45 sec); 30P ( T1/2 - 2,55 min), 31P ( T1/2
14,22 zile), 32P ( T1/2 - 25 zile), 33P ( T1/2 - 12,5 sec). 32P are cea mai mare valoare , care posedă o energie semnificativă de radiație B și este utilizat în cercetarea chimică și biochimică ca atom etichetat. Referință istorică. Conform unor date din literatura de specialitate, metoda de obtinere
Fosforul era deja cunoscut arabilor. alchimiştii secolului al XII-lea. Dar data general acceptată pentru descoperirea fosforului este considerată a fi 1669, când H. Brand (Germania), prin calcinarea reziduului uscat de la evaporarea urinei cu nisip și distilarea ulterioară fără acces la aer, a obținut o substanță care strălucește în întunecat, numit mai întâi „foc rece”, iar mai târziu fosfor din greacă. fosfor – luminos. În curând i-a devenit cunoscută metoda de obținere a fosforului. chimiști - I. Kraft, I. Kunkel; în 1682 a fost publicată această metodă. În 1743, A. S. Marggraf a dezvoltat următoarea metodă de producere a fosforului: un amestec de clorură de plumb și urină a fost evaporat până la uscare și încălzit până când a încetat eliberarea de produse volatile; reziduul a fost amestecat cu cărbune pulbere și distilat într-o retortă de lut; Vaporii de fosfor s-au condensat în recipient cu apă. Cea mai simplă metodă de obţinere a fosforului prin calcinarea cenuşii osoase cu cărbune a fost propusă abia în 1771 de K. Scheele. Natura elementară a fosforului a fost stabilită de A. Lavoisier. În a 2-a jumătate a secolului al XIX-lea. a apărut producția industrială de fosfor din fosforiți în cuptoarele cu retortă; la începutul secolului al XX-lea. au fost înlocuite cu cuptoare electrice. Distribuție în natură. Conținutul mediu de fosfor în scoarța terestră (clark) -
9,3 x 10-2% în greutate; în roci medii 1,6×10-1, în roci bazice 1,4×10-1, mai puțin în granite și alte roci magmatice acide - 7×10-2 și chiar mai puțin în roci ultrabazice (manta) - 1, 7×10-2% ; în roci sedimentare de la 1,7×10-2 (gresii) la 4×10-2% (roci carbonatice). Fosforul participă la procesele magmatice și migrează puternic în biosferă. Ambele procese sunt asociate cu marile sale acumulări, formând depozite industriale de apatite și fosforite . Fosforul este un element biogen extrem de important, este acumulat de multe organisme. Multe procese de concentrare a fosforului în scoarța terestră sunt asociate cu migrația biogenă. Fosforul este ușor precipitat din ape sub formă de minerale insolubile sau captat de materia vie. Prin urmare, apa de mare conține doar 7 × 10-6% fosfor. Sunt cunoscute aproximativ 180 de minerale de fosfor, în principal diverși fosfați, dintre care fosfații de calciu sunt cei mai des întâlniți. . Proprietăți fizice. Fosforul elementar există sub formă de mai multe
modificări alotropice, dintre care principalele sunt alb, roșu și negru. Fosforul alb este o substanță ceroasă, transparentă, cu miros caracteristic, formată prin condensarea vaporilor de fosfor. Fosfor alb în prezența impurităților - urme de fosfor roșu, arsenic, fier etc. - vopsit galben, deci fosfor alb comercial. numit galben. Există două forme de fosfor alb: forma a și forma b. a- modificarea reprezintă cristale ale sistemului cubic ( A- 18,5); densitate 1.828 g/cm3, t pl 44,1 °C, t kip 280,5 °C, căldură de fuziune 2,5 kJ/mol P4 (0,6 kcal/mol P4), căldură de evaporare 58,6 kJ/mol P4(14,0 kcal/mol P4) , presiunea aburului la 25 °C 5.7 n/m2 (0,043 mmHg Artă.). Coeficientul de dilatare liniară în domeniul de temperatură de la 0 la 44 °C este 12,4 × 10-4 , conductivitate termică 0,56 mar/(m×K) la 25 °C. Proprietățile electrice ale fosforului alb. aproape de dielectrici: band gap aproximativ 2,1 ev, rezistivitate electrică 1,54×1011 ohm× cm, susceptibilitate magnetică diamagnetică specifică - 0,86×10-6. Duritatea Brinell 6 Mn/m2 (0,6 kgf/mm2). Forma a a fosforului alb se dizolvă bine în disulfură de carbon, mai puțin bine în amoniac lichid, benzen, tetraclorură de carbon etc. La - 76,9 °C și o presiune de 0,1 Mn/m2(1kgf/cm2) forma a se transformă în forma b la temperatură joasă (densitate 1,88 g/cm3). Cu presiunea care crește la 1200 Mn/m2(12 mii kgf/cm2) tranziția are loc la 64,5 °C. b-forma - cristale cu birefringență, structura lor nu a fost stabilită definitiv. Fosforul alb este otrăvitor: în aer la o temperatură de aproximativ 40 °C
se auto-aprinde, deci trebuie păstrat sub apă (solubilitate în apă la 25 °C 3,3 × 10-4%) . Prin încălzirea fosforului alb fără acces la aer la 250-300 °C timp de câteva ore, se obține fosfor roșu. Tranziția este exotermă, accelerată de razele ultraviolete, precum și de impurități (iod, sodiu, seleniu). Fosforul roșu comercial obișnuit este aproape complet amorf; are o culoare de la maro închis la violet. Cu încălzire prelungită, se poate transforma ireversibil într-una dintre formele cristaline (triclinică, cubică etc.) cu proprietăți diferite: densitate de la 2,0 la 2,4 g/cm 3, t pl de la 585 la 610 °C la o presiune de câteva zeci de atmosfere, temperatura de sublimare de la 416 la 423 °C, rezistivitate electrică de la 109 la 1014 ohm× cm. Fosforul roșu nu se aprinde spontan în aer; până la o temperatură de 240-250 °C, dar se auto-aprinde la frecare sau impact; insolubil în apă, precum și în benzen, disulfură de carbon etc., solubil în tribromură de fosfor. La temperatura de sublimare, fosforul roșu se transformă în vapori, la răcire care produce în principal fosfor alb. Când fosforul alb este încălzit la 200-220 °C sub presiune (1,2-1,7) × 103 Mn/m 2
[(12-17)×103 kgf/cm 2] se formează fosfor negru. Această transformare poate fi efectuată fără presiune, dar în prezența mercurului și a unei cantități mici de cristale de fosfor negru (sămânță) la 370 °C timp de 8 zile Fosforul negru este un cristal cu o structură ortorombică ( A -3,31 , b - 4,38 , Cu-10,50), rețeaua este construită din straturi fibroase cu fosfor caracteristic. aranjarea piramidală a atomilor, densitate 2,69 g/cm3, t pl aproximativ 1000 °C sub presiune 1,8×103 Mn/m2(18×103 kgf/cm2). În aparență, fosforul negru este similar cu grafitul; semiconductor: bandgap 0,33 ev la 25 °C; are o rezistivitate electrică specifică de 1,5 ohm× cm, coeficientul de temperatură al rezistenței electrice este de 0,0077, susceptibilitatea magnetică diamagnetică specifică este de 0,27 × 10-6. Când este încălzită la 560-580 °C sub presiunea propriilor vapori, se transformă în fosfor roșu. Fosforul negru este slab activ și greu de aprins atunci când este aprins, astfel încât poate fi procesat în siguranță în aer. Raza atomică a fosforului este de 1,34, raze ionice: P5 + 0,35, P3 + 0,44, P3- 1,86.
Atomii de fosfor se combină pentru a forma molecule diatomice (P2), tetraatomice (P4) și polimerice. Cele mai stabile molecule de polimer în condiții normale sunt cele care conțin lanțuri lungi de tetraedre P4 interconectate. În lichid, solid (fosfor alb) și vapori sub 800 °C, fosforul este format din molecule P4. La temperaturi peste 800 °C, moleculele P4 se disociază în P2 , care, la rândul lor, se dezintegrează în atomi la temperaturi peste 2000 °C. Doar fosforul alb este format din molecule P4, toate celelalte modificări sunt polimeri. Proprietăți chimice. Configurația electronilor exteriori ai atomului de fosfor 3 s2 3p3, V
compuși, cele mai caracteristice stări de oxidare sunt + 5, + 3 și - 3. Ca și azotul, fosforul din compuși este în principal covalent. Există foarte puțini compuși ionici precum fosfuri Na3P și Ca3P2. Spre deosebire de azot, fosforul are 3 liber d- orbitali cu energii destul de reduse, ceea ce duce la posibilitatea cresterii numarului de coordonare si formarii de legaturi donor-acceptor. Fosforul este activ din punct de vedere chimic, fosforul alb are cea mai mare activitate;
fosforul roșu și negru sunt mult mai pasivi în reacțiile chimice. Oxidarea fosforului alb are loc printr-un mecanism de reacție în lanț. Oxidarea fosforului este de obicei însoțită de chemiluminiscență. Când fosforul arde în exces de oxigen, se formează pentoxid P4O10 (sau P2O5) când există o deficiență, în principal trioxid P4O6 (sau P2O3). Existența P4O7, P4O8 în vapori a fost dovedită spectroscopic , P2O6, PO și alți oxizi de fosfor. Pentoxidul de fosfor este produs la scară industrială prin arderea fosforului elementar în exces de aer uscat. Hidratarea ulterioară a P4O10 duce la producerea de orto-(H3PO4) și poli-(H n+2 P n O3 P+ 1) acizi fosforici. Cu exceptia
În plus, fosforul formează acid fosforic H3PO3, acid fosforic H4P2O6 și acid hipofosforic H3PO2, precum și peracizi: acid perfosforic H4P2O8 și acid monoperfosforic H3PO5 Sărurile acizilor fosforici (fosfați) sunt utilizate pe scară largă , într-o măsură mai mică – fosfiți și hipofosfiți. Fosforul se combină direct cu toți halogenii pentru a elibera un mare
cantitatea de căldură și formarea de trihalogenuri (PX3, unde X este halogen), pentahalogenuri (PX5) și oxihalogenuri (de exemplu, POX3) . Când fosforul fuzionează cu sulful sub 100 °C, se formează soluții solide pe bază de fosfor și sulf, iar peste 100 °C are loc o reacție exotermă pentru a forma sulfuri cristaline P4S3, P4S5, P4S7, P4S10, dintre care numai P4S5 se descompune în P4S3 atunci când este încălzit. peste 200 °C și P4S7, iar restul se topește fără descompunere. Sunt cunoscute următoarele oxisulfuri de fosfor: P2O3S2, P2O3S3, P4O4S3, P6O10S5 și P4O4S3. Fosforul, în comparație cu azotul, este mai puțin capabil să formeze compuși cu hidrogenul. Fosfina hidrogen fosfor PH3 și difosfina P2H4 pot fi obținute doar indirect. Dintre compușii fosforului și azotului se cunosc nitrururile PN, P2N3, P3N5 - substanțe solide, stabile chimic, obținute prin trecerea azotului cu vapori de fosfor printr-un arc electric; Halogenuri de fosfonitril polimerice - (PNX2)n (de exemplu, clorură de polifosfonitril) , obţinut prin reacţia pentahalogenurilor cu amoniac în diferite condiţii; amidoimidofosfații sunt compuși, de obicei polimerici, care conțin legături P-NH-P împreună cu legături P-O-P. La temperaturi peste 2000°C, fosforul reacţionează cu carbonul pentru a se forma
Carbura PC3 este o substanță insolubilă în solvenți obișnuiți și nu interacționează nici cu acizii, nici cu alcalii. Când este încălzit cu metale, fosforul formează fosfuri. Fosforul formează numeroși compuși organofosforici. chitanta. se realizează producerea de fosfor elementar
reducerea electrotermală a acestuia din fosfați naturali (apatite sau fosforite) la 1400-1600 °C cu cocs în prezență de silice (nisip cuarț):
2Ca3(PO4)2 + 10C + n SiO2 = P4 + 10CO + 6CaO× n SiO2 Minereul pre-zdrobit și îmbogățit care conține fosfor este amestecat în
rapoarte specificate cu silice și cocs și încărcate într-un cuptor electric. Silicea este necesară pentru a reduce temperatura reacției, precum și pentru a crește viteza acesteia prin legarea oxidului de calciu eliberat în timpul procesului de reducere în silicat de calciu, care este îndepărtat continuu sub formă de zgură topită. În zgură trec, de asemenea, silicații și oxizii de aluminiu, magneziu, fier și alte impurități, precum și ferofosforul (Fe2P, FeP, Fe3P), formați prin interacțiunea unei părți a fierului redus cu fosforul. Ferofosforul, precum și cantități mici de fosfuri de mangan și alte metale dizolvate în acesta, sunt îndepărtate din cuptorul electric pe măsură ce se acumulează pentru utilizare ulterioară în producția de oțeluri speciale. Vaporii de fosfor părăsesc cuptorul electric împreună cu subprodușii gazoși.
produse și impurități volatile (CO, SiF4, PH3, vapori de apă, produse de piroliză ai impurităților de încărcare organică etc.) la o temperatură de 250-350 °C. După curățarea de praf, gazele care conțin fosfor sunt trimise la unități de condensare, în care fosforul alb tehnic lichid este colectat sub apă la o temperatură de cel puțin 50 °C. Se dezvoltă metode de producere a fosforului folosind gaz
agenți reducători, reactoare cu plasmă pentru a intensifica producția prin creșterea temperaturilor până la 2500-3000 °C, adică mai mari decât temperaturile de disociere ale fosfaților naturali și gazelor reducătoare (de exemplu, metanul) utilizate ca gaz de transport în plasmă la temperatură joasă.
Aplicație. Cea mai mare parte a fosforului produs este procesată în acid fosforic și îngrășăminte cu fosfor și săruri tehnice (fosfați) obținute pe baza acestuia. . Fosforul alb este folosit în obuze incendiare și fumigene, bombe; roșu
fosfor - în producția de chibrituri. Fosforul este utilizat în producerea aliajelor de metale neferoase ca agent de dezoxidare. Introducerea de până la 1% fosfor crește rezistența la căldură a aliajelor precum fechral și cromal. Fosforul este inclus în unele bronzuri, deoarece le mareste fluiditatea si rezistenta la abraziune. Fosfurile metalelor, precum și unele nemetale (B, Si, As etc.) sunt utilizate în producția și dopajul materialelor semiconductoare. Fosforul este parțial utilizat pentru a produce cloruri și sulfuri, care servesc ca materii prime pentru producerea de plastifianți care conțin fosfor (de exemplu, fosfat de tricrezil, fosfat de tributil etc.), medicamente, pesticide organofosforice și sunt, de asemenea, utilizate ca aditivi în lubrifianți. și combustibili. Măsuri de siguranță. Fosforul alb și compușii săi sunt foarte toxici. Lucreaza cu
fosforul necesită etanșarea atentă a echipamentului; depozitează fosfor alb. trebuie să fie sub apă sau într-un recipient metalic închis ermetic. Când lucrați cu fosfor, trebuie respectate cu strictețe regulile de siguranță. Fosforul în organism. Fosforul este unul dintre cele mai importante elemente biogene,
necesare vietii tuturor organismelor. Este prezent în celulele vii sub formă de acizi orto- și pirofosforici și derivați ai acestora și, de asemenea, face parte din nucleotide, acizi nucleici, fosfoproteine, fosfolipide, esteri fosforici ai carbohidraților, multe coenzime și alți compuși organici. Datorită particularităților structurii lor chimice, atomii de fosfor, ca și atomii de sulf, sunt capabili să formeze legături bogate în energie în compușii de înaltă energie; acid adenozin trifosforic (ATP), creatină fosfat etc. În procesul de evoluție biologică, compușii fosforului au devenit principalii depozitari universali de informații genetice și purtători de energie în toate sistemele vii. Dr. Rolul important al compușilor de fosfor în organism constă în faptul că adăugarea enzimatică a unui reziduu de fosforil () la diverși compuși organici (fosforilare) servește drept „pasare” pentru participarea lor la metabolism și, dimpotrivă, scindarea unui restul fosforil (defosforilarea) exclude acești compuși din schimbul activ. Enzime din metabolismul fosforului - kinaze, fosforilaze și fosfataze. Ficatul joacă rolul principal în transformarea compușilor fosforului în corpul animalelor și al oamenilor. Metabolismul compușilor fosforului este reglat de hormoni și vitamina D. Conținutul de fosfor (în mg la 100 G substanță uscată) în țesuturile plantelor - 230-350,
animale marine - 400-1800, animale terestre - 1700-4400, bacterii - aproximativ 3000; în corpul uman există mai ales mult fosfor în țesutul osos (puțin mai mult de 5000), în țesutul cerebral (aproximativ 4000) și în mușchi (220-270). Necesarul uman zilnic de fosfor este de 1-1,2 G(la copii este mai mare decat la adulti). Dintre produsele alimentare, cele mai bogate în fosfor sunt brânza, carnea, ouăle, leguminoasele (mazăre, fasole etc.). Echilibrul fosforului din organism depinde de starea generală a metabolismului. Încălcarea metabolismului fosforului duce la modificări biochimice profunde, în primul rând în metabolismul energetic. Cu o lipsă de fosfor în organism, animalele și oamenii dezvoltă osteoporoză și alte boli osoase, iar plantele dezvoltă foamete de fosfor . Sursa de fosfor în natura vie o reprezintă compușii săi anorganici conținuti în sol și dizolvați în apă. Fosforul este extras din sol de către plante sub formă de fosfați solubili. Animalele primesc de obicei suficient fosfor din dieta lor. După moartea organismelor, fosforul intră din nou în sol și în sedimentele de fund, participând astfel. în ciclul substanțelor. Rolul important al fosforului în reglarea proceselor metabolice determină sensibilitatea ridicată a multor sisteme enzimatice ale celulelor vii la acțiunea compușilor organofosforici. Această împrejurare este utilizată în medicină la dezvoltarea medicamentelor, în agricultură la producerea de fosfor
îngrășăminte, precum și în crearea de insecticide eficiente. Mulți compuși ai fosforului sunt extrem de toxici și unii dintre compușii organofosforici pot fi clasificați ca agenți de război chimic (sarin, soman, tabun). Izotopul radioactiv al fosforului 32P este utilizat pe scară largă în biologie și medicină ca indicator în studiul tuturor tipurilor de metabolism și energie în organismele vii. . Medicamente care conțin fosfor (acid adenozin trifosforic,
fitină, glicerofosfat de calciu, fosfenă etc.), afectează în principal procesele de metabolism tisular și sunt utilizate pentru boli ale mușchilor, sistemului nervos, tuberculoză, pierderea nutriției, anemie etc. Izotopii radioactivi ai fosforului sunt utilizați ca indicatori izotopi pentru studiul metabolismului, diagnosticarea bolilor, precum și pentru radioterapie a tumorilor .
Arsenic(lat. Arsenicum), As, element chimic din grupa V a sistemului periodic al lui Mendeleev, număr atomic 33, masă atomică 74,9216; cristale gri-oțel. Elementul constă dintr-un izotop stabil 75As. Referință istorică. Compuși naturali arsen cu sulf (orpiment As2S3,
realgar As4S4) erau cunoscute de popoarele lumii antice, care foloseau aceste minerale ca medicamente și vopsele. Era cunoscut și produsul arderii sulfurilor de arsen - oxidul de arsen (III) As2O3 („arsen alb”). Numele de arsenikón se găsește deja la Aristotel; este derivat din greacă. ársen - puternic, curajos și a servit pentru a desemna compușii de arsenic (pe baza efectului lor puternic asupra organismului). Se crede că numele rusesc provine de la „șoarece” (după utilizarea preparatelor de arsenic pentru a extermina șoarecii și șobolanii). Producția de arsenic în stare liberă este atribuită lui Albertus Magnus (circa 1250). În 1789 A. Lavoisier a inclus arsenicul în lista elementelor chimice. Distribuție în natură. Conținutul mediu de arsenic în scoarța terestră (clark)
1,7·10-4% (în masă), în astfel de cantități este prezent în majoritatea rocilor magmatice. Deoarece compușii de arsenic sunt volatili la temperaturi ridicate, elementul nu se acumulează în timpul proceselor magmatice; se concentrează, precipitând din ape calde de adâncime (împreună cu S, Se, Sb, Fe, Co, Ni, Cu și alte elemente). În timpul erupțiilor vulcanice, arsenul sub formă de compuși volatili intră în atmosferă. Deoarece arsenul este multivalent, migrarea lui este influențată în mare măsură de mediul redox. În condiții de oxidare ale suprafeței terestre, se formează arseniați (As5+) și arseniți (As3+). Acestea sunt minerale rare care se găsesc numai în zonele cu zăcăminte de arsenic. Arsenicul nativ și mineralele As2+ sunt și mai puțin frecvente. Dintre numeroasele minerale de arsenic (aproximativ 180), numai arsenopiritul FeAsS este de importanță industrială primară. Cantități mici de arsenic sunt esențiale pentru viață. Cu toate acestea, în zonele depozitului
arsenul și activitatea vulcanilor tineri, solurile în unele locuri conțin până la 1% arsen, care este asociat cu bolile animalelor și moartea vegetației. Acumularea de arsen este tipică în special pentru peisajele de stepă și deșerturi, în solurile cărora arsenul este inactiv. În climatele umede, arsenul este ușor de spălat din sol. În materia vie există în medie 3·10-5% arsenic, în râuri 3·10-7%. Arsenic adus
râurilor în ocean, se depune relativ repede. În apa de mare există doar 1·10-7% arsen, dar în argile și șisturi este de 6,6·10-4%. Minereurile sedimentare de fier și nodulii de feromangan sunt adesea îmbogățite în arsenic.
Proprietati fizice si chimice. Arsenicul are mai multe modificări alotropice. În condiții normale, cel mai stabil este așa-numitul arsen metalic sau gri (a-As) - o masă cristalină fragilă de culoare gri-oțel; când este proaspăt fracturat, are un luciu metalic în aer se estompează rapid deoarece este acoperit cu o peliculă subțire de As2O3. Rețeaua cristalină a arsenului gri este romboedrică ( A- 4,123 Å, unghi a – 54о10", X- 0,226), stratificat. Densitate 5,72 g/cm3(la 20°C), rezistivitate electrică 35·10-8 ohm× m, sau 35·10-6 ohm× cm, coeficient de temperatură al rezistenței electrice 3,9·10-3 (0о-100 оC), duritate Brinell 1470 Mn/ m2, sau 147 kgf/mm2(3-4 conform lui Mohs); Arsenicul este diamagnetic. Sub presiunea atmosferică, arsenul se sublimează la 615 °C fără să se topească, deoarece punctul triplu (vezi diagrama de fază) a-As se află la 816 °C și o presiune de 36 la. Vaporii de arsen constă din molecule de As4 până la 800 °C, peste 1700 °C - doar As2. Când vaporii de arsen se condensează pe o suprafață răcită de aer lichid, se formează arsen galben - cristale transparente, moi ca ceara, cu o densitate de 1,97 g/cm3, asemănătoare ca proprietăți cu fosforul alb. Când este expus la lumină sau la căldură scăzută, se transformă în arsen gri. Sunt cunoscute și modificări sticlo-amorfe: arsenul negru și arsenul maro, care, la încălzire peste 270 C, se transformă în M gri. Configurația electronilor exteriori ai atomului de arsen 3 d 104s 24p 3. Arsenicul în compuși
are stări de oxidare + 5, + 3 și - 3. Arsenicul gri este mult mai puțin activ din punct de vedere chimic decât fosforul. Când este încălzit în aer peste 400°C, arsenul arde, formând As2O3. Arsenicul se combină direct cu halogenii; în condiții normale, AsF5 este un gaz; AsF3, AsCl3, AsBr3 - lichide incolore, foarte volatile; AsI3 și As2l4 sunt cristale roșii. Când arsenul și sulful sunt încălzite, se obțin sulfuri: As4S4 portocaliu-rosu și galben-lămâie As2S3. Sulfura galben pal As2S5 este precipitată prin trecerea H2S într-o soluție răcită cu gheață de acid arsenic (sau sărurile sale) în acid clorhidric fumos: 2H3AsO4 + 5H2S = As2S5 + 8H2O; La aproximativ 500°C se descompune în As2S3 și sulf. Toate sulfurile M. sunt insolubile în apă și acizi diluați. Agenții oxidanți puternici (amestecurile de HNO3 + HCl, HCl + KClO3) îi transformă într-un amestec de H3AsO4 și H2SO4. Sulfura de As2S3 se dizolvă ușor în sulfuri și polisulfuri de amoniu și metale alcaline, formând săruri ale acizilor - tioarsenic H3AsS3 și tioarsenic H3AsS4. Cu oxigen, arsenul produce oxizi: oxid M. (III) As2O3 - anhidrida arsenosa si oxid M. (V) As2O5 - anhidrida de arsen. Prima dintre ele se formează prin acțiunea oxigenului asupra metalului sau a sulfurilor acestuia, de exemplu 2As2S3 + 9O2 - 2As2O3 + 6SO2. Vaporii de As2O3 se condensează într-o masă sticloasă incoloră, care devine opacă în timp datorită formării de cristale cubice mici, densitate 3,865 g/cm3. Densitatea vaporilor corespunde formulei As4O6: peste 1800?C vaporii sunt formați din As2O3. La 100 G apa se dizolvă 2.1 G As2O3 (la 25oC). M. oxidul (III) este un compus amfoter cu predominanța proprietăților acide. Sunt cunoscute sărurile (arsenitele) corespunzătoare acizilor ortoarsenic H3AsO3 și acizilor metaarsenic HAsO2; acizii în sine nu au fost obţinuţi. Doar arseniții de metal alcalin și de amoniu sunt solubili în apă. As2O3 și arseniții sunt de obicei agenți reducători (de exemplu, As2O3 + 2I2 + 5H2O - 4HI + 2H3AsO4), dar pot fi și agenți oxidanți (de exemplu, As2O3 + 3C - 2As + 3CO). Oxidul de arsenic(V) este preparat prin încălzirea acidului arsenic H3AsO4 (aproximativ
200oC). Este incolor și se descompune la aproximativ 500°C în As2O3 și O2. Acidul arsenic este preparat prin acțiunea HNO3 concentrat asupra As sau As2O3. Sărurile acidului arsenic (arseniații) sunt insolubile în apă, cu excepția sărurilor de metale alcaline și de amoniu. Sunt cunoscute săruri care corespund acizilor ortoarsenic H3AsO4, metaarsenic HAsO3 și piroarsenic H4As2O7; ultimii doi acizi nu s-au obtinut in stare libera. Atunci când este aliat cu metale, arsenul formează în mare parte compuși (arsenide).
Chitanța și cererea. Arsenicul este produs industrial prin încălzirea piritelor de arsenic:
FeAsS - FeS + As sau (mai rar) reducerea As2O3 cu cărbune. Ambele procese sunt efectuate în retorte din
argilă refractară conectată la un receptor pentru condensarea vaporilor de arsen. Anhidrida de arsen este obținută prin prăjirea oxidativă a minereurilor de arsen sau ca produs secundar al prăjirii minereurilor polimetalice, care conțin aproape întotdeauna arsen. În timpul prăjirii oxidative se formează vapori de As2O3, care se condensează în camerele de colectare. As2O3 brut este purificat prin sublimare la 500-600°C. As2O3 purificat este utilizat pentru producerea arsenului și a preparatelor acestuia.
Mici adaosuri de arsen (0,2-1,0% în greutate) sunt introduse în plumbul utilizat pentru producerea împușcăturii (arsenul crește tensiunea superficială a plumbului topit, datorită căruia împușcătura capătă o formă apropiată de sferică; arsenul crește ușor duritatea) de plumb). Ca înlocuitor parțial al antimoniului, arsenul este inclus în unele aliaje babbitt și imprimare. Arsenicul pur nu este otrăvitor, ci toți compușii săi, solubili în apă sau capabili
intra in solutie sub influenta sucului gastric, extrem de otravitor; Hidrogenul arsenului este deosebit de periculos. Dintre compușii de arsen utilizați în producție, anhidrida de arsen este cea mai toxică. Aproape toate minereurile sulfurate ale metalelor neferoase, precum și pirita de fier (sulf), conțin un amestec de arsen. Prin urmare, în timpul prăjirii lor oxidative, împreună cu dioxidul de sulf SO2, se formează întotdeauna As2O3; Cea mai mare parte se condensează în canalele de fum, dar în absența sau eficiența scăzută a instalațiilor de tratare, gazele de evacuare ale cuptoarelor de prăjire a minereului transportă cantități vizibile de As2O3. Arsenicul pur, deși nu este otrăvitor, este întotdeauna acoperit cu un strat de As2O3 toxic atunci când este depozitat în aer. În absența unei ventilații adecvate, gravarea metalelor (fier, zinc) cu acizi sulfuric sau clorhidric industrial care conțin arsen este extrem de periculoasă, deoarece aceasta produce hidrogen arsenic. Arsenic în organism. Ca oligoelement, arsenul este omniprezent
în natura vie. Conținutul mediu de arsenic în sol este de 4·10-4%, în cenușă de plante - 3·10-5%. Conținutul de arsenic în organismele marine este mai mare decât în organismele terestre (la pești 0,6-4,7 mgîn 1 kg materie brută se acumulează în ficat). Conținutul mediu de arsenic din corpul uman este de 0,08-0,2 mg/kg. În sânge, arsenul este concentrat în celulele roșii din sânge, unde se leagă de molecula de hemoglobină (iar fracțiunea de globină conține de două ori mai mult decât hem). Cea mai mare cantitate din ea (per 1 G tesut) se gaseste in rinichi si ficat. O mulțime de arsenic se găsește în plămâni și splină, piele și păr; relativ puțin - în lichidul cefalorahidian, creier (în principal glanda pituitară), gonade etc. În țesuturi, arsenul se găsește în fracția principală de proteine, mult mai puțin în fracția solubilă în acid și doar o mică parte din acesta se găsește în fracția lipidică. Arsenicul este implicat în reacțiile redox: descompunerea oxidativă a carbohidraților complecși, fermentație, glicoliză etc. Compușii arsenului sunt utilizați în biochimie ca inhibitori specifici ai enzimelor pentru studiul reacțiilor metabolice. Arsenicul în medicină. Compuși organici de arsenic (aminarson, miarsenol,
novasenal, osarsol) sunt utilizate în principal pentru tratamentul sifilisului și bolilor protozoare. Preparatele anorganice de arsenic - arsenitul de sodiu (acidul arsenic de sodiu), arsenitul de potasiu (acidul arsenic de potasiu), anhidrida arsenosa As2O3, sunt prescrise ca agenti generali de intarire si tonici. Atunci când sunt aplicate local, preparatele anorganice de arsenic pot provoca un efect necrozator fără iritare prealabilă, făcând acest proces aproape nedureros; această proprietate, care este cel mai pronunțată în As2O3, este folosită în stomatologie pt
distrugerea pulpei dentare. Preparatele anorganice de arsenic sunt, de asemenea, folosite pentru a trata psoriazisul. Izotopi radioactivi obținuți artificial M. 74As (T1/2 - 17,5 zile) și 76As (T1/2
26,8 h) sunt utilizate în scopuri diagnostice și terapeutice. Cu ajutorul lor, se clarifică localizarea tumorilor cerebrale și se determină gradul de radicalitate al îndepărtării acestora. Arsenicul radioactiv este uneori folosit pentru boli de sânge etc. Conform recomandărilor Comisiei Internaționale pentru Protecția împotriva Radiațiilor,
conținutul maxim admis de 76As în corp 11 mccurie. Conform standardelor sanitare adoptate în URSS, concentrațiile maxime admise de 76A în apă și rezervoare deschise sunt 1·10-7 curie/l, în aerul spațiilor de lucru 5·10-11 curie/l. Toate preparatele cu arsenic sunt foarte otrăvitoare. În caz de otrăvire acută, se observă dureri abdominale severe, diaree și leziuni renale; Colapsul și convulsiile sunt posibile. In intoxicatiile cronice, cele mai frecvente sunt afectiunile gastrointestinale, catarul mucoaselor cailor respiratorii (faringita, laringita, bronsita), leziunile cutanate (exantem, melanoza, hiperkeratoza) si tulburarile de sensibilitate; este posibilă dezvoltarea anemiei aplastice. În tratamentul otrăvirii cu preparate de arsenic, unithiolul are cea mai mare importanță. Ar trebui să se urmărească măsurile de prevenire a intoxicațiilor industriale
în primul rând pe mecanizarea, etanșarea și îndepărtarea prafului procesului tehnologic, crearea unei ventilații eficiente și asigurarea lucrătorilor cu echipament individual de protecție împotriva expunerii la praf. Sunt necesare examinări medicale regulate ale lucrătorilor. Examenele medicale preliminare se efectuează la angajare, iar pentru angajați - o dată la șase luni.
ANTIMONIU(lat. Stibium), Sb, element chimic din grupa V a sistemului periodic al lui Mendeleev; numărul atomic 51, masa atomică 121,75; Metalul este alb-argintiu cu o nuanță albăstruie. Doi izotopi stabili sunt cunoscuți în natură: 121Sb (57,25%) și 123Sb (42,75%). Dintre izotopii radioactivi obținuți artificial, cel mai important este 122Sb ( T 1/2 - 2,8 cym), 124Sb ( T 1/2 - 60,2 cym) și 125Sb ( T 1/2 - 2 ani).
Referință istorică. Antimoniul este cunoscut din cele mai vechi timpuri. În țările din Orient a fost folosit aproximativ 3000 î.Hr. e. pentru confecţionarea vaselor. În Egiptul Antic deja în secolul al XIX-lea. î.Hr e. Pulbere cu sclipici de antimoniu (Sb2S3 natural) numită mesten sau stem a fost folosită pentru a înnegri sprâncenele. În Grecia antică era cunoscut sub numele de stími și stíbi, de unde latinescul stibium. Pe la secolele 12-14. n. e. a apărut denumirea de antimoniu. În 1789, A. Lavoisier a inclus antimoniul în lista elementelor chimice numite antimoine (antimoniu în engleză modernă, antimonio spaniolă și italiană, Antimon german). „antimoniul” rusesc provine din limba turcă sürme; denota pulberea cu sclipici de plumb PbS, care era folosită și pentru înnegrirea sprâncenelor (conform altor surse, „antimoniu” - din surma persană - metal). O descriere detaliată a proprietăților și metodelor de producere a antimoniului și a compușilor acestuia a fost dată pentru prima dată de alchimistul Vasily Valentin (Germania) în 1604. Distribuție în natură. Conținutul mediu de antimoniu în scoarța terestră (clarke) 5 × 10-5
% după greutate. Antimoniul este dispersat în magmă și biosferă. Din apele subterane calde, se concentrează în depozite hidrotermale. Sunt cunoscute zăcămintele de antimoniu în sine, precum și zăcămintele de antimoniu-mercur, antimoniu-plumb, aur-antimoniu și antimoniu-tungsten. Dintre cele 27 de minerale de antimoniu, stibnitul (Sb2S3) are o importanță industrială majoră. . Datorită afinității sale cu sulful, antimoniul se găsește adesea ca impuritate în sulfurile de arsen, bismut, nichel, plumb, mercur, argint și alte elemente. Proprietati fizice si chimice. Antimoniul este cunoscut în cristalin și trei
forme amorfe (explozive, negre și galbene). Antimoniu exploziv (densitate 5,64-5,97 g/cm 3) explodează la orice contact: format în timpul electrolizei unei soluții
SbCI3; negru (densitate 5,3 g/cm 3) - cu răcire rapidă a vaporilor de antimoniu; galben - când oxigenul este trecut în SbH3 lichefiat. Antimoniul galben și negru sunt instabili; la temperaturi scăzute, se transformă în antimoniu obișnuit. Cel mai stabil antimoniu cristalin , se cristalizează în sistemul trigonal, A - 4,5064; densitate 6,61-6,73 g/cm 3(lichid - 6,55 g/cm 3); t p.t. 630,5°C; t kip1635-1645 °C; capacitate termică specifică la 20-100 °C 0,210 kJ/(kg × LA ) ; conductivitate termică la 20 °C 17,6 W/M× K. Coeficient de temperatură de dilatare liniară pentru C policristalin. 11,5 ×10-6 la 0-100 °C; pentru monocristal a1 - 8,1×10-a2 - 19,5×10-6 la 0-400 °C, rezistivitate electrică (20 °C) (43,045×10-6 ohm× cm). Antimoniul este diamagnetic, susceptibilitatea magnetică specifică este -0,66 × 10-6. Spre deosebire de majoritatea metalelor, antimoniul este fragil, se desparte cu ușurință de-a lungul planurilor de clivaj, se macină în pulbere și nu poate fi forjat (uneori este clasificat ca semi-metal) . Proprietățile mecanice depind de puritatea metalului. Duritate Brinell pentru metal turnat 325-340 Mn/m 2 (32,5-34,0 kgf/mm 2); modul elastic 285-300; rezistență la tracțiune 86,0 Mn/m 2 (8,6 kgf/mm 2). Configurația electronilor exteriori ai atomului Sb5s25r3. În compuși, prezintă stări de oxidare în principal +5, +3 și -3. Din punct de vedere chimic, antimoniul este inactiv. Nu se oxidează în aer până când
temperatură de topire. Antimoniul nu reacționează cu azotul și hidrogenul. Carbonul se dizolvă ușor în antimoniul topit. Metalul interacționează activ cu clorul și alți halogeni, formând halogenuri de antimoniu. Reacționează cu oxigenul la temperaturi peste 630 °C pentru a forma Sb2O3 . Atunci când este fuzionat cu sulf, se obțin sulfuri de antimoniu și interacționează, de asemenea, cu fosforul și arsenul. Antimoniul este rezistent la apă și acizi diluați. Acizii clorhidric și sulfuric concentrați dizolvă lent antimoniul pentru a forma clorură de SbCl3 și sulfat de Sb2 (SO4)3; acidul azotic concentrat oxidează antimoniul la un oxid superior, care se formează sub formă de compus hidratat xSb2O5 ×yH2O. De interes practic sunt sărurile puțin solubile ale acidului de antimoniu - antimoniți (MeSbO3 × 3H2O, unde Me este Na, K) și sărurile de acid metaantimonic neizolat - metaantimoniți (MeSbO2 × 3H2O), care au proprietăți reducătoare. S. se combină cu metalele pentru a forma antimonide. chitanta. Antimoniul se obține prin metode pirometalurgice și hidrometalurgice
prelucrarea concentratelor sau a minereului care conțin 20-60% Sb. Metodele pirometalurgice includ precipitarea și topirea prin reducere. Materiile prime pentru topirea prin precipitare sunt concentratele sulfurate; procesul se bazează pe deplasarea antimoniului din sulfura acestuia de către fier: Sb2S3 + 3Fe Û 2Sb + 3FeS. Fierul este introdus în încărcătură sub formă de resturi. Topirea se realizează în cuptoare reverberative sau cu tambur scurt rotativ la 1300-1400 °C. Recuperarea antimoniului în metal brut este mai mare de 90%. Topirea reductivă a antimoniului se bazează pe reducerea oxizilor acestuia la metal cu cărbune sau praf de cărbune și pe zgură roci sterile. Topirea prin reducere este precedată de prăjirea oxidativă la 550 °C cu exces de aer. Cenușa conține tetroxid de antimoniu nevolatil. Cuptoarele electrice pot fi folosite atât pentru precipitare, cât și pentru reducerea topiturii. Metoda hidrometalurgică de producere a antimoniului constă în două etape: prelucrarea materiei prime cu o soluție de sulfură alcalină, transferul antimoniului în soluție sub formă de săruri de acizi de antimoniu și sulfosaruri și separarea antimoniului. electroliză. Antimoniul brut, în funcție de compoziția materiei prime și de metoda de producere a acesteia, conține de la 1,5 până la 15% impurități: Fe, As, S etc. Pentru obținerea antimoniului pur se folosește rafinarea pirometalurgică sau electrolitică. În timpul rafinării pirometalurgice, impuritățile de fier și de cupru sunt îndepărtate sub formă de compuși cu sulf prin introducerea de antimonit (crudum) - Sb2S3 - în topitura de antimoniu, după care arsenul (sub formă de arsenat de sodiu) și sulful sunt îndepărtate prin suflarea de aer sub zgura de sifon. În timpul rafinării electrolitice cu un anod solubil, antimoniul brut este purificat din fier, cupru și alte metale rămase în
electrolitul (Cu, Ag, Au rămân în nămol). Electrolitul este o soluție formată din SbF3, H2SO4 și HF. Conținutul de impurități în antimoniu rafinat nu depășește 0,5-0,8%. Pentru a obține antimoniu de înaltă puritate, topirea zonei este utilizată într-o atmosferă de gaz inert sau se obține antimoniul din compuși prepurificați - trioxid sau triclorura. Aplicație. Antimoniul este utilizat în principal sub formă de aliaje de plumb și staniu
pentru plăci de baterie, mantale de cablu, rulmenți (babbitt) , aliaje utilizate în imprimare (hart) , etc. Astfel de aliaje au duritate crescută, rezistență la uzură și rezistență la coroziune. În lămpile fluorescente, Sb este activat cu halofosfat de calciu. Antimoniul este inclus în materialele semiconductoare ca dopant pentru germaniu și siliciu, precum și în antimonide (de exemplu, InSb). Izotopul radioactiv 12Sb este utilizat în surse de radiații g și neutroni. Antimoniu în organism. Conținut de antimoniu (la 100 G materie uscată) este în
plante 0,006 mg, la animalele marine 0,02 mg, la animalele terestre 0,0006 mg. Antimoniul intră în organismul animalelor și al oamenilor prin sistemul respirator sau tractul gastrointestinal. Se excretă în principal în fecale și în cantități mici în urină. Rolul biologic al antimoniului este necunoscut. Este concentrat selectiv în glanda tiroidă, ficat și splină. În eritrocite, antimoniul se acumulează predominant în starea de oxidare + 3, în plasma sanguină - în starea de oxidare + 5. Concentrația maximă admisă C. 10-5 - 10-7 G cu 100 G cârpă uscată. La concentrații mai mari, acest element inactivează o serie de enzime ale metabolismului lipidic, carbohidraților și proteinelor (posibil ca urmare a blocării grupărilor sulfhidril) . În practica medicală, preparatele de antimoniu (solyusurmină etc.) sunt utilizate în
în principal pentru tratamentul leishmaniozei și a unor helmintiază (de exemplu, schistosomiaza). Antimoniul și compușii săi sunt otrăvitori. Otrăvirea este posibilă în timpul topirii concentratului
minereuri de antimoniu și în producerea aliajelor de antimoniu. În otrăvirea acută - iritarea membranelor mucoase ale tractului respirator superior, a ochilor și a pielii. Se pot dezvolta dermatite, conjunctivite etc. Tratament: antidoturi (unitiol), diuretice si diaforetice, etc. Preventie: mecanizarea productiei. procese, ventilație eficientă etc.
BISMUT(lat. Bismuthum), Bi, element chimic al grupului periodic V
sistemul lui Mendeleev; numărul atomic 83, masa atomică 208,980; metal gri-argintiu cu o tentă roz. Bismutul natural constă dintr-un izotop stabil, 209Bi. V. era cunoscut în secolele XV-XVI, dar multă vreme a fost considerat un tip de tablă,
plumb sau antimoniu. Bismutul a fost recunoscut ca un metal independent la mijlocul secolului al XVIII-lea. Chimistul francez A. Lavoisier l-a inclus în lista corpurilor simple. Originea denumirii „bismut” nu este stabilită. Conținutul de bismut din scoarța terestră este de 2·10-5% în masă. Bismutul se găsește în mod natural în
sub formă de numeroase minerale, dintre care cele mai importante sunt luciul de bismut Bi2S3, bismutul nativ Bi, bismitul Bi2O3 etc. În cantități mai mari, dar în concentrații mici, bismutul se găsește ca impuritate izomorfă în plumb-zinc, cupru, molibden. -minereuri de cobalt și staniu-tungsten . Aproximativ 90% din consumul global este acoperit de producția asociată de bismut în timpul prelucrării minereurilor polimetalice. Proprietati fizice si chimice. Bismutul are o rețea romboedrică cu
perioadă A- 4,7457 A și unghiul α-57?14 " 13"" . Densitate 9,80 g/cm 3; t pl 271,3°C; t kip 1560 °C. Capacitate termică specifică (20 °C) 123,5 J/kg K (0,0294 cal/g·CU); coeficientul termic
dilatare liniară la temperatura camerei 13,3·10-6; conductivitate termică (20°C) 8,37 W/(m·LA) ; rezistivitate electrică (20°C) 106,8 10-8 ohm· m(106.8·10-6 ohm· cm). Bismutul este cel mai diamagnetic metal. Susceptibilitatea magnetică specifică este -1,35·10-6. Sub influența unui câmp magnetic, rezistența electrică a bismutului crește într-o măsură mai mare decât cea a altor metale, care este folosit pentru a măsura inducerea câmpurilor magnetice puternice. Secțiunea transversală de captare a neutronilor termici a bismutului este mică (34 10-31 m 2 sau 0,034 hambar). La temperatura camerei, bismutul este fragil, se desparte ușor de-a lungul planurilor de clivaj și este măcinat sub formă de pulbere într-un mortar de porțelan. Forjare la temperatura de 120-150°C; prin presare la cald (la 240-250°C) poate fi folosit pentru a produce sarma cu diametrul de pana la 0,1 mm, precum și plăci cu grosimea de 0,2-0,3 mm. Duritate Brinell 93 Mn/m 2 (9,3 kgf/mm 2), conform lui Mohs 2.5. La topire, V. scade în volum cu 3,27%. Bismutul este stabil în aer uscat, dar în aer umed suprafața sa
oxidare. Când este încălzit peste 1000°C, arde cu o flacără albăstruie pentru a forma oxid de Bi2O3 . În seria de tensiune, bismutul se află între hidrogen și cupru, prin urmare nu se dizolvă în acizi sulfuric și clorhidric diluați; dizolvarea în acizi sulfuric și azotic concentrați are loc cu eliberarea de SO2 și oxizi de azot corespunzători. Bismutul prezintă valențe de 2, 3 și 5. Compuși de bismut cu valențe inferioare
au un caracter de bază, cele superioare sunt acide. Dintre compușii de oxigen din lume, cel mai important este trioxidul Bi2O3, care își schimbă culoarea galbenă în roșu-maro când este încălzit. Bi2O3 este utilizat pentru obținerea sărurilor de bismut. În soluții diluate, sărurile de bismut se hidrolizează. Clorura de BiCl3 se hidrolizează cu precipitarea oxiclorurii BiOCl, Bi azotat (NO3)3 - cu precipitarea sării principale BiONO3·BiOOH. Capacitatea sărurilor V. de a se hidroliza este folosită pentru purificarea acesteia. Compușii de bismut 5-valent sunt greu de obținut; sunt agenți oxidanți puternici. Sarea KBiO3 (corespunzătoare anhidridei Bi2O5) se formează sub formă de precipitat brun-roșu pe un anod de platină în timpul electrolizei unei soluții la fierbere a unui amestec de KOH, KCl și o suspensie de Bi2O3. Bismutul se combină ușor cu halogeni și sulf. Când acizii acționează asupra unui aliaj de bismut și magneziu, se formează bismutin (bismut hidrogen) BiH3; Spre deosebire de arsina AsH3, bismutina este un compus instabil și nu a fost obținut în forma sa pură (fără hidrogen în exces). Cu unele metale (plumb, cadmiu, staniu), bismutul formează eutectice cu punct de topire scăzut; cu sodiu, potasiu, magneziu și calciu - compuși intermetalici cu un punct de topire semnificativ mai mare decât punctul de topire al componentelor originale. Bismutul nu interacționează cu aluminiul topit, cromul și fierul. Chitanța și cererea. Cantitatea principală de bismut este produsă ca produs secundar
rafinarea la foc a plumbului brut (werkbley). Metoda pirometalurgică se bazează pe capacitatea bismutului de a forma compuși intermetalici refractari cu K, Na, Mg și Ca. Metalele specificate sunt adăugate plumbului topit și compușii solizi rezultați cu V. (zgură) sunt separați de topitură. O cantitate semnificativă de bismut este extrasă din nămolul din rafinarea electrolitică a plumbului într-o soluție hidrofluorosilicică, precum și din praf și nămol din producția de cupru. Zgura și nămolurile care conțin bismut sunt topite sub zguri alcaline. Metalul brut rezultat conține impurități de As, Sb, Cu, Pb, Zn, Se, Te, Ag și alte câteva elemente. Topirea bismutului din minereurile proprii se realizează la scară mică. Minereurile sulfurate sunt prelucrate prin topire prin precipitare cu resturi de fier. Din minereurile oxidate, aurul este redus cu cărbune sub un strat de flux cu punct de topire scăzut. Pentru curățarea grosieră a apei aspre se folosesc în funcție de compoziția impurităților.
diverse metode: zeigerizare, rafinare oxidativă sub fluxuri alcaline, fuziune cu sulf etc. Impuritatea de plumb cel mai greu de separat este îndepărtată (până la 0,01%) prin suflarea clorului prin metalul topit. Bismut comercial conține
99,9-99,98% metal de bază. V. de înaltă puritate se obţin prin recristalizare de zonă în barci de cuarţ în atmosferă de gaz inert. O cantitate semnificativă de bismut este utilizată pentru prepararea aliajelor cu punct de topire scăzut care conțin plumb, staniu, cadmiu, care sunt utilizate în protetica dentară, pentru fabricarea de clișee din matrice de lemn, ca capace de topire în dispozitivele automate de stingere a incendiilor, la lipirea capacelor pe proiectile perforatoare etc. Bismutul topit poate servi ca agent de răcire în reactoarele nucleare. Consumul de bismut în compuși cu Te pt
generatoare termoelectrice. Acești compuși, datorită combinației favorabile de conductivitate termică, conductivitate electrică și forță termoelectromotoare, fac posibilă transformarea energiei termice în energie electrică cu randament ridicat (~7%). Adăugarea de bismut la oțelurile inoxidabile îmbunătățește prelucrabilitatea acestora. Compușii de bismut sunt utilizați în fabricarea sticlei, ceramicii, produse farmaceutice
industrie. Sărurile solubile de bismut sunt otrăvitoare și au efecte similare cu mercurul.
Literatură
1. Substanțe nocive în industrie, în general. ed. N. V. Lazareva, ed. a 6-a, partea 2, Leningrad, 1971.
2. Ivanov V.V. Geochimia ecologică a elementelor. 3. Cercetări în domeniul creării unei noi tehnologii de producere a antimoniului și a acestuia
compuși, în colecția: Chimia și tehnologia antimoniului, Franța, 1965. 4. Scurtă enciclopedie chimică, vol. 5, M., 1967; 5. Nekrasov B.V., Fundamentele de chimie generală, vol. 1, M., 1965; 6. Pogodin S.A., Arsenic, în cartea: Scurtă enciclopedie chimică, vol. 3, M., 1964 7. Remy G., Curs de chimie anorganică, trad. din germană, vol. 1, M., 1963, p. 700-712; 8. Thomson J. G., Bismuth, trad. [din engleză], L., 1932; 9. Shiyanov A.G., Producția de antimoniu, M., 1961; Fundamentele metalurgiei, vol. 5, M.,
1968; 10. Chimia și tehnologia azotului legat, [M.-L.], 1934; KHE, vol. 1, M., 1961.
Subgrupul de azot este format din cinci elemente: azot, fosfor, arsen, antimoniu și bismut. Acestea sunt elementele p ale grupului V din sistemul periodic al lui D.I.
La nivelul energetic exterior, atomii acestor elemente conțin cinci electroni, care au configurația ns2np3 și sunt distribuiți după cum urmează:

Prin urmare, cea mai mare stare de oxidare a acestor elemente este +5, cea mai scăzută este -3 și +3 este, de asemenea, tipică.
Prezența a trei electroni nepereche la nivelul exterior indică faptul că, într-o stare neexcitată, atomii elementelor au o valență de 3. Nivelul exterior al atomului de azot este format din doar două subnivele - 2s și 2p. Atomii elementelor rămase din acest subgrup au celule libere ale subnivelului d la nivelurile exterioare de energie. În consecință, unul dintre electronii s ai nivelului exterior poate, la excitare, să se deplaseze la subnivelul d al aceluiași nivel, ceea ce duce la formarea a 5 electroni nepereche.

învelișul exterior de electroni a fosforului (atomul neexcitat)

învelișul exterior de electroni a unui atom de fosfor excitat.
Astfel, fosforul, arsenul, antimoniul și bismutul în stare excitată au 5 electroni nepereche, iar valența lor în această stare este de 5.
Într-un atom de azot, este imposibil să excitați un electron în acest mod din cauza absenței unui subnivel d în al doilea nivel. Prin urmare, azotul nu poate fi pentavalent, dar poate forma o a patra legătură covalentă prin mecanismul donor-acceptor datorită perechii de electroni singuri 2s2. Un alt proces este posibil și pentru atomul de azot. Când unul dintre cei doi electroni 2s este îndepărtat, azotul devine un ion tetravalent N+ încărcat unic.

De la azot la bismut, razele atomice cresc, iar potențialele de ionizare scad. Proprietățile reducătoare ale atomilor neutri cresc de la N la Bi, iar proprietățile oxidante slăbesc (vezi Tabelul 21).
Cu hidrogenul, azotul, fosforul și arsenul formează compuși polari RH3, prezentând o stare de oxidare negativă de -3. Moleculele RH3 au o formă piramidală. La acești compuși, legăturile elementelor cu hidrogenul sunt mai puternice decât în compușii corespunzători ai elementelor subgrupului oxigen și în special subgrupului halogen. Prin urmare, compușii cu hidrogen ai elementelor subgrupului de azot în soluții apoase nu formează ioni de hidrogen.

Cu oxigen, elementele subgrupului de azot formează oxizi cu formula generală R2O3 și R2O5. Oxizii corespund acizilor HRO2 și HRO3 (și ortoacizilor H3RO4, cu excepția azotului). În cadrul subgrupei, natura oxizilor se modifică astfel: N2O3 - oxid acid; Р4О6 - oxid slab acid; As2O3 este un oxid amfoter cu proprietăți acide predominante; Sb2O3 este un oxid amfoter cu predominanța proprietăților de bază; Bi2O3 este oxidul principal. Astfel, proprietățile acide ale oxizilor de compoziție R2O3 și R2O5 scad odată cu creșterea numărului atomic al elementului.
După cum se vede din tabel. 21, în cadrul subgrupului de la azot la bismut, proprietățile nemetalice scad și proprietățile metalice cresc. În antimoniu, aceste proprietăți sunt exprimate în mod egal în bismut, predomină proprietățile metalice, predomină proprietățile nemetalice; Fosforul, arsenul și antimoniul formează mai mulți compuși alotropi.
Azot.
Chitanță
În laboratoare se poate obține prin reacția de descompunere a nitritului de amoniu:
Reacția este exotermă, eliberând 80 kcal (335 kJ), așa că vasul trebuie răcit în timp ce are loc (deși nitritul de amoniu trebuie încălzit pentru a începe reacția).
În practică, această reacție se realizează prin adăugarea prin picurare a unei soluții saturate de azotat de sodiu la o soluție saturată încălzită de sulfat de amoniu, iar nitritul de amoniu format ca urmare a reacției de schimb se descompune instantaneu.
Gazul degajat în acest caz este contaminat cu amoniac, oxid de azot (I) și oxigen, din care se purifică prin trecerea succesivă prin soluții de acid sulfuric, sulfat de fier (II) și peste cupru fierbinte. Azotul este apoi uscat.
O altă metodă de laborator pentru producerea azotului este încălzirea unui amestec de dicromat de potasiu și sulfat de amoniu (într-un raport de 2:1 în greutate). Reacția se desfășoară conform ecuațiilor:
Cel mai pur azot poate fi obținut prin descompunerea azidelor metalice:
Așa-numitul azot „aer” sau „atmosferic”, adică un amestec de azot cu gaze nobile, se obține prin reacția aerului cu cocs fierbinte, care produce așa-numitul gaz „generator” sau „aer” - materie primă pentru sinteza chimica si combustibil . Dacă este necesar, azotul poate fi separat de acesta prin absorbția monoxidului de carbon.
Azotul molecular este produs industrial prin distilarea fracționată a aerului lichid. Această metodă poate fi folosită și pentru a obține „azot atmosferic”. Instalațiile și stațiile de azot care utilizează metoda de adsorbție și separare a gazelor prin membrană sunt de asemenea utilizate pe scară largă.
Una dintre metodele de laborator este trecerea amoniacului peste oxid de cupru (II) la o temperatură de ~700 °C:
Amoniacul este luat din soluția sa saturată prin încălzire. Cantitatea de CuO este de 2 ori mai mare decât cea calculată. Imediat înainte de utilizare, azotul este purificat din oxigen și amoniac prin trecerea peste cupru și oxidul său (II) (de asemenea, ~700 °C), apoi uscat cu acid sulfuric concentrat și alcali uscat. Procesul este destul de lent, dar merită: gazul obținut este foarte curat.
În fig. Figura 15.12 arată locația celor cinci elemente din Grupa V în tabelul periodic. Toate sunt elemente p, iar învelișul exterior al atomilor lor este caracterizat de o configurație electronică. În tabel 15.10 sunt indicate unele proprietăţi ale elementelor grupei V. Pe măsură ce vă deplasați la partea de jos a acestui grup, proprietățile elementelor sale se schimbă de la nemetalice la metalice. Azotul și fosforul sunt nemetale tipice. Arsenicul și antimoniul prezintă semne de caracter metalic, iar bismutul este un metal.
AZOT ȘI FOSFOR
Acestea sunt cele mai importante două elemente din Grupa V.
În condiții normale, azotul este un gaz format din diatomic

Orez. 15.12. Poziția elementelor grupei V în tabelul periodic.
Tabelul 15.10. Proprietățile elementelor din grupa V

molecule Este incolor, inodor și insipid și nu are reactivitate vizibilă.
Fosforul există în trei forme alotrope, dintre care cele două cele mai comune sunt fosforul roșu și fosforul alb, mai puțin stabil. Structura acestor alotropi a fost discutată în Sect. 3.2. În tabel 15.11 Se compară unele proprietăți ale fosforului roșu și alb.
Deși azotul este unul dintre elementele cele mai electronegative (vezi Tabelul 2.2), acesta are o reactivitate relativ scăzută. Motivul este că moleculele sale diatomice sunt nepolare și tripla legătură dintre doi atomi
Tabelul 15.11. Proprietățile fosforului alb și roșu


Orez. 15.13. Patru orbitali hibrizi ai atomului de azot.
Azotul din ele are o rezistență foarte mare. Entalpia acestei legături este de + 944 kJ/mol.
Atât azotul, cât și fosforul pot intra în compușii lor cu stări de oxidare de la -3 la 4-5. De exemplu, în amoniac, azotul are o stare de oxidare de +3, iar în ionul de nitrat starea sa de oxidare este -1-5.
Atomii ambelor elemente sunt capabili să atașeze trei electroni, ceea ce duce la umplerea subînvelișului lor exterior; ca urmare, se formează ioni de nitrură și ioni de fosfură. Cu toate acestea, ambele elemente tind să formeze compuși covalenti. În acest caz, atomii lor formează patru orbitali hibrizi, fiecare având o orientare tetraedrică (Fig. 15.13). Trei dintre acești orbitali conțin un electron. Acești electroni sunt împărțiți în timpul formării legăturilor covalente cu electronii altor atomi. Al patrulea orbital conține o singură pereche de electroni. Poate fi folosit pentru a forma o legătură de coordonare (donator-acceptor). De exemplu, în ionul de amoniu, perechea singură de azot se suprapune cu orbitalul vacant al ionului de hidrogen.
ns 2 np 3.
AZOT și compușii săi
În natură, se găsește sub formă liberă (conținut în aer - 78 %), sub formă de minerale (salpetru), în ulei, în proteine vegetale și animale.
Proprietăți fizice
În condiții normale, N2 este un gaz incolor, inodor și fără gust.
t o kip. = -195,8 o C.
Producția de azot:
a) în industrie - lichefierea aerului,
b) în laborator: NH 4 NO 2 ® N 2 + H 2 O.
Proprietățile chimice ale azotului și ale compușilor săi.
Activitatea chimică a azotului molecular este foarte scăzută, deoarece datorită legăturii covalente triple, molecula este foarte puternică (legatura E = 946 kJ/mol). Cu toate acestea, mulți compuși diferiți sunt cunoscuți pentru azot, în care prezintă stări de oxidare -3, -2, -1, +1, +2, +3, +4, +5.
Compuși cu azot cu stări negative de oxidare.
3
1)NH 3 – amoniac– un gaz incolor cu miros înțepător, ușor de lichefiat.
Producția de amoniac:
a) N2 + 3H2« 2NH3 (Kat: Fe, Al2O3, K2O)
b) 2NH4CI + Ca(OH)2 = CaCI2 + 2NH3 + 2H2O
Proprietățile chimice ale amoniacului:
a) NH 3 + H 2 O « NH 4 OH (concentrație maximă = 25%)
b) NH 3 + HCI « NH 4 CI (mecanism don.-acc.: NH 3 + H + = NH 4 +)
c) arderea are loc diferit în funcție de cantitatea de oxigen:
4NH 3 + 3O 2 (săptămână) = 2N 2 + 6H 2 O
4NH3 + 5О 2(g) = 2NO+ 6H2O
d) în OVR, amoniacul este întotdeauna un agent reducător:
3CuO + 2NH3 = 3Cu + N2 + 3H2O
2) NH 4 OH – hidroxid de amoniu- bază slabă, instabilă, formează bine compuși complecși (amoniac):
Cu(OH)2 + 4NH4OH = (OH)2 + 4H2O
3) Săruri de amoniu:
a) soluțiile datorate hidrolizei au o reacție ușor acidă:
NH 4 CI + HON « NH 4 OH + HCI (NH 4 + + HON « NH 4 OH + H +)
b) descompunerea termică a sărurilor de amoniu are loc diferit în funcție de natura anionului: dacă anionul este un agent oxidant, atunci reacția de descompunere este ireversibilă:
NH4CI «NH3 + HCI
NH4NO3 = N2O+ 2H2O
4) Amide se formează atunci când atomii de H din amoniac sunt înlocuiți cu metal:
2K + 2NH3 = 2KNH2 + H2
5) Nitruri cunoscut pentru metale și nemetale și, în funcție de natura lor, se descompun diferit:
a)Li3N + 3H2O = 3LiOH + NH3
Ca3N2 + 6HCI = 3CaCI2 + 2NH3
b)CI3N + 6HCI = 3HCIO + NH3
stare de oxidare - 2
N 2 H 4 – hidrazină(diamida) este un lichid incolor, un solvent bun, mai puțin stabil decât amoniacul.
Prepararea hidrazinei:
2NH3 + NaCIO = N2H4 + NaCI + H2O
Proprietățile chimice ale hidrazinei:
N2H4 + H2O « + +OH -
H2O «2+ +OH -
b) Se arde la azot: N 2 H 4 + O 2 = N 2 + 2H 2 O
c) Agent reducător puternic: N 2 H 4 + 2H 2 O 2 = N 2 + 4H 2 O
stare de oxidare - 1
NH 2 OH – hidroxilamină, o substanță cristalină albă, ocupă o poziție intermediară între H 2 O 2 și hidrazină N 2 H 4.
Prepararea hidroxilaminei:
HNO3 + 6H = NH2OH + 2H2O
Proprietățile chimice ale hidroxilaminei:
a) Soluții apoase – baze slabe:
NH2OH + H2O « + +OH -
b) Sărurile de hidroxilamoniu (stabile) se dau cu acizi:
NH2OH + HCI = + + CI -
c) Se descompune (reacție de disproporționare):
3NH2OH = NH3 + N2 + 3H2O
d) Ca și H 2 O 2, în funcție de mediu prezintă dualitate redox:
Bine: 2NH 2 OH + 4FeSO 4 + 3H 2 SO 4 = 2Fe 2 (SO 4) 3 + (NH 4) 2 SO 4 + 2H 2 O
restaurat: 2NH 2 OH + I 2 + 2KOH = N 2 + 2KI + 4H 2 O
Cei mai importanți compuși de azot cu s pozitiv. O.
Stare de oxidare + 3
1) N2O3- oxidul de azot (III) sau „anhidrida de azot” este un lichid instabil de culoare albastru-verde:
a) N 2 O 3 ® NO 2 (gaz maro cu miros înțepător) + NO (gaz incolor);
b) formează cu apa un acid instabil: N 2 O 3 + H 2 O « 2 HNO 2
2) HNO2– acid azot (tărie medie):
HNO2 « H + + NO2 - (K = 5,1 . 10 -4).
3) Nitriți– sărurile acidului azot, ca și alți compuși N+3 din reacțiile redox, prezintă dualitate:
Bine: KNO2 + NH3 = N2 + H2O
restaurat: KNO2 + H2O2 = KNO3 + H2O
Stare maximă de oxidare + 5
1) N2O5- oxidul de azot (V) sau „anhidrida azotică” este o substanță cristalină incoloră; Când este dizolvat în apă, dă acid.
2) HNO3– acid azotic, puternic: HNO 3 ® H + + NO 3 - .
3) Nitrați– săruri de acid azotic:
a) în laborator se poate obţine N 2 O prin reacţia de descompunere termică: NH 4 NO 3 ® N 2 O + H 2 O;
b) nitrații metalici, în funcție de poziția metalului în seria de activități, se descompun diferit:
la stânga Mg: nitrat ® nitrit + O 2
Mg – Cu: nitrat ® oxid metalic + NO 2 + O 2
la dreapta Cu: nitrat ® metal + NO 2 + O 2 .
4) toți compușii N +5 sunt agenți oxidanți puternici; interacțiunea acidului azotic cu metalele:
a) niciun metal nu eliberează hidrogen din HNO3;
b) la normal t o metalele Al, Zn, Cr, Fe, Pb, Au, Pt sunt pasivate;
c) atunci când este încălzit, interacționează cu majoritatea metalelor și cu cât metalul este mai activ și cu cât acidul este mai diluat, cu atât mai puternică este reducerea N +5:
inactiv Meh: Cu + 4HNO 3 (conc.) = Cu (NO 3) 2 + 2NO 2 + 2H 2 O
3Cu + 8HNO 3(dil.) = 3Cu(NO 3) 2 + 2NO + 4H 2O
active. Meh: 4Ca + 10HNO3(conc.) = 4Ca(NO3)2 + N2O + 5H2O
5Ca + 12HNO3(diluat) = 5Ca(NO3)2 + N2 + 6H2O
4Ca + 9HNO 3 (ultra dil.) = 4Ca (NO 3) 2 + NH 3 (sau NH 4 NO 3) + 3H 2 O
FOSFOR și compușii săi
Se găsește în natură: a) sub formă de minerale (fosforite și apatite), b) în proteine vegetale și animale, c) în țesutul cerebral și oase.
Proprietăți fizice
alotropen:
A) fosfor alb(P 4) – structură tetraedrică, otrăvitoare, strălucește în întuneric, solubilă în disulfură de carbon; în timpul depozitării se transformă treptat în fosfor roșu, deci este depozitat sub apă;
b) fosfor roșu(P 2 n – polimer) – există mai multe forme de structură, netoxice, insolubile în disulfură de carbon, stabile în timpul depozitării, mai puțin reactive;
V) fosfor negru– structură piramidală, stratificată, asemănătoare grafitului, semiconductor.
Obținerea fosforului:
Mineralul fosforit este calcinat cu cocs și nisip:
Ca 3 (PO 4) + 5C + 3 SiO 2 = 3CaSiO 3 +2P +5CO
Proprietățile chimice ale fosforului și ale compușilor săi.
Activitatea chimică a fosforului variază în funcție de modificarea sa alotropică. Principalele stări de oxidare: -3, +1, +3, +5.
1) Reacțiile fosforului cu substanțe simple:
proprietăți de restaurare: a)P + O2® P203, P205;
b) P + CI2® PCI3, PCI5; c) 2P + 3S® P2S3
proprietati oxidante: a) 2P + 3H 2 ® 2РН 3, b) 2P + 3Ca ® Ca 3 P 2
2) Reacții ale fosforului cu substanțe complexe:
a) nu are loc reacția cu apa,
b) 2P + 5H2SO4 (conc.) ® 2H3PO4 + 5SO2 + 2H2O,
c) P + HNO3 (conc.) ® H3PO4 + NO (sau NO2).
3)Stare minimă de oxidare - 3
A) PH 3– fosfină, un gaz otrăvitor cu miros de usturoi,
aprins: 2РH 3 + 4О 2 = Р 2 О 5 + 3H 2 O,
cu unii acizi dă săruri de fosfoniu: РH 3 + HI = РH 4 I
b) fosfuri metalice– compuși ionocovalenti
Mg 3 P 2 + 6 H 2 O = Mg(OH) 2 + 2РН 3,
Ca3P2 + 6HCI = CaCI2 + 2PH3.
4)Stare de oxidare + 1
H 3 PO 2 sau H[PO 2 H 2 ] – acid hipofosforic, puternic; sărurile sunt hipofosfiți, foarte solubili, buni agenți reducători.
5)Stare de oxidare + 3
a) P 2 O 3 – anhidridă de fosfor, are mai multe modificări (P 2 O 3) n, cristale otrăvitoare incolore;
b) H 3 PO 3 sau H 2 [PO 3 H] – acid fosforic, putere medie;
c) săruri fosfit, solubile numai în metale alcaline (K 2 [PO 3 H]),
PCI 3 + CI 2 = PCI 5,
PCI 3 + O 2 = PCI 3,
PCI 3 + HCI® N.
6)Stare de oxidare maximă +5
a) P 2 O 5 – anhidridă de fosfor, pulbere albă, are o modificare (P 2 O 5) 2, un puternic agent de îndepărtare a apei: P 2 O 5 + 2H 2 O = 2HPO 3;
b) HPO 3 - meta, H 4 P 2 O 7 - piro, H 3 PO 4 - acid ortofosforic, putere medie;
c) săruri meta-, piro-, orto-fosfat;
d) halogenurile sunt destul de active:
PCI5 + 4H2O = H3PO4 +5HCI,
RF5 + HF = N.
CARACTERISTICI GENERALE ALE SUBGRUPULUI
7 N, 15 P, 33 As, 51 Sb, 83 Bi. În subgrupul de sus în jos, proprietățile metalice cresc în mod natural și acest lucru este în concordanță cu valorile stărilor de oxidare prezentate de elementele din compuși, precum și cu unele proprietăți fizice. Deși alotropia lui P, As și Sb creează anumite dificultăți la combinarea proprietăților fizice într-un singur tabel:
Tabelul 11
Proprietățile elementelor din a cincea grupă, subgrupul principal
Proprietăți chimice
1. Cu substanțe simple dau o varietate de compuși, prezentând naturi redox diferite:
a) proprietăţi de restaurare
2P + 3CI2 = 2PC13 (sau PC15);
4As + 5O2 = 2As2O5;
2Bi + 3Cl2 = 2BiCl3.
b) Proprietăţi oxidante
2P + 3Ca = Ca3P2;
2As + 3Mg = Mg 3As 2.
2. Ele reacţionează diferit cu acizii în funcţie de natura elementului subgrupului:
2P + 5H2S04 = 2H3PO4 + 5S02 + 2H20;
3As + 5HNO3 + 2H2O = 3H3AsO4 + 5NO;
3Sb + 5HNO3 = 3HSbO3 + 5NO + H20;
2Sb + 6H2SO4 conc. = Sb2(S04)3 + 3S02 + 6H20;
Bi + 4HNO3 = Bi(NO3)3 + NO + 2H2O.
Trebuie amintit că elementele subgrupului de arsenic apar după hidrogen în seria de activitate.
3. Hidroliza compușilor are loc în diferite moduri:
a) PCl3 + 3H20 = H3P03 + 3HCI;
BiCl3 + H2O® BiOCl ¯ + 2HCI.
(SbCl 3) (SbOCl)
b) NaNO 2 + H 2 O Û HNO 2 + NaOH;
K3PO4 + H20Û K2HP04 + KOH;
K 3 AsO 4 + H 2 O Û K 2 HAsO 4 + KOH.
4. Modificările proprietăților acido-bazice ale elementelor se manifestă în moduri diferite
Tabelul 12
Cei mai importanți compuși ai elementelor din al cincilea subgrup
5. Capacitatea redox a compușilor depinde de gradul de oxidare al elementului:
A) E -3– agenţi reducători
2NH3 + 6KМn04 + 6KOH = 6K2MnO4 + N2 + 6H20;
2PH 3 + 4O 2 = P 2 O 5 + 3H 2 O.
Agenti oxidanti:
2KNO 2 + 4H 2 S = 3S + N 2 + K 2 S + 4H 2 O
E +3 2BiCl 3 + 3SnCl 2 + 18KOH = 2Bi + 3K 2 SnO 3 + 12KCl + 9H 2 O.
agenţi reducători:
10KNO 2 +4KМnO 4 +11H 2 SO 4 =10HNO 3 +4MnSO 4 +7K 2 SO 4 +6H 2 O
V) E +5 – Agenti oxidanti
Na 3 SbO 4 + 2NaJ + H 2 SO 4 = Na 3 SbO 3 + J 2 + Na 2 SO 4 + H 2 O.
Elemente din grupa 6. (Calcogeni)
Structura carcasei electronice:... ns 2 np 4.
8 O, 16 S, 34 Se, 52 Te, 84 Po (radioactiv).
OXIGEN și compușii săi
Cel mai comun element de pe Pământ: 21% (în volum) în aer, face parte din H 2 O, minerale și substanțe organice.
Proprietăți fizice
Există sub formă de substanțe:
a) „oxigen” O 2 – un gaz fără culoare, gust, miros, netoxic; t° fierbe. = -183°C; ;
b) „ozon” O 3 – un gaz albastru cu miros înțepător, otrăvitor, un agent oxidant foarte puternic; t° fierbe. = -111,8°C.
Proprietăți chimice
1. Într-o singură reacție oxigenul este un agent reducător:
О 2 + 2F 2 = 2OF 2 ().
2. În toate celelalte cazuri, oxigenul este un agent oxidant, mai ales dacă este în stare atomică:
a) Oxidarea substanţelor simple
2H2 + O2 = 2H20;
S + O2 = S02;
2Ca + O2 = 2CaO.
b) Oxidarea substanţelor complexe
R203 + O2 = R205;
2S02 + O2 = 2S03;
2PCl3 + O2 = 2POCI3.
c) Arderea substanţelor anorganice complexe
2H2S + O2 insuficient = 2S + 2H20;
2H2S + 3O2 g. = 2S02 + 2H2O.
d) Arderea substanţelor organice
CH4 + 2O2 = C02 + 2H20;
C2H5OH + 3O2 = 2CO2 + 3H2O.
SULFUL și compușii săi
Găsit în natură în forma sa nativă; sub formă de minerale (sulfuri, sulfați); în ulei; în proteine.
Proprietăți fizice
Dur, casant, galben, insolubil în H 2 O, dar solubil în sulfură de carbon și anilină. Alotrop: sulf rombic (forma a); monoclinic (b - sulf); plastic etc. Cea mai stabilă modificare este a (t° pl. » 113°C), i se atribuie compoziţia S 8.
Proprietăți chimice
Compușii, care prezintă grade diferite de oxidare, au abilități redox diferite.
Tabelul 13
Cei mai importanți compuși ai sulfului
1. Sulful, interacționând cu compuși complecși, își schimbă starea de oxidare în diferite moduri:
a) S + 2H2SO4 conc. = 3S02 + 2H20 ();
b) S + 6HNO3 conc. = H2S04 + 6NO2 + 2H20 ();
c) 3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
reacție de disproporționare
2. Conexiuni S-2
A) H2S– hidrogen sulfurat, gaz otrăvitor cu miros de ouă putrezite, agent reducător puternic: 2H 2 S + O 2 = 2S + 2H 2 O;
H2S + CI2 = 2HCI + S.
b) Soluție H 2 S – acid slab
H 2 S Û N + + HS - (K 1 = 6 × 10 -8).
c) Săruri – sulfuri; sărurile metalelor alcaline și alcalino-pământoase sunt foarte solubile și se hidrolizează; sulfurile metalelor p și d sunt practic insolubile.
G) sulfuri exponat de metale principal natură:
K2S + H20Û KHS + KOH;
Expoziție de sulfuri nemetalice acid natură:
SiS2 + 3H2O = H2SiO3 + 2H2S.
d) Tiosolii: similar sărurilor obișnuite în care atomii de O sunt înlocuiți cu S:
Na 2 S + CS 2 = Na 2 CS 3 – tiocarbonat de sodiu;
Na2CS3 + 2HCI = 2NaCI + H2CS3
instabil
e) Polisulfuri: sulful, ca și oxigenul din peroxizi, poate forma săruri: Na 2 S soluție + ´S = Na 2 S n - polisulfură de sodiu (conțin punți sulfuroase - S - S - S - S -).
3. S+4 conexiuni
a) SO 2 – dioxid de sulf cu miros înțepător, otrăvitor;
b) Soluţie de SO 2 - acid sulfuros H 2 SO 3, rezistenţă medie
H2SO3Û H + + HSO3- (K1 = 1,3 × 10-2);
c) Săruri – sulfiți, se hidrolizează bine
Na 2 SO 3 + H 2 O Û NaHSO 3 + NaOH.
d) În reacțiile redox, toți acești compuși prezintă dualitate:
S02 + 2H2S = 3S + 2H20;
2SO 2 + O 2 = 2SO 3.
e) clorură de tionil: SOCl2
SOC12 + 2H20 = H2S03 + 2HCI.
4. Conexiuni S+6
A) SO 3– anhidrida sulfurica; alotrop, agent oxidant puternic. Reactioneaza foarte puternic cu apa
S03 + H20® H2S04 + 89,1 kJ/mol;
b) H2SO4– acid sulfuric, lichid uleios incolor; puternic.
H2SO4 conc. – agent oxidant foarte puternic; hartie, zahar, lemn:
C + 2H2SO4 conc. = CO2 + 2SO2 + 2H2O.
Individual, comportamentul său cu metale:
la temperaturi obișnuite nu interacționează cu multe metale („pasivează” Cr, Fe, Al, Zn, ...);
la niveluri ridicate, reacționează cu aproape toate metalele, cu excepția Au și Pt.
Este un agent de îndepărtare a apei foarte bun deoarece... cu apa formeaza hidrati H 2 SO 4 × nH 2 O:
V) Săruri: mediu – K 2 SO 4 (sulfati);
acid – KHSO 4 (sulfați de hidrogen);
vitriol – CuSO 4 × 5H 2 O; ZnS04 x 7H20;
alaun – săruri duble, hidrați de cristal
KA1(S04)2 x 12H20; NH4Fe(SO4)2 × 12H2O.
G) Oleum– o soluție de SO 3 în H 2 SO 4, în timp ce reacția are loc parțial
2SO3 + H2O = H2S2O7 acid pirosulfuric.
d) Clorura de sulfuril SO2Cl2
S02CI2 + 2H20 = H2S04 + 2HCI.
e) Acizi peroxosulfuric– conțin punți de peroxid
H2SO5 – peroxomonosulfur,
H2S2O8 – peroxodisulf;
agenţi oxidanţi puternici.
și) Tiosulfați– conțin sulf în diferite stări de oxidare: S +6 și S -2; datorită prezenței S-2, compușii sunt agenți reducători puternici.
Na2S2O3 + Br2 + H2O = 2HBr + S + Na2SO4.
Acidul corespunzător H 2 S 2 O 3 (tiosulfuric) este instabil:
Na2S2O3 + H2SO4 = Na2SO4 + H2S2O3.
Elemente din grupa 7a. (Halogeni )
Structura carcasei electronice:... ns 2 np 5.
9 F, 17 CI, 35 Br, 53 J, 85 At (radioactiv). În stare liberă ele există sub formă de molecule diatomice.
Proprietăți fizice
Otrăvitor, cu miros înțepător F 2 – gaz galben pal, punct de fierbere. = -188,2°C;
Cl 2 – gaz verde-galben; t° fierbe. = -34,1°C;
Br 2 – lichid roșu; t° fierbe. = 59,2°C;
J 2 – cristale violete; t° fierbe. = +185,5°C.
Proprietăți chimice
1) Cel mai activ este F 2, chiar și sticla și apa arde în atmosfera sa:
2F2 + Si02 = SiF4 + O2;
2F2 + 2H2O = 4HF + O2.
2) Halogenii din amonte (ca agenți oxidanți mai puternici) îi înlocuiesc pe cei din aval de la diverși compuși:
F2 + 2KCI (KBr, KJ) = 2KF + CI2 (Br2, J2).
3) Când halogenii sunt dizolvați în apă și soluții alcaline, apar reacții de disproporționare; În funcție de temperatură, se obțin diferiți produși de reacție:
CI2 + H20 = HCI + HCIO;
CI2 + 2NaOH = NaCI + NaCIO;
4) Halogenuri de hidrogen– toate sunt gaze incolore (HF, datorită legăturilor de hidrogen, formează asociații H x F x).
În seria: HF – HCl – HBr – HJ, puterea de legătură scade și proprietățile reducătoare cresc:
Mn02 + 4HCI = CI2 + MnCI2 + 2H20 ().
5) Când se dizolvă în apă, se obțin acizi tari; HJ este cel mai puternic (cu excepția acidului fluorhidric slab:
H 2 F 2 Û H + + HF 2 -)
6) Halogenuri elementele au caracter acido-bazic diferit, care se manifestă:
a) în reacţii de hidroliză
AlCI3 + H2O Û AlOHCI2 + HCI;
PBr3 + 3H20 = H3PO3 + 3HBr.
b) în reacţii complexe de formare
2NaF + SiF4® Na2;
pentru un număr de liganzi F-; Cl -; Br -; J - scade stabilitatea complexelor.
7) Halogeni în stări superioare de oxidare
a) oxizi: CI2O; (CI02)2; (CI03)2; CI207;
b) acizi: HClO; HCI02; HCI03; HCI04;
pentru un număr de acizi ® rezistența crește, pentru acizi și sărurile lor din aceeași serie scad proprietățile oxidante.
c) acizii și sărurile lor se descompun la încălzire:
d) compuși între halogeni: mulți dintre ei sunt cunoscuți; Compoziția corespunde poziției elementelor în Tabelul Periodic (la sfârșitul formulelor apar mai multe elemente electronegative):
CIF, BrF, JF; CLF3, JF3; CLF5, CLOF3; BrF 7, JO 3 F etc.;
sunt de natură acidă: JF7 + 4H2O = 7HF + HJO4;
ClO3F + 2NaOH = NaClO4 + NaF + H2O.
Întrebări pentru consolidarea materialului:
1. Ce substanță se formează când arsenul reacţionează cu acidul azotic concentrat - a)Аs(NO3)3? b)H3AsO4? c) Ca 2 O 3?
2.Ce substanță reacționează cu acidul concentrat pentru a elibera clor liber – a)CaCl 2? b)MnO2? c) CrC1 3 ?