Ce este inhibarea agregării plachetare? Medicamente care afectează hemostaza trombocitară vasculară Agregarea trombocitară este inhibată de un blocant de ca2
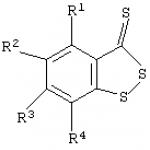
Invenţia se referă la fiziologie, farmacologie şi chimie medicinală, în special, la o metodă îmbunătăţită pentru inhibarea agregării trombocitelor. Acest obiectiv este atins prin metoda îmbunătățită descrisă de inhibare a agregării trombocitelor folosind compuși heterociclici care conțin sulf, care constă în utilizarea benzo-1,2-ditiol-3-tiona (BDTT) cunoscută sau a derivaților săi cu formula generală ca conținând sulf. compuși heterociclici
 în care R1-R4=H sau Ci-4-alchil. Rezultat tehnic: face posibilă inhibarea mai eficientă a agregării plachetare in vitro. Invenţia se referă la fiziologie, farmacologie şi chimie medicinală, în special, la o metodă îmbunătăţită de inhibare a agregării plachetare rol cheie în patogeneza multor boli cardiovasculare (de exemplu, tromboză arterială, infarct miocardic, angină instabilă). Compușii care pot preveni activarea trombocitelor, care poate fi cauzată de inductori endogeni (de exemplu, adenozin-5’-difosfat/ADP), sunt în prezent utilizați pe scară largă pentru a influența în mod eficient modificările patologice ale sistemului hemostatic (B.A. Sidorenko, D. .V. Preobrazhensky. Utilizarea clinică a medicamentelor antitrombotice - M., 1998. Sunt cunoscute diverse metode de inhibare a agregării trombocitelor folosind compuși biciclici care conțin sulf agregarea plachetară ,5,6,7-tetrahidrotienopiridină (ticlopidină) cu formula I
în care R1-R4=H sau Ci-4-alchil. Rezultat tehnic: face posibilă inhibarea mai eficientă a agregării plachetare in vitro. Invenţia se referă la fiziologie, farmacologie şi chimie medicinală, în special, la o metodă îmbunătăţită de inhibare a agregării plachetare rol cheie în patogeneza multor boli cardiovasculare (de exemplu, tromboză arterială, infarct miocardic, angină instabilă). Compușii care pot preveni activarea trombocitelor, care poate fi cauzată de inductori endogeni (de exemplu, adenozin-5’-difosfat/ADP), sunt în prezent utilizați pe scară largă pentru a influența în mod eficient modificările patologice ale sistemului hemostatic (B.A. Sidorenko, D. .V. Preobrazhensky. Utilizarea clinică a medicamentelor antitrombotice - M., 1998. Sunt cunoscute diverse metode de inhibare a agregării trombocitelor folosind compuși biciclici care conțin sulf agregarea plachetară ,5,6,7-tetrahidrotienopiridină (ticlopidină) cu formula I  fiind un antagonist al receptorilor P 2T ADP plachetari (brevet US nr. 4963559, cl. 514-301, op. 1990). clorhidrat de dihidro-5--2-(2-metoxifenil)-1,5-benzotiazepin-4(5H)-onă (diltiazem) cu formula II
fiind un antagonist al receptorilor P 2T ADP plachetari (brevet US nr. 4963559, cl. 514-301, op. 1990). clorhidrat de dihidro-5--2-(2-metoxifenil)-1,5-benzotiazepin-4(5H)-onă (diltiazem) cu formula II  are un efect antitrombotic (A.R.Dehpour, T.Samadian et al. „Efectele diltiazemului și verapamilului asupra modificării și agregării formei trombocitelor induse de ADP la iepure” Gen. Pharmacol, 1995, v.26, No. 6, p.1295-1299 Compușii de mai sus, in vitro, au inhibat agregarea plachetară cauzată de ADP la o concentrație de > 300 μM Benzo-1,2-ditiol-3-tiona (BDTT) și derivații săi cu formula generală III.
are un efect antitrombotic (A.R.Dehpour, T.Samadian et al. „Efectele diltiazemului și verapamilului asupra modificării și agregării formei trombocitelor induse de ADP la iepure” Gen. Pharmacol, 1995, v.26, No. 6, p.1295-1299 Compușii de mai sus, in vitro, au inhibat agregarea plachetară cauzată de ADP la o concentrație de > 300 μM Benzo-1,2-ditiol-3-tiona (BDTT) și derivații săi cu formula generală III.  în care R1R4=H sau C1-6-alchil, benzoil, grupare aminosulfonil (substituită), etc., ca produşi ai sintezei organice (brevet european nr. 0043936, op. 1981). Capacitatea acestor compuşi de a preveni agregarea plachetară nu a fost studiată. Cea mai apropiată de ceea ce este descris este metoda cunoscută de inhibare a agregării plachetare prin introducerea în mediul care conține aceste celule cu compuși heterociclici cu sulf - 3,4-dihidro-1,2-ditiină-2 substituită. -oxizi în special, această metodă a condus la o scădere a agregarii trombocitelor folosind 3,4-dihidro-3-vinil-1,2-ditiin-2-oxid cu formula IV.
în care R1R4=H sau C1-6-alchil, benzoil, grupare aminosulfonil (substituită), etc., ca produşi ai sintezei organice (brevet european nr. 0043936, op. 1981). Capacitatea acestor compuşi de a preveni agregarea plachetară nu a fost studiată. Cea mai apropiată de ceea ce este descris este metoda cunoscută de inhibare a agregării plachetare prin introducerea în mediul care conține aceste celule cu compuși heterociclici cu sulf - 3,4-dihidro-1,2-ditiină-2 substituită. -oxizi în special, această metodă a condus la o scădere a agregarii trombocitelor folosind 3,4-dihidro-3-vinil-1,2-ditiin-2-oxid cu formula IV.  la concentrații relativ mari (de exemplu, în condiții in vitro pentru un compus dat, IC50 = 100 μM) (brevet japonez 02204487, C 07 D 339/08, op. 1991, Chem. Abstr., 1991, v. 114, p. 6523s - prototip). Scopul invenției este de a dezvolta o metodă mai eficientă de inhibare a agregării trombocitelor. caracterizat prin aceea că BDTT cunoscut sau derivații săi cu formula generală III de mai sus, în care R 1 -R 4 au valorile date Compușii cu formula generală III au fost obținuți într-un mod cunoscut - prin reacția o-clorului nesubstituit sau substituit corespunzător. - sau clorură sau bromură de o-bromobenzil cu sulf la o temperatură de 50-200°C într-un mediu monoalchil eter de glicol în prezenţa unui alcoxid de metal alcalin. Invenţia descrisă este ilustrată prin următoarele exemple 1. Inhibarea trombocitelor umane agregarea sub influența BDTT și a derivaților săi. Efectul produselor din prezenta invenție asupra agregării trombocitelor umane a fost studiat prin binecunoscuta metodă turbidimetrică Born. Pentru aceasta, sângele venos prelevat la ora 8 a.m. de la donatori sănătoși a fost centrifugat la 450 g la temperatura camerei într-un recipient de plastic timp de 10 minute, folosind citrat de sodiu ca anticoagulant. Supernatantul, adică plasma bogată în trombocite, a fost colectat și centrifugat la 650 g timp de 30 de minute pentru a obține plasmă săracă în trombocite. Concentraţia de trombocite în plasma bogată în trombocite a fost ajustată la 2,5108 celule/ml prin diluare cu plasmă săracă în trombocite, iar suspensia rezultată a fost turnată într-o cuvă de 0,5 ml. Agregarea a fost indusă prin adăugarea de ADP la o concentrație de 20 μM. Concentrația de ADP a fost selectată în fiecare experiment astfel încât agregarea să fie reversibilă, iar maximul a avut loc la 2 minute după adăugarea de ADP, fără a depăși 50%. Difuzarea luminii a unei suspensii de trombocite a fost măsurată folosind un agregometru dezvoltat la Facultatea de Biologie a Universității de Stat din Moscova. M.V. Lomonosov. Compusul studiat (sub formă de soluţie apoasă, dacă este necesar, conţinând DMSO până la 0,2%) a fost adăugat la probă înainte de adăugarea inductorului de agregare (ADP). Produsele prezentei invenţii la o concentraţie de 1-100 μM a inhibat agregarea plachetară cauzată de 20 μM ADP, în timp ce acțiunea eficientă a fost observată la concentrație<30 мкМ. В частности, значение концентрации, при которой достигалось полумаксимальное ингибирование, (IC 50) для БДТТ составляло 6,4 мкМ. Согласно данным прототипа, для известного аналога (3,4-дигидро-3-винил-1,2-дитиин-2-оксида) в условиях in vitro IC 50 имела значение 100 мкМ.Пример 2. Острая токсичность БДТТ и его производных.Острую токсичность соединений настоящего изобретения определяли известным способом по ЛД 50 с использованием беспородных мышей обоего пола средней массой 21 г при комнатной температуре; стандартное питание и воду давали ad libitum в течение всего эксперимента; подвижность животных не ограничивали. Растворы соединений в ДМСО вводили с помощью стерильного шприца внутрибрюшинно. После инъекции за животными вели наблюдение в течение 48 ч по истечении этого времени за мышами наблюдали дополнительно в течение 72 ч (ни одно из животных не погибло в течение дополнительного промежутка времени). Полученные результаты свидетельствуют о том, что значение ЛД 50 для БДТТ составляет >100 mg/kg, iar pentru derivații săi nu mai mici de 50 mg/kg. Datele prezentate în exemplul 1 arată că metoda descrisă face posibilă inhibarea agregării plachetare in vitro mai eficient în comparație cu metoda cunoscută.
la concentrații relativ mari (de exemplu, în condiții in vitro pentru un compus dat, IC50 = 100 μM) (brevet japonez 02204487, C 07 D 339/08, op. 1991, Chem. Abstr., 1991, v. 114, p. 6523s - prototip). Scopul invenției este de a dezvolta o metodă mai eficientă de inhibare a agregării trombocitelor. caracterizat prin aceea că BDTT cunoscut sau derivații săi cu formula generală III de mai sus, în care R 1 -R 4 au valorile date Compușii cu formula generală III au fost obținuți într-un mod cunoscut - prin reacția o-clorului nesubstituit sau substituit corespunzător. - sau clorură sau bromură de o-bromobenzil cu sulf la o temperatură de 50-200°C într-un mediu monoalchil eter de glicol în prezenţa unui alcoxid de metal alcalin. Invenţia descrisă este ilustrată prin următoarele exemple 1. Inhibarea trombocitelor umane agregarea sub influența BDTT și a derivaților săi. Efectul produselor din prezenta invenție asupra agregării trombocitelor umane a fost studiat prin binecunoscuta metodă turbidimetrică Born. Pentru aceasta, sângele venos prelevat la ora 8 a.m. de la donatori sănătoși a fost centrifugat la 450 g la temperatura camerei într-un recipient de plastic timp de 10 minute, folosind citrat de sodiu ca anticoagulant. Supernatantul, adică plasma bogată în trombocite, a fost colectat și centrifugat la 650 g timp de 30 de minute pentru a obține plasmă săracă în trombocite. Concentraţia de trombocite în plasma bogată în trombocite a fost ajustată la 2,5108 celule/ml prin diluare cu plasmă săracă în trombocite, iar suspensia rezultată a fost turnată într-o cuvă de 0,5 ml. Agregarea a fost indusă prin adăugarea de ADP la o concentrație de 20 μM. Concentrația de ADP a fost selectată în fiecare experiment astfel încât agregarea să fie reversibilă, iar maximul a avut loc la 2 minute după adăugarea de ADP, fără a depăși 50%. Difuzarea luminii a unei suspensii de trombocite a fost măsurată folosind un agregometru dezvoltat la Facultatea de Biologie a Universității de Stat din Moscova. M.V. Lomonosov. Compusul studiat (sub formă de soluţie apoasă, dacă este necesar, conţinând DMSO până la 0,2%) a fost adăugat la probă înainte de adăugarea inductorului de agregare (ADP). Produsele prezentei invenţii la o concentraţie de 1-100 μM a inhibat agregarea plachetară cauzată de 20 μM ADP, în timp ce acțiunea eficientă a fost observată la concentrație<30 мкМ. В частности, значение концентрации, при которой достигалось полумаксимальное ингибирование, (IC 50) для БДТТ составляло 6,4 мкМ. Согласно данным прототипа, для известного аналога (3,4-дигидро-3-винил-1,2-дитиин-2-оксида) в условиях in vitro IC 50 имела значение 100 мкМ.Пример 2. Острая токсичность БДТТ и его производных.Острую токсичность соединений настоящего изобретения определяли известным способом по ЛД 50 с использованием беспородных мышей обоего пола средней массой 21 г при комнатной температуре; стандартное питание и воду давали ad libitum в течение всего эксперимента; подвижность животных не ограничивали. Растворы соединений в ДМСО вводили с помощью стерильного шприца внутрибрюшинно. После инъекции за животными вели наблюдение в течение 48 ч по истечении этого времени за мышами наблюдали дополнительно в течение 72 ч (ни одно из животных не погибло в течение дополнительного промежутка времени). Полученные результаты свидетельствуют о том, что значение ЛД 50 для БДТТ составляет >100 mg/kg, iar pentru derivații săi nu mai mici de 50 mg/kg. Datele prezentate în exemplul 1 arată că metoda descrisă face posibilă inhibarea agregării plachetare in vitro mai eficient în comparație cu metoda cunoscută.
Revendicare
O metodă pentru inhibarea agregării trombocitelor prin introducerea de compuși heterociclici care conțin sulf într-un mediu care conține aceste celule, caracterizată prin aceea că benzo-1,2-ditiol-3-tiona și derivații săi cu formula generală sunt utilizați ca compuși heterociclici care conțin sulf  unde R1-R4 este H sau C1-4 este alchil.
unde R1-R4 este H sau C1-4 este alchil.
Brevete similare:
Invenția se referă la chimia organică și la farmacologie, și anume la un amestec de izomeri ai sării de potasiu a acidului 2-acetic într-un raport molar de 1:3, care prezintă activitate cardiotonică.
Sistemul de hemostază îndeplinește următoarele funcții principale în organism:
Menține sângele în vase în stare lichidă, care este necesară pentru alimentarea normală cu sânge a organelor și țesuturilor;
Oferă oprirea sângerării în caz de deteriorare a peretelui vascular.
Oprirea sângerării (hemostaza - din greacă hemo-sânge, stază- stop) se realizează cu participarea mai multor mecanisme. După afectarea peretelui vascular, apare vasospasmul. Acest răspuns imediat la rănire poate opri sângerarea numai atunci când leziunile vaselor mici sunt minore. Practic, oprirea sângerării se realizează prin formarea de cheaguri de sânge, care previn pierderea de sânge prin închiderea locului de vătămare. O astfel de formare locală de cheaguri de sânge (dopuri hemostatice) în caz de leziuni vasculare este o reacție de protecție.
Cu toate acestea, în anumite condiții, în interiorul vaselor se formează cheaguri de sânge, închizându-le lumenul și împiedicând fluxul sanguin normal. Formarea de trombus intravascular poate apărea cu modificări patologice ale endoteliului vascular, inclusiv afectarea acestuia asociată cu ateroscleroză, creșterea tensiunii arteriale sau alți factori. Cauza cheagurilor de sânge poate fi, de asemenea, modificări anormale ale fluxului sanguin (de exemplu, o scădere a vitezei acestuia) sau o deficiență a anumitor proteine care previn formarea cheagurilor de sânge.
Tromboza apare cu participarea a două procese principale: agregarea trombocitelor și coagularea sângelui (hemocoagularea).
Agregarea trombocitară - aceasta este combinația de trombocite în conglomerate (agregate) de diferite dimensiuni și densități. Acest proces este inițiat atunci când peretele vascular este deteriorat. La locul leziunii, trombocitele se leagă mai întâi de factorul von Willebrand și de colagenul stratului subendotelial (apare aderenţa trombocitelor). Interacțiunea cu colagenul determină activarea trombocitelor (Fig. 27-1). În acest caz, trombocitele însele devin surse de substanțe care stimulează agregarea, cum ar fi tromboxanul A2, ADP,
serotonina. Trombina, care se formează local în timpul coagulării sângelui, induce, de asemenea, agregarea trombocitelor. În plus, catecolaminele, factorul de activare a trombocitelor și unele alte substanțe endogene sunt inductori de agregare.
Agregarea trombocitară este împiedicată de prostaciclină și factorul de relaxare endotelial, care sunt produse de celulele endoteliale vasculare și eliberate în fluxul sanguin. Când celulele endoteliale sunt deteriorate, sinteza acestor substanțe scade și pe acest fond domină efectul substanțelor care stimulează agregarea. Ca rezultat, trombocitele se combină în agregate, din care se formează un tromb trombocitar.
Trombul trombocitar devine mai puternic datorită firelor de fibrină care se formează în acest proces coagularea sângelui. Principalii participanți la acest proces sunt proteinele plasmatice numite factori de coagulare a sângelui.
Factorii de coagulare plasmatici sunt sintetizați în ficat și circulă în sânge într-o formă inactivă. Când peretele vascular este deteriorat, factorul VII este activat rapid cu participarea factor tisular- o proteină transmembranară care este sintetizată de diferite celule (inclusiv celule endoteliale activate) și, în mod normal, nu intră în contact cu sângele. Exprimarea factorului tisular pe suprafața celulei în timpul leziunii endoteliale accelerează semnificativ activarea factorului VII (transformarea acestuia în factor VIIa) în prezența ionilor de Ca2+. Sub influența factorului VIIa (în combinație cu factorul tisular), activarea secvențială a altor factori de coagulare a sângelui (IX și X) are loc într-un sistem autocatalitic complex numit cascada de coagulare a sângelui. Ca urmare, sub influența factorului Xa, se formează trombina (factorul Ha), care transformă fibrinogenul proteic solubil (factorul I) care circulă în sânge în fibrină insolubilă (Fig. 27-5). Fibrina polimerizează și, umplând spațiul dintre trombocite, întărește trombul plachetar. Firele de fibrină pătrund în cheagul de sânge, formând o rețea care captează celulele roșii din sânge care circulă în sânge. Se formează un cheag de sânge roșu.
Coagularea sângelui este contracarată de substanțe care sunt inhibitori naturali ai factorilor activi de coagulare a sângelui.
Activarea factorului X de către factorul VIIa este împiedicată inhibitor al căii factorului tisular, sintetizat de către endotelial
celule. Un inhibitor al trombinei și al altor factori activi de coagulare (Xa, IXa XIa, XIIa) este antitrombina III- o proteina care circula in plasma sanguina care actioneaza in combinatie cu heparina sau substante asemanatoare heparinei (prezente la suprafata celulelor endoteliale intacte). Aceste substanțe accelerează foarte mult inactivarea factorilor de coagulare a sângelui sub influența antitrombinei III.
Inhibitor al factorilor VIIIa și Va necesar pentru formarea trombinei - proteina C activata. Această proteină este sintetizată în ficat cu participarea vitaminei K, circulă în sânge într-o formă inactivă și este activată de trombină pe suprafața celulelor endoteliale intacte. Activarea proteinei C crește odată cu generarea excesivă de trombine. Când se formează cheaguri locale de sânge la locul leziunii peretelui vascular, inhibitorii de mai sus ajută la menținerea sângelui în stare lichidă, prevenind creșterea unui cheag de sânge în interiorul vasului.
Agregarea trombocitară și coagularea sângelui sunt interdependente. Predominanța unuia sau altuia proces în mecanismul de formare a trombului depinde de calibrul vasului și de viteza fluxului sanguin. Agregarea trombocitară este de o importanță mai mare pentru formarea cheagurilor de sânge la viteze mari de flux sanguin, de exemplu. în artere. În vasele venoase, unde viteza fluxului sanguin este scăzută, predomină procesul de coagulare a sângelui.
Soarta ulterioară a trombului depinde de activitatea sistemului fibrinolitic. Dacă acest sistem funcționează normal, fibrina se dizolvă treptat (fibrinoliză) cu participarea enzimei plasmină, care se formează dintr-un precursor inactiv (plasminogen) sub influența activatorilor. Acțiunea plasminei este împiedicată de antiplasminele care circulă în sânge. Activatorii plasminogenului sunt neutralizați de inhibitori specifici.
Întreruperea proceselor de agregare a trombocitelor și coagulare a sângelui și/sau creșterea activității sistemului fibrinolitic poate duce la sângerare, iar activarea excesivă a acestor procese sau inhibarea fibrinolizei poate duce la apariția cheagurilor de sânge intravasculare (tromboză). Ca urmare a trombozei vaselor arteriale, fluxul sanguin către țesuturi scade și ischemia acestora se dezvoltă. Consecința ischemiei este moartea celulară (necroza). Tromboza poate provoca complicații atât de grave precum infarctul miocardic (tromboza arterei coronare), accidentul vascular cerebral ischemic (tromboza vasculară cerebrală) etc. Tromboza venoasă poate provoca embolie pulmonară.
Pentru prevenirea trombozei se folosesc substanțe care inhibă agregarea trombocitelor și coagularea sângelui, prevenind astfel formarea cheagurilor de sânge. Pentru tromboză se folosesc și substanțe care provoacă liza cheagurilor de sânge - agenți trombolitici (fibrinolitici).
Pentru a opri sângerarea, se folosesc agenți care cresc coagularea sângelui și agenți care inhibă fibrinoliza. Alegerea unuia sau altuia depinde de cauza sângerării.
Următoarele grupuri de agenți care afectează formarea trombilor sunt de importanță practică.
Agenți care reduc agregarea trombocitelor(agenți antiplachetari).
Medicamente care afectează coagularea sângelui.
Medicamente care reduc coagularea sângelui (anticoagulante).
Medicamente care cresc coagularea sângelui (hemostatice).
Agenți care afectează fibrinoliza.
Agenți fibrinolitici (trombolitici).
Agenți antifibrinolitici (inhibitori de fibrinoliză).
27.1. MEDICAMENTE CARE REDUC AGREGAȚIA PLACHETARE (ANTIPLACHETARE)
Trombocitele sunt elemente sanguine mici, în formă de disc, care se formează ca fragmente de megacariocite din măduva osoasă. Trombocitele circulă în sânge timp de 6-12 zile și apoi sunt preluate de macrofagele tisulare.
Endoteliul vascular influențează activitatea funcțională a trombocitelor. Celulele endoteliale eliberează prostaciclina (prostaglandina I 2) și factorul de relaxare endotelial, care este identificat cu oxid nitric - NO, în fluxul sanguin. Aceste substanțe previn agregarea trombocitelor. În plus, celulele endoteliale secretă substanțe care reduc coagularea sângelui și favorizează liza cheagurilor. Toate acestea asigură proprietățile antitrombogenice ale endoteliului vascular intact.
Atunci când endoteliul vascular este deteriorat, ceea ce poate fi cauzat de diverși factori (traume mecanice, infecții, modificări aterosclerotice ale peretelui vascular, creșterea tensiunii arteriale etc.), proprietățile antitrombogenice ale endoteliului sunt reduse, ceea ce creează condiții pentru formare. a unui cheag de sânge. Sinteza prostaciclinei și a factorului de relaxare endotelial este perturbată și acest lucru facilitează contactul
trombocite cu suprafața endotelială deteriorată. Trombocitele se acumulează la locul leziunii și interacționează cu subendoteliul vascular: direct sau prin factorul von Willebrand (secretat de trombocitele activate și celulele endoteliale), se leagă de colagen și alte proteine ale subendoteliului cu participarea unor glicoproteine specifice localizate în trombocite. membrană. Factorul Von Willebrand se leagă de glicoproteina Ib, iar colagenul se leagă de glicoproteina Ia a membranei plachetare (vezi Fig. 27-1). Impactul colagenului (precum și al trombinei, care se formează local în cantități mici deja în stadiul inițial de formare a trombului) asupra trombocitelor provoacă o schimbare a stării lor - activarea. Trombocitele își schimbă forma (din forma de disc se răspândesc cu multe procese - pseudopode) și acoperă suprafața deteriorată a vasului.
Când sunt activate, trombocitele eliberează diverse substanțe biologic active, care în trombocitele neactivate sunt localizate în granule (α-granule, granule dense). Granulele dense sunt un depozit de substanțe care stimulează agregarea trombocitară: ADP și serotonina. Eliberarea acestor substanțe din granulele plachetare are loc ca urmare a creșterii concentrației intracelulare de Ca 2+ datorită acțiunii colagenului, trombinei și a altor inductori de agregare, inclusiv ADP însuși, asupra trombocitelor. ADP eliberat în fluxul sanguin stimulează receptorii specifici (purinergici) localizați în membrana trombocitară. Prin receptorii cuplați cu proteina G (receptorii purinergici P2Y 12), ADP determină inhibarea adenilat-ciclazei și o scădere a nivelurilor cAMP, ceea ce duce la creșterea nivelului de Ca 2 în citoplasma trombocitelor (Fig. 27-2).
În plus, atunci când trombocitele sunt activate, activitatea fosfolipazei A2 a membranei plachetare, o enzimă implicată în formarea acidului arahidonic din fosfolipidele membranei, crește. În trombocite, endoperoxizii ciclici (prostaglandine G2/H2) sunt mai întâi sintetizați din acidul arahidonic sub influența ciclooxigenazei și din aceștia, cu participarea tromboxanezinei.
Tetaza produce tromboxan A2, un stimulator activ al agregării plachetare și un vasoconstrictor. Odată eliberat în fluxul sanguin, tromboxanul A 2 stimulează receptorii de tromboxan de pe membranele trombocitelor. Ca rezultat, prin C asociat cu acești receptori q -proteinele fosfolipaza C se activeaza si formarea de
Orez.27-1. Aderența și agregarea trombocitelor în timpul leziunii peretelui vascular: EC - celulă endotelială; VW - factorul von Willebrand; TxA2 - tromboxan A2; PGI 2 - prostaciclină; NO - factor de relaxare endotelial; GP - glicoproteine; GP llb/llla - glicoproteine llb/llla (De la: Katzung B.G. Bazic and Clinical Pharmacology - NY, 2001, cu modificările ulterioare)
inozitol 1,4,5-trifosfat, care favorizează eliberarea de Ca 2+ din depozitul intracelular al trombocitelor (rolul depozitului de calciu în trombocite este îndeplinit de un sistem de tubuli denși). Aceasta duce la o creștere a concentrației citoplasmatice de Ca 2+ (Fig. 27-2). Tromboxanul A 2 determină o creștere a concentrației de Ca 2+ în celulele musculare netede vasculare, ceea ce duce la vasoconstricție.

Orez. 27-2. Mecanisme de acțiune ale agenților antiplachetari (acid acetilsalicilic, ticlopidină și epoprostenol): EC - celulă endotelială; PL - fosfolipide ale membranelor celulare; AA - acid arhidonic; PLA2 - fosfolipaza A2; COX - ciclooxigenază; TS - tromboxan sintetaza; PS - prostaciclin sintetaza; PGG2/H2 - endoperoxizi ciclici; TxA2 - tromboxan A2; PGI 2 - prostaciclină; AC - adenilat ciclază; PLS - fosfolipaza C; IP 3 - inozitol-1, 4, 5-trifosfat
Astfel, ADP și tromboxanul A 2 cresc nivelul de Ca 2+ din citoplasma trombocitelor. Ca 2+ citoplasmatic provoacă o modificare a conformației glicoproteinelor IIb/IIIa în membrana trombocitară, în urma căreia acestea dobândesc capacitatea de a lega fibrinogenul. O moleculă de fibrinogen are două situsuri de legare pentru glicoproteinele IIb/IIIa și astfel poate uni două trombocite (Fig. 27-3). Unirea multor trombocite prin punți de fibrinogen duce la formarea de agregate plachetare.
Prostaciclina (prostaglandina I 2) are efectul opus asupra agregării plachetare. Ca tromboxanul, prostaciclina
se formează din endoperoxizi ciclici, dar sub acțiunea unei alte enzime – prostaciclin sintetaza. Prostaciclina este sintetizată de celulele endoteliale și eliberată în fluxul sanguin, unde stimulează receptorii de prostaciclină din membrana trombocitară și adenilat ciclaza asociată acestora prin intermediul proteinei G. Ca urmare, nivelul de cAMP din trombocite crește și concentrația de Ca 2+ citoplasmatic scade (vezi Fig. 27-2). Acest lucru împiedică modificarea conformației glicoproteinelor IIb/IIIa și își pierd capacitatea de a lega fibrinogenul. Astfel, prostaciclina previne agregarea trombocitelor. Sub influența prostaciclinei, concentrația de Ca 2+ în celulele musculare netede vasculare scade, ceea ce duce la vasodilatație.

Se poate distinge următoarea secvență de evenimente principale care duc la agregarea trombocitelor (vezi Diagrama 27-1).
Accentul principal al acțiunii agenților antiplachetari, care sunt utilizați în prezent în practica clinică, este asociat cu eliminarea acțiunii tromboxanului A 2 și ADP, precum și cu blocarea glicoproteinelor IIb/IIIa a membranelor plachetare. Se folosesc și substanțe cu un mecanism de acțiune diferit, care cresc concentrația de cAMP în trombocite și, prin urmare, reduc concentrația de Ca 2+ în acestea.
Se disting următoarele grupuri de agenți care reduc agregarea trombocitară.
Agenți care inhibă sinteza tromboxanului A2. - Inhibitori de ciclooxigenază:
acid acetilsalicilic.

Schema 27.1. Mecanismul de agregare a trombocitelor
Inhibitori de ciclooxigenază și tromboxan sintetazei: indobufen.
Agenți care stimulează receptorii de prostaciclină:
epoprostenol**.
Agenți care interferează cu efectul ADP asupra trombocitelor:
ticlopidină; clopidogrel.
Agenți care inhibă fosfodiesteraza trombocitară:
dipiridamol
Agenți care blochează glicoproteinele IIb/IIIa ale membranelor plachetare.
Anticorpi monoclonali: abciximab.
Blocante sintetice ale glicoproteinelor IIb/IIIa: eptifibatidă; tirofiban.
Agenți care inhibă sinteza tromboxanului A2
Acidul acetilsalicilic (aspirina*) este un cunoscut agent antiinflamator, analgezic și antipiretic. În prezent, utilizat pe scară largă ca agent antiagregant plachetar. Efectul antiplachetar al acidului acetilsalicilic este asociat cu efectul său inhibitor asupra sintezei tromboxanului A2 în trombocite.
Acidul acetilsalicilic inhibă ireversibil ciclooxigenaza (determină acetilarea ireversibilă a enzimei) și astfel perturbă formarea endoperoxizilor ciclici, precursori ai tromboxanului A2 și ai prostaglandinelor din acidul arahidonic. Prin urmare, sub influența acidului acetilsalicilic scade nu numai sinteza tromboxanului A 2 în trombocite, ci și sinteza prostaciclinei în celulele endoteliale vasculare (vezi Fig. 27-2). Totuşi, prin selectarea dozelor şi regimului adecvat, este posibil să se realizeze un efect preferenţial al acidului acetilsalicilic asupra sintezei tromboxanului A2. Acest lucru se datorează diferențelor semnificative dintre trombocite și celulele endoteliale.
Trombocitele - celule anucleate - nu au un sistem de resinteză a proteinelor și, prin urmare, nu sunt capabile să sintetizeze ciclooxigenaza. Prin urmare, cu inhibarea ireversibilă a acestei enzime, perturbarea sintezei tromboxanului A2 persistă pe toată durata vieții trombocitelor, adică. în termen de 7-10 zile. Datorită formării de noi trombocite, efectul antiplachetar al acidului acetilsalicilic durează o perioadă mai scurtă de timp și, prin urmare, pentru a obține un efect stabil al medicamentului (adică, o scădere stabilă a nivelului de tromboxan), se recomandă prescrierea acestuia. o data pe zi.
Cicloxigenaza este resintetizată în celulele endoteliale vasculare, iar activitatea acestei enzime este restabilită în câteva ore după administrarea acidului acetilsalicilic. Prin urmare, atunci când se prescrie medicamentul o dată pe zi, nu există o reducere semnificativă a sintezei prostaciclinei.

În plus, aproximativ 30% din acidul acetilsalicilic suferă un metabolism de primă trecere în ficat, astfel încât concentrația sa în circulația sistemică este mai mică decât în sângele portal. Ca urmare, acidul acetilsalicilic acționează asupra trombocitelor care circulă în fluxul sanguin portal în concentrații mai mari decât asupra celulelor endoteliale ale vaselor sistemice. Prin urmare, pentru a suprima sinteza tromboxanului A2 în trombocite, sunt necesare doze mai mici de acid acetilsalicilic decât pentru a suprima sinteza prostaciclinei în celulele endoteliale.
Din aceste motive, odată cu creșterea dozei și a frecvenței de administrare a acidului acetilsalicilic, efectul său inhibitor asupra sintezei prostaciclinei devine mai pronunțat, ceea ce poate duce la o scădere a efectului antiplachetar. În legătură cu aceste caracteristici, acidul acetilsalicilic ca agent antiplachetar este recomandat să fie prescris în doze mici (în medie 100 mg) o dată pe zi.
Ca agent antiagregant plachetar, acidul acetilsalicilic este utilizat pentru angina instabilă, pentru prevenirea infarctului miocardic, a accidentului vascular cerebral ischemic și a trombozei vaselor periferice, pentru a preveni formarea cheagurilor de sânge în timpul grefei de bypass coronarian și a angioplastiei coronariene. Acidul acetilsalicilic este prescris pe cale orală în doze de 75-160 mg (pentru anumite indicații - în intervalul de doze de la 50 la 325 mg) o dată pe zi pentru o perioadă lungă de timp. În prezent, medicii au la dispoziție preparate cu acid acetilsalicilic destinate prevenirii trombozei, care conțin 50-325 mg de substanță activă, inclusiv comprimate acoperite enteric - Acecardol*, Aspicor*, Cardiopyrin*, Aspirin Cardio*, Novandol*, Trombo ACC * etc. Efectul antiplachetar al acidului acetilsalicilic apare rapid (în 20-30 de minute). Formele de dozare acoperite enteric încep să acționeze mai lent, dar cu utilizarea pe termen lung, eficacitatea lor nu este practic diferită de cea a tabletelor convenționale. Pentru a obține un efect mai rapid, tabletele de acid acetilsalicilic trebuie mestecate.
Principalele efecte secundare ale acidului acetilsalicilic sunt asociate cu inhibarea ciclooxigenazei. Aceasta perturbă formarea prostaglandinelor E 2 și I 2, care au efect antisecretor și gastroprotector (reduce secreția de acid clorhidric de către celulele parietale ale stomacului, crește secreția de mucus și bicarbonați). Ca rezultat, chiar și cu utilizarea pe termen scurt, acidul acetilsalicilic poate provoca leziuni ale epiteliului stomacului și duodenului (efect ulcerogen). Efectul asupra mucoasei gastrice este mai puțin pronunțat atunci când se utilizează forme de dozare acoperite enteric. Când se utilizează acid acetilsalicilic, sunt posibile sângerări gastrointestinale și alte complicații hemoragice. Riscul apariției unor astfel de complicații este mai mic atunci când acidul acetilsalicilic este prescris la o doză de 100 mg/zi sau mai puțin. Inhibarea selectivă a COX duce la activarea căii lipoxigenazei pentru conversia acidului arahidonic și formarea de leucotriene, care au proprietăți bronhoconstrictoare. La pacienții cu astm bronșic, acidul acetilsalicilic poate provoca apariția unui atac („astm cu aspirină”). Sunt posibile reacții alergice.
Pentru a reduce efectul ulcerogen al acidului acetilsalicilic, a fost propus un medicament combinat Cardiomagnyl * care conține hidroxid de magneziu. Hidroxidul de magneziu neutralizează acidul clorhidric din stomac (efect antiacid), reducând efectul său dăunător asupra membranei mucoase. Medicamentul este utilizat pentru aceleași indicații ca și acidul acetilsalicilic, inclusiv pentru prevenirea secundară a accidentului vascular cerebral ischemic.
Indobufenul (ibustrin*) reduce sinteza tromboxanului A 2, inhibă simultan ciclooxigenaza și tromboxan sintetaza. Spre deosebire de acidul acetilsalicilic, indobufenul determină inhibarea reversibilă a ciclooxigenazei. Când luați acest medicament, există o creștere relativă a cantității de prostaciclină (raportul prostaciclină/tromboxan A 2 crește). Indobufenul inhibă aderența și agregarea trombocitelor. Indicațiile de utilizare și efectele secundare sunt aceleași ca și pentru acidul acetilsalicilic.
Agenți care stimulează receptorii de prostaciclină
O altă modalitate de a reduce agregarea trombocitară este stimularea receptorilor de prostaciclină. În acest scop folosesc
preparat de prostaciclină e p o pro s t e n o l * . Efectul prostaciclinei este opus efectului tromboxanului A 2 nu numai asupra trombocitelor, ci și asupra tonusului vascular. Determină vasodilatație și scăderea tensiunii arteriale. Acest efect al prostaciclinei este utilizat în hipertensiunea pulmonară. Deoarece prostaciclina este distrusă rapid în sânge (t 1/2 aproximativ 2 minute) și, prin urmare, nu acționează mult timp, medicamentul este administrat prin perfuzie. Datorită acțiunii sale scurte, epoprostenolul* nu a găsit o utilizare pe scară largă ca agent antiagregant plachetar. O posibilă zonă de utilizare a efectului antiplachetar al epoprostenolului este prevenirea agregării trombocitelor în timpul circulației extracorporale.
Agenți care interferează cu acțiunea ADP asupra trombocitelor
Ticlopidina (ticlid*), un derivat de tienopiridină, inhibă agregarea plachetară cauzată de ADP. Ticlopidina este un promedicament; efectul său antiplachetar este asociat cu formarea unui metabolit activ cu participarea enzimelor hepatice microzomale. Metabolitul ticlopidinei conține grupări tiol, prin care se leagă ireversibil de receptorii purinergici P2Y 12 din membrana trombocitară. Acest lucru duce la eliminarea efectului stimulator al ADP asupra trombocitelor și la o scădere a concentrației de Ca 2+ citoplasmatic în acestea. Ca urmare, expresia glicoproteinelor IIb/IIIa în membrana trombocitară și legarea lor la fibrinogen scade (vezi Fig. 27-2). Datorită naturii ireversibile a acțiunii sale, ticlopidina are un efect antiagregant plachetar de lungă durată.
Efectul maxim cu utilizarea constantă a ticlopidinei este atins după 7-11 zile (timpul necesar formării și dezvoltării acțiunii metabolitului activ) și după întreruperea medicamentului persistă pe toată durata de viață a trombocitelor (7-10). zile).
Ticlopidina este prescrisă pentru prevenirea secundară a accidentului vascular cerebral ischemic, pentru prevenirea trombozei în bolile obliterante ale extremităților inferioare, în timpul grefei de bypass coronarian și stentarea arterelor coronare. Medicamentul este eficient atunci când este administrat pe cale orală, prescris de 2 ori pe zi cu mese.
Utilizarea ticlopidinei este limitată din cauza efectelor sale secundare. Posibilă pierdere a poftei de mâncare, greață, vărsături, diaree (20%), dureri abdominale, erupții cutanate (11-14%). Remarcat
creșterea nivelului plasmatic al lipoproteinelor aterogene. Sângerarea este o complicație frecventă atunci când se utilizează agenți antiplachetari. O complicație periculoasă este neutropenia, care apare în primele trei luni de tratament la 1-2,4% dintre pacienți. Trombocitopenia, agranulocitoza și foarte rar anemia aplastică sunt posibile. În acest sens, în primele luni de tratament este necesară monitorizarea sistematică a tabloului sanguin.
Clopidogrelul (Plavix*, Zilt*) este similar cu ticlopidinei în structura chimică, efectele principale și mecanismul de acțiune. La fel ca ticlopidina, este un promedicament și suferă conversie în ficat pentru a forma un metabolit activ. Inhibarea semnificativă a agregării trombocitelor a fost observată din a doua zi de tratament, efectul maxim fiind atins după 4-7 zile. După întreruperea administrării medicamentului, efectul acestuia durează 7-10 zile. Clopidogrelul este superior ca activitate ticlopidinei - la o doză zilnică de 75 mg determină aceeași scădere a agregării trombocitelor și prelungirea timpului de sângerare ca și ticlopidinei la o doză zilnică de 500 mg.

Clopidogrelul se utilizează pentru aceleași indicații ca și acidul acetilsalicilic, în caz de intoleranță. Luați pe cale orală 1 dată pe zi, indiferent de mese. Clopidogrelul poate fi combinat cu acid acetilsalicilic, deoarece medicamentele inhibă diferite mecanisme de agregare a trombocitelor și, prin urmare, își sporesc efectul unul altuia (cu toate acestea, cu această combinație există un risc mai mare de complicații hemoragice).
În comparație cu ticlopidina, efectele secundare ale clopidogrelului sunt mai puțin pronunțate (diaree - 4,5%, erupție cutanată - 6%). Utilizarea clopidogrelului este asociată cu un risc mai scăzut al unei complicații atât de grave precum neutropenia (0,1%), iar trombocitopenia apare mai rar. Ca o complicație rară, ca și în cazul ticlopidinei, se poate dezvolta purpura trombocitopenică trombotică.
Inhibitori ai fosfodiesterazei plachetare
Dipiridamolul (curantyl*, persantin*) a fost propus pentru prima dată ca dilatator coronarian. Mai târziu, a fost dezvăluită capacitatea sa de a inhiba agregarea trombocitelor. În prezent, dipiridamolul este utilizat în principal ca agent antiplachetar pentru prevenirea trombozei. Efectul antiplachetar al dipiridamolului este asociat cu o creștere a nivelului de cAMP în trombocite, în urma căreia concentrația de Ca 2+ citoplasmatic în acestea scade. Acest lucru se întâmplă din mai multe motive. În primul rând, dipiridamolul inhibă fosfodiesteraza, care inactivează AMPc. În plus, dipiridamolul inhibă captarea adenozinei de către celulele endoteliale și eritrocite și metabolismul acesteia (inhibă adenozin deaminaza), crescând astfel nivelul de adenozină din sânge (Fig. 27-4). Adenozina stimulează receptorii plachetari A 2 și crește activitatea adenilat-ciclazei asociată cu acești receptori, ca urmare, formarea de cAMP în trombocite crește și nivelul de Ca 2+ citoplasmatic scade. Dipiridamolul crește, de asemenea, nivelurile de AMPc în celulele musculare netede vasculare, provocând vasorelaxare.

Dipiridamolul este utilizat pentru prevenirea accidentului vascular cerebral ischemic, precum și pentru bolile arterelor periferice (în principal în combinație cu acid acetilsalicilic, deoarece dipiridamolul însuși are un efect antiplachetar slab). Se prescrie pe cale orală de 3-4 ori pe zi cu 1 oră înainte de masă. În combinație cu anticoagulante orale, dipiridamolul este prescris pentru a preveni formarea cheagurilor de sânge în bolile cardiace mitrale.
Când utilizați dipiridamol, dureri de cap, amețeli, hipotensiune arterială, simptome dispeptice,
iritatii ale pielii. Riscul de sângerare este mai mic decât în cazul utilizării acidului acetilsalicilic. Dipiridamolul este contraindicat în cazurile de angină pectorală (posibil „sindrom de furt”).

Orez. 27-4. Mecanismul acțiunii antiplachetare a dipiridamolului: EC - celula endotelială; A2-P-receptor de adenozină A2; PDE - cAMP fosfodiesteraza; AC - adenilat ciclază; GP IIb/IIIa - glicoproteine IIb/IIIa
Pentoxifilina (agapurina*, trental*), ca și dipiridamolul, inhibă fosfodiesteraza și crește nivelul cAMP. Ca urmare, nivelul de Ca 2 + citoplasmatic din trombocite scade, ceea ce duce la o scădere a agregării acestora. Pentoxifilina are și alte proprietăți: crește deformabilitatea globulelor roșii, reduce vâscozitatea sângelui și are efect vasodilatator, îmbunătățind microcirculația.
Pentoxifilina este utilizată pentru accidentele cerebrovasculare, tulburările circulatorii periferice de diferite origini și patologia vasculară a ochilor (vezi capitolul „Medicamente utilizate pentru accidentele cerebrovasculare”). Reacții adverse posibile: simptome dispeptice, amețeli, roșeață a feței, precum și scăderea tensiunii arteriale, tahicardie, reacții alergice, sângerare. La fel ca dipiridamolul, poate provoca atacuri în timpul anginei pectorale.
Agenți care blochează glicoproteinele IIb/IIIa ale membranelor plachetare
Acest grup de agenți antiplachetari, care interacționează direct cu glicoproteinele IIb/IIIa ale membranelor plachetare și perturbă legarea acestora de fibrinogen, a apărut relativ recent.
Abciximab (reopro*) - primul medicament din acest grup este un anticorp monoclonal „himeric” de șoarece/uman (fragment Fab de anticorpi de șoarece la glicoproteinele IIb/IIIa combinat cu fragmentul Fc al Ig umană). Abciximabul inhibă în mod necompetitiv legarea fibrinogenului de glicoproteinele IIb/IIIa de pe membrana trombocitară, perturbând agregarea acestora (vezi Fig. 27-3). Agregarea trombocitară se normalizează la 48 de ore după o singură doză. Medicamentul se administrează intravenos (sub formă de perfuzie) pentru a preveni tromboza în timpul angioplastiei arterelor coronare. Când se utilizează abciximab, este posibilă sângerare, inclusiv internă (gastrointestinală, intracraniană, sângerare din tractul genito-urinar), greață, vărsături, hipotensiune arterială, bradicardie, reacții alergice până la șoc anafilactic, trombocitopenie.
Căutarea unor medicamente mai puțin alergene cu același mecanism de acțiune a dus la crearea blocanților sintetici ai glicoproteinelor IIb/IIIa. Pe baza de barborină (o peptidă izolată din veninul șarpelui cu clopoței pigmeu), s-a obținut medicamentul e p t i f i b a t i d (integrilin *) - o hectapeptidă ciclică care imită secvența de aminoacizi a lanțului de fibrinogen, care se leagă direct de glicoproteinele IIb/IIIa. Eptifibatida înlocuiește în mod competitiv fibrinogenul de la legarea la receptori, provocând o tulburare reversibilă a agregării plachetare. Medicamentul se administrează intravenos sub formă de perfuzie; efectul antiplachetar apare în decurs de 5 minute și dispare la 6-12 ore de la încetarea administrării. Medicamentul este recomandat pentru prevenirea formării de trombi în timpul angioplastiei coronariene percutanate, pentru angina instabilă și pentru prevenirea infarctului miocardic. O complicație periculoasă la utilizarea eptifibatidei este sângerarea; trombocitopenia este posibilă.
Tirofiban (agrastat*) este un blocant non-peptidic al glicoproteinelor IIb/IIIa, un analog al tirozinei. Ca și eptifibatida, tirofibanul blochează competitiv receptorii glicoproteinei IIb/IIIa. Medicamentul se administrează intravenos (perfuzie). Viteza de apariție a efectului, durata de acțiune și indicațiile de utilizare sunt aceleași ca pentru eptifibatidă. Efecte secundare - sângerare, trombocitopenie.
Pentru a extinde posibilitățile de utilizare a medicamentelor din acest grup, au fost creați blocanți ai glicoproteinelor IIb/IIIa care sunt eficienți atunci când sunt administrați pe cale orală - xemilofiban *, sibrafiban * etc. Cu toate acestea, testele acestor medicamente au evidențiat eficacitatea lor insuficientă și un efect secundar în formă de trombocitopenie severă.
27.2. MEDICAMENTE CARE AFECTEAZĂ COAgulaREA SÂNGELUI
Deteriorarea peretelui vascular inițiază nu numai agregarea trombocitelor, ci și coagularea sângelui. Există mulți factori cunoscuți (plasmă, țesuturi, trombocite) implicați în acest proces. Cele mai multe dintre ele sunt proteine plasmatice care circulă în stare inactivă, dar sunt ulterior activate în timpul procesului de coagulare a sângelui. Pentru a explica efectul medicamentelor, este necesar să menționăm factorul VII (proconvertin), factorul IX (Crăciun), factorul X (Stuart-Prower), factorul II (protrombina). Acești factori de coagulare sunt proenzime și, atunci când sunt activați, sunt transformați în enzime proteolitice (factorii GCa, Xa și Na). Factorii VIII și V, după activare, acționează ca proteine cofactori pentru enzime (factorii IXa și respectiv Xa), crescând activitatea lor proteolitică.
Factorul VII are inițial activitate proteolitică scăzută, dar ca urmare a interacțiunii cu factorul tisular (vezi p. 481), crește rapid. Factorul VII activat (factorul VIIa), împreună cu factorul tisular și Ca 2+, formează un complex care provoacă proteoliza parțială a factorilor IX și X. Factorul IXa, la rândul său, activează suplimentar factorul X (se formează factorul Xa). Factorul Xa acționează asupra protrombinei (factorul II) și o transformă în trombină (factorul Ha). Trombina determină proteoliza parțială a fibrinogenului pentru a forma fibrină (Fig. 27-5).
Activarea proteolitică a factorilor de coagulare a sângelui este accelerată semnificativ dacă aceștia se leagă prin ionii de Ca2+ la fosfolipidele încărcate negativ ale membranelor celulare. Aceste fosfolipide acționează ca un fel de matrice pe care factorii de coagulare sunt asamblați în complexe cu participarea ionilor de Ca 2 +. În același timp, rata de activare a factorilor din aceste complexe crește de 10 mii de ori sau mai mult. O condiție necesară pentru formarea unor astfel de complexe este capacitatea factorilor II, VII, IX și X de a se lega de Ca2+. Acești factori conțin încărcare negativă
reziduuri de acizi γ-carboxiglutamici, care asigură legarea lor la Ca 2+. Formarea acizilor γ-carboxiglutamici are loc în ficat cu participarea vitaminei K. Cu deficiența vitaminei K, în sânge apar factori de coagulare II, VII, IX și X defectuoși, ceea ce perturbă formarea fibrinei.

Orez. 27-5. Schema de activare a coagulării sângelui în caz de deteriorare a peretelui vascular (Din: Katzung B. G. Farmacologie de bază și clinică. - NY, 2001, cu modificările ulterioare): complexele de factori de coagulare a sângelui asociați cu fosfolipidele încărcate negativ ale membranelor celulare sunt subliniate cu un linie îndrăzneață. Complexul VIIa + TF + Ca 2+ activează factorii X și IX (TF - factor de țesut). Complexul IXa + VIIIa + Ca 2+ activează suplimentar factorul X. Complexul Xa + Va + Ca 2+ (protrombinaza) favorizează conversia protrombinei în trombină. Factorii închiși în cutii sunt inhibați de heparină
Proteinele plasmatice din sânge, care conțin reziduuri de acid γ-carboxiglutamic și se formează în ficat cu participarea vitaminei K, includ, de asemenea, proteinele C și S. După activare, proteina C (Ca) determină scindarea proteolitică a factorilor VIIIa și Va. Acest lucru duce la întreruperea formării trombinei. Proteina S acționează ca un cofactor în reacțiile de proteoliză. Activarea proteinei C are loc sub influența trombinei pe suprafața celulelor endoteliale intacte (nedeteriorate) care exprimă proteina trombomodulină, care leagă simultan proteina C și trombina.
27.2.1. Anticoagulante (anticoagulante)
Anticoagulantele utilizate în practica clinică fie inhibă factorii activi de coagulare direct în sânge, fie interferează cu formarea lor în ficat. Prin urmare, acestea sunt împărțite în 2 grupe:
(acționează direct în sânge).
- Heparină standard(nefracționat).
- Heparine cu greutate moleculară mică:
enoxaparină de sodiu;
Nadroparină de calciu;
Dalteparină de sodiu;
Reviparina de sodiu.
- Heparinoide:
sulodexid;
Danaparoid**.
- Medicament antitrombina III.
- Preparate cu hirudin:
Lepirudin*.
- Proteina C activată:
Drotrecogin alfa.
(inhiba sinteza factorilor de coagulare in ficat).
- Derivați de cumarină:
acenocumarol (sincumar*);
Warfarină (warfarex*).
- Derivați de indandionă:
Fenindiona (fenilina*).
Anticoagulante directe
heparină- glicozaminoglican sulfatat (mucopolizaharidă), format din D-glucozamină și reziduuri de acid D-glucuronic. Heparina este produsă de mastocite în multe țesuturi; este conținut în cantități mari de ficat, plămâni și mucoasa intestinală. În scopuri medicale, heparina este izolată din mucoasa intestinală a porcilor și din plămânii bovinelor. În curs
izolarea produce un amestec de fracții cu lungimi diferite ale lanțului polizaharidic și greutăți moleculare diferite (de la 3000 la 40.000 D). Fracțiile cu greutăți moleculare diferite diferă ușor în activitatea biologică și proprietățile farmacocinetice. Prin urmare, preparatele de heparină obținute prin metode diferite și din surse diferite pot avea activitate anticoagulantă diferită, drept urmare este necesară realizarea standardizării lor biologice. Activitatea heparinei este determinată de capacitatea sa de a prelungi timpul de coagulare a sângelui (1 mg de heparină standard conține 130 de unități).
Heparina are efect asupra factorilor de coagulare a sângelui numai după formarea unui complex cu anticoagulantul endogen antitrombina III. Antitrombina III, o glicoproteină a plasmei sanguine, inhibă serin proteazele, care includ factorii de coagulare a sângelui IIa (trombina), EXa și Xa (precum XIa și XIIa). Procesul de inactivare a factorului numai sub influența antitrombinei III decurge foarte lent. Heparina determină modificări conformaționale în molecula de antitrombină III, ceea ce duce la o accelerare a acestui proces de aproximativ 1000 de ori.

Acțiunea principală a complexului heparină-antitrombină III este îndreptată împotriva trombinei și a factorului Xa, dar mecanismele de inhibare a acestor factori prezintă unele diferențe. Pentru a inactiva trombina, heparina trebuie să se lege atât de molecula de antitrombină III, cât și de molecula de trombină. În același timp, inactivarea rapidă a factorului Xa de către complexul heparină-antitrombină III nu necesită legarea acestui factor la heparină. Fracțiile de heparină cu un lanț polimeric relativ scurt (mai puțin de 18 unități de zaharidă) nu pot lega simultan antitrombina III și trombina și, prin urmare, nu au activitate antitrombină. Acțiunea lor este asociată în principal cu inactivarea factorului Xa și, prin urmare, cu perturbarea conversiei protrombinei în trombină.
Pe lângă efectul său asupra coagulării sângelui, heparina are și alte efecte: reduce nivelul lipidelor din sânge datorită activării lipoprotein lipazei (această enzimă hidrolizează trigliceridele) și suprimă proliferarea celulelor musculare netede.
Heparina este slab absorbită atunci când este administrată pe cale orală, deci se administrează intravenos, uneori subcutanat. La administrarea intravenoasă, efectul apare imediat și durează 2-6 ore Când este administrată subcutanat, heparina începe să acționeze după 1-2 ore, durata de acțiune este de 8-12 ore (se prescrie de 2-3 ori pe zi). Heparina din sânge se leagă de multe proteine, inclusiv de cele care o neutralizează (factor trombocitar 4 și unele altele). Nivelurile ridicate ale acestor proteine în sânge pot provoca rezistență relativă la medicament. În plus, heparina se leagă de macrofage și celule endoteliale și are loc degradarea acesteia (depolimerizarea). Heparina este, de asemenea, metabolizată în ficat și excretată prin rinichi.
Heparina este utilizată pentru prevenirea și tratamentul trombozei venoase profunde și emboliei pulmonare, pentru angina instabilă și infarctul miocardic, pentru prevenirea trombozei arterelor periferice, pentru înlocuirea valvelor cardiace și circulația extracorporală. Heparina este dozată în unități de acțiune (AU).
Cele mai frecvente complicații ale terapiei cu heparină sunt sângerările, care pot fi cauzate de inhibarea funcției trombocitelor sau de scăderea numărului acestora (trombocitopenie). Legarea heparinei de factorul von Willebrand pare să explice efectul său inhibitor asupra adeziunii și agregării trombocitelor. În astfel de cazuri, heparina este întreruptă, iar în caz de sângerare gravă se administrează și sulfat de protamina intravenos, care neutralizează heparina prin formarea unui complex insolubil.
Trombocitopenia apare în zilele 7-14 de tratament la aproximativ 1-5% dintre pacienții cărora li se administrează heparină. Este cauzată de apariția anticorpilor (IgG) direcționați împotriva complexului heparină-factor 4 plachetar. Acest complex se leagă de membrana trombocitară la neutralizarea heparinei de către factorul 4, o glicoproteină derivată din trombocite care este eliberată la agregarea trombocitelor. Mai puțin de 1% dintre pacienții cu trombocitopenie prezintă tromboză din cauza leziunilor endoteliale
celulele și activarea trombocitelor de către anticorpi la complexul heparină-factor 4 Această afecțiune necesită întreruperea heparinei și numirea anticoagulantelor care nu provoacă trombocitopenie: danaparoid** și lepirudină**.
La administrarea pe termen lung a heparinei (mai mult de 3 luni), se poate dezvolta osteoporoza. Acest lucru este deosebit de important de luat în considerare atunci când prescrieți heparină în timpul sarcinii. Hiperkaliemia asociată cu inhibarea sintezei de aldosteron în glandele suprarenale este o complicație destul de rară a terapiei cu heparină.
Heparine cu greutate moleculară mică (fracționate). constau din fragmente de heparină cu o greutate moleculară de la 1000 la 10.000 D (în medie, 4000-5000 D). Ele sunt obținute prin fracționarea, hidroliza sau depolimerizarea heparinei convenționale (nefracționate). Aceste medicamente, precum heparina, acționează asupra factorilor de coagulare prin intermediul antitrombinei III, dar diferă de heparină prin următoarele proprietăți:
Ele inhibă activitatea factorului Xa într-o măsură mai mare decât factorul IIa (de 3-4 ori);
Au o biodisponibilitate mai mare atunci când sunt administrate subcutanat (heparine cu greutate moleculară mică - aproximativ 90%, heparină standard - 20%);
Acţionează pe o perioadă mai lungă de timp, ceea ce le permite să fie administrate de 1-2 ori pe zi;
Au o afinitate mai mică pentru factorul trombocitar 4, deci sunt mai puțin probabil să provoace trombocitopenie decât heparina standard;
Mai rar provoacă osteoporoză.
În practica casnică se folosesc următoarele preparate de heparine cu greutate moleculară mică: en o x a parin sodiu (Clexane *), nadroparină calcică (Fraxiparin *), d alte parin sodiu (Fragmin *), reviparin sodiu (klivarin*). Aceste medicamente sunt eterogene în compoziția lor (conțin diferite fracțiuni de heparină), prin urmare diferă oarecum unele de altele în proprietăți fizico-chimice, farmacocinetice și activitate.
Heparinele cu greutate moleculară mică sunt utilizate pentru prevenirea și tratamentul trombozei venoase profunde (în special după intervenții chirurgicale), pentru a preveni embolia pulmonară, precum și pentru angina instabilă și infarctul miocardic. Preparatele cu heparină cu greutate moleculară mică sunt indicate pentru profilaxie
ticuri si terapia trombozei in practica obstetricala. Se administrează numai subcutanat. Dozajul este dat în ME (unități internaționale).
Heparinele cu greutate moleculară mică, precum preparatele cu heparină nefracţionată, pot provoca sângerări. În primele zile de tratament este posibilă o trombocitopenie moderată. Heparinele cu greutate moleculară mică cresc în unele cazuri activitatea enzimelor hepatice și pot provoca reacții alergice. Sulfatul de protamina nu elimină complet efectele heparinelor cu greutate moleculară mică.
Recent, în practica clinică a apărut medicamentul fo n d a p a - sodium rinux - o pentazaharidă sintetică, care, prin legarea de antitrombina III, accelerează inactivarea factorului Xa. Medicamentul este produs sub formă de sare de sodiu și este utilizat pentru prevenirea trombozei venoase și a emboliei pulmonare în chirurgia ortopedică.
heparinoide- glicozaminoglicani sulfataţi, înrudiţi structural cu heparinele. La fel ca heparina, ele sporesc efectul inhibitor al antitrombinei III asupra factorilor de coagulare a sângelui. Prin multe caracteristici importante, ele diferă de heparină și heparine cu greutate moleculară mică, așa că sunt clasificate într-un grup special. Danaparoide* și sulodexide aparțin acestui grup. Aceste medicamente sunt obținute din mucoasa intestinală a porcilor.
Danaparoid** (organo**) conține un amestec de sulfat de heparan, sulfat de dermatan și sulfat de condroitin. Danaparoid p inhibă factorul Xa mai semnificativ decât protrombina. Medicamentul este administrat subcutanat pentru prevenirea și tratamentul trombozei venoase. Danaparoid p nu se leagă de factorul trombocitar 4 și nu provoacă trombocitopenie. Prin urmare, este indicat în cazurile în care terapia cu heparină este complicată de trombocitopenie.
Sulodexida (Wessel Due F*) constă dintr-un amestec de sulfat de heparan și sulfat de dermatan. Sulodexida reduce în mare măsură activitatea factorului Xa, cu un efect redus asupra protrombinei. Medicamentul crește activitatea fibrinolitică, are un efect protector asupra endoteliului vascular și are proprietăți hipolipidemiante. Sulodexida este indicată pentru bolile vasculare periferice cu risc crescut de tromboză. Există forme de dozare ale medicamentului pentru administrare parenterală (intravenoasă și intramusculară) și pentru administrare orală.
Antitrombina IIInecesare pentru efectul anticoagulant al heparinei, heparinelor cu greutate moleculară mică și heparinoidelor.
În caz de deficiență ereditară de antitrombină III, medicamentul său este utilizat și administrat intravenos. Odată cu utilizarea pe termen lung a heparinei, consumul de antitrombină III crește, astfel încât concentrația acesteia în sânge scade semnificativ. Acest lucru reduce eficacitatea terapiei cu heparină. În astfel de cazuri, se administrează și antitrombina III.
Hirudin- o proteină cu o greutate moleculară de 7 kDa, descoperită pentru prima dată în glandele salivare ale lipitorilor medicinale Hirudo medicinalis. Hirudina, ca și heparina, este un anticoagulant care acționează direct în sânge, dar spre deosebire de heparină, hirudina inhibă direct trombina: se leagă selectiv de ea și o inactivează fără participarea antitrombinei III. Inhibarea este ireversibilă. Spre deosebire de heparină, hirudina are capacitatea de a inhiba trombina asociată cu cheagul de sânge și, astfel, de a întârzia creșterea cheagului de sânge. Hirudina nu interacționează cu factorul trombocitar 4 și, prin urmare, nu provoacă trombocitopenie.
A fost obținut un preparat recombinant de hirudin - le p i r u d i n * (refludan *) pentru uz clinic. Se recomandă utilizarea pentru prevenirea posibilelor complicații tromboembolice în trombocitopenia cauzată de heparină. Lepirudina* se administrează intravenos. În timpul utilizării pot apărea sângerări. Nu există un antidot specific pentru preparatele cu hirudină.
Drotrecogin alfa (Zigris*) este un preparat recombinant de proteină C activată. Inhibă formarea trombinei, determinând inactivarea proteolitică a factorilor VIIIa și Va de coagulare a sângelui. În plus, drotrecoginul crește activitatea fibrinolitică a plasma sanguină, reducând cantitatea de inhibitor al activatorului de plasminogen de tip 1 care circulă în sânge. Prezența activității antiinflamatorii în medicament este asociată cu efectul său inhibitor asupra eliberării factorului de necroză tumorală. din monocite. Toate aceste proprietăți ale drotrecoginului determină eficacitatea acestuia în tratamentul șocului septic (inflamația și creșterea coagularii sângelui sunt principalele simptome ale acestei afecțiuni). Ca și alte anticoagulante, medicamentul poate provoca complicații hemoragice.
Anticoagulante indirecte
Aceste medicamente, spre deosebire de heparină, nu afectează factorii de coagulare direct în sânge. Ele inhibă sin-
sinteza în ficat a proteinelor plasmatice din sânge dependente de vitamina K – factor II (protrombină), factori VII, IX și X (vezi Fig. 27-5). Vitamina K este necesară pentru formarea unor factori valoroși din punct de vedere funcțional, deoarece acționează ca o coenzimă în reacția de γ-carboxilare a reziduurilor de acid glutamic. Forma redusă a vitaminei K, hidrochinona, prezintă activitate de coenzimă. În timpul carboxilării, vitamina K-hidrochinona este oxidată pentru a forma vitamina K-epoxid inactiv. Anticoagulantele indirecte previn conversia (reducerea) epoxidului de vitamina K inactiv în vitamina K-hidrochinonă activă de către epoxid reductază și DT-diaforază, inhibând aceste enzime. Prin urmare, ei sunt clasificați ca antagoniști ai vitaminei K (Fig. 27-6).

Orez. 27-6.Mecanismul de acțiune al vitaminei K și al anticoagulantelor indirecte
Anticoagulantele indirecte nu reduc imediat concentrația factorilor de coagulare în sânge. Acțiunea lor este caracterizată de o perioadă latentă. Astfel, efectul anticoagulant al acenocumarolului atinge valoarea maximă după 48 de ore sau mai mult. Această dezvoltare lentă a efectului se explică prin faptul că, atunci când aceste medicamente sunt administrate, factorii de coagulare cu drepturi depline circulă încă în sânge de ceva timp (rata de apariție a efectului este determinată de timpul în care factorii de coagulare ai complexul de protrombină sunt degradate). Efectul anticoagulantelor indirecte durează aproximativ 2-4 zile, medicamentele sunt capabile să se acumuleze.

Anticoagulantele indirecte sunt utilizate pentru prevenirea și tratamentul pe termen lung al trombozei și tromboembolismului (tromboză venoasă profundă, embolie pulmonară, complicații tromboembolice în fibrilația atrială, infarct miocardic, înlocuirea valvei cardiace), în practica chirurgicală pentru a preveni formarea trombului în perioada postoperatorie. Intrat înăuntru. Tratamentul se efectuează sub monitorizarea obligatorie a nivelului de protrombină în plasma sanguină prin determinarea timpului de protrombină - un indicator a cărui valoare depinde de conținutul de protrombină din sânge și de factorii IX și X.
Cele mai frecvente complicații la utilizarea anticoagulantelor indirecte sunt sângerarea. Riscul de sângerare crește odată cu utilizarea concomitentă a aspirinei* și a altor agenți antiplachetari. Pentru a opri sângerarea cauzată de anticoagulante indirecte, trebuie administrate preparate cu vitamina K1 și concentrat de complex de protrombină (conține factori II, VII, IX și X). Sunt posibile și alte reacții adverse: reacții alergice, diaree, disfuncție hepatică, necroză cutanată. Medicamentele anticoagulante indirecte sunt contraindicate în timpul sarcinii: ele pătrund în placentă și pot avea un efect teratogen (deranjează formarea scheletului, deoarece
inhibă formarea osteocalcinei, o proteină osoasă dependentă de vitamina K). Fenindiona (fenilina*) poate provoca inhibarea hematopoiezei.
27.2.2. Agenți de coagulare a sângelui
Medicamentele care cresc coagularea sângelui sunt folosite pentru a opri sângerarea, deci sunt clasificate ca agenți hemostatici (hemostatice) sau agenți antihemoragici. Această grupă include substanțele necesare pentru formarea factorilor de coagulare a sângelui (preparate cu vitamina K) și preparate ale factorilor de coagulare înșiși.
Preparate cu vitamina K
Vitamina K există în două forme - vitamina K 1 (filochinonă), care se găsește în plante și vitamina K 2 - un grup de compuși (menachinone) sintetizați de microorganisme (în special, microflora intestinală umană). Vitaminele K 1 și K 2 sunt compuși liposolubili, derivați ai 2-metil-1,4-naftochinonei, care diferă prin lungimea și natura lanțului de carbon lateral. Vitamina K j se obține pe cale sintetică, preparatul său fiind cunoscut sub numele de fitomenadionă. A fost sintetizat un precursor solubil în apă al vitaminei K, 2-metil-1,4-naftochinona (menadiona), care are activitate provitamină. Acest compus a fost numit vitamina K 3 . Un derivat al vitaminei K 3 - menadiona bisulfit de sodiu - este utilizat în practica medicală sub denumirea b și k a - sol *.
Vitamina K este necesară pentru sinteza în ficat a protrombinei (factorul II) și a factorilor de coagulare a sângelui VII, IX și X, precum și a proteinelor C și S. Se știe că vitamina K participă la sinteza proteinei osteocalcinei din țesutul osos.
Structura tuturor proteinelor dependente de vitamina K are o caracteristică comună: aceste proteine conțin reziduuri de acid γ-carboxiglutamic care leagă ionii de Ca 2+. Vitamina K-hidrochinona funcționează ca o coenzimă în reacția de γ-carboxilare a resturilor de acid glutamic (vezi Fig. 27-6). Cu deficiența de vitamina K, apar precursori inactivi ai factorilor de coagulare a sângelui care nu sunt capabili să lege Ca 2+. Deficitul de vitamina K în organism duce cel mai rapid la afectarea hemocoagulării. Prin urmare, principalul
iar cele mai precoce manifestări ale deficitului de vitamina K sunt sângerarea și hemoragia.
Preparatele cu vitamina K sunt folosite pentru a preveni și opri sângerarea și alte complicații hemoragice cauzate de deficitul de vitamina K în organism, de exemplu, sindromul hemoragic al nou-născuților. Deficitul de vitamina K la nou-născuți poate fi cauzat atât de aportul insuficient de vitamina K 1 cât și de absența microflorei intestinale care sintetizează vitamina K 2 . Pentru a preveni astfel de complicații, se recomandă administrarea profilactică a vitaminei K 1 nou-născuților în primele ore de viață.
Preparatele cu vitamina K sunt indicate pentru scăderea absorbției vitaminei K în intestin din cauza secreției biliare afectate în icterul obstructiv (bila este necesară pentru absorbția vitaminei K liposolubile) sau cu sindrom de malabsorbție (pentru sprue, enterocolită, boala Crohn etc. .)
Preparatele cu vitamina K 1 sunt eficiente pentru sângerările cauzate de anticoagulante indirecte. Se administrează oral și intravenos lent.
Preparatele cu vitamina K pot provoca reacții alergice (erupții cutanate, mâncărime, eritem, bronhospasm). Atunci când se administrează intravenos, există riscul de reacții anafilactoide. Când se utilizează preparate cu vitamina K 3 (Vikasol*) la nou-născuți, există riscul de a dezvolta anemie hemolitică și hiperbilirubinemie.
Preparate cu factor de coagulare
Necesitatea unor astfel de medicamente apare atunci când unul sau mai mulți factori de coagulare a sângelui sunt deficienți.
Factorul VIII de coagulare a sângelui antihemofil (hemofil M*, immunat* etc.) este un concentrat uscat de factor VIII. Medicamentele sunt obținute din plasmă de sânge de la donator care a suferit o dublă inactivare a virusului și sunt standardizate în funcție de conținutul de factor VIII. Sunt mai activi și mai siguri decât crioprecipitatul*.
Crioprecipitatul* este un concentrat de proteine din plasma sanguină, care include factorul VIII, factorul von Willebrand, fibronectina, precum și, într-o măsură mai mică, alți factori de coagulare a sângelui și cantități mici de fibrinogen.
Medicamentele se administrează intravenos pentru deficiența ereditară (hemofilie A) și dobândită de factor VIII. Crioprecipitat*,
în plus, este utilizat pentru terapia de substituție pentru boala von Willebrand (deficiența ereditară a factorului von Willebrand) și afibrinogenemie. La administrare, sunt posibile reacții adverse sub formă de tahicardie, hipotensiune arterială, dificultăți de respirație, reacții alergice (urticarie, febră, șoc anafilactic), precum și hemoliză a globulelor roșii.
Toate preparatele cu factor de coagulare obținute din plasma sanguină au un dezavantaj semnificativ - posibilitatea transmiterii infecțiilor virale (HIV, hepatită). În prezent, s-au obținut preparate recombinante de factor VIII și factor von Willebrand, a căror utilizare reduce riscul de infecție.
Pe lângă medicamentele cu factor de coagulare, pentru formele ușoare de hemofilie A și boala von Willebrand, se utilizează analogul argininei vasopresinei, desmopresina. Desmopresina crește conținutul de factor von Willebrand în plasma sanguină, promovând eliberarea acestuia din celulele endoteliale și crește activitatea factorului
VIII. Medicamentul se administrează parenteral.
Factorul IX de coagulare a sângelui (agemphil B*, imunina*, octanina*) este o fracțiune purificată din plasmă umană îmbogățită cu factor IX. Folosit pentru deficiența congenitală (hemofilie B) și dobândită de factor IX, precum și pentru supradozajul anticoagulantelor indirecte. Efectele secundare sunt aceleași ca la medicamentele cu factor VIII.
Eptacog alfa activat (novoseven *) este un factor VIIa recombinant de coagulare a sângelui. Folosit pentru deficitul de factor VII și alți factori de coagulare (V, II,
IX, X).
Local, pentru a opri sângerarea din capilarele mici și organele parenchimoase, se utilizează medicamentul trombina (obținut din plasma sanguină a donatorului), precum și bureții hemostatici (colagen, gelatină).
Pentru a opri sângerările uterine, pulmonare, renale, intestinale și de altă natură, se folosesc preparate din plante medicinale: frunze de urzică, iarbă de șoricel, plantă de troscot de ardei, plantă de troscot, coajă de viburn, flori de arnică, lagochilus îmbătător. Plantele medicinale sunt folosite sub formă de infuzii, tincturi și extracte intern și local.
27.3. MEDICAMENTE CARE AFECTEAZĂ FIBRINOLIZA
Când se formează cheaguri de sânge, sistemul fibrinolitic este activat, ceea ce asigură dizolvarea (liza) fibrinei și distrugerea cheagului de sânge. Acest lucru duce la restabilirea fluxului sanguin normal.
În timpul procesului de fibrinoliză, plasminogenul inactiv este transformat în plasmină (fibrinolizină) cu participarea activatorilor de plasminogen. Plasmina hidrolizează fibrina pentru a forma peptide solubile. Plasmina nu are specificitate și provoacă, de asemenea, distrugerea fibrinogenului și a altor factori de coagulare a sângelui, ceea ce crește riscul de sângerare. Plasmina care circulă în sânge este rapid inactivată de α2-antiplasmină și alți inhibitori și, prin urmare, nu are în mod normal un efect fibrinogenolitic sistemic. Cu toate acestea, în anumite condiții patologice sau în utilizarea agenților fibrinolitici, este posibilă activarea excesivă a plasminogenului plasmatic, care poate provoca sângerări.
27.3.1. Agenți fibrinolitici (trombolitici).
Agenții fibrinolitici sunt utilizați pentru a dizolva cheagurile de sânge în tromboză coronariană (infarct miocardic acut), tromboză venoasă profundă, tromboză acută a arterelor periferice și embolie pulmonară.
Preparatele care activează plasminogenul sunt utilizate ca agenți fibrinolitici: preparate de streptokinază, preparate de activator de plasminogen tisular, preparate de urokinază.
Medicamente cu streptokinază
Streptokinaza (cabikinaza *) este un preparat proteic foarte purificat, obținut dintr-o cultură de streptococ β-hemolitic. Streptokinaza dobândește activitate proteolitică numai în combinație cu plasminogenul. Când se administrează streptokinaza, se formează un complex echimolar streptokinază-plasminogen, transformând plasminogenul în plasmină. Streptokinaza acționează asupra plasminogenului atât în cheagul de sânge, cât și în plasma sanguină (Fig. 27-7).
Streptokinaza se administrează intravenos în infarctul miocardic acut cauzat de tromboza vaselor coronare (cele mai multe
eficient în primele 3-6 ore), pentru tromboza venoasă profundă, embolia pulmonară și tromboza vasculară retiniană. Streptokinaza este dozată în ME (unități internaționale).
Complicațiile frecvente la utilizarea streptokinazei sunt sângerarea, care poate fi asociată atât cu activarea plasminogenului care circulă în sânge (plasmina rezultată distruge fibrinogenul, ducând la o agregare redusă a trombocitelor), cât și cu dizolvarea cheagurilor de sânge fiziologice. Sunt posibile greața, vărsăturile și hipotensiunea arterială. Datorită prezenței proprietăților antigenice, streptokinaza poate provoca reacții alergice, inclusiv șoc anafilactic. Pericolul lor crește odată cu administrarea repetată a medicamentului. Anticorpii care circulă în sânge pot inactiva streptokinaza și pot reduce eficacitatea terapiei.
Anistreplaza ** (eminaza**) este un complex de streptokinază cu plasminogen lizină acilat. Gruparea acil din molecula de plasminogen închide locul catalitic, ceea ce împiedică activarea plasminogenului. Medicamentul este un promedicament și dobândește capacitatea de a converti plasminogenul în plasmină numai după scindarea grupării acil. Viteza de deacilare și, prin urmare, timpul de formare a medicamentului activ depinde de natura grupării acil și poate varia de la 40 de minute la câteva ore. Anistreplase** se administrează intravenos. După o singură injecție, efectul fibrinolitic durează 4-6 ore. Indicațiile de utilizare și efectele secundare sunt aceleași ca pentru streptokinaza.
Activator tisular de plasminogen și preparate de urokinază
Activatorul tisular al plasminogenului și urokinaza sunt principalii activatori fiziologici ai plasminogenului.
Activatorul de plasminogen tisular este produs de celulele endoteliale. Determină proteoliza parțială a plasminogenului, ducând la conversia acestuia în plasmină. O caracteristică distinctivă a activatorului tisular este afinitatea sa mare pentru fibrină, care accelerează efectul său asupra plasminogenului de sute de ori. Ca rezultat, activatorul tisular activează cu o rată mai mare acele molecule de plasminogen care sunt adsorbite pe filamentele de fibrină. Astfel, acțiunea activatorului de plasminogen tisular este limitată de fibrina trombică. Intrând în sânge,

Orez. 27-7.Mecanismul de acțiune al agenților fibrinolitici: tPA - activator tisular de plasminogen; FDP - produse de degradare a fibrinogenului; EC - celula endoteliala; ? - activare; Θ - liză
activatorul tisular se leagă de un inhibitor specific, prin urmare are un efect redus asupra plasminogenului care circulă în sânge și reduce nivelul de fibrinogen într-o măsură mai mică.
S-au obținut preparate recombinante de activator tisular de plasminogen pentru uz clinic: alteplază (actilize*) și tenecteplase (metaliza*). Medicamentele se administrează intravenos pentru infarctul miocardic acut cauzat de tromboza vaselor coronare (eficiente în primele 6-12 ore), pentru embolia pulmonară. În ciuda faptului că alteplaza are un efect redus asupra plasminogenului care circulă în sânge, complicațiile hemoragice apar adesea odată cu utilizarea sa. Nu are proprietăți antigenice. Tenecteplaza are o specificitate crescută pentru fibrina trombică.
Urokinaza este produsă de celulele renale și se găsește în urină. În rinichi, se formează urokinaza cu un singur lanț (prourokinaza), care, sub influența plasminei, este transformată în forma activă - urokinaza cu lanț dublu. Urokinaza cu lanț dublu are un efect de activare direct asupra plasminogenului (nu este necesară formarea unui complex cu plasminogen). Preparatul de urokinază cu lanț dublu este obținut dintr-o cultură de celule renale embrionare umane. Folosit pentru infarctul miocardic acut, tromboză venoasă și arterială, embolie pulmonară. Se administrează intravenos. Dozat în ME. În comparație cu activatorul de plasminogen tisular, urokinaza acționează într-o măsură mai mare asupra plasminogenului care circulă în sânge, ca urmare, plasmina formată în sânge determină descompunerea fibrinogenului (vezi Fig. 27-7). În același timp, agregarea trombocitară scade și se formează produse de degradare a fibrinogenului, care au activitate anticoagulantă. Principalele efecte secundare sunt sângerarea. Nu are proprietăți antigenice.
S-a obţinut un preparat recombinant de urokinază cu catenă unică (prourokinaza) - c a p u p l a z a * -, care prezintă o specificitate mai mare pentru fibrina trombului decât urokinaza.
27.3.2. Agenți antifibrinolitici
Medicamentele antifibrinolitice sunt utilizate pentru a opri sângerarea cauzată de activitatea crescută a sistemului fibrinolitic în timpul leziunilor, intervențiilor chirurgicale, nașterii,
boli hepatice, prostatita, menoragie, precum și supradozaj cu medicamente fibrinolitice. În aceste scopuri, se folosesc medicamente care inhibă activarea plasminogenului sau sunt inhibitori ai plasminei.
Acidul aminocaproic se leagă de plasminogen și previne conversia acestuia în plasmină. În plus, interferează cu efectul plasminei asupra fibrinei. Medicamentul se administrează oral și intravenos. Reacții adverse posibile: hipotensiune arterială, bradicardie, aritmii, amețeli, greață, diaree. Acidul aminometilbenzoic (Ambene*, Pamba*) are un efect similar.
Acidul tranexamic (tranexam*, ciclocapron*) inhibă activarea plasminogenului. Medicamentul se administrează pe cale orală și intravenoasă. Este mai eficient decât acidul aminocaproic și durează mai mult. Efectele secundare includ simptome dispeptice (anorexie, greață, vărsături, diaree), amețeli, somnolență; Sunt posibile reacții alergice ale pielii.
Aprotinina (Gordox*, Contrical*, Trasylol*, Ingitril*) inhibă plasmina și alte enzime proteolitice. Medicamentul se administrează intravenos. Reacții adverse: hipotensiune arterială, tahicardie, greață, vărsături, reacții alergice.
Trombocitele, cele mai mici celule sanguine (comparativ cu leucocitele și globulele roșii), îndeplinesc cea mai importantă funcție - protejează organismul de pierderea de sânge. Agregarea trombocitară este procesul de lipire a celulelor, stadiul inițial al formării cheagurilor de sânge.
A doua etapă este atașarea trombocitelor pe peretele vasului deteriorat. Firele de fibrină, alte elemente și noi celule aderente sunt stratificate pe masa trombocitară. Astfel, trombul crește la o dimensiune capabilă să blocheze diametrul vasului și să oprească sângerarea. Uneori, viața unei persoane depinde de viteza procesului.
Rolul agregării trombocitelor în procesul de coagulare a sângelui
Coagularea sângelui depinde de mulți factori. Una dintre ele, agregarea trombocitară, într-un organism sănătos este de natură adaptativă protectoare. Celulele se lipesc împreună numai într-un vas care sângerează. În acest caz, procesul joacă un rol pozitiv.
Dar există condiții patologice cunoscute în care formarea cheagurilor de sânge este nedorită, deoarece duce la perturbarea nutriției organelor vitale. De exemplu, cu infarct miocardic, accident vascular cerebral, tromboză a arterelor conducătoare. Activitatea de agregare a trombocitelor ia de partea modificărilor patologice. Trebuie să lupți împotriva ei cu ajutorul diferitelor medicamente.
Există o nevoie practică de a cuantifica agregarea plachetară bună și rea. Pentru a face acest lucru, trebuie să utilizați norma și să distingeți abaterile.
Cum se determină normalitatea și patologia?
Poate un test de sânge să arate capacitatea de agregare a trombocitelor a unei anumite persoane? La urma urmei, pentru a efectua studiul, sângele este luat dintr-o venă și, din acel moment, „ordinele” corpului nu acționează asupra celulelor sanguine. Acest tip de analiză se numește „in vitro”, o traducere literală din latină „pe sticlă, într-o eprubetă”. Oamenii de știință încearcă întotdeauna să studieze reacția în condiții apropiate de corpul uman. Doar datele obținute în acest fel pot fi considerate fiabile și utilizate în diagnosticare.
Abilitățile trombocitelor sunt determinate de agregarea indusă. Aceasta înseamnă că substanțele care nu sunt străine organismului în compoziția chimică și care pot provoca cheaguri de sânge sunt folosite ca substanță inductoră. Ca inductori se folosesc componente ale peretelui vascular: adenozin difosfat (ADP), ristocetina (ristomicină), colagen, serotonina, acid arahidonic, adrenalină.
Agregarea spontană se determină fără inductori.
Tehnicile de cuantificare se bazează pe trecerea undelor luminoase prin plasma sanguină bogată în trombocite. Gradul de activitate de agregare este studiat prin diferența de densitate luminoasă a plasmei înainte de începerea coagulării și după obținerea rezultatului maxim. Se determină și rata de agregare în primul minut, natura și forma undelor.
Viteza depinde de substanța inductor și de concentrația acesteia.
Agregarea trombocitelor cu ADP este de obicei prescrisă și evaluată în combinație cu colagen, ristomicina și adrenalină.
Norma de analiză cu ADP este de la 30,7 la 77,7%. Cantitatea de agregare a trombocitelor cu adrenalină variază de la 35 la 92,5%. Într-un studiu cu colagen, valorile normale sunt considerate a fi de la 46,4 la 93,1%.
Reguli de pregătire pentru analiză
Pentru a face un test de sânge pentru capacitatea de agregare, trebuie să înțelegeți că testul va fi inexact dacă regulile de pregătire sunt încălcate. Vor exista substanțe în sânge care afectează rezultatul.
- Cu o săptămână înainte de a dona sânge, toate medicamentele cu aspirină, dipiridamol, indometacin, sulfapiridazină și antidepresive trebuie întrerupte. Utilizarea acestor medicamente inhibă (suprimă) formarea de trombi. Dacă nu puteți înceta să îl luați, trebuie să informați tehnicianul de laborator.
- Nu ar trebui să mănânci cel puțin 12 ore alimentele grase pe care le consumi îți afectează în special rezultatele.
- Pacientul trebuie să fie cât mai calm posibil și să nu efectueze muncă fizică.
- Cu o zi înainte, excludeți cafeaua, alcoolul, usturoiul din alimente și nu fumați.
- Analiza nu se efectuează dacă există un proces inflamator activ.
Trombocitele aglomerate sunt vizibile la microscop
Un test de sânge pentru agregarea trombocitelor este prescris de un medic dacă este necesar un tratament cu anticoagulante, monitorizarea eficacității acestora, selectarea dozei optime, pentru a diagnostica sângerarea crescută.
Decodificarea rezultatelor
Motivele efectuării studiilor cu trei inductori standard simultan și, dacă este necesar, adăugarea altora noi, sunt mecanismul predominant de activare a unuia dintre factorii de coagulare. Norma alterată identificată, de exemplu, cu ADP în absența dinamicii cu alți inductori, are semnificație diagnostică. Rezultatele sunt evaluate de un medic.
Scăderea agregării trombocitelor poate fi cauzată de:
- utilizarea cu succes a terapiei antiplachetare;
- un grup de boli numite trombocitopatii.

Aparat de analiză de agregare
Rolul trombocitopatiei
Trombocitopatiile pot fi ereditare sau dobândite ca urmare a altor boli. Statisticile spun că până la 10% din populația planetei suferă de această patologie. Toate acestea sunt asociate cu disfuncția trombocitelor în acumularea anumitor substanțe.
Ca urmare, coagularea și formarea cheagurilor de sânge nu are loc, ceea ce duce la creșterea sângerării în răni mici și vânătăi (sângerare internă).
Bolile apar deja în copilărie cu sângerări ale gingiilor, sângerări nazale frecvente, multe vânătăi pe corpul copilului, umflarea articulațiilor din cauza vânătăilor. În timpul pubertății, fetele încep să aibă menstruații lungi și grele. Sângerarea duce la dezvoltarea anemiei (anemie).
Capacitatea scăzută de agregare în trombocitopatie poate fi activată de infecții virale și bacteriene, medicamente și proceduri fizioterapeutice.

Sângerările nazale în 80% din cazuri sunt cauzate de trombocitopatie și doar 20% de boli ale organelor ORL
Trombocitopatii secundare
Trombocitopatiile simptomatice (secundare) se formează în leucemia cronică, mielom,. Această condiție este tipică pentru stadiul final al insuficienței renale (uremie), scăderea funcției tiroidiene.
Chirurgii se confruntă cu trombocitopatii atunci când există sângerare crescută în timpul intervențiilor chirurgicale.
Se observă o creștere a agregării trombocitelor cu:
- ateroscleroza vasculară pe scară largă;
- hipertensiune;
- infarct al organelor interne;
- tromboza arterelor abdominale;
- accident vascular cerebral;
- diabetul zaharat
Modificări în agregare în timpul sarcinii
Agregarea trombocitară în timpul sarcinii se poate abate de la valorile normale.
Agregarea este redusă din cauza producției insuficiente de trombocite sau a încălcării compoziției lor calitative. Acest lucru se manifestă prin sângerare și vânătăi. În timpul nașterii, trebuie luată în considerare posibilitatea unei sângerări masive.
Agregarea este crescută cel mai adesea în timpul toxicozei din cauza pierderii de lichide din cauza vărsăturilor și diareei. O creștere a concentrației sanguine duce la creșterea formării de trombi. Acest lucru poate duce la un avort spontan precoce. Hiperagregarea moderată este considerată normală în timpul sarcinii și este asociată cu dezvoltarea circulației placentare.
- în caz de avort spontan;
- tratamentul infertilității;
- înainte și în timpul luării contraceptivelor;
- înainte de o sarcină planificată.
Analiza proprietăților de agregare a trombocitelor ne permite să identificăm riscurile, să prezicăm complicațiile periculoase în timpul bolilor și să efectuăm cu promptitudine terapia preventivă.
Trombocitele sunt celule sanguine care nu au culoare. Ele îndeplinesc o funcție importantă în organism, protejându-l de pierderea de sânge. Acest proces este agregarea trombocitelor în sânge, are proprii indicatori standard.
Pentru a înțelege ce este, trebuie să aveți o idee despre formarea unui cheag de sânge, standardele existente și pericolul abaterilor de la valorile normale.
Descriere și rol în corpul uman
După lezarea țesuturilor, trombocitele se atașează de pereții vasului deteriorat. Ca rezultat, celulele se lipesc împreună. În timp, la masa rezultată se adaugă fire de fibrină, celule noi lipite și alte elemente.
Pe acest fond, crește un cheag de sânge, care atinge dimensiuni mari, ceea ce poate duce la blocarea vasului și oprirea sângerării. Viteza unui astfel de proces este foarte importantă, deoarece păstrarea vieții umane depinde uneori de aceasta.

Coagularea sângelui este influențată de un număr mare de factori. Una dintre ele este agregarea. În absența stărilor patologice, îndeplinește o funcție de protecție adaptativă.
Caracteristicile de agregare constau în lipirea celulelor numai în vasul deteriorat. În acest caz, procesul este considerat pozitiv.
.jpg)
Cu toate acestea, există situații în care tromboza este nedorită. De exemplu, dacă este diagnosticat un accident vascular cerebral sau un infarct miocardic.
Acest lucru se explică prin faptul că formarea cheagurilor de sânge împiedică fluxul normal al substanțelor necesare către organele vitale.
În acest caz, trombocitele iau partea proceselor patologice. Abaterile de la normă pot fi tratate numai cu ajutorul medicamentelor.
Pentru a identifica indicatorii normali din anormali, este necesar să se efectueze o analiză cantitativă a agregării pozitive și negative.
feluri
În practica medicală, există o anumită clasificare a agregării după tip. Acestea includ:

- Agregare moderată. Este diagnosticat în principal în timpul sarcinii. Afecțiunea poate fi declanșată de circulația placentară.
- Agregare spontană. Nu este necesar un inductor pentru detectare. Pentru a detecta activitatea de agregare, sângele este turnat într-o eprubetă, care este plasată într-un dispozitiv special, unde este încălzit la 37 de grade.
- Agregare indusă. Pentru a efectua studiul, în plasmă se adaugă inductori. În acest caz, agregarea are loc cu ADP, colagen, ristomicina și adrenalină. Această metodă este utilizată în cazurile în care este necesară diagnosticarea anumitor patologii ale fluidului sanguin.
- Agregarea crescută favorizează formarea cheagurilor de sânge. Simptomele caracteristice ale acestei stări patologice sunt amorțeala și umflarea.
- Agregarea redusă este cel mai adesea detectată în cazurile de tulburări în funcționarea sistemului circulator. O scădere a numărului de trombocite provoacă diverse sângerări. Apare la sexul frumos în timpul ciclului menstrual.
Atât agregarea crescută, cât și cea scăzută sunt periculoase pentru sănătatea umană. Prin urmare, nivelul trombocitelor din sânge trebuie monitorizat în mod regulat.
Simptomele abaterilor de la indicatori
Hiperagregarea este însoțită de creșterea vâscozității sângelui și de o scădere a vitezei curgerii acestuia, care afectează negativ toate sistemele și organele umane.
Cu toate acestea, există condiții patologice când agregarea pronunțată este un fenomen normal, care, la rândul său, nu este considerat un motiv pentru a refuza studiul constant al indicatorilor de coagulare.
Astfel de boli includ:
- creșterea tensiunii arteriale;
- Diabet;
- cancer;
- patologii vasculare.
Detectarea prematură a hiperagregării și lipsa asistenței pot duce la dezvoltarea infarctului, accident vascular cerebral și tromboză venoasă.
O scădere a indicatorilor de agregare este însoțită de sângerare prelungită, inclusiv sângerare internă, care se manifestă prin formarea de hematoame.
Care este norma
Normele de nivel de trombocite la un adult și la un copil vor fi ușor diferite. Valorile optime ale indicatorilor sunt prezentate în tabelul de mai jos.
Dacă vorbim de valori normale de agregare, atunci va fi de 25-75 la sută. În acest caz, trombocitele se lipesc împreună fără abateri și nu reprezintă o amenințare pentru corpul uman.
Ce cercetări se fac?
Analizorul de agregare a trombocitelor este o hemoleucogramă completă. Cu toate acestea, există și alte studii care oferă rezultate mai precise. Principalele metode includ următoarele teste:
.jpg)
- conform lui Lee-White;
- coagulogramă.
Esența lor constă în faptul că în sânge se adaugă substanțe speciale care inhibă agregarea.
Aceste componente sunt similare cu substanțele conținute în corpul uman, care provoacă cheaguri de sânge. Astfel de componente se numesc inductori.
Pregătirea pentru analiză
Înainte de a efectua analiza, este necesar să se supună anumitor pregătiri. Pentru ca rezultatele să fie cât mai exacte posibil, lichidul sanguin nu trebuie să conțină substanțe care ar putea avea un efect negativ asupra acestuia.
Activitati pregatitoare:
- Cu o săptămână înainte de analiză, unele medicamente cu aspirină sunt excluse, deoarece utilizarea lor suprimă formarea de trombi. Dacă nu este posibilă anularea acestor medicamente, tehnicianul de laborator care efectuează studiul trebuie anunțat.
- Trebuie să încetați să mâncați alimente timp de 12 ore. Produsele, în special cele cu conținut ridicat de grăsimi, afectează negativ rezultatele.
- Evitați stresul fizic și emoțional.
- În timpul zilei, nu luați băuturi alcoolice, cafea, usturoi sau fum.
Analiza este amânată dacă există un proces inflamator activ.
Efectuarea
Prelevarea de sânge se efectuează dimineața, între orele 7 și 10. Studiul poate fi efectuat doar pe stomacul gol. Este permis să bei apă plată.
Pentru a efectua un hemotest, lichidul sanguin este prelevat dintr-o venă. În aceste scopuri se folosește o seringă de unică folosință. După aceasta, materialul este plasat într-un agregometru care conține o soluție de citrat de sodiu 4%. Apoi recipientul este răsturnat de mai multe ori. Ulterior, tubul de sânge este trimis la laborator pentru teste suplimentare.
Decodificarea rezultatelor
Ținând cont de substanța care a fost folosită în timpul studiului, analiza este descifrată. Pentru a face acest lucru, indicatorii obținuți sunt comparați cu valorile normale, care sunt prezentate mai jos.
Dacă se observă o creștere față de normal, este diagnosticată hiperagregarea. Poate apărea în condiții patologice precum:
.jpg)
- leucemie;
- patologii ale tractului gastrointestinal sau rinichilor;
- ateroscleroza;
- Diabet;
- tensiune arterială crescută;
- septicemie;
- limfogranulomatoza.
Dacă abaterile sunt în jos, hipoagregarea este diagnosticată. Poate fi cauzată de patologii ale sângelui sau de tratament cu agenți antiplachetari.
Procentul arată nivelul de transmitere a luminii a plasmei după ce substanța inductoră este adăugată la aceasta. Dacă numărul de trombocite este scăzut, acest indicator este de 100 la sută, iar dacă este mare, este zero.
Caracteristicile agregarii la femeile gravide
În timpul sarcinii, sunt permise abateri de la normă, care în această perioadă variază de la 30 la 60 la sută.
Dezagregarea poate fi observată atunci când există o lipsă de trombocite, precum și dacă există o modificare a compoziției lor calitative, care se manifestă prin sângerare și vânătăi.
Agregarea crescută apare în timpul toxicozei, când pacientul suferă o pierdere mare de lichid ca urmare a vărsăturilor sau a diareei. O creștere a concentrației sanguine provoacă creșterea formării cheagurilor de sânge. Acest lucru amenință un avort spontan precoce.
Cum poți normaliza valorile?
Dacă este diagnosticată o tulburare de coagulare a fluidelor din sânge, este necesar să se ia imediat măsuri pentru a elimina starea patologică. O creștere a agregării poate duce la tromboză, iar o scădere poate duce la sângerări abundente și periculoase.
În stadiile inițiale ale dezvoltării hiperagregației, specialiștii prescriu medicamente care pot subția sângele. Aspirina obișnuită poate face față sarcinii.
Pe baza rezultatelor unei examinări suplimentare, sunt adesea prescrise următoarele:
.jpg)
- analgezice;
- blocarea novocainei;
- medicamente care favorizează vasodilatația;
- anticoagulante, care previn coagularea rapidă.
Uneori, metodele tradiționale nu sunt mai puțin eficiente. Merită să ne amintim că un astfel de tratament trebuie convenit cu medicul curant.
Printre rețetele dovedite se numără următoarele:
- Se toarnă o lingură de trifoi dulce în 200 ml apă fiartă și se lasă să fiarbă timp de 30 de minute. Utilizați amestecul preparat pe zi în mai multe doze. Cursul terapiei este de o lună.
- Preparați un litru și jumătate de apă clocotită în cantități egale (o linguriță) de ghimbir și ceai verde. Adaugati un praf de scortisoara. Se lasa un sfert de ora si se ia pe tot parcursul zilei.
- Bea suc de portocale proaspat stors in fiecare zi. Se poate amesteca in parti egale cu dovleac.
De asemenea, este important să se mențină o alimentație adecvată. Dieta ar trebui să includă:
- citrice;
- ghimbir;
- usturoi;
- legume roșii și verzi;
- fructe de mare.
Dacă aveți coagulare slabă a sângelui, nu trebuie să luați medicamente. care subțiază lichidul sanguin. Dacă cursul procesului a dobândit o formă avansată, atunci măsurile terapeutice sunt efectuate numai în condiții staționare.
Următoarele medicamente sunt prescrise:

- Emosint;
- Acid aminocaproic și tranexamic;
- injecție de ATP;
Dieta trebuie să includă terci de hrișcă, ouă, sfeclă și morcovi, rodie, ficat de vită și carne roșie.
Pentru a menține sângele în stare normală, este necesar să se respecte cu strictețe regimul de băut. Cel puțin un litru și jumătate de apă curată este considerată norma pe zi. Alimentele trebuie să fie proaspete și echilibrate.
Respectarea regulilor nutriționale este prevenirea multor boli ale corpului uman. Activitatea fizică joacă, de asemenea, un rol la fel de important. Ele ajută nu numai la întărirea corpului, ci și la normalizarea tuturor proceselor interne.
Cu diagnosticarea în timp util a abaterilor indicatorilor de agregare, multe boli și complicații pot fi prevenite. Nivelul de agregare a trombocitelor trebuie monitorizat în mod regulat.
Trombocitele sunt celule sanguine mici care sunt responsabile de coagularea sângelui. Ele ajută la oprirea pierderii de sânge dacă apare sângerare.
Când apare o rană, trombocitele se deplasează în zona rănită. Aici sunt atașate de peretele vasului deteriorat, în urma căruia sângerarea se oprește. Acest proces se numește agregare trombocitară.
Agregarea trombocitară este un proces în care celulele sanguine aderă între ele și le fixează pe peretele vasului lezat. Acest lucru oprește sângerarea. Cu toate acestea, un astfel de proces poate fi și periculos pentru organism. În acest caz, se formează un cheag de sânge, care în anumite circumstanțe poate provoca un atac de cord și un accident vascular cerebral. Acest lucru se poate întâmpla dacă trombocitele sunt hiperactive și agregarea are loc prea repede.
În plus, procesul lent, de asemenea, nu promite nimic bun pentru organism. În acest caz, poate apărea o coagulare slabă a sângelui din cauza aderenței lente a trombocitelor. Această patologie provoacă anemie. Dacă coagularea sângelui este slabă, este dificil să opriți sângerarea, ceea ce poate duce la probleme de sănătate și chiar la moarte. Pentru a preveni acest lucru, este necesar să se monitorizeze nivelul trombocitelor din sânge și capacitatea acestora de a lipi.
Procesul de agregare a trombocitelor în timpul sarcinii
 Este extrem de important ca agregarea trombocitelor să aibă loc normal în timpul sarcinii. Dacă procesul are loc prea lent, atunci în timpul nașterii sau în perioada postpartum poate apărea sângerare din uter, care poate duce la moartea femeii. În plus, dacă agregarea trombocitară are loc rapid în timpul sarcinii, se pot forma cheaguri de sânge, care în timpul sarcinii pot duce la întreruperea acesteia în orice stadiu.
Este extrem de important ca agregarea trombocitelor să aibă loc normal în timpul sarcinii. Dacă procesul are loc prea lent, atunci în timpul nașterii sau în perioada postpartum poate apărea sângerare din uter, care poate duce la moartea femeii. În plus, dacă agregarea trombocitară are loc rapid în timpul sarcinii, se pot forma cheaguri de sânge, care în timpul sarcinii pot duce la întreruperea acesteia în orice stadiu.
Puteți evita această situație dacă vă planificați sarcina și aveți grijă de sănătatea dumneavoastră din timp. Este necesar, chiar înainte de concepție, să se afle în ce stare se află trombocitele și, dacă este necesar, să se ia măsuri pentru corectarea situației. Dacă sarcina nu a fost planificată, atunci patologia de agregare poate fi evitată prin înregistrarea într-un stadiu incipient. Apoi, medicul va prescrie testele necesare și va ajuta să scăpați de starea patologică a trombocitelor dacă este detectată.
Număr normal de trombocite în sânge
Pentru a cunoaște starea nivelului trombocitelor, trebuie să aveți o idee despre nivelul lor normal.
Dacă vorbim de rata de agregare, aceasta este de 25-75%. În acest caz, procesul de lipire a trombocitelor are loc bine și nu prezintă niciun pericol pentru sănătate.
Dacă se observă abateri de la normă, atunci este prescris un tratament adecvat pentru a ajuta la corectarea situației.Test de sânge pentru agregarea trombocitelor
Un test de sânge numit agregare indusă ajută la studiul stării trombocitelor. În acest caz, sângele este prelevat din vena pacientului și amestecat cu substanțe speciale. Astfel de agenți au o compoziție care este similară cu compoziția celulelor corpului care participă la procesul de agregare. Următoarele substanțe sunt cel mai adesea luate ca inductori:
- adenozin difosfat (ADP);
- colagen;
- serotonina;
- ristocetină;
- adrenalină;
- acid arahidonic.
Procedura cel mai frecvent efectuată este agregarea trombocitelor cu ADP. Pentru a efectua studiul, se ia un dispozitiv special. Se numește analizor de agregare a trombocitelor. Cu ajutorul acestuia, undele de lumină sunt trecute prin sânge înainte ca acesta să înceapă să se coaguleze și după finalizarea acestui proces. Apoi rezultatul este evaluat.
Pregătirea pentru teste
 Pentru a vă asigura că rezultatul este cât mai precis posibil, trebuie să urmați următoarele reguli pentru efectuarea unui test de sânge:
Pentru a vă asigura că rezultatul este cât mai precis posibil, trebuie să urmați următoarele reguli pentru efectuarea unui test de sânge:
- Studiul se efectuează pe stomacul gol. În acest caz, trebuie să încetați să mâncați cu 12 ore înainte de test. În acest caz, puteți bea apă plată curată.
- Cu 7 zile înainte de test, trebuie să opriți tratamentul medicamentos cu anumite medicamente. Dacă acest lucru nu este posibil, atunci trebuie să informați medicul care efectuează analiza.
- Cu câteva zile înainte de analiză, ar trebui să evitați situațiile stresante și activitatea fizică.
- Trebuie să încetați să beți cafea, fumat, alcool și usturoi cu 24 de ore înainte.
- Cercetările nu pot fi efectuate dacă în organism are loc un proces inflamator.
Indicații pentru analiză
 Puteți face din când în când un test de agregare a trombocitelor din proprie inițiativă.
Puteți face din când în când un test de agregare a trombocitelor din proprie inițiativă. Interpretarea rezultatului analizei agregarii induse
Interpretarea indicatorilor depinde de mijloacele prin care a fost realizat studiul. Pentru a face acest lucru, datele sunt comparate cu norma.
Dacă rezultatele deviază de la normă în sus, atunci este diagnosticată agregarea trombocitară crescută. Această condiție apare atunci când: 
- tensiune arterială crescută;
- ateroscleroza;
- leucemie;
- diabetul zaharat;
- boli oncologice ale tractului gastro-intestinal sau rinichilor;
- limfogranulomatoza;
- septicemie;
- îndepărtarea chirurgicală a splinei.
Creșterea agregării trombocitelor poate duce la infarct miocardic, accident vascular cerebral, tromboză și moarte din cauza blocării unui vas de către un cheag de sânge.
Dacă rezultatele se abat de la normă spre o scădere, atunci este diagnosticată o agregare redusă a trombozei. Acest lucru se datorează:
- boli de sânge;
- trombocitopatie;
- utilizarea agenților antiplachetari.
Cu o agregare redusă, vasele devin fragile. În plus, procesul de oprire a sângerării este dificil, ceea ce poate provoca moartea.
Mijloace care reduc procesul de agregare
Unii agenți inhibă procesul de agregare. Aceste medicamente includ agenți antiplachetari. Inhibitorii agregării plachetare includ medicamente precum acidul acetilsalicilic, ibustrină, micristină și altele. Astfel de medicamente sunt prescrise pentru tratamentul anumitor boli. Cu toate acestea, dacă procesul de agregare se abate brusc de la normă, medicamentele inhibitoare trebuie înlocuite cu alți agenți care nu conduc la astfel de consecințe. Dacă acest lucru nu este posibil, atunci medicul poate prescrie medicamente speciale care promovează agregarea.
Atât agregarea crescută, cât și cea scăzută pot duce la consecințe grave. Prin urmare, astfel de situații nu pot fi ignorate. În astfel de cazuri, trebuie să consultați un medic pentru a prescrie un tratament adecvat.