Жиры природные органические соединения, полные сложные эфиры глицерина и одноосновных жирных кислот; входят в класс липидов. Жиры – сложные эфиры глицерина
Жиры и масла - это природные эфиры, которые образованы трехатомным спиртом – глицерином и высшими жирными кислотами с неразветвленной углеродной цепью, содержащими четное число атомов углерода. В свою очередь, натриевые или калиевые соли высших жирных кислот называются мылами.
При взаимодействии карбоновых кислот со спиртами (реакция этерификации ) образуются сложные эфиры:
Эта реакция обратима. Продукты реакции могут взаимодействовать друг с другом с образованием исходных веществ - спирта и кислоты. Таким образом, реакция сложных эфиров с водой - гидролиз сложного эфира - обратна реакции этерификации. Химическое равновесие, устанавливающееся при равенстве скоростей прямой (этерификация) и обратной (гидролиз) реакций, может быть смещено в сторону образования эфира присутствием водоотнимающих средств.

Сложные эфиры в природе и технике
Сложные эфиры широко распространены в природе, находят применение в технике и различных отраслях промышленности. Они являются хорошими растворителями органических веществ, их плотность меньше плотности воды, и они практически не растворяются в ней. Так, сложные эфиры с относительно небольшой молекулярной массой представляют собой легко воспламеняющиеся жидкости с невысокими температурами кипения, имеют запахи различных фруктов. Их применяют в качестве растворителей лаков и красок, ароматизаторов изделий пищевой промышленности. Например, метиловый эфир масляной кислоты имеет запах яблок, этиловый эфир этой кислоты - запах ананасов, изобутиловый эфир уксусной кислоты - запах бананов:

Сложные эфиры высших карбоновых кислот и высших одноосновных спиртов называют восками
. Так, пчелиный воск состоит главным об
разом из эфира пальмитиновой кислоты и мирицилового спирта C 15 H 31 COOC 31 H 63 ; кашалотовый воск - спермацет - сложный эфир той же пальмитиновой кислоты и цетилового спирта C 15 H 31 COOC 16 H 33.

Жиры

Важнейшими представителями сложных эфиров являются жиры.
Жиры - природные соединения, которые представляют собой сложные эфиры глицерина и высших карбоновых кислот.
Состав и строение жиров могут быть отражены общей формулой:

Большинство жиров образовано тремя карбоновыми кислотами: олеиновой, пальмитиновой и стеариновой. Очевидно, что две из них - предельные (насыщенные), а олеиновая кислота содержит двойную связь между атомами углерода в молекуле. Таким образом, в состав жиров могут входить остатки как предельных, так и непредельных карбоновых кислот в различных сочетаниях.
В обычных условиях жиры, содержащие в своем составе остатки непредельных кислот, чаще всего бывают жидкими. Их называют маслами. В основном это жиры растительного происхождения - льняное, конопляное, подсолнечное и другие масла. Реже встречаются жидкие жиры животного происхождения, например рыбий жир. Большинство природных жиров животного происхождения при обычных условиях - твердые (легкоплавкие) вещества и содержат в основном остатки предельных карбоновых кислот, например, бараний жир. Так, пальмовое масло - твердый в обычных условиях жир.
Состав жиров определяет их физические и химические свойства. Понятно, что для жиров, содержащих остатки ненасыщенных карбоновых кислот, характерны все реакции непредельных соединений. Они обесцвечивают бромную воду, вступают в другие реакции присоединения. Наиболее важная в практическом плане реакция - гидрирование жиров. Гидрированием жидких жиров получают твердые сложные эфиры. Именно эта реакция лежит в основе получения маргарина - твердого жира из растительных масел. Условно этот процесс можно описать уравнением реакции:

гидролизу :


Мыла
Все жиры, как и другие сложные эфиры, подвергаются гидролизу . Гидролиз сложных эфиров - обратимая реакция. Чтобы сместить равновесие в сторону образования продуктов гидролиза, его проводят в щелочной среде (в присутствии щелочей или Na 2 CO 3). В этих условиях гидролиз жиров протекает необратимо и приводит к образованию солей карбоновых кислот, которые называются мылами. Гидролиз жиров в щелочной среде называют омылением жиров.
При омылении жиров образуются глицерин и мыла - натриевые или калиевые соли высших карбоновых кислот:

Шпаргалка

Жиры – это сложные эфиры трехатомного спирта глицерина и высших карбоновых кислот, общая формула которых изображена на слайде.
Жиры, как это не удивительно, относятся к сложным эфирам. В их образовании участвуют стеариновая кислота С 17 Н 35 СООН (или близкие к ней по составу и строению другие жирные кислоты) и трехатомный спирт глицерин С 3 Н 5 (ОН) 3 . Вот как выглядит схема молекулы такого эфира:
Н 2 С- О –С(О)С 17 Н 35
НС- О –С(О)С 17 Н 35
Н 2 С- О –С(О)С 17 Н 35 тристеарин, эфир глицерина и стеариновой кислоты, тристеарат глицерина.
Жиры имеют сложное строение – это подтверждает модель молекулы тристеарата.
Химические свойства жиров: гидролиз и гидрирование жидких жиров.
Для жиров, содержащих остатки ненасыщенных карбоновых кислот, характерны все реакции непредельных соединений. Наиболее важная реакция присоединения, имеющая практическое значение – это гидрирование жидких жиров . Эта реакция лежит в основе получения маргарина (твердого жира) из растительного масла.
Все жиры, как и другие сложные эфиры, подвергаются гидролизу .
Гидролиз жиров протекает и в нашем организме: когда в органы пищеварения поступают жиры, то под влиянием ферментов они гидролизуются с образованием глицерина и карбоновых кислот. Продукты гидролиза всасываются ворсинками кишечника, а затем синтезируется жир, но уже свойственный данному организму. В дальнейшем они гидролизуются и постепенно окисляются до углекислого газа и воды. При окислении жиров в организме выделяется большое количество энергии. Для людей, занятых тяжелым физическим трудом, затраченную энергию проще всего компенсировать жирной пищей. Жиры поставляют в ткани организма жирорастворимые витамины и другие биологические активные вещества.
В зависимости от условий гидролиз бывает:
¾ Водный (без катализатора, при высоких температуре и давлении).
¾ Кислотный (в присутствии кислоты в качестве катализатора).
¾ Ферментативный (происходит в живых организмах).
¾ Щелочной (под действием щелочей).
Гидролиз сложных эфиров – обратимая реакция. Для смещения равновесия в сторону продуктов реакции его проводят в щелочной среде (в присутствии щелочей или карбонатов щелочных металлов, например, карбоната натрия).
DATEM - это аббревиатура пищевой добавки под названием Глицерина и диацетилвинной и жирных кислот эфиры. Она зарегистрирована под номером E472e, а также известна под названиями Diacetyltartaric and fatty acid esters of glycerol, Эфиры глицерина, диацетилвинной и жирных кислот , Mixed acetic and tartaric acid esters of mono- and diglycerides of fatty acids.
Для использования в промышленных целях эти соединения синтезируют химически. Первый вариант их получения - взаимодействие диацетилвинного ангидрида с моно- и диглицеридами жирных кислот в присутствии уксусной кислоты, а второй вариант - реакция между уксусным ангидридом и глицеридами жирных кислот в присутствии винной кислоты. В качестве сырья для жирных кислот, участвующих в синтезе Е472е, часто используется соевое масло. Готовое вещество на внешний вид представляет собой маслянистые, воскоподобные жидкости, пасты либо твёрдые воски, желтовато-белого цвета, со вкусом и запахом. Оно легко растворяется в воде (и холодной, и горячей), спиртах, ацетоне и этилацетате.
Добавка E472e разрешена в России для добавления в некоторые продукты согласно их ТИ и выполняет в них функции эмульгатора, комплексообразователя и стабилизатора. Попадая в организм человека, она полностью перерабатывается, не оказывая негативного действия на здоровье. Это подтверждают и проведенные на животных исследования. Поэтому эта добавка считается безопасной для человека. Но рекомендуется не употреблять ее более 50 мг/кг веса в сутки - такая максимальная доза установлена в Канаде.
Подробнее см. ниже СМЕШАННЫЕ ЭФИРЫ ГЛИЦЕРИНА И ВИННОЙ, УКСУСНОЙ И ЖИРНЫХ КИСЛОТ.
ЭФИРЫ ГЛИЦЕРИНА И МОЛОЧНОЙ И ЖИРНЫХ КИСЛОТ Е472b
Добавка E472b называется Глицерина и молочной и жирных кислот эфиры, а также Lactic and fatty acid esters of glycerol , Лактилированные моно- и диглицериды, Lactylated mono- and diglycerides, Лактоглицериды, Lactoglycerides или LACTEM.
В пищевой промышленности России добавка Е472b разрешена в качестве эмульгатора, стабилизатора и комплексообразователя. А когда она поступает в организм, то расщепляется на отдельные кислоты и жиры и затем усваивается как и любые натуральные жиры.
Допустимое суточное потребление установлено на уровне 50 мг/кг массы тела. Побочных эффектов при соблюдении этой нормы замечено не было
. Иногда ее причисляют к веществам - возможным канцерогенам, но точных данных по этой теме нет.
| Технологические функции | Эмульгаторы, средства обработки муки, пенообразователи, стабилизаторы пены. |
| Синонимы | Лактилированные моно- и диглицериды, лактоглицериды; англ. lactic and fatty acids esters of glycerol, lactylated mono- and diglycerides, lactylic esters of fatty acids, LACTEM, lactoglycerides; нем. Lactoglyceride, Milchsaureester der Mono- und Diglyceride, LACTEM, Mono-und Diglyceride von Speisefettsauren, verestert mit Milchsaure; фр. esters lactiques et d"acides gras de glycerine, mono- et diglycerides lactyles. |
| Состав | Смесь сложных эфиров глицерина с жирными и молочными кислотами. |
| Молекулярная масса | 122,14 |
| Состав | Смесь четырёх изомеров 1,2,3,4-тетрагидроксибутана. |
| Структурная формула | Ri, R2, R3 - остатки молочной или жирной кислоты, либо водород |
| Органолептические свойства | Масла и воски от беловатого до коричневатого цвета с маслянистым, слегка горьким вкусом. |
| Физико-химические свойства | Температура плавления и твёрдость заметно ниже, чем у соответствующих моноглицеридов. Диспергируются в горячей воде; нерастворимы в холодной воде. |
| Получение | Непосредственным взаимодействием компонентов друг с другом или этерификацией (дистиллированных) моноглицеридов молочной кислотой по равновесной реакции с перегруппировкой ацильной группы. Примеси: моно-, ди- и триглицериды, сопутствующие жирам в-ва, молочная и полимолочная кислоты. |
| Спецификации | |
| Метаболизм и токсичность | Полностью гидролизуются и усваиваются. Высокая гидролитическая способность этих эмульгаторов приводит к тому, что обычно уже в пищевом продукте, особенно в хлебобулочных изделиях, они в большой степени разлагаются на моноглицериды и лактаты и тем самым выводятся из кишечника. |
| Гигиенические нормы |
ДСП 50 мг/кг веса тела в день. Опасности по ГН-98 отсутствуют. Codex: разрешены в маргаринах в количестве до 10 г/кг. В РФ разрешены в качестве эмульгаторов в пищевые продукты согласно ТИ в количестве согласно ТИ (п. 3.6.6 СанПиН 2.3.2.1293-03). |
| Применение | Этерификация моно- и диглицеридов молочной и полимолочной кислотами приводит к: сужению области плавления; снижению устойчивости к гидролизу и нагреванию; возрастанию величины ГЛБ до 4-5; облегчению переработки, особенно с добавкой мыла; особой активности на границе раздела с газовой фазой. По этим причинам молочнокислые глицериды являются прекрасными эмульгаторами при взбивании трёхфазных систем и облегчают вспенивание (насыщение воздухом, взбивание) теста, маргаринов для выпечки, мороженого, десертов без предварительной обработки. Из-за склонности к гидролизу этот эмульгатор может использоваться только в порошкообразных продуктах. Другие области применения: благотворное влияние глицеридов молочной кислоты на кожу позволяет использовать их в косметике, но из-за склонности к гидролизу их применение ограничивается пенными масками и аналогичными средствами, приготовляемыми непосредственно перед употреблением. |
ЭФИРЫ ГЛИЦЕРИНА И СМОЛЯНЫХ КИСЛОТ Е445
Эфир глицерина Е445 относится к группе стабилизаторов предназначенных для сохранения вязкости и консистенции пищевых продуктов. К примеру, подобным действием обладает пектин. Основным действующим веществом добавки является глюкоманнан отличающийся пониженным содержанием калорий и большим количеством волокон диетических. Для ее получения смоляные кислоты извлекают из пней старых сосен. А затем проводят реакцию между ними и глицерином. В итоге образуется твердое вещество цветом от бледно-янтарного до желтого, которое нерастворимо в воде, но хорошо растворяется в органических растворителях (ацетоне и бензоле).
Эфиры глицерина и смоляных кислот разрешены в российской пищевой промышленности для изготовления замутненных безалкогольных напитков на ароматизаторах и для поверхностной обработки цитрусовых. При этом они выполняют функцию эмульгатора (т.е. повышают смешиваемость тех веществ, которые в обычных условиях не смешиваются) и стабилизатора (т.е. способствуют лучшему сохранению текстуры, формы и консистенции пищевых продуктов).
Влияние на организм человека:
Добавка Е445 при попадании внутрь организма человека выводится затем из него с мочой. Она считается безопасной для человека
. Именно она служит хорошей альтернативой для .
Эфиры смоляных кислот могут являться аллергенами и вызвать раздражение кожных покровов. Применяемая добавка Е445 в качестве эмульгатора может приводить к раздражению слизистых оболочек организма и к расстройству работы желудка. Особенно осторожно следует употреблять продукты, имеющие в составе добавку Е445 людям, имеющим нарушения обменных процессов. В производстве детского питания эфиры глицерина не используются..
Пищевая добавка Е445 разрешена в Российской Федерации согласно норм и ТИ (см. ниже Гигиенические нормы).| Технологические функции | Эмульгаторы, стабилизаторы, загустители. |
| Синонимы | Англ. ester gum, glycerol esters of wood rosin; нем. Glycerinester der Harzsauren, Glycerinester aus Wurzelharz; фр. esters de glycerol et acides gommique. |
| САS№ | 8050-30-4. |
| Состав | Смесь три- и диглицериновых эфиров смоляных кислот, комплексной смеси изомерных дитерпеноидных монокарбоновых кислот, имеющих молекулярную формулу вида: С 20 Н 30 2 , гл. обр. абиетиновой кислоты. |
| Органолептические свойства | Твердое вещество от желтого до бледно-янтарного цвета. |
| Физико-химические свойства | Раств. в ацетоне и бензоле; нераств. в воде. |
| Получение | Этерификацией глицерина смоляными кислотами, получаемыми экстракцией из пней старых сосен, с последующей очисткой путем отгонки с водяным паром или противоточной перегонкой с паром. Флуоресцин иодируют в водных или спиртовых р-рах. Под эритрозином понимают натриевую соль. Кальциеваая, калиевая соли и алюминиевый лак в ЕС также разрешены. Примеси: хлорид натрия, сульфат натрия. |
| Спецификации |
 |
| Гигиенические нормы | В РФ разрешены в качестве эмульгаторов, стабилизаторов консистенции, загустителей, текстураторов в напитки безалкогольные на ароматизаторах замутнённые в количестве до 100 мг/кг; в цитрусовые плоды для обработки поверхности в количестве до 50 мг/кг (п. 3.6.7 СанПиН 2.3.2.1293-03). |
| Применение | В качестве компонента основы жевательной резинки, стабилизатора консистенции (загустителя) в напитках, также регулирует плотность эфирных масел в напитках, не позволяя им всплывать на поверхность напитка при хранении. |
ЭФИРЫ ГЛИЦЕРИНА И УКСУСНОЙ И ЖИРНЫХ КИСЛОТ Е472а
Добавка Е472а относятся к стабилизаторам, применяющимся для сохранения и улучшения вязкости и консистенции пищевых продуктов. Эти эфиры синтезируют из , натуральных жирных кислот и . Например, их можно получить при взаимодействии жиров с ацетангидридом либо путем переэтерификации триацетина. Готовый продукт - это белое или бледно-жёлтое масло или мягкий воск со слабым запахом уксуса. Он хорошо растворяется в этиловом спирте, но нерастворим в воде.
В Российской Федерации добавка Е472а является разрешенной и применяется для смешивания несмешиваемых в обычных условиях продуктов (эмульгатор), стабилизации их консистенции и текстуры (стабилизатор) и в качестве комплексообразователя. Ее можно встретить в таких продуктах как рис быстрого приготовления, хлеб, бисквиты, сухарики, продукты на зерновой основе, в других продуктах согласно их ТИ, а также в составе красителей и жирорастворимых антиокислителей.
Влияние на организм человека:
В организме Ацетоглицериды хорошо усваиваются как и любые другие жиры и не оказывают какого-либо негативного влияния на здоровье.
Поэтому предельно допустимое количество их потребления в сутки не ограничено.
| Технологические функции | Покрытия, разделители. |
| Синонимы | Моно- и диглицериды уксусной и жирных кислот, ацетилированные моно- и диглицериды, ацетоглицериды; англ. acetic and fatty acid esters of glycerol, acetylated mono- and diglycerides, acetoglyc-erides, acetic acid esters of mono-and diglycerides; нем. Acetofette, Essigsaureester der Mono- und Diglyceride, Mono- und Diglyceride von Speisefettsauren, verestert mit Essigsaure; фр. esters acetiques et d"acides gras de glycerol, mono- et diglycerides acetyles |
| Состав | Сложные эфиры глицерина с одной или двумя пищевыми жирными кислотами и одной или двумя молекулами уксусной кислоты. |
| Структурная формула | Rj, R2, R3 - остаток жирной кислоты, либо СОСНз, либо водород |
| Органолептические свойства | От светло-жёлтого масла до пластичного воска с лёгким запахом уксуса. |
| Физико-химические свойства | Температура плавления ниже, чем у соответствующих моноглицеридов. Раств. в этаноле; нераств. в воде. |
| Получение | Взаимодействием жиров или парциальных глицеридов с ацетан-гидридом или переэтерификацией триацетина. Примеси: моно-, ди- и триглицериды, сопутствующие жирам в-ва. |
| Спецификации |  |
| Метаболизм и токсичность | |
| Гигиенические нормы | ДСП не ограничено. Опасности по ГН-98 отсутствуют. В РФ разрешены в качестве эмульгаторов в пищевые продукты согласно ТИ в количестве согласно ТИ (п. 3.6.6 СанПиН 2.3.2.1293-03). В основном, моноглицериды насыщенных жирных кислот и одной или двух молекул уксусной кислоты (50/70/90% этерифицированных свободных ОН-групп). |
| Применение | Ацетожирами являются ди- и триглицериды натуральных жирных кислот с чётным числом атомов углерода от С 2 до C 18 , т.е. с очень разной длиной цепи. Поскольку они содержат только насыщенные жирные кислоты, они устойчивы к кислороду и свету, а также осмолению и прогорканию, но легко отщепляют уксусную кислоту. Они едва ли обладают эмульгирующим действием, но могут влиять на кристаллическую структуру и пластичность жиров; выполнять роль смазки, разделяющего агента; образовывать твёрдые, крепко держащиеся и устойчивые к разрушению покрытия или плёнки. Это позволяет использовать ацетожиры в качестве покрывных масс для колбас, сыров, орехов, изюма, конфет, а также пищевых упаковочных материалов; пластификаторов для хрупких восков, твёрдых жиров, жевательной резинки; регуляторов консистенции в маргаринах, жировых покрытиях, майонезах, наполнителях. Другие области применения: в качестве регуляторов консистенции и плёнкообразователей в кремах для ухода за кожей, лосьонах, суппозиториях. |
| Товарные формы | В основном, моноглицериды насыщенных жирных кислот и одной или двух молекул уксусной кислоты (50/70/90% этерифицированных свободных ОН-групп). |
ЭФИРЫ ЛАКТИЛИРОВАННЫХ ЖИРНЫХ КИСЛОТ ГЛИЦЕРИНА И ПРОПИЛЕНГЛИКОЛЯ Е 478
- Пищевая добавка Е 478
имеет синтетическое происхождение и изготовляется путем взаимодействия пищевых масел или жиров с пропиленгликолем и дальнейшим лактилированием.
Ранее добавка Е 478 применялась в Российской Федерации в некоторых продуктах согласно их технологии изготовления. Но с 2010 года она включена в список запрещенных к употреблению добавок. В Европе же она запрещена уже в 1986 году.
Эфиры лактилированных жирных кислот глицерина и пропиленгликоля используются в качестве стабилизатора и эмульгатора в продуктах с высоким содержанием жиров для качественного формирования и структурирования жировых кристаллов.
Процесс этерификации добавки Е 478 позволяет качественно изменять область плавления, снижать устойчивость к гидролизу, облегчать переработку сырья. Благодаря этим свойствам эфиры значительно улучшают качество взбивания теста, мороженого, десертов, маргарина. Применяются эфиры при производстве сухих сливок для кофе и соусов, а так же способны продлить жизнедеятельность клеток дрожжей и защитить ароматизаторы от изменения вкуса.
Применение красителя может привести к нарушениям работы органов желудочно-кишечного тракта, вызывает аллергию (крапивницу, экземы), приступы удушья. Кроме того, Е131 нельзя употреблять людям, которые имеют чувствительность к аспирину. Может вызывать, особенно у маленьких детей, слишком активное поведение, возбуждение.
| Технологические функции | Эмульгаторы. |
| Синонимы | Англ. lactylated fatty acids esters of glycerol and propylene glycol, propylenglycollactostearates; нем. Propylenglycollactostearate; фр. propylenglycollactostearates. |
| Состав | Смесь сложных эфиров пропиленгликоля и глицерина и молочной и жирных кислот, полученная лактилированием продукта реакции пищевых жиров или масел с пропиленгликолем. |
| Внешний вид | Более или менее твёрдая масса. |
| Физико-химические свойства | Диспергируются в горячей воде и умеренно растворяются в соевом масле. |
| Спецификации |
 |
| Гигиенические нормы | В Европе запрещены для применения в пищевых продуктах. В марте 1986 г. вычеркнуты из приложения II Директивы ЕС по эмульгаторам. В РФ разрешены в качестве эмульгаторов в пищевые продукты согласно ТИ в количестве согласно ТИ (п. 3.6.9 СанПиН 2.3.2.1293-03). |
| Применение | Для формирования структуры кристаллов жира. |
ЭФИРЫ ЛИМОННОЙ КИСЛОТЫ И МОНО- И ДИГЛИЦЕРИДОВ ЖИРНЫХ КИСЛОТ Е 472с
Эфиры глицерина и лимонной и жирных кислот - это пищевая добавка E 472c.
Получить эти соединения можно путем этерификации с и жирными кислотами. Причем, жирные кислоты могут быть как растительного, так и животного происхождения. Внешне это воскоподобная масса цветом от белого до беловато-желтого. Цитроглицериды способны растворяться в маслах, жирах и углеводородах, образуют дисперсию в горячей воде и не растворяются в холодной воде и холодном этиловом спирте. Также они характеризуются низкой термостойкостью и легко гидролизуются.
Влияние на организм человека:
Допустимая норма суточного потребления эфиров жирных кислот не ограничена Организм человека усваивает Е 472f как любые усваиваемые натуральные жиры и добавка в качестве хлебопекарного улучшителя и стабилизатора считается безвредной.
Е472f не вызывает аллергических реакций и не обладает токсическим действием. При прямом контакте не вызывает раздражения кожных покровов. Не рекомендуется злоупотреблять продуктами, имеющими в составе добавку людям, имеющим нарушения обменных процессов в организме.
| Технологические функции | Эмульгаторы, стабилизаторы, синергисты антиокислителей. |
| Синонимы | Эфиры глицерина и лимонной и жирных кислот, цитроглицериды; англ. citric and fatty acid esters of glycerol, CITREM, citroglycerides; нем. Citronensaureester der Mono- und Diglyceride, CITREM, Mono- und Diglyceride von Speisefettsauren, verestert mit Citronensaure; фр. esters d"acides citrique et d"acides gras de glycerine. |
| Состав | Сложный эфир глицерина с одной-двумя молекулами пищевых жирных кислот и одной-двумя молекулами лимонной кислоты, причём лимонная кислота, как трёхосновная, может быть этерифицирована другими глицеридами и как оксикислота - другими жирными кислотами. Свободные кислотные группы могут быть нейтрализованы натрием. |
| Внешний вид | От желтоватых и коричневых масел до беловатых восков. |
| Физико-химические свойства | Широкая область плавления, при этом невысокая термостойкость, склонность к ацильной перегруппировке, легко гидролизуются. Диспергируемы в горячей воде; раств. в углеводородах, маслах, жирах; нераств. в холодной воде, холодном этаноле. |
| Получение | Непосредственным взаимодействием компонентов друг с другом или этерификацией (дистиллированных) моноглицеридов лимонной кислотой. Оставшиеся свободными карбоксильные группы могут быть нейтрализованы натрием. Примеси: моно-, ди-, и триглицериды, в-ва, сопутствующие жирам, сложные эфиры лимонной кислоты с глицерином или другими жирными |
| Спецификации |
 |
| Метаболизм и токсичность | Полностью гидролизуются и усваиваются. |
| Гигиенические нормы | ДСП не ограничено. Опасности по ГН-98 отсутствуют. Codex:разрешены в маргаринах в количестве до 10 г/кг (сумма всех эмульгаторов). В РФ разрешены в качестве стабилизаторов консистенции, эмульгаторов в пищевые продукты согласно ТИ в количестве согласно ТИ (п. 3.6.6 СанПиН 2.3.2.1293-03). |
| Применение | Этерификация моно- и диглицеридов трёхосновной лимонной кислотой приводит к большому числу возможных продуктов реакции; ионогенным липофильным продуктам с высокой комплексообразующей способностью в жировой фазе, обладающим поэтому: Величиной ГЛБ, меняющейся в зависимости от рН среды: от 4 в кислой среде до 12 в нейтральной; Глицериды лимонной кислоты применяются в качестве эмульгаторов (обычно в смеси с моноглицеридами) и синергистов антиоксидантов (обычно в смеси с токоферолами), а также: Также они делают возможным одноэтапное приготовление кондитерских изделий; улучшают взбитость и снижают опасность плесневения (в количестве 0,5-1,5%); в препаратах сухих дрожжей продлевают жизнеспособность дрожжевых клеток; в ароматизаторах используются для защиты от изменения вкуса. Другие области применения: в кремах, лосьонах и других косметических препаратах. |
| Товарные формы | Препараты с определённой областью применения. |
ЭФИРЫ МОНО- И ДИГЛИЦЕРИДОВ ВИННОЙ И ЖИРНЫХ КИСЛОТ E472d
Пищевая добавка E472d объединяет группу веществ - это Моно- и диглицериды жирных кислот и винной кислоты, эфиры .
В пищевой промышленности России и многих других стран (за исключением Австралии) добавка Е472d разрешена к использованию . Она обладает свойствами эмульгатора, стабилизатора и комплексообразователя, позволяя улучшать и стабилизировать консистенцию и текстуру продуктов питания в соответствии с их технологией изготовления. Но применяется она относительно редко, поскольку не дает каких-либо технологических преимуществ по сравнению с другими эмульгаторами.
Влияние на организм человека:
Побочные эффекты при попадании внутрь Эфиров моно- и диглицеридов винной и жирных кислот не известны. В организме они расщепляются и полностью усваиваются так же, как и натуральные жиры. Предельно допустимой величиной их суточного потребления считается 30 мг/кг массы тела.
ЭФИРЫ МОНОГЛИЦЕРИДОВ И ЯНТАРНОЙ КИСЛОТЫ, СУКЦИНИЛИРОВАННЫЕ МОНОГЛИЦЕРИДЫ E472g
SMG - это сокращенное название пищевой добавки E472g . Она известна также под названиями Моноглицеридов и янтарной кислоты эфиры, Succinylated Monoglycerides , Сукцинилированные моноглицериды.
Сукцинилированные моноглицериды относятся к стабилизаторам, эмульгаторам и улучшителям хлебопекарным сохраняющим и улучшающим вязкость и консистенцию пищевых продуктов.
Имеют структуру порошка, чешуек, шариков или восков белого цвета и не обладающих выраженным запахом. Растворимы в бензолах, этанолах и хлороформе. Не растворимы в воде.
Ранее добавка Е472g использовалась в качестве эмульгатора, стабилизатора и комплексообразователя в различных продуктах в соответствии с их ТИ (чаще хлебобулочной продукции). Но с 2010г. в России ее исключили из списка разрешенных к применению в пищевой промышленности. Также она не имеет разрешения для применения и на территории Европейского Союза.
Влияние на организм человека:
При производстве детского питания добавка Е472g применяется очень ограниченно. Людям, имеющим заболевания желудка и кишечного тракта, к употреблению продуктов с добавкой Е472g следует относиться с осторожностью. При употреблении продуктов, содержащих сукцинилированные моноглицериды, следует учитывать тот факт, что вред организму может быть нанесён исключительно чрезмерным употреблением самих продуктов, а не добавкой. На этом основании людям, которым рекомендовано ограничить потребление хлебобулочных изделий следует придерживаться именно этим рекомендациям.
| Технологические функции | Эмульгаторы. |
| Синонимы | Англ. succinylated monoglycerides. |
| Состав | Смесь эфиров янтарной кислоты и моно- и диглицеридов, получаемая сукцинилированием продукта глицеролиза пищевых жиров и масел, либо прямой этерификацией глицерина пищевыми жирными кислотами. |
| Внешний вид | Воскоподобная масса грязно-белого цвета. |
| Структурная формула | R1, R2, R3 - остаток жирной или янтарной кислоты, либо водород |
| Спецификации |  |
| Гигиенические нормы | ДСП отсутствует. В РФ разрешены в качестве эмульгаторов в пищевые продукты согласно ТИ в количестве согласно ТИ (п. 3.6.6 СанПиН 2.3.2.1293-03). |
| Применение | В хлебобулочных изделиях (аналогично DATEM). |
ЭФИРЫ ПОЛИГЛИЦЕРИНА И ВЗАИМОЭТЕРИФИЦИРОВАННЫХ РИЦИНОЛОВЫХ КИСЛОТ Е 476
Имеющиеся сведения о полиглицерине достаточно противоречивы и требуют тщательной проверки.
Официальное разрешение на применение добавка Е 476 не имеет на территории Российской Федерации, Украины и некоторых стран ЕС.
Получают полиглицерин из модифицированных растительных веществ, в качестве разрешенного к применению может служить соевый лецитин.
Полиглицерин используется при производстве шоколада, а в пищевой промышленности применяется в качестве эмульгатора. Шоколад с высоким содержанием жиров имеет не очень хорошие свойства обтекания, поэтому для сокращения расходов масла какао, в шоколад пониженной жирности добавляется полиглицерин, который придаёт шоколаду хорошую способность обтекания начинки с получением более тонкого слоя.
Влияние на организм человека:
По некоторым данным чрезмерное употребление продуктов с Е 476 может привести к увеличению размеров печени и почек, а так же к нарушению обменных процессов в организме человека. Добавка е 476 не является аллергеном.
С особой осторожностью следует относиться к употреблению полиглицеринов людям страдающим заболеваниями желудка и детям младшего возраста.
Дополнительные исследования воздействия полиглицерина на организм человека доказали что Е476 не обладает токсическим действием и не способна вызывать раздражения кожных покровов при прямом контакте с веществом. Более дорогой аналог - соевый лецитин без ГМО является безвредным.
| Технологические функции | Эмульгаторы, разделители, плёнкообразователи. |
| Синонимы | Полиглицерилполирицинолеаты; англ. polyglycerin-polyricinoleate; polyglycerol esters of Interesterified ricinoleic acid; нем. Polyglycerin-Polyricinoleat, PGPR, Emulgator WOL; фр. polyglycerine-polyricinoleate. |
| Состав | Сложные эфиры конденсированных глицеринов (преимущественно ди- и триглицерина) с конденсированными гидроксижирными кислотами, преимущественно цепи из 5-8 рициноловых кислот (12-гидроксимасляных кислот). |
| Структурная формула |  |
| Молекулярная масса | Выше 1000. |
| Органолептические свойства | Вязкие тёмные масла. |
| Физико-химические свойства | Широкая область плавления. Хор. раств. в эфире, углеводородах, маслах; ср. раств. в спиртах; нераств. в воде, гликолях. Термостойкость и устойчивость к гидролизу хорошие. |
| Получение | Глицерин и рициноловая кислота самоконденсируются (полимеризуются), и обе фракции совместно этерифицируются. Примеси: свободные (поли)глицерины, свободные жирные (поли) кислоты, нейтральные жиры. |
| Спецификации |  |
| Метаболизм и токсичность | Основная часть эмульгатора медленно расщепляется в кишечнике, полирициноловая кислота всасывается и расщепляется в печени, длинные полиглицерины выделяются с калом, короткие - с мочой. Зарегистрировано увеличение почек и печени благодаря медленной обратимой гипертрофии клеток паренхима. |
| Гигиенические нормы | ДСП 7,5 мг/кг веса тела в день.
Опасности по ГН-98 отсутствуют. Codex: разрешены в качестве эмульгатора в шоколаде, шоколаде с наполнителями, низкожирных маргаринах в количестве не более 5 г/кг (общее содержание эмульгаторов не более 15 г/кг). В РФ разрешены в качестве эмульгаторов в маргарины бутербродные с содержанием жира не более 41% , в заправки, приправы, десерты желированные в количестве до 4 г/кг; в сахаристые кондитерские изделия на основе какао и шоколад, глазурь шоколадную в количестве до 5 г/кг (п. 3.6.36 СанПиН 2.3.2.1293-03). |
| Применение | Раздельная полимеризация жирных кислот и глицерина с последующей этерификацией ведёт к образованию неионогенных, относительно высокомолекулярных эмульгаторов с включёнными гидрофильными «гнёздами». Это приводит к поразительно сильному влиянию на поверхностное напряжение в системе масло/вода и масло/жировой кристалл.
У полиглицеринрицинолеатов есть две основных области применения:
- в качестве эмульгатора и разделителя в разделяющих эмульсиях, спреях и восках для смазывания пекарских форм, противней, а также формующих и штампующих машин для кондитерских изделий;
- для снижения вязкости темперируемых шоколадных масс при размалывании, вальцевании и коншировании, а также для лучшего формования и получения тонких, но плотных и прочных шоколадных глазурей (покрытий). Для ощутимого снижения вязкости шоколадных масс, необходимого при производстве глазурей, концентрация PGPR должна составлять 0,3-0,5%. При употреблении плиточного шоколада с таким высоким содержанием PGPR их предельно допустимая дневная доза (соответствующая 100 г шоколада) достигалась бы слишком быстро. При употреблении же тонких шоколадных глазурей на выпечке, кондитерских изделиях и мороженом опасность превышения ДСП отсутствует даже при такой высокой концентрации. Другие области применения: в разделяющих восках, спреях и эмульсиях (смазка для форм). |
ЭФИРЫ ПОЛИГЛИЦЕРИНА И ЖИРНЫХ КИСЛОТ Е475
Пищевой стабилизатор Е475 Эфиры полиглицеридов и жирных кислот является стабилизирующим агентом для улучшения консистенции и сохранения вязкости продуктов питания. По сути, данное вещество является смесью полиглицеридов и эфиров жирных кислот, поэтому может также играть роль эмульгатора.
Самостоятельно эти соединения образуются в жирах после жарки. А искусственно их синтезируют в ходе химической реакции между жирными кислотами и .
В российской пищевой промышленности добавка Е475 разрешена и применяется для лучшего смешивания продуктов разной консистенции, т.е. в качестве эмульгатора. Ее можно встретить в аналогах молока и сливок, жировых эмульсиях, мучных и сахаристых кондитерских изделиях, хлебобулочных изделиях, десертах, жевательной резинке, продуктах из яиц, забеливателях для напитков, эмульгированных ликерах, диетических смесях для снижения массы тела, БАДах, а также в составе красителей и жирорастворимых антиокислителей.
Влияние на организм человека:
В организме эта добавка расщепляется до более простых составляющих (моно- и диглицеридов и жирных кислот), а затем усваивается аналогично натуральным жирам при помощи содержащегося в слюне фермента. По результатам проведенных в Великобритании исследований она была признана безопасной для человека, и разрешена во многих странах мира
. Но рекомендуется ее употреблять не более 25 мг/кг массы тела в сутки.
| Технологические функции | Эмульгаторы, пеногасители, диспергирующие агенты. |
| Синонимы |
Полиглицериды; англ. polyglycerol esters of fatty acids, polyglycerides; нем. Polyglycerinester von Speisefettsauren, Polyglyceride; фр. polyglycerides. |
| САS№ | 2731-72-8 (триглицерилмоностеарат); 34424-98-1 (декаглицерилтетраолеат). |
| Эмпирическая формула | С 27 Н 53 0 8 |
| Молекулярная масса | 505,70 (триглицерилмоностеарат). |
| Структурная формула |  |
| Состав | Сложный эфир поликонденсированного глицерина, преимущественно диглицерина, с пищевыми жирными кислотами. Может содержать добавки натриевых солей до 6%. |
| Внешний вид | Маслянистая вязкая жидкость от светло-жёлтого до янтарного цвета; с увеличением доли глицерина сложные эфиры становятся более твёрдыми и хрупкими, так что некоторые из них можно размалывать до порошков от желтовато-коричневого до коричневого цвета. |
| Физико-химические свойства | Имеют широкую область плавления, т.к. представляют собой смесь различных изомеров. Хор. раств. в спиртах, углеводородах; ср. раств. в тёплой воде, тёплых маслах; нераств. в холодной воде, холодных гликолях. |
| Природный источник | В использованных жирах для жарки. |
| Получение | Конденсацией глицерина или присоединением глицерида к глицерину и переэтерификацией (очищенного) продукта жирами или этерификацией свободными жирными кислотами. Примеси: моно-, ди- и триглицериды, свободный глицерин и свободный полиглицерин. |
| Спецификации |  |
| Метаболизм и токсичность | Полиглицериновые эфиры расщепляются ферментами, свободные полиглицерины выделяются из организма через почки. |
| Гигиенические нормы |
ДСП 25 мг/кг веса тела в день.
Опасности по ГН-98 отсутствуют. Codex: разрешены в качестве эмульгаторов маргаринов в количестве до 5 г/кг, низкожирных маргаринов до 10 г/кг индивидуально или в сочетании с другими эмульгаторами. В РФ разрешены в качестве эмульгаторов в забеливатели для напитков в количестве до 500 мг/кг; в продукты из яиц в количестве до 1 г/кг; в сахаристые кондитерские изделия, десерты в количестве до 2 г/кг; в аналоги молока и сливок, в жировые эмульсии, в жевательную резинку, в хлебобулочные и мучные кондитерские изделия, в ликёры эмульгированные, в диетические смеси для снижения массы тела в количестве до 5 г/кг; в биологически активные добавки к пище в количестве согласно ТИ (п. 3.6.35 СанПиН 2.3.2.1293-03). |
| Применение | Увеличение гидрофильной доли (поли)глицерина в молекуле эмульгатора увеличивает величину ГЛБ до 6-11. Устойчивость к гидролизу и температурным воздействиям достаточна для использования эфиров полиглицерина в водных системах и позволяет подвергать их кипячению и стерилизации, но эфиры полиглицерина нестойки по отношению к липофильным ферментам. Области применения: Другие области применения: в качестве эмульгатора в косметике (кремы, лосьоны и т.п.), а также в средствах обработки почвы, в кожевенной промышленности; для технических целей часто используются эфиры с более высоким содержанием свободных полиглицеринов, чем растворителей. |
ЭФИРЫ ПРОПИЛЕНГЛИКОЛЯ И ЖИРНЫХ КИСЛОТ Е 477
-
Сведения о влиянии и свойствах пищевого стабилизатора Е 477 Эфиры пропиленгликоля и жирных кислот
довольно противоречивы, поэтому на сегодняшний день данная добавка все еще проходит необходимые тесты и исследования. Между тем, использование этого вещества при промышленном изготовлении продовольственных товаров не запрещено на территории стран Евросоюза, в то время как в Российской Федерации и на Украине законодательно не разрешено
. Это связано в вероятным вредом пищевого стабилизатора Е 477 Эфиры пропиленгликоля и жирных кислот для здоровья человека.
Добавка Е 477 действует как эмульгатор, увеличивает степень взбитости продуктов и стабилизирует действие других эмульгаторов. В нашей стране она применяется при изготовлении различных аналогов молока и сливок, в том числе мороженого и фруктового льда, забеливателей для напитков, десертов и взбитых десертных покрытий, хлебобулочных и кондитерских изделий и жировых эмульсий для них, диетических смесей, в том числе для снижения массы тела.
Влияние на организм человека:
В теле человека Эфиры пропелингликоля и жирных кислот расщепляются ферментами ли-пазами и усваиваются, не оказывая побочных эффектов. Они признаны безопасными
, поскольку обладают низкой токсичностью, не вызывают мутаций и изменений массы тела. Но иногда у чувствительных людей возможны реакции по типу экземы (не при употреблении внутрь!). Тем не менее, несмотря на безвредность, не рекомендуется превышать допустимую дозу 25 мг/кг массы тела в сутки.
| Технологические функции | Эмульгаторы |
| Синонимы | Англ. propylene glycol esters of fatty acids, propylene glycol mono- and diesters of fatty acids; нем. Propylenglykolester der Speisefettsauren, Propandiol-FS-Ester; фр. esters de propyleneglycol d"acides gras. |
| Состав | Смесь сложных эфиров 1,2-пропандиола с одной или двумя пищевыми жирными кислотами. |
| Структурная формула |  Rj и R2 - либо два остатка жирной кислоты, -ORi либо остаток жирной кислоты и водород |
| Внешний вид | Прозрачная жидкость или пластинки, крупинки и т.п. от белого до кремового цвета. |
| Физико-химические свойства | Тпл 30-40°С (пропиленгликолевые эфиры насыщенных жирных кислот). Хор. раств. в спиртах, углеводородах; нераств. в воде. Термостойкость и устойчивость к гидролизу достаточные для условий, имеющихся в пищевых продуктах; эфиры расщепляются липазами. |
| Получение | Этерификацией жирных кислот пропиленгликолем, иногда с последующей, быстрой дистилляцией для обогащения мономерами. Примеси: моно-, ди- и триглицериды, полипропиленгликоль и его сложные эфиры с жирными кислотами. |
| Спецификации |  |
| Метаболизм и токсичность | Жирнокислотная часть расщепляется липазами. |
| Гигиенические нормы |
ДСП 25 мг/кг веса тела в день
. Опасности по ГН-98 отсутствуют. Codex: разрешены в качестве эмульгатора в маргаринах в количестве до 20 г/кг. В РФ разрешены в качестве эмульгатора в забеливатели для напитков, в диетические смеси (продукты), в том числе для снижения массы тела в количестве до 1 г/кг; в мороженое (кроме молочного и сливочного), фруктовый лёд в количестве до 3 г/кг; в аналоги молока и сливок, десерты, сахаристые кондитерские изделия, сдобные хлебобулочные и кондитерские изделия в количестве до 5 г/кг; в жировые эмульсии для хлебобулочных и мучных кондитерских изделий в количестве до 10 г/кг; во взбитые декоративные десертные покрытия кроме молочных в количестве до 30 г/кг (п. 3.6.42 СанПиН 2.3.2.1293-03). |
| Применение | Сложные эфиры пропиленгликоля и жирных кислот имеют величины ГЛБ 1,5-3, что ещё ниже, чем у моноглицеридов, однако кристаллизуются всегда в а-форме и переводят жиры и другие эмульгаторы, особенно моноглицериды, в активную и легко гидратируемую альфа-форму. Поэтому они действуют в качестве эмульгаторов или коэмульгаторов, повышая взбитость пен, мороженого, десертов и стабилизируя другие препараты эмульгаторов. Другие области применения: как регулятор кристаллообразования в твёрдых жирах. |
| Товарные формы | Непосредственно этерифицированные с содержанием 50-60% моноэфиров пропиленгликоля и жирных кислот или дистиллированные с содержанием моноэфиров 90-95%. |
ЭФИРЫ САХАРОЗЫ И ЖИРНЫХ КИСЛОТ Е 473
Сахарозы и жирных кислот эфиры (Sucrose esters of fatty acids) - это пищевая добавка E473, разрешенная в России в качестве эмульгатора.
Как и другие представители группы стабилизирующих веществ, химические параметры, а кроме того свойства пищевого стабилизатора Е473 Эфиры сахарозы и жирных кислот позволяют использовать добавку в качестве формообразователя, т.е. вещества придающего определенную санитарно-эпидемиологическими нормами консистенцию продовольственным товарам. Кроме того стабилизатор Е473 оказывает определяющее влияние на консистенцию и уровень вязкости готовой продукции.
В пищевой промышленности РФ добавка Е473 может входить в состав множества продуктов, таких как сливки и их аналоги, мороженое и фруктовый лед, напитки на молочной основе; хлебобулочные и кондитерские изделия, а также жировые эмульсии для них, десерты; мясные продукты, консервированные супы и бульоны, соусы; забеливатели для напитков, безалкогольные напитки на основе кокосового ореха, миндаля и аниса и алкогольные напитки (кроме вина и пива), порошки для приготовления горячих напитков. Также эту добавку используют для поверхностной обработки свежих плодов, изготовления диетических смесей и БАДов, жировых растворителей и антиокислителей и продуктов, содержащих гидролизаты белков, пептиды и аминокислоты.
Влияние на организм человека:
В организме человека Эфиры сахарозы и жирных кислот постепенно расщепляются на составляющие и усваиваются аналогично натуральным жирам и сахарам. Они не оказывают токсичного, канцерогенного действия или других побочных эффектов. И при употреблении в количестве, не превышающем максимальную суточную дозу - 10мг/кг, вполне безопасны
.
| Технологические функции | Эмульгаторы, средства обработки муки, покрытия. |
| Синонимы |
Сложные эфиры сахара и жирных кислот; англ. sucrose esters of fatty acids, sucrose fatty acid esters; нем. Saccharose-Fettsaureester, Zuckerester der Speisefettsaure; фр. esters de sucrose d"acides gras. |
| Состав | Сложные эфиры сахарозы и 1,2 или 3 молекул пищевых жирных кислот |
| Структурная формула |  Моноэфиры: X", X" e Н, X"" - остаток жирной кислоты Диэфиры: X", X"" - остатки жирной кислоты, X" » Н Триэфиры: X", X", X"" - остатки жирной кислоты |
| Органолептические свойства | Прочные гели, мягкие кусочки или порошки от белого до сероватого цвета с маслянистым сладковато-горьким вкусом. |
| Физико-химические свойства | Имеют широкую область плавления. Раств. в тёплых спиртах, гликолях, других орг. растворителях; плохо раств. в воде. Устойчивость к гидролизу достаточная, термостойкость соответствует содержанию сахара. |
| Получение | Переэтерификацией сахарозой метиловых и этиловых эфиров жирных кислот или экстракцией из реакционной смеси «сахаро-глицеридов». Для экстракции используются диметилформамид, диметилсульфоксид, этилацетат, изопропанол, пропиленгликоль, изобутанол, метилэтилкетон. Примеси: остатки растворителей, продукты расщепления сахара. |
| Спецификации |  |
| Метаболизм и токсичность | В организме медленно расщепляются ферментами на жирные кислоты и сахар. |
| Гигиенические нормы | ДСП 10 мг/кг веса тела в день. Codex: разрешены в качестве эмульгатора в маргаринах в количестве до 10 г/кг и в сухих какао-продуктах до 10 г/кг индивидуально или в сочетании с другими эмульгаторами (общее содержание эмульгаторов не более 15 г/кг). В РФ разрешены в качестве эмульгаторов в супы и бульоны консервированные, концентрированные в количестве до 2 г/кг; в сливки стерилизованные, напитки на молочной основе, аналоги сливок, мороженое (кроме молочного и сливочного), фруктовый лёд, сахаристые кондитерские изделия, десерты, напитки безалкогольные на основе кокосового ореха, миндаля, аниса, спиртные напитки за исключением вина и пива, диетические смеси (продукты), в том числе для снижения массы тела в количестве до 5 г/кг; в мясные продукты, обработанные теплом, в количестве до 5 г/кг в пересчёте на жир; в жировые эмульсии для хлебобулочных и мучных кондитерских изделий, в сдобные хлебобулочные и мучные кондитерские изделия, жевательную резинку, порошки для приготовления горячих напитков, соусы в количестве до 10 г/кг; в забеливатели для напитков в количестве до 20 г/кг; в свежие плоды, поверхностная обработка, в биологически активные добавки к пище в количестве согласно ТИ индивидуально или в комбинации с сахароглицеридами (п. 3.6.43 СанПиН 2.3.2.1293-03). |
| Применение | Эфиры сахарозы и жирных кислот состоят из обычных пищевых компонентов: сахара и жира или жирных кислот и были бы идеальными пищевыми эмульгаторами с величинами ГЛБ от 3 до 16, если бы не два недостатка: Процесс их получения очень сложен, необходима дорогостоящая очистка от побочных продуктов, катализаторов и растворителей, что сильно удорожает продукт; Моноэфиры сахарозы и жирных кислот сильно снижают поверхностное натяжение на границе фаз масло-вода, являются хорошими эмульгаторами систем «масло в воде». Ди- и триэфиры сахарозы и жирных кислот менее гидрофильны и не растворяются ни в воде, ни в жире. Эфиры сахарозы и жирных кислот хор. проявляют себя в составе хлебопекарных улучшителей как неионогенные поверхностно-активные в-ва. Их можно применять в качестве соэмульгаторов для стабилизации активной формы моноглицеридов при их использовании в различных областях. Эфиры сахарозы используются в качестве компонента воскожировых составов для покрытий, в т.ч. для свежих фруктов. Другие области применения: в технических эмульсиях, кремах и пастах. |
10.5. Сложные эфиры. Жиры
Сложные эфиры
–
функциональные производные карбоновых кислот,
в молекулах которых гидроксильная группа (-ОН) замещена на остаток спирта (-
OR
)
Сложные эфиры карбоновых кислот – соединения с общей формулой.
R–COOR" , где R и R" – углеводородные радикалы.
Сложные эфиры предельных одноосновных карбоновых кислот имеют общую формулу:

Физические свойства:
· Летучие, бесцветные жидкости
· Плохо растворимы в воде
· Чаще с приятным запахом
· Легче воды
Сложные
эфиры содержатся в цветах, фруктах, ягодах. Они определяют их специфический
запах.
Являются составной частью эфирных масел (известно около 3000 эф.м. –
апельсиновое, лавандовое, розовое и т. д.)
Эфиры низших карбоновых кислот и низших одноатомных спиртов имеют приятный запах цветов, ягод и фруктов. Эфиры высших одноосновных кислот и высших одноатомных спиртов – основа природных восков. Например, пчелиный воск содержит сложный эфир пальмитиновой кислоты и мирицилового спирта (мирицилпальмитат):
CH 3 (CH 2) 14 –CO–O–(CH 2) 29 CH 3
Аромат. Структурная формула. |
Название сложного эфира |
Яблоко
|
Этиловый эфир 2-метилбутановой кислоты |
Вишня
|
Амиловый эфир муравьиной кислоты |
Груша
|
Изоамиловый эфир уксусной кислоты |
Ананас |
Этиловый эфир масляной кислоты (этилбутират) |
Банан |
Изобутиловый эфир уксусной кислоты (у изоамилацетата так же напоминает запах банана) |
Жасмин
|
Бензиловый эфир уксусной (бензилацетат) |
Краткие названия сложных эфиров строятся по названию радикала (R") в остатке спирта и названию группы RCOO - в остатке кислоты. Например, этиловый эфир уксусной кислотыCH 3 COO C 2 H 5 называетсяэтил ацетат .

Применение
· В качестве отдушек и усилителей запаха в пищевой и парфюмерной (изготовление мыла, духов, кремов) промышленности;
· В производстве пластмасс, резины в качестве пластификаторов.

Пластификаторы – вещества, которые вводят в состав полимерных материалов для придания (или повышения) эластичности и (или) пластичности при переработке и эксплуатации.
Применение в медицине
В конце XIX — начале ХХ века, когда органический синтез делал свои первые шаги, было синтезировано и испытано фармакологами множество сложных эфиров. Они стали основой таких лекарственных средств, как салол, валидол и др. Как местнораздражающее и обезболивающее средство широко использовался метилсалицилат, в настоящее время практически вытесненный более эффективными средствами.
Получение сложных эфиров
Cложные эфиры могут быть получены при взаимодействии карбоновых кислот со спиртами (реакция этерификации ). Катализаторами являются минеральные кислоты.
Реакция этерификации в условиях кислотного катализа обратима. Обратный процесс – расщепление сложного эфира при действии воды с образованием карбоновой кислоты и спирта – называют гидролизом сложного эфира .
RCOOR " + H 2 O ( H +) ↔ RCOOH + R " OH
Гидролиз в присутствии щелочи протекает необратимо (т.к. образующийся отрицательно заряженный карбоксилат-анион RCOO – не вступает в реакцию с нуклеофильным реагентом – спиртом).
Эта реакция называется омылением сложных эфиров (по аналогии со щелочным гидролизом сложноэфирных связей в жирах при получении мыла).
Жиры, их строение, свойства и применение
«Химия везде, химия во всем:
Во всем, чем мы дышим,
Во всем, что мы пьем,
Во всем, что едим».
Во всем, что мы носим,



Люди давно научились выделять жир из натуральных объектов и использовать его в повседневной жизни. Жир сгорал в примитивных светильниках, освещая пещеры первобытных людей, жиром смазывали полозья, по которым спускали на воду суда. Жиры – основной источник нашего питания. Но неправильное питание, малоподвижный образ жизни приводит к избыточному весу. Животные пустынь запасают жир как источник энергии и воды. Толстый жировой слой тюленей и китов помогает им плавать в холодных водах Северного Ледовитого океана.
Жиры широко распространены в природе. Наряду с углеводами и белками они входят в состав всех животных и растительных организмов и составляют одну из основных частей нашей пищи. Источниками жиров являются живые организмы. Среди животных это коровы, свиньи, овцы, куры, тюлени, киты, гуси, рыбы (акулы, тресковые, сельди). Из печени трески и акулы получают рыбий жир – лекарственное средство, из сельди – жиры, используемые для подкормки сельскохозяйственных животных. Растительные жиры чаще всего бывают жидкими, их называют маслами. Применяются жиры таких растений, как хлопок, лен, соя, арахис, кунжут, рапс, подсолнечник, горчица, кукуруза, мак, конопля, кокос, облепиха, шиповник, масличная пальма и многих других.

Жиры выполняют различные функции: строительную, энергетическую (1 г жира дает 9 ккал энергии), защитную, запасающую. Жиры обеспечивают 50% энергии, требуемой человеку, поэтому человеку необходимо потреблять 70–80 г жиров в день. Жиры составляют 10–20% от массы тела здорового человека. Жиры являются незаменимым источником жирных кислот. Некоторые жиры содержат витамины А, D, Е, К, гормоны.
Многие животные и человек используют жир в качестве теплоизолирующей оболочки, например, у некоторых морских животных толщина жирового слоя достигает метра. Кроме того, в организме жиры являются растворителями вкусовых веществ и красителей. Многие витамины, например витамин А, растворяются только в жирах.
Некоторые животные (чаще водоплавающие птицы) используют жиры для смазки своих собственных мышечных волокон.
Жиры повышают эффект насыщения пищевыми продуктами, т. к. они перевариваются очень медленно и задерживают наступление чувства голода.
История открытия жиров
Еще в 17 в. немецкий ученый, один из первых химиков-аналитиков Отто Тахений (1652–1699) впервые высказал предположение, что жиры содержат «скрытую кислоту».
В 1741 французский химик Клод Жозеф Жоффруа (1685–1752) обнаружил, что при разложении кислотой мыла (которое готовили варкой жира со щелочью) образуется жирная на ощупь масса.
То, что в состав жиров и масел входит глицерин, впервые выяснил в 1779 знаменитый шведский химик Карл Вильгельм Шееле.
Впервые химический состав жиров определил в начале прошлого века французский химикМишель Эжен Шеврёль , основоположник химии жиров, автор многочисленных исследований их природы, обобщенных в шеститомной монографии "Химические исследования тел животного происхождения".
1813 г Э. Шеврёль установил строение жиров, благодаря реакции гидролиза жиров в щелочной среде.Он показал, что жиры состоят из глицерина и жирных кислот, причем это не просто их смесь, а соединение, которое, присоединяя воду, распадается на глицерин и кислоты.
Синтез жиров

В 1854 французский химик Марселен Бертло (1827–1907) провел реакцию этерификации, то есть образования сложного эфира между глицерином и жирными кислотами и таким образом впервые синтезировал жир.

Общая формула жиров (триглицеридов)

Жиры
–
сложные эфиры глицерина и высших карбоновых кислот.
Общее название таких
соединений – триглицериды.
Классификация жиров



Животные жиры содержат главным образом глицериды предельных кислот и являются твердыми веществами. Растительные жиры, часто называемые маслами, содержат глицериды непредельных карбоновых кислот. Это, например, жидкие подсолнечное, конопляное и льняное масла.

Природные жиры содержат следующие жирные кислоты
Насыщенные: стеариновая (C 17 H 35 COOH) пальмитиновая (C 15 H 31 COOH) Масляная (C 3 H 7 COOH) |
В СОСТАВЕ ЖИВОТНЫХ ЖИРОВ |
Ненасыщенные : олеиновая (C 17 H 33 COOH, 1 двойная связь) линолевая (C 17 H 31 COOH, 2 двойные связи) линоленовая (C 17 H 29 COOH, 3 двойные связи) арахидоновая (C 19 H 31 COOH, 4 двойные связи, реже встречается) |
В СОСТАВЕ РАСТИТЕЛЬНЫХ ЖИРОВ |
Жиры содержатся во всех растениях и животных. Они представляют собой смеси полных сложных эфиров глицерина и не имеют чётко выраженной температуры плавления.
· Животные жиры (бараний, свиной, говяжий и т.п.), как правило, являются твердыми веществами с невысокой температурой плавления (исключение – рыбий жир). В твёрдых жирах преобладают остатки насыщенных кислот.
· Растительные жиры – масла (подсолнечное, соевое, хлопковое и др.) – жидкости (исключение – кокосовое масло, масло какао-бобов). Масла содержат в основном остатки ненасыщенных (непредельных) кислот.
Химические свойства жиров
1. Гидролиз, или омыление , жиров происходит под действием воды, с участием ферментов или кислотных катализаторов (обратимо) , при этом образуются спирт - глицерин и смесь карбоновых кислот:

или щелочей (необратимо) . При щелочном гидролизе образуются соли высших жирных кислот, называемые мылами. Мыла получаются при гидролизе жиров в присутствии щелочей:

Мыла — это калиевые и натриевые соли высших карбоновых кислот.
2.Гидрирование жиров – превращение жидких растительных масел в твердые жиры – имеет большое значение для пищевых целей. Продукт гидрогенизации масел – твердый жир (искусственное сало, саломас ). Маргарин – пищевой жир, состоит из смеси гидрогенизированных масел (подсолнечного, кукурузного, хлопкого и др.), животных жиров, молока и вкусовых добавок (соли, сахара, витаминов и др.).
Так в промышленности получают маргарин:

В условиях процесса гидрогенизации масел (высокая температура, металлический катализатор) происходит изомеризация части кислотных остатков, содержащих цис-связи С=С, в более устойчивые транс-изомеры. Повышенное содержание в маргарине (особенно, в дешевых сортах) остатков транс-ненасыщенных кислот увеличивает опасность атеросклероза, сердечно-сосудистых и других заболеваний.

Реакция получения жиров (этерификация)

Применение жиров


Жиры - продукт питания. Биологическая роль жиров
Животные жиры и растительные масла, наряду с белками и углеводами – одна из главных составляющих нормального питания человека. Они являются основным источником энергии: 1 г жира при полном окислении (оно идет в клетках с участием кислорода) дает 9,5 ккал (около 40 кДж) энергии, что почти вдвое больше, чем можно получить из белков или углеводов. Кроме того, жировые запасы в организме практически не содержат воду, тогда как молекулы белков и углеводов всегда окружены молекулами воды. В результате один грамм жира дает почти в 6 раз больше энергии, чем один грамм животного крахмала – гликогена. Таким образом, жир по праву следует считать высококалорийным «топливом». В основном оно расходуется для поддержания нормальной температуры человеческого тела, а также на работу различных мышц, поэтому даже когда человек ничего не делает (например, спит), ему каждый час требуется на покрытие энергетических расходов около 350 кДж энергии, примерно такую мощность имеет электрическая 100-ваттная лампочка .
Для обеспечения организма энергией в неблагоприятных условиях в нем создаются жировые запасы, которые откладываются в подкожной клетчатке, в жировой складке брюшины – так называемом сальнике. Подкожный жир предохраняет организм от переохлаждения (особенно эта функция жиров важна для морских животных). В течение тысячелетий люди выполняли тяжелую физическую работу, которая требовала больших затрат энергии и соответственно усиленного питания. Для покрытия минимальной суточной потребности человека в энергии достаточно всего 50 г жира. Однако при умеренной физической нагрузке взрослый человек должен получать с продуктами питания несколько больше жиров, но их количество не должно превышать 100 г (это дает треть калорийности при диете, составляющей около 3000 ккал). Следует отметить, что половина из этих 100 г содержится в продуктах питания в виде так называемого скрытого жира. Жиры содержатся почти во всех пищевых продуктах: в небольшом количестве они есть даже в картофеле (там их 0,4%), в хлебе (1–2%), в овсяной крупе (6%). В молоке обычно содержится 2–3% жира (но есть и специальные сорта обезжиренного молока). Довольно много скрытого жира в постном мясе – от 2 до 33%. Скрытый жир присутствует в продукте в виде отдельных мельчайших частиц. Жиры почти в чистом виде – это сало и растительное масло; в сливочном масле около 80% жира, в топленом – 98%. Конечно, все приведенные рекомендации по потреблению жиров – усредненные, они зависят от пола и возраста, физической нагрузки и климатических условий. При неумеренном потреблении жиров человек быстро набирает вес, однако не следует забывать, что жиры в организме могут синтезироваться и из других продуктов. «Отрабатывать» лишние калории путем физической нагрузки не так-то просто. Например, пробежав трусцой 7 км, человек тратит примерно столько же энергии, сколько он получает, съев всего лишь одну стограммовую плитку шоколада (35% жира, 55% углеводов) .Физиологи установили, что при физической нагрузке, которая в 10 раз превышала привычную, человек, получавший жировую диету, полностью выдыхался через 1,5 часа. При углеводной же диете человек выдерживал такую же нагрузку в течение 4 часов. Объясняется этот на первый взгляд парадоксальный результат особенностями биохимических процессов. Несмотря на высокую «энергоемкость» жиров, получение из них энергии в организме – процесс медленный. Это связано с малой реакционной способностью жиров, особенно их углеводородных цепей. Углеводы, хотя и дают меньше энергии, чем жиры, «выделяют» ее намного быстрее. Поэтому перед физической нагрузкой предпочтительнее съесть сладкое, а не жирное.Избыток в пище жиров, особенно животных, увеличивает и риск развития таких заболеваний как атеросклероз, сердечная недостаточность и др. В животных жирах много холестерина (но не следует забывать, что две трети холестерина синтезируется в организме из нежировых продуктов – углеводов и белков).
Известно, что значительную долю потребляемого жира должны составлять растительные масла, которые содержат очень важные для организма соединения – полиненасыщенные жирные кислоты с несколькими двойными связями. Эти кислоты получили название «незаменимых». Как и витамины, они должны поступать в организм в готовом виде. Из них наибольшей активностью обладает арахидоновая кислота (она синтезируется в организме из линолевой), наименьшей – линоленовая (в 10 раз ниже линолевой). По разным оценкам суточная потребность человека в линолевой кислоте составляет от 4 до 10 г. Больше всего линолевой кислоты (до 84%) в сафлоровом масле, выжимаемом из семян сафлора – однолетнего растения с ярко-оранжевыми цветками. Много этой кислоты также в подсолнечном и ореховом масле.
По мнению диетологов, в сбалансированном рационе должно быть 10% полиненасыщенных кислот, 60% мононенасыщенных (в основном это олеиновая кислота) и 30% насыщенных. Именно такое соотношение обеспечивается, если треть жиров человек получает в виде жидких растительных масел – в количестве 30–35 г в сутки. Эти масла входят также в состав маргарина, который содержит от 15 до 22% насыщенных жирных кислот, от 27 до 49% ненасыщенных и от 30 до 54% полиненасыщенных. Для сравнения: в сливочном масле содержится 45–50% насыщенных жирных кислот, 22–27% ненасыщенных и менее 1% полиненасыщенных. В этом отношении высококачественный маргарин полезнее сливочного масла.
Необходимо помнить!!!
Насыщенные жирные кислоты отрицательно влияют на жировой обмен, работу печени и способствуют развитию атеросклероза. Ненасыщенные (особенно линолевая и арахидоновая кислоты) регулируют жировой обмен и участвуют в выведении холестерина из организма. Чем выше содержание ненасыщенных жирных кислот, тем ниже температура плавления жира. Калорийность твердых животных и жидких растительных жиров примерно одинакова, однако физиологическая ценность растительных жиров намного выше. Более ценными качествами обладает жир молока. Он содержит одну треть ненасыщенных жирных кислот и, сохраняясь в виде эмульсии, легко усваивается организмом. Несмотря на эти положительные качества, нельзя употреблять только молочный жир, так как никакой жир не содержит идеального состава жирных кислот. Лучше всего употреблять жиры как животного, так и растительного происхождения. Соотношение их должно быть 1:2,3 (70% животного и 30% растительного) для молодых людей и лиц среднего возраста. В рационе питания пожилых людей должны преобладать растительные жиры.
Жиры не только участвуют в обменных процессах, но и откладываются про запас (преимущественно в брюшной стенке и вокруг почек). Запасы жира обеспечивают обменные процессы, сохраняя для жизни белки. Этот жир обеспечивает энергию при физической нагрузке, если с пищей жира поступило мало, а также при тяжелых заболеваниях, когда из-за пониженного аппетита его недостаточно поступает с пищей.
Обильное потребление с пищей жира вредно для здоровья: он в большом количестве откладывается про запас, что увеличивает массу тела, приводя порой к обезображиванию фигуры. Увеличивается его концентрация в крови, что, как фактор риска, способствует развитию атеросклероза, ишемической болезни сердца, гипертонической болезни и др.
УПРАЖНЕНИЯ
1. Имеется 148 г смеси двух органических соединений одинакового состава С 3 Н 6 О 2 . Определите строение этих соединений и их массовые доли в смеси, если известно, что одно из них при взаимодействии с избытком гидрокарбоната натрия выделяет 22,4 л (н.у.) оксида углерода ( IV ), а другое не реагирует с карбонатом натрия и аммиачным раствором оксида серебра, но при нагревании с водным раствором гидроксида натрия образует спирт и соль кислоты.
Решение:
Известно, что оксид углерода (IV ) выделяется при взаимодействии карбоната натрия с кислотой. Кислота состава С 3 Н 6 О 2 может быть только одна — пропионовая, СН 3 СН 2 СООН.
С 2 Н 5 СООН + N аНСО 3 → C 2 H 5 COONa + CO 2 + Н 2 О.
По условию, выделилось 22,4 л СО 2 , что составляет 1 моль, значит кислоты в смеси также было 1 моль. Молярная масса исходных органических соединений равна: M (С 3 Н 6 О 2) = 74 г/моль, следовательно 148 г составляют 2 моль.
Второе соединение при гидролизе образует спирт и соль кислоты, значит это — сложный эфир:
RCOOR‘ + NaOH → RCOONa + R‘OH.
Составу С 3 Н 6 О 2 отвечают два сложных эфира: этилформиат НСООС 2 Н 5 и метилацетат СН 3 СООСН 3 . Эфиры муравьиной кислоты реагируют с аммиачным раствором оксида серебра, поэтому первый эфир не удовлетворяет условию задачи. Следовательно, второе вещество в смеси — метилацетат.
Поскольку в смеси было по одному молю соединений с одинаковой молярной массой, то их массовые доли равны и составляют 50%.
Ответ. 50% СН 3 СН 2 СООН, 50% СН 3 СООСН 3 .
2. Относительная плотность паров сложного эфира по водороду равна 44. При гидролизе этого эфира образуются двасоединения, при сгорании равных количеств которых образуются одинаковые объемы углекислого газа (при одинаковых условиях).Приведите структурную формулу этого эфира.
Решение:
Общая формула сложных эфиров, образованных предельными спиртами и кислотами, — С n Н 2 n О 2 . Значение n можно определить из плотности по водороду:
M (С n Н 2 n О 2) = 14 n + 32 = 44 . 2 = 88 г/моль,
откуда n = 4, то есть эфир содержит 4 атома углерода. Поскольку при сгорании спирта и кислоты, образующихся при гидролизе эфира, выделяются равные объемы углекислого газа, то кислота и спирт содержат одинаковое число атомов углерода, по два. Таким образом, искомый эфир образован уксусной кислотой и этанолом и называется этилацетат:
СН 3 — |
О-С 2 Н 5 |
Ответ. Этилацетат, СН 3 СООС 2 Н 5 .
________________________________________________________________
3. При гидролизе сложного эфира, молярная масса которого равна 130 г/моль, образуются кислота А и спирт Б. Определите строение эфира, если известно, что серебряная соль кислоты содержит 59,66% серебра по массе. Спирт Б не окисляется дихроматом натрия и легко реагирует с хлороводородной кислотой с образованием алкилхлорида.
Решение:
Сложный эфир имеет общую формулу RCOOR ‘. Известно, что серебряная соль кислоты, RCOOAg , содержит 59,66%серебра, следовательно молярная масса соли равна: M (RCOOAg ) = M (А g )/0,5966 = 181 г/моль, откуда M (R ) = 181-(12+2 . 16+108) = 29 г/моль. Этот радикал — этил, С 2 Н 5 , а сложный эфир был образован пропионовой кислотой: C 2 H 5 COOR ‘.
Молярная масса второго радикала равна: M (R ‘) = M (C 2 H 5 COOR ‘) — М(С 2 Н 5 СОО) = 130-73 = 57 г/моль. Этот радикал имеет молекулярную формулу С 4 Н 9 . По условию, спирт С 4 Н 9 ОН не окисляется Na 2 С r 2 О 7 и легко реагирует с HCl следовательно, этот спирт — третичный, (СН 3) 3 СОН.
Таким образом, искомый эфир образован пропионовой кислотой и трет-бутанолом и называется трет-бутилпропионат:
CH 3 |
||
C 2 H 5 — |
C — O — |
C — CH 3 |
CH 3 |
Ответ . Трет-бутилпропионат.
________________________________________________________________
4. Напишите две возможные формулы жира, имеющего в молекуле 57 атомов углерода и вступающего в реакцию с иодом в соотношении 1:2. В составе жира имеются остатки кислот с четным числом углеродных атомов.
Решение:
Общая формула жиров:
где R, R’, R " — углеводородные радикалы, содержащие нечетное число атомов углерода (еще один атом из кислотного остатка входит в состав группы -СО-). На долю трех углеводородных радикалов приходится 57- 6 = 51 атом углерода. Можно предположить, что каждый из радикалов содержит по 17 атомов углерода.
Поскольку одна молекула жира может присоединить две молекулы иода, то на три радикала приходится две двойные связи или одна тройная. Если две двойные связи находятся в одном радикале, то в состав жира входят остаток линолевой кислоты (R = С 17 Н 31) и два остатка стеариновой кислоты (R ‘ = R " = С 17 Н 35). Если две двойные связи находятся в разных радикалах, то в состав жира входят два остатка олеиновой кислоты (R = R ‘ = С 17 H 33 ) и остаток стеариновой кислоты (R " = С 17 Н 35). Возможные формулы жира:
|
|
________________________________________________________________


5.

ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1. Что такое реакция этерификации.
2. Какое различие существует в строении твердых и жидких жиров.
3. Каковы химические свойства жиров.
4. Приведите уравнение реакции получения метилформиата.
5. Напишите структурные формулы двух сложных эфиров и кислоты, имеющих состав С 3 Н 6 О 2 . Назовите эти вещества по международной номенклатуре.
6. Напишите уравнения реакций этерификации между: а) уксусной кислотой и 3-метилбутанолом-1; б) масляной кислотой и пропанолом-1. Назовите эфиры.
7. Сколько граммов жира было взято, если для гидрирования образовавшейся в результате его гидролиза кислоты потребовалось 13,44 л водорода (н.у.).
8. Рассчитайте массовую долю выхода сложного эфира, образующегося при нагревании в присутствии концентрированной серной кислоты 32 г уксусной кислоты и 50 г пропанола-2, если при этом образовалось 24 г эфира.
9. Для гидролиза образца жира массой 221 г понадобилось 150 г раствора гидроксида натрия с массовой долей щелочи 0,2. Предложите структурную формулу исходного жира.
10. Вычислите объем раствора гидроксида калия с массовой долей щелочи 0,25 и плотностью 1,23 г/см 3 , который нужно затратить для проведения гидролза 15 г смеси, состоящей из этилового эфира этановой кислоты, пропилового эфира метановой кислоты и метилового эфира пропановой кислоты.
ВИДЕО ОПЫТ
1. Какая реакция лежит в основе получения сложных эфиров: |
|
а) нейтрализации |
б) полимеризации |
в) этерификации |
г) гидрирования |
2. Сколько изомерных сложных эфиров отвечает формуле С 4 Н 8 О 2: |
|
а) 2 |
|
Размер: px
Начинать показ со страницы:
Транскрипт
1 Жиры. Жиры сложные эфиры глицерина и высших одноосновных карбоновых кислот (так называемых ЖИРНЫХ кислот). Общее название таких соединений триглицериды или триацилглицерины, где ацил остаток карбоновой кислоты - С= О R Жирные кислоты. Предельные кислоты: 1. Масляная кислота С 3 Н 7 -СООН 2. Пальмитиновая кислота С 15 Н 31 - СООН 3. Стеариновая кислота С 17 Н 35 - СООН Физические свойства. Непредельные кислоты: 5. Олеиновая кислота С 17 Н 33 СООН (1 = связь) СН 3 (СН 2) 7 СН = СН (СН 2) 7 СООН 6. Линолевая кислота С 17 Н 31 СООН (2 = связи) СН 3 -(СН 2) 4 -СН = СН-СН 2 -СН = СН-СООН 7. Линоленовая кислота С 17 Н 29 СООН (3 = связи) СН 3 СН 2 СН = CHCH 2 CH = CHCH 2 CH=СН(СН 2) 4 СООН Животные жиры Растительные жиры (масла) Твѐрдые, образованы Жидкие, образованы предельными кислотами непредельными кислотами стеариновой и пальмитиновой. олеиновой, линолевой и другими. Жиры растворимы в органических растворителях и нерастворимы в воде.
2 ХИМИЧЕСКИЕ СВОЙСТВА. 1. Гидролиз (омыление) жиров в кислой или в щелочной среде, или под действием ферментов: а) кислотный гидролиз: под действием кислоты жиры гидролизуются до глицерина и карбоновых кислот, которых входили в молекулу жира. б) щелочной гидролиз омыление. Получается глицерин и СОЛИ карбоновых кислот, входивших в состав жира. Кислотный гидролиз Щелочной гидролиз В щелочной среде образуются МЫЛА соли высших жирных кислот (натриевые твѐрдые, калиевые жидкие). 2. Гидрирование (гидрогенизация) процесс присоединения водорода к остаткам непредельных кислот, входящих в состав жира. При этом остатки непредельных кислот переходят в остатки предельных, жидкие растительные жиры превращаются в твѐрдые (маргарин).
3 Количественной характеристикой степени ненасыщенности жиров служит йодное число, показывающее сколько г йода может присоединиться по двойным связям к 100 г жира. Синтетические моющие средства. Обычное мыло плохо стирает в жѐсткой воде и совсем не стирает в морской воде, так как содержащие в ней ионы кальция и магния дают с высшими кислотами нерастворимые в воде соли: С 17 Н 35 COONa + CaSO 4 (С 17 Н 35 COO) 2 Ca + Na 2 SO 4 Поэтому наряду с мылом из синтетических кислот производят синтетические моющие средства из других видов сырья, например из алкилсульфатов солей сложных эфиров высших спиртов и серной кислоты. В общем виде образование таких солей можно изобразить уравнениями: R-CH 2 -OH + H 2 SO 4 R-CH 2 -O-SO 2 -OH + H 2 O спирт серная кислота алкилсерная кислота R-CH 2 -O-SO 2 -OH + NaOH R-CH 2 -O-SO 2 -ONa + H 2 O алкилсульфат Эти соли содержат в молекуле от 12 до 14 углеродных атомов и обладают очень хорошими моющими свойствами. Кальциевые и магниевые соли растворимы в воде, а потому такие мыла моют и в жесткой воде. Алкилсульфаты содержатся во многих стиральных порошках. УГЛЕВОДЫ Углеводы (сахара) органические соединения, имеющие сходное строение и свойства, состав большинства которых отражает формула C x (H 2 O) y, где x, y 3. Исключение составляет дезоксирибоза, которая имеют формулу С 5 Н 10 O 4. НЕКОТОРЫЕ ВАЖНЕЙШИЕ УГЛЕВОДЫ Моносахариды Олигосахариды Полисахариды Глюкоза С 6 Н 12 О 6 Фруктоза С 6 Н 12 О 6 Рибоза С 5 Н 10 О 5 Дезоксирибоза С 5 Н 10 О 4 Сахароза (дисахарид) С 12 Н 22 О 11 Лактоза молочный сахар (дисахарид) С 12 Н 22 О 11 Целлюлоза (С 6 Н 10 О 5) n Крахмал (С 6 Н 10 О 5) n Гликоген (С 6 Н 10 О 5) n
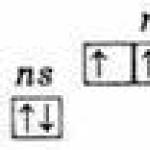
4 Моносахариды Моносахариды гетерофункциональные соединения, в состав их молекул входит одна карбонильная группа (альдегидная или кетонная) и несколько гидроксильных. ГЛЮКОЗА. Получение. 1. Гидролиз крахмала: (C 6 H 10 O 5)n + H 2 O C 6 H 12 O 6 2. Синтез из формальдегида: 6Н 2 С=О Са(ОН) 2 С 6 Н 12 О 6 Реакция была впервые изучена А. М. Бутлеровым. 3.В растениях углеводы образуются в результате реакции фотосинтеза из CO 2 и Н 2 О: 6CO H 2 O (хлорофилл, свет) C 6 H 12 O 6 + 6O 2 Химические свойства глюкозы. 1. В водном растворе глюкозы существует динамическое равновесие между двумя циклическими формами - α и β и линейной формой:

5 2. Реакция комплексообразования с гидроксидом меди (II). При взаимодействии свежеосажденного гидроксида меди (II) с моносахаридами происходит растворение гидроксида с образованием комплекса синего цвета. 3. Глюкоза как альдегид. а) реакция серебряного зеркала. б) реакция с гидроксидом меди (II) при нагревании. в) Глюкозу можно окислить бромной водой: г) Каталитическое гидрирование глюкозы - происходит восстановление карбонильной группы до спиртового гидроксила, получается шестиатомный спирт сорбит. 4. Реакции брожения. а) спиртовое брожение C 6 H 12 O 6 2C 2 H 5 OH + 2CO 2 этанол б) молочнокислое брожение C 6 H 12 O 6 2CH 3 -CH(OH)-COOH молочная кислота

6 в) маслянокислое брожение C 6 H 12 O 6 C 3 H 7 COOH + 2CO 2 + 2H 2 O масляная кислота 5. Реакции образования эфиров глюкозы. Глюкоза способна образовывать простые и сложные эфиры. Наиболее легко происходит замещение полуацетального (гликозидного) гидроксила: Простые эфиры получили название гликозидов. В более жестких условиях (например, с CH 3 -I) возможно алкилирование и по другим оставшимся гидроксильным группам. Моносахариды способны образовывать сложные эфиры как с минеральными, так и с карбоновыми кислотами, например: Фруктоза структурный изомер глюкозы - кетоноспирт: СН 2 - СН- СН- СН - С - СН 2 OH OH OH OH O OH Кристаллическое вещество, хорошо растворимое в воде, более сладкое, чем глюкоза. В свободном виде содержится в мѐде и фруктах. Химические свойства фруктозы обусловлены наличием кетонной и пяти гидроксильных групп. При гидрировании фруктозы также получается СОРБИТ.
7 Дисахариды. Дисахариды это углеводы, молекулы которых состоят из двух остатков моносахаридов, соединенных друг с другом за счет взаимодействия гидроксильных групп (двух полуацетальных или одной полуацетальной и одной спиртовой). 1. Сахароза (свекловичный или тростниковый сахар) С 12 Н 22 О 11 Молекула сахарозы состоит из остатков α-глюкозы и β- фруктозы, соединенных друг с другом. В молекуле сахарозы гликозидный атом углерода глюкозы СВЯЗАН, поэтому она не образует ОТКЫТУЮ (альдегидную) форму. Вследствие этого сахароза не вступает в реакции альдегидной группы с аммиачным раствором оксида серебра с гидроксидом меди при нагревании. Подобные дисахариды называют невосстанавливающими, т.е. не способными окисляться. Сахароза подвергается гидролизу подкисленной водой: С 12 Н 22 О 11 + Н 2 О С 6 Н 12 О 6 (глюкоза) + С 6 Н 12 О 6 (фруктоза) 2. Мальтоза. Это дисахарид, состоящий из двух остатков α-глюкозы, она является промежуточным веществом при гидролизе крахмала. остаток α-глюкозы остаток α-глюкозы

8 Мальтоза - является восстанавливающим дисахаридом и вступает в реакции, характерные для альдегидов. 3. К восстанавливающим сахаром относятся также целлобиоза и лактоза: Остальные дисахариды так же могут гидролизоваться. Полисахариды. Полисахариды - это природные высокомолекулярные углеводы, макромолекулы которых состоят из остатков моносахаридов. Основные представители - крахмал и целлюлоза - построены из остатков одного моносахарида - глюкозы. Крахмал и целлюлоза имеют одинаковую молекулярную формулу: (C 6 H 10 O 5) n, но совершенно различные свойства. Это объясняется особенностями их пространственного строения. Крахмал состоит из остатков α-глюкозы, а целлюлоза из β-глюкозы, которые являются пространственными изомерами и отличаются лишь положением одной гидроксильной группы (выделена цветом):

9 Крахмал. Крахмалом называется смесь двух полисахаридов, построенных из остатков циклической α-глюкозы. В его состав входят: амилоза (внутренняя часть крахмального зерна) 10-20% амилопектин (оболочка крахмального зерна) 80-90% Цепь амилозы включает остатков α-глюкозы (средняя мол.масса) и имеет неразветвленное строение. Макромолекула амилозы представляет собой спираль, каждый виток которой состоит из 6 звеньев α- глюкозы. Свойства крахмала: 1. Гидролиз крахмала: при кипячении в кислой среде крахмал последовательно гидролизуется. 2. Крахмал не дает реакцию серебряного зеркала и не восстанавливает гидроксид меди (II). 3. Качественная реакция на крахмал: синее окрашивание с раствором йода.

10 ЦЕЛЛЮЛОЗА Целлюлоза (клетчатка) наиболее распространенный растительный полисахарид. Цепи целлюлозы построены из остатков β-глюкозы и имеют линейное строение. Молекулярная масса целлюлозы - от до 2 млн. СВОЙСТВА ЦЕЛЛЮЛОЗЫ. 1. Образование сложных эфиров с азотной и уксусной кислотами. а) нитрование целлюлозы. Так как в звене целлюлозы содержится 3 гидроксильные группы, то при нитровании избытком азотной кислоты возможно образование тринитрата целлюлозы, взрывчатого вещества пироксилина: (С 6 Н 7 О 2 (ОН) 3) n + 3n HNO 3 3nH 2 O + (С 6 Н 7 О 2 (ОNO 2) 3) n целлюлоза азотная кислота тринитрат целлюлозы (пироксилин) б) ацилирование целлюлозы. При действии на целлюлозу уксусного ангидрида происходит реакция этерификации, при этом возможно участие в реакции 1, 2 и 3 групп ОН. Получается ацетат целлюлозы - ацетатное волокно. (С 6 Н 7 О 2 (ОН) 3) n +3n(СН 3 СО) 2 О 3n СН 3 -СООН + (С 6 Н 7 О 2 (ОСОСН 3) 3) n целлюлоза уксусный ангидрид уксусная кислота триацетат целлюлозы 2. Гидролиз целлюлозы. Целлюлоза, подобно крахмалу, в кислой среде гидролизуется:
ОРГАНИЧЕСКАЯ ХИМИЯ РАЗДЕЛ 3. ЭЛЕМЕНТЫ БИООРГАНИЧЕСКОЙ ХИМИИ ТЕМА 6. УГЛЕВОДЫ (САХАРА) 6.2. ДИ- И ПОЛИСАХАРИДЫ ОЛИГОСАХАРИДЫ Олигосахариды (греч. несколько) углеводы, гидролизующиеся с образованием нескольких
БГПУ им. М. Танка Лекция по прикладной химии Мыла и моющие средства Доцент Козлова-Козыревская А.Л., кафедра химии Содержание: История Достижения ученых Мыла. получение Омыление Производство Образование
Задания В8 по химии 1. Метиламин может взаимодействовать с 1) пропаном 2) хлорметаном 3) кислородом 4) гидроксидом натрия 5) хлоридом калия 6) серной кислотой Метиламин - первичный амин. За счет неподеленной
ЦИКЛИЧЕСКИЕ ФОРМЫ МОНОСАХАРИДОВ. МУТАРОТАЦИЯ Основной формой существования углеводов в растворах является, как неожиданно оказалось, циклическая. Циклическая форма углеводов появляется в результате внутримолекулярной
Тема а Колво часов Тип а Элементы содержания Эксперимент Вид контроля Возможное домашнее задание Примечание п/п 1 Предмет органической химии 1 Изучение нового материала. 2 Основные положения теории строения
1. Взаимные превращения веществ основных классов неорганических соединений В зависимости от того, сколько различных элементов входят в состав веществ, их можно разделить на простые и сложные. Простые вещества
КАРБОНОВЫЕ КИСЛОТЫ. ЖИРЫ Карбоновыми кислотами называются производные углеводородов, в молекуле которых содержится одна или несколько карбоксильных групп CH. Общая формула карбоновых кислот: В зависимости
Вариант Нижний Новгород 1-1. Укажите число протонов, электронов и электронную конфигурацию атома кадмия. 2-2. В колбе находится азот при атмосферном давлении и температуре 298 К. До какого давления нужно
Промежуточная аттестация по химии 10-11 классы Образец А1.Сходную конфигурацию внешнего энергетического уровня имеют атомы углерода и 1) азота 2) кислорода 3) кремния 4) фосфора А2. В ряду элементов алюминий
Вариант 4 1. К какому типу солей можно отнести: а) 2 CO 3, б) FeNH 4 (SO 4) 2 12H 2 O, кристаллогидрат, в) NH 4 HSO 4? Ответ: а) 2 CO 3 основная соль, б) FeNH 4 (SO 4) 2 12H 2 O двойная
Задание 1. В какой из данных смесей можно отделить соли друг от друга, используя воду и прибор для фильтрования? а) BaSO 4 и CaCO 3 б) BaSO 4 и CaCl 2 в) BaCl 2 и Na 2 SO 4 г) BaCl 2 и Na 2 CO 3 Задание
Задания А16 по химии 1. Формальдегид не реагирует с Формальдегид это муравьиный альдегид, он же метаналь; 40%-й раствор формальдегида в воде называется формалин. По карбонильной группе идут реакции присоединения
11. Азотсодержащие органические соединения 11.1. Нитросоединения. Амины Очень важны в народном хозяйстве азотсодержащие органические вещества. Азот может входить в органические соединения в виде нитрогруппы
Задания А15 по химии 1. Свежеосаждённый гидроксид меди(ii) реагирует с 1) этиленгликолем 2) метанолом 3) диметиловым эфиром 4) пропеном Свежеосаждённый гидроксид меди (II) реагирует многоатомными спиртами
1 ПОЯСНИТЕЛЬНАЯ ЗАПИСКА Рабочая программа по химии составлена на основе Примерной программы среднего (полного) общего образования по химии (Допущено Министерством образования и науки РФ 21.02.2005). Программа
КОНТРОЛЬНАЯ РАБОТА Тема: «Одноатомные спирты» 1 1. ВСПОМНИТЕ ХИМИЧЕСКИЕ СВОЙСТВА И ПОЛУЧЕНИЕ ОДНО- АТОМНЫХ СПИРТОВ. 2. ВЫПОЛНИТЕ ПРЕДЛОЖЕННЫЕ ТЕСТЫ 22 и 23 (Выбор ВАШ) ХИМИЧЕСКИЕ СВОЙСТВА ОДНОАТОМНЫХ СПИРТОВ
0,Учебник: О.С. Габриелян, Химия 10, 2007-2010 г. Издательство Дрофа Внимание! Тренировочные работы и задания из учебника выполняются в отдельной тетради и предоставляются до экзамена на консультации Программные
Государственное бюджетное образовательное учреждение города Севастополя «Средняя общеобразовательная школа 52 имени Ф.Д.Безрукова» Рабочая программа по предмету «Химии» для 10 класса на 2016/2017 учебный
КАЛЕНДАРНО-ТЕМАТИЧЕСКОЕ ПЛАНИРОВАНИЕ ПО ХИМИИ В 10 КЛАССЕ 2009-2010 УЧЕБНЫЙ ГОД. 2 часа в неделю. Программа для общеобразовательных школ, гимназий, лицеев. Химия 8-11 класс, М.»Дрофа», 2009. Основной учебник:
Пояснительная записка Рабочая программа составлена на основании программы по химии для учащихся 10 классов общеобразовательных учреждений (авторы И.И.Новошинский, Н.С.Новошинская) без изменений. В основу
Инверсия Образование и реакции гликозидов Образование и реакции гликозидов Гликозиды продукты замещения полуацетального гидроксила в моносахаридах на алкокси-, арилокси-, алкилтио-, арилтио-, ацилокси-,
Департамент здравоохранения города Москвы Государственное бюджетное профессиональное образовательное учреждение Департамента здравоохранения города Москвы «Медицинский колледж 2» ОДОБРЕН УТВЕРЖДАЮ Методическим
Приложение к рабочей программе по химии для 10 класса Примерные оценочные и методические материалы для осуществления текущего контроля успеваемости и промежуточной аттестации учащихся 10 го класса по химии
Пояснительная записка. 10 класс. Рабочая программа по химии составлена на основе: Фундаментального ядра содержания общего образования; требований к результатам освоения основной образовательной программы
ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОГО УЧРЕЖДЕНИЕ СРЕДНЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ ГОРОДА МОСКВЫ ЭКОНОМИКО-ТЕХНОЛОГИЧЕСКИЙ КОЛЛЕДЖ 22 Профессия: 19.01.17 Повар, кондитер УЧЕБНАЯ ДИСЦИПЛИНА /
Аннотация к рабочей программе по химии в 10 классе Рабочая программа по химии 10 класса составлена на основе федерального компонента государственного образовательного стандарта, утверждённого приказом
Инструкция к заданиям # 1_30: В этих заданиях заданы вопросы и приведены четыре предполагаемых ответа, только один из которых правильный. Найдите соответствующий данному заданию номер в листе ответов,
ОРГАНИЧЕСКАЯ ХИМИЯ ТЕМА 4. КИСЛОРОДОСОДЕРЖАЩИЕ СОЕДИНЕНИЯ 4.3. КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ 4.3.3. ЛИПИДЫ ЖИРЫ Жиры это сложные эфиры, образованные трехатомным спиртом глицерином и одноосновными
Аннотация к рабочей программе по химии 9 класс. 1. Место предмета в структуре основной образовательной программы школы. Рабочая программа по химии для 9 класса реализуется в общеобразовательном классе,
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ КРАСНОДАРСКОГО КРАЯ государственное бюджетное профессиональное образовательное учреждение Краснодарского края «Краснодарский информационно-технологический техникум» Перечень
СОДЕРЖАНИЕ. ПАСПОРТ ПРОГРАММЫ УЧЕБНОЙ ДИСЦИПЛИНЫ 2. СТРУКТУРА И СОДЕРЖАНИЕ УЧЕБНОЙ ДИСЦИПЛИНЫ 3. УСЛОВИЯ РЕАЛИЗАЦИИ УЧЕБНОЙ ДИСЦИПЛИНЫ 4. КОНТРОЛЬ И ОЦЕНКА РЕЗУЛЬТАТОВ ОСВОЕНИЯ УЧЕБНОЙ ДИСЦИПЛИНЫ стр.
Муниципальное бюджетное общеобразовательное учреждение «Лицей 20» Рассмотрено на заседании МО. Рекомендовано к утверждению на педсовете. Протокол «29» августа 207 г. Утверждено на педагогическом совете.
ВАРИАНТ 1 Образовательная организация Класс (по списку) ФИО 1. Из предложенного перечня выберите два вещества, которые не имеют структурных изомеров: 1) этанол 2) уксусная кислота 3) метанол 4) пропан
Планируемые предметные результаты освоения учебного предмета В результате изучения химии на базовом уровне ученик должен знать / понимать важнейшие химические понятия: вещество, химический элемент, атом,
ХИМИЯ 0 КЛАСС Рабочая программа разработана на основе программы общеобразовательных учреждений. Химия 0- классы, базовый уровень. М.: Просвещение, 2008,автор Гара Н.Н. Программа рассчитана (I вариант)
Окислительно-восстановительные реакции с участием органических веществ Рассмотрим наиболее типичные реакции окисления различных классов органических веществ. При этом будем иметь в виду, что реакция горения
Экз. билета 1 1. Место химии среди других естественных наук. Взаимодействие физики и химии. Особенности химии как науки. Основные теории химии. Химическая номенклатура. 2. Причины многообразия органических
По химии 10 класс Семенец Наталья Валерьевна, учитель биологии и химии Составлена на основе примерной программы по химии для 8-11 классов под редакцией О. С. Габриелян. М:Дрофа, 2010. 2017 Нормативными
Рабочая программа по химии 10 класс (базовый уровень) Пояснительная записка Рабочая программа составлена на основании программы по химии для учащихся 10 классов общеобразовательных учреждений (авторы И.И.Новошинский,
Муниципальное казенное образовательное учреждение "Сулевкентская средняя общеобразовательная школа" Отчет о мониторинговой работе Я_СДАМ_ЕГЭ_III_ЭТАП в 11 классе Химия 2017 г. Отчёт о диагностической работе:
Очный этап. 11 класс. Решения. Задание 1. Смесь трёх газов А,В,С имеет плотность по водороду равную 14. Порция этой смеси массой 168 г была пропущена через избыток раствора брома в инертном растворителе
Приложение к основной образовательной программе среднего общего образования, утверждённой приказом директора МБОУ СОШ 5 от 01.06.2016 203 РАБОЧАЯ ПРОГРАММА Предмет: Химия Класс: 10 Количество часов (всего):
Банк заданий к промежуточной аттестации учащихся 9 класса А1. Строение атома. 1. Заряд ядра атома углерода 1) 3 2) 10 3) 12 4) 6 2. Заряд ядра атома натрия 1) 23 2) 11 3) 12 4) 4 3. Число протонов в ядре
КАЛЕНДАРНО-ТЕМАТИЧЕСКОЕ ПЛАНИРОВАНИЕ уроков химии Классы: 10 «А» Учитель: Иванова Елена Вячеславовна Тольятти 2015 Пояснительная записка Программа по химии для 10-11 классов общеобразовательных учреждений
Пояснительная записка. Изучение химии на ступени основного общего образования направлено на достижение следующих целей: освоение важнейших знаний об основных понятиях и законах химии, химической символике;
Муниципальное бюджетное общеобразовательное учреждение средняя общеобразовательная школа 3 г.о. Подольск мкр. Климовск УТВЕРЖДАЮ Директор МБОУ СОШ 3 С.Г. Пелипака 2016 Рабочая программа по химии 10 класс
Аннотация к рабочей программе основной школы Место в учебном плане/ Уровень среднего общего образования, учебный план 10 класс 2 ч/нед.; недельная нагрузка Базовый/ профильный/ углублённый курс Документы
10 класс. Условия. Задание 1. Напишите три соединения кальция А, Б, С, в которых катион Са 2+ имеет такую же электронную оболочку, как и анионы, входящие в молекулу соответствующего соединения. Напишите
АВТОНОМНАЯ НЕКОММЕРЧЕСКАЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ОРГАНИЗАЦИЯ «ШКОЛА СОСНЫ» УТВЕРЖДАЮ Директор И.П. Гурьянкина Приказ _8 от «29» августа 2017 г. Рабочая программа по предмету «ХИМИЯ» 9 класс основное общее
Эксперимент по органической химии в средней школе. Цветков Л.А. ие для учителей. 5-е изд., перераб. и доп. М.: Школьная Пресса, 2000. 192 с. В пособии основное внимание уделено методике эксперимента, используемого
СПИРТЫ Дегтярёва М.О. МОУ ЛНИП С n Н 2n+1 OH Определение Спирты органические соединения, содержащие одну или несколько гидроксильных групп ОН Простейшие спирты Название Формула Модели Метиловый спирт (метанол)
МБОУ «Школа 15» приложение к приказу 162а от 20.08.2014 г Рабочая программа по химии 9 класс (дистанционное обучение 1ч, Кречетов Александр, Пшеничный Павел) Составитель: Ушанкова Светлана Петровна, учитель
Задания А17 по химии 1. Метанол образуется в результате взаимодействия 1) ацетилена с водой 2) гидрирования формальдегида 3) этилена с водой 4) метана с водой При реакции ацетилена с водой получится уксусный
FACULTATEA STOMATOLOGIE, ANUL I Pag. 1 / 5 Analizată și aprobată la ședința catedrei din, proces verbal nr șeful catedrei de Biochimie și Biochimie Clinică, conferențiar universitar, doctor habilitat în
Муниципальное бюджетное общеобразовательное учреждение средняя общеобразовательная школа 4 г. Балтийска Рабочая программа учебного предмета «Химия» 9 класс, ступень базовый уровень Балтийск 2017год 1.Пояснительная
Министерство образования и науки Российской Федерации САРАТОВСКИЙ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ИМЕНИ Н.Г.ЧЕРНЫШЕВСКОГО Программа вступительного испытания на бакалавриат/специалитет
Пояснительная записка Рабочая программа по химии составлена на основе: Федерального компонента государственного образовательного стандарта основного общего образования; примерной программы основного общего
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА Рабочая программа составлена в соответствии с Федеральным компонентом государственного образовательного стандарта первого поколения на основе авторской программы О.С.Габриеляна от
АМИНОКИСЛОТЫ. ПЕПТИДЫ. БЕЛКИ Аминокислотами называются карбоновые кислоты, в углеводородном радикале которых один или несколько атомов водорода замещены аминогруппами. В зависимости от взаимного расположения
Организация подготовки к ЕГЭ по химии: окислительно-восстановительные реакции с участием органических веществ Лидия Ивановна Асанова к.п.н., доцент кафедры естественнонаучного образования ГБОУ ДПО «Нижегородский
Тестируемый: Дата: Задание 1 Фенолом является вещество формула которого: Задание 2 К фенолам не относится вещество, формула которого Задание 3 Укажите общую формулу гомологического ряда фенолов: C n H
11 класс 1. Отгадайте вещества А и В, напишите уравнение реакции и расставьте недостающие A + B = изобутан + Na 2 CO 3 Решение: Исходя из необычного сочетания продуктов алкан и карбонат натрия можно определить,
Рабочая программа по химии для обучающихся 10 класса Составитель: учитель химии и биологии высшей квалификационной категории Чернышева М.Е. 2017-2018 учебный год 1. Планируемые результаты В результате
Урок 3 Тема: Органические вещества клетки: углеводы и липиды Ведущая дидактическая цель: изучение нового материала. Форма урока: комбинированная. Задачи урока: Образовательная: Продолжить изучение химической
Нормативные документы 1. Федеральный закон от 29.12.2012 г. 273-ФЗ «Об образовании в Российской Федерации» (редакция от 23.07.2013). 2. Об утверждении Федерального перечня учебников, рекомендованных к
Класс Фамилия, имя (полностью) Дата 2015 г. Инструкция по выполнению работы ЧАСТЬ 1 При выполнении задания 1-10 из предложенного перечня ответов выберите один правильный ответ. Цифры выбранных ответов
Рабочая программа по учебному предмету «Химия» составлена в соответствии с требованиями: - Федерального компонента государственного образовательного стандарта среднего общего образования; - Образовательной