Bendrosios V-A grupės elementų charakteristikos. V grupės P-elementai Didžiausias pagrindinio pogrupio 5 grupės elementų valentingumas
Elementų panašumai:
Identiška išorinio elektroninio atomų sluoksnio struktūra ns 2 np 3;
P-elementai;
Aukštasis kaimas O. lygus +5;
Žemutinė s. O. lygus -3 (nebūdinga Sb ir Bi).
Pagrindinio V grupės pogrupio elementams kartais vartojamas grupės pavadinimas „pniktogenai“, įvedamas pagal analogiją su terminais „halogenai“ ir „halkogenai“ ir kilęs iš elementų fosforo P ir azoto N simbolių.
Atomų valentinės būsenos
P, As, Sb, Bi atomams galimos 2 valentinės būsenos:
Pagrindinis ns 2 np 3
Raguotas ns 1 np 3 ir 1
Skirtumas tarp azoto ir kitų pogrupio elementų
1. Dėl to, kad azoto atomo išoriniame elektroniniame sluoksnyje nėra d-orbitalių, kovalentinių ryšių, kuriuos azoto atomas sudaro pagal mainų mechanizmą, skaičius negali būti didesnis nei 3.
2. Vienos elektronų poros buvimas azoto atomo 2s polygyje leidžia suformuoti kovalentinį ryšį per donoro-akceptoriaus mechanizmą. Taigi didžiausias N valentingumas yra IV.
3. Junginiuose su deguonimi azotas turi oksidacijos būsenas +1, +2, +3, +4, +5.
Vertikalus elementų ir jų formuojamų medžiagų savybių pokytis
Skirtingai nuo halogenų ir chalkogenų, pagrindiniame V grupės pogrupyje elementų ir jų susidarančių paprastų medžiagų savybės kinta labiau, nes didėja branduolio krūvis ir atomų spindulys:
Vertikalus elementų ir jų suformuotų paprastų medžiagų savybių pokytis |
|||||
nemetalai |
metalas su tam tikrais nemetališkumo požymiais |
||||
Oksidai ir hidroksidai |
Azotas ir jo deguonies junginiai nagrinėjami atskirai dėl daugybės skirtumų. |
||||
E 2 O 3 ir atitinkami hidroksidai |
P 2 O 3 (P 4 O 6) rūgšties oksidas |
Kaip 2 O 3 rūgštinis oksidas su amfoteriškumo požymiais |
Sb 2 O 3 amfoterinis oksidas |
Bi 2 O 3 bazinis oksidas |
|
E 2 O 5 ir atitinkami hidroksidai |
P 2 O 5 (P 4 O 10) rūgšties oksidas |
Kaip 2 O 5 rūgšties oksidas |
Sb 2 O 5 rūgšties oksidas |
Bi 2 O 5 amfoterinis trapus |
|
HPO 3 (H 3 PO 4) |
|||||
silpnos rūgštys |
|||||
Rūgščių savybės susilpnėja |
|||||
Patobulintos pagrindinės savybės |
|||||
Vandenilio junginiai EN 3
Pagrindinio V grupės pogrupio elementai su vandeniliu sudaro lakiuosius junginius, kurie yra būdingo kvapo nuodingos dujos. Jie yra stiprūs reduktorius. Skirtingai nuo VII ir VI grupių nemetalų vandenilio junginių, vandeniniuose tirpaluose jie nesudaro H+ jonų, t.y. nepasižymi rūgštinėmis savybėmis.
BENDROSIOS 5-OSIOS ELEMENTŲ GRUPĖS CHARAKTERISTIKOS.
Į pagrindinį periodinės lentelės pogrupį V 0 01 F įeina azotas, fosforas, arsenas, stibis ir bismutas. Šie elementai, turintys penkis elektronus išoriniame atomo sluoksnyje, apibūdinami bendrai
kaip ir nemetalai. Tačiau jų gebėjimas prijungti elektronus yra daug mažiau ryškus nei atitinkamų VI ir VII grupių elementų. Dėl penkių išorinių elektronų didžiausia teigiama šio pogrupio elementų oksidacija yra -5, o neigiama - 3. Dėl santykinai mažesnio elektronegatyvumo nagrinėjamų elementų ryšys su vandeniliu yra mažiau polinis nei VI ir VII grupių elementų jungtis su vandeniliu. Todėl šių elementų vandenilio junginiai nepašalina vandenilio jonų H vandeniniame tirpale, todėl neturi rūgščių savybių. Azoto pogrupio elementų fizikinės ir cheminės savybės kinta su
0 0 1 Serijos numerio didinimas ta pačia seka, kokia buvo pastebėta
0 0 1 Anksčiau nagrinėjamoms grupėms, Bet kadangi nemetalinės savybės išreiškiamos
silpnesnis už deguonies ir ypač fluoro, tada šių savybių susilpnėjimas pereinant prie 0 0 1 F šie elementai reiškia metalinių savybių atsiradimą ir padidėjimą.
Pastarosios jau pastebimos arsene, stibis turi abi savybes maždaug vienodai, o bismute metalinės savybės vyrauja prieš nemetalines. ELEMENTŲ APRAŠYMAS. AZOTAS(iš graikų ázōos – negyvas, lot. Nitrogenium), N, cheminis elementas V
Mendelejevo periodinės sistemos grupės, atominis skaičius 7, atominė masė 14,0067; bespalvės dujos, bekvapės ir beskoniai. Istorinė nuoroda. Azoto junginių – salietros, azoto rūgšties, amoniako – buvo
žinomas gerokai prieš azoto gamybą laisvoje būsenoje. 1772 m. D. Rutherfordas, degindamas fosforą ir kitas medžiagas stikliniame varpe, parodė, kad po degimo likusios dujos, kurias jis pavadino „dusinančiu oru“, nepalaiko kvėpavimo ir degimo. 1787 m. A. Lavoisier nustatė, kad orą sudarančios „gyvybinės“ ir „dusinančios“ dujos yra paprastos medžiagos, ir pasiūlė pavadinimą „azotas“. 1784 m. G. Cavendishas parodė, kad azotas yra salietros dalis; Iš čia kilęs lotyniškas pavadinimas azotas (iš vėlyvojo lotyniško nitrum – salietra ir graikiško gennao – pagimdžiu, gaminu), 1790 m. pasiūlė J. A. Chaptal. Iki XIX amžiaus pradžios. Išaiškintas laisvo azoto cheminis inertiškumas ir išskirtinis jo, kaip surišto azoto, vaidmuo junginiuose su kitais elementais. Nuo tada oro azoto „surišimas“ tapo viena iš svarbiausių techninių chemijos problemų. Paplitimas gamtoje. Azotas yra vienas iš labiausiai paplitusių elementų
Žemė ir jos didžioji dalis (apie 4´1015 T) yra susitelkęs laisvoje būsenoje atmosferoje. Ore laisvojo azoto (N2 molekulių pavidalu) yra 78,09 % tūrio (arba 75,6 % masės), neskaitant jo smulkių priemaišų amoniako ir oksidų pavidalu. Vidutinis azoto kiekis litosferoje yra 1,9×10-3 masės %. Natūralūs azoto junginiai. - amonio chloridas NH4Cl ir įvairūs nitratai (žr.
Druska.) Didelės salietros sankaupos būdingos sausam dykumos klimatui (Čilė, Vidurinė Azija). Ilgą laiką nitratas buvo pagrindinis azoto tiekėjas pramonei (dabar pramoninė amoniako sintezė iš oro azoto ir vandenilio yra itin svarbi azoto fiksavimui). Nedideli fiksuoto azoto kiekiai randami anglyse (1-2,5%) ir naftoje (0,02-1,5%), taip pat upių, jūrų ir vandenynų vandenyse. Azotas kaupiasi dirvožemyje (0,1%) ir gyvuose organizmuose (0,3%).
Nors pavadinimas „azotas“ reiškia „nepalaikantis gyvybės“, iš tikrųjų jis yra būtinas gyvybės elementas. Gyvūnų ir žmonių baltymuose yra 16-17% azoto. Mėsėdžių gyvūnų organizmuose baltymai susidaro dėl suvartotų baltyminių medžiagų, esančių žolėdžių gyvūnų organizmuose ir augaluose. Augalai sintetina baltymus asimiliuodami azotines medžiagas, esančias dirvožemyje, daugiausia neorganines. Nemažai azoto į dirvožemį patenka dėl azotą fiksuojančių mikroorganizmų, gebančių laisvą azotą iš oro paversti azoto junginiais. Gamtoje vyksta azoto ciklas, kuriame pagrindinis vaidmuo tenka
mikroorganizmai – nitrofuojasi, denitrofuojasi, fiksuoja azotą ir kt. Tačiau augalams ištraukus didžiulius kiekius fiksuoto azoto (ypač intensyviai ūkininkaujant), dirvose trūksta azoto. Azoto trūkumas būdingas beveik visų šalių žemės ūkiui, taip pat gyvulininkystėje ("baltymų badas"). Dirvožemyje, kuriame trūksta azoto, augalai blogai vystosi. Azoto trąšos ir gyvulių šėrimas baltymais yra svarbiausios žemės ūkio skatinimo priemonės. Žmonių ūkinė veikla sutrikdo azoto ciklą. Taigi deginant kurą atmosfera praturtinama azotu, o gamyklos, gaminančios trąšas, suriša azotą iš oro. Transportuojant trąšas ir žemės ūkio produktus, azotas perskirstomas į žemės paviršių. Azotas yra ketvirtas pagal gausumą elementas Saulės sistemoje (po vandenilio,
helis ir deguonis). Izotopai, atomas, molekulė. Natūralus azotas susideda iš dviejų stabilių izotopų: 14N
(99,635%) ir 15N (0,365%). 15N izotopas naudojamas cheminiuose ir biocheminiuose tyrimuose kaip paženklintas atomas. Iš dirbtinių radioaktyviųjų azoto izotopų 13N pusinės eliminacijos laikas yra ilgiausias (T1/2 – 10,08 min), likusieji yra labai trumpalaikiai. Viršutiniuose atmosferos sluoksniuose, veikiant kosminės spinduliuotės neutronams, 14N virsta radioaktyviuoju anglies izotopu 14C. Šis procesas taip pat naudojamas branduolinėse reakcijose gaminant 14C. Azoto atomo išorinis elektroninis apvalkalas. susideda iš 5 elektronų (viena pora ir trys nesuporuoti - 2 konfigūracija s 22p 3). Dažniausiai azotas. junginiuose jis yra 3-kovalentinis dėl nesuporuotų elektronų (kaip ir amoniake NH3). Vienos elektronų poros buvimas gali paskatinti kito kovalentinio ryšio susidarymą, o azotas tampa 4 kovalentiniu (kaip amonio jone NH4+). Azoto oksidacijos laipsniai svyruoja nuo +5 (N205) iki -3 (NH3). Normaliomis sąlygomis laisvoje būsenoje azotas sudaro N2 molekulę, kurioje N atomai yra sujungti trimis kovalentiniais ryšiais. Azoto molekulė yra labai stabili: jos disociacijos energija į atomus yra 942,9 kJ/mol (225,2 kcal/mol), todėl net ir su t apie 3300°C azoto disociacijos laipsnį. yra tik apie 0,1%. Fizinės ir cheminės savybės. Azotas yra šiek tiek lengvesnis už orą; tankis 1,2506 kilogramas/
m3(esant 0°C ir 101325 n/m2 arba 760 mmHg Art.), tpl-209,86 °C, virti-195,8 °C. A. sunkiai skystėja: jo kritinė temperatūra gana žema (-147,1 °C), o kritinis slėgis aukštas 3,39 Mn/m2 (34,6 kgf/cm2); skystojo azoto tankis 808 kg (m3. Azotas vandenyje tirpsta mažiau nei deguonis: 0°C temperatūroje 1 m3 H2O tirpsta 23.3 G azoto. Azotas kai kuriuose angliavandeniliuose tirpsta geriau nei vandenyje. Tik su aktyviais metalais, tokiais kaip litis, kalcis, magnis, azotas
sąveikauja kaitinant iki palyginti žemos temperatūros. Azotas reaguoja su dauguma kitų elementų esant aukštai temperatūrai ir esant katalizatoriams. Azoto junginiai su deguonimi N2O, NO, N2O3, NO2 ir N2O5 buvo gerai ištirti. Iš jų tiesioginės elementų sąveikos metu (4000°C) susidaro NO oksidas, kuris vėsdamas lengvai oksiduojasi toliau iki NO2 dioksido. Ore azoto oksidai susidaro atmosferos išmetimo metu. Jų taip pat galima gauti veikiant azoto ir deguonies mišinį jonizuojančia spinduliuote. Kai azotinis N2O3 ir
Azoto anhidridai N2O5 atitinkamai gamina azoto rūgštį HNO2 ir azoto rūgštį HNO3, sudarydamos druskas – nitritus ir nitratus. Azotas su vandeniliu jungiasi tik aukštoje temperatūroje ir esant katalizatoriams, susidaro amoniakas NH3. Be amoniako, žinoma daug kitų azoto junginių su vandeniliu, pavyzdžiui, hidrazinas H2N-NH2, diimidas HN-NH, vandenilio azoto rūgštis HN3(H-N-NºN), oktazonas N8H14 ir kt.; Dauguma azoto ir vandenilio junginių išskiriami tik organinių darinių pavidalu. Azotas su halogenais tiesiogiai nesąveikauja, todėl visi azoto halogenidai gaunami tik netiesiogiai, pvz., azoto fluoridas NF3- fluorui reaguojant su amoniaku. Paprastai azoto halogenidai yra mažai stabilūs junginiai (išskyrus NF3); Azoto oksihalogenidai yra stabilesni – NOF, NOCI, NOBr, N02F ir NO2CI. Azotas taip pat nesijungia tiesiogiai su siera; azotinė siera N4S4 gaunama skystai sierai reaguojant su amoniaku. Kai karštas koksas reaguoja su azotu, susidaro cianogenas (CN). Kaitinant azotą su acetilenu C2H2 iki 1500°C, galima gauti vandenilio cianidą HCN. Dėl azoto sąveikos su metalais aukštoje temperatūroje susidaro nitridai (pavyzdžiui, Mg3N2). Kai įprastą azotą veikia elektros iškrovos [slėgis 130–270 n/m2(1- 2
mmHg)] arba skaidant B, Ti, Mg ir Ca nitridus, taip pat vykstant elektros išlydžiams ore gali susidaryti aktyvusis azotas, kuris yra azoto molekulių ir atomų mišinys su padidintu energijos rezervu. Skirtingai nuo molekulinio azoto, aktyvusis azotas labai energingai sąveikauja su deguonimi, vandeniliu, sieros garais, fosforu ir kai kuriais metalais. Azotas yra daugelio svarbių organinių junginių dalis (aminai,
aminorūgštys, nitro junginiai ir kt.). Kvitas ir paraiška. Laboratorijoje azotą galima lengvai gauti
kaitinant koncentruotą amonio nitrito tirpalą: NH4NO2 - N2 + 2H2O. Techninis azoto gamybos metodas pagrįstas iš anksto suskystinto oro atskyrimu, kuris vėliau yra distiliuojamas. Didžioji dalis išgaunamo laisvojo azoto panaudojama pramonėje
amoniako, kuris vėliau dideliais kiekiais perdirbamas į azoto rūgštį, trąšas, sprogmenis ir kt., gamyba. Be tiesioginės amoniako sintezės iš elementų, 1905 m. sukurtas cianamido metodas, pagrįstas tuo, kad 1000 °C temperatūroje kalcio karbidas (gaunamas kaitinant kalkių ir anglies mišinį elektrinėje krosnyje) reaguoja su laisvuoju azotu: CaC2 + N2 = CaCN2 + C. Susidaręs kalcio cianamidas suyra veikiant perkaitintiems vandens garams, išskirdamas amoniaką:
CaCN+3H2O=CaCO3+2NH3.
Laisvasis azotas naudojamas daugelyje pramonės šakų: kaip inertinė terpė įvairiuose chemijos ir metalurgijos procesuose, laisvos vietos užpildymui gyvsidabrio termometruose, siurbiant degius skysčius ir kt. Skystas azotas naudojamas įvairiuose šaldymo įrenginiuose. Jis laikomas ir gabenamas plieniniuose Dewar induose, azoto dujos suslėgtos formos – balionuose. Daugelis azoto junginių yra plačiai naudojami po Pirmojo pasaulinio karo ir dabar yra pasiekę milžiniškus mastus.
Fosforas(lot. Fosforas), P, Mendelejevo periodinės sistemos V grupės cheminis elementas, atominis skaičius 15, atominė masė 30,97376, nemetalas. Natūralų fosforą sudaro vienas stabilus izotopas 31P; buvo gauti šeši dirbtiniai radioaktyvieji izotopai: 28P ( T1/2 - 6,27 sek), 29P ( T1/2 - 4,45 sek.); 30p ( T1/2 - 2,55 min), 31P ( T1/2
14,22 dienų), 32P ( T1/2 - 25 dienų), 33P ( T1/2 - 12,5 sek). 32P turi didžiausią vertę , turintis didelę b-spinduliavimo energiją ir naudojamas cheminiuose bei biocheminiuose tyrimuose kaip žymėtasis atomas. Istorinė nuoroda. Kai kuriais literatūros duomenimis, gavimo būdas
Fosforą jau žinojo arabai. XII amžiaus alchemikai. Bet visuotinai pripažinta fosforo atradimo data laikomi 1669 m., kai H. Brandas (Vokietija), smėliu kalcinuodamas sausą šlapimo išgarinimo likutį ir vėliau distiliuojant be oro prieigos, gavo medžiagą, kuri švyti tamsi, iš pradžių vadinama „šalta ugnimi“, o vėliau iš graikų kalbos – fosforas. fosforas – šviečiantis. Netrukus jam tapo žinomas fosforo gavimo būdas. chemikai - I. Kraft, I. Kunkel; 1682 m. šis metodas buvo paskelbtas. 1743 metais A. S. Marggrafas sukūrė tokį fosforo gavimo būdą: švino chlorido ir šlapimo mišinys išgarinamas iki sausumo ir kaitinamas tol, kol nutrūko lakiųjų produktų išsiskyrimas; likučiai buvo sumaišyti su medžio anglies milteliais ir distiliuoti molinėje retortoje; Fosforo garai, kondensuoti imtuve su vandeniu. Paprasčiausią fosforo gavimo būdą kalcinuojant kaulų pelenus anglimi pasiūlė tik 1771 m. K. Scheele. Fosforo elementarumą nustatė A. Lavoisier. 2 pusėje XIX a. atsirado pramoninė fosforo gamyba iš fosforitų retortinėse krosnyse; pradžioje. jas pakeitė elektrinės orkaitės. Paplitimas gamtoje. Vidutinis fosforo kiekis žemės plutoje (clark) -
9,3×10-2 % masės; vidutinėse uolienose 1,6×10-1, bazinėse uolienose 1,4×10-1, mažiau granituose ir kitose rūgštinėse magminėse uolienose - 7×10-2 ir dar mažiau ultrabazinėse uolienose (mantijoje) - 1, 7×10-2 % ; nuosėdinėse uolienose nuo 1,7×10-2 (smėlio akmenys) iki 4×10-2 % (karbonatinės uolienos). Fosforas dalyvauja magminiuose procesuose ir energingai migruoja biosferoje. Abu procesai yra susiję su dideliais jo sankaupomis, formuojančiais pramonines apatitų ir fosforitų nuosėdas. . Fosforas yra nepaprastai svarbus biogeninis elementas, jį kaupia daugelis organizmų. Daugelis fosforo koncentracijos procesų žemės plutoje yra susiję su biogenine migracija. Fosforas lengvai nusodinamas iš vandens netirpių mineralų pavidalu arba sugaunamas gyvųjų medžiagų. Todėl jūros vandenyje yra tik 7 × 10-6% fosforo. Yra žinoma apie 180 fosforo mineralų, daugiausia įvairūs fosfatai, iš kurių labiausiai paplitę kalcio fosfatai. . Fizinės savybės. Elementinis fosforas egzistuoja kelių pavidalu
alotropinės modifikacijos, kurių pagrindinės yra balta, raudona ir juoda. Baltasis fosforas yra vaškinė, skaidri, būdingo kvapo medžiaga, susidaranti kondensuojantis fosforo garams. Baltasis fosforas esant priemaišoms – raudonojo fosforo, arseno, geležies ir kt. pėdsakai. - dažytas geltonai, taigi komercinis baltasis fosforas. vadinamas geltonu. Yra dvi baltojo fosforo formos: a ir b formos. a- modifikacija reiškia kubinės sistemos kristalus ( A- 18,5); tankis 1,828 g/cm3, t pl 44,1 °C, t kip 280,5 °C, lydymosi šiluma 2,5 kJ/mol P4 (0.6 kcal/mol P4), garavimo šiluma 58.6 kJ/mol P4(14.0 kcal/mol P4) , garų slėgis esant 25 °C 5.7 n/m2 (0,043 mmHg Art.). Linijinio plėtimosi koeficientas temperatūros diapazone nuo 0 iki 44 °C yra 12,4 × 10-4 , šilumos laidumas 0,56 antradienis/(m×K) 25 °C temperatūroje. Baltojo fosforo elektrinės savybės. arti dielektrikų: juostos tarpas apie 2,1 ev, elektrinė varža 1,54×1011 ohm× cm, diamagnetinis, specifinis magnetinis jautrumas - 0,86×10-6. Brinelio kietumas 6 Mn/m2 (0,6 kgf/mm2). Baltojo fosforo a forma gerai tirpsta anglies disulfide, prasčiau skystame amoniake, benzene, anglies tetrachloride ir kt. Esant -76,9 °C ir 0,1 slėgiui Mn/m2(1kgf/cm2) a-forma virsta žematemperatūrine b-forma (tankis 1,88 g/cm3). Padidėjus slėgiui iki 1200 Mn/m2(12 tūkst kgf/cm2) perėjimas vyksta 64,5 °C temperatūroje. b formos - kristalai su dvigubu lūžiu, jų struktūra galutinai nenustatyta. Baltasis fosforas yra nuodingas: ore, kurio temperatūra apie 40 °C
savaime užsidega, todėl reikia laikyti po vandeniu (tirpumas vandenyje 25 °C temperatūroje 3,3×10-4%) . Baltąjį fosforą kaitinant be oro prieigos 250-300 °C keletą valandų, gaunamas raudonasis fosforas. Perėjimas yra egzoterminis, pagreitintas ultravioletinių spindulių, taip pat priemaišų (jodo, natrio, seleno). Paprastas komercinis raudonasis fosforas yra beveik visiškai amorfinis; turi spalvą nuo tamsiai rudos iki violetinės. Ilgai kaitinant, jis gali negrįžtamai virsti viena iš kristalinių formų (triklinika, kubinė ir kt.), kurios savybės skiriasi: tankis nuo 2,0 iki 2,4 g/cm 3,t pl nuo 585 iki 610 °C esant kelių dešimčių atmosferų slėgiui, sublimacijos temperatūra nuo 416 iki 423 °C, elektrinė varža nuo 109 iki 1014 ohm× cm. Raudonasis fosforas ore savaime neužsidega; iki 240-250 °C temperatūros, tačiau nuo trinties ar smūgio užsidega savaime; netirpsta vandenyje, taip pat benzene, anglies disulfide ir kt., tirpsta fosforo tribromide. Sublimacijos temperatūroje raudonasis fosforas virsta garais, o aušinant susidaro daugiausia baltasis fosforas. Baltąjį fosforą kaitinant iki 200-220 °C esant slėgiui (1,2-1,7) × 103 Mn/m 2
[(12-17) × 103 kgf / cm 2] susidaro juodasis fosforas. Ši transformacija gali būti atliekama be slėgio, bet esant gyvsidabriui ir nedideliam kiekiui juodojo fosforo kristalų (sėklų) 370 °C temperatūroje 8 dienų Juodasis fosforas yra ortorombinės struktūros kristalas ( A -3,31 , b - 4,38 , Su-10.50), grotelės pastatytos iš pluoštinių sluoksnių su būdingu fosforu. piramidinis atomų išsidėstymas, tankis 2.69 g/cm3, t pl apie 1000 °C esant slėgiui 1,8×103 Mn/m2(18 × 103 kgf/cm2). Savo išvaizda juodasis fosforas panašus į grafitą; puslaidininkis: juostos tarpas 0,33 ev 25 °C temperatūroje; kurio savitoji elektrinė varža yra 1,5 ohm× cm, elektrinės varžos temperatūros koeficientas 0,0077, diamagnetinis, savitasis magnetinis jautrumas 0,27×10-6. Kaitinamas iki 560-580 °C, veikiant savų garų slėgiui, jis virsta raudonuoju fosforu. Juodasis fosforas yra mažai aktyvus ir sunkiai užsidega, todėl jį galima saugiai apdoroti ore. Fosforo atominis spindulys yra 1,34, joniniai spinduliai: P5 + 0,35, P3 + 0,44, P3- 1,86.
Fosforo atomai susijungia ir sudaro dviatomes (P2), tetraatomines (P4) ir polimero molekules. Įprastomis sąlygomis stabiliausios polimero molekulės yra tos, kurios turi ilgas tarpusavyje sujungtų P4 tetraedrų grandines. Skystuose, kietuose (baltajame fosfore) ir garuose, kurių temperatūra žemesnė nei 800 °C, fosforą sudaro P4 molekulės. Esant aukštesnei nei 800 °C temperatūrai, P4 molekulės disocijuoja į P2 , kurie savo ruožtu aukštesnėje nei 2000 °C temperatūroje suyra į atomus. Tik baltasis fosforas susideda iš P4 molekulių, visos kitos modifikacijos yra polimerai. Cheminės savybės. Fosforo atomo išorinių elektronų konfigūracija 3 s2 3p3, V
junginių, būdingiausios oksidacijos laipsniai yra + 5, + 3 ir - 3. Kaip ir azotas, taip ir junginiuose esantis fosforas daugiausia yra kovalentinis. Yra labai mažai joninių junginių, tokių kaip fosfidai Na3P ir Ca3P2. Skirtingai nuo azoto, fosforas turi laisvą 3 d- orbitalės, kurių energija yra gana maža, todėl atsiranda galimybė padidinti koordinavimo skaičių ir formuoti donoro-akceptoriaus ryšius. Fosforas yra chemiškai aktyvus, baltasis fosforas turi didžiausią aktyvumą;
raudonasis ir juodasis fosforas yra daug pasyvesni cheminėse reakcijose. Baltojo fosforo oksidacija vyksta per grandininės reakcijos mechanizmą. Fosforo oksidaciją dažniausiai lydi chemiliuminescencija. Kai fosforas dega deguonies pertekliumi, susidaro pentoksidas P4O10 (arba P2O5), kai yra trūkumas, daugiausia trioksidas P4O6 (arba P2O3). P4O7, P4O8 buvimas garuose įrodytas spektroskopiškai , P2O6, PO ir kiti fosforo oksidai. Fosforo pentoksidas gaminamas pramoniniu mastu, deginant elementinį fosforą sauso oro pertekliumi. Vėlesnė P4O10 hidratacija lemia orto-(H3PO4) ir poli-(H) gamybą. n+2 P n O3 P+ 1) fosforo rūgštys. Išskyrus
Be to, fosforas sudaro fosforo rūgštį H3PO3, fosforo rūgštį H4P2O6 ir hipofosforo rūgštį H3PO2, taip pat perrūgštis: perfosforo rūgštį H4P2O8 ir monoperfosforo rūgštį H3PO5. Fosforo rūgščių druskos yra plačiai naudojamos , mažesniu mastu – fosfitai ir hipofosfitai. Fosforas tiesiogiai jungiasi su visais halogenais ir išskiria didelį kiekį
šilumos kiekį ir trihalogenidų (PX3, kur X yra halogenas), pentahalogenidų (PX5) ir oksihalogenidų (pavyzdžiui, POX3) susidarymą . Kai fosforas susilieja su siera žemesnėje nei 100 °C temperatūroje, susidaro kietieji tirpalai fosforo ir sieros pagrindu, o aukštesnėje nei 100 °C temperatūroje vyksta egzoterminė reakcija, susidaro kristaliniai sulfidai P4S3, P4S5, P4S7, P4S10, iš kurių kaitinant tik P4S5 skyla į P4S3. aukštesnėje nei 200 °C temperatūroje ir P4S7, o likusi dalis ištirpsta nesuirdama. Žinomi šie fosforo oksisulfidai: P2O3S2, P2O3S3, P4O4S3, P6O10S5 ir P4O4S3. Fosforas, palyginti su azotu, mažiau gali sudaryti junginius su vandeniliu. Fosforo vandenilio fosfino PH3 ir difosfino P2H4 galima gauti tik netiesiogiai. Iš fosforo-azoto junginių žinomi nitridai PN, P2N3, P3N5 - kietos, chemiškai stabilios medžiagos, gaunamos azotą su fosforo garais leidžiant elektros lanku; polimeriniai fosfonitrilo halogenidai – (PNX2)n (pavyzdžiui, polifosfonitrilo chloridas) , gaunamas reaguojant pentahalidams su amoniaku įvairiomis sąlygomis; amidoimidofosfatai yra junginiai, dažniausiai polimeriniai, turintys P-NH-P ryšių kartu su P-O-P jungtimis. Esant aukštesnei nei 2000°C temperatūrai, fosforas reaguoja su anglimi ir susidaro
PC3 karbidas yra įprastuose tirpikliuose netirpi medžiaga, nesąveikaujanti nei su rūgštimis, nei su šarmais. Kaitinant su metalais, fosforas sudaro fosfidus. Fosforas sudaro daugybę organinių fosforo junginių. Kvitas. vykdoma elementinio fosforo gamyba
elektroterminis jo redukavimas iš natūralių fosfatų (apatitų arba fosforitų) 1400–1600 °C temperatūroje koksu, esant silicio dioksidui (kvarciniam smėliui):
2Ca3(PO4)2 + 10C + n SiO2 = P4 + 10CO + 6CaO× n SiO2 iš anksto susmulkinta ir praturtinta fosforo rūda įmaišoma į
nurodytais santykiais su silicio dioksidu ir koksu ir kraunamas į elektrinę krosnį. Silicio dioksidas būtinas norint sumažinti reakcijos temperatūrą, taip pat padidinti jos greitį, redukcijos metu išsiskiriantį kalcio oksidą surišant į kalcio silikatą, kuris nuolat pašalinamas kaip išlydytas šlakas. Į šlaką taip pat patenka aliuminio, magnio, geležies ir kitų priemaišų silikatai ir oksidai, taip pat ferofosforas (Fe2P, FeP, Fe3P), susidarę daliai redukuotos geležies sąveikaujant su fosforu. Ferofosforas, taip pat nedideli kiekiai jame ištirpusių mangano fosfidų ir kitų metalų pašalinami iš elektrinės krosnies, nes kaupiasi vėlesniam naudojimui specialių plienų gamyboje. Fosforo garai palieka elektrinę krosnį kartu su dujiniais šalutiniais produktais.
produktai ir lakiosios priemaišos (CO, SiF4, PH3, vandens garai, organinio krūvio priemaišų pirolizės produktai ir kt.) 250-350 °C temperatūroje. Išvalius nuo dulkių, fosforo turinčios dujos nukreipiamos į kondensacinius įrenginius, kuriuose po vandeniu ne žemesnėje kaip 50 °C temperatūroje surenkamas skystas techninis baltas fosforas. Kuriami metodai fosforui gaminti naudojant dujinį
reduktorius, plazminius reaktorius, siekiant suintensyvinti gamybą didinant temperatūrą iki 2500–3000 °C, t. y. aukštesnę nei natūralių fosfatų ir redukuojančių dujų (pavyzdžiui, metano) disociacijos temperatūra žemos temperatūros plazmoje.
Taikymas. Didžioji dalis pagaminto fosforo perdirbama į fosforo rūgštį ir fosforo trąšas bei jų pagrindu gaunamas technines druskas (fosfatus). . Baltasis fosforas naudojamas padegamiesiems ir dūminiams sviediniams, bomboms; raudona
fosforo – degtukų gamyboje. Fosforas naudojamas spalvotųjų metalų lydinių gamyboje kaip deoksidacinė medžiaga. Įdėjus iki 1 % fosforo, padidėja lydinių, tokių kaip fechral ir chromal, atsparumas karščiui. Kai kuriose bronzose yra fosforo, nes padidina jų sklandumą ir atsparumą dilimui. Puslaidininkinių medžiagų gamyboje ir legiravimui naudojami metalų fosfidai, taip pat kai kurie nemetalai (B, Si, As ir kt.). Iš fosforo iš dalies gaminami chloridai ir sulfidai, kurie yra pradinės medžiagos fosforo turinčių plastifikatorių (pavyzdžiui, trikrezilfosfato, tributilo fosfato ir kt.), vaistų, organinių fosforo pesticidų gamyboje, taip pat naudojami kaip tepalų priedai. ir degalai. Saugos priemonės. Baltasis fosforas ir jo junginiai yra labai toksiški. Dirbti su
fosforas reikalauja kruopštaus įrangos sandarinimo; saugoti baltąjį fosforą. turi būti po vandeniu arba hermetiškai uždarytame metaliniame inde. Dirbant su fosforu, reikia griežtai laikytis saugos taisyklių. Fosforas organizme. Fosforas yra vienas iš svarbiausių biogeninių elementų,
būtinas visų organizmų gyvybei. Jis yra gyvose ląstelėse orto- ir pirofosforo rūgščių ir jų darinių pavidalu, taip pat yra nukleotidų, nukleorūgščių, fosfoproteinų, fosfolipidų, angliavandenių fosforo esterių, daugelio kofermentų ir kitų organinių junginių dalis. Dėl savo cheminės sandaros ypatumų fosforo atomai, kaip ir sieros atomai, gali sudaryti daug energijos turinčius ryšius didelės energijos junginiuose; adenozino trifosforo rūgštis (ATP), kreatino fosfatas ir kt.. Biologinės evoliucijos procese būtent fosforo junginiai tapo pagrindiniais, universaliais genetinės informacijos ir energijos nešiotojais visose gyvose sistemose. Dr. Svarbus fosforo junginių vaidmuo organizme slypi tame, kad fermentinis fosforilo liekanos () pridėjimas prie įvairių organinių junginių (fosforilinimas) yra „praėjimas“ jiems dalyvauti medžiagų apykaitoje ir, atvirkščiai, skilimas. fosforilo liekana (defosforilinimas) neleidžia šiems junginiams aktyviai keistis. Fosforo apykaitos fermentai – kinazės, fosforilazės ir fosfatazės. Kepenys vaidina pagrindinį vaidmenį transformuojant fosforo junginius gyvūnų ir žmonių organizme. Fosforo junginių apykaitą reguliuoja hormonai ir vitaminas D. Fosforo kiekis (mg/100 G sausosios medžiagos) augalų audiniuose - 230-350,
jūrų gyvūnai - 400-1800, sausumos gyvūnai - 1700-4400, bakterijos - apie 3000; žmogaus organizme ypač daug fosforo yra kauliniame audinyje (šiek tiek daugiau nei 5000), smegenų audinyje (apie 4000) ir raumenyse (220-270). Kasdienis žmogaus fosforo poreikis yra 1-1,2 G(vaikams jis didesnis nei suaugusiems). Iš maisto produktų daugiausiai fosforo turi sūriai, mėsa, kiaušiniai, ankštiniai augalai (žirniai, pupelės ir kt.). Fosforo balansas organizme priklauso nuo bendros medžiagų apykaitos būklės. Fosforo apykaitos pažeidimas sukelia gilius biocheminius pokyčius, pirmiausia energijos apykaitą. Kai organizme trūksta fosforo, gyvūnai ir žmonės suserga osteoporoze ir kitomis kaulų ligomis, o augalams – fosforo badas. . Fosforo šaltinis gyvojoje gamtoje yra jo neorganiniai junginiai, esantys dirvožemyje ir ištirpę vandenyje. Fosforą iš dirvožemio išgauna augalai tirpių fosfatų pavidalu. Gyvūnai paprastai gauna pakankamai fosforo iš savo mitybos. Po organizmų mirties fosforas vėl patenka į dirvožemį ir dugno nuosėdas ir taip dalyvauja. medžiagų cikle. Svarbus fosforo vaidmuo reguliuojant medžiagų apykaitos procesus lemia didelį daugelio gyvų ląstelių fermentų sistemų jautrumą organinių fosforo junginių veikimui. Ši aplinkybė naudojama medicinoje kuriant vaistus, žemės ūkyje – fosforo gamyboje
trąšoms, taip pat kuriant veiksmingus insekticidus. Daugelis fosforo junginių yra labai toksiški, o kai kurie organiniai fosforo junginiai gali būti klasifikuojami kaip cheminės kovos medžiagos (zarinas, somanas, tabunas). Fosforo radioaktyvusis izotopas 32P plačiai naudojamas biologijoje ir medicinoje kaip rodiklis tiriant visų rūšių medžiagų apykaitą ir energiją gyvuose organizmuose. . Vaistai, kurių sudėtyje yra fosforo (adenozintrifosforo rūgšties,
fitinas, kalcio glicerofosfatas, fosfenas ir kt.), daugiausia veikia audinių metabolizmo procesus ir yra naudojami raumenų, nervų sistemos ligoms, tuberkuliozei, mitybos sutrikimui, anemijai ir kt. medžiagų apykaitai, ligų diagnostikai, taip pat navikų spindulinei terapijai tirti .
Arsenas(lot. Arsenicum), As, Mendelejevo periodinės sistemos V grupės cheminis elementas, atominis skaičius 33, atominė masė 74,9216; plieno pilkumo kristalai. Elementą sudaro vienas stabilus izotopas 75As. Istorinė nuoroda. Natūralūs arseno ir sieros junginiai (orpimentas As2S3,
realgar As4S4) buvo žinomi senovės pasaulio tautoms, kurios naudojo šiuos mineralus kaip vaistus ir dažus. Taip pat buvo žinomas arseno sulfidų deginimo produktas - arseno (III) oksidas As2O3 („baltasis arsenas“). Vardas arsenikón randamas jau Aristotelyje; jis kilęs iš graikų kalbos. ársen – stiprus, drąsus ir skirtas arseno junginiams žymėti (remiantis jų stipriu poveikiu organizmui). Manoma, kad rusiškas pavadinimas kilęs iš „pelės“ (po arseno preparatų panaudojimo pelėms ir žiurkėms naikinti). Laisvo arseno gamyba priskiriama Albertui Magnusui (apie 1250 m.). 1789 metais A. Lavoisier įtraukė arseną į cheminių elementų sąrašą. Paplitimas gamtoje. Vidutinis arseno kiekis žemės plutoje (klarkas)
1,7·10-4 % (pagal masę), tokiais kiekiais jo yra daugumoje magminių uolienų. Kadangi arseno junginiai yra lakūs aukštoje temperatūroje, elementas nesikaupia magminių procesų metu; jis koncentruojasi, nusodinamas iš karštų gilių vandenų (kartu su S, Se, Sb, Fe, Co, Ni, Cu ir kitais elementais). Vulkanų išsiveržimų metu arsenas lakiųjų junginių pavidalu patenka į atmosferą. Kadangi arsenas yra daugiavalentis, jo migracijai didelę įtaką daro redokso aplinka. Oksiduojančiomis žemės paviršiaus sąlygomis susidaro arsenatai (As5+) ir arsenitai (As3+). Tai reti mineralai, randami tik arseno telkinių vietose. Vietinis arsenas ir As2+ mineralai yra dar mažiau paplitę. Iš daugybės arseno mineralų (apie 180) tik arsenopiritas FeAsS turi pirminę pramoninę reikšmę. Nedideli arseno kiekiai yra būtini gyvybei. Tačiau telkinio srityse
arseno ir jaunų ugnikalnių veiklos, dirvožemiuose kai kuriose vietose yra iki 1% arseno, kuris yra susijęs su gyvulių ligomis ir augmenijos mirtimi. Arseno kaupimasis ypač būdingas stepių ir dykumų kraštovaizdžiams, kurių dirvožemiuose arsenas yra neaktyvus. Drėgno klimato sąlygomis arsenas lengvai išplaunamas iš dirvožemio. Gyvojoje medžiagoje arseno vidutiniškai yra 3·10-5%, upėse 3·10-7%. Atnešė arseną
upės patenka į vandenyną, jis gana greitai nusėda. Jūros vandenyje tik 1·10-7 % arseno, o molyje ir skalūnuose – 6,6·10-4 %. Nuosėdinės geležies rūdos ir feromangano mazgeliai dažnai yra praturtinti arsenu.
Fizinės ir cheminės savybės. Arsenas turi keletą alotropinių modifikacijų. Normaliomis sąlygomis stabiliausias yra vadinamasis metalinis, arba pilkasis, arsenas (a-As) – plieniškai pilka trapi kristalinė masė; ką tik suskilęs, ore jis turi metalinį blizgesį, jis greitai išnyksta, nes yra padengtas plona As2O3 plėvele. Pilko arseno kristalinė gardelė yra romboedrinė ( A- 4,123 Å, kampas a – 54о10", X- 0,226), sluoksniuotas. Tankis 5,72 g/cm3(esant 20°C), elektrinė varža 35·10-8 ohm× m, arba 35·10-6 ohm× cm, elektrinės varžos temperatūros koeficientas 3,9·10-3 (0о-100 оC), Brinelio kietumas 1470 Mn/ m2 arba 147 kgf/mm2(3-4 pagal Mosą); Arsenas yra diamagnetinis. Esant atmosferos slėgiui, arsenas sublimuojasi 615 °C temperatūroje nelydydamas, nes trigubas taškas (žr. fazių diagramą) a-As yra 816 °C temperatūroje ir 36 °C slėgyje. adresu. Arseno garai susideda iš As4 molekulių iki 800?C, aukštesnėje nei 1700?C – tik As2. Arseno garams kondensuojantis ant skystu oru aušinamo paviršiaus susidaro geltonas arsenas – skaidrūs, minkšti kristalai kaip vaškas, kurių tankis 1,97 g/cm3, savo savybėmis panašus į baltąjį fosforą. Veikiant šviesai arba žemai šilumai, jis virsta pilku arsenu. Taip pat žinomos stiklinės-amorfinės modifikacijos: juodasis arsenas ir rudasis arsenas, kurie kaitinant virš 270 C virsta pilku M. Arseno atomo išorinių elektronų konfigūracija d 104s 24p 3. Arsenas junginiuose
turi oksidacijos laipsnius + 5, + 3 ir - 3. Pilkasis arsenas yra daug mažiau chemiškai aktyvus nei fosforas. Kaitinamas ore aukštesnėje nei 400°C temperatūroje, arsenas dega ir susidaro As2O3. Arsenas tiesiogiai jungiasi su halogenais; normaliomis sąlygomis AsF5 yra dujos; AsF3, AsCl3, AsBr3 – bespalviai, labai lakūs skysčiai; AsI3 ir As2l4 yra raudoni kristalai. Kaitinant arseną ir sierą, gaunami sulfidai: oranžinės raudonos spalvos As4S4 ir citrinos geltonumo As2S3. Blyškiai geltonas As2S5 sulfidas nusodinamas perleidžiant H2S į ledu aušinamą arseno rūgšties (arba jos druskų) tirpalą rūkstančiame druskos rūgštyje: 2H3AsO4 + 5H2S = As2S5 + 8H2O; Maždaug 500°C temperatūroje suyra į As2S3 ir sierą. Visi M. sulfidai netirpūs vandenyje ir praskiestose rūgštyse. Stiprūs oksidatoriai (HNO3 + HCl, HCl + KClO3 mišiniai) paverčia juos H3AsO4 ir H2SO4 mišiniu. As2S3 sulfidas lengvai tirpsta amonio ir šarminių metalų sulfiduose ir polisulfiduose, sudarydamas rūgščių druskas – tioarseno H3AsS3 ir tioarseno H3AsS4. Su deguonimi arsenas gamina oksidus: oksidą M. (III) As2O3 - arseno anhidridą ir oksidą M. (V) As2O5 - arseno anhidridą. Pirmasis iš jų susidaro deguoniui veikiant metalą arba jo sulfidus, pavyzdžiui, 2As2S3 + 9O2 - 2As2O3 + 6SO2. As2O3 garai kondensuojasi į bespalvę stiklinę masę, kuri laikui bėgant tampa nepermatoma dėl mažų kubinių kristalų susidarymo, tankis 3,865 g/cm3. Garų tankis atitinka formulę As4O6: aukštesnėje nei 1800°C temperatūroje garai susideda iš As2O3. Prie 100 G vanduo tirpsta 2.1 G As2O3 (esant 25oC). M. oksidas (III) yra amfoterinis junginys, kuriame vyrauja rūgštinės savybės. Yra žinomos druskos (arsenitai), atitinkančios ortoarseno rūgštis H3AsO3 ir metaarseno rūgštis HAsO2; pačios rūgštys nebuvo gautos. Vandenyje tirpsta tik šarminių metalų ir amonio arsenitai. As2O3 ir arsenitai paprastai yra reduktoriai (pavyzdžiui, As2O3 + 2I2 + 5H2O - 4HI + 2H3AsO4), bet gali būti ir oksidatoriai (pavyzdžiui, As2O3 + 3C - 2As + 3CO). Arseno(V) oksidas gaunamas kaitinant arseno rūgštį H3AsO4 (apie
200oC). Jis yra bespalvis ir maždaug 500°C temperatūroje skyla į As2O3 ir O2. Arseno rūgštis gaunama koncentruotą HNO3 veikiant As arba As2O3. Arseno rūgšties druskos (arsenatai) netirpsta vandenyje, išskyrus šarminių metalų ir amonio druskas. Yra žinomos druskos, atitinkančios ortoarseno H3AsO4, metaarseno HAsO3 ir piroarseno H4As2O7 rūgštis; paskutinės dvi rūgštys nebuvo gautos laisvoje būsenoje. Kai legiruotas su metalais, arsenas dažniausiai sudaro junginius (arsenidus).
Kvitas ir paraiška. Arsenas gaminamas pramoniniu būdu kaitinant arseno piritus:
FeAsS - FeS + As arba (rečiau) As2O3 redukcija anglimi. Abu procesai atliekami replikose iš
ugniai atsparus molis, prijungtas prie imtuvo arseno garams kondensuoti. Arseno anhidridas gaunamas oksidaciniu būdu skrudinant arseno rūdas arba kaip šalutinis produktas skrudinant polimetalines rūdas, kuriose beveik visada yra arseno. Oksidacinio skrudinimo metu susidaro As2O3 garai, kurie kondensuojasi surinkimo kamerose. Neapdorotas As2O3 išvalomas sublimuojant 500-600°C temperatūroje. Išgrynintas As2O3 naudojamas arseno ir jo preparatų gamybai.
Nedideli arseno priedai (0,2-1,0 % masės) dedami į šviną, naudojamą šūviams gaminti (arsenas padidina išlydyto švino paviršiaus įtempimą, dėl to šūvis įgauna sferinę formą; arsenas šiek tiek padidina kietumą švino). Kaip dalinis stibio pakaitalas, arsenas yra įtrauktas į kai kuriuos babbito ir spausdinimo lydinius. Grynas arsenas nėra nuodingas, bet visi jo junginiai, tirpūs vandenyje arba galintys
patenka į tirpalą veikiant skrandžio sultims, labai nuodingas; Arseno vandenilis yra ypač pavojingas. Iš gamyboje naudojamų arseno junginių arseno anhidridas yra toksiškiausias. Beveik visose spalvotųjų metalų sulfidinėse rūdose, taip pat geležies (sieros) pirite yra arseno priemaišos. Todėl jų oksidacinio skrudinimo metu kartu su sieros dioksidu SO2 visada susidaro As2O3; Didžioji jo dalis kondensuojasi dūmų kanaluose, tačiau nesant valymo įrenginių arba esant mažam efektyvumui, rūdos deginimo krosnių išmetamosios dujos išneša pastebimus As2O3 kiekius. Grynas arsenas, nors ir nėra nuodingas, laikant ore, visada yra padengtas toksiško As2O3 danga. Jei nėra tinkamo vėdinimo, metalų (geležies, cinko) ėsdinimas pramoninėmis sieros arba druskos rūgštimis, kuriose yra arseno, yra ypač pavojingas, nes taip susidaro arseninis vandenilis. Arsenas organizme. Arsenas yra visur kaip mikroelementas.
gyvojoje gamtoje. Vidutinis arseno kiekis dirvožemyje yra 4·10-4%, augalų pelenuose - 3·10-5%. Arseno kiekis jūros organizmuose yra didesnis nei sausumos organizmuose (žuvyse 0,6-4,7 mg 1 kilogramasžalios medžiagos kaupiasi kepenyse). Vidutinis arseno kiekis žmogaus organizme yra 0,08-0,2 mg/kg. Kraujyje arsenas koncentruojasi raudonuosiuose kraujo kūneliuose, kur jungiasi su hemoglobino molekule (o globino frakcijoje yra dvigubai daugiau nei hemo). Didžiausias jo kiekis (1 G audinys) yra inkstuose ir kepenyse. Daug arseno randama plaučiuose ir blužnyje, odoje ir plaukuose; santykinai mažai - smegenų skystyje, smegenyse (daugiausia hipofizėje), lytinėse liaukose ir kt. Audiniuose arseno randama pagrindinėje baltymų frakcijoje, daug mažiau rūgštyje tirpioje frakcijoje ir tik nedidelė jo dalis. lipidų frakcijoje. Arsenas dalyvauja redokso reakcijose: oksidaciniame kompleksinių angliavandenių skaidyme, fermentacijoje, glikolizėje ir kt. Arseno junginiai naudojami biochemijoje kaip specifiniai fermentų inhibitoriai metabolinėms reakcijoms tirti. Arsenas medicinoje. Organiniai arseno junginiai (aminarzonas, miarsenolis,
novarsenal, osarsol) daugiausia naudojami sifiliui ir pirmuonių ligoms gydyti. Neorganiniai arseno preparatai - natrio arsenitas (natrio arseno rūgštis), kalio arsenitas (kalio arseno rūgštis), arseno anhidridas As2O3, skiriami kaip bendrosios stiprinamosios ir tonizuojančios medžiagos. Naudojant lokaliai, neorganiniai arseno preparatai gali sukelti nekrozinį poveikį be ankstesnio dirginimo, todėl šis procesas yra beveik neskausmingas; ši savybė, kuri ryškiausia As2O3, naudojama odontologijoje
danties pulpos sunaikinimas. Neorganiniais arseno preparatais taip pat gydoma žvynelinė. Dirbtinai gauti radioaktyvieji izotopai M. 74As (T1/2 - 17,5 dienų) ir 76As (T1/2
26,8 h) naudojami diagnostikos ir gydymo tikslais. Jų pagalba išaiškinama smegenų auglių vieta ir nustatomas jų pašalinimo radikalumo laipsnis. Radioaktyvusis arsenas kartais naudojamas kraujo ligoms gydyti ir kt. Remiantis Tarptautinės radiacinės saugos komisijos rekomendacijomis,
didžiausias leistinas 76As kiekis organizme 11 Mccurie. Pagal SSRS priimtus sanitarinius standartus didžiausia leistina 76As koncentracija vandenyje ir atviruose rezervuaruose yra 1·10-7 curie/l, darbo patalpų ore 5·10-11 curie/l. Visi arseno preparatai yra labai nuodingi. Ūminio apsinuodijimo atveju pastebimas stiprus pilvo skausmas, viduriavimas, inkstų pažeidimas; Galimas kolapsas ir traukuliai. Lėtiniu apsinuodijimu dažniausiai pasireiškia virškinimo trakto sutrikimai, kvėpavimo takų gleivinės kataras (faringitas, laringitas, bronchitas), odos pažeidimai (egzantema, melanozė, hiperkeratozė), jautrumo sutrikimai; galimas aplazinės anemijos išsivystymas. Gydant apsinuodijimą arseno preparatais, unitiolis turi didžiausią reikšmę. Turėtų būti siekiama užkirsti kelią pramoniniam apsinuodijimui
visų pirma dėl technologinio proceso mechanizavimo, sandarinimo ir dulkių pašalinimo, efektyvios ventiliacijos sukūrimo ir darbuotojų aprūpinimo asmeninėmis apsaugos priemonėmis nuo dulkių poveikio. Būtina reguliariai tikrinti darbuotojų sveikatą. Preliminari medicininė apžiūra atliekama priimant į darbą, o darbuotojams – kartą per pusmetį.
ANTIMONIS(lot. Stibium), Sb, Mendelejevo periodinės sistemos V grupės cheminis elementas; atominis skaičius 51, atominė masė 121,75; Metalas yra sidabriškai baltas su melsvu atspalviu. Gamtoje žinomi du stabilūs izotopai: 121Sb (57,25%) ir 123Sb (42,75%). Iš dirbtinai gautų radioaktyviųjų izotopų svarbiausias yra 122Sb ( T 1/2 - 2,8 cym), 124Sb ( T 1/2 - 60,2 cym) ir 125Sb ( T 1/2 - 2 metai).
Istorinė nuoroda. Stibis buvo žinomas nuo seniausių laikų. Rytų šalyse jis buvo naudojamas maždaug 3000 m. e. indams gaminti. Senovės Egipte jau XIX a. pr. Kr e. Antakiams pajuodinti buvo naudojama stibio blizgučių pudra (natūrali Sb2S3), vadinama mesten arba koteliu. Senovės Graikijoje jis buvo žinomas kaip stími ir stíbi, taigi ir lotyniškas stibium. Maždaug 12-14 amžių. n. e. atsirado pavadinimas antimonas. 1789 metais A. Lavoisier įtraukė stibį į cheminių elementų, vadinamų antimoine, sąrašą (šiuolaikinis angliškas stibis, ispaniškas ir itališkas antimonio, vokiškas Antimonas). Rusiškas "stibis" kilęs iš turkiško sürme; tai žymėjo švino blizgučio miltelius PbS, kurie taip pat buvo naudojami antakiams juodinti (pagal kitus šaltinius „stibis“ - iš persų kalbos surme - metalas). Alchemikas Vasilijus Valentinas (Vokietija) pirmą kartą detaliai aprašo stibio ir jo junginių savybes bei gamybos būdus 1604 m. Paplitimas gamtoje. Vidutinis stibio kiekis žemės plutoje (clarke) 5 ×10-5
% pagal svorį. Stibis yra pasklidęs magmoje ir biosferoje. Iš karštų požeminių vandenų jis telkiasi hidroterminiuose telkiniuose. Yra žinomos pačios stibio nuosėdos, taip pat stibio-gyvsidabrio, stibio-švino, aukso-stibio ir stibio-volframo nuosėdos. Iš 27 stibio mineralų stibnitas (Sb2S3) turi didelę pramoninę reikšmę. . Dėl savo giminingumo su siera stibis dažnai randamas kaip priemaiša arseno, bismuto, nikelio, švino, gyvsidabrio, sidabro ir kitų elementų sulfiduose. Fizinės ir cheminės savybės. Stibis yra žinomas kristalinis ir trys
amorfinės formos (sprogiosios, juodos ir geltonos spalvos). Sprogstamasis stibis (tankis 5,64-5,97 g/cm 3) sprogsta bet kokio kontakto metu: susidaro tirpalo elektrolizės metu
SbCl3; juoda (tankis 5,3 g/cm 3) - su greitu stibio garų aušinimu; geltona – kai deguonis patenka į suskystintą SbH3. Geltonas ir juodas stibis yra nestabilūs, esant žemai temperatūrai, jie virsta paprastu stibiu. Stabiliausias kristalinis stibis , kristalizuojasi trigonalinėje sistemoje, A - 4,5064 ; tankis 6,61-6,73 g/cm 3 (skystas - 6,55 g/cm 3); t lyd. 630,5 °C; t kip1635-1645 °C; savitoji šiluminė talpa esant 20-100 °C 0,210 kJ/(kg × KAM ) ; šilumos laidumas esant 20 °C 17.6 W/M× K. Temperatūros tiesinio plėtimosi koeficientas polikristaliniam C. 11,5 × 10-6 esant 0-100 °C; vienam kristalui a1 - 8,1 × 10-a2 - 19,5 × 10-6 esant 0-400 °C, elektrinė varža (20 °C) (43,045 × 10-6 ohm× cm). Stibis yra diamagnetinis, specifinis magnetinis jautrumas -0,66 ×10-6. Skirtingai nuo daugelio metalų, stibis yra trapus, lengvai skyla išilgai skilimo plokštumų, sumalamas į miltelius ir negali būti kaltas (kartais jis priskiriamas pusmetaliams). . Mechaninės savybės priklauso nuo metalo grynumo. Brinelio kietumas lietam metalui 325-340 Mn/m 2 (32,5-34,0 kgf/mm 2); tamprumo modulis 285-300; tempiamasis stipris 86,0 Mn/m 2 (8,6 kgf/mm 2). Sb5s25r3 atomo išorinių elektronų konfigūracija. Junginiuose daugiausia oksidacijos laipsniai yra +5, +3 ir -3. Chemiškai stibis yra neaktyvus. Neoksiduoja ore iki
lydymosi temperatūra. Stibis nereaguoja su azotu ir vandeniliu. Anglis šiek tiek ištirpsta išlydytame stibe. Metalas aktyviai sąveikauja su chloru ir kitais halogenais, sudarydamas stibio halogenidus. Reaguoja su deguonimi aukštesnėje nei 630 °C temperatūroje, sudarydamas Sb2O3 . Susiliejus su siera, gaunami stibio sulfidai, jis taip pat sąveikauja su fosforu ir arsenu. Stibis yra atsparus vandeniui ir atskiestoms rūgštims. Koncentruotos druskos ir sieros rūgštys lėtai ištirpdo stibį, kad susidarytų SbCl3 chloridas ir Sb2 (SO4)3 sulfatas; koncentruota azoto rūgštis oksiduoja stibį iki aukštesnio oksido, kuris susidaro hidratuoto junginio xSb2O5 ×yH2O pavidalu. Praktiškai įdomios mažai tirpios stibio rūgšties druskos - antimonatai (MeSbO3 × 3H2O, kur Me yra Na, K) ir neišskirtos metaantimono rūgšties druskos - metaantimonitai (MeSbO2 × 3H2O), turinčios redukuojančių savybių. S. jungiasi su metalais ir susidaro antimonidai. Kvitas. Stibis gaunamas pirometalurginiais ir hidrometalurginiais metodais
koncentratų arba rūdos, turinčios 20-60 % Sb, perdirbimas. Pirometalurginiai metodai apima nusodinimą ir redukcinį lydymą. Kritulių lydymo žaliavos yra sulfidų koncentratai; procesas pagrįstas stibio išstūmimu iš jo sulfido geležimi: Sb2S3 + 3Fe Û 2Sb + 3FeS. Geležis į įkrovą įvedama laužo pavidalu. Lydymas atliekamas reverberacinėse arba trumpai besisukančiose būgninėse krosnyse 1300-1400 °C temperatūroje. Stibio atgavimas į neapdorotą metalą yra daugiau nei 90%. Redukcinis stibio lydymas pagrįstas jo oksidų redukavimu į metalą anglies arba anglies dulkėmis ir atliekų uolienų šlakavimu. Prieš redukcinį lydymą vyksta oksidacinis skrudinimas 550 °C temperatūroje su oro pertekliumi. Pelenuose yra nelakaus stibio tetroksido. Elektrinės krosnys gali būti naudojamos tiek nusodinimui, tiek redukavimui. Hidrometalurginis stibio gamybos būdas susideda iš dviejų etapų: žaliavos apdorojimas šarminiu sulfido tirpalu, stibio perkėlimas į tirpalą stibio rūgščių ir sulfosalų druskų pavidalu ir stibio atskyrimas. elektrolizė. Grubus stibis, priklausomai nuo žaliavos sudėties ir jo gamybos būdo, turi nuo 1,5 iki 15% priemaišų: Fe, As, S ir kt. Grynam stibiui gauti naudojamas pirometalurginis arba elektrolitinis valymas. Pirometalurginio rafinavimo metu geležies ir vario priemaišos pašalinamos sieros junginių pavidalu, į stibio lydalą įvedant antimonitą (crudum) - Sb2S3, o po to arsenas (natrio arsenato pavidalu) ir siera pašalinami pučiant orą po vamzdžiu. sodos šlakas. Atliekant elektrolitinį rafinavimą tirpiu anodu, šiurkštus stibis išvalomas iš geležies, vario ir kitų metalų, likusių
elektrolitas (Cu, Ag, Au lieka dumble). Elektrolitas yra tirpalas, sudarytas iš SbF3, H2SO4 ir HF. Rafinuotame stibio priemaišų kiekis neviršija 0,5-0,8%. Norint gauti didelio grynumo stibį, zoninis lydymas naudojamas inertinių dujų atmosferoje arba stibis gaunamas iš iš anksto išgrynintų junginių – trioksido arba trichlorido. Taikymas. Stibis daugiausia naudojamas švino ir alavo lydinių pavidalu
akumuliatoriaus plokštėms, kabelių apvalkalams, guoliams (babbitt) , lydiniai, naudojami spaudoje (hartas) , tt Tokie lydiniai turi padidintą kietumą, atsparumą dilimui ir atsparumą korozijai. Liuminescencinėse lempose Sb aktyvuojamas kalcio halofosfatu. Stibis yra įtrauktas į puslaidininkines medžiagas kaip priedas germaniui ir siliciui, taip pat antimoniduose (pavyzdžiui, InSb). Radioaktyvusis izotopas 12Sb naudojamas g spinduliuotės ir neutronų šaltiniuose. Stibis organizme. Stibio kiekis (100 G sausosios medžiagos) yra
augalai 0,006 mg, jūrų gyvūnuose 0,02 mg, sausumos gyvūnuose 0,0006 mg. Stibis į gyvūnų ir žmonių organizmą patenka per kvėpavimo sistemą arba virškinamąjį traktą. Jis išsiskiria daugiausia su išmatomis ir nedideliais kiekiais su šlapimu. Biologinis stibio vaidmuo nežinomas. Jis selektyviai koncentruojasi skydliaukėje, kepenyse ir blužnyje. Eritrocituose stibis daugiausia kaupiasi oksidacijos būsenoje + 3, kraujo plazmoje - oksidacijos būsenoje + 5. Didžiausia leistina koncentracija C. 10-5 - 10-7 G iki 100 G sausu skudurėliu. Didesnėmis koncentracijomis šis elementas inaktyvuoja daugybę lipidų, angliavandenių ir baltymų metabolizmo fermentų (galbūt dėl sulfhidrilo grupių blokavimo). . Medicinos praktikoje naudojami stibio preparatai (soliusurminas ir kt.).
daugiausia leišmaniozei ir kai kurioms helmintozėms (pavyzdžiui, šistosomiozei) gydyti. Stibis ir jo junginiai yra nuodingi. Lydant koncentratą galima apsinuodyti
stibio rūdos ir stibio lydinių gamyboje. Ūminio apsinuodijimo atveju - viršutinių kvėpavimo takų, akių ir odos gleivinių sudirginimas. Gali išsivystyti dermatitas, konjunktyvitas ir kt. Gydymas: priešnuodžiai (unitiolis), diuretikai ir prakaitavimas ir kt. Profilaktika: gamybos mechanizavimas. procesai, efektyvi ventiliacija ir kt.
BISMUTAS(lot. Bismutas), Bi, V periodinės grupės cheminis elementas
Mendelejevo sistema; atominis skaičius 83, atominė masė 208,980; sidabriškai pilkas metalas su rausvu atspalviu. Natūralų bismutą sudaro vienas stabilus izotopas 209Bi. V. buvo žinomas XV-XVI a., tačiau ilgą laiką buvo laikomas alavo rūšimi,
švino arba stibio. Bismutas buvo pripažintas nepriklausomu metalu XVIII amžiaus viduryje. Prancūzų chemikas A. Lavoisier įtraukė jį į paprastų kūnų sąrašą. Vardo „bismutas“ kilmė nenustatyta. Bismuto kiekis žemės plutoje yra 2·10-5 % masės. Bismutas randamas natūraliai
daugybės mineralų pavidalu, iš kurių svarbiausi yra bismuto blizgesys Bi2S3, vietinis bismutas Bi, bismitas Bi2O3 ir kt. Didesniais kiekiais, bet nedidelėmis koncentracijomis, bismutas randamas kaip izomorfinė priemaiša švino-cinko, vario, molibdeno sudėtyje. - kobalto ir alavo-volframo rūdos. Apdorojant polimetalines rūdas, apie 90 % viso pasaulio suvartojama bismuto gamyba. Fizinės ir cheminės savybės. Bismutas turi romboedrinę gardelę su
laikotarpį a- 4,7457 A ir kampas α-57?14 " 13"" . Tankis 9,80 g/cm 3; t pl 271,3°C; t kip 1560 °C. Savitoji šiluminė talpa (20 °C) 123,5 J/kg K (0,0294 kal/g·SU); šiluminis koeficientas
tiesinis plėtimasis kambario temperatūroje 13,3·10-6; šilumos laidumas (20°C) 8.37 W/(m·Į) ; varža elektrinė (20°C) 106,8 10-8 ohm· m(106,8·10-6 ohm· cm). Bismutas yra labiausiai diamagnetinis metalas. Specifinis magnetinis jautrumas yra -1,35·10-6. Veikiant magnetiniam laukui, bismuto elektrinė varža padidėja labiau nei kitų metalų, kurie naudojami stiprių magnetinių laukų indukcijai matuoti. Šiluminio neutronų gaudymo bismuto skerspjūvis yra mažas (34 10-31 m 2 arba 0,034 tvartas). Kambario temperatūroje bismutas yra trapus, lengvai skyla išilgai skilimo plokštumų ir porceliano skiedinyje sumalamas į miltelius. Kalimas 120-150°C temperatūroje; karšto presavimo būdu (esant 240-250°C) galima pagaminti iki 0,1 skersmens vielą mm, taip pat plokštės, kurių storis 0,2-0,3 mm. Brinelio kietumas 93 Mn/m 2 (9,3 kgf/mm 2), pagal Moso 2.5. Lydant V. tūris sumažėja 3,27%. Bismutas yra stabilus sausame ore, tačiau drėgname ore jo paviršius
oksidacija. Kaitinamas aukštesnėje nei 1000 °C temperatūroje, jis dega melsva liepsna, sudarydamas Bi2O3 oksidą . Įtampos serijoje bismutas stovi tarp vandenilio ir vario, todėl netirpsta praskiestose sieros ir druskos rūgštyse; ištirpsta koncentruotose sieros ir azoto rūgštyse, kai išsiskiria SO2 ir atitinkami azoto oksidai. Bismuto valentingumas yra 2, 3 ir 5. Mažesnio valentingumo bismuto junginiai
turi bazinį pobūdį, aukštesni yra rūgštūs. Iš deguonies junginių pasaulyje svarbiausias yra trioksidas Bi2O3, kuris kaitinant pakeičia geltoną spalvą į raudonai rudą. Bi2O3 naudojamas bismuto druskoms gauti. Atskiestuose tirpaluose bismuto druskos hidrolizuojasi. BiCl3 chloridas hidrolizuojamas nusodinant oksichloridą BiOCl, Bi nitratas (NO3)3 - nusodinant pagrindinę druską BiONO3·BiOOH. Jo gryninimui naudojamas V. druskų gebėjimas hidrolizuotis. Sunku gauti 5-valenčio bismuto junginius; jie yra stiprūs oksidatoriai. KBiO3 druska (atitinka anhidridą Bi2O5) susidaro rudai raudonų nuosėdų pavidalu ant platinos anodo elektrolizės metu verdant KOH, KCl ir Bi2O3 mišinio tirpalą. Bismutas lengvai derinamas su halogenais ir siera. Kai rūgštys veikia bismuto ir magnio lydinį, susidaro bismutas (bismuto vandenilis) BiH3; Skirtingai nuo arsino AsH3, bismutas yra nestabilus junginys ir nebuvo gautas gryna forma (be vandenilio pertekliaus). Su kai kuriais metalais (švinu, kadmiu, alavu) bismutas sudaro mažai tirpstančią eutektiką; su natriu, kaliu, magniu ir kalciu - intermetaliniai junginiai, kurių lydymosi temperatūra yra žymiai aukštesnė už pradinių komponentų lydymosi temperatūrą. Bismutas nesąveikauja su išlydytu aliuminiu, chromu ir geležimi. Kvitas ir paraiška. Pagrindinis bismuto kiekis susidaro kaip šalutinis produktas
neapdoroto švino rafinavimas ugnimi (werkbley). Pirometalurginis metodas pagrįstas bismuto gebėjimu sudaryti ugniai atsparius intermetalinius junginius su K, Na, Mg ir Ca. Nurodytų metalų dedama į išlydytą šviną ir susidarę kietieji junginiai su V. (nuodegomis) atskiriami nuo lydalo. Nemaža dalis bismuto išgaunama iš dumblo, susidariusio elektrolitinio švino rafinavimo hidrofluorsilicio tirpale, taip pat iš dulkių ir dumblo, susidarančio gaminant varį. Bismuto turinčios nuodegos ir dumblai lydomi po šarminiais šlakais. Gautame neapdorotame metale yra As, Sb, Cu, Pb, Zn, Se, Te, Ag ir kai kurių kitų elementų priemaišų. Bismuto lydymas iš savo rūdų atliekamas nedideliu mastu. Sulfido rūdos apdorojamos nusodinant lydymosi būdu su geležies laužu. Iš oksiduotų rūdų auksas redukuojamas anglimis po mažai tirpstančio srauto sluoksniu. Grubiai valant šiurkštų vandenį, jie naudojami priklausomai nuo priemaišų sudėties.
įvairūs metodai: zeigerizacija, oksidacinis valymas šarminiais srautais, lydymas su siera ir kt. Sunkiausiai atskiriama švino priemaiša (iki 0,01%) pašalinama pučiant chlorą per išlydytą metalą. Komercinio bismuto sudėtyje yra
99,9-99,98% netauriųjų metalų. V. didelio grynumo gaunami zoninės perkristalizacijos būdu kvarcinėse valtyse inertinių dujų atmosferoje. Nemažai bismuto sunaudojama ruošiant žemo lydymosi lydinius, kuriuose yra švino, alavo, kadmio, kurie naudojami dantų protezavimui, klišėms iš medinių matricų gaminti, kaip automatinių gaisro gesinimo prietaisų išlydomiems dangteliams, lituojant dangtelius ant šarvus pradurtų sviedinių ir kt. Išlydytas bismutas gali būti naudojamas kaip aušinimo skystis branduoliniuose reaktoriuose. Bismuto vartojimas junginiuose su Te už
termoelektriniai generatoriai. Šie junginiai dėl palankaus šilumos laidumo, elektros laidumo ir termoelektrovaros jėgos derinio leidžia dideliu efektyvumu (~7%) šiluminę energiją paversti elektros energija. Pridėjus bismuto į nerūdijantį plieną, pagerėja jų apdirbamumas. Bismuto junginiai naudojami stiklo gamyboje, keramikoje, farmacijoje
industrija. Tirpios bismuto druskos yra nuodingos ir turi panašų poveikį kaip gyvsidabris.
Literatūra
1. Kenksmingos medžiagos pramonėje, bendrai. red. N. V. Lazareva, 6 leidimas, 2 dalis, Leningradas, 1971 m.
2. Ivanovas V.V. Ekologinė elementų geochemija. 3. Naujos stibio ir jo gamybos technologijos sukūrimo tyrimai
junginiai, rinkinyje: Stibio chemija ir technologija, Prancūzija, 1965. 4. Trumpa cheminė enciklopedija, t. 5, M., 1967; 5. Nekrasov B.V., Bendrosios chemijos pagrindai, t. 1, M., 1965; 6. Pogodin S.A., Arsenic, knygoje: Brief Chemical Encyclopedia, vol 3, M., 1964 7. Remy G., Course of Neorganic Chemry, vert. iš vokiečių k., 1 t., M., 1963, p. 700-712; 8. Thomson J. G., Bismutas, vert. [iš anglų kalbos], L., 1932; 9. Shiyanov A.G., Stibio gamyba, M., 1961; Metalurgijos pagrindai, t. 5, M.,
1968 m.; 10. Surišto azoto chemija ir technologija, [M.-L.], 1934; KHE, t. 1, M., 1961 m.
Azoto pogrupį sudaro penki elementai: azotas, fosforas, arsenas, stibis ir bismutas. Tai yra D.I. Mendelejevo periodinės sistemos V grupės p-elementai.
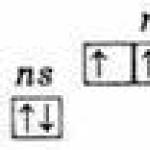
Išoriniame energijos lygyje šių elementų atomai turi penkis elektronus, turinčius ns2np3 konfigūraciją ir pasiskirstę taip:

Todėl aukščiausia šių elementų oksidacijos būsena yra +5, žemiausia -3, taip pat būdinga +3.
Trijų nesuporuotų elektronų buvimas išoriniame lygyje rodo, kad nesužadintoje būsenoje elementų atomų valentingumas yra 3. Išorinis azoto atomo lygis susideda tik iš dviejų polygių – 2s ir 2p. Likusių šio pogrupio elementų atomai turi laisvų d-polygio ląstelių išoriniuose energijos lygiuose. Vadinasi, vienas iš išorinio lygio s-elektronų, sužadinus, gali pereiti į to paties lygio d-sublygį, dėl ko susidaro 5 nesuporuoti elektronai.

išorinis fosforo elektroninis apvalkalas (nesudrintas atomas)

sužadinto fosforo atomo išorinis elektronų apvalkalas.
Taigi, fosforas, arsenas, stibis ir bismutas sužadintoje būsenoje turi 5 nesuporuotus elektronus, o jų valentingumas šioje būsenoje yra 5.
Azoto atome elektrono tokiu būdu sužadinti neįmanoma, nes antrajame lygyje nėra d-polygio. Todėl azotas negali būti penkiavalentis, bet gali sudaryti ketvirtą kovalentinę jungtį donoro-akceptoriaus mechanizmu dėl vienišos elektronų poros 2s2. Kitas procesas taip pat galimas azoto atomui. Pašalinus vieną iš dviejų 2s elektronų, azotas virsta viengubo krūvio keturiavalenčiu jonu N+.

Nuo azoto iki bismuto didėja atomų spinduliai, mažėja jonizacijos potencialai. Neutralių atomų redukcijos savybės didėja nuo N iki Bi, o oksidacinės savybės susilpnėja (žr. 21 lentelę).
Su vandeniliu, azotu, fosforu ir arsenu susidaro poliniai junginiai RH3, kurių oksidacijos būsena yra neigiama -3. RH3 molekulės yra piramidės formos. Šiuose junginiuose elementų ryšiai su vandeniliu yra stipresni nei atitinkamuose deguonies pogrupio ir ypač halogeno pogrupio elementų junginiuose. Todėl azoto pogrupio elementų vandenilio junginiai vandeniniuose tirpaluose nesudaro vandenilio jonų.

Su deguonimi azoto pogrupio elementai sudaro oksidus, kurių bendra formulė R2O3 ir R2O5. Oksidai atitinka rūgštis HRO2 ir HRO3 (ir orto rūgštis H3RO4, išskyrus azotą). Pogrupio viduje oksidų pobūdis kinta taip: N2O3 – rūgštinis oksidas; Р4О6 - silpnai rūgštus oksidas; As2O3 yra amfoterinis oksidas, turintis vyraujančias rūgštines savybes; Sb2O3 yra amfoterinis oksidas, kuriame vyrauja pagrindinės savybės; Bi2O3 yra pagrindinis oksidas. Taigi, didėjant elemento atominiam skaičiui, mažėja R2O3 ir R2O5 sudėties oksidų rūgštinės savybės.
Kaip matyti iš lentelės. 21, pogrupyje nuo azoto iki bismuto nemetalinės savybės mažėja ir metalinės savybės didėja. Stibio šios savybės išreiškiamos vienodai, bismute vyrauja metalinės, o azoto – nemetalinės savybės. Fosforas, arsenas ir stibis sudaro keletą alotropinių junginių.
Azotas.
Kvitas
Laboratorijose jį galima gauti amonio nitrito skilimo reakcijos būdu:
Reakcija egzoterminė, išsiskiria 80 kcal (335 kJ), todėl jai vykstant indas turi būti atvėsintas (nors amonio nitritas turi būti kaitinamas, kad prasidėtų reakcija).
Praktiškai ši reakcija atliekama į pašildytą sočiųjų amonio sulfato tirpalą lašinant įlašinant prisotintą natrio nitrito tirpalą, o mainų reakcijos metu susidaręs amonio nitritas akimirksniu suyra.
Šiuo atveju išsiskiriančios dujos yra užterštos amoniaku, azoto oksidu (I) ir deguonimi, iš kurių jos išvalomos paeiliui leidžiant per sieros rūgšties, geležies (II) sulfato tirpalus ir per karštą varį. Tada azotas išdžiovinamas.
Kitas laboratorinis azoto gamybos būdas yra kalio dichromato ir amonio sulfato mišinio kaitinimas (santykiu 2:1 pagal svorį). Reakcija vyksta pagal lygtis:
Gryniausias azotas gali būti gaunamas skaidant metalų azidus:
Vadinamasis „oro“ arba „atmosferos“ azotas, tai yra azoto ir inertinių dujų mišinys, gaunamas reaguojant orui su karštu koksu, iš kurio susidaro vadinamosios „generatoriaus“ arba „oro“ dujos - žaliava. cheminei sintezei ir kurui . Jei reikia, azotą nuo jo galima atskirti absorbuojant anglies monoksidą.
Molekulinis azotas gaminamas pramoniniu būdu, frakciniu būdu distiliuojant skystą orą. Šis metodas taip pat gali būti naudojamas „atmosferos azotui“ gauti. Taip pat plačiai naudojami azoto įrenginiai ir stotys, kuriose naudojamas adsorbcijos ir membraninio dujų atskyrimo metodas.
Vienas iš laboratorinių metodų yra amoniako perdavimas per vario (II) oksidą ~700 °C temperatūroje:
Amoniakas paimamas iš jo prisotinto tirpalo kaitinant. CuO kiekis yra 2 kartus didesnis nei apskaičiuotas. Prieš pat naudojimą azotas išvalomas iš deguonies ir amoniako, praleidžiant per varį ir jo oksidą (II) (taip pat ~700 °C), po to džiovinamas koncentruota sieros rūgštimi ir sausu šarmu. Procesas gana lėtas, bet vertas: gautos dujos labai švarios.
Fig. 15.12 paveiksle parodyta penkių V grupės elementų vieta periodinėje lentelėje. Visi jie yra p-elementai, o jų atomų išorinis apvalkalas pasižymi elektronų konfigūracija. Lentelėje 15.10 parodytos kai kurios V grupės elementų savybės. Kai pereinate į šios grupės apačią, jos elementų savybės keičiasi iš nemetalinių į metalines. Azotas ir fosforas yra tipiški nemetalai. Arsenas ir stibis turi metalo požymius, o bismutas yra metalas.
AZOTAS IR FOSFORAS
Tai du svarbiausi elementai V grupėje.
Įprastomis sąlygomis azotas yra dujos, susidedančios iš dviatomės

Ryžiai. 15.12. V grupės elementų padėtis periodinėje lentelėje.
15.10 lentelė. V grupės elementų savybės

molekulių Jis yra bespalvis, bekvapis ir beskonis ir neturi pastebimo reaktyvumo.
Fosforas yra trijų alotropinių formų, iš kurių dvi labiausiai paplitusios yra raudonasis fosforas ir mažiau stabilus baltas fosforas. Šių alotropų struktūra buvo aptarta sektoje. 3.2. Lentelėje 15.11 palygintos kai kurios raudonojo ir baltojo fosforo savybės.
Nors azotas yra vienas elektroneigiamiausių elementų (žr. 2.2 lentelę), jo reaktyvumas yra palyginti mažas. Priežastis ta, kad jo dviatomės molekulės yra nepolinės, o trigubas ryšys tarp dviejų atomų
15.11 lentelė. Baltojo ir raudonojo fosforo savybės


Ryžiai. 15.13. Keturios hibridinės azoto atomo orbitos.
Juose esantis azotas turi labai didelį stiprumą. Šios jungties entalpija yra + 944 kJ/mol.
Ir azotas, ir fosforas gali patekti į savo junginius, kurių oksidacijos būsena yra nuo -3 iki 4-5. Pavyzdžiui, amoniake azoto oksidacijos laipsnis yra +3, o nitratų jonuose - -1-5.
Abiejų šių elementų atomai gali prijungti tris elektronus, todėl užpildomas jų išorinis posluoksnis; dėl to susidaro nitrido jonai ir fosfido jonai Tačiau abu elementai linkę formuoti kovalentinius junginius. Šiuo atveju jų atomai sudaro keturias hibridines -orbitales, kurių kiekviena turi tetraedrinę orientaciją (15.13 pav.). Trijose iš šių orbitų yra vienas elektronas. Būtent šie elektronai yra dalijami formuojant kovalentinius ryšius su kitų atomų elektronais. Ketvirtoje orbitoje yra vieniša elektronų pora. Jis gali būti naudojamas koordinaciniam (donoro-akceptoriaus) ryšiui suformuoti. Pavyzdžiui, amonio jone vieniša azoto pora persidengia su laisva vandenilio jono orbitale.
ns 2 np 3.
AZOTAS ir jo junginiai
Gamtoje jis randamas laisvos formos (78 tūrio proc. ore), mineralų (druskos) pavidalu, aliejuje, augaliniuose ir gyvūniniuose baltymuose.
Fizinės savybės
Normaliomis sąlygomis N 2 yra bespalvės, bekvapės ir beskonės dujos.
t o kip. = -195,8 o C.
Azoto gamyba:
a) pramonėje - oro skystinimas,
b) laboratorijoje: NH 4 NO 2 ® N 2 + H 2 O.
Azoto ir jo junginių cheminės savybės.
Molekulinio azoto cheminis aktyvumas yra labai mažas, nes trigubo kovalentinio ryšio dėka molekulė yra labai stipri (E jungtis = 946 kJ/mol). Tačiau yra žinoma daug skirtingų azoto junginių, kuriuose jis turi oksidacijos būsenas -3, -2, -1, +1, +2, +3, +4, +5.
Azoto junginiai, turintys neigiamą oksidacijos būseną.
3
1)NH 3 – amoniakas– bespalvės aštraus kvapo dujos, lengvai suskystintos.
Amoniako gamyba:
a) N 2 + 3H 2 « 2NH 3 (Kat: Fe, Al 2 O 3, K 2 O)
b) 2NH 4 CI + Ca(OH) 2 = CaCI 2 + 2NH 3 + 2H 2 O
Cheminės amoniako savybės:
a) NH 3 + H 2 O « NH 4 OH (didžiausia koncentracija = 25 %)
b) NH 3 + HCI « NH 4 CI (nepakankamas mechanizmas: NH 3 + H + = NH 4 +)
c) degimas vyksta skirtingai, priklausomai nuo deguonies kiekio:
4NH3 + 3O 2 (savaitė) = 2N2 + 6H2O
4NH3 + 5О 2(g) = 2NO+ 6H2O
d) OVR amoniakas visada yra reduktorius:
3CuO + 2NH3 = 3Cu + N2 + 3H2O
2) NH 4 OH – amonio hidroksidas- silpna bazė, nestabili, gerai sudaro sudėtingus junginius (amoniaką):
Cu(OH)2 + 4NH4OH = (OH)2 + 4H2O
3) Amonio druskos:
a) tirpalai dėl hidrolizės turi šiek tiek rūgštinę reakciją:
NH 4 CI + HON « NH 4 OH + HCI (NH 4 + + HON « NH 4 OH + H +)
b) terminis amonio druskų skilimas vyksta skirtingai, priklausomai nuo anijono pobūdžio: jei anijonas yra oksidatorius, tada skilimo reakcija yra negrįžtama:
NH 4 CI « NH 3 + HCI
NH 4 NO 3 = N 2 O+ 2H 2 O
4) Amidai susidaro, kai H atomai amoniake pakeičiami metalu:
2K + 2NH3 = 2KNH2 + H2
5) Nitridaižinomi dėl metalų ir nemetalų ir, priklausomai nuo jų pobūdžio, skaidosi skirtingai:
a) Li 3 N + 3 H 2 O = 3 LiOH + NH 3
Ca3N2 + 6HCI = 3CaCI2 + 2NH3
b) CI 3 N + 6HCI = 3HCIO + NH 3
Oksidacijos būsena - 2
N 2 H 4 – hidrazinas(diamidas) yra bespalvis skystis, geras tirpiklis, mažiau stabilus nei amoniakas.
Hidrazino paruošimas:
2NH3 + NaCIO = N 2 H 4 + NaCI + H 2 O
Cheminės hidrazino savybės:
N 2 H 4 + H 2 O « + +OH -
H 2 O « 2+ +OH -
b) Dega iki azoto: N 2 H 4 + O 2 = N 2 + 2H 2 O
c) Stiprus reduktorius: N 2 H 4 + 2H 2 O 2 = N 2 + 4H 2 O
Oksidacijos būsena - 1
NH 2 OH – hidroksilaminas, balta kristalinė medžiaga, užima tarpinę padėtį tarp H 2 O 2 ir hidrazino N 2 H 4.
Hidroksilamino paruošimas:
HNO3 + 6H = NH2OH + 2H2O
Cheminės hidroksilamino savybės:
a) Vandeniniai tirpalai – silpnos bazės:
NH 2 OH + H 2 O « + +OH -
b) Hidroksilammonio druskos (stabilios) pateikiamos su rūgštimis:
NH 2 OH + HCI = + + CI -
c) suyra (disproporcingumo reakcija):
3NH2OH = NH3 + N2 + 3H2O
d) Kaip ir H 2 O 2, priklausomai nuo aplinkos, jis turi redokso dvilypumą:
Gerai: 2NH 2OH + 4FeSO 4 + 3H 2 SO 4 = 2Fe 2 (SO 4) 3 + (NH 4) 2 SO 4 + 2H 2 O
atkurta: 2NH 2OH + I 2 + 2KOH = N 2 + 2KI + 4H 2 O
Svarbiausi azoto junginiai, turintys teigiamą s. O.
Oksidacijos būsena + 3
1) N 2 O 3- azoto oksidas (III) arba „azoto anhidridas“ yra nestabilus mėlynai žalias skystis:
a) N 2 O 3 ® NO 2 (rudos aštraus kvapo dujos) + NO (bespalvės dujos);
b) su vandeniu sudaro nestabilią rūgštį: N 2 O 3 + H 2 O « 2 HNO 2
2) HNO2– azoto rūgštis (vidutinio stiprumo):
HNO 2 « H + + NO 2 - (K = 5,1 . 10 -4).
3) Nitritai– azoto rūgšties druskos, kaip ir kiti N +3 junginiai, vykstantys redokso reakcijose, turi dvilypumą:
Gerai: KNO 2 + NH 3 = N 2 + H 2 O
atkurta: KNO 2 + H 2 O 2 = KNO 3 + H 2 O
Maksimali oksidacijos būsena + 5
1) N 2 O 5- azoto oksidas (V) arba „azoto anhidridas“ yra bespalvė kristalinė medžiaga; Ištirpus vandenyje, susidaro rūgštis.
2) HNO3– azoto rūgštis, stipri: HNO 3 ® H + + NO 3 - .
3) Nitratai– azoto rūgšties druskos:
a) laboratorijoje N 2 O galite gauti terminio skilimo reakcijos būdu: NH 4 NO 3 ® N 2 O + H 2 O;
b) metalo nitratai, priklausomai nuo metalo padėties aktyvumo serijoje, skaidosi skirtingai:
į kairę Mg: nitratas ® nitritas + O 2
Mg – Cu: nitratas ® metalo oksidas + NO 2 + O 2
į dešinę Cu: nitratas ® metalas + NO 2 + O 2 .
4) visi N +5 junginiai yra stiprūs oksidatoriai; azoto rūgšties sąveika su metalais:
a) joks metalas neišskiria vandenilio iš HNO 3;
b) esant normaliai t o metalai Al, Zn, Cr, Fe, Pb, Au, Pt pasyvinami;
c) kaitinamas, jis sąveikauja su dauguma metalų, o kuo aktyvesnis metalas ir kuo praskiestesnė rūgštis, tuo stipresnis N +5 redukavimas:
neaktyvus Meh: Cu + 4HNO 3 (konc.) = Cu (NO 3) 2 + 2NO 2 + 2H 2 O
3Cu + 8HNO 3 (dil.) = 3Cu(NO 3) 2 + 2NO + 4H 2 O
turto. Meh: 4Ca + 10HNO3 (konc.) = 4Ca (NO 3) 2 + N 2 O + 5H 2 O
5Ca + 12HNO3 (praskiestas) = 5Ca(NO3)2 + N2 + 6H2O
4Ca + 9HNO 3 (ultra praskiedimas) = 4Ca(NO 3) 2 + NH 3 (arba NH 4 NO 3) + 3H 2 O
FOSFORAS ir jo junginiai
Gamtoje randama: a) mineralų (fosforitų ir apatitų) pavidalu, b) augaliniuose ir gyvūniniuose baltymuose, c) smegenų audinyje ir kauluose.
Fizinės savybės
Allotropenas:
A) baltasis fosforas(P 4) – tetraedrinės struktūros, nuodingas, švyti tamsoje, tirpus anglies disulfide; laikant jis palaipsniui virsta raudonuoju fosforu, todėl laikomas po vandeniu;
b) raudonasis fosforas(P 2 n – polimeras) – yra keletas struktūros formų, netoksiškas, netirpus anglies disulfide, stabilus sandėliuojant, mažiau reaktyvus;
V) juodasis fosforas– piramidės struktūros, sluoksniuotas, panašus į grafitą, puslaidininkinis.
Fosforo gavimas:
Fosforito mineralas deginamas koksu ir smėliu:
Ca 3 (PO 4) + 5C + 3 SiO 2 = 3CaSiO 3 + 2P + 5CO
Fosforo ir jo junginių cheminės savybės.
Fosforo cheminis aktyvumas skiriasi priklausomai nuo jo alotropinės modifikacijos. Pagrindinės oksidacijos būsenos: -3, +1, +3, +5.
1) Fosforo reakcijos su paprastomis medžiagomis:
atkuriamosios savybės: a)P + O2® P2O3, P2O5;
b)P + CI 2 ® PCI 3, PCI 5; c) 2P + 3S ® P 2 S 3
Oksidacinės savybės: a) 2P + 3H 2 ® 2РН 3, b) 2P + 3Ca ® Ca 3 P 2
2) Fosforo reakcijos su sudėtingomis medžiagomis:
a) nevyksta reakcija su vandeniu,
b) 2P + 5H 2 SO 4 (konc.) ® 2H 3 PO 4 + 5SO 2 + 2H 2 O,
c) P + HNO 3 (konc.) ® H 3 PO 4 + NO (arba NO 2).
3)Minimali oksidacijos būsena - 3
A) PH 3- fosfinas, nuodingos dujos, turinčios česnako kvapą,
apšviesta: 2РH 3 + 4О 2 = Р 2 О 5 + 3H 2 O,
su kai kuriomis rūgštimis suteikia fosfonio druskų: РH 3 + HI = РH 4 I
b) metalo fosfidai– jonokovalentiniai junginiai
Mg 3 P 2 + 6 H 2 O = Mg(OH) 2 + 2PH 3,
Ca 3 P 2 + 6HCI = CaCI 2 + 2PH 3.
4)Oksidacijos būsena + 1
H 3 PO 2 arba H[PO 2 H 2 ] – hipofosforo rūgštis, stipri; druskos yra hipofosfitai, labai tirpūs, geri reduktoriai.
5)Oksidacijos būsena + 3
a) P 2 O 3 – fosforo anhidridas, turi keletą modifikacijų (P 2 O 3) n, bespalviai nuodingi kristalai;
b) H 3 PO 3 arba H 2 [PO 3 H] – fosforo rūgštis, vidutinio stiprumo;
c) fosfito druskos, tirpios tik šarminiuose metaluose (K 2 [PO 3 H]),
PCI 3 + CI 2 = PCI 5,
PCI 3 + O 2 = PCI 3,
PCI 3 + HCI ® N.
6)Maksimali oksidacijos būsena +5
a) P 2 O 5 – fosforo anhidridas, balti milteliai, turi modifikaciją (P 2 O 5) 2, stiprią vandens šalinimo priemonę: P 2 O 5 + 2H 2 O = 2HPO 3;
b) HPO 3 - meta, H 4 P 2 O 7 - piro, H 3 PO 4 - ortofosforo rūgštis, vidutinio stiprumo;
c) meta-, piro-, ortofosfatinės druskos;
d) halogenidai yra gana aktyvūs:
PCI 5 + 4H 2 O = H 3 PO 4 + 5 HCI,
RF 5 + HF = N.
BENDROSIOS POGRUPĖS CHARAKTERISTIKOS
7 N, 15 P, 33 As, 51 Sb, 83 Bi. Pogrupyje iš viršaus į apačią metalo savybės natūraliai didėja ir tai atitinka junginių elementų oksidacijos būsenų vertes, taip pat kai kurias fizines savybes. Nors P, As ir Sb allotropija sukuria tam tikrų sunkumų derinant fizines savybes į vieną lentelę:
11 lentelė
Penktosios grupės, pagrindinio pogrupio, elementų savybės
Cheminės savybės
1. Su paprastomis medžiagomis gaminami įvairūs junginiai, pasižymintys skirtingomis redokso savybėmis:
a) atkuriamosios savybės
2P + 3Cl2 = 2PCl3 (arba PCl 5);
4As + 5O 2 = 2As 2 O 5;
2Bi + 3Cl 2 = 2BiCl 3.
b) Oksidacinės savybės
2P + 3Ca = Ca3P2;
2As + 3Mg = Mg 3 As 2.
2. Jie skirtingai reaguoja su rūgštimis, priklausomai nuo pogrupio elemento pobūdžio:
2P + 5H2SO4 = 2H3PO4 + 5SO2 + 2H2O;
3As + 5HNO3 + 2H2O = 3H3AsO4 + 5NO;
3Sb + 5HNO3 = 3HSbO3 + 5NO + H2O;
2Sb + 6H 2SO 4 koncentr. = Sb2(SO4)3 + 3SO2 + 6H2O;
Bi + 4HNO 3 = Bi(NO 3) 3 + NO + 2H 2 O.
Reikia atsiminti, kad aktyvumo eilutėje po vandenilio atsiranda arseno pogrupio elementai.
3. Junginių hidrolizė vyksta įvairiais būdais:
a) PCl3 + 3H2O = H3PO3 + 3HCl;
BiCl 3 + H 2 O ® BiOCl ¯ + 2HCl.
(SbCl 3) (SbOCl)
b) NaNO 2 + H 2 O Û HNO 2 + NaOH;
K 3 PO 4 + H 2 O Û K 2 HPO 4 + KOH;
K 3 AsO 4 + H 2 O Û K 2 HAsO 4 + KOH.
4. Elementų rūgščių-šarmų savybių pokyčiai pasireiškia įvairiai
12 lentelė
Svarbiausi penktojo pogrupio elementų junginiai
5. Junginių redokso gebėjimas priklauso nuo elemento oksidacijos laipsnio:
A) E -3- reduktorius
2NH3 + 6KМnO4 + 6KOH = 6K 2MnO4 + N2 + 6H2O;
2PH 3 + 4O 2 = P 2 O 5 + 3H 2 O.
oksiduojančios medžiagos:
2KNO2 + 4H2S = 3S + N2 + K2S + 4H2O
E +3 2BiCl3 + 3SnCl2 + 18KOH = 2Bi + 3K 2 SnO3 + 12KCl + 9H2O.
reduktorius:
10KNO2 +4KМnO4 +11H2SO4 =10HNO3 +4MnSO4 +7K2SO4 +6H2O
V) E +5 – oksiduojančios medžiagos
Na 3 SbO 4 + 2 NaJ + H 2 SO 4 = Na 3 SbO 3 + J 2 + Na 2 SO 4 + H 2 O.
6 grupės elementai. (Calkogenai)
Elektroninio apvalkalo struktūra: ... ns 2 np 4.
8 O, 16 S, 34 Se, 52 Te, 84 Po (radioaktyvus).
DEGUONAS ir jo junginiai
Labiausiai paplitęs elementas Žemėje: 21% (pagal tūrį) ore, yra H 2 O, mineralų ir organinių medžiagų dalis.
Fizinės savybės
Yra medžiagų pavidalu:
a) „deguonis“ O 2 – dujos be spalvos, skonio, kvapo, netoksiškos; t° virti. = -183 °C; ;
b) „ozonas“ O 3 – mėlynos, aštraus kvapo dujos, nuodingos, labai stipriai oksiduojantis; t° virti. = -111,8°C.
Cheminės savybės
1. Tik vienoje reakcijoje deguonis yra reduktorius:
О 2 + 2F 2 = 2OF 2 ().
2. Visais kitais atvejais deguonis yra oksidatorius, ypač jei jis yra atominės būsenos:
a) Paprastų medžiagų oksidacija
2H2 + O2 = 2H2O;
S + O2 = SO2;
2Ca + O 2 = 2CaO.
b) Sudėtingų medžiagų oksidacija
R2O3 + O2 = R2O5;
2SO 2 + O 2 = 2SO 3;
2PCl 3 + O 2 = 2POCl 3.
c) Sudėtingų neorganinių medžiagų deginimas
2H 2 S + O 2 nepakanka = 2S + 2H2O;
2H 2S + 3O 2 g. = 2SO 2 + 2H 2 O.
d) Organinių medžiagų deginimas
CH4 + 2O2 = CO2 + 2H2O;
C 2 H 5 OH + 3O 2 = 2CO 2 + 3H 2 O.
SIERA ir jos junginiai
Gamtoje randama savo gimtąja forma; mineralų (sulfidų, sulfatų) pavidalu; aliejuje; baltymuose.
Fizinės savybės
Kietas, trapus, geltonas, netirpus H 2 O, bet tirpus anglies disulfide ir aniline. Allotropinis: rombinė siera (a forma); monoklininis (b - siera); plastikas ir kt. Stabiliausia modifikacija yra a (t° pl. » 113°C), jai priskiriama S 8 sudėtis.
Cheminės savybės
Junginiai, pasižymintys skirtingu oksidacijos laipsniu, turi skirtingus redokso gebėjimus.
13 lentelė
Svarbiausi sieros junginiai
1. Siera, sąveikaudama su sudėtingais junginiais, įvairiai keičia savo oksidacijos būseną:
a) S + 2H 2 SO 4 koncentr. = 3SO2 + 2H2O ();
b) S + 6HNO 3 koncentr. = H2SO4 + 6NO2 + 2H2O ();
c) 3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
disproporcijos reakcija
2. Jungtys S-2
A) H2S– vandenilio sulfidas, nuodingos dujos su supuvusių kiaušinių kvapu, stiprus reduktorius: 2H 2 S + O 2 = 2S + 2H 2 O;
H 2 S + Cl 2 = 2HCl + S.
b) H 2 S tirpalas – silpna rūgštis
H 2 S Û N + + HS - (K 1 = 6 × 10 -8).
c) Druskos – sulfidai; šarminių ir šarminių žemių metalų druskos gerai tirpsta ir hidrolizuojasi; p- ir d-metalų sulfidai praktiškai netirpūs.
G) Sulfidai metalų paroda pagrindinis gamta:
K 2 S + H 2 O Û KHS + KOH;
Nemetalų sulfidai eksponuojami rūgštus gamta:
SiS 2 + 3H 2 O = H 2 SiO 3 + 2H 2 S.
d) Tiozoliai: panašus į įprastas druskas, kuriose O atomai pakeisti S:
Na 2 S + CS 2 = Na 2 CS 3 – natrio tiokarbonatas;
Na 2 CS 3 + 2 HCl = 2 NaCl + H 2 CS 3
nestabilus
e) Polisulfidai: siera, kaip ir deguonis peroksiduose, gali sudaryti druskas: Na 2 S tirpalas + ´S = Na 2 S n - natrio polisulfidas (sudėtyje yra sulfidinių tiltelių - S - S - S - S -).
3. S+4 jungtys
a) SO 2 – aštraus kvapo sieros dioksidas, nuodingas;
b) SO 2 tirpalas - sieros rūgštis H 2 SO 3, vidutinio stiprumo
H2SO3Û H+ + HSO3- (K1 = 1,3 × 10-2);
c) Druskos – sulfitai, gerai hidrolizuojasi
Na 2 SO 3 + H 2 O Û NaHSO 3 + NaOH.
d) Redokso reakcijose visi šie junginiai turi dvilypumą:
SO2 + 2H2S = 3S + 2H2O;
2SO 2 + O 2 = 2SO 3.
e) tionilchloridas: SOCl 2
SOCl 2 + 2H 2 O = H 2 SO 3 + 2HCl.
4. S+6 jungtys
A) SO 3– sieros anhidridas; alotropinis, stiprus oksidatorius. Labai intensyviai reaguoja su vandeniu
SO 3 + H 2 O ® H 2 SO 4 + 89,1 kJ/mol;
b) H2SO4– sieros rūgštis, bespalvis aliejinis skystis; stiprus.
H 2 SO 4 koncentr. – labai stiprus oksidatorius; sudegina popierių, cukrų, medieną:
C + 2H 2 SO 4 koncentr. = CO 2 + 2SO 2 + 2H 2 O.
Atskirai jo elgesys su metalais:
įprastoje temperatūroje jis nesąveikauja su daugeliu metalų („pasyvuoja“ Cr, Fe, Al, Zn, ...);
esant padidintam lygiui, jis reaguoja su beveik visais metalais, išskyrus Au ir Pt.
Tai labai gera vandenį šalinanti priemonė, nes... su vandeniu sudaro hidratus H 2 SO 4 × nH 2 O:
V) Druskos: vidutinė – K 2 SO 4 (sulfatai);
rūgštus – KHSO 4 (vandenilio sulfatai);
vitriolis – CuSO 4 × 5H 2 O; ZnSO4 × 7H2O;
alūnas – dvigubos druskos, kristaliniai hidratai
KAl(SO4)2 × 12H2O; NH 4 Fe(SO 4) 2 × 12H 2 O.
G) Oleum– SO 3 tirpalas H 2 SO 4, o reakcija vyksta iš dalies
2SO 3 + H 2 O = H 2 S 2 O 7 pirosieros rūgštis.
d) Sulfurilchloridas SO2Cl2
SO 2 Cl 2 + 2H 2 O = H 2 SO 4 + 2HCl.
e) Peroksosieros rūgštys– sudėtyje yra peroksido tiltelių
H 2 SO 5 – peroksomono siera,
H 2 S 2 O 8 – peroksodisulfas;
stiprūs oksidatoriai.
ir) Tiosulfatai– turi skirtingą oksidacijos laipsnį sieros: S +6 ir S -2; dėl S-2 buvimo junginiai yra stiprūs reduktoriai.
Na 2 S 2 O 3 + Br 2 + H 2 O = 2HBr + S + Na 2 SO 4.
Atitinkama rūgštis H 2 S 2 O 3 (tiosulfato) yra nestabili:
Na 2 S 2 O 3 + H 2 SO 4 = Na 2 SO 4 + H 2 S 2 O 3.
7a grupės elementai. (halogenai )
Elektroninio apvalkalo struktūra: ... ns 2 np 5.
9F, 17 Cl, 35 Br, 53 J, 85 At (radioaktyvus). Laisvoje būsenoje jie egzistuoja dviatominių molekulių pavidalu.
Fizinės savybės
Nuodingas, aštraus kvapo F 2 – šviesiai geltonos dujos, virimo temperatūra. = -188,2 °C;
Cl 2 – žaliai geltonos dujos; t° virti. = -34,1 °C;
Br 2 – raudonas skystis; t° virti. = 59,2 °C;
J 2 – violetiniai kristalai; t° virti. = +185,5°C.
Cheminės savybės
1) Aktyviausias yra F 2, jo atmosferoje dega net stiklas ir vanduo:
2F 2 + SiO 2 = SiF 4 + O 2;
2F 2 + 2H 2 O = 4HF + O 2.
2) Prieš srovę esantys halogenai (kaip stipresni oksidatoriai) išstumia pasroviui esančius iš įvairių junginių:
F2 + 2KCl (KBr, KJ) = 2KF + Cl2 (Br 2, J 2).
3) Halogenams ištirpus vandenyje ir šarmų tirpaluose, vyksta disproporcijų reakcijos; Priklausomai nuo temperatūros, gaunami įvairūs reakcijos produktai:
Cl2 + H2O = HCl + HClO;
Cl2 + 2NaOH = NaCl + NaClO;
4) Vandenilio halogenidai– visos jos yra bespalvės dujos (HF dėl vandenilinių ryšių sudaro asocijuotas medžiagas H x F x).
Serijoje: HF – HCl – HBr – HJ sukibimo stiprumas mažėja, o redukuojančios savybės padidėja:
MnO 2 + 4HCl = Cl 2 + MnCl 2 + 2H 2 O ().
5) Ištirpinus vandenyje, gaunamos stiprios rūgštys; HJ yra stipriausias (išskyrus silpną vandenilio fluorido rūgštį:
H 2 F 2 Û H + + HF 2 -)
6) Halidai elementai turi skirtingą rūgščių-šarmų charakterį, kuris pasireiškia:
a) hidrolizės reakcijose
AlCl 3 + H 2 O Û AlOHCl 2 + HCl;
PBr3 + 3H2O = H3PO3 + 3HBr.
b) kompleksinio susidarymo reakcijose
2NaF + SiF 4 ® Na 2;
daugeliui ligandų F - ; Cl - ; Br - ; J – mažėja kompleksų stabilumas.
7) Halogenai aukštesnės oksidacijos būsenose
a) oksidai: Cl2O; (ClO 2) 2; (ClO 3) 2; Cl2O7;
b) rūgštys: HClO; HClO2; HClO3; HClO4;
daugybei rūgščių ® stiprumas didėja, rūgščių ir jų druskų toje pačioje serijoje oksidacinės savybės mažėja.
c) rūgštys ir jų druskos suyra kaitinant:
d) junginiai tarp halogenų: daug jų žinoma; Sudėtis atitinka elementų padėtį periodinėje lentelėje (daugiau elektronneigiamų elementų atsiranda formulių pabaigoje):
ClF, BrF, JF; ClF 3, JF 3; ClF 5, ClOF 3; BrF 7, JO 3 F ir kt.;
yra rūgštinės prigimties: JF 7 + 4H 2 O = 7HF + HJO 4;
ClO 3 F + 2NaOH = NaClO 4 + NaF + H 2 O.
Klausimai, norint konsoliduoti medžiagą:
1. Kokia medžiaga susidaro arsenui reaguojant su koncentruota azoto rūgštimi - a)Аs(NO3)3? b) H 3 AsO 4? c) Kaip 2 O 3?
2.Kokia medžiaga reaguoja su koncentruota rūgštimi, kad išsiskirtų laisvas chloras – a)CaC1 2? b) MnO 2? c) CrC13?