Régions fonctionnelles de l'ARNt. Structure et fonctions de l'ARNt, caractéristiques de l'activation des acides aminés
70-90N | page secondaire - feuille de trèfle | CCA 3" const pour tous les ARNt |
la présence de thymine, pseudouridine-psi, digirouridine DGU dans la boucle D - protection contre les ribonucléases ? de longue durée | Une variété de structures primaires d'ARNt - 61 + 1 - par le nombre de codons + ARNt de formylméthionine, l'anticodon du chat est le même que celui de l'ARNt de méthionine. Variété de structures tertiaires - 20 (selon le nombre d'acides aminés) | reconnaissance - la formation d'une liaison covalente m-y ARNt et acte | les aminoacyl-ARNt synthétases attachent des actes à l'ARNt
La fonction de l'ARNt est de transférer les acides aminés du cytoplasme aux ribosomes, dans lesquels se produit la synthèse des protéines.
Les ARNt qui se lient à un acide aminé sont appelés isoaccepteurs.
Au total, 64 ARNt différents existent simultanément dans une cellule.
Chaque ARNt ne s'apparie qu'avec son propre codon.
Chaque ARNt reconnaît son propre codon sans l'implication d'un acide aminé. Les acides aminés liés à l'ARNt ont été chimiquement modifiés, après quoi le polypeptide résultant, qui contenait l'acide aminé modifié, a été analysé. Cysteinyl-tRNACys (R = CH2-SH) a été réduit en alanyl-tRNACys (R = CH3).
La plupart des ARNt, quelle que soit leur séquence nucléotidique, ont une structure secondaire en forme de feuille de trèfle en raison de la présence de trois épingles à cheveux.
Caractéristiques structurelles de l'ARNt
Il y a toujours quatre nucléotides non appariés à l'extrémité 3 "de la molécule, et trois d'entre eux sont nécessairement des CCA. Les extrémités 5" et 3" de la chaîne d'ARN forment une tige acceptrice. Les chaînes sont maintenues ensemble en raison de l'appariement complémentaire de sept nucléotides 5" - extrémité avec sept nucléotides situés près de l'extrémité 3". 2. Toutes les molécules ont une épingle à cheveux T? C, ainsi désignée car elle contient deux résidus inhabituels : la ribothymidine (T) et la pseudouridine (? L'épingle à cheveux -tige brin de cinq bases appariées, y compris la paire G-C, et une boucle de sept nucléotides de longueur.
au même point de la boucle. 3. Dans une épingle à cheveux anticodon, la tige est toujours représentée par une famille de paires
terrains. Le triplet complémentaire du codon apparenté, l'anticodon, est situé dans la boucle.
le, composé de sept nucléotides. Un ura invariant
cyl et une cytosine modifiée, et une purine modifiée jouxte son extrémité 3 ", en règle générale
adénine. 4. Une autre épingle à cheveux consiste en une tige de trois à quatre paires de nucléotides de long et une boucle variable
taille, contenant souvent de l'uracile sous une forme réduite - dihydrouracile (DU). Les séquences nucléotidiques des tiges, le nombre de nucléotides entre la tige anticodon et la tige T?C (boucle variable), ainsi que la taille de la boucle et la localisation des résidus dihydrouracile dans la boucle DU varient le plus fortement.
[Chanteur, 1998].
Structure tertiaire de l'ARNt
Structure en forme de L.
Attachement des acides aminés à l'ARNt
Pour qu'un acide aminé forme une chaîne polypeptidique, il doit être attaché à l'ARNt par l'enzyme aminoacyl-ARNt synthétase. Cette enzyme forme une liaison covalente entre le groupe carboxyle de l'acide aminé et le groupe hydroxyle du ribose à l'extrémité 3' de l'ARNt avec la participation de l'ATP. L'aminoacyl-ARNt synthétase reconnaît un codon spécifique non pas à cause de la présence d'un anticodon sur l'ARNt, mais par la présence d'un site de reconnaissance spécifique sur l'ARNt.
Au total, il existe 21 synthétases d'aminoacyl-ARNt différentes dans la cellule.
L'adhésion se déroule en deux temps :
1. Le groupe carboxyle d'un acide aminé est lié à l'ATP a-phosphate. L'adénylate d'aminoacyle instable résultant est stabilisé par liaison à l'enzyme.
2. Transfert du groupe aminoacyle de l'adénylate d'aminoacyle au groupe 2' ou 3'-OH du ribose terminal de l'ARNt
Certaines aminoacyl-ARNt synthétases sont constituées d'une seule chaîne polypeptidique, tandis que d'autres sont constituées de deux ou quatre chaînes identiques, chacune avec un poids moléculaire de 35 à 115 kDa. Certaines enzymes dimères et tétramères sont composées de deux types de sous-unités. Il n'y a pas de corrélation claire entre la taille de la molécule d'enzyme ou la nature de sa structure de sous-unité et sa spécificité.
La spécificité d'une enzyme est déterminée par sa forte liaison à l'extrémité acceptrice de l'ARNt, à la région DU et à la boucle variable. Certaines enzymes ne semblent pas reconnaître le triplet d'anticodon et catalysent la réaction d'aminoacétylation même lorsque l'anticodon est altéré. Cependant, certaines enzymes montrent une activité réduite par rapport à ces ARNt modifiés et ajoutent le mauvais acide aminé lors du remplacement de l'anticodon.
70-90n | page secondaire - feuille de trèfle | CCA 3" const pour tous les ARNt |
la présence de thymine, pseudouridine-psi, digirouridine DGU dans la boucle D - protection contre les ribonucléases ? de longue durée | Une variété de structures primaires d'ARNt - 61 + 1 - par le nombre de codons + ARNt de formylméthionine, l'anticodon du chat est le même que celui de l'ARNt de méthionine. Variété de structures tertiaires - 20 (selon le nombre d'acides aminés)
Il existe deux types d'ARNt liant la méthionine tRNAFMet et tRNAMMet chez les procaryotes et tRNAIMet et tRNAMMet chez les eucaryotes. La méthionine est ajoutée à chaque ARNt en utilisant la synthèse d'aminoacyl-ARNt appropriée. la méthionine attachée au tRNAFMet et au tRNAIMet est formée par l'enzyme méthionyl-tRNA-transformylase en Fmet-tRNAFMet. Les ARNt chargés de formylméthionine reconnaissent le codon d'initiation AUG.
Littérature:
Malheureusement, il n'y a pas de bibliographie.
Cahier de texte. Malgré le fait que l'ARNt est beaucoup plus petit, une histoire sur sa structure, ses caractéristiques et son fonctionnement mérite un chapitre séparé.
Ainsi, l'ARNt est un "adaptateur", qui reconnaît la séquence à trois lettres du code génétique à une extrémité, la faisant correspondre avec le seul acide aminé correspondant fixé à l'autre extrémité de l'ARNt. A la fin de l'ARN de transfert qui touche l'ARN messager, il y a 3 nucléotides qui forment anticodon. Ce n'est que si l'anticodon est complémentaire de la région de l'ARNm que l'ARN de transfert peut la rejoindre. Mais même dans ce cas, l'ARNt ne peut pas rejoindre l'ARNm par lui-même ; il a besoin de l'aide du ribosome, qui est le site de leur interaction, ainsi que d'un participant actif à la traduction. Par exemple, c'est le ribosome qui crée des liaisons entre les acides aminés apportés par l'ARNt, formant une chaîne protéique.
Les caractéristiques structurelles de l'ARNt sont déterminées par le code génétique, c'est-à-dire les règles de construction d'une protéine en fonction d'un gène lu par l'ARN de transfert. Ce code fonctionne dans chaque créature vivante sur Terre : la création d'un virus est écrite dans les mêmes codons à trois lettres qui sont utilisés pour écrire les "instructions d'assemblage" d'un dauphin. Il a été vérifié expérimentalement que les gènes d'un être vivant, placés dans la cellule d'un autre, sont parfaitement copiés et traduits en protéines indiscernables des gènes se reproduisant dans les cellules de l'hôte. L'uniformité du code génétique est à la base de la production d'E. coli modifiés par des colonies d'insuline et de nombreuses autres enzymes humaines qui sont utilisées comme médicaments pour les personnes dont l'organisme n'est pas capable de les produire, ou en produit insuffisamment. Malgré la différence évidente entre les humains et E. coli, les protéines humaines sont facilement créées à partir de plans humains à l'aide d'un copieur E. coli. Sans surprise, les ARN de transfert de différentes créatures diffèrent très peu.

Chaque codon de cette liste, à l'exception de trois codons d'arrêt, signalant l'achèvement de la traduction, doit être reconnu par l'ARN de transfert. La reconnaissance est effectuée en attachant un anticodon à l'ARN messager, qui ne peut se lier qu'à un codon de la liste, de sorte que l'ARNt ne peut reconnaître qu'un seul codon. Cela signifie qu'il existe au moins 61 types de ces molécules dans la cellule. En fait, il y en a encore plus, car dans certaines situations pour lire l'ARN messager, il ne suffit pas d'avoir le bon anticodon: d'autres conditions sont requises, selon lesquelles un ARNt spécial et modifié est créé.
À première vue, une telle variété d'ARNt devrait compliquer considérablement le processus de traduction: après tout, chacune de ces molécules vérifiera le codon de l'ARN matriciel qui lui est substitué par le ribosome pour la conformité avec son anticodon - il semblerait que tant de travail mécanique inutile , tant de temps et d'énergie perdus. Mais à la suite de l'évolution, des mécanismes cellulaires se sont également formés pour prévenir ce problème. Par exemple, la quantité d'ARNt de chaque espèce dans une cellule correspond à la fréquence à laquelle l'acide aminé porté par cette espèce se retrouve dans les protéines en cours de construction. Il y a des acides aminés qui sont rarement utilisés par la cellule, et il y a ceux qui sont souvent utilisés, et si le nombre d'ARNt les portant était le même, cela compliquerait grandement l'assemblage des protéines. Par conséquent, il existe peu d'acides aminés "rares" et leurs ARNt correspondants dans la cellule, tandis que les acides aminés fréquemment présents sont produits en grande quantité.

Avec une telle variété de molécules d'ARNt, elles sont toutes très similaires, par conséquent, compte tenu de leur structure et de leurs fonctions, nous étudierons principalement les caractéristiques communes à toutes les espèces. Lorsque vous regardez la disposition 3D de l'ARNt, cela ressemble à un tas dense d'atomes. Il semble incroyable que cette molécule enroulée de manière complexe soit le résultat du repliement d'une longue chaîne de nucléotides, mais c'est ainsi qu'elle se forme.
Il est possible de retracer les étapes de sa formation, en commençant par la toute première : la compilation d'une séquence nucléotidique par l'ARN polymérase conformément au gène contenant l'information sur cet ARN de transfert. L'ordre dans lequel ces nucléotides se succèdent et leur nombre s'appelle structure primaire de l'ARNt. Il s'avère que c'est la structure primaire de l'ARNt qui est codée dans le gène lu par l'ARN polymérase. En général, la structure primaire est une séquence de molécules relativement simples du même type, dont une molécule de polymère repliée plus complexe est composée. Par exemple, la structure primaire d'une molécule de protéine est la simple séquence de ses acides aminés constitutifs.

Toute chaîne de nucléotides ne peut pas être à l'état déplié dans une cellule, simplement étirée en ligne. Il y a trop de parties chargées positivement et négativement sur les bords des nucléotides, qui forment facilement des liaisons hydrogène les unes avec les autres. La façon dont les mêmes liaisons sont formées entre les nucléotides de deux molécules d'ADN, les reliant en une double hélice, est décrite dans, et vous pouvez entrer dans les détails sur les liaisons hydrogène. Les liaisons hydrogène sont moins fortes que les liaisons entre les atomes dans les molécules, mais elles sont suffisantes pour tordre le fil d'ARNt de manière complexe et le maintenir dans cette position. Au début, ces liaisons ne se forment qu'entre certains nucléotides, repliant l'ARNt en forme de feuille de trèfle. Le résultat de ce pliage initial est appelé structure secondaire ARNt. Le diagramme de gauche montre que seuls certains nucléotides sont liés par des liaisons hydrogène, tandis que d'autres restent non appariés, formant des anneaux et des boucles. Les différences entre la structure secondaire de différents types d'ARNt sont dues à des différences dans leur structure primaire. Cela se manifeste par différentes longueurs de "feuilles de trèfle" ou de "tige" en raison des différentes longueurs de la chaîne initiale de nucléotides.
Une autre différence dans la structure primaire des différents ARNt est que seulement dans certaines positions, ils ont les mêmes nucléotides (dans le diagramme ci-dessus, ils sont marqués par les premières lettres de leurs noms), alors que la plupart des nucléotides des différents ARNt diffèrent les uns des autres. Le schéma ci-dessus est commun à tous les ARNt, donc différents nucléotides sont marqués de chiffres.
Les principales parties fonctionnelles de l'ARNt sont :
=) anticodon, c'est-à-dire la séquence nucléotidique complémentaire d'un seul codon d'ARN messager situé sur épingle à cheveux anticodon
=) extrémité de l'accepteur auquel un acide aminé peut être fixé. Il est situé sur le côté opposé de l'épingle anticodon.
En réalité, pas un seul ARNt ne ressemble à ce qu'il est dans le diagramme de structure secondaire, car seuls certains nucléotides se sont réunis pour le former, tandis que les autres sont restés non appariés. En raison de la formation de liaisons hydrogène entre les nucléotides de différentes parties de la feuille de trèfle, celle-ci se replie davantage en un ensemble beaucoup plus complexe. structure tertiaire en forme de L. Vous pouvez comprendre exactement comment les différentes parties de la structure secondaire se sont courbées pour former la structure tertiaire en faisant correspondre les couleurs dans leurs schémas ci-dessous. L'épingle à cheveux anticodon, marquée en bleu et gris, reste en bas (il convient de rappeler que ce «bas» est conditionnel: il convient de représenter l'ARNt dans cette orientation spatiale dans les schémas de traduction des protéines), et l'extrémité accepteur (jaune) est penché sur le côté.

Voici à quoi ressemble l'ARNt lorsqu'il est prêt à attacher un acide aminé. L'ARNt n'est pas capable de se combiner seul avec l'acide aminé, cela nécessite la participation d'une enzyme spéciale : aminoacyl-ARNt synthétases. Le nombre de types de synthétase dans une cellule coïncide avec le nombre de types d'ARNt.
L'uniformité de la forme de tous les types d'ARNt est nécessaire pour que le ribosome puisse reconnaître n'importe lequel d'entre eux, faciliter leur amarrage à l'ARNm et se déplacer en lui-même d'un site à un autre. Si différents types d'ARNt étaient significativement différents les uns des autres, cela rendrait le travail du ribosome extrêmement difficile, réduisant de manière critique le taux de synthèse des protéines. La sélection naturelle vise ainsi à rendre les ARNt similaires les uns aux autres. Mais en même temps, il existe un autre facteur qui nécessite l'existence de différences notables entre les différents types d'ARNt : après tout, il est nécessaire de reconnaître chaque type et de lui attacher le seul acide aminé correspondant. Évidemment, ces différences devraient être perceptibles, mais pas trop importantes, pour que le travail de reconnaissance des espèces d'ARNt se transforme en un processus de bijoux. Et c'est précisément cela qui est réalisé par les aminoacyl-ARNt synthétases : chacune d'elles peut se lier à un seul des 20 acides aminés et l'attacher précisément aux types d'ARNt qui correspondent à cet acide aminé. D'après le tableau avec le code génétique, on peut voir que chaque acide aminé est codé par plusieurs séquences de nucléotides, donc, par exemple, les quatre ARNt avec les anticodons CGA, CGG, CGU et CGC seront reconnus par la même synthétase qui attache l'alanine pour eux. De tels ARNt traités par une synthétase sont appelés en relation.
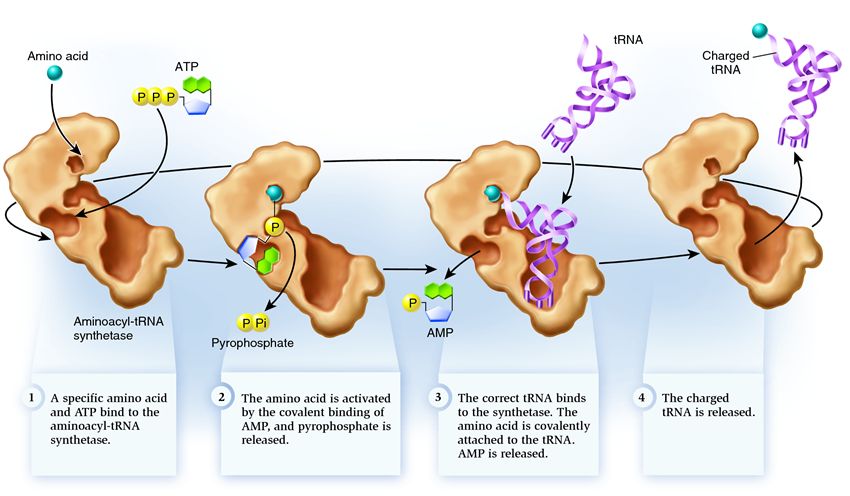
La synthétase appartient à un groupe d'enzymes dont la fonction est de se lier à des molécules existantes séparément et de les combiner en une seule :
1 . la synthétase relie un acide aminé et une molécule d'ATP. Deux groupes phosphate se détachent de l'ATP, libérant l'énergie nécessaire aux activités suivantes. L'adénosine monophosphate (AMP) restant de la molécule détruite se fixe à l'acide aminé, le préparant pour la connexion avec l'épingle à cheveux accepteur.
2 . la synthétase attache à elle-même l'un des ARNt apparentés correspondant à cet acide aminé.

A ce stade, la conformité de l'ARN de transfert à la synthétase est vérifiée. Il existe plusieurs voies de reconnaissance, et chaque synthétase en possède une combinaison unique. Au moins un nucléotide anticodon est impliqué dans l'interaction entre la synthétase et l'ARNt. L'épingle à cheveux accepteur doit également être vérifiée : la présence de nucléotides spécifiques communs aux ARNt apparentés correspondant à l'acide aminé souhaité est déterminée. Les nucléotides d'autres parties de l'ARNt peuvent également participer à l'appariement en se liant à certains sites de synthétase. Le mauvais ARNt peut correspondre à celui souhaité d'une certaine manière, mais en raison d'une correspondance incomplète, il rejoindra la synthétase lentement et de manière lâche, tombant facilement. Et l'ARNt correct collera à la synthétase rapidement et fermement, à la suite de quoi la structure de la synthétase change, démarrant le processus aminoacylation , c'est-à-dire la fixation d'un acide aminé à l'ARNt.

3 . l'aminoacylation consiste à remplacer la molécule d'AMP attachée à l'acide aminé par une molécule d'ARNt. Après ce remplacement, l'AMP quitte la synthétase et l'ARNt est retenu pour un dernier contrôle des acides aminés. Si l'acide aminé attaché est reconnu comme incorrect, il sera détaché de l'ARNt, la place de l'acide aminé dans la synthétase sera vide et une autre molécule pourra s'y joindre. Le nouvel acide aminé passera par les étapes de connexion avec l'ATP et l'ARNt, et sera également testé. Si aucune erreur n'a été commise, l'ARNt chargé d'acides aminés est libéré : il est prêt à jouer son rôle dans la traduction des protéines. Et la synthétase est prête à attacher de nouveaux acides aminés et ARNt, et le cycle recommencera.
Beaucoup dépend du bon fonctionnement de l'aminoacyl-ARNt synthétase : si une défaillance survient à ce stade, le mauvais acide aminé sera attaché à l'ARNt. Et il sera intégré à la protéine se développant sur le ribosome, car l'ARNt et le ribosome n'ont pas pour fonction de vérifier la correspondance du codon et de l'acide aminé. Les conséquences d'une erreur peuvent être mineures ou catastrophiques, et grâce à la sélection naturelle, les créatures dotées d'enzymes qui n'ont pas la fonction de tels contrôles ont été supplantées par d'autres plus adaptables avec diverses options d'appariement entre l'acide aminé et l'ARNt. Par conséquent, dans les cellules modernes, la synthétase se combine avec le mauvais acide aminé en moyenne dans un cas sur 50 000, et avec le mauvais ARNt seulement une fois sur 100 000 pièces jointes.

Certains acides aminés ne diffèrent les uns des autres que par quelques atomes. Si vous regardez leurs schémas, il devient évident que la probabilité de confondre l'arginine avec l'alanine est bien moindre que de confondre l'isoleucine avec la leucine ou la valine. Par conséquent, chaque synthétase qui se lie à l'un des acides aminés similaires les uns aux autres possède des mécanismes de vérification supplémentaires. Voici un exemple d'une telle adaptation dans l'isoleucine-ARNt synthétase :

Chaque synthase a centre synthétique dans lequel un acide aminé est attaché à un ARNt. L'épingle à cheveux accepteur de l'ARNt capturé par la synthétase y va, ainsi que l'acide aminé qui est prêt à réagir avec lui. Le travail de certaines synthétases se termine immédiatement après la connexion de l'acide aminé et de l'ARNt. Mais l'Ile-ARNt synthétase a un risque accru de faire des erreurs en raison de l'existence d'autres acides aminés de type isoleucine. Elle a donc aussi centre correctionnel: d'après son nom, il est clair quel rôle il joue dans le processus de connexion de l'ARNt et des acides aminés. La figure de droite montre que la position de l'extrémité de l'épingle à cheveux accepteur d'ARNt dans le centre synthétique de l'Ile-ARNt synthétase donne à cette épingle à cheveux une courbure non naturelle. Cependant, la synthétase maintient l'ARNt dans cette position jusqu'à ce que l'acide aminé y soit attaché. Une fois cette connexion établie, le besoin de trouver l'épingle à cheveux accepteur dans le centre synthétique est épuisé et l'ARNt se redresse, obtenant son extrémité avec l'acide aminé qui lui est attaché dans le centre de correction.

Bien entendu, le centre synthétique joue également un rôle dans le filtrage des acides aminés qui ne conviennent pas à la synthétase. Pour y entrer, la molécule doit remplir un certain nombre de conditions, dont avoir la bonne taille. Malgré le fait que la leucine et l'isoleucine contiennent le même nombre d'atomes, en raison des différences de structure spatiale, la leucine est plus grande. Par conséquent, il ne peut pas pénétrer dans le centre synthétique, dont la taille correspond à l'isoleucine plus compacte, et rebondit simplement sur l'Ile-ARNt synthétase.
Mais la valine, qui est la plus petite de ces trois molécules avec une structure atomique similaire, prend facilement la place de l'isoleucine dans le centre de synthèse, et la synthétase l'attache à l'ARNt. C'est dans ce cas qu'intervient le centre correctionnel de la synthétase. Si l'épingle à cheveux accepteur de lissage est correctement chargée et transporte de l'isoleucine, elle ne peut pas se faufiler à l'intérieur du centre de correction : elle est tout simplement trop petite pour cette molécule. Ainsi, l'ARNt redressé n'est plus retenu par rien, et il est détaché de la synthétase. Mais si la valine est attachée à l'ARNt, elle se glisse dans le centre de correction, maintenant ainsi l'ARNt qui lui est connecté dans la synthétase. Un tel séjour excessivement long de l'ARNt à l'intérieur est un signal d'erreur pour la synthétase, modifiant sa configuration spatiale. Par conséquent:
=) la valine est détachée de l'ARNt et retirée de la synthétase
=) l'épingle à cheveux accepteur retourne sur le site synthétique, en attendant l'attachement à l'acide aminé
=) la synthétase se lie à un nouvel acide aminé, "charge" l'ARNt avec celui-ci et vérifie à nouveau si l'isoleucine a été utilisée pour cela.
Un mécanisme similaire de double reconnaissance est utilisé par d'autres synthétases.
Propriétés physiques et chimiques de l'ADN
Divers facteurs qui rompent les liaisons hydrogène (augmentation de la température au-dessus de 80 C, modifications du pH et de la force ionique, action de l'urée, etc.) provoquent la dénaturation de l'ADN, c'est-à-dire modification de l'arrangement spatial des chaînes d'ADN sans rompre les liaisons covalentes. La double hélice de l'ADN lors de la dénaturation est complètement ou partiellement divisée en ses chaînes constitutives. La dénaturation de l'ADN s'accompagne d'une augmentation de l'absorption optique dans la région UV des bases puriques et pyrimidiques. Ce phénomène est appelé effet hyperchromique . La dénaturation réduit également la viscosité élevée inhérente aux solutions d'ADN natif. Lorsque la structure originale de l'ADN double brin est restaurée, à la suite d'une renaturation, l'absorption à 260 nm par les bases azotées diminue en raison de leur "blindage". Ce phénomène est appelé effet hypochrome .
Le "déroulage" de chaque ADN en ses chaînes constitutives s'effectue dans une certaine plage de température. Le milieu de cet intervalle est appelé point de fusion. La température de fusion de l'ADN dépend dans des conditions standard (un certain pH et une certaine force ionique) du rapport des bases azotées. Les paires G-C contenant trois liaisons hydrogène sont plus fortes, par conséquent, plus la teneur en paires G-C dans l'ADN est élevée, plus le point de fusion est élevé.
Fonctions de l'ADN. Dans la séquence des nucléotides des molécules d'ADN, l'information génétique est codée. Les principales fonctions de l'ADN sont, d'une part, d'assurer sa propre reproduction dans une série de générations cellulaires et de générations d'organismes, et d'autre part, d'assurer la synthèse des protéines. Ces fonctions sont dues au fait que les molécules d'ADN servent de matrice dans le premier cas pour la réplication, c'est-à-dire copier des informations dans les molécules d'ADN filles, dans le second - pour la transcription, c'est-à-dire pour recoder les informations dans la structure de l'ARN.
Riz. 5 Courbe de fusion (dénaturation de l'ADN)
Des brins complémentaires d'ADN séparés lors de la dénaturation peuvent, sous certaines conditions, se reconnecter en une double hélice. Ce processus est appelé RENATURATION. Si la dénaturation ne s'est pas produite complètement et qu'au moins quelques bases n'ont pas perdu l'interaction par des liaisons hydrogène, la renaturation se déroule très rapidement.
Le cytoplasme des cellules contient trois principaux types fonctionnels d'ARN. Ce sont des ARN messagers - des ARNm qui agissent comme modèles pour la synthèse des protéines, des ARN ribosomiques - des ARNr qui agissent comme des composants structurels des ribosomes et des ARN de transfert - des ARNt impliqués dans la traduction (traduction) des informations d'ARNm dans la séquence d'acides aminés de la protéine.
Le tableau 2 montre les différences entre l'ADN et l'ARN en termes de structure, de localisation dans la cellule et de fonctions.
Tableau 2 Différences entre ADN et ARN
ARN de transfert, ARNt-l'acide ribonucléique dont la fonction est de transporter l'AA vers le site de synthèse des protéines. Il a une longueur typique de 73 à 93 nucléotides et une taille d'environ 5 nm. Les ARNt sont également directement impliqués dans la croissance de la chaîne polypeptidique, se joignant - étant dans un complexe avec un acide aminé - au codon de l'ARNm et assurant la conformation du complexe nécessaire à la formation d'une nouvelle liaison peptidique. Chaque acide aminé possède son propre ARNt. L'ARNt est un ARN simple brin, mais dans sa forme fonctionnelle, il a une conformation en feuille de trèfle. AA se fixe de manière covalente à l'extrémité 3 "de la molécule à l'aide de l'enzyme aminoacyl-ARNt synthétase, spécifique de chaque type d'ARNt. Au site C, il existe un anticodon correspondant à AA-te. Les ARNt sont synthétisés par l'ARN polymérase ordinaire dans le cas des procaryotes et par l'ARN polymérase III dans le cas des eucaryotes Les transcrits des gènes d'ARNt subissent un traitement en plusieurs étapes, ce qui conduit à la formation d'une structure spatiale typique de l'ARNt.
Le traitement de l'ARNt implique 5 étapes clés :
élimination de la séquence nucléotidique de tête 5" ;
élimination de la séquence 3'-terminale ;
ajouter une séquence CCA à l'extrémité 3" ;
excision des introns (chez les eucaryotes et les archées);
modifications de nucléotides individuels.
Le transport de l'ARNt s'effectue le long d'une voie dépendante de Ran avec la participation du facteur de transport exportin t, qui reconnaît les str-ru secondaires et tertiaires caractéristiques de l'ARNt mature: sections courtes à double brin et correctement traitées 5 "- et 3" prend fin. Ce mécanisme garantit que seuls les ARNt matures sont exportés du noyau.
62. Traduction - reconnaissance de codons d'ARNm
La traduction est une synthèse protéique réalisée par des ribosomes à partir d'acides aminés sur une matrice d'ARNm (ou et d'ARN). Les éléments constitutifs du processus de traduction : acides aminés, ARNt, ribosomes, ARNm, enzymes d'aminoacylation de l'ARNt, facteurs protéiques de traduction (facteurs protéiques d'initiation, d'élongation, de terminaison - protéines extraribosomiques spécifiques nécessaires aux processus de traduction), sources d'énergie ATP et GTP , ions magnésium (stabilisent la structure des ribosomes). 20 acides aminés sont impliqués dans la synthèse des protéines. Pour qu'un acide aminé « reconnaisse » sa place dans la future chaîne polypeptidique, il doit se lier à un ARN de transfert (ARNt) qui remplit une fonction d'adaptateur. L'ARNt qui se lie à l'acide aminé reconnaît alors le codon correspondant sur l'ARNm. Reconnaissance des codons d'ARNm :
L'interaction codon-anticodon est basée sur les principes de complémentarité et d'antiparallélisme :
3'----C - G-A*------5' anticodon ARNt
5'-----G-C-Y*------3' codon d'ARNm
L'hypothèse d'oscillation a été proposée par F. Crick :
La base 3' du codon d'ARNm a un appariement non strict avec la base 5' de l'anticodon d'ARNt : par exemple, Y (ARNm) peut interagir avec A et G (ARNt)
Certains ARNt peuvent s'apparier avec plus d'un codon.
63. Caractéristiques des éléments constitutifs du processus de traduction. La traduction (translatio-traduction) est le processus de synthèse protéique à partir d'acides aminés sur la matrice d'ARN informationnel (matrice) (ARNm, ARNm) effectué par le ribosome.
La synthèse des protéines est la base de la vie cellulaire. Pour mener à bien ce processus dans les cellules de tous les organismes, il existe des organites spéciaux - ribosomes- des complexes ribonucléoprotéiques construits à partir de 2 sous-unités : grande et petite. La fonction des ribosomes est de reconnaître les trois lettres (trois nucléotides) codons ARNm, en les comparant aux anticodons ARNt correspondants portant acides aminés, et l'ajout de ces acides aminés à la chaîne protéique en croissance. En se déplaçant le long de la molécule d'ARNm, le ribosome synthétise une protéine conformément aux informations contenues dans la molécule d'ARNm.
Pour la reconnaissance d'AK-t dans la cellule, il existe des "adaptateurs" spéciaux, transférer des molécules d'ARN(ARNt). Ces molécules en forme de trèfle possèdent un site (anticodon) complémentaire d'un codon d'ARNm, ainsi qu'un autre site auquel est attaché l'acide aminé correspondant à ce codon. La fixation des acides aminés à l'ARNt est réalisée dans une réaction dépendante de l'énergie par les enzymes aminoacyl-ARNt synthétases, et la molécule résultante est appelée aminoacyl-ARNt. Ainsi, la spécificité de la traduction est déterminée par l'interaction entre le codon de l'ARNm et l'anticodon de l'ARNt, ainsi que la spécificité des aminoacyl-ARNt synthétases qui attachent les acides aminés strictement à leurs ARNt correspondants (par exemple, le codon GGU correspondra à un ARNt contenant l'anticodon CCA et uniquement la glycine AK).
ribosome procaryote
ARNr 5S et 23S ARNr 16S
34 écureuils 21 écureuils
Les ribosomes procaryotes ont une constante de sédimentation de 70S, c'est pourquoi ils sont appelés particules 70S. Ils sont construits à partir de deux sous-unités différentes : les sous-unités 30S et 50S. Chaque sous-unité est un complexe d'ARNr et de protéines ribosomiques.
La particule 30S contient une molécule d'ARNr 16S et dans la plupart des cas une molécule de protéine de plus de 20 espèces (21) . La sous-unité 50S est constituée de deux molécules d'ARNr (23S et 5S). Il se compose de plus de 30 protéines différentes (34), également représentées, en règle générale, par un exemplaire. La plupart des protéines ribosomales remplissent une fonction structurelle.
ribosome eucaryote
5S ; ARNr 5,8S et 28S ARNr 18S
au moins 50 protéines au moins 33 protéines
Le ribosome est constitué de grandes et petites sous-unités. La base de la structure de chaque sous-unité est un ARNr replié de manière complexe. Des protéines de ribosome ont été attachées à l'échafaudage d'ARNr.
Le coefficient de sédimentation d'un ribosome eucaryote complet est d'environ 80 unités Svedberg (80S), et le coefficient de sédimentation de ses sous-particules est de 40S et 60S.
La plus petite sous-unité 40S se compose d'une molécule d'ARNr 18S et de 30 à 40 molécules de protéines. La grande sous-unité 60S contient trois types d'ARNr avec des coefficients de sédimentation de protéines 5S, 5,8S et 28S et 40-50 (par exemple, les ribosomes d'hépatocytes de rat comprennent 49 protéines).
Régions fonctionnelles des ribosomes
P - site peptidyle pour l'ARNt peptidyle
A - site aminoacyle pour l'ARNt aminoacyle
E - site de libération de l'ARNt du ribosome
Le ribosome contient 2 sites fonctionnels d'interaction avec l'ARNt : aminoacyle (accepteur) et peptidyle (donneur). L'aminoacyl-ARNt pénètre dans le site accepteur du ribosome et interagit pour former des liaisons hydrogène entre les triplets de codon et d'anticodon. Après la formation de liaisons hydrogène, le système avance d'un codon et se retrouve dans le site donneur. En même temps, un nouveau codon apparaît dans le site accepteur libéré et l'aminoacyl-t-ARN correspondant y est attaché.
Ribosomes : structure, fonction
Les ribosomes sont les centres cytoplasmiques de la biosynthèse des protéines. Ils sont constitués de grandes et petites sous-unités, différant par des coefficients de sédimentation (taux de sédimentation lors de la centrifugation), exprimés en unités de Svedberg - S.
Les ribosomes sont présents à la fois dans les cellules eucaryotes et procaryotes, car ils remplissent une fonction importante dans biosynthèse des protéines. Chaque cellule contient des dizaines, des centaines de milliers (jusqu'à plusieurs millions) de ces petits organites arrondis. C'est une particule ribonucléoprotéique arrondie. Son diamètre est de 20-30 nm. Le ribosome est constitué de grandes et petites sous-unités, différant par des coefficients de sédimentation (vitesse de sédimentation lors de la centrifugation), exprimés en unités Svedberg - S. Ces sous-unités sont combinées en présence d'un brin d'ARNm (matrice, ou informationnelle, ARN). Un complexe d'un groupe de ribosomes unis par une seule molécule d'ARNm comme une chaîne de perles est appelé polysome. Ces structures sont soit librement situées dans le cytoplasme, soit attachées aux membranes du RE granulaire (dans les deux cas, la synthèse des protéines se déroule activement sur elles).
Les polysomes du RE granulaire forment des protéines qui sont excrétées de la cellule et utilisées pour les besoins de tout l'organisme (par exemple, les enzymes digestives, les protéines du lait maternel humain). De plus, les ribosomes sont présents sur la surface interne des membranes mitochondriales, où ils participent également activement à la synthèse des molécules protéiques.
L'ARN de transfert (ARNt) joue un rôle important dans le processus d'utilisation de l'information héréditaire par la cellule. Délivrant les acides aminés nécessaires au site d'assemblage des chaînes peptidiques, l'ARNt agit comme un médiateur traductionnel.
Les molécules d'ARNt sont des chaînes polynucléotidiques synthétisées sur des séquences d'ADN spécifiques. Ils sont constitués d'un nombre relativement faible de nucléotides -75-95. En raison de la connexion complémentaire de bases situées dans différentes parties de la chaîne polynucléotidique de l'ARNt, il acquiert une structure ressemblant à une feuille de trèfle (Fig. 3.26).
Riz. 3.26. La structure d'une molécule d'ARNt typique.
Il comporte quatre parties principales qui remplissent différentes fonctions. accepteur La "tige" est formée de deux parties terminales complémentaires connectées de l'ARNt. Il est composé de sept paires de bases. L'extrémité 3' de cette tige est un peu plus longue et forme une région simple brin qui se termine par une séquence CCA avec un groupe OH libre. Un acide aminé transportable est fixé à cette extrémité. Les trois branches restantes sont des séquences de nucléotides appariées complémentaires qui se terminent par des sections non appariées qui forment des boucles. Le milieu de ces branches - l'anticodon - est constitué de cinq paires de nucléotides et contient un anticodon au centre de sa boucle. L'anticodon est composé de trois nucléotides complémentaires du codon de l'ARNm, qui code pour l'acide aminé transporté par cet ARNt jusqu'au site de synthèse peptidique.
Entre les branches accepteur et anticodon se trouvent deux branches latérales. Dans leurs boucles, ils contiennent des bases modifiées - la dihydrouridine (boucle D) et le triplet TψC, où \y est la pseudouriaine (boucle T^C).
Entre les branches aiticodone et T^C, il y a une boucle supplémentaire, qui comprend de 3-5 à 13-21 nucléotides.
En général, différents types d'ARNt se caractérisent par une certaine constance de la séquence nucléotidique, qui est le plus souvent constituée de 76 nucléotides. La variation de leur nombre est principalement due à la variation du nombre de nucléotides dans la boucle supplémentaire. Les régions complémentaires qui soutiennent la structure de l'ARNt sont généralement conservées. La structure primaire de l'ARNt, déterminée par la séquence de nucléotides, forme la structure secondaire de l'ARNt, qui a la forme d'une feuille de trèfle. À son tour, la structure secondaire provoque une structure tertiaire tridimensionnelle, caractérisée par la formation de deux doubles hélices perpendiculaires (Fig. 3.27). L'un d'eux est formé par les branches accepteur et TψC, l'autre par les branches anticodon et D.
A l'extrémité de l'une des doubles hélices se trouve l'acide aminé transporté, à l'extrémité de l'autre se trouve l'anticodon. Ces zones sont les plus éloignées les unes des autres. La stabilité de la structure tertiaire de l'ARNt est maintenue en raison de l'apparition de liaisons hydrogène supplémentaires entre les bases de la chaîne polynucléotidique, situées dans différentes parties de celle-ci, mais spatialement proches dans la structure tertiaire.
Différents types d'ARNt ont une structure tertiaire similaire, bien qu'avec quelques variations.
Riz. 3.27. Organisation spatiale de l'ARNt :
I - la structure secondaire de l'ARNt sous la forme d'une "feuille de trèfle", déterminée par sa structure primaire (la séquence de nucléotides dans la chaîne);
II - projection bidimensionnelle de la structure tertiaire de l'ARNt ;
III - disposition de la molécule d'ARNt dans l'espace
APPENDICE (au cas où quelqu'un ne comprendrait pas ceci)
Dents de foudre - nucléotides (Adénine-Thymine / Uracil /, Guanine-Cytazine). Tous les éclairs sont de l'ADN.

Pour transférer des informations de l'ADN, vous devez casser 2 brins. La liaison entre A-T et G-C est l'hydrogène, elle est donc facilement rompue par l'enzyme hélicase :

Pour éviter la formation de nœuds (A titre d'exemple, j'ai tordu une serviette):



La topoisomérase coupe un brin d'ADN à l'origine de la réplication afin que la chaîne ne se torde pas.

Lorsqu'un fil est libre, le second peut facilement tourner autour de son axe, soulageant ainsi la tension lors du "déroulement". Les nœuds n'apparaissent pas, l'énergie est économisée.
Ensuite, une amorce d'ARN est nécessaire pour commencer à collecter l'ARN. Une protéine qui assemble l'ARNm ne peut pas simplement assembler le premier nucléotide, elle a besoin d'un morceau d'ARN pour démarrer (c'est écrit en détail là-bas, je l'écrirai plus tard). Cette pièce s'appelle l'amorce d'ARN. Et cette protéine y attache déjà le premier nucléotide.


Lors de la description de la structure des acides nucléiques, différents niveaux d'organisation des macromolécules sont pris en compte : structure primaire et secondaire.
La structure primaire des acides nucléiques est la composition nucléotidique et une certaine séquence d'unités nucléotidiques dans la chaîne polymère.
Structure secondaire de l'ARN. La molécule d'acide ribonucléique est construite à partir d'une seule chaîne polynucléotidique.
Structure secondaire de l'ARN
Des sections séparées de la chaîne d'ARN forment des boucles spiralées - "épingles à cheveux", dues aux liaisons hydrogène entre les bases azotées complémentaires A-U et G-C. Les sections de la chaîne d'ARN dans de telles structures hélicoïdales sont antiparallèles, mais pas toujours complètement complémentaires ; elles contiennent des résidus de nucléotides non appariés ou même des boucles simple brin qui ne rentrent pas dans la double hélice. La présence de régions spiralisées est caractéristique de tous les types d'ARN.
Le rôle principal de l'ARN est la participation directe à la biosynthèse des protéines.
On connaît trois types d'ARN cellulaires qui diffèrent par leur localisation dans la cellule, leur composition, leur taille et leurs propriétés qui déterminent leur rôle spécifique dans la formation des macromolécules protéiques :
- les ARN informationnels (matrices) transmettent des informations codées dans l'ADN sur la structure de la protéine du noyau cellulaire aux ribosomes, où s'effectue la synthèse protéique ; la structure primaire de tous les ARNm, quelle que soit l'unicité de leur séquence codante, a la même structure des extrémités 5' et 3'.
Ainsi, à l'extrémité 5', il y a un nucléotide modifié 7-méthylguanosine-5'-triphosphate (coiffe). Plusieurs dizaines de nucléotides séparent la coiffe du codon d'initiation, généralement le triplet -AUG-. La région codante est suivie par l'un des codons de terminaison -UGA-, -UUA-, -UAG-. À l'extrémité 3' de la plupart des ARNm, il y a une séquence de 100 à 200 nucléotides de résidus d'adénosine monophosphate.
- les ARN de transfert collectent les acides aminés dans le cytoplasme de la cellule et les transfèrent au ribosome ; Les molécules d'ARN de ce type "apprennent" des sections correspondantes de la chaîne d'ARN messager quels acides aminés doivent participer à la synthèse des protéines.
La structure spatiale de tout ARNt, quelles que soient les différences dans la séquence nucléotidique, est décrite par le modèle universel de trèfle. Chaque molécule d'ARNt a des sections de chaîne qui ne sont pas impliquées dans la formation de liaisons hydrogène entre les résidus nucléotidiques.
Ceux-ci incluent, en particulier, le site responsable de la liaison à l'acide aminé à l'extrémité 3' de la molécule et l'anticodon, un triplet spécifique de nucléotides qui interagit de manière complémentaire avec le codon de l'ARNm.
- L'ARN ribosomal assure la synthèse protéique d'une certaine structure, en lisant les informations à partir de l'ARN d'information (matrice). Les ARNr forment des complexes avec des protéines appelées ribosomes.
Chaque ribosome est constitué de deux sous-unités - petite (40S) et grande (60S). Les sous-unités de ribosome diffèrent non seulement par l'ensemble des ARNr, mais également par le nombre et la structure des protéines.
Date de parution : 2015-02-03 ; Lire : 2729 | Violation des droits d'auteur de la page

L'ARN est un polymère dont les monomères sont des ribonucléotides.
Contrairement à l'ADN, l'ARN n'est pas formé de deux, mais d'une chaîne polynucléotidique (exception - certains virus contenant de l'ARN ont un ARN double brin). Les nucléotides d'ARN sont capables de former des liaisons hydrogène entre eux. Les chaînes d'ARN sont beaucoup plus courtes que les chaînes d'ADN.
Le monomère d'ARN - nucléotide (ribonucléotide) - est constitué de résidus de trois substances : 1) une base azotée, 2) un monosaccharide à cinq carbones (pentose) et 3) de l'acide phosphorique. Les bases azotées des ARN appartiennent également aux classes des pyrimidines et des purines.
Bases pyrimidiques de l'ARN - uracile, cytosine, bases puriques - adénine et guanine.
31. Types d'ARN et caractéristiques de sa structure
Le monosaccharide nucléotidique d'ARN est représenté par le ribose.
Il existe trois types d'ARN : 1) ARN informationnel (matrice) - ARNm (ARNm), 2) ARN de transfert - ARNt, 3) ARN ribosomal - ARNr.
Tous les types d'ARN sont des polynucléotides non ramifiés, ont une conformation spatiale spécifique et participent aux processus de synthèse des protéines.
Les informations sur la structure de tous les types d'ARN sont stockées dans l'ADN. Le processus de synthèse d'ARN sur une matrice d'ADN est communément appelé transcription.

Les ARN de transfert contiennent généralement 76 (de 75 à 95) nucléotides ; poids moléculaire - 25 000–30 000.
L'ARNt représente environ 10% du contenu total d'ARN dans la cellule. Fonctions de l'ARNt : 1) transport des acides aminés vers le site de synthèse des protéines, vers les ribosomes, 2) médiateur de la traduction. Environ 40 types d'ARNt se trouvent dans la cellule, chacun d'eux a une séquence de nucléotides qui lui est propre. Dans le même temps, tous les ARNt ont plusieurs régions complémentaires intramoléculaires, grâce auxquelles les ARNt acquièrent une conformation ressemblant à une feuille de trèfle.
Tout ARNt possède une boucle de contact avec le ribosome (1), une boucle anticodon (2), une boucle de contact avec l'enzyme (3), une tige acceptrice (4) et un anticodon (5). L'acide aminé est fixé à l'extrémité 3' de la tige acceptrice. Anticodon - trois nucléotides qui « reconnaissent » un codon d'ARNm.
Il convient de souligner qu'un ARNt particulier peut transporter un acide aminé strictement défini correspondant à son anticodon. La spécificité de la connexion des acides aminés et de l'ARNt est obtenue grâce aux propriétés de l'enzyme aminoacyl-ARNt synthétase.
Les ARN ribosomiques contiennent 3 000 à 5 000 nucléotides ; poids moléculaire - 1 000 000–1 500 000.
L'ARNr représente 80 à 85% du contenu total d'ARN dans la cellule. En complexe avec les protéines ribosomiques, l'ARNr forme des ribosomes - des organites qui effectuent la synthèse des protéines. Dans les cellules eucaryotes, la synthèse de l'ARNr se produit dans le nucléole. Fonctions de l'ARNr : 1) un composant structurel nécessaire des ribosomes et, par conséquent, assurant le fonctionnement des ribosomes ; 2) assurer l'interaction du ribosome et de l'ARNt ; 3) la liaison initiale du ribosome et du codon initiateur de l'ARNm et la détermination du cadre de lecture, 4) la formation du centre actif du ribosome.
Les ARN messagers sont divers en termes de teneur en nucléotides et de poids moléculaire (de 50 000 à 4 000 000).
La part d'ARNm représente jusqu'à 5% du contenu total d'ARN dans la cellule. Fonctions de l'ARNm : 1) transfert d'informations génétiques de l'ADN aux ribosomes, 2) matrice pour la synthèse d'une molécule protéique, 3) détermination de la séquence d'acides aminés de la structure primaire d'une molécule protéique.
Lire aussi
L'ARN est un polymère dont les monomères sont des nucléotides.
Les trois bases azotées sont les mêmes que dans l'ADN (adénine, guanine, cytosine) ; le quatrième - l'uracile - est présent dans la molécule d'ARN à la place de la thymine. Les nucléotides d'ARN contiennent du ribose au lieu de désoxyribose. Dans la chaîne d'ARN...
trois principaux types d'ARN : informatif(ARNm), ou matrice(ARNm), ribosomique(ARNr), et le transport(ARNt). Ils diffèrent par leur taille moléculaire et leur fonction. Tous les types d'ARN sont synthétisés sur l'ADN avec la participation d'enzymes - les ARN polymérases. L'ARN messager représente 2 à 3% de tous les ARN cellulaires, ribosomal - 80-85, transport - environ 15%.
ARNm.
il lit les informations héréditaires d'un segment d'ADN et, sous la forme d'une séquence copiée de bases azotées, les transfère aux ribosomes, où une certaine protéine est synthétisée. Chacune des molécules d'ARNm dans l'ordre des nucléotides et en taille correspond au gène dans l'ADN à partir duquel elle a été transcrite. En moyenne, l'ARNm contient 1500 nucléotides (75-3000). Chaque triplet (trois nucléotides) sur un ARNm est appelé un codon. Cela dépend du codon quel acide aminé apparaîtra à un endroit donné lors de la synthèse des protéines.
(ARNt) a un poids moléculaire relativement faible d'environ 24-29 mille.
D et contient de 75 à 90 nucléotides dans la molécule. Jusqu'à 10% de tous les nucléotides de l'ARNt sont des bases mineures, ce qui, apparemment, le protège de l'action des enzymes hydrolytiques.Le rôle de l'ARNt est qu'ils transfèrent les acides aminés aux ribosomes et participent au processus de synthèse des protéines. Chaque acide aminé se fixe à un ARNt spécifique. Un certain nombre d'acides aminés ont plus d'un ARNt. À ce jour, plus de 60 ARNt ont été découverts qui diffèrent par leur structure primaire (séquence de bases).
La structure secondaire de tous les ARNt se présente sous la forme d'une feuille de trèfle avec une tige double brin et trois simples brins). À l'extrémité de l'une des chaînes se trouve un site accepteur - le triplet CCA, à l'adénine duquel est attaché un acide aminé spécifique.
(ARNr). Ils contiennent 120 à 3100 nucléotides. L'ARN ribosomique s'accumule dans le noyau, dans les nucléoles.
Les protéines ribosomiques sont transportées vers le nucléole à partir du cytoplasme et la formation spontanée de sous-particules de ribosomes s'y produit en combinant des protéines avec l'ARNr correspondant. Les sous-particules du ribosome sont transportées ensemble ou séparément à travers les pores de la membrane nucléaire dans le cytoplasme. Ribosomes sont des organites d'une taille de 20 à 30 nm.
Ils sont construits à partir de deux sous-particules de tailles et de formes différentes. A certaines étapes de la synthèse des protéines dans la cellule, les ribosomes sont divisés en sous-particules.
L'ARN ribosomique sert de cadre aux ribosomes et facilite la liaison initiale de l'ARNm au ribosome lors de la biosynthèse des protéines.
Question 6 Les liaisons qui forment les structures primaires et secondaires de l'ADN et de l'ARN. Types d'ARN
Le code génétique est un moyen de coder la séquence d'acides aminés des protéines à l'aide d'une séquence de nucléotides, caractéristique de tous les organismes vivants.
Propriétés : 1) code génétique triolet(chaque acide aminé est codé par trois nucléotides); 2) sans chevauchement(les triplets voisins n'ont pas de nucléotides communs); 3) dégénérer(à l'exception de la méthionine et du tryptophane, tous les acides aminés ont plus d'un codon); 4) universel(principalement la même pour tous les organismes vivants); 5) dans les codons d'un acide aminé, les deux premiers nucléotides sont généralement les mêmes et le troisième varie ; 6) a un ordre de lecture linéaire et se caractérise par colinéarité, t.
e) la coïncidence de l'ordre des codons dans l'ARNm avec l'ordre des acides aminés dans la chaîne polypeptidique synthétisée.
Date de parution : 2014-12-08 ; Lire : 11268 | Violation des droits d'auteur de la page
studopedia.org - Studopedia.Org - 2014-2018. (0.001 s) ...
Le cytoplasme des cellules contient trois principaux types fonctionnels d'ARN :
- l'ARN messager (ARNm) qui sert de matrice pour la synthèse des protéines ;
- l'ARN ribosomique (ARNr) agissant en tant que composants structurels des ribosomes ;
- transférer les ARN (ARNt) impliqués dans la traduction (traduction) des informations d'ARNm dans la séquence d'acides aminés d'une molécule de protéine.
Dans le noyau des cellules, on trouve de l'ARN nucléaire, constituant de 4 à 10 % de l'ARN cellulaire total.
La majeure partie de l'ARN nucléaire est représentée par des précurseurs de haut poids moléculaire d'ARN ribosomal et de transfert. Les précurseurs des ARNr de haut poids moléculaire (ARN 28 S, 18 S et 5 S) sont principalement localisés dans le nucléole.
L'ARN est le principal matériel génétique de certains virus animaux et végétaux (ARN génomique). La plupart des virus à ARN sont caractérisés par une transcription inverse de leur génome à ARN, dirigée par la transcriptase inverse.
Tous les acides ribonucléiques sont des polymères de ribonucléotides reliés, comme dans une molécule d'ADN, par des liaisons 3′,5′-phosphorodiester.
Contrairement à l'ADN, qui a une structure double brin, l'ARN est une molécule polymère linéaire simple brin.
Structure de l'ARNm. L'ARNm est la classe d'ARN la plus hétérogène en termes de taille et de stabilité.
structure de l'ARNt.
Les ARN de transfert agissent comme médiateurs (adaptateurs) lors de la traduction de l'ARNm. Ils représentent environ 15 % de l'ARN cellulaire total. Chacun des 20 acides aminés protéinogènes possède son propre ARNt. Pour certains acides aminés codés par deux codons ou plus, il existe plusieurs ARNt.
Les ARNt sont des molécules simple brin relativement petites composées de 70 à 93 nucléotides. Leur poids moléculaire est de (2,4-3,1) .104 kDa.
La structure secondaire de l'ARNt est formée en raison de la formation du nombre maximal de liaisons hydrogène entre des paires complémentaires intramoléculaires de bases azotées.
À la suite de la formation de ces liaisons, la chaîne polynucléotidique de l'ARNt se tord avec la formation de branches en spirale se terminant par des boucles de nucléotides non appariés. L'image spatiale des structures secondaires de tous les ARNt a la forme d'une feuille de trèfle.
Quatre branches obligatoires sont distinguées dans la "feuille de trèfle", les ARNt plus longs contiennent en outre une courte cinquième branche (supplémentaire).
La fonction adaptatrice de l'ARNt est assurée par une branche acceptrice, à l'extrémité 3' de laquelle un résidu d'acide aminé est fixé par une liaison éther, et une branche anticodon opposée à la branche acceptrice, au sommet de laquelle se trouve une boucle contenant un anticodon.
Un anticodon est un triplet spécifique de nucléotides qui est complémentaire dans le sens antiparallèle du codon d'ARNm codant pour l'acide aminé correspondant.
La branche en T portant la boucle pseudo-uridine (boucle TyC) assure l'interaction de l'ARNt avec les ribosomes.
La branche D, portant la boucle déhydrouridine, assure l'interaction de l'ARNt avec l'aminoacyl-ARNt synthétase correspondante.

Structure secondaire de l'ARNt
Les fonctions de la cinquième branche supplémentaire sont encore mal comprises ; très probablement, elle égalise la longueur des différentes molécules d'ARNt.
La structure tertiaire de l'ARNt est très compacte et est formée en rassemblant des branches individuelles de la feuille de trèfle en raison de liaisons hydrogène supplémentaires pour former une structure en forme de "coude".
ARN de transport, structure et mécanisme fonctionnel.
Dans ce cas, le bras accepteur qui lie l'acide aminé est situé à une extrémité de la molécule, et l'anticodon est à l'autre.

Structure tertiaire de l'ARNt (selon A.S. Spirin)
La structure de l'ARNr et des ribosomes. Les ARN ribosomiques forment le squelette auquel des protéines spécifiques se lient pour former des ribosomes. Les ribosomes sont des organites nucléoprotéiques qui assurent la synthèse des protéines à partir de l'ARNm.
Le nombre de ribosomes dans une cellule est très important : de 104 chez les procaryotes à 106 chez les eucaryotes. Les ribosomes sont localisés principalement dans le cytoplasme, chez les eucaryotes, en plus, dans le nucléole, dans la matrice mitochondriale et dans le stroma des chloroplastes. Les ribosomes sont constitués de deux sous-particules : une grande et une petite. Par taille et poids moléculaire, tous les ribosomes étudiés sont divisés en 3 groupes - les ribosomes 70S de procaryotes (coefficient de sédimentation S), constitués de petites sous-particules 30S et de grandes sous-particules 50S ; Ribosomes eucaryotes 80S, composés de petites sous-unités 40S et de grandes sous-unités 60S.
La petite sous-unité des ribosomes 80S est formée d'une molécule d'ARNr (18S) et de 33 molécules de diverses protéines.
La grande sous-unité est formée de trois molécules d'ARNr (5S, 5,8S et 28S) et d'environ 50 protéines.
La structure secondaire de l'ARNr est formée en raison de courtes sections double brin de la molécule - épingles à cheveux (environ 2/3 de l'ARNr), 1/3 - est représentée par des sections simple brin riches en nucléotides puriques.
Boutons sociaux pour Joomla
Les protéines constituent la base de la vie. Leurs fonctions dans la cellule sont très diverses. Cependant, les protéines "ne peuvent pas" se reproduire. Et toutes les informations sur la structure des protéines sont contenues dans les gènes (ADN).
Dans les organismes supérieurs, les protéines sont synthétisées dans le cytoplasme de la cellule et l'ADN est caché derrière la coque du noyau. Par conséquent, l'ADN ne peut pas directement servir de matrice pour la synthèse des protéines. Ce rôle est joué par un autre acide nucléique - l'ARN.
La molécule d'ARN est un polynucléotide non ramifié avec une structure tertiaire.
Il est formé d'une chaîne polynucléotidique, et bien que les nucléotides complémentaires qu'il contient soient également capables de former des liaisons hydrogène entre eux, ces liaisons se produisent entre les nucléotides d'une chaîne. Les chaînes d'ARN sont beaucoup plus courtes que les chaînes d'ADN. Si le contenu d'ADN dans une cellule est relativement constant, le contenu d'ARN fluctue considérablement. La plus grande quantité d'ARN dans les cellules est observée lors de la synthèse des protéines.
L'ARN joue un rôle majeur dans la transmission et la mise en œuvre de l'information héréditaire.
Conformément à la fonction et aux caractéristiques structurelles, plusieurs classes d'ARN cellulaires sont distinguées.
Il existe trois classes principales d'ARN cellulaire.
- Informationnel (ARNm) ou matriciel (ARNm). Ses molécules sont les plus diverses en termes de taille, de poids moléculaire (de 0,05x106 à 4x106) et de stabilité.
Ils représentent environ 2% de la quantité totale d'ARN dans la cellule. Tous les ARNm sont porteurs d'informations génétiques du noyau au cytoplasme, jusqu'au site de synthèse des protéines. Ils servent de matrice (dessin de travail) pour la synthèse d'une molécule de protéine, car ils déterminent la séquence d'acides aminés (structure primaire) d'une molécule de protéine.

- ARN ribosomal (ARNr).
Ils représentent 80 à 85% du contenu total d'ARN dans la cellule.
31. La structure de l'ARN. Types d'ARN, caractéristiques structurelles et fonctions. Structure secondaire de l'ARNt
L'ARN ribosomal est composé de 3 à 5 000 nucléotides. Il est synthétisé dans les nucléoles du noyau. En complexe avec les protéines ribosomiques, l'ARNr forme des ribosomes - des organites sur lesquels les molécules de protéines sont assemblées. La principale signification de l'ARNr est qu'il fournit la liaison initiale de l'ARNm et du ribosome et forme le centre actif du ribosome, dans lequel des liaisons peptidiques se forment entre les acides aminés lors de la synthèse de la chaîne polypeptidique.
- ARN de transfert (ARNt).
Les molécules d'ARNt contiennent généralement 75 à 86 nucléotides. Le poids moléculaire des molécules d'ARNt est d'environ 25 000. Les molécules d'ARNt jouent le rôle d'intermédiaires dans la biosynthèse des protéines - elles fournissent des acides aminés au site de synthèse des protéines, c'est-à-dire aux ribosomes. La cellule contient plus de 30 types d'ARNt. Chaque type d'ARNt a sa propre séquence de nucléotides unique.
Cependant, toutes les molécules ont plusieurs régions complémentaires intramoléculaires, en raison de la présence desquelles tous les ARNt ont une structure tertiaire ressemblant à une feuille de trèfle.
Structure secondaire de l'ARN- caractéristique de l'ARNt, simple brin, en forme de "feuille de trèfle".
Comprend :
- doubles hélices relativement courtes - tiges,
- sections à un seul brin - boucles.
Il y a 4 tiges (accepteur, anticodon, dihydrouridyl, pseudouridyl) et 3 boucles.

"Stem-boucle" - un élément de la structure secondaire de l'ARN, schématiquement

"Pseudoknot" - un élément de la structure secondaire de l'ARN, schématiquement

La tige acceptrice contient les extrémités 3' et 5' de la chaîne polynucléotidique, l'extrémité 5' se termine par un résidu d'acide guanilique, l'extrémité 3' est un triplet CCA et sert à former une liaison ester avec AA.
La tige anticodon reconnaît son codon sur l'ARNm dans les ribosomes par le principe de complémentarité.
La tige pseudouridyle sert à se fixer au ribosome.
La tige dihydrouridyle sert à se lier à l'aminoacyl-ARNt synthétase.
Boutons sociaux pour Joomla





