Funkcjonalne regiony tRNA. Budowa i funkcje tRNA, cechy aktywacji aminokwasów
70-90N | strona drugorzędna - koniczyna | CCA 3" const dla wszystkich tRNA |
obecność tyminy, pseudourydyny-psi, digirourydyny DGU w pętli D – ochrona przed rybonukleazami? długowieczny | Różnorodność podstawowych struktur tRNA - 61 + 1 - pod względem liczby kodonów + tRNA formylometioniny, antykodon kota jest taki sam jak w przypadku tRNA metioniny. Różnorodność struktur trzeciorzędowych - 20 (według liczby aminokwasów) | rozpoznanie - tworzenie wiązania kowalencyjnego m-y tRNA i działanie | syntetazy aminoacylo-tRNA przyłączają się do tRNA
Funkcją tRNA jest przenoszenie aminokwasów z cytoplazmy do rybosomów, w których zachodzi synteza białek.
tRNA, które wiążą jeden aminokwas, nazywane są izoakceptorami.
W sumie w komórce istnieją jednocześnie 64 różne tRNA.
Każde tRNA paruje tylko z własnym kodonem.
Każde tRNA rozpoznaje własny kodon bez udziału aminokwasu. Aminokwasy związane z tRNA zmodyfikowano chemicznie, po czym uzyskany polipeptyd, który zawierał zmodyfikowany aminokwas, poddano analizie. Cysteinyl-tRNACys (R=CH2-SH) został zredukowany do alanylo-tRNACys (R=CH3).
Większość tRNA, niezależnie od ich sekwencji nukleotydowej, ma drugorzędową strukturę w kształcie koniczyny ze względu na obecność w niej trzech szpilek do włosów.
Cechy strukturalne tRNA
Na końcu 3" cząsteczki zawsze znajdują się cztery niesparowane nukleotydy, a trzy z nich są koniecznie CCA. Końce 5" i 3" łańcucha RNA tworzą trzon akceptorowy. Łańcuchy są utrzymywane razem dzięki komplementarnemu parowaniu siedem nukleotydów 5" - koniec z siedmioma nukleotydami znajdującymi się w pobliżu końca 3". 2. Wszystkie cząsteczki mają spinkę do włosów T? C, tak oznaczoną, ponieważ zawiera dwie nietypowe reszty: rybotymidynę (T) i pseudourydynę (? Spinka do włosów składa się z podwójnego -niciowy pień złożony z pięciu sparowanych zasad, w tym pary G-C i pętli o długości siedmiu nukleotydów.
w tym samym punkcie pętli. 3. W antykodonowej szpilce do włosów łodyga jest zawsze reprezentowana przez rodzinę sparowanych
fusy. Trójka komplementarna do pokrewnego kodonu, antykodonu, znajduje się w pętli.
le, składający się z siedmiu nukleotydów. Niezmienna ura-
cyl i zmodyfikowaną cytozynę, a zmodyfikowana puryna z reguły przylega do jej końca 3
adenina. 4. Kolejna spinka do włosów składa się z łodygi o długości od trzech do czterech par nukleotydów i zmiennej pętli
rozmiar, często zawierający uracyl w postaci zredukowanej - dihydrouracyl (DU). Najsilniej różnią się sekwencje nukleotydowe pni, liczba nukleotydów między pniem antykodonu a pniem T=C (pętla zmienna), a także wielkość pętli i lokalizacja reszt dihydrouracylowych w pętli DU.
[Piosenkarz, 1998].
Trzeciorzędowa struktura tRNA
Struktura w kształcie litery L.
Przyłączenie aminokwasów do tRNA
Aby aminokwas utworzył łańcuch polipeptydowy, musi być przyłączony do tRNA przez enzym syntetazę aminoacylo-tRNA. Enzym ten tworzy wiązanie kowalencyjne między grupą karboksylową aminokwasu a grupą hydroksylową rybozy na końcu 3' tRNA z udziałem ATP. Syntetaza aminoacylo-tRNA rozpoznaje specyficzny kodon nie ze względu na obecność antykodonu na tRNA, ale na podstawie obecności specyficznego miejsca rozpoznawania na tRNA.
W sumie w komórce występuje 21 różnych syntetaz aminoacylo-tRNA.
Łączenie odbywa się w dwóch etapach:
1. Grupa karboksylowa aminokwasu jest przyłączona do ATP a-fosforanu. Powstały niestabilny adenylan aminoacylu jest stabilizowany przez wiązanie z enzymem.
2. Przeniesienie grupy aminoacyloadenylanu aminoacylo do grupy 2' lub 3'-OH terminalnej rybozy tRNA
Niektóre syntetazy aminoacylo-tRNA składają się z pojedynczego łańcucha polipeptydowego, podczas gdy inne składają się z dwóch lub czterech identycznych łańcuchów, każdy o masie cząsteczkowej od 35 do 115 kDa. Niektóre enzymy dimeryczne i tetrameryczne składają się z dwóch rodzajów podjednostek. Nie ma wyraźnej korelacji między wielkością cząsteczki enzymu lub naturą jej struktury podjednostkowej a specyficznością.
Specyficzność enzymu jest określona przez jego silne wiązanie z akceptorowym końcem tRNA, regionem DU i pętlą zmienną. Wydaje się, że niektóre enzymy nie rozpoznają trypletu antykodonu i katalizują reakcję aminoacetylacji, nawet gdy antykodon jest zmieniony. Jednak niektóre enzymy wykazują zmniejszoną aktywność w stosunku do tak zmodyfikowanych tRNA i dodają niewłaściwy aminokwas podczas zastępowania antykodonu.
70-90n | strona drugorzędna - koniczyna | CCA 3" const dla wszystkich tRNA |
obecność tyminy, pseudourydyny-psi, digirourydyny DGU w pętli D – ochrona przed rybonukleazami? długowieczny | Różnorodność podstawowych struktur tRNA - 61 + 1 - pod względem liczby kodonów + tRNA formylometioniny, antykodon kota jest taki sam jak w przypadku tRNA metioniny. Różnorodność struktur trzeciorzędowych - 20 (w zależności od liczby aminokwasów)
Istnieją dwa typy wiążącego tRNA metioniny tRNAFMet i tRNAMMet u prokariontów oraz tRNAIMet i tRNAMMet u eukariontów. Metionina jest dodawana do każdego tRNA przy użyciu odpowiedniej syntezy aminoacylo-tRNA. Metionina przyłączona do tRNAFMet i tRNAIMet jest tworzona przez enzym transformylazę metionylo-tRNA do Fmet-tRNAFMet. tRNA obciążone formylometioniną rozpoznają kodon inicjacji AUG.
Literatura:
Niestety nie ma bibliografii.
Podręcznik. Pomimo tego, że tRNA jest znacznie mniejsze, opowieść o jego budowie, cechach i funkcjonowaniu zasługuje na osobny rozdział.
Tak więc tRNA jest „adapterem”, który rozpoznaje trzyliterową sekwencję kodu genetycznego na jednym końcu, dopasowując ją do jedynego odpowiadającego aminokwasu związanego z drugim końcem tRNA. Na końcu transferowego RNA, który dotyka informacyjnego RNA, tworzą się 3 nukleotydy antykodon. Tylko jeśli antykodon jest komplementarny do regionu mRNA, transferowy RNA może do niego dołączyć. Ale nawet w tym przypadku tRNA nie może samo łączyć się z mRNA, potrzebuje pomocy rybosomu, który jest miejscem ich interakcji, a także aktywnego uczestnika translacji. Na przykład to rybosom tworzy wiązania między aminokwasami wniesionymi przez tRNA, tworząc łańcuch białkowy.
Strukturalne cechy tRNA są określone przez kod genetyczny, czyli zasady konstruowania białka zgodnie z genem, który odczytuje transferowy RNA. Ten kod działa w każdym żywym stworzeniu na Ziemi: tworzenie wirusa jest napisane przy użyciu tych samych trzyliterowych kodonów, które są używane do napisania „instrukcji montażu” delfina. Zostało eksperymentalnie zweryfikowane, że geny jednej żywej istoty, umieszczone w komórce innej, są doskonale kopiowane i tłumaczone na białka nie do odróżnienia od genów reprodukujących się w komórkach żywiciela. Jednolitość kodu genetycznego jest podstawą do produkcji zmodyfikowanej bakterii E. coli przez kolonie insuliny i wielu innych ludzkich enzymów, które są stosowane jako leki dla osób, których organizm nie jest w stanie ich wytworzyć lub produkuje w niewystarczającym stopniu. Pomimo oczywistej różnicy między ludźmi a E. coli, ludzkie białka można łatwo stworzyć z ludzkich planów za pomocą kopiarki E. coli. Nic dziwnego, że transferowe RNA różnych stworzeń różnią się bardzo niewiele.

Każdy kodon z tej listy, z wyjątkiem trzech kodony stop, sygnalizujący zakończenie translacji, powinien być rozpoznany przez transferowy RNA. Rozpoznawanie odbywa się poprzez dołączenie antykodonu do informacyjnego RNA, który może wiązać się tylko z jednym kodonem z listy, więc tRNA może rozpoznać tylko jeden kodon. Oznacza to, że w komórce jest co najmniej 61 rodzajów tych cząsteczek. W rzeczywistości jest ich jeszcze więcej, ponieważ w niektórych sytuacjach do odczytu informacyjnego RNA nie wystarczy posiadanie odpowiedniego antykodonu: wymagane są inne warunki, zgodnie z którymi powstaje specjalny, zmodyfikowany tRNA.
Na pierwszy rzut oka taka różnorodność tRNA powinna znacząco skomplikować proces translacji: wszak każda z tych molekuł sprawdzi kodon macierzy RNA zastąpiony przez rybosom pod kątem zgodności z jego antykodonem – wydawałoby się, że tyle bezcelowej pracy mechanicznej , tyle zmarnowanego czasu i energii. Ale w wyniku ewolucji powstały również mechanizmy komórkowe, które zapobiegają temu problemowi. Na przykład ilość tRNA każdego gatunku w komórce odpowiada temu, jak często aminokwas niesiony przez ten gatunek znajduje się w budowanych białkach. Istnieją aminokwasy, które są rzadko używane przez komórkę i są takie, które są często używane, a jeśli liczba niosących je tRNA byłaby taka sama, znacznie skomplikowałoby to składanie białek. Dlatego w komórce jest niewiele „rzadkich” aminokwasów i odpowiadających im tRNA, podczas gdy często występujące aminokwasy są produkowane w dużych ilościach.

Przy takiej różnorodności cząsteczek tRNA wszystkie są bardzo podobne, dlatego biorąc pod uwagę ich strukturę i funkcje, będziemy badać głównie cechy wspólne dla wszystkich gatunków. Kiedy spojrzysz na trójwymiarowy układ tRNA, wygląda on jak gęsty stos atomów. Wydaje się niewiarygodne, że ta misternie zwinięta cząsteczka jest wynikiem fałdowania długiego łańcucha nukleotydów, ale tak właśnie powstaje.
Możliwe jest prześledzenie etapów jego powstawania, począwszy od pierwszego: kompilacji sekwencji nukleotydowej przez polimerazę RNA zgodnie z genem zawierającym informacje o tym transferowym RNA. Kolejność, w jakiej te nukleotydy następują po sobie i ich liczba, nazywa się pierwszorzędowa struktura tRNA. Okazuje się, że to właśnie podstawowa struktura tRNA jest zakodowana w genie odczytanym przez polimerazę RNA. Ogólnie rzecz biorąc, struktura pierwotna jest sekwencją stosunkowo prostych cząsteczek tego samego typu, z których składa się bardziej złożona, pofałdowana cząsteczka polimeru. Na przykład podstawowa struktura cząsteczki białka to prosta sekwencja jego składowych aminokwasów.

Żaden łańcuch nukleotydów nie może być w komórce w stanie rozwiniętym, po prostu rozciągnięty w linii. Na krawędziach nukleotydów jest zbyt wiele dodatnio i ujemnie naładowanych części, które łatwo tworzą ze sobą wiązania wodorowe. W jaki sposób te same wiązania powstają między nukleotydami dwóch cząsteczek DNA, łącząc je w podwójną helisę, opisano w i można uzyskać szczegółowe informacje na temat wiązań wodorowych. Wiązania wodorowe są słabsze niż wiązania między atomami w cząsteczkach, ale wystarczają, aby misternie skręcić nić tRNA i utrzymać ją w tej pozycji. Początkowo wiązania te tworzą się tylko między niektórymi nukleotydami, zwijając tRNA w kształt liścia koniczyny. Wynik tego początkowego składania nazywa się struktura drugorzędowa tRNA. Diagram po lewej pokazuje, że tylko niektóre nukleotydy są połączone wiązaniami wodorowymi, podczas gdy inne pozostają niesparowane, tworząc pierścienie i pętle. Różnice między drugorzędową strukturą różnych typów tRNA wynikają z różnic w ich pierwotnej strukturze. Objawia się to różnymi długościami „liści koniczyny” lub „łodygi” ze względu na różne długości początkowego łańcucha nukleotydów.
Inną różnicą w pierwotnej strukturze różnych tRNA jest to, że tylko w niektórych pozycjach mają te same nukleotydy (na powyższym schemacie są oznaczone pierwszymi literami ich nazw), podczas gdy większość nukleotydów w różnych tRNA różni się od siebie. Powyższy schemat jest wspólny dla wszystkich tRNA, więc różne nukleotydy są oznaczone numerami.
Główne funkcjonalne części tRNA to:
=) antykodon, czyli sekwencja nukleotydów komplementarna do pojedynczego kodonu informacyjnego RNA zlokalizowanego na antykodon spinka do włosów
=) akceptujący koniec do którego można dołączyć aminokwas. Znajduje się po przeciwnej stronie szpilki antykodonu.
W rzeczywistości żadne pojedyncze tRNA nie wygląda tak, jak na schemacie struktury drugorzędowej, ponieważ tylko niektóre nukleotydy połączyły się, aby je utworzyć, podczas gdy reszta pozostała niesparowana. Ze względu na tworzenie wiązań wodorowych między nukleotydami z różnych części liścia koniczyny, fałduje się on dalej w znacznie bardziej złożony struktura trzeciorzędowa w kształcie litery L. Możesz dokładnie zrozumieć, jak różne części struktury drugorzędowej zakrzywiają się, tworząc strukturę trzeciorzędową, dopasowując kolory na poniższych diagramach. Spinka antykodonu, zaznaczona na niebiesko i szaro, pozostaje na dole (warto pamiętać, że to „dół” jest warunkowe: wygodnie jest przedstawić tRNA w tej orientacji przestrzennej w schematach translacji białek), a koniec akceptorowy (żółty) jest zgięty na bok.

Tak wygląda tRNA, gdy jest gotowe do przyłączenia aminokwasu. tRNA nie jest w stanie samodzielnie łączyć się z aminokwasem, wymaga to udziału specjalnego enzymu: syntetazy aminoacylo-tRNA. Liczba typów syntetazy w komórce pokrywa się z liczbą typów tRNA.
Jednolitość kształtu wszystkich typów tRNA jest konieczna, aby rybosom mógł rozpoznać każdy z nich, ułatwić jego dokowanie z mRNA i przemieszczać się w sobie z jednego miejsca do drugiego. Gdyby różne typy tRNA znacznie różniły się od siebie, bardzo utrudniłoby to pracę rybosomu, co krytycznie zmniejszyłoby tempo syntezy białek. Dobór naturalny ma zatem na celu upodobnienie tRNA do siebie. Ale jednocześnie istnieje inny czynnik, który wymaga istnienia zauważalnych różnic między różnymi typami tRNA: w końcu konieczne jest rozpoznanie każdego typu i dołączenie do niego jedynego odpowiadającego mu aminokwasu. Oczywiście różnice te powinny być zauważalne, ale niezbyt znaczące, aby praca rozpoznawania gatunków tRNA zamieniła się w proces jubilerski. I to jest dokładnie to, co jest realizowane przez syntetazy aminoacylo-tRNA: każda z nich może wiązać się tylko z jednym z 20 aminokwasów i łączyć go dokładnie z tymi typami tRNA, które odpowiadają temu aminokwasowi. Z tabeli z kodem genetycznym widać, że każdy aminokwas jest kodowany przez kilka sekwencji nukleotydowych, dlatego np. wszystkie cztery tRNA z antykodonami CGA, CGG, CGU i CGC będą rozpoznawane przez tę samą syntetazę, która przyłącza alaninę do nich. Takie tRNA przetwarzane przez jedną syntetazę nazywa się związane z.
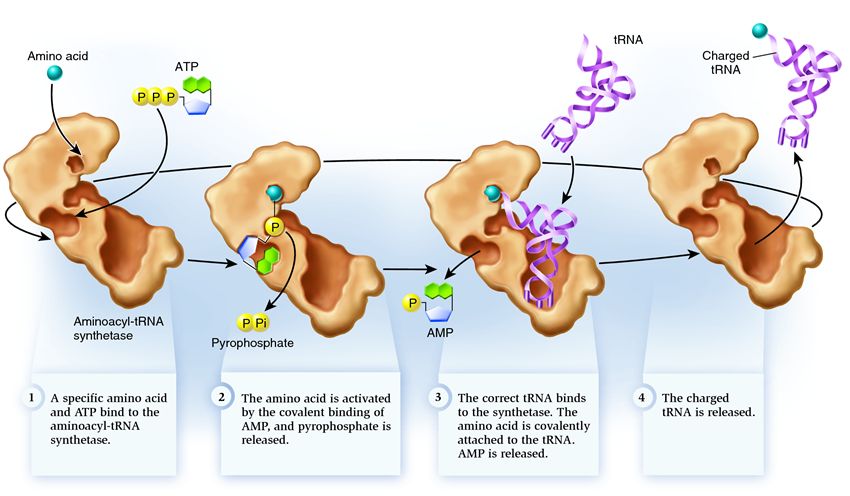
Syntetaza należy do grupy enzymów, których funkcją jest wiązanie się z oddzielnie istniejącymi cząsteczkami i łączenie ich w jeden:
1 . syntetaza łączy aminokwas i cząsteczkę ATP. Dwie grupy fosforanowe odrywają się od ATP, uwalniając energię potrzebną do następujących czynności. Pozostały po zniszczonej cząsteczce monofosforan adenozyny (AMP) przyłącza się do aminokwasu, przygotowując go do połączenia z akceptorową szpilką do włosów.
2 . syntetaza przyłącza do siebie jeden z pokrewnych tRNA odpowiadający temu aminokwasowi.

Na tym etapie sprawdzana jest zgodność transferowego RNA z syntetazą. Istnieje kilka sposobów rozpoznania, a każda syntetaza ma ich unikalną kombinację. Co najmniej jeden nukleotyd antykodonowy bierze udział w interakcji między syntetazą a tRNA. Należy również sprawdzić akceptorową szpilkę do włosów: określa się na niej obecność określonych nukleotydów, które są wspólne dla spokrewnionych tRNA odpowiadających pożądanemu aminokwasowi. Nukleotydy z innych części tRNA mogą również uczestniczyć w dopasowaniu poprzez wiązanie się z określonymi miejscami syntetazy. Niewłaściwe tRNA może w jakiś sposób pasować do pożądanego, ale z powodu niepełnego dopasowania będzie powoli i luźno przyłączać się do syntetazy, łatwo odpadając. A prawidłowe tRNA szybko i mocno przyklei się do syntetazy, w wyniku czego zmieni się struktura syntetazy, rozpoczynając proces aminoacylacja , czyli przyłączanie aminokwasu do tRNA.

3 . aminoacylacja polega na zastąpieniu cząsteczki AMP przyłączonej do aminokwasu cząsteczką tRNA. Po tym zastąpieniu AMP opuszcza syntetazę, a tRNA jest zatrzymywane do ostatniej kontroli aminokwasów. Jeśli dołączony aminokwas zostanie rozpoznany jako nieprawidłowy, zostanie odłączony od tRNA, miejsce aminokwasu w syntetazie będzie puste i może tam dołączyć kolejna cząsteczka. Nowy aminokwas przejdzie przez etapy łączenia z ATP i tRNA, a także będzie testowany. Jeśli nie popełniono żadnych błędów, tRNA naładowane aminokwasami jest uwalniane: jest gotowe do odegrania swojej roli w translacji białek. A syntetaza jest gotowa do przyłączenia nowych aminokwasów i tRNA, a cykl rozpocznie się od nowa.
Wiele zależy od prawidłowego działania syntetazy aminoacylo-tRNA: jeśli na tym etapie nastąpi awaria, do tRNA zostanie przyłączony niewłaściwy aminokwas. I zostanie on wbudowany w białko rosnące na rybosomie, ponieważ tRNA i rybosom nie mają funkcji sprawdzania zgodności kodonu i aminokwasu. Konsekwencje błędu mogą być niewielkie lub katastrofalne, a dzięki doborowi naturalnemu stworzenia z enzymami, które nie pełnią funkcji takich kontroli, zostały wyparte przez bardziej przystosowalne, z różnymi opcjami dopasowania między aminokwasem a tRNA. Dlatego w nowoczesnych komórkach syntetaza łączy się z niewłaściwym aminokwasem średnio w jednym przypadku na 50 tysięcy, a z niewłaściwym tRNA tylko raz na 100 tysięcy przyłączeń.

Niektóre aminokwasy różnią się od siebie tylko kilkoma atomami. Jeśli spojrzysz na ich schematy, stanie się oczywiste, że prawdopodobieństwo pomylenia argininy z alaniną jest znacznie mniejsze niż pomylenia izoleucyny z leucyną lub waliną. Dlatego każda syntetaza, która wiąże się z jednym z podobnych do siebie aminokwasów, ma dodatkowe mechanizmy weryfikacji. Oto przykład takiej adaptacji w syntetazie izoleucyny-tRNA:

Każda syntaza ma centrum syntetyczne w którym aminokwas jest przyłączony do tRNA. Tam trafia akceptorowa spinka do włosów tRNA przechwycona przez syntetazę, podobnie jak aminokwas, który jest gotowy do reakcji z nim. Praca niektórych syntetaz kończy się natychmiast po połączeniu aminokwasu z tRNA. Ale syntetaza Ile-tRNA ma zwiększoną szansę na popełnienie błędów ze względu na istnienie innych aminokwasów podobnych do izoleucyny. Dlatego też ma ośrodek poprawczy: z nazwy jasno wynika, jaką rolę odgrywa w procesie łączenia tRNA i aminokwasów. Rysunek po prawej pokazuje, że pozycja końca spinki do włosów akceptora tRNA w syntetycznym centrum syntetazy Ile-tRNA nadaje tej spince do włosów nienaturalne wygięcie. Jednak syntetaza utrzymuje tRNA w tej pozycji, aż do przyłączenia do niego aminokwasu. Po wystąpieniu tego połączenia potrzeba znalezienia akceptorowej spinki do włosów w syntetycznym centrum zostaje wyczerpana, a tRNA prostuje się, dostając swój koniec z dołączonym do niego aminokwasem do centrum korekcji.

Oczywiście centrum syntetyczne odgrywa również rolę w wyszukiwaniu aminokwasów, które nie są odpowiednie dla syntetazy. Aby się do niego dostać, cząsteczka musi spełniać szereg warunków, w tym mieć odpowiedni rozmiar. Pomimo tego, że leucyna i izoleucyna zawierają taką samą liczbę atomów, to ze względu na różnice w budowie przestrzennej leucyna jest większa. Dlatego nie może przeniknąć do centrum syntetycznego, którego wielkość odpowiada bardziej zwartej izoleucynie i po prostu odbija się od syntetazy Ile-tRNA.
Ale walina, która jest najmniejszą z tych trzech cząsteczek o podobnej budowie atomowej, z łatwością zajmuje miejsce izoleucyny w centrum syntetycznym, a syntetaza przyłącza ją do tRNA. W tym przypadku w grę wchodzi korekcyjne centrum syntetazy. Jeśli szpilka do prostowania akceptora jest prawidłowo naładowana i zawiera izoleucynę, to nie może wcisnąć się do środka korekcji: jest po prostu za mała dla tej cząsteczki. W ten sposób wyprostowane tRNA nie jest już przez nic utrzymywane i jest odłączane od syntetazy. Ale jeśli walina jest przyłączona do tRNA, wślizguje się do centrum korekcji, utrzymując w ten sposób tRNA połączone z nim w syntetazie. Tak zbyt długi pobyt tRNA w środku jest sygnałem błędu dla syntetazy, zmieniającym jej konfigurację przestrzenną. W rezultacie:
=) walina jest odłączona od tRNA i usunięta z syntetazy
=) spinka akceptora wraca do miejsca syntetycznego, czekając na przyłączenie do aminokwasu
=) syntetaza wiąże się z nowym aminokwasem, „ładuje” nim tRNA i ponownie sprawdza, czy użyto do tego izoleucyny.
Podobny mechanizm podwójnego rozpoznawania stosują inne syntetazy.
Właściwości fizyczne i chemiczne DNA
Różne czynniki rozrywające wiązania wodorowe (wzrost temperatury powyżej 80 C, zmiany pH i siły jonowej, działanie mocznika itp.) powodują denaturację DNA, tj. zmiana przestrzennego ułożenia łańcuchów DNA bez zrywania wiązań kowalencyjnych. Podwójna helisa DNA podczas denaturacji jest całkowicie lub częściowo podzielona na swoje łańcuchy składowe. Denaturacji DNA towarzyszy wzrost absorpcji optycznej w obszarze UV zasad purynowych i pirymidynowych. Zjawisko to nazywa się efekt hiperchromiczny . Denaturacja zmniejsza również wysoką lepkość właściwą natywnym roztworom DNA. Kiedy pierwotna dwuniciowa struktura DNA zostaje przywrócona, w wyniku renaturacji, absorpcja przy 260 nm przez zasady azotowe zmniejsza się z powodu ich „ekranowania”. Zjawisko to nazywa się efekt hipochromiczny .
„Rozwijanie” każdego DNA w jego łańcuchy składowe odbywa się w określonym zakresie temperatur. Środek tego przedziału nazywany jest temperaturą topnienia. Temperatura topnienia DNA zależy w standardowych warunkach (określone pH i siła jonowa) od stosunku zasad azotowych. Pary G-C zawierające trzy wiązania wodorowe są silniejsze, dlatego im wyższa zawartość par G-C w DNA, tym wyższa temperatura topnienia.
Funkcje DNA. W sekwencji nukleotydów w cząsteczkach DNA zakodowana jest informacja genetyczna. Główne funkcje DNA to, po pierwsze, zapewnienie reprodukcji samego siebie w szeregu pokoleń komórek i pokoleń organizmów, a po drugie, zapewnienie syntezy białek. Funkcje te wynikają z faktu, że cząsteczki DNA służą jako matryca w pierwszym przypadku replikacji, tj. kopiowanie informacji w potomnych cząsteczkach DNA, w drugim - do transkrypcji, tj. przekodować informacje do struktury RNA.
Ryż. 5 Krzywa topnienia (denaturacja DNA)
Dopełniające się nici DNA oddzielone podczas denaturacji mogą, w pewnych warunkach, ponownie połączyć się w podwójną helisę. Proces ten nazywa się RENaturacją. Jeśli denaturacja nie zaszła całkowicie i co najmniej kilka zasad nie utraciło oddziaływania przez wiązania wodorowe, renaturacja postępuje bardzo szybko.
Cytoplazma komórek zawiera trzy główne funkcjonalne typy RNA. Są to informacyjne RNA – mRNA, które działają jako matryce do syntezy białek, rybosomalne RNA – rRNA, które działają jako strukturalne składniki rybosomów, oraz transferowe RNA – tRNA zaangażowane w translację (translację) informacji o mRNA na sekwencję aminokwasową w białku.
Tabela 2 pokazuje różnice między DNA i RNA pod względem struktury, lokalizacji w komórce i funkcji.
Tabela 2 Różnice między DNA a RNA
Transfer RNA, tRNA-kwas rybonukleinowy, którego funkcją jest transport AA do miejsca syntezy białek. Ma typową długość od 73 do 93 nukleotydów i rozmiar około 5 nm. tRNA są również bezpośrednio zaangażowane we wzrost łańcucha polipeptydowego, łącząc - będąc w kompleksie z aminokwasem - z kodonem mRNA i zapewniając konformację kompleksu niezbędną do utworzenia nowego wiązania peptydowego. Każdy aminokwas ma swój własny tRNA. tRNA jest jednoniciowym RNA, ale w swojej funkcjonalnej postaci ma konformację koniczyny. AA jest kowalencyjnie przyłączone do 3" końca cząsteczki za pomocą enzymu syntetazy aminoacylo-tRNA, specyficznego dla każdego typu tRNA. W miejscu C znajduje się antykodon odpowiadający AA-te. tRNA są syntetyzowane przez zwykłą polimerazę RNA w w przypadku prokariotów oraz polimerazę III RNA w przypadku eukariontów Transkrypcje genów tRNA podlegają wieloetapowej obróbce, co prowadzi do powstania struktury przestrzennej typowej dla tRNA.
Przetwarzanie tRNA obejmuje 5 kluczowych etapów:
usunięcie sekwencji nukleotydowej lidera 5";
usunięcie 3'-końcowej sekwencji;
dodanie sekwencji CCA na końcu 3";
wycięcie intronów (u eukariotów i archeonów);
modyfikacje poszczególnych nukleotydów.
Transport tRNA odbywa się szlakiem zależnym od Ran z udziałem czynnika transportującego exportin t, który rozpoznaje charakterystyczne drugorzędowe i trzeciorzędowe str-ru dojrzałego tRNA: krótkie dwuniciowe odcinki i prawidłowo przetworzone 5"- i 3" kończy się. Ten mechanizm zapewnia, że tylko dojrzałe tRNA są eksportowane z jądra.
62. Translacja – rozpoznawanie kodonów mRNA
Translacja to synteza białek przeprowadzana przez rybosomy z aminokwasów na matrycy mRNA (lub i RNA). Elementy składowe procesu translacji: aminokwasy, tRNA, rybosomy, mRNA, enzymy aminoacylacji tRNA, białkowe czynniki translacji (białkowe czynniki inicjacji, elongacji, terminacji – specyficzne białka pozarybosomalne niezbędne w procesach translacji), źródła energii ATP i GTP , jony magnezu (stabilizują strukturę rybosomów). W syntezę białek bierze udział 20 aminokwasów. Aby aminokwas „rozpoznał” swoje miejsce w przyszłym łańcuchu polipeptydowym, musi związać się z transferowym RNA (tRNA), które pełni funkcję adaptacyjną. tRNA, które wiąże się z aminokwasem, rozpoznaje następnie odpowiedni kodon na mRNA. Rozpoznawanie kodonów mRNA:
Interakcja kodon-antykodon opiera się na zasadach komplementarności i antyrównoległości:
3'----C - G-A*------5' Antykodon tRNA
5'-----G-C-Y*------3' kodon mRNA
Hipotezę chybotania zaproponował F. Crick:
3'-zasada kodonu mRNA ma nieścisłe parowanie z 5'-zasadą antykodonu tRNA: na przykład Y (mRNA) może oddziaływać z A i G (tRNA)
Niektóre tRNA mogą łączyć się z więcej niż jednym kodonem.
63. Charakterystyka elementów składowych procesu tłumaczeniowego. Translacja (translatio-translacja) to proces syntezy białek z aminokwasów na matrycy informacyjnego (macierzy) RNA (mRNA, mRNA) realizowany przez rybosom.
Synteza białek jest podstawą życia komórki. Aby przeprowadzić ten proces w komórkach wszystkich organizmów, istnieją specjalne organelle - rybosomy- kompleksy rybonukleoproteinowe zbudowane z 2 podjednostek: dużej i małej. Funkcją rybosomów jest rozpoznawanie trzyliterowego (trzynukleotydowego) kodony mRNA, porównując je z odpowiednimi antykodonami tRNA niosącymi aminokwasy i dodanie tych aminokwasów do rosnącego łańcucha białkowego. Poruszając się wzdłuż cząsteczki mRNA, rybosom syntetyzuje białko zgodnie z informacją zawartą w cząsteczce mRNA.
Do rozpoznawania AK-t w komórce służą specjalne „adaptery”, przenieść cząsteczki RNA(tRNA). Te cząsteczki w kształcie liścia koniczyny mają miejsce (antykodon) komplementarne do kodonu mRNA, a także inne miejsce, do którego przyłączony jest aminokwas odpowiadający temu kodonowi. Przyłączenie aminokwasów do tRNA odbywa się w zależnej od energii reakcji przez enzymy syntetazy aminoacylo-tRNA, a powstała w ten sposób cząsteczka nazywana jest aminoacylo-tRNA. Tak więc specyficzność translacji jest determinowana przez interakcję między kodonem mRNA i antykodonem tRNA, a także specyficzność syntetaz aminoacylo-tRNA, które wiążą aminokwasy ściśle z odpowiadającymi im tRNA (na przykład kodon GGU będzie odpowiadał tRNA zawierający antykodon CCA i tylko glicynę AK).
rybosom prokariotyczny
5S i 23S rRNA 16S rRNA
34 wiewiórki 21 wiewiórek
Rybosomy prokariotyczne mają stałą sedymentacji 70S, dlatego nazywa się je cząstkami 70S. Zbudowane są z dwóch różnych podjednostek: podjednostek 30S i 50S. Każda podjednostka to kompleks rRNA i białek rybosomalnych.
Cząstka 30S zawiera jedną cząsteczkę 16S rRNA iw większości przypadków jedną cząsteczkę białka z ponad 20 gatunków (21). Podjednostka 50S składa się z dwóch cząsteczek rRNA (23S i 5S). Składa się z ponad 30 różnych białek (34), również reprezentowanych z reguły przez jedną kopię. Większość białek rybosomalnych pełni funkcję strukturalną.
rybosom eukariotyczny
5S; 5,8S i 28S rRNA 18S rRNA
co najmniej 50 białek co najmniej 33 białka
Rybosom składa się z dużych i małych podjednostek. Podstawą budowy każdej podjednostki jest złożony rRNA. Białka rybosomalne były przyłączone do rusztowania rRNA.
Współczynnik sedymentacji kompletnego rybosomu eukariotycznego wynosi około 80 jednostek Svedberga (80S), a współczynnik sedymentacji jego podcząstek to 40S i 60S.
Mniejsza podjednostka 40S składa się z jednej cząsteczki 18S rRNA i 30-40 cząsteczek białka. Duża podjednostka 60S zawiera trzy typy rRNA o współczynnikach sedymentacji białek 5S, 5,8S i 28S oraz 40-50 (na przykład rybosomy szczurzych hepatocytów zawierają 49 białek).
Funkcjonalne regiony rybosomów
P - miejsce peptydylowe dla peptydylowego tRNA
A - miejsce aminoacylowe dla aminoacylo tRNA
E - miejsce uwalniania tRNA z rybosomu
Rybosom zawiera 2 funkcjonalne miejsca interakcji z tRNA: aminoacylo (akceptor) i peptydyl (donor). Aminoacylo-tRNA wchodzi w miejsce akceptorowe rybosomu i oddziałuje, tworząc wiązania wodorowe między tripletami kodonów i antykodonów. Po utworzeniu wiązań wodorowych system przesuwa się o 1 kodon i kończy w miejscu dawcy. W tym samym czasie w zwolnionym miejscu akceptorowym pojawia się nowy kodon, do którego przyłącza się odpowiedni aminoacylo-t-RNA.
Rybosomy: struktura, funkcja
Rybosomy są cytoplazmatycznymi centrami biosyntezy białek. Składają się z dużych i małych podjednostek, różniących się współczynnikami sedymentacji (szybkość sedymentacji podczas wirowania), wyrażonymi w jednostkach Svedberg - S.
Rybosomy są obecne zarówno w komórkach eukariotycznych, jak i prokariotycznych, ponieważ pełnią ważną funkcję w: biosynteza białek. Każda komórka zawiera dziesiątki, setki tysięcy (do kilku milionów) tych małych okrągłych organelli. Jest to zaokrąglona cząsteczka rybonukleoproteinowa. Jego średnica to 20-30 nm. Rybosom składa się z dużych i małych podjednostek, różniących się współczynnikami sedymentacji (szybkość sedymentacji podczas wirowania), wyrażonymi w jednostkach Svedberga - S. Podjednostki te są łączone w obecności nici m-RNA (macierzowy lub informacyjny RNA). Nazywa się kompleks grupy rybosomów połączonych pojedynczą cząsteczką mRNA, taką jak sznur koralików polisom. Struktury te są albo swobodnie zlokalizowane w cytoplazmie, albo przyłączone do błon ziarnistego ER (w obu przypadkach aktywnie przebiega na nich synteza białek).
Polisomy granulowanego ER tworzą białka wydalane z komórki i wykorzystywane na potrzeby całego organizmu (np. enzymy trawienne, białka mleka kobiecego). Ponadto rybosomy znajdują się na wewnętrznej powierzchni błon mitochondrialnych, gdzie również biorą czynny udział w syntezie cząsteczek białek.
Transferowe RNA (tRNA) odgrywa ważną rolę w procesie wykorzystywania informacji dziedzicznej przez komórkę. Dostarczając niezbędne aminokwasy do miejsca montażu łańcuchów peptydowych, tRNA działa jako mediator translacji.
Cząsteczki tRNA to łańcuchy polinukleotydowe syntetyzowane na określonych sekwencjach DNA. Składają się ze stosunkowo niewielkiej liczby nukleotydów -75-95. W wyniku komplementarnego połączenia zasad, które znajdują się w różnych częściach łańcucha polinukleotydowego tRNA, uzyskuje on strukturę przypominającą kształtem liść koniczyny (ryc. 3.26).
Ryż. 3.26. Struktura typowej cząsteczki tRNA.
Składa się z czterech głównych części, które pełnią różne funkcje. akceptor„Łodyga” jest utworzona przez dwie komplementarnie połączone końcowe części tRNA. Składa się z siedmiu par zasad. Koniec 3' tego pnia jest nieco dłuższy i tworzy jednoniciowy region, który kończy się sekwencją CCA z wolną grupą OH. Do tego końca dołączony jest przenośny aminokwas. Pozostałe trzy rozgałęzienia to komplementarne sparowane sekwencje nukleotydowe, które kończą się niesparowanymi odcinkami, które tworzą pętle. Środek tych rozgałęzień - antykodon - składa się z pięciu par nukleotydów i zawiera antykodon w środku swojej pętli. Antykodon to trzy nukleotydy komplementarne do kodonu mRNA, który koduje aminokwas transportowany przez ten tRNA do miejsca syntezy peptydu.
Pomiędzy odgałęzieniami akceptora i antykodonu znajdują się dwa odgałęzienia boczne. W swoich pętlach zawierają zmodyfikowane zasady - dihydrourydynę (pętla D) i triplet TψC, gdzie \y oznacza pseudourydynę (pętla T^C).
Pomiędzy gałęziami aitikodonu i T^C znajduje się dodatkowa pętla, która zawiera od 3-5 do 13-21 nukleotydów.
Generalnie różne typy tRNA charakteryzują się pewną stałością sekwencji nukleotydowej, która najczęściej składa się z 76 nukleotydów. Zmienność ich liczby wynika głównie ze zmiany liczby nukleotydów w dodatkowej pętli. Regiony komplementarne, które wspierają strukturę tRNA, są zwykle konserwowane. Pierwotna struktura tRNA, określona przez sekwencję nukleotydów, tworzy drugorzędową strukturę tRNA, która ma kształt liścia koniczyny. Z kolei struktura drugorzędowa powoduje trójwymiarową strukturę trzeciorzędową, która charakteryzuje się tworzeniem dwóch prostopadłych podwójnych helis (ryc. 3.27). Jeden z nich tworzą odgałęzienia akceptora i TψC, a drugi odgałęzienia antykodonu i D.
Na końcu jednej z podwójnych helis znajduje się transportowany aminokwas, a na końcu drugiej znajduje się antykodon. Obszary te są najbardziej od siebie oddalone. Stabilność trzeciorzędowej struktury tRNA jest utrzymywana dzięki pojawieniu się dodatkowych wiązań wodorowych między zasadami łańcucha polinukleotydowego, zlokalizowanych w różnych jego częściach, ale blisko przestrzennie w trzeciorzędowej strukturze.
Różne typy tRNA mają podobną strukturę trzeciorzędową, chociaż z pewnymi odmianami.
Ryż. 3.27. Przestrzenna organizacja tRNA:
I - drugorzędowa struktura tRNA w postaci „liścia koniczyny”, określona przez jego strukturę pierwotną (sekwencja nukleotydów w łańcuchu);
II - dwuwymiarowa projekcja trzeciorzędowej struktury tRNA;
III - układ cząsteczki tRNA w przestrzeni
DODATEK (w przypadku, gdy ktoś tego nie rozumie)
Błyskawiczne zęby - nukleotydy (adenina-tymina / uracyl /, guanina-cytazyna). Każda błyskawica to DNA.

Aby przenieść informacje z DNA, musisz zerwać 2 nici. Wiązanie pomiędzy A-T i G-C to wodór, dlatego łatwo je rozbija enzym Helicase:

Aby zapobiec tworzeniu się węzłów (na przykład skręciłem ręcznik):



Topoizomeraza tnie jedną nić DNA na początku replikacji, tak aby łańcuch się nie skręcał.

Gdy jedna nić jest wolna, druga może łatwo obracać się wokół własnej osi, łagodząc w ten sposób napięcie podczas „odwijania”. Węzły się nie pojawiają, energia jest oszczędzana.
Następnie potrzebny jest starter RNA, aby rozpocząć zbieranie RNA. Białko, które składa mRNA, nie może po prostu złożyć pierwszego nukleotydu, potrzebuje kawałka RNA, aby rozpocząć (jest to szczegółowo napisane tam, opiszę to później). Ten fragment nazywa się starterem RNA. A to białko już przyłącza do niego pierwszy nukleotyd.


Opisując budowę kwasów nukleinowych brane są pod uwagę różne poziomy organizacji makrocząsteczek: struktura pierwotna i drugorzędowa.
Pierwszorzędowa struktura kwasów nukleinowych to skład nukleotydów i pewna sekwencja jednostek nukleotydowych w łańcuchu polimerowym.
Drugorzędowa struktura RNA. Cząsteczka kwasu rybonukleinowego jest zbudowana z pojedynczego łańcucha polinukleotydowego.
Drugorzędowa struktura RNA
Oddzielne odcinki łańcucha RNA tworzą spiralne pętle - „szpilki do włosów”, dzięki wiązaniom wodorowym między komplementarnymi zasadami azotowymi A-U i G-C. Odcinki łańcucha RNA w takich strukturach helikalnych są antyrównoległe, ale nie zawsze całkowicie komplementarne, zawierają niesparowane reszty nukleotydowe lub nawet jednoniciowe pętle, które nie pasują do podwójnej helisy. Obecność spiralizowanych regionów jest charakterystyczna dla wszystkich typów RNA.
Główną rolą RNA jest bezpośredni udział w biosyntezie białek.
Znane są trzy typy komórkowego RNA, które różnią się umiejscowieniem w komórce, składem, wielkością oraz właściwościami, które determinują ich specyficzną rolę w tworzeniu makrocząsteczek białkowych:
- informacyjne (macierzowe) RNA przekazują zakodowaną w DNA informację o budowie białka z jądra komórkowego do rybosomów, gdzie odbywa się synteza białka; struktura pierwotna wszystkich mRNA, niezależnie od unikalności ich sekwencji kodującej, ma taką samą strukturę końców 5' i 3'.
Tak więc na końcu 5' znajduje się zmodyfikowany nukleotyd 7-metyloguanozyno-5'-trifosforan (czapka). Kilkadziesiąt nukleotydów oddziela czapeczkę od kodonu inicjacji, zwykle trypletu -AUG-. Po regionie kodującym następuje jeden z kodonów terminacji -UGA-, -UUA-, -UAG-. Na końcu 3' większości mRNA znajduje się sekwencja nukleotydowa 100-200 reszt adenozynomonofosforanu.
- transferowe RNA gromadzą aminokwasy w cytoplazmie komórki i przenoszą je do rybosomu; Cząsteczki RNA tego typu „uczą się” z odpowiednich odcinków łańcucha informacyjnego RNA, które aminokwasy powinny uczestniczyć w syntezie białek.
Strukturę przestrzenną dowolnego tRNA, niezależnie od różnic w sekwencji nukleotydów, opisuje uniwersalny model koniczyny. Każda cząsteczka tRNA ma odcinki łańcucha, które nie biorą udziału w tworzeniu wiązań wodorowych między resztami nukleotydów.
Obejmują one w szczególności miejsce odpowiedzialne za wiązanie z aminokwasem na końcu 3' cząsteczki oraz antykodon, specyficzną trójkę nukleotydów, która oddziałuje komplementarnie z kodonem mRNA.
- rybosomalny RNA zapewnia syntezę białek o określonej strukturze, odczytując informacje z informacyjnego (macierzy) RNA. rRNA tworzą kompleksy z białkami zwanymi rybosomami.
Każdy rybosom składa się z dwóch podjednostek - małej (40S) i dużej (60S). Podjednostki rybosomów różnią się nie tylko zestawem rRNA, ale także liczbą i strukturą białek.
Data publikacji: 2015-02-03; Przeczytaj: 2729 | Naruszenie praw autorskich do strony

RNA to polimer, którego monomerami są rybonukleotydy.
W przeciwieństwie do DNA, RNA składa się nie z dwóch, ale z jednego łańcucha polinukleotydowego (wyjątek - niektóre wirusy zawierające RNA mają dwuniciowy RNA). Nukleotydy RNA są zdolne do tworzenia ze sobą wiązań wodorowych. Łańcuchy RNA są znacznie krótsze niż łańcuchy DNA.
Monomer RNA - nukleotyd (rybonukleotyd) - składa się z reszt trzech substancji: 1) zasady azotowej, 2) pięciowęglowego monosacharydu (pentozy) i 3) kwasu fosforowego. Zasady azotowe RNA również należą do klas pirymidyn i puryn.
Zasady pirymidynowe RNA - uracyl, cytozyna, zasady purynowe - adenina i guanina.
31. Rodzaje RNA i cechy jego budowy
Monosacharyd nukleotydu RNA jest reprezentowany przez rybozę.
Istnieją trzy rodzaje RNA: 1) informacyjny (macierz) RNA - mRNA (mRNA), 2) transferowy RNA - tRNA, 3) rybosomalny RNA - rRNA.
Wszystkie rodzaje RNA są nierozgałęzionymi polinukleotydami, mają określoną konformację przestrzenną i biorą udział w procesach syntezy białek.
Informacje o strukturze wszystkich typów RNA są przechowywane w DNA. Proces syntezy RNA na matrycy DNA jest powszechnie nazywany transkrypcją.

Transferowe RNA zazwyczaj zawierają 76 (od 75 do 95) nukleotydów; masa cząsteczkowa - 25 000-30 000.
tRNA stanowi około 10% całkowitej zawartości RNA w komórce. Funkcje tRNA: 1) transport aminokwasów do miejsca syntezy białek, do rybosomów, 2) mediator translacji. W komórce znajduje się około 40 typów tRNA, każdy z nich ma charakterystyczną tylko dla niej sekwencję nukleotydową. Jednocześnie wszystkie tRNA mają kilka wewnątrzcząsteczkowych regionów komplementarnych, dzięki czemu tRNA uzyskują konformację przypominającą kształtem liść koniczyny.
Każde tRNA ma pętlę do kontaktu z rybosomem (1), pętlę antykodonową (2), pętlę do kontaktu z enzymem (3), pień akceptorowy (4) i antykodon (5). Aminokwas jest przyłączony do końca 3' trzonu akceptora. Antykodon - trzy nukleotydy, które „rozpoznają” kodon mRNA.
Należy podkreślić, że określone tRNA może transportować ściśle określony aminokwas odpowiadający jego antykodonowi. Specyfikę połączenia aminokwasów i tRNA uzyskuje się dzięki właściwościom enzymu syntetazy aminoacylo-tRNA.
Rybosomalne RNA zawierają 3000–5000 nukleotydów; masa cząsteczkowa - 1 000 000-1 500 000.
rRNA stanowi 80-85% całkowitej zawartości RNA w komórce. W kompleksie z białkami rybosomalnymi rRNA tworzy rybosomy - organelle, które przeprowadzają syntezę białek. W komórkach eukariotycznych synteza rRNA zachodzi w jąderku. Funkcje rRNA: 1) niezbędny składnik strukturalny rybosomów, a tym samym zapewniający funkcjonowanie rybosomów; 2) zapewnienie interakcji rybosomu i tRNA; 3) początkowe wiązanie rybosomu i kodonu inicjatora mRNA oraz określenie ramki odczytu, 4) tworzenie aktywnego centrum rybosomu.
Komunikatorowe RNA różnią się zawartością nukleotydów i masą cząsteczkową (od 50 000 do 4 000 000).
Udział mRNA stanowi do 5% całkowitej zawartości RNA w komórce. Funkcje mRNA: 1) transfer informacji genetycznej z DNA do rybosomów, 2) matryca do syntezy cząsteczki białka, 3) określenie sekwencji aminokwasowej pierwotnej struktury cząsteczki białka.
Przeczytaj także
RNA to polimer, którego monomerami są nukleotydy.
Trzy zasady azotowe są takie same jak w DNA (adenina, guanina, cytozyna); czwarty - uracyl - jest obecny w cząsteczce RNA zamiast tyminy. Nukleotydy RNA zawierają rybozę zamiast dezoksyrybozy. W łańcuchu RNA...
trzy główne typy RNA: informacyjny(mRNA) lub matryca(mRNA), rybosomalny(rRNA) i transport(tRNA). Różnią się wielkością i funkcją cząsteczek. Wszystkie rodzaje RNA są syntetyzowane na DNA przy udziale enzymów - polimeraz RNA. Messenger RNA stanowi 2-3% całego komórkowego RNA, rybosom - 80-85, transport - około 15%.
mRNA.
odczytuje informacje dziedziczne z segmentu DNA i w postaci skopiowanej sekwencji zasad azotowych przenosi je do rybosomów, gdzie syntetyzuje się określone białko. Każda z cząsteczek mRNA w kolejności nukleotydów i wielkości odpowiada genowi w DNA, z którego została przepisana. Średnio mRNA zawiera 1500 nukleotydów (75-3000). Każda trójka (trzy nukleotydy) na mRNA nazywana jest kodonem. Zależy to od kodonu, który aminokwas pojawi się w danym miejscu podczas syntezy białka.
(tRNA) ma stosunkowo niską masę cząsteczkową około 24-29 tys.
D i zawiera od 75 do 90 nukleotydów w cząsteczce. Aż 10% wszystkich nukleotydów tRNA to drugorzędne zasady, co najwyraźniej chroni je przed działaniem enzymów hydrolitycznych.Rola tRNA polega na tym, że przenoszą aminokwasy do rybosomów i uczestniczą w procesie syntezy białek. Każdy aminokwas przyłącza się do określonego tRNA. Wiele aminokwasów ma więcej niż jedno tRNA. Do chwili obecnej odkryto ponad 60 tRNA różniących się strukturą pierwotną (sekwencją zasad).
Struktura drugorzędowa wszystkich tRNA jest przedstawiona w postaci liścia koniczyny z dwuniciową łodygą i trzema jednoniciowymi). Na końcu jednego z łańcuchów znajduje się miejsce akceptorowe - triplet CCA, do którego przyłącza się adeninę określony aminokwas.
(rRNA). Zawierają 120-3100 nukleotydów. Rybosomalny RNA gromadzi się w jądrze, w jąderkach.
Białka rybosomalne są transportowane do jąderek z cytoplazmy i tam następuje spontaniczne tworzenie subcząstek rybosomalnych poprzez łączenie białek z odpowiednim rRNA. Subcząstki rybosomu są transportowane razem lub oddzielnie przez pory błony jądrowej do cytoplazmy. Rybosomy to organelle o wielkości 20-30 nm.
Zbudowane są z dwóch podcząstek o różnych rozmiarach i kształtach. Na pewnych etapach syntezy białek w komórce rybosomy dzielą się na podcząsteczki.
Rybosomalny RNA służy jako szkielet dla rybosomów i ułatwia początkowe wiązanie mRNA z rybosomem podczas biosyntezy białka.
Pytanie 6 Wiązania, które tworzą pierwotne i wtórne struktury DNA i RNA. Rodzaje RNA
Kod genetyczny to sposób kodowania sekwencji aminokwasowej białek za pomocą sekwencji nukleotydów, charakterystycznej dla wszystkich żywych organizmów.
Właściwości: 1) kod genetyczny tryplet(każdy aminokwas jest kodowany przez trzy nukleotydy); 2) nienakładające się(sąsiadujące trojaczki nie mają wspólnych nukleotydów); 3) zdegenerowany(z wyjątkiem metioniny i tryptofanu wszystkie aminokwasy mają więcej niż jeden kodon); 4) uniwersalny(w większości takie same dla wszystkich żywych organizmów); 5) w kodonach dla jednego aminokwasu, pierwsze dwa nukleotydy są zwykle takie same, a trzeci zmienia się; 6) ma liniową kolejność odczytu i charakteryzuje się współliniowość, t.
e. zbieżność kolejności kodonów w mRNA z kolejnością aminokwasów w syntetyzowanym łańcuchu polipeptydowym.
Data publikacji: 08.12.2014; Przeczytaj: 11268 | Naruszenie praw autorskich do strony
studopedia.org - Studopedia.Org - 2014-2018 (0,001 s) ...
Cytoplazma komórek zawiera trzy główne funkcjonalne typy RNA:
- informacyjne RNA (mRNA), które działają jako matryce do syntezy białek;
- rybosomalny RNA (rRNA) działający jako składniki strukturalne rybosomów;
- transferowe RNA (tRNA) zaangażowane w translację (translację) informacji o mRNA na sekwencję aminokwasową cząsteczki białka.
W jądrze komórkowym znajduje się jądrowy RNA, stanowiący od 4 do 10% całkowitego komórkowego RNA.
Większość jądrowego RNA jest reprezentowana przez wielkocząsteczkowe prekursory rybosomalnego i transferowego RNA. Prekursory rRNA o dużej masie cząsteczkowej (28 S, 18 S i 5 S RNA) są zlokalizowane głównie w jąderku.
RNA jest głównym materiałem genetycznym niektórych wirusów zwierzęcych i roślinnych (genomowy RNA). Większość wirusów RNA charakteryzuje się odwrotną transkrypcją ich genomu RNA, kierowaną przez odwrotną transkryptazę.
Wszystkie kwasy rybonukleinowe są polimerami rybonukleotydów połączonych, jak w cząsteczce DNA, wiązaniami 3',5'-fosforodiestrowymi.
W przeciwieństwie do DNA, który ma strukturę dwuniciową, RNA jest jednoniciową liniową cząsteczką polimerową.
Struktura mRNA. mRNA jest najbardziej niejednorodną klasą RNA pod względem wielkości i stabilności.
struktura tRNA.
Transferowe RNA działają jako mediatory (adaptery) podczas translacji mRNA. Stanowią one około 15% całkowitego komórkowego RNA. Każdy z 20 aminokwasów proteinogennych ma swój własny tRNA. W przypadku niektórych aminokwasów kodowanych przez dwa lub więcej kodonów istnieje kilka tRNA.
tRNA to stosunkowo małe jednoniciowe cząsteczki składające się z 70-93 nukleotydów. Ich masa cząsteczkowa wynosi (2,4-3,1) 0,104 kDa.
Drugorzędowa struktura tRNA powstaje w wyniku tworzenia maksymalnej liczby wiązań wodorowych między wewnątrzcząsteczkowymi komplementarnymi parami zasad azotowych.
W wyniku tworzenia tych wiązań łańcuch polinukleotydowy tRNA skręca się, tworząc spiralne odgałęzienia zakończone pętlami niesparowanych nukleotydów. Przestrzenny obraz struktur drugorzędowych wszystkich tRNA ma kształt koniczyny.
W „koniczynie” wyróżnia się cztery gałęzie obowiązkowe, dłuższe tRNA zawierają dodatkowo krótką piątą (dodatkową) gałąź.
Funkcję adaptorową tRNA zapewnia odgałęzienie akceptorowe, do którego 3'-końca dołączona jest reszta aminokwasowa wiązaniem eterowym i odgałęzienie antykodonu przeciwległe do odgałęzienia akceptorowego, na szczycie której znajduje się pętla zawierająca antykodon.
Antykodon to specyficzna trójka nukleotydów, która jest komplementarna w kierunku antyrównoległym do kodonu mRNA kodującego odpowiedni aminokwas.
Gałąź T niosąca pętlę pseudourydyny (pętla TyC) zapewnia interakcję tRNA z rybosomami.
Gałąź D, niosąca pętlę dehydrourydynową, zapewnia oddziaływanie tRNA z odpowiednią syntetazą aminoacylo-tRNA.

Drugorzędowa struktura tRNA
Funkcje piątej dodatkowej gałęzi są nadal słabo poznane, najprawdopodobniej wyrównuje ona długość różnych cząsteczek tRNA.
Trzeciorzędowa struktura tRNA jest bardzo zwarta i powstaje przez połączenie ze sobą poszczególnych gałęzi koniczyny dzięki dodatkowym wiązaniom wodorowym, tworząc strukturę „łokciową” w kształcie litery L.
Transportowe RNA, struktura i mechanizm funkcjonalny.
W tym przypadku ramię akceptorowe, które wiąże aminokwas, znajduje się na jednym końcu cząsteczki, a antykodon na drugim.

Trzeciorzędowa struktura tRNA (wg A.S. Spirin)
Struktura rRNA i rybosomów. Rybosomalne RNA tworzą szkielet, z którym wiążą się określone białka, tworząc rybosomy. Rybosomy to organelle nukleoproteinowe, które zapewniają syntezę białek z mRNA.
Liczba rybosomów w komórce jest bardzo duża: od 104 u prokariontów do 106 u eukariontów. Rybosomy zlokalizowane są głównie w cytoplazmie, u eukariontów, ponadto w jąderku, w macierzy mitochondrialnej oraz w zrębie chloroplastów. Rybosomy składają się z dwóch podcząstek: dużej i małej. Pod względem wielkości i masy cząsteczkowej wszystkie badane rybosomy są podzielone na 3 grupy - rybosomy prokariotów 70S (współczynnik sedymentacji S), składające się z małych podcząstek 30S i dużych 50S; Rybosomy eukariotyczne 80S, składające się z 40S małych i 60S dużych podjednostek.
Mała podjednostka rybosomów 80S składa się z jednej cząsteczki rRNA (18S) i 33 cząsteczek różnych białek.
Duża podjednostka składa się z trzech cząsteczek rRNA (5S, 5,8S i 28S) i około 50 białek.
Strukturę drugorzędową rRNA tworzą krótkie dwuniciowe odcinki cząsteczki - spinki do włosów (około 2/3 rRNA), 1/3 - jest reprezentowana przez jednoniciowe odcinki bogate w nukleotydy purynowe.
Przyciski społecznościowe dla Joomla
Białka stanowią podstawę życia. Ich funkcje w komórce są bardzo zróżnicowane. Jednak białka „nie mogą” się rozmnażać. A wszystkie informacje o budowie białek zawarte są w genach (DNA).
W organizmach wyższych białka są syntetyzowane w cytoplazmie komórki, a DNA jest ukryte za powłoką jądra. Dlatego DNA nie może bezpośrednio służyć jako matryca do syntezy białek. Rolę tę pełni inny kwas nukleinowy – RNA.
Cząsteczka RNA to nierozgałęziony polinukleotyd o strukturze trzeciorzędowej.
Tworzy go jeden łańcuch polinukleotydowy i chociaż zawarte w nim nukleotydy komplementarne są również zdolne do tworzenia między sobą wiązań wodorowych, wiązania te występują między nukleotydami jednego łańcucha. Łańcuchy RNA są znacznie krótsze niż łańcuchy DNA. Jeśli zawartość DNA w komórce jest względnie stała, to zawartość RNA ulega znacznym wahaniom. Największą ilość RNA w komórkach obserwuje się podczas syntezy białek.
RNA odgrywa ważną rolę w przekazywaniu i wdrażaniu informacji dziedzicznych.
Zgodnie z funkcją i cechami strukturalnymi rozróżnia się kilka klas komórkowych RNA.
Istnieją trzy główne klasy komórkowego RNA.
- Informacyjny (mRNA) lub matrycowy (mRNA). Jego cząsteczki są najbardziej zróżnicowane pod względem wielkości, masy cząsteczkowej (od 0,05x106 do 4x106) i stabilności.
Stanowią około 2% całkowitej ilości RNA w komórce. Wszystkie mRNA są nośnikami informacji genetycznej od jądra do cytoplazmy, do miejsca syntezy białek. Służą jako matryca (rysunek roboczy) do syntezy cząsteczki białka, ponieważ określają sekwencję aminokwasową (pierwotną strukturę) cząsteczki białka.

- Rybosomalny RNA (rRNA).
Stanowią one 80-85% całkowitej zawartości RNA w komórce.
31. Struktura RNA. Rodzaje RNA, cechy strukturalne i funkcje. Drugorzędowa struktura tRNA
Rybosomalny RNA składa się z 3–5 tysięcy nukleotydów. Jest syntetyzowany w jąderkach jądra. W kompleksie z białkami rybosomalnymi rRNA tworzy rybosomy - organelle, na których składają się cząsteczki białka. Główne znaczenie rRNA polega na tym, że zapewnia początkowe wiązanie mRNA i rybosomu oraz tworzy centrum aktywne rybosomu, w którym podczas syntezy łańcucha polipeptydowego powstają wiązania peptydowe między aminokwasami.
- Transferowe RNA (tRNA).
Cząsteczki tRNA zwykle zawierają 75-86 nukleotydów. Masa cząsteczkowa cząsteczek tRNA wynosi około 25 tys. Cząsteczki tRNA pełnią rolę pośredników w biosyntezie białek - dostarczają aminokwasy do miejsca syntezy białek, czyli do rybosomów. Komórka zawiera ponad 30 rodzajów tRNA. Każdy typ tRNA ma swoją własną unikalną sekwencję nukleotydową.
Jednak wszystkie cząsteczki mają kilka wewnątrzcząsteczkowych regionów komplementarnych, dzięki czemu wszystkie tRNA mają strukturę trzeciorzędową przypominającą kształtem liść koniczyny.
Drugorzędowa struktura RNA- charakterystyczny dla tRNA, jednoniciowy, w kształcie „liścia koniczyny”.
Zawiera:
- stosunkowo krótkie podwójne helisy - łodygi,
- sekcje jednoniciowe - pętle.
Istnieją 4 łodygi (akceptor, antykodon, dihydrouridyl, pseudourydyl) i 3 pętle.

„Stem-loop” – element struktury drugorzędowej RNA, schematycznie

„Pseudoknot” – element struktury drugorzędowej RNA, schematycznie

Rdzeń akceptorowy zawiera 3'- i 5'-końce łańcucha polinukleotydowego, 5'-koniec z resztą kwasu guanylowego, 3'-koniec jest tripletem CCA i służy do tworzenia wiązania estrowego z AA.
Rdzeń antykodonu rozpoznaje swój kodon na mRNA w rybosomach na zasadzie komplementarności.
Trzon pseudourydylowy służy do przyłączenia się do rybosomu.
Rdzeń dihydrourydylowy służy do wiązania się z syntetazą aminoacylo-tRNA.
Przyciski społecznościowe dla Joomla





