Bendrosios IV grupės elementų charakteristikos, pagrindinis periodinės sistemos pogrupis D.I.
Sustiprėja metalinės savybės, sumažėja nemetalinės savybės. Išoriniame sluoksnyje yra 4 elektronai.
Cheminės savybės(anglies pagrindu)
Sąveika su metalais:
4Al + 3C = Al 4 C3 (idset reakcija aukštoje temperatūroje)
Sąveika su nemetalais:
2H2 + C = CH4
Sąveika su vandeniu:
C + H 2 O = CO + H 2
2Fe 2 O 3 + 3C = 3CO 2 + 4Fe
Sąveika su rūgštimis:
3C + 4HNO3 = 3CO2 + 4NO + 2H2O
Anglies. Anglies charakteristikos, remiantis jos padėtimi periodinėje lentelėje, anglies alotropija, adsorbcija, pasiskirstymas gamtoje, gamyba, savybės. Svarbiausi anglies junginiai
Anglis (cheminis simbolis – C, lot. Carboneum) – keturioliktos grupės (pagal pasenusią klasifikaciją – pagrindinis ketvirtos grupės pogrupis), periodinės cheminių elementų lentelės 2 periodo cheminis elementas. eilės numeris 6, atominė masė - 12,0107.
Anglies yra įvairiuose alotropuose su labai įvairiomis fizinėmis savybėmis. Modifikacijų įvairovė atsiranda dėl anglies gebėjimo sudaryti įvairių tipų cheminius ryšius.
Natūralią anglį sudaro du stabilūs izotopai - 12C (98,93%) ir 13C (1,07%) ir vienas radioaktyvusis izotopas 14C (β-spinduliuotojas, T½ = 5730 metų), susitelkę atmosferoje ir viršutinėje žemės plutos dalyje.
Pagrindinės ir gerai ištirtos alotropinės anglies modifikacijos yra deimantas ir grafitas. Normaliomis sąlygomis tik grafitas yra termodinamiškai stabilus, o deimantas ir kitos formos yra metastabilios. Skysta anglis egzistuoja tik esant tam tikram išoriniam slėgiui.
Esant slėgiui virš 60 GPa, daroma prielaida, kad susidaro labai tanki C III modifikacija (tankis 15-20 % didesnis už deimanto tankį), turintis metalinį laidumą.
Šešiakampės sistemos anglies kristalinė modifikacija su grandinine molekulių struktūra vadinama karbinu. Yra žinomos kelios karbino formos, kurios skiriasi atomų skaičiumi vienetinėje ląstelėje.
Karbinas yra smulkiai kristaliniai juodi milteliai (tankis 1,9–2 g/cm³) ir pasižymi puslaidininkinėmis savybėmis. Gautas dirbtinėmis sąlygomis iš ilgų anglies atomų grandinių, išdėstytų lygiagrečiai viena kitai.
Karbinas yra linijinis anglies polimeras. Karbino molekulėje anglies atomai yra sujungti grandinėmis pakaitomis arba trigubomis ir viengubomis jungtimis (polieno struktūra) arba nuolat dvigubomis jungtimis (polikumuleno struktūra). Karbinas turi puslaidininkių savybių, o jo laidumas labai padidėja veikiant šviesai. Pirmasis praktinis pritaikymas pagrįstas šia savybe – fotoelementuose.
Taip pat žinomi anglies reakcijos su siera anglies disulfidai CS2 ir C3S2.
Daugumoje metalų anglis sudaro karbidus, pavyzdžiui:
Anglies reakcija su vandens garais yra svarbi pramonėje:
Kaitinant, anglis redukuoja metalų oksidus į metalus. Ši savybė plačiai naudojama metalurgijos pramonėje.
Grafitas naudojamas pieštukų pramonėje, tačiau maišomas su moliu, kad sumažintų jo minkštumą. Deimantas dėl savo išskirtinio kietumo yra nepakeičiama abrazyvinė medžiaga. Farmakologijoje ir medicinoje plačiai naudojami įvairūs anglies junginiai – anglies rūgšties ir karboksirūgščių dariniai, įvairūs heterociklai, polimerai ir kiti junginiai. Anglis vaidina didžiulį vaidmenį žmogaus gyvenime. Jo pritaikymas yra toks pat įvairus, kaip ir pats šis daugialypis elementas. Visų pirma, anglis yra neatskiriama plieno (iki 2,14 % masės) ir ketaus (daugiau nei 2,14 % masės) sudedamoji dalis.
Anglis yra atmosferos aerozolių dalis, dėl to gali keistis regiono klimatas ir sumažėti saulėtų dienų skaičius. Anglis į aplinką patenka suodžių pavidalu transporto priemonių išmetamosiose dujose, deginant anglį šiluminėse elektrinėse, anglies kasybos atviroje duobėje, požeminio dujinimo, anglies koncentratų gamybos ir kt. Anglies koncentracija virš degimo šaltinių yra 100-400 μg/m³, dideliuose miestuose 2,4-15,9 µg/m³, kaimo vietovėse 0,5-0,8 µg/m³. Su dujų aerozolių emisija iš atominių elektrinių, (6-15) · 109 Bq/parą 14СО2 patenka į atmosferą.
Didelis anglies kiekis atmosferos aerozoliuose padidina gyventojų, ypač viršutinių kvėpavimo takų ir plaučių, sergamumą. Profesinės ligos dažniausiai yra antrakozė ir dulkių bronchitas. Darbo zonos ore MPC, mg/m³: deimantas 8,0, antracitas ir koksas 6,0, anglis 10,0, suodžiai ir anglies dulkės 4,0; atmosferos ore didžiausias vienkartinis yra 0,15, vidutinis paros kiekis yra 0,05 mg/m³.
Svarbiausi ryšiai. Anglies (II) monoksidas (anglies monoksidas) CO. Normaliomis sąlygomis tai yra bespalvės, bekvapės ir beskonės dujos. Toksiškumas paaiškinamas tuo, kad jis lengvai susijungia su hemoglobinu kraujyje.
Anglies monoksidas (IV) CO2. Normaliomis sąlygomis tai bespalvės, šiek tiek rūgštaus kvapo ir skonio dujos, pusantro karto sunkesnės už orą, nedega ir nepalaiko degimo.
Anglies rūgštis H2CO3. Silpna rūgštis. Anglies rūgšties molekulės egzistuoja tik tirpale.
Fosgenas COCl2. Bespalvės dujos su būdingu kvapu, virimo temperatūra = 8°C, lydymosi temperatūra = -118°C. Labai nuodingas. Šiek tiek tirpsta vandenyje. Reaktyvus. Naudojamas organinėje sintezėje.
Periodinės cheminių elementų sistemos grupė yra didėjančio branduolinio krūvio atomų seka, turinti tą pačią elektroninę struktūrą. Grupės skaičius nustatomas pagal elektronų skaičių ant išorinio atomo apvalkalo (valentinių elektronų) ... Wikipedia
Ketvirtasis periodinės sistemos periodas apima periodinės cheminių elementų sistemos ketvirtosios eilės (arba ketvirto periodo) elementus. Periodinės lentelės struktūra pagrįsta eilutėmis, iliustruojančiomis pasikartojančius (periodinius) ... ... Vikipedija
Pirmasis periodinės sistemos periodas apima periodinės cheminių elementų sistemos pirmosios eilės (arba pirmojo periodo) elementus. Periodinės lentelės struktūra pagrįsta eilutėmis, iliustruojančiomis pasikartojančias (periodines) tendencijas... ... Vikipedijoje
Antrasis periodinės sistemos periodas apima periodinės cheminių elementų sistemos antrosios eilės (arba antrojo periodo) elementus. Periodinės lentelės struktūra pagrįsta eilutėmis, iliustruojančiomis pasikartojančias (periodines) tendencijas ... Vikipedija
Penktasis periodinės sistemos periodas apima periodinės cheminių elementų sistemos penktosios eilės (arba penktojo periodo) elementus. Periodinės lentelės struktūra pagrįsta eilutėmis, iliustruojančiomis pasikartojančias (periodines) tendencijas... ... Vikipedijoje
Trečiasis periodinės sistemos periodas apima periodinės cheminių elementų sistemos trečiosios eilės (arba trečiojo periodo) elementus. Periodinės lentelės struktūra paremta eilutėmis, iliustruojančiomis pasikartojančias (periodines) tendencijas... Vikipedija
Septintas periodinės sistemos periodas apima periodinės cheminių elementų sistemos septintos eilės (arba septintojo periodo) elementus. Periodinės lentelės struktūra paremta eilutėmis, iliustruojančiomis pasikartojančias (periodines) tendencijas... Vikipedija
Šeštasis periodinės sistemos periodas apima periodinės cheminių elementų sistemos šeštos eilės (arba šeštojo periodo) elementus. Periodinės lentelės struktūra pagrįsta eilutėmis, iliustruojančiomis pasikartojančias (periodines) tendencijas... ... Vikipedijoje
Trumpoji periodinės lentelės forma pagrįsta pagrindinių ir mažų pogrupių elementų oksidacijos būsenų lygiagretumu: pavyzdžiui, maksimali vanadžio oksidacijos būsena yra +5, kaip ir fosforo ir arseno, maksimali chromo oksidacijos būsena yra + 6 ... Vikipedija
„Grupavimo“ užklausa nukreipiama čia. Šia tema reikia atskiro straipsnio... Vikipedija
Bendrosios IV grupės elementų, pagrindinio D. I. Mendelejevo periodinės sistemos pogrupio, charakteristikos
IV grupės pagrindinio pogrupio elementai yra anglis, silicis, germanis, alavas ir švinas. Sustiprėja metalinės savybės, sumažėja nemetalinės savybės. Išorinis sluoksnis turi 4 elektronus.
Cheminės savybės(anglies pagrindu)
· Sąveika su metalais
4Al+3C = Al 4 C 3 (reakcija vyksta aukštoje temperatūroje)
· Bendrauti su nemetalais
2H2 +C = CH4
· Sąveika su deguonimi
· Sąveika su vandeniu
C+H2O = CO+H2
· Sąveika su oksidais
2Fe 2 O 3 +3C = 3CO 2 +4Fe
· Sąveika su rūgštimis
3C+4HNO3 = 3CO2 +4NO+2H2O
Anglies. Anglies charakteristikos, remiantis jos padėtimi periodinėje lentelėje, anglies alotropija, adsorbcija, pasiskirstymas gamtoje, gamyba, savybės. Svarbiausi anglies junginiai
Anglis (cheminis simbolis – C, lot. Carboneum) – keturioliktos grupės (pagal pasenusią klasifikaciją – pagrindinis ketvirtos grupės pogrupis), periodinės cheminių elementų lentelės 2 periodo cheminis elementas. eilės numeris 6, atominė masė - 12,0107. Anglies yra įvairiuose alotropuose su labai įvairiomis fizinėmis savybėmis. Modifikacijų įvairovė atsiranda dėl anglies gebėjimo sudaryti įvairių tipų cheminius ryšius.
Natūralią anglį sudaro du stabilūs izotopai - 12C (98,93%) ir 13C (1,07%) ir vienas radioaktyvusis izotopas 14C (β-spinduliuotojas, T½ = 5730 metų), susitelkę atmosferoje ir viršutinėje žemės plutos dalyje.
Pagrindinės ir gerai ištirtos alotropinės anglies modifikacijos yra deimantas ir grafitas. Normaliomis sąlygomis tik grafitas yra termodinamiškai stabilus, o deimantas ir kitos formos yra metastabilios. Skysta anglis egzistuoja tik esant tam tikram išoriniam slėgiui.
Esant slėgiui virš 60 GPa, daroma prielaida, kad susidaro labai tanki C III modifikacija (tankis 15-20 % didesnis už deimanto tankį), turintis metalinį laidumą.
Šešiakampės sistemos anglies kristalinė modifikacija su grandinine molekulių struktūra paprastai vadinama karbinu. Yra žinomos kelios karbino formos, kurios skiriasi atomų skaičiumi vienetinėje ląstelėje.
Karbinas yra smulkiai kristaliniai juodi milteliai (tankis 1,9–2 g/cm³) ir pasižymi puslaidininkinėmis savybėmis. Gautas dirbtinėmis sąlygomis iš ilgų anglies atomų grandinių, išdėstytų lygiagrečiai viena kitai.
Karbinas yra linijinis anglies polimeras. Karbino molekulėje anglies atomai yra sujungti grandinėmis pakaitomis arba trigubomis, ir viengubomis jungtimis (polieno struktūra) arba nuolat dvigubomis jungtimis (polikumuleno struktūra). Karbinas turi puslaidininkių savybių, o jo laidumas labai padidėja veikiant šviesai. Pirmasis praktinis pritaikymas pagrįstas šia savybe – fotoelementuose.
Grafenas yra dvimatė alotropinė anglies modifikacija, sudaryta iš vieno atomo storio anglies atomų sluoksnio, sujungto per sp² ryšius į šešiakampę dvimatę kristalinę gardelę.
Esant įprastoms temperatūroms, anglis yra chemiškai inertiška, esant pakankamai aukštai temperatūrai, ji susijungia su daugeliu elementų ir pasižymi stipriomis redukuojančiomis savybėmis. Įvairių anglies formų cheminis aktyvumas mažėja tokia tvarka: amorfinė anglis, grafitas, deimantas ore užsidega esant atitinkamai aukštesnei nei 300-500 °C, 600-700 °C ir 850-1000 °C temperatūrai.
Anglies degimo produktai yra CO ir CO2 (atitinkamai anglies monoksidas ir anglies dioksidas). Taip pat žinomas nestabilus anglies suboksidas C3O2 (lydymosi temperatūra –111 °C, virimo temperatūra 7 °C) ir kai kurie kiti oksidai (pavyzdžiui, C12O9, C5O2, C12O12). Grafitas ir amorfinė anglis pradeda reaguoti su vandeniliu 1200 °C temperatūroje, su fluoru 900 °C temperatūroje.
Anglies dioksidas reaguoja su vandeniu ir susidaro silpna anglies rūgštis – H2CO3, iš kurios susidaro druskos – karbonatai. Žemėje labiausiai paplitę kalcio karbonatai (mineralinės formos – kreida, marmuras, kalcitas, kalkakmenis ir kt.) ir magnis (mineralinė forma dolomitas).
Grafitas su halogenais, šarminiais metalais ir kt.
Paskelbta ref.rf
medžiagos sudaro inkliuzinius junginius. Kai azoto atmosferoje tarp anglies elektrodų perduodama elektros iškrova, susidaro cianogenas. Esant aukštai temperatūrai, anglies reakcijai su H2 ir N2 mišiniu susidaro cianido rūgštis:
Taip pat žinomi anglies reakcijos su siera anglies disulfidai CS2 ir C3S2. Daugumoje metalų anglis sudaro karbidus, pavyzdžiui:
Anglies reakcija su vandens garais yra svarbi pramonėje:
Kaitinant, anglis redukuoja metalų oksidus į metalus. Ši savybė plačiai naudojama metalurgijos pramonėje.
Grafitas naudojamas pieštukų pramonėje, tačiau maišomas su moliu, kad sumažintų jo minkštumą. Deimantas dėl savo išskirtinio kietumo yra nepakeičiama abrazyvinė medžiaga. Farmakologijoje ir medicinoje plačiai naudojami įvairūs anglies junginiai – anglies rūgšties ir karboksirūgščių dariniai, įvairūs heterociklai, polimerai ir kiti junginiai. Anglis vaidina didžiulį vaidmenį žmogaus gyvenime. Jo pritaikymo galimybės yra tokios pat įvairios, kaip ir pats šis daugialypis elementas. Visų pirma, anglis yra neatskiriama plieno (iki 2,14 % masės) ir ketaus (daugiau nei 2,14 % masės) sudedamoji dalis.
Anglis yra atmosferos aerozolių dalis, dėl kurios gali keistis regiono klimatas ir sumažėti saulėtų dienų skaičius. Anglis į aplinką patenka suodžių pavidalu transporto priemonių išmetamosiose dujose deginant anglį šiluminėse elektrinėse, atliekant atviras anglies kasyklas, požeminę dujofikaciją, gaminant anglies koncentratus ir kt.
Paskelbta ref.rf
Anglies koncentracija virš degimo šaltinių yra 100-400 µg/m³, dideliuose miestuose 2,4-15,9 µg/m³, kaime 0,5-0,8 µg/m³. Su dujų aerozolių emisijomis iš atominių elektrinių į atmosferą patenka (6-15)·109 Bq/parą 14СО2.
Didelis anglies kiekis atmosferos aerozoliuose padidina gyventojų, ypač viršutinių kvėpavimo takų ir plaučių, sergamumą. Profesinės ligos – daugiausia antrakozė ir dulkių bronchitas. Darbo zonos ore MPC, mg/m³: deimantas 8,0, antracitas ir koksas 6,0, anglis 10,0, suodžiai ir anglies dulkės 4,0; atmosferos ore didžiausias vienkartinis yra 0,15, vidutinis paros kiekis yra 0,05 mg/m³.
Svarbiausi ryšiai. Anglies (II) monoksidas (anglies monoksidas) CO. Normaliomis sąlygomis tai yra bespalvės, bekvapės ir beskonės dujos. Toksiškumas paaiškinamas tuo, kad jis lengvai susijungia su kraujo hemoglobinu Anglies monoksidu (IV) CO2. Normaliomis sąlygomis tai bespalvės, šiek tiek rūgštaus kvapo ir skonio dujos, pusantro karto sunkesnės už orą, nedega ir nepalaiko degimo. Anglies rūgštis H2CO3. Silpna rūgštis. Anglies rūgšties molekulės egzistuoja tik tirpale. Fosgenas COCl2. Bespalvės dujos su būdingu kvapu, virimo temperatūra = 8°C, lydymosi temperatūra = -118°C. Labai nuodingas. Šiek tiek tirpsta vandenyje. Reaktyvus. Naudojamas organinėje sintezėje.
IV grupės elementų, pagrindinio D.I. Mendelejevo periodinės sistemos pogrupio, charakteristikos - sąvoka ir tipai. Kategorijos "D. I. Mendelejevo periodinės lentelės pagrindinio pogrupio IV grupės elementų bendrosios charakteristikos" klasifikacija ir ypatumai 2017, 2018 m.
Prancūzų gotikinės skulptūros užuomazgos buvo padėtos Saint-Denis. Trys garsiosios bažnyčios vakarinio fasado portalai buvo užpildyti skulptūriniais vaizdais, kuriuose pirmą kartą pasireiškė noras griežtai apgalvotai ikonografinei programai, kilo noras...
Ankstyvaisiais viduramžiais naujų miestų beveik nebuvo statoma. Dėl nuolatinių karų reikėjo statyti įtvirtintas gyvenvietes, ypač pasienio zonose. Ankstyvųjų viduramžių materialinės ir dvasinės kultūros centras buvo vienuolynai. Jie buvo statomi....
ERDVINIAI SPRENDIMAI Bendras pastatų ir kompleksų sprendimas Aukštosios mokyklos struktūra pagal architektūrinę ir planavimo struktūrą apima šiuos padalinius: bendrojo instituto ir fakulteto padalinius su kabinetais ir laboratorijomis; ...
Periodinė cheminių elementų sistema yra cheminių elementų klasifikacija, sukurta D. I. Mendelejevo remiantis periodiniu dėsniu, kurį jis atrado 1869 m.
D. I. Mendelejevas
Remiantis šiuolaikine šio dėsnio formuluote, nuolatinėje elementų serijoje, išdėstytoje didėjančio jų atomų branduolių teigiamo krūvio dydžiu, panašių savybių elementai periodiškai kartojasi.
Periodinė cheminių elementų lentelė, pateikta lentelės pavidalu, susideda iš periodų, serijų ir grupių.
Kiekvieno periodo pradžioje (išskyrus pirmąjį) elementas turi ryškių metalinių savybių (šarminis metalas).

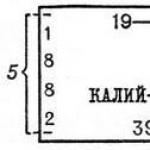
Spalvų lentelės simboliai: 1 - cheminis elemento ženklas; 2 - vardas; 3 - atominė masė (atominė masė); 4 - serijos numeris; 5 - elektronų pasiskirstymas per sluoksnius.
Didėjant elemento atominiam skaičiui, lygiam jo atomo branduolio teigiamam krūviui, metalinės savybės palaipsniui silpnėja, o nemetalinės savybės didėja. Priešpaskutinis kiekvieno laikotarpio elementas yra elementas, turintis ryškių nemetalinių savybių (), o paskutinis yra inertinės dujos. I periode yra 2 elementai, II ir III - 8 elementai, IV ir V - 18, VI - 32 ir VII (nebaigtas laikotarpis) - 17 elementų.
Pirmieji trys periodai vadinami mažais periodais, kiekvienas jų susideda iš vienos horizontalios eilutės; likusi dalis – dideliais laikotarpiais, kurių kiekvienas (išskyrus VII laikotarpį) susideda iš dviejų horizontalių eilučių – lyginės (viršutinės) ir nelyginės (apatinės). Tik metalai randami vienodomis didelių laikotarpių eilėmis. Šių serijų elementų savybės šiek tiek keičiasi didėjant eilės skaičiui. Keičiasi didelių laikotarpių nelyginių eilučių elementų savybės. VI laikotarpiu po lantano seka 14 elementų, labai panašių cheminėmis savybėmis. Šie elementai, vadinami lantanidais, yra išvardyti atskirai po pagrindine lentele. Lentelėje panašiai pateikiami aktinidai, po aktinio einantys elementai.

Lentelėje yra devynios vertikalios grupės. Grupės skaičius, su retomis išimtimis, yra lygus didžiausiam teigiamam šios grupės elementų valentiškumui. Kiekviena grupė, išskyrus nulį ir aštuntą, yra suskirstyta į pogrupius. - pagrindinis (esantis dešinėje) ir antrinis. Pagrindiniuose pogrupiuose, didėjant atominiam skaičiui, stiprėja elementų metalinės savybės, o nemetalinės – silpnėja.
Taigi elementų chemines ir fizines savybes lemia vieta, kurią tam tikras elementas užima periodinėje lentelėje.
Biogeniniai elementai, ty elementai, kurie yra organizmų dalis ir atlieka tam tikrą biologinį vaidmenį, užima viršutinę periodinės lentelės dalį. Ląstelės, kurias užima elementai, sudarantys didžiąją dalį (daugiau nei 99%) gyvosios medžiagos, yra mėlynos spalvos (žr.
Periodinė cheminių elementų lentelė yra didžiausias šiuolaikinio gamtos mokslo pasiekimas ir ryškiausia bendriausių dialektinių gamtos dėsnių išraiška.
Taip pat žiūrėkite Atominis svoris.
Periodinė cheminių elementų sistema yra natūrali cheminių elementų klasifikacija, sukurta D. I. Mendelejevo remiantis periodiniu dėsniu, kurį jis atrado 1869 m.
Pradinėje formuluotėje D. I. Mendelejevo periodinis įstatymas teigė: cheminių elementų savybės, taip pat jų junginių formos ir savybės periodiškai priklauso nuo elementų atominio svorio. Vėliau, plėtojant atomo sandaros doktriną, buvo parodyta, kad tikslesnė kiekvieno elemento charakteristika yra ne atominis svoris (žr.), o elemento atomo branduolio teigiamo krūvio reikšmė, lygus šio elemento eilės (atominiam) numeriui periodinėje D. I. Mendelejevo sistemoje. Atomo branduolio teigiamų krūvių skaičius yra lygus atomo branduolį supančių elektronų skaičiui, nes visi atomai yra elektriškai neutralūs. Atsižvelgiant į šiuos duomenis, periodinis dėsnis formuluojamas taip: cheminių elementų savybės, taip pat jų junginių formos ir savybės periodiškai priklauso nuo jų atomų branduolių teigiamo krūvio dydžio. Tai reiškia, kad nuolatinėje elementų serijoje, išdėstytoje taip, kad jų atomų branduolių teigiami krūviai padidėtų, panašių savybių elementai periodiškai kartosis.
Periodinės cheminių elementų lentelės lentelė pateikiama šiuolaikine forma. Jį sudaro laikotarpiai, serijos ir grupės. Periodas reiškia nuoseklią horizontalią elementų seriją, išdėstytą taip, kad jų atomų branduolių teigiamas krūvis padidėtų.
Kiekvieno periodo pradžioje (išskyrus pirmąjį) yra elementas su ryškiomis metalinėmis savybėmis (šarminis metalas). Tada, didėjant serijos numeriui, elementų metalinės savybės palaipsniui silpnėja, o nemetalinės savybės didėja. Priešpaskutinis kiekvieno laikotarpio elementas yra elementas, turintis ryškių nemetalinių savybių (halogenas), o paskutinis yra inertinės dujos. Pirmasis laikotarpis susideda iš dviejų elementų, šarminio metalo ir halogeno vaidmenį čia vienu metu atlieka vandenilis. II ir III laikotarpiai apima po 8 elementus, Mendelejevo vadinamus tipiniais. IV ir V laikotarpiai turi po 18 elementų, VI-32. VII laikotarpis dar nebaigtas ir papildytas dirbtinai sukurtais elementais; Šiuo metu šiame laikotarpyje yra 17 elementų. I, II ir III laikotarpiai vadinami mažais, kiekvienas iš jų susideda iš vienos horizontalios eilutės, IV-VII – dideli: juose (išskyrus VII) yra dvi horizontalios eilės – lyginės (viršutinė) ir nelyginės (apatinė). Lygiose didelių periodų eilėse yra tik metalai, o elementų savybių pokytis eilutėje iš kairės į dešinę yra silpnai išreikštas.
Nelyginėse didelių laikotarpių serijose serijos elementų savybės keičiasi taip pat, kaip ir tipinių elementų savybės. Lyginėje VI laikotarpio eilėje po lantano yra 14 elementų [vadinami lantanidais (žr.), lantanidais, retųjų žemių elementais], cheminėmis savybėmis panašių į lantaną ir vienas į kitą. Jų sąrašas pateikiamas atskirai po lentele.
Elementai po aktinio – aktinidai (aktinoidai) – išvardyti atskirai ir išvardyti po lentele.
Periodinėje cheminių elementų lentelėje devynios grupės yra išdėstytos vertikaliai. Grupės skaičius lygus didžiausiam šios grupės elementų teigiamam valentiškumui (žr.). Išimtys yra fluoras (gali būti tik neigiamai monovalentinis) ir bromas (negali būti septyniavalentis); be to, vario, sidabro, aukso valentingumas gali būti didesnis nei +1 (Cu-1 ir 2, Ag ir Au-1 ir 3), o iš VIII grupės elementų tik osmis ir rutenis turi +8 valentingumą. . Kiekviena grupė, išskyrus aštuntą ir nulį, yra suskirstyta į du pogrupius: pagrindinį (esantį dešinėje) ir antrinį. Pagrindiniai pogrupiai apima tipinius elementus ir ilgo periodo elementus, antrinius – tik ilgo periodo elementus ir, be to, metalus.
Kalbant apie chemines savybes, kiekvienos tam tikros grupės pogrupio elementai labai skiriasi vienas nuo kito, ir tik didžiausias teigiamas valentingumas yra vienodas visiems tam tikros grupės elementams. Pagrindiniuose pogrupiuose iš viršaus į apačią stiprėja elementų metalinės savybės, o susilpnėja nemetalinės (pavyzdžiui, ryškiausias metalines savybes turintis elementas yra francis, o nemetalinis – fluoras). Taigi elemento vieta Mendelejevo periodinėje sistemoje (eilės skaičius) lemia jo savybes, kurios yra gretimų elementų savybių vidurkis vertikaliai ir horizontaliai.
Kai kurios elementų grupės turi specialius pavadinimus. Taigi I grupės pagrindinių pogrupių elementai vadinami šarminiais metalais, II grupės – šarminių žemių metalais, VII grupės – halogenais, elementai, esantys už urano – transuranu. Elementai, kurie yra organizmų dalis, dalyvauja medžiagų apykaitos procesuose ir turi aiškų biologinį vaidmenį, vadinami biogeniniais elementais. Visi jie užima aukščiausią D. I. Mendelejevo lentelės dalį. Tai visų pirma O, C, H, N, Ca, P, K, S, Na, Cl, Mg ir Fe, kurie sudaro didžiąją gyvosios medžiagos dalį (daugiau nei 99%). Šių elementų užimamos vietos periodinėje lentelėje yra šviesiai mėlynos spalvos. Biogeniniai elementai, kurių organizme yra labai mažai (nuo 10 -3 iki 10 -14%), vadinami mikroelementais (žr.). Geltonos spalvos periodinės sistemos ląstelėse yra mikroelementų, kurių gyvybinė svarba žmogui įrodyta.
Remiantis atominės sandaros teorija (žr. Atomas), cheminės elementų savybės daugiausia priklauso nuo elektronų skaičiaus išoriniame elektronų apvalkale. Periodiškas elementų savybių pasikeitimas, didėjant teigiamam atomų branduolių krūviui, paaiškinamas periodišku atomų išorinio elektronų apvalkalo (energijos lygio) struktūros pasikartojimu.
Mažais laikotarpiais, padidėjus teigiamam branduolio krūviui, elektronų skaičius išoriniame apvalkale I periode padidėja nuo 1 iki 2, o II ir III periodais – nuo 1 iki 8. Taigi elementų savybių pokytis laikotarpiu nuo šarminio metalo iki inertinių dujų. Išorinis elektronų apvalkalas, kuriame yra 8 elektronai, yra pilnas ir energetiškai stabilus (nulinės grupės elementai yra chemiškai inertiški).
Ilgą laiką lygiomis eilėmis, didėjant teigiamam branduolių krūviui, išoriniame apvalkale elektronų skaičius išlieka pastovus (1 arba 2), o antrasis išorinis apvalkalas užpildomas elektronais. Taigi lėtas elementų savybių pokytis lygiose eilutėse. Nelyginėje didelių periodų serijoje, didėjant branduolių krūviui, išorinis apvalkalas prisipildo elektronų (nuo 1 iki 8) ir elementų savybės keičiasi taip pat, kaip ir tipinių elementų.
Elektronų apvalkalų skaičius atome yra lygus periodo skaičiui. Pagrindinių pogrupių elementų atomų išoriniuose apvalkaluose elektronų skaičius lygus grupės skaičiui. Šoninių pogrupių elementų atomų išoriniame apvalkale yra vienas arba du elektronai. Tai paaiškina pagrindinių ir antrinių pogrupių elementų savybių skirtumą. Grupės numeris nurodo galimą elektronų skaičių, galintį dalyvauti formuojant cheminius (valentingus) ryšius (žr. Molekulė), todėl tokie elektronai vadinami valentiniais. Šoninių pogrupių elementams valentiniai yra ne tik išorinių apvalkalų elektronai, bet ir priešpaskutinių. Elektronų apvalkalų skaičius ir struktūra nurodomi pridedamoje periodinėje cheminių elementų lentelėje.
Periodinis D. I. Mendelejevo dėsnis ir juo pagrįsta sistema turi išskirtinai didelę reikšmę moksle ir praktikoje. Periodinis dėsnis ir sistema buvo pagrindas atrasti naujus cheminius elementus, tiksliai nustatyti jų atominį svorį, plėtoti atomų sandaros doktriną, nustatyti geocheminius elementų pasiskirstymo žemės plutoje dėsnius ir šiuolaikinių idėjų apie gyvąją medžiagą plėtojimą, kurios sudėtis ir su ja susiję modeliai atitinka periodinę sistemą. Elementų biologinį aktyvumą ir jų kiekį organizme taip pat daugiausia lemia vieta, kurią jie užima Mendelejevo periodinėje lentelėje. Taigi, padidėjus serijos numeriui daugelyje grupių, elementų toksiškumas didėja ir jų kiekis organizme mažėja. Periodinis dėsnis yra aiški bendriausių dialektinių gamtos raidos dėsnių išraiška.
Fig. 15.4 paveiksle parodyta penkių IV grupės elementų vieta periodinėje lentelėje. Kaip ir III grupės elementai, jie priklauso p elementų skaičiui. Visų IV grupės elementų atomai turi vienodą išorinio apvalkalo elektroninę konfigūraciją: . Lentelėje 15.4 nurodo specifinę elektroninę atomų konfigūraciją ir kai kurias IV grupės elementų savybes. Šios ir kitos IV grupės elementų fizikinės ir cheminės savybės yra susijusios su jų struktūra, būtent: anglis (deimantų pavidalu), silicis ir germanis turi karkasinę kristalinę deimantą panašią struktūrą (žr. 3.2 skyrių); alavas ir švinas turi metalinę struktūrą (kubinis į veidą, taip pat žr. 3.2 skirsnį).

Ryžiai. 15.4. IV grupės elementų padėtis periodinėje lentelėje.
Judant grupe žemyn, elementų atominis spindulys didėja, o ryšiai tarp atomų silpnėja. Dėl nuosekliai didėjančio išorinių atomų apvalkalų elektronų delokalizacijos ta pačia kryptimi, padidėja IV grupės elementų elektrinis laidumas. Jų savybės
15.4 lentelė. IV grupės elementų elektroninės konfigūracijos ir fizikinės savybės

palaipsniui pereiti iš nemetalinio į metalinį: anglis yra nemetalinis elementas, o deimanto pavidalu yra izoliatorius (dielektrikas); silicis ir germanis – puslaidininkiai; alavas ir švinas yra metalai ir geri laidininkai.
Dėl atomų dydžio padidėjimo pereinant iš viršutinės grupės elementų į apatinės dalies elementus, nuosekliai silpnėja ryšiai tarp atomų ir atitinkamai mažėja lydymosi greitis. taškas ir virimo temperatūra, taip pat elementų kietumas.
Allotropija
Silicis, germanis ir švinas egzistuoja tik viena struktūrine forma. Tačiau anglis ir alavas egzistuoja keliomis struktūrinėmis formomis. Skirtingos vieno elemento struktūrinės formos vadinamos alotropais (žr. 3.2 skyrių).
Anglis turi du alotropus: deimantą ir grafitą. Jų struktūra aprašyta skyriuje. 3.2. Anglies alotropija yra monotropijos pavyzdys, kuriam būdingi šie požymiai: 1) alotropai gali egzistuoti tam tikrame temperatūrų ir slėgio diapazone (pavyzdžiui, kambario temperatūroje ir atmosferos slėgyje egzistuoja ir deimantas, ir grafitas); 2) nėra pereinamosios temperatūros, kuriai esant vienas alotropas virstų kitu; 3) vienas allotropas yra stabilesnis už kitą. Pavyzdžiui, grafitas yra atsparesnis nei deimantas. Mažiau stabilios formos vadinamos metastabiliomis. Todėl deimantas yra metastabilus anglies alotropas (arba monotropas).
Anglies vis dar gali būti kitų formų, įskaitant anglį, koksą ir suodžius. Jie visi yra neapdorotos anglies formos. Kartais vadinamos amorfinėmis formomis, anksčiau buvo manoma, kad jos atstovauja trečiajam anglies alotropui. Terminas amorfinis reiškia beformis. Dabar nustatyta, kad „amorfinė“ anglis yra ne kas kita, kaip mikrokristalinis grafitas.
Alavas yra trijų alotropinių formų. Jie vadinami: pilka skarda (a-alvas), balta skarda (P-alvas) ir rombinė skarda (u-tin). Alavo tipo alotropija vadinama enantiotropija. Jai būdingi šie požymiai: 1) vieno alotropo transformacija į kitą įvyksta tam tikroje temperatūroje, vadinamoje perėjimo temperatūra; Pavyzdžiui

Vlmaz struktūra Metalo (puslaidininkio) struktūra 2) kiekvienas alotropas yra stabilus tik tam tikrame temperatūrų diapazone.
IV grupės elementų reaktyvumas
IV grupės elementų reaktyvumas paprastai didėja judant į grupės apačią, nuo anglies iki švino. Elektrocheminės įtampos serijose virš vandenilio yra tik alavas ir švinas (žr. 10.3 skyrių). Švinas labai lėtai reaguoja su praskiestomis rūgštimis, išskirdamas vandenilį. Reakcija tarp alavo ir praskiestų rūgščių vyksta vidutiniu greičiu.
Anglis oksiduojama karštomis koncentruotomis rūgštimis, tokiomis kaip koncentruota azoto rūgštis ir koncentruota sieros rūgštis.