Regioni funzionali del tRNA. Struttura e funzioni del tRNA, caratteristiche dell'attivazione degli amminoacidi
70-90N | pagina secondaria - quadrifoglio | CCA 3" const per tutti i tRNA |
la presenza di timina, pseudouridina-psi, digirouridina DGU nel D-loop - protezione contro le ribonucleasi? longevo | Una varietà di strutture primarie di tRNA - 61 + 1 - dal numero di codoni + formilmetionina tRNA, l'anticodone del gatto è lo stesso di quello della metionina tRNA. Varietà di strutture terziarie - 20 (in base al numero di amminoacidi) | riconoscimento - la formazione di un legame covalente m-y tRNA e atto | le sintetasi dell'amminoacil-tRNA attaccano gli atti al tRNA
La funzione del tRNA è quella di trasferire gli amminoacidi dal citoplasma ai ribosomi, nei quali avviene la sintesi proteica.
I tRNA che legano un amminoacido sono chiamati isoaccettori.
In totale, in una cellula esistono contemporaneamente 64 diversi tRNA.
Ogni tRNA si accoppia solo con il proprio codone.
Ogni tRNA riconosce il proprio codone senza il coinvolgimento di un amminoacido. Gli amminoacidi legati al tRNA sono stati modificati chimicamente, dopodiché è stato analizzato il polipeptide risultante, che conteneva l'amminoacido modificato. Il cisteinil-tRNACys (R=CH2-SH) è stato ridotto ad alanil-tRNACys (R=CH3).
La maggior parte dei tRNA, indipendentemente dalla loro sequenza nucleotidica, ha una struttura secondaria a forma di quadrifoglio a causa della presenza di tre forcine al suo interno.
Caratteristiche strutturali del tRNA
Ci sono sempre quattro nucleotidi spaiati all'estremità 3 "della molecola e tre di essi sono necessariamente CCA. Le estremità 5" e 3" della catena di RNA formano uno stelo accettore. Le catene sono tenute insieme a causa dell'accoppiamento complementare di sette nucleotidi 5" - terminano con sette nucleotidi situati vicino all'estremità 3". 2. Tutte le molecole hanno una forcina T? C, così designata perché contiene due residui insoliti: ribotimidina (T) e pseudouridina (? La forcina è costituita da un doppio -gambo incagliato di cinque basi accoppiate, inclusa la coppia GC, e un'ansa di sette nucleotidi di lunghezza.
nello stesso punto del ciclo. 3. In una forcina anticodone, lo stelo è sempre rappresentato da una famiglia di accoppiati
motivi. La tripletta complementare al relativo codone, l'anticodone, si trova nell'ansa.
le, costituito da sette nucleotidi. Un invariante ura-
cyl e una citosina modificata, e una purina modificata confina con la sua 3 "estremità, di regola
adenina. 4. Un'altra forcina consiste in un gambo lungo da tre a quattro paia di nucleotidi e un anello variabile
dimensione, spesso contenente uracile in forma ridotta - diidrouracile (DU). Le sequenze nucleotidiche degli steli, il numero di nucleotidi tra lo stelo dell'anticodone e lo stelo T?C (ansa variabile), così come la dimensione dell'ansa e la localizzazione dei residui di diidrouracile nell'ansa DU variano fortemente.
[Cantante, 1998].
Struttura terziaria del tRNA
Struttura a L.
Attaccamento degli amminoacidi al tRNA
Affinché un amminoacido formi una catena polipeptidica, deve essere attaccato al tRNA dall'enzima aminoacil-tRNA sintetasi. Questo enzima forma un legame covalente tra il gruppo carbossilico dell'amminoacido e il gruppo idrossile ribosio all'estremità 3' del tRNA con la partecipazione dell'ATP. L'amminoacil-tRNA sintetasi riconosce un codone specifico non per la presenza di un anticodone sul tRNA, ma per la presenza di uno specifico sito di riconoscimento sul tRNA.
In totale, ci sono 21 diverse sintetasi di aminoacil-tRNA nella cellula.
L'adesione avviene in due fasi:
1. Il gruppo carbossilico di un amminoacido è legato all'ATP a-fosfato. L'adenilato amminoacilico instabile risultante viene stabilizzato legandosi all'enzima.
2. Trasferimento del gruppo amminoacilico dell'adenilato amminoacilico al gruppo 2' o 3'-OH del ribosio terminale del tRNA
Alcune aminoacil-tRNA sintetasi sono costituite da una singola catena polipeptidica, mentre altre sono costituite da due o quattro catene identiche, ciascuna con un peso molecolare da 35 a 115 kDa. Alcuni enzimi dimerici e tetramerici sono composti da due tipi di subunità. Non esiste una chiara correlazione tra la dimensione della molecola dell'enzima o la natura della sua struttura e specificità della subunità.
La specificità di un enzima è determinata dal suo forte legame con l'estremità accettore del tRNA, la regione DU e il ciclo variabile. Alcuni enzimi sembrano non riconoscere la tripletta di anticodone e catalizzare la reazione di aminoacetilazione anche quando l'anticodone è alterato. Tuttavia, alcuni enzimi mostrano un'attività ridotta in relazione a tali tRNA modificati e aggiungono l'amminoacido sbagliato quando si sostituisce l'anticodone.
70-90n | pagina secondaria - quadrifoglio | CCA 3" const per tutti i tRNA |
la presenza di timina, pseudouridina-psi, digirouridina DGU nel D-loop - protezione contro le ribonucleasi? longevo | Una varietà di strutture primarie di tRNA - 61 + 1 - dal numero di codoni + formilmetionina tRNA, l'anticodone del gatto è lo stesso di quello della metionina tRNA. Varietà di strutture terziarie - 20 (in base al numero di amminoacidi)
Esistono due tipi di metionina legante il tRNA tRNAFMet e tRNAMMet nei procarioti e tRNAIMet e tRNAMMet negli eucarioti. La metionina viene aggiunta a ciascun tRNA utilizzando l'appropriata sintesi di aminoacil-tRNA. la metionina attaccata a tRNAFMet e tRNAIMet è formata dall'enzima metionil-tRNA-transformilasi a Fmet-tRNAFMet. I tRNA caricati con formilmetionina riconoscono il codone di inizio AUG.
Letteratura:
Purtroppo non c'è bibliografia.
Manuale. Nonostante il fatto che il tRNA sia molto più piccolo, una storia sulla sua struttura, caratteristiche e funzionamento merita un capitolo a parte.
Quindi, il tRNA è un "adattatore", che riconosce la sequenza di tre lettere del codice genetico a un'estremità, abbinandola all'unico amminoacido corrispondente fissato all'altra estremità del tRNA. Alla fine dell'RNA di trasferimento che tocca l'RNA messaggero, si formano 3 nucleotidi anticodone. Solo se l'anticodone è complementare alla regione dell'mRNA, l'RNA di trasferimento può unirsi ad esso. Ma anche in questo caso, il tRNA non può unirsi all'mRNA da solo; ha bisogno dell'aiuto del ribosoma, che è il sito della loro interazione, nonché di un partecipante attivo alla traduzione. Ad esempio, è il ribosoma che crea legami tra gli amminoacidi portati dal tRNA, formando una catena proteica.
Le caratteristiche strutturali del tRNA sono determinate dal codice genetico, cioè dalle regole per costruire una proteina secondo un gene che legge l'RNA di trasferimento. Questo codice funziona in ogni creatura vivente sulla Terra: la creazione di un virus è scritta negli stessi codoni di tre lettere che vengono usati per scrivere le "istruzioni di montaggio" di un delfino. È stato verificato sperimentalmente che i geni di un essere vivente, posti nella cellula di un altro, sono perfettamente copiati e tradotti in proteine indistinguibili dai geni che si riproducono nelle cellule dell'ospite. L'uniformità del codice genetico è alla base della produzione di E. coli modificato da parte di colonie di insulina e di molti altri enzimi umani che vengono utilizzati come farmaci per persone il cui organismo non è in grado di produrli, o produrli in modo insufficiente. Nonostante l'ovvia differenza tra esseri umani ed E. coli, le proteine umane sono facilmente create da modelli umani utilizzando una fotocopiatrice di E. coli. Non sorprende che gli RNA di trasferimento di diverse creature differiscano molto poco.

Ogni codone di questo elenco, tranne tre codoni di arresto, che segnala il completamento della traduzione, dovrebbe essere riconosciuto dall'RNA di trasferimento. Il riconoscimento viene effettuato allegando un anticodone all'RNA messaggero, che può legarsi solo a un codone dell'elenco, quindi il tRNA può riconoscere solo un codone. Ciò significa che ci sono almeno 61 tipi di queste molecole nella cellula. In effetti, ce ne sono anche di più, poiché in alcune situazioni per leggere l'RNA messaggero non basta avere l'anticodone giusto: sono necessarie altre condizioni, in base alle quali si crea uno speciale tRNA modificato.
A prima vista, una tale varietà di tRNA dovrebbe complicare notevolmente il processo di traduzione: dopotutto, ciascuna di queste molecole controllerà il codone dell'RNA della matrice sostituito dal ribosoma per verificarne la conformità con il suo anticodone - sembrerebbe che così tanto lavoro meccanico inutile , tanto tempo ed energie sprecate. Ma come risultato dell'evoluzione, si sono formati anche meccanismi cellulari che prevengono questo problema. Ad esempio, la quantità di tRNA di ciascuna specie in una cellula corrisponde alla frequenza con cui l'amminoacido trasportato da quella specie si trova nelle proteine in costruzione. Ci sono amminoacidi che sono usati raramente dalla cellula, e ci sono quelli che sono usati spesso, e se il numero di tRNA che li trasporta fosse lo stesso, ciò complicherebbe notevolmente l'assemblaggio delle proteine. Pertanto, ci sono pochi aminoacidi "rari" e i loro corrispondenti tRNA nella cellula, mentre gli aminoacidi che si verificano frequentemente vengono prodotti in grandi quantità.

Con una tale varietà di molecole di tRNA, sono tutte molto simili, quindi, considerando la loro struttura e le loro funzioni, studieremo principalmente le caratteristiche comuni a tutte le specie. Quando guardi il layout 3D del tRNA, sembra un denso mucchio di atomi. Sembra incredibile che questa molecola intricata a spirale sia il risultato del ripiegamento di una lunga catena di nucleotidi, ma è così che si forma.
È possibile risalire alle fasi della sua formazione, partendo dal primo: la compilazione di una sequenza nucleotidica da parte della RNA polimerasi in accordo con il gene contenente le informazioni su questo RNA di trasferimento. Viene chiamato l'ordine in cui questi nucleotidi si susseguono e il loro numero struttura primaria del tRNA. Si scopre che è la struttura primaria del tRNA che è codificata nel gene letto dalla RNA polimerasi. In generale, la struttura primaria è una sequenza di molecole relativamente semplici dello stesso tipo, di cui è composta una molecola polimerica più complessa e ripiegata. Ad esempio, la struttura primaria di una molecola proteica è la semplice sequenza dei suoi amminoacidi costituenti.

Qualsiasi catena di nucleotidi non può essere in uno stato dispiegato in una cellula, semplicemente distesa in una linea. Ci sono troppe parti caricate positivamente e negativamente ai bordi dei nucleotidi, che formano facilmente legami idrogeno tra loro. Come si formano gli stessi legami tra i nucleotidi di due molecole di DNA, collegandoli in una doppia elica, è descritto in e puoi entrare nei dettagli sui legami idrogeno. I legami idrogeno sono meno forti dei legami tra gli atomi nelle molecole, ma sono sufficienti per attorcigliare il filo del tRNA in modo complesso e mantenerlo in quella posizione. All'inizio, questi legami si formano solo tra alcuni nucleotidi, piegando il tRNA a forma di foglia di trifoglio. Viene chiamato il risultato di questa piegatura iniziale struttura secondaria tRNA. Il diagramma a sinistra mostra che solo alcuni nucleotidi sono legati da legami idrogeno, mentre altri rimangono spaiati, formando anelli e anse. Le differenze tra la struttura secondaria di diversi tipi di tRNA sono dovute a differenze nella loro struttura primaria. Ciò si manifesta in diverse lunghezze di "foglie di trifoglio" o "stelo" a causa delle diverse lunghezze della catena iniziale di nucleotidi.
Un'altra differenza nella struttura primaria dei diversi tRNA è che solo in alcune posizioni hanno gli stessi nucleotidi (nel diagramma sopra sono contrassegnati con le prime lettere dei loro nomi), mentre la maggior parte dei nucleotidi nei diversi tRNA differiscono l'uno dall'altro. Lo schema sopra è comune a tutti i tRNA, quindi i diversi nucleotidi sono contrassegnati da numeri.
Le principali parti funzionali del tRNA sono:
=) anticodone, cioè la sequenza nucleotidica complementare a un singolo codone di RNA messaggero situato su forcina anticodone
=) estremità accettore a cui si può legare un amminoacido. Si trova sul lato opposto della forcina anticodone.
In realtà, non un singolo tRNA appare come nel diagramma della struttura secondaria, perché solo alcuni nucleotidi si sono uniti per formarlo, mentre il resto è rimasto spaiato. A causa della formazione di legami idrogeno tra nucleotidi provenienti da diverse parti della foglia di trifoglio, si piega ulteriormente in una forma molto più complessa struttura terziaria a forma di L. Puoi capire esattamente come le diverse parti della struttura secondaria si sono curvate per formare la struttura terziaria facendo corrispondere i colori nei loro diagrammi sottostanti. La forcina anticodone, contrassegnata in blu e grigio, rimane in basso (vale la pena ricordare che questo "fondo" è condizionale: è conveniente rappresentare il tRNA in questo orientamento spaziale negli schemi di traduzione delle proteine) e l'estremità dell'accettore (giallo) è piegato di lato.

Ecco come appare il tRNA quando è pronto per legare un amminoacido. Il tRNA non è in grado di combinarsi con l'amminoacido da solo, ciò richiede la partecipazione di un enzima speciale: sintetasi aminoacil-tRNA. Il numero di tipi di sintetasi in una cellula coincide con il numero di tipi di tRNA.
L'uniformità della forma di tutti i tipi di tRNA è necessaria affinché il ribosoma sia in grado di riconoscerne uno, facilitare il loro aggancio con l'mRNA e spostarsi al suo interno da un sito all'altro. Se diversi tipi di tRNA fossero significativamente diversi l'uno dall'altro, ciò renderebbe estremamente difficile il lavoro del ribosoma, riducendo in modo critico il tasso di sintesi proteica. La selezione naturale mira quindi a rendere i tRNA simili tra loro. Ma allo stesso tempo, c'è un altro fattore che richiede l'esistenza di differenze evidenti tra i diversi tipi di tRNA: dopotutto, è necessario riconoscere ogni tipo e attaccarvi l'unico amminoacido corrispondente. Ovviamente, queste differenze dovrebbero essere evidenti, ma non troppo significative, in modo che il lavoro di riconoscimento delle specie di tRNA si trasformi in un processo di gioielleria. Ed è proprio questo che svolgono le aminoacil-tRNA sintetasi: ognuna di esse può legarsi a uno solo dei 20 aminoacidi e legarlo proprio a quei tipi di tRNA che corrispondono a questo amminoacido. Dalla tabella con il codice genetico si può notare che ogni amminoacido è codificato da più sequenze nucleotidiche, quindi, ad esempio, tutti e quattro i tRNA con anticodoni CGA, CGG, CGU e CGC saranno riconosciuti dalla stessa sintetasi che lega l'alanina a loro. Vengono chiamati tali tRNA elaborati da una sintetasi imparentato.
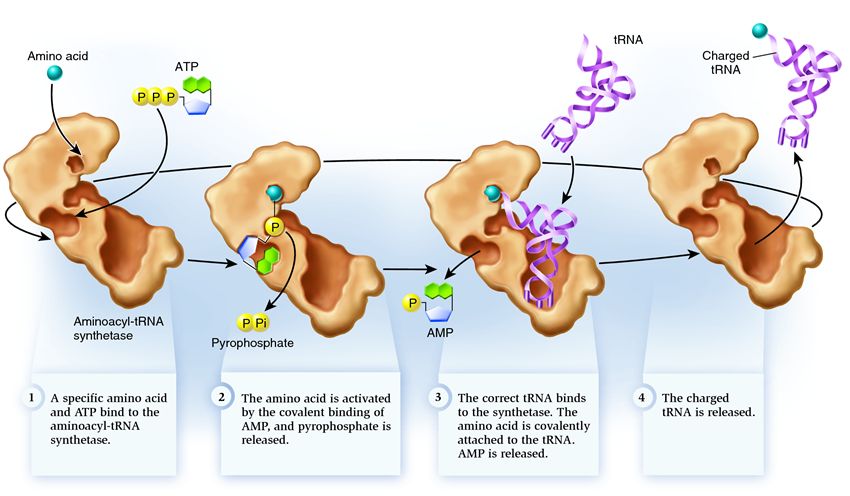
La sintetasi appartiene a un gruppo di enzimi la cui funzione è quella di legarsi a molecole esistenti separatamente e combinarle in una:
1 . la sintetasi collega un amminoacido e una molecola di ATP. Due gruppi fosfato si staccano dall'ATP, liberando l'energia necessaria per le seguenti attività. L'adenosina monofosfato (AMP) rimanente dalla molecola distrutta si attacca all'amminoacido, preparandolo per la connessione con la forcina accettore.
2 . la sintetasi si lega a uno dei relativi tRNA corrispondenti a questo amminoacido.

In questa fase viene verificata la conformità dell'RNA di trasferimento alla sintetasi. Esistono diversi modi di riconoscimento e ogni sintetasi ha una combinazione unica di essi. Almeno un nucleotide anticodone è coinvolto nell'interazione tra sintetasi e tRNA. Anche la forcina accettore deve essere verificata: su di essa viene determinata la presenza di nucleotidi specifici comuni ai relativi tRNA corrispondenti all'amminoacido desiderato. Anche i nucleotidi di altre parti del tRNA possono partecipare all'abbinamento legandosi a determinati siti di sintetasi. Il tRNA sbagliato può corrispondere in qualche modo a quello desiderato, ma a causa dell'abbinamento incompleto, si unirà alla sintetasi lentamente e liberamente, cadendo facilmente. E il tRNA corretto si attaccherà alla sintetasi rapidamente e saldamente, a seguito della quale la struttura della sintetasi cambia, avviando il processo aminoacilazione , cioè l'attaccamento di un amminoacido al tRNA.

3 . l'aminoacilazione consiste nel sostituire la molecola di AMP attaccata all'amminoacido con una molecola di tRNA. Dopo questa sostituzione, l'AMP lascia la sintetasi e il tRNA viene trattenuto per un ultimo controllo degli aminoacidi. Se l'amminoacido attaccato viene riconosciuto come errato, verrà staccato dal tRNA, il posto dell'amminoacido nella sintetasi sarà vuoto e un'altra molecola può unirsi a lì. Il nuovo amminoacido passerà attraverso le fasi di connessione con ATP e tRNA e sarà anche testato. Se non sono stati commessi errori, il tRNA carico di amminoacidi viene rilasciato: è pronto a svolgere il suo ruolo nella traduzione delle proteine. E la sintetasi è pronta per attaccare nuovi amminoacidi e tRNA e il ciclo ricomincia.
Molto dipende dal corretto funzionamento dell'amminoacil-tRNA sintetasi: se si verifica un guasto in questa fase, l'amminoacido sbagliato verrà attaccato al tRNA. E sarà incorporato nella proteina che cresce sul ribosoma, perché il tRNA e il ribosoma non hanno la funzione di controllare la corrispondenza del codone e dell'amminoacido. Le conseguenze dell'errore possono essere minori o catastrofiche e, attraverso la selezione naturale, le creature con enzimi che non hanno la funzione di tali controlli sono state soppiantate da creature più adattabili con varie opzioni di abbinamento tra amminoacido e tRNA. Pertanto, nelle cellule moderne, la sintetasi si combina con l'amminoacido sbagliato in media in un caso su 50 mila e con il tRNA sbagliato solo una volta su 100 mila allegati.

Alcuni amminoacidi differiscono l'uno dall'altro solo per pochi atomi. Se guardi ai loro schemi, diventa ovvio che la probabilità di confondere l'arginina con l'alanina è molto inferiore rispetto alla confusione dell'isoleucina con leucina o valina. Pertanto, ogni sintetasi che si lega a uno degli amminoacidi simili tra loro ha meccanismi di verifica aggiuntivi. Ecco un esempio di tale adattamento nell'isoleucina-tRNA sintetasi:

Ogni sintasi ha centro sintetico in cui un amminoacido è legato a un tRNA. La forcella accettore del tRNA catturato dalla sintetasi va lì, così come l'amminoacido che è pronto a reagire con esso. Il lavoro di alcune sintetasi termina immediatamente dopo la connessione dell'amminoacido e del tRNA. Ma l'ile-tRNA sintetasi ha una maggiore possibilità di commettere errori a causa dell'esistenza di altri aminoacidi simili all'isoleucina. Pertanto, anche lei ha centro correzionale: dal nome è chiaro quale ruolo svolge nel processo di connessione del tRNA e degli amminoacidi. La figura a destra mostra che la posizione dell'estremità della forcina dell'accettore di tRNA nel centro sintetico dell'ile-tRNA sintetasi conferisce a questa forcina una curva innaturale. Tuttavia, la sintetasi mantiene il tRNA in questa posizione fino a quando l'amminoacido non si attacca ad esso. Dopo che si è verificata questa connessione, la necessità di trovare la forcina accettore nel centro sintetico è esaurita e il tRNA si raddrizza, portando la sua estremità con l'amminoacido attaccato ad esso nel centro di correzione.

Naturalmente, il centro sintetico svolge anche un ruolo nello screening degli amminoacidi che non sono adatti per la sintetasi. Per entrarci, la molecola deve soddisfare una serie di condizioni, inclusa la giusta dimensione. Nonostante il fatto che leucina e isoleucina contengano lo stesso numero di atomi, a causa delle differenze nella struttura spaziale, la leucina è più grande. Pertanto, non può penetrare nel centro sintetico, la cui dimensione corrisponde all'isoleucina più compatta, e rimbalza semplicemente sull'ile-tRNA sintetasi.
Ma la valina, che è la più piccola di queste tre molecole con una struttura atomica simile, prende facilmente il posto dell'isoleucina nel centro sintetico e la sintetasi la lega al tRNA. È in questo caso che entra in gioco il centro correttivo della sintetasi. Se la forcina accettore di raddrizzamento è caricata correttamente e trasporta isoleucina, allora non può schiacciarsi all'interno del centro di correzione: è semplicemente troppo piccola per questa molecola. Pertanto, il tRNA raddrizzato non è più trattenuto da nulla e viene staccato dalla sintetasi. Ma se la valina è attaccata al tRNA, scivola nel centro di correzione, mantenendo così il tRNA collegato ad esso nella sintetasi. Una permanenza così troppo lunga di tRNA all'interno è un segnale di errore per la sintetasi, cambiando la sua configurazione spaziale. Di conseguenza:
=) la valina viene staccata dal tRNA e rimossa dalla sintetasi
=) la forcina accettore ritorna al sito sintetico, in attesa dell'adesione all'amminoacido
=) la sintetasi si lega a un nuovo amminoacido, "carica" il tRNA con esso e controlla di nuovo se l'isoleucina è stata utilizzata per questo.
Un simile meccanismo di doppio riconoscimento è utilizzato da altre sintetasi.
Proprietà fisiche e chimiche del DNA
Vari fattori che rompono i legami idrogeno (aumento della temperatura oltre gli 80°C, variazioni del pH e della forza ionica, azione dell'urea, ecc.) causano la denaturazione del DNA, ad es. cambiamento nella disposizione spaziale delle catene di DNA senza rompere i legami covalenti. La doppia elica del DNA durante la denaturazione è completamente o parzialmente divisa nelle sue catene componenti. La denaturazione del DNA è accompagnata da un aumento dell'assorbimento ottico nella regione UV delle basi puriniche e pirimidiniche. Questo fenomeno si chiama effetto ipercromico . La denaturazione riduce anche l'elevata viscosità inerente alle soluzioni di DNA nativo. Quando la struttura originale del DNA a doppio filamento viene ripristinata, a seguito della rinaturazione, l'assorbimento a 260 nm da parte delle basi azotate diminuisce a causa della loro "schermatura". Questo fenomeno si chiama effetto ipocromico .
Lo "svolgimento" di ciascun DNA nelle sue catene componenti viene effettuato entro un determinato intervallo di temperatura. Il punto medio di questo intervallo è chiamato punto di fusione. La temperatura di fusione del DNA dipende in condizioni standard (un certo pH e forza ionica) dal rapporto delle basi azotate. Le coppie GC contenenti tre legami idrogeno sono più forti, quindi, maggiore è il contenuto di coppie GC nel DNA, maggiore è il punto di fusione.
Funzioni del DNA. Nella sequenza dei nucleotidi nelle molecole di DNA, l'informazione genetica è codificata. Le principali funzioni del DNA sono, in primo luogo, garantire la riproduzione di se stesso in una serie di generazioni di cellule e generazioni di organismi e, in secondo luogo, garantire la sintesi delle proteine. Queste funzioni sono dovute al fatto che le molecole di DNA fungono da matrice nel primo caso per la replicazione, ad es. copiare le informazioni nelle molecole di DNA figlie, nel secondo - per la trascrizione, ad es. per ricodificare le informazioni nella struttura dell'RNA.
Riso. 5 Curva di fusione (denaturazione del DNA)
I filamenti complementari di DNA separati durante la denaturazione possono, in determinate condizioni, ricollegarsi in una doppia elica. Questo processo è chiamato RINATURAZIONE. Se la denaturazione non è avvenuta completamente e almeno alcune basi non hanno perso l'interazione da parte dei legami idrogeno, la rinaturazione procede molto rapidamente.
Il citoplasma delle cellule contiene tre principali tipi funzionali di RNA. Questi sono RNA messaggeri - mRNA che fungono da modelli per la sintesi proteica, RNA ribosomiali - rRNA che agiscono come componenti strutturali dei ribosomi e RNA di trasferimento - tRNA coinvolti nella traduzione (traduzione) delle informazioni dell'mRNA nella sequenza di amminoacidi nella proteina.
La tabella 2 mostra le differenze tra DNA e RNA in termini di struttura, localizzazione nella cellula e funzioni.
Tabella 2 Differenze tra DNA e RNA
Trasferimento di RNA, tRNA-acido ribonucleico, la cui funzione è di trasportare AA al sito di sintesi proteica. Ha una lunghezza tipica da 73 a 93 nucleotidi e una dimensione di circa 5 nm. I tRNA sono anche coinvolti direttamente nella crescita della catena polipeptidica, unendosi - trovandosi in un complesso con un amminoacido - al codone dell'mRNA e fornendo la conformazione del complesso necessaria per la formazione di un nuovo legame peptidico. Ogni amminoacido ha il suo tRNA. Il tRNA è un RNA a filamento singolo, ma nella sua forma funzionale ha una conformazione a quadrifoglio. AA si lega in modo covalente all'estremità 3 "della molecola utilizzando l'enzima aminoacil-tRNA sintetasi, specifico per ogni tipo di tRNA. Nel sito C, è presente un anticodone corrispondente all'AA-te. I tRNA sono sintetizzati dalla normale RNA polimerasi nel caso dei procarioti e dalla RNA polimerasi III nel caso degli eucarioti I trascritti dei geni del tRNA subiscono un processamento multistadio, che porta alla formazione di una struttura spaziale tipica del tRNA.
L'elaborazione del tRNA prevede 5 passaggi chiave:
rimozione della sequenza nucleotidica leader da 5";
rimozione della sequenza 3'-terminale;
aggiunta di una sequenza CCA all'estremità 3";
escissione di introni (negli eucarioti e negli archaea);
modificazioni dei singoli nucleotidi.
Il trasporto del tRNA viene effettuato lungo una via Ran-dipendente con la partecipazione del fattore di trasporto exportin t, che riconosce il caratteristico str-ru secondario e terziario del tRNA maturo: brevi sezioni a doppio filamento e correttamente processate 5"- e 3" finisce. Questo meccanismo assicura che solo i tRNA maturi vengano esportati dal nucleo.
62. Traduzione - riconoscimento del codone mRNA
La traduzione è una sintesi proteica effettuata dai ribosomi a partire da amminoacidi su un modello di mRNA (o e RNA). Gli elementi costitutivi del processo di traduzione: aminoacidi, tRNA, ribosomi, mRNA, enzimi per l'amminoacilazione del tRNA, fattori di traduzione proteica (fattori proteici di inizio, allungamento, terminazione - proteine extraribosomiali specifiche necessarie per i processi di traduzione), fonti di energia ATP e GTP , ioni magnesio (stabilizzano la struttura del ribosoma). 20 aminoacidi sono coinvolti nella sintesi proteica. Affinché un amminoacido possa "riconoscere" il suo posto nella futura catena polipeptidica, deve legarsi a un RNA di trasferimento (tRNA) che svolge una funzione di adattamento. Il tRNA che si lega all'amminoacido riconosce quindi il codone corrispondente sull'mRNA. Riconoscimento del codone mRNA:
L'interazione codone-anticodone si basa sui principi di complementarità e antiparallelismo:
3'----C - G-A*------5' tRNA anticodone
5'-----G-C-Y*------ Codone di mRNA da 3'
L'ipotesi dell'oscillazione è stata proposta da F. Crick:
La base 3' del codone mRNA ha un accoppiamento non stretto con la base 5' dell'anticodone tRNA: ad esempio, Y (mRNA) può interagire con A e G (tRNA)
Alcuni tRNA possono accoppiarsi con più di un codone.
63. Caratteristiche degli elementi costitutivi del processo traduttivo. La traduzione (translatio-translation) è il processo di sintesi proteica a partire da amminoacidi sulla matrice dell'RNA informativo (matrice) (mRNA, mRNA) svolto dal ribosoma.
La sintesi proteica è alla base della vita cellulare. Per eseguire questo processo nelle cellule di tutti gli organismi ci sono organelli speciali - ribosomi- complessi ribonucleoproteici costituiti da 2 subunità: grande e piccola. La funzione dei ribosomi è quella di riconoscere tre lettere (tre nucleotidi) codoni mRNA, confrontandoli con i corrispondenti anticodoni tRNA che trasportano aminoacidi e l'aggiunta di questi amminoacidi alla catena proteica in crescita. Muovendosi lungo la molecola di mRNA, il ribosoma sintetizza una proteina in accordo con le informazioni contenute nella molecola di mRNA.
Per il riconoscimento di AK-t nella cella, ci sono speciali "adattatori", trasferire molecole di RNA(tRNA). Queste molecole a forma di quadrifoglio hanno un sito (anticodone) complementare a un codone di mRNA, così come un altro sito a cui è attaccato l'amminoacido corrispondente a quel codone. L'attacco degli amminoacidi al tRNA viene effettuato in una reazione dipendente dall'energia dagli enzimi aminoacil-tRNA sintetasi e la molecola risultante è chiamata aminoacil-tRNA. Pertanto, la specificità della traduzione è determinata dall'interazione tra il codone mRNA e l'anticodone tRNA, nonché dalla specificità delle aminoacil-tRNA sintetasi che legano gli amminoacidi strettamente ai loro tRNA corrispondenti (ad esempio, il codone GGU corrisponderà a un tRNA contenente l'anticodone CCA e solo glicina AK).
ribosoma procariotico
5S e 23S rRNA 16S rRNA
34 scoiattoli 21 scoiattoli
I ribosomi procariotici hanno una costante di sedimentazione di 70S, motivo per cui sono chiamati particelle 70S. Sono costruiti da due diverse subunità: subunità 30S e 50S. Ogni subunità è un complesso di rRNA e proteine ribosomiali.
La particella 30S contiene una molecola di rRNA 16S e nella maggior parte dei casi una molecola proteica di più di 20 specie (21) . La subunità 50S è costituita da due molecole di rRNA (23S e 5S). È costituito da più di 30 diverse proteine (34), anch'esse rappresentate, di regola, da una copia. La maggior parte delle proteine ribosomiali svolge una funzione strutturale.
ribosoma eucariotico
5S; 5,8S e 28S rRNA 18S rRNA
almeno 50 proteine almeno 33 proteine
Il ribosoma è costituito da subunità grandi e piccole. La base della struttura di ciascuna subunità è un rRNA ripiegato in modo complesso. Le proteine del ribosoma sono state attaccate allo scaffold di rRNA.
Il coefficiente di sedimentazione di un ribosoma eucariotico completo è di circa 80 unità Svedberg (80S) e il coefficiente di sedimentazione delle sue sottoparticelle è 40S e 60S.
La subunità 40S più piccola è costituita da una molecola di rRNA 18S e da 30-40 molecole proteiche. La grande subunità 60S contiene tre tipi di rRNA con coefficienti di sedimentazione di 5S, 5,8S e 28S e 40-50 proteine (ad esempio, i ribosomi degli epatociti di ratto includono 49 proteine).
Regioni funzionali dei ribosomi
P - sito peptidil per peptidil tRNA
Sito A - amminoacilico per il tRNA amminoacilico
E - sito per il rilascio di tRNA dal ribosoma
Il ribosoma contiene 2 siti funzionali per l'interazione con il tRNA: aminoacile (accettore) e peptidile (donatore). L'amminoacil-tRNA entra nel sito accettore del ribosoma e interagisce per formare legami idrogeno tra le triplette di codone e anticodone. Dopo la formazione dei legami idrogeno, il sistema avanza di 1 codone e finisce nel sito donatore. Allo stesso tempo, un nuovo codone appare nel sito dell'accettore lasciato libero e il corrispondente aminoacil-t-RNA è attaccato ad esso.
Ribosomi: struttura, funzione
I ribosomi sono i centri citoplasmatici della biosintesi proteica. Sono costituiti da subunità grandi e piccole, che differiscono per coefficienti di sedimentazione (velocità di sedimentazione durante la centrifugazione), espressi in unità di Svedberg - S.
I ribosomi sono presenti sia nelle cellule eucariotiche che in quelle procariotiche, poiché svolgono un'importante funzione biosintesi proteica. Ogni cellula contiene decine, centinaia di migliaia (fino a diversi milioni) di questi piccoli organelli rotondi. È una particella ribonucleoproteica arrotondata. Il suo diametro è di 20-30 nm. Il ribosoma è costituito da subunità grandi e piccole, che differiscono per coefficienti di sedimentazione (velocità di sedimentazione durante la centrifugazione), espressi in unità di Svedberg - S. Queste subunità sono combinate in presenza di un filamento di m-RNA (matrice, o RNA informativo). Viene chiamato un complesso di un gruppo di ribosomi uniti da una singola molecola di mRNA come un filo di perline polisoma. Queste strutture si trovano liberamente nel citoplasma o sono attaccate alle membrane dell'ER granulare (in entrambi i casi, la sintesi proteica procede attivamente su di esse).
I polisomi dell'ER granulare formano proteine che vengono escrete dalla cellula e utilizzate per i bisogni dell'intero organismo (ad esempio enzimi digestivi, proteine del latte materno umano). Inoltre, i ribosomi sono presenti sulla superficie interna delle membrane mitocondriali, dove partecipano anche attivamente alla sintesi delle molecole proteiche.
L'RNA di trasferimento (tRNA) svolge un ruolo importante nel processo di utilizzo delle informazioni ereditarie da parte della cellula. Fornendo gli amminoacidi necessari al sito di assemblaggio delle catene peptidiche, il tRNA funge da mediatore traslazionale.
Le molecole di tRNA sono catene polinucleotidiche sintetizzate su specifiche sequenze di DNA. Sono costituiti da un numero relativamente piccolo di nucleotidi -75-95. Come risultato della connessione complementare di basi che si trovano in diverse parti della catena polinucleotidica del tRNA, acquisisce una struttura simile a una foglia di trifoglio (Fig. 3.26).
Riso. 3.26. La struttura di una tipica molecola di tRNA.
Ha quattro parti principali che svolgono funzioni diverse. accettore Il "gambo" è formato da due parti terminali collegate complementari del tRNA. Consiste di sette coppie di basi. L'estremità 3' di questo stelo è leggermente più lunga e forma una regione a filamento singolo che termina con una sequenza CCA con un gruppo OH libero. A questo fine è attaccato un amminoacido trasportabile. I restanti tre rami sono sequenze nucleotidiche accoppiate complementari che terminano in sezioni spaiate che formano anelli. Il centro di questi rami - anticodone - è costituito da cinque coppie di nucleotidi e contiene un anticodone al centro del suo anello. L'anticodone è costituito da tre nucleotidi complementari al codone mRNA, che codifica per l'amminoacido trasportato da questo tRNA al sito di sintesi del peptide.
Tra l'accettore e i rami dell'anticodone ci sono due rami laterali. Nei loro cicli, contengono basi modificate - diidrouridina (D-loop) e la tripletta TψC, dove \y è la pseudouriaina (T^C-loop).
Tra i rami di aiticodone e T^C c'è un'ansa aggiuntiva, che comprende da 3-5 a 13-21 nucleotidi.
In generale, diversi tipi di tRNA sono caratterizzati da una certa costanza della sequenza nucleotidica, che il più delle volte è costituita da 76 nucleotidi. La variazione del loro numero è principalmente dovuta alla variazione del numero di nucleotidi nell'anello aggiuntivo. Le regioni complementari che supportano la struttura del tRNA sono solitamente conservate. La struttura primaria del tRNA, determinata dalla sequenza dei nucleotidi, forma la struttura secondaria del tRNA, che ha la forma di una foglia di trifoglio. A sua volta, la struttura secondaria determina una struttura terziaria tridimensionale, caratterizzata dalla formazione di due doppie eliche perpendicolari (Fig. 3.27). Uno di essi è formato dall'accettore e dai rami TψC, l'altro dall'anticodone e dai rami D.
Alla fine di una delle doppie eliche c'è l'amminoacido trasportato, all'estremità dell'altra c'è l'anticodone. Queste aree sono le più distanti l'una dall'altra. La stabilità della struttura terziaria del tRNA è mantenuta grazie alla comparsa di ulteriori legami idrogeno tra le basi della catena polinucleotidica, situate in parti diverse di essa, ma spazialmente vicine nella struttura terziaria.
Diversi tipi di tRNA hanno una struttura terziaria simile, sebbene con alcune variazioni.
Riso. 3.27. Organizzazione spaziale del tRNA:
I - la struttura secondaria del tRNA sotto forma di una "foglia di trifoglio", determinata dalla sua struttura primaria (la sequenza dei nucleotidi nella catena);
II - proiezione bidimensionale della struttura terziaria del tRNA;
III - disposizione della molecola di tRNA nello spazio
APPENDICE (nel caso qualcuno non lo capisca)
Denti da fulmine - nucleotidi (adenina-timina / uracile /, guanina-citazina). Tutti i fulmini sono DNA.

Per trasferire informazioni dal DNA, devi rompere 2 fili. Il legame tra AT e G-C è idrogeno, quindi è facilmente rotto dall'enzima Helicase:

Per evitare la formazione di nodi (ad esempio, ho attorcigliato un asciugamano):



La topoisomerasi taglia un filamento di DNA all'origine della replicazione in modo che la catena non si attorcigli.

Quando un filo è libero, il secondo può ruotare facilmente attorno al proprio asse, scaricando così la tensione durante lo "svolgimento". I nodi non vengono visualizzati, l'energia viene risparmiata.
Quindi, è necessario un primer di RNA per iniziare a raccogliere l'RNA. Una proteina che assembla l'mRNA non può semplicemente assemblare il primo nucleotide, ha bisogno di un pezzo di RNA per iniziare (è scritto in dettaglio lì, lo scriverò più avanti). Questo pezzo è chiamato primer RNA. E questa proteina le attacca già il primo nucleotide.


Quando si descrive la struttura degli acidi nucleici, vengono presi in considerazione i diversi livelli di organizzazione delle macromolecole: struttura primaria e secondaria.
La struttura primaria degli acidi nucleici è la composizione nucleotidica e una certa sequenza di unità nucleotidiche nella catena polimerica.
Struttura secondaria dell'RNA. La molecola di acido ribonucleico è costituita da un'unica catena polinucleotidica.
Struttura secondaria dell'RNA
Sezioni separate della catena dell'RNA formano anelli a spirale - "forcine", a causa dei legami idrogeno tra le basi azotate complementari A-U e G-C. Le sezioni della catena dell'RNA in tali strutture elicoidali sono antiparallele, ma non sempre completamente complementari; contengono residui di nucleotidi spaiati o persino anse a filamento singolo che non si adattano alla doppia elica. La presenza di regioni spiralizzate è caratteristica di tutti i tipi di RNA.
Il ruolo principale dell'RNA è la partecipazione diretta alla biosintesi delle proteine.
Sono noti tre tipi di RNA cellulare, che differiscono per posizione nella cellula, composizione, dimensioni e proprietà che determinano il loro ruolo specifico nella formazione delle macromolecole proteiche:
- gli RNA informativi (matrice) trasmettono informazioni codificate nel DNA sulla struttura della proteina dal nucleo cellulare ai ribosomi, dove avviene la sintesi proteica; la struttura primaria di tutti gli mRNA, indipendentemente dall'unicità della loro sequenza codificante, ha la stessa struttura delle estremità 5'- e 3'.
Quindi, all'estremità 5' c'è un nucleotide modificato 7-metilguanosina-5'-trifosfato (cappuccio). Diverse decine di nucleotidi separano il cappuccio dal codone di iniziazione, solitamente la tripletta -AUG-. La regione di codifica è seguita da uno dei codoni di terminazione -UGA-, -UUA-, -UAG-. All'estremità 3' della maggior parte degli mRNA, c'è una sequenza nucleotidica di 100-200 residui di adenosina monofosfato.
- gli RNA transfer raccolgono gli amminoacidi nel citoplasma della cellula e li trasferiscono al ribosoma; Molecole di RNA di questo tipo "apprendono" dalle sezioni corrispondenti della catena dell'RNA messaggero quali amminoacidi dovrebbero partecipare alla sintesi proteica.
La struttura spaziale di qualsiasi tRNA, indipendentemente dalle differenze nella sequenza nucleotidica, è descritta dal modello a quadrifoglio universale. Ogni molecola di tRNA ha sezioni di catena che non sono coinvolte nella formazione di legami idrogeno tra i residui nucleotidici.
Questi includono, in particolare, il sito responsabile del legame con l'amminoacido all'estremità 3' della molecola e l'anticodone, una tripletta specifica di nucleotidi che interagisce in modo complementare con il codone dell'mRNA.
- L'RNA ribosomiale fornisce la sintesi proteica di una certa struttura, leggendo le informazioni dall'RNA dell'informazione (matrice). Gli rRNA formano complessi con proteine chiamate ribosomi.
Ogni ribosoma è costituito da due subunità: piccola (40S) e grande (60S). Le subunità ribosomiali differiscono non solo nell'insieme degli rRNA, ma anche nel numero e nella struttura delle proteine.
Data di pubblicazione: 03-02-2015; Leggi: 2729 | Violazione del copyright della pagina

L'RNA è un polimero i cui monomeri sono ribonucleotidi.
A differenza del DNA, l'RNA non è formato da due, ma da una catena polinucleotidica (eccezione: alcuni virus contenenti RNA hanno RNA a doppio filamento). I nucleotidi di RNA sono in grado di formare legami idrogeno tra loro. Le catene di RNA sono molto più corte delle catene di DNA.
Il monomero RNA - nucleotide (ribonucleotide) - è costituito da residui di tre sostanze: 1) una base azotata, 2) un monosaccaride a cinque atomi di carbonio (pentoso) e 3) acido fosforico. Anche le basi azotate dell'RNA appartengono alle classi delle pirimidine e delle purine.
Basi pirimidiniche dell'RNA - uracile, citosina, basi puriniche - adenina e guanina.
31. Tipi di RNA e caratteristiche della sua struttura
L'RNA nucleotide monosaccaride è rappresentato dal ribosio.
Esistono tre tipi di RNA: 1) informazione (matrice) RNA - mRNA (mRNA), 2) RNA di trasferimento - tRNA, 3) RNA ribosomiale - rRNA.
Tutti i tipi di RNA sono polinucleotidi non ramificati, hanno una specifica conformazione spaziale e partecipano ai processi di sintesi proteica.
Le informazioni sulla struttura di tutti i tipi di RNA sono memorizzate nel DNA. Il processo di sintesi dell'RNA su un modello di DNA è comunemente chiamato trascrizione.

Gli RNA di trasferimento contengono solitamente 76 (da 75 a 95) nucleotidi; peso molecolare - 25.000–30.000.
Il tRNA rappresenta circa il 10% del contenuto totale di RNA nella cellula. Funzioni del tRNA: 1) trasporto degli amminoacidi al sito di sintesi proteica, ai ribosomi, 2) mediatore traslazionale. Nella cellula si trovano circa 40 tipi di tRNA, ognuno di essi ha una sequenza nucleotidica caratteristica solo per essa. Allo stesso tempo, tutti i tRNA hanno diverse regioni complementari intramolecolari, grazie alle quali i tRNA acquisiscono una conformazione simile a una foglia di trifoglio.
Qualsiasi tRNA ha un'ansa per il contatto con il ribosoma (1), un'ansa anticodone (2), un'ansa per il contatto con l'enzima (3), uno stelo accettore (4) e un anticodone (5). L'amminoacido è attaccato all'estremità 3' dello stelo accettore. Anticodone - tre nucleotidi che "riconoscono" un codone di mRNA.
Va sottolineato che un particolare tRNA può trasportare un amminoacido strettamente definito corrispondente al suo anticodone. La specificità della connessione di amminoacidi e tRNA è ottenuta grazie alle proprietà dell'enzima aminoacil-tRNA sintetasi.
Gli RNA ribosomiali contengono 3000–5000 nucleotidi; peso molecolare - 1.000.000-1.500.000.
L'rRNA rappresenta l'80-85% del contenuto totale di RNA nella cellula. In complesso con le proteine ribosomiali, l'rRNA forma ribosomi - organelli che svolgono la sintesi proteica. Nelle cellule eucariotiche, la sintesi dell'rRNA avviene nel nucleolo. Funzioni dell'rRNA: 1) un componente strutturale necessario dei ribosomi e, quindi, garantire il funzionamento dei ribosomi; 2) garantire l'interazione del ribosoma e del tRNA; 3) il legame iniziale del ribosoma e del codone iniziatore dell'mRNA e la determinazione del frame di lettura, 4) la formazione del centro attivo del ribosoma.
Gli RNA messaggeri sono diversi per contenuto di nucleotidi e peso molecolare (da 50.000 a 4.000.000).
La quota di mRNA rappresenta fino al 5% del contenuto totale di RNA nella cellula. Funzioni dell'mRNA: 1) trasferimento di informazioni genetiche dal DNA ai ribosomi, 2) una matrice per la sintesi di una molecola proteica, 3) determinazione della sequenza amminoacidica della struttura primaria di una molecola proteica.
Leggi anche
L'RNA è un polimero i cui monomeri sono nucleotidi.
Le tre basi azotate sono le stesse del DNA (adenina, guanina, citosina); il quarto - uracile - è presente nella molecola di RNA al posto della timina. I nucleotidi di RNA contengono ribosio invece di desossiribosio. Nella catena dell'RNA...
tre tipi principali di RNA: informativo(mRNA), o matrice(mRNA), ribosomiale(rRNA) e trasporto(tRNA). Differiscono per dimensione molecolare e funzione. Tutti i tipi di RNA sono sintetizzati sul DNA con la partecipazione di enzimi - RNA polimerasi. L'RNA messaggero costituisce il 2-3% di tutto l'RNA cellulare, ribosomiale - 80-85, trasporto - circa il 15%.
mRNA.
legge le informazioni ereditarie da un segmento di DNA e, sotto forma di una sequenza copiata di basi azotate, le trasferisce ai ribosomi, dove viene sintetizzata una certa proteina. Ciascuna delle molecole di mRNA nell'ordine dei nucleotidi e nelle dimensioni corrisponde al gene nel DNA da cui è stata trascritta. In media, l'mRNA contiene 1500 nucleotidi (75-3000). Ogni tripletta (tre nucleotidi) su un mRNA è chiamata codone. Dipende dal codone quale aminoacido apparirà in un determinato luogo durante la sintesi proteica.
(tRNA) ha un peso molecolare relativamente basso di circa 24-29 mila.
D e contiene da 75 a 90 nucleotidi nella molecola. Fino al 10% di tutti i nucleotidi di tRNA sono basi minori, che, a quanto pare, lo proteggono dall'azione degli enzimi idrolitici.Il ruolo del tRNA è che trasferiscono gli amminoacidi ai ribosomi e partecipano al processo di sintesi proteica. Ogni amminoacido si lega a un tRNA specifico. Un certo numero di amminoacidi ha più di un tRNA. Ad oggi sono stati scoperti più di 60 tRNA che differiscono nella loro struttura primaria (sequenza di base).
La struttura secondaria di tutti i tRNA si presenta sotto forma di una foglia di trifoglio con uno stelo a doppio filamento e tre a filamento singolo). Alla fine di una delle catene c'è un sito accettore: la tripletta CCA, all'adenina di cui è attaccato un amminoacido specifico.
(rRNA). Contengono 120-3100 nucleotidi. L'RNA ribosomiale si accumula nel nucleo, nei nucleoli.
Le proteine ribosomiali vengono trasportate al nucleolo dal citoplasma e lì avviene la formazione spontanea di sottoparticelle ribosomiali combinando le proteine con il corrispondente rRNA. Le sottoparticelle del ribosoma vengono trasportate insieme o separatamente attraverso i pori della membrana nucleare nel citoplasma. ribosomi sono organelli di 20-30 nm.
Sono costruiti da due sottoparticelle di diverse dimensioni e forme. In determinate fasi della sintesi proteica nella cellula, i ribosomi sono divisi in sottoparticelle.
L'RNA ribosomiale funge da struttura per i ribosomi e facilita il legame iniziale dell'mRNA al ribosoma durante la biosintesi proteica.
Domanda 6 I legami che formano le strutture primarie e secondarie del DNA e dell'RNA. Tipi di RNA
Il codice genetico è un modo per codificare la sequenza amminoacidica delle proteine utilizzando una sequenza di nucleotidi, caratteristica di tutti gli organismi viventi.
Proprietà: 1) codice genetico tripletta(ogni amminoacido è codificato da tre nucleotidi); 2) non sovrapponibili(le triplette vicine non hanno nucleotidi comuni); 3) degenerare(ad eccezione della metionina e del triptofano, tutti gli amminoacidi hanno più di un codone); 4) universale(per lo più lo stesso per tutti gli organismi viventi); 5) nei codoni per un amminoacido, i primi due nucleotidi sono generalmente gli stessi e il terzo varia; 6) ha un ordine di lettura lineare ed è caratterizzato da linearità, t.
e. la coincidenza dell'ordine dei codoni nell'mRNA con l'ordine degli amminoacidi nella catena polipeptidica sintetizzata.
Data di pubblicazione: 08-12-2014; Leggi: 11268 | Violazione del copyright della pagina
studiopedia.org - Studopedia.Org - 2014-2018 (0,001 s) ...
Il citoplasma delle cellule contiene tre principali tipi funzionali di RNA:
- RNA messaggero (mRNA) che fungono da modelli per la sintesi proteica;
- RNA ribosomiale (rRNA) che agisce come componenti strutturali dei ribosomi;
- trasferire gli RNA (tRNA) coinvolti nella traduzione (traduzione) delle informazioni di mRNA nella sequenza amminoacidica di una molecola proteica.
Nel nucleo delle cellule si trova l'RNA nucleare, che costituisce dal 4 al 10% dell'RNA cellulare totale.
La maggior parte dell'RNA nucleare è rappresentata da precursori ad alto peso molecolare dell'RNA ribosomiale e di trasferimento. I precursori degli rRNA ad alto peso molecolare (28 S, 18 S e 5 S RNA) sono localizzati principalmente nel nucleolo.
L'RNA è il materiale genetico principale in alcuni virus animali e vegetali (RNA genomico). La maggior parte dei virus a RNA sono caratterizzati dalla trascrizione inversa del loro genoma a RNA, diretta dalla trascrittasi inversa.
Tutti gli acidi ribonucleici sono polimeri di ribonucleotidi collegati, come in una molecola di DNA, da legami 3′,5′-fosforodiestere.
A differenza del DNA, che ha una struttura a doppio filamento, l'RNA è una molecola polimerica lineare a filamento singolo.
struttura dell'mRNA. L'mRNA è la classe di RNA più eterogenea in termini di dimensioni e stabilità.
struttura del tRNA.
Gli RNA di trasferimento agiscono come mediatori (adattatori) durante la traduzione dell'mRNA. Rappresentano circa il 15% dell'RNA cellulare totale. Ciascuno dei 20 amminoacidi proteinogenici ha il proprio tRNA. Per alcuni amminoacidi codificati da due o più codoni, esistono diversi tRNA.
I tRNA sono molecole a filamento singolo relativamente piccole costituite da 70-93 nucleotidi. Il loro peso molecolare è (2,4-3,1) 0,104 kDa.
La struttura secondaria del tRNA si forma a causa della formazione del numero massimo di legami idrogeno tra coppie complementari intramolecolari di basi azotate.
Come risultato della formazione di questi legami, la catena polinucleotidica del tRNA si attorciglia con la formazione di rami spiralati che terminano in anelli di nucleotidi spaiati. L'immagine spaziale delle strutture secondarie di tutti i tRNA ha la forma di un quadrifoglio.
Quattro rami obbligatori si distinguono nel "quadrifoglio", i tRNA più lunghi, inoltre, contengono un quinto ramo corto (aggiuntivo).
La funzione adattatrice del tRNA è fornita da un ramo accettore, all'estremità 3' del quale un residuo amminoacidico è attaccato da un legame etereo, e un ramo anticodone opposto al ramo accettore, alla sommità del quale vi è un anello contenente un anticodone.
Un anticodone è una tripletta specifica di nucleotidi che è complementare nella direzione antiparallela al codone mRNA che codifica per l'amminoacido corrispondente.
Il ramo a T che trasporta l'ansa della pseudouridina (TyC-loop) assicura l'interazione del tRNA con i ribosomi.
Il ramo D, che porta il ciclo deidrouridina, assicura l'interazione del tRNA con la corrispondente aminoacil-tRNA sintetasi.

Struttura secondaria del tRNA
Le funzioni del quinto ramo aggiuntivo sono ancora poco conosciute; molto probabilmente equalizza la lunghezza di diverse molecole di tRNA.
La struttura terziaria del tRNA è molto compatta ed è formata riunendo i singoli rami della foglia di trifoglio a causa di legami idrogeno aggiuntivi per formare una struttura a "curva del gomito" a forma di L.
RNA di trasporto, struttura e meccanismo funzionale.
In questo caso, il braccio accettore che lega l'amminoacido si trova a un'estremità della molecola e l'anticodone si trova all'altra.

Struttura terziaria del tRNA (secondo AS Spirin)
La struttura dell'rRNA e dei ribosomi. Gli RNA ribosomiali costituiscono la spina dorsale a cui si legano proteine specifiche per formare i ribosomi. I ribosomi sono organelli nucleoproteici che forniscono la sintesi proteica dall'mRNA.
Il numero di ribosomi in una cellula è molto grande: da 104 nei procarioti a 106 negli eucarioti. I ribosomi sono localizzati principalmente nel citoplasma, negli eucarioti, inoltre, nel nucleolo, nella matrice mitocondriale e nello stroma dei cloroplasti. I ribosomi sono costituiti da due sottoparticelle: grande e piccola. Per dimensione e peso molecolare, tutti i ribosomi studiati sono divisi in 3 gruppi: ribosomi 70S di procarioti (coefficiente di sedimentazione S), costituiti da piccole sottoparticelle 30S e grandi 50S; Ribosomi eucariotici 80S, costituiti da subunità 40S piccole e 60S grandi.
La piccola subunità dei ribosomi 80S è formata da una molecola di rRNA (18S) e 33 molecole di varie proteine.
La subunità grande è formata da tre molecole di rRNA (5S, 5.8S e 28S) e circa 50 proteine.
La struttura secondaria dell'rRNA è formata a causa di brevi sezioni a doppio filamento della molecola - forcine (circa 2/3 di rRNA), 1/3 - è rappresentata da sezioni a singolo filamento ricche di nucleotidi purinici.
Pulsanti sociali per Joomla
Le proteine costituiscono la base della vita. Le loro funzioni nella cellula sono molto diverse. Tuttavia, le proteine "non possono" riprodursi. E tutte le informazioni sulla struttura delle proteine sono contenute nei geni (DNA).
Negli organismi superiori, le proteine vengono sintetizzate nel citoplasma della cellula e il DNA è nascosto dietro il guscio del nucleo. Pertanto, il DNA non può fungere direttamente da modello per la sintesi proteica. Questo ruolo è svolto da un altro acido nucleico - RNA.
La molecola di RNA è un polinucleotide non ramificato con una struttura terziaria.
È formato da una catena polinucleotidica e, sebbene i nucleotidi complementari inclusi in essa siano anche in grado di formare legami idrogeno tra loro, questi legami si verificano tra i nucleotidi di una catena. Le catene di RNA sono molto più corte delle catene di DNA. Se il contenuto di DNA in una cellula è relativamente costante, il contenuto di RNA fluttua notevolmente. La maggior quantità di RNA nelle cellule si osserva durante la sintesi proteica.
L'RNA svolge un ruolo importante nella trasmissione e nell'implementazione delle informazioni ereditarie.
In accordo con la funzione e le caratteristiche strutturali, si distinguono diverse classi di RNA cellulare.
Esistono tre classi principali di RNA cellulare.
- Informativo (mRNA) o matrice (mRNA). Le sue molecole sono le più diverse per dimensioni, peso molecolare (da 0,05x106 a 4x106) e stabilità.
Costituiscono circa il 2% della quantità totale di RNA nella cellula. Tutti gli mRNA sono portatori di informazioni genetiche dal nucleo al citoplasma, al sito di sintesi proteica. Servono da matrice (disegno di lavoro) per la sintesi di una molecola proteica, poiché determinano la sequenza amminoacidica (struttura primaria) di una molecola proteica.

- RNA ribosomiale (rRNA).
Costituiscono l'80-85% del contenuto totale di RNA nella cellula.
31. La struttura dell'RNA. Tipi di RNA, caratteristiche e funzioni strutturali. Struttura secondaria del tRNA
L'RNA ribosomiale è costituito da 3-5 mila nucleotidi. È sintetizzato nei nucleoli del nucleo. In complesso con le proteine ribosomiali, l'rRNA forma ribosomi - organelli su cui sono assemblate le molecole proteiche. Il significato principale dell'rRNA è che fornisce il legame iniziale di mRNA e ribosoma e forma il centro attivo del ribosoma, in cui si formano legami peptidici tra gli amminoacidi durante la sintesi della catena polipeptidica.
- Trasferimento di RNA (tRNA).
Le molecole di tRNA di solito contengono 75-86 nucleotidi. Il peso molecolare delle molecole di tRNA è di circa 25 mila Le molecole di tRNA svolgono il ruolo di intermediari nella biosintesi proteica: forniscono amminoacidi al sito di sintesi proteica, cioè ai ribosomi. La cellula contiene più di 30 tipi di tRNA. Ogni tipo di tRNA ha la sua sequenza nucleotidica unica.
Tuttavia, tutte le molecole hanno diverse regioni complementari intramolecolari, a causa della presenza delle quali tutti i tRNA hanno una struttura terziaria che ricorda la forma di una foglia di trifoglio.
Struttura secondaria dell'RNA- caratteristica del tRNA, a filamento singolo, a forma di "foglia di trifoglio".
Include:
- doppie eliche relativamente corte - steli,
- sezioni a filamento singolo - anelli.
Ci sono 4 steli (accettore, anticodone, diidrouridile, pseudouridile) e 3 anse.

"Stem-loop" - un elemento della struttura secondaria dell'RNA, schematicamente

"Pseudoknot" - un elemento della struttura secondaria dell'RNA, schematicamente

Lo stelo accettore contiene le estremità 3' e 5' della catena polinucleotidica, l'estremità 5' termina con un residuo di acido guanilico, l'estremità 3' è una tripletta CCA e serve a formare un legame estereo con AA.
Lo stelo dell'anticodone riconosce il suo codone sull'mRNA nei ribosomi in base al principio di complementarità.
Lo stelo pseudouridilico serve per attaccarsi al ribosoma.
Lo stelo diidrouridilico serve a legarsi all'amminoacil-tRNA sintetasi.
Pulsanti sociali per Joomla





