A tRNS funkcionális régiói. A tRNS felépítése és funkciói, az aminosavaktiváció jellemzői
70-90N | másodlagos oldal - lóhere | CCA 3" állandó minden tRNS esetén |
timin, pszeudouridin-psi, digirouridin DGU jelenléte a D-hurokban - ribonukleázok elleni védelem? hosszú életű | A tRNS számos primer szerkezete - 61 + 1 - a kodonok száma + formil-metionin tRNS, a macska antikodonja megegyezik a metionin tRNS-ével. A tercier szerkezetek változatossága - 20 (az aminosavak száma szerint) | felismerés - kovalens kötés kialakulása m-y tRNS és aktus | aminoacil-tRNS szintetázok kapcsolódnak a tRNS-hez
A tRNS funkciója az aminosavak átvitele a citoplazmából a riboszómákba, ahol a fehérjeszintézis megtörténik.
Az egy aminosavat megkötő tRNS-eket izoakceptoroknak nevezzük.
Összesen 64 különböző tRNS létezik egyidejűleg egy sejtben.
Mindegyik tRNS csak a saját kodonjával párosul.
Mindegyik tRNS felismeri a saját kodonját aminosav bevonása nélkül. A tRNS-hez kötött aminosavakat kémiailag módosítottuk, majd a kapott polipeptidet, amely a módosított aminosavat tartalmazta, elemeztük. A ciszteinil-tRNACys (R=CH2-SH) alanil-tRNACys-re (R=CH3) redukálódott.
A legtöbb tRNS, függetlenül a nukleotid szekvenciától, lóherelevél alakú másodlagos szerkezettel rendelkezik, mivel három hajtű van benne.
A tRNS szerkezeti jellemzői
A molekula 3 "végén mindig négy párosítatlan nukleotid található, és ebből három szükségszerűen CCA. Az RNS lánc 5" és 3" vége akceptor szárat alkot. A láncok a komplementer párosítás miatt tartják össze hét nukleotid 5" - a végén hét nukleotid található a 3 "vég közelében. 2. Minden molekulának van egy T?C hajtűje, ezért azért nevezték így, mert két szokatlan maradékot tartalmaz: ribotimidint (T) és pszeudouridint (? A hajtű egy kettős hajtűből áll - szálas szár öt páros bázisból, beleértve a G-C párt, és egy hét nukleotid hosszúságú hurokból.
a hurok ugyanazon a pontján. 3. Az antikodon hajtűben a szárat mindig egy páros család képviseli
okokból. A hurokban található a kapcsolódó kodonnal komplementer triplet, az antikodon.
le, amely hét nukleotidból áll. Egy változatlan ura-
cil és egy módosított citozin, és egy módosított purin csatlakozik a 3" végéhez, mint szabály
adenin. 4. Egy másik hajtű egy három-négy pár nukleotid hosszúságú szárból és egy változó hurokból áll
méretű, gyakran redukált formában tartalmaz uracilt - dihidrouracilt (DU). A szárak nukleotidszekvenciája, az antikodon szár és a T?C szár közötti nukleotidok száma (változó hurok), valamint a hurok mérete és a DU hurokban lévő dihidrouracil-maradékok lokalizációja változik a legerősebben.
[Énekes, 1998].
A tRNS harmadlagos szerkezete
L alakú szerkezet.
Aminosavak kötődése a tRNS-hez
Ahhoz, hogy egy aminosav polipeptidláncot tudjon kialakítani, az aminoacil-tRNS szintetáz enzim által a tRNS-hez kell kapcsolódnia. Ez az enzim kovalens kötést hoz létre az aminosav-karboxilcsoport és a ribóz-hidroxilcsoport között a tRNS 3' végén, az ATP részvételével. Az aminoacil-tRNS szintetáz egy specifikus kodont nem a tRNS-en lévő antikodon jelenléte miatt ismer fel, hanem a tRNS-en lévő specifikus felismerési hely miatt.
Összesen 21 különböző aminoacil-tRNS szintetáz található a sejtben.
A csatlakozás két szakaszban történik:
1. Egy aminosav karboxilcsoportja az ATP a-foszfáthoz kapcsolódik. A kapott instabil aminoacil-adenilát az enzimhez való kötődéssel stabilizálódik.
2. Az aminoacil-adenilát aminoacilcsoportjának átvitele a tRNS terminális ribóz 2' vagy 3'-OH csoportjába
Egyes aminoacil-tRNS szintetázok egyetlen polipeptid láncból állnak, míg mások két vagy négy azonos láncból állnak, amelyek molekulatömege 35-115 kDa. Egyes dimer és tetramer enzimek kétféle alegységből állnak. Nincs egyértelmű összefüggés az enzimmolekula mérete, illetve alegységének szerkezete és specificitása között.
Egy enzim specificitását a tRNS akceptor végéhez, a DU régióhoz és a variábilis hurokhoz való erős kötődése határozza meg. Úgy tűnik, hogy egyes enzimek nem ismerik fel az antikodonhármast, és katalizálják az aminoacetilezési reakciót még akkor sem, ha az antikodon megváltozik. Egyes enzimek azonban csökkent aktivitást mutatnak az ilyen módosított tRNS-ekkel kapcsolatban, és rossz aminosavat adnak hozzá az antikodon cseréjekor.
70-90n | másodlagos oldal - lóhere | CCA 3" állandó minden tRNS esetén |
timin, pszeudouridin-psi, digirouridin DGU jelenléte a D-hurokban - ribonukleázok elleni védelem? hosszú életű | A tRNS számos primer szerkezete - 61 + 1 - a kodonok száma + formil-metionin tRNS, a macska antikodonja megegyezik a metionin tRNS-ével. Különféle tercier szerkezetek - 20 (az aminosavak számától függően)
Kétféle tRNS-kötő metionin létezik: tRNAFMet és tRNAMMet prokariótákban, tRNAIMet és tRNAMMet pedig eukariótákban. Mindegyik tRNS-hez metionint adnak a megfelelő aminoacil-tRNS szintézis alkalmazásával. A tRNAFMet-hez és a tRNAIMet-hez kapcsolódó metionint a metionil-tRNS-transzformiláz enzim hozza létre Fmet-tRNAFMet-vé. A formil-metioninnal töltött tRNS-ek felismerik az AUG iniciációs kodont.
Irodalom:
Sajnos nincs bibliográfia.
Tankönyv. Annak ellenére, hogy a tRNS sokkal kisebb, a felépítéséről, jellemzőiről és működéséről szóló történet külön fejezetet érdemel.
Tehát a tRNS egy „adapter”, amely az egyik végén felismeri a genetikai kód hárombetűs szekvenciáját, és összeilleszti azt a tRNS másik végén rögzített egyetlen megfelelő aminosavval. A hírvivő RNS-t érintő transzfer RNS végén 3 nukleotid képződik antikodon. A transzfer RNS csak akkor csatlakozhat hozzá, ha az antikodon komplementer az mRNS-régióval. A tRNS azonban ebben az esetben sem tud önmagában csatlakozni az mRNS-hez, szüksége van a kölcsönhatásuk helyszínéül szolgáló riboszóma segítségére, valamint a transzláció aktív résztvevőjére. Például a riboszóma az, amely kötéseket hoz létre a tRNS által hozott aminosavak között, fehérjeláncot alkotva.
A tRNS szerkezeti jellemzőit a genetikai kód határozza meg, vagyis a transzfer RNS által beolvasott gén szerinti fehérje felépítésének szabályai. Ez a kód minden élőlényben működik a Földön: a vírus létrehozása ugyanazokban a hárombetűs kodonokban van leírva, mint a delfinek "összeszerelési utasításainak". Kísérletileg igazolták, hogy az egyik élőlény génjei, amelyeket egy másik sejtjébe helyeznek, tökéletesen lemásolódnak és olyan fehérjékké alakulnak át, amelyek megkülönböztethetetlenek a gazdaszervezet sejtjeiben szaporodó génektől. A genetikai kód egységessége az alapja annak, hogy az inzulin és sok más emberi enzim kolóniái módosított E. coli-t termelnek, amelyeket gyógyszerként használnak olyan emberek számára, akiknek szervezete nem képes előállítani, vagy nem termel elegendő mennyiséget. Az ember és az E. coli közötti nyilvánvaló különbség ellenére emberi fehérjék könnyen előállíthatók emberi tervrajzokból E. coli másológép segítségével. Nem meglepő, hogy a különböző lények transzfer RNS-ei nagyon kevéssé különböznek.

Minden kodon ebből a listából, három kivételével stop kodonok, amely a transzláció befejezését jelzi, a transzfer RNS-nek fel kell ismernie. A felismerés úgy történik, hogy a hírvivő RNS-hez egy antikodont kapcsolunk, amely csak egy kodonhoz tud kötődni a listából, így a tRNS csak egy kodont tud felismerni. Ez azt jelenti, hogy ezeknek a molekuláknak legalább 61 típusa van a sejtben. Sőt, még több is van belőlük, hiszen bizonyos helyzetekben a hírvivő RNS leolvasásához nem elég csak a megfelelő antikodon megléte: más feltételek is szükségesek, amelyeknek megfelelően speciális, módosított tRNS jön létre.
Első pillantásra a tRNS-ek ilyen sokfélesége jelentősen megnehezíti a transzlációs folyamatot: elvégre ezek a molekulák mindegyike ellenőrzi a riboszómával helyettesített mátrix RNS kodont, hogy megfeleljen-e az antikodonjának – úgy tűnik, hogy ez a sok értelmetlen mechanikai munka. , annyi elvesztegetett idő és energia. De az evolúció eredményeként olyan sejtes mechanizmusok is kialakultak, amelyek megakadályozzák ezt a problémát. Például az egyes fajok tRNS-ének mennyisége egy sejtben megfelel annak, hogy az adott faj által hordozott aminosav milyen gyakran található meg az épülő fehérjékben. Vannak aminosavak, amelyeket ritkán használ fel a sejt, és vannak olyanok, amelyeket gyakran használnak, és ha az ezeket hordozó tRNS-ek száma azonos lenne, az nagymértékben megnehezítené a fehérjék összeállítását. Ezért kevés "ritka" aminosav és a hozzájuk tartozó tRNS található a sejtben, miközben a gyakran előforduló aminosavak nagy mennyiségben termelődnek.

A tRNS-molekulák ilyen sokféleségével mindegyik nagyon hasonló, ezért szerkezetüket és funkciójukat figyelembe véve elsősorban az összes fajra jellemző tulajdonságokat vizsgáljuk. Ha megnézzük a tRNS 3D-s elrendezését, úgy néz ki, mint egy sűrű atomhalom. Hihetetlennek tűnik, hogy ez a bonyolultan felcsavarodott molekula egy hosszú nukleotidlánc felhajtásának eredménye, de így keletkezik.
Kialakulásának szakaszai nyomon követhetők, az elsőtől kezdve: egy nukleotidszekvencia RNS-polimeráz általi összeállítása a transzfer RNS-ről információt tartalmazó génnek megfelelően. Azt a sorrendet, amelyben ezek a nukleotidok követik egymást és számukat, nevezzük A tRNS elsődleges szerkezete. Kiderült, hogy ez a tRNS elsődleges szerkezete, amelyet az RNS-polimeráz által leolvasott gén kódol. Általában az elsődleges szerkezet azonos típusú, viszonylag egyszerű molekulák sorozata, amelyekből egy összetettebb, hajtogatott polimer molekula áll. Például egy fehérjemolekula elsődleges szerkezete az alkotó aminosavak egyszerű szekvenciája.

Egy sejtben egyetlen nukleotidlánc sem lehet kibontott állapotban, egyszerűen egy vonalban kinyújtva. A nukleotidok szélein túl sok pozitív és negatív töltésű rész található, amelyek könnyen hidrogénkötést képeznek egymással. Leírja, hogyan jönnek létre ugyanazok a kötések két DNS-molekula nukleotidjai között, kettős spirálba kapcsolva őket, és a hidrogénkötésekkel kapcsolatos részletekért belemászhat. A hidrogénkötések kevésbé erősek, mint a molekulák atomjai közötti kötések, de elegendőek ahhoz, hogy a tRNS-szálat bonyolultan megcsavarják és ebben a helyzetben tartsák. Ezek a kötések eleinte csak néhány nukleotid között jönnek létre, és a tRNS-t lóherelevél alakba hajtják össze. Ennek a kezdeti hajtásnak az eredményét ún másodlagos szerkezet tRNS. A bal oldali diagram azt mutatja, hogy csak néhány nukleotid kapcsolódik hidrogénkötéssel, míg mások páratlanok maradnak, és gyűrűket és hurkokat képeznek. A különböző típusú tRNS másodlagos szerkezete közötti különbségek az elsődleges szerkezetükben mutatkozó különbségekből adódnak. Ez a "lóherelevél" vagy "szár" különböző hosszúságában nyilvánul meg a kezdeti nukleotidlánc eltérő hosszúsága miatt.
Másik különbség a különböző tRNS-ek elsődleges szerkezetében, hogy csak néhány pozícióban rendelkeznek azonos nukleotidokkal (a fenti diagramon nevük kezdőbetűivel vannak jelölve), míg a különböző tRNS-ekben lévő nukleotidok többsége különbözik egymástól. A fenti séma minden tRNS-re közös, ezért a különböző nukleotidokat számokkal jelöljük.
A tRNS fő funkcionális részei a következők:
=) antikodon, vagyis az a nukleotidszekvencia, amely komplementer a hírvivő RNS egyetlen kodonjával antikodon hajtű
=) elfogadó vég amelyhez aminosav kapcsolódhat. Az antikodon hajtű ellentétes oldalán található.
A valóságban egyetlen tRNS sem néz ki úgy, mint a másodlagos szerkezeti diagramon, mert csak néhány nukleotid kapcsolódott össze, és a többi párosítatlan maradt. A lóherelevél különböző részeiből származó nukleotidok között létrejövő hidrogénkötések következtében a lóherelevél tovább gyűrődik egy sokkal összetettebb harmadlagos szerkezet L alakban. Pontosan megértheti, hogy a másodlagos szerkezet különböző részei hogyan görbülnek a harmadlagos struktúrába, ha az alábbi ábráik színeit párosítják. A kékkel és szürkével jelölt antikodon hajtű alul marad (érdemes megjegyezni, hogy ez az „alsó” feltételes: kényelmes a tRNS-t ebben a térbeli orientációban ábrázolni a fehérje transzlációs sémákban), és az akceptor vége (sárga) oldalra van hajlítva.

Így néz ki a tRNS, amikor készen áll egy aminosav csatolására. A tRNS önmagában nem képes kombinálódni az aminosavval, ehhez egy speciális enzim részvétele szükséges: aminoacil-tRNS szintetázok. A szintetáz típusok száma egy sejtben egybeesik a tRNS típusok számával.
Minden típusú tRNS alakjának egységessége szükséges ahhoz, hogy a riboszóma bármelyiket felismerje, megkönnyítse az mRNS-hez való dokkolásukat, és önmagában mozogjon egyik helyről a másikra. Ha a különböző típusú tRNS jelentősen eltérne egymástól, az rendkívül megnehezítené a riboszóma munkáját, ami kritikusan csökkentené a fehérjeszintézis sebességét. A természetes szelekció tehát arra törekszik, hogy a tRNS-eket hasonlóvá tegye egymáshoz. Ugyanakkor van egy másik tényező, amely megköveteli, hogy észrevehető különbségek legyenek a különböző típusú tRNS-ek között: végül is minden típust fel kell ismerni, és hozzá kell kötni az egyetlen megfelelő aminosavat. Nyilvánvalóan ezeknek a különbségeknek észrevehetőnek kell lenniük, de nem túl jelentőseknek, hogy a tRNS-fajok felismerésének munkája ékszerfolyamattá fajuljon. És pontosan ezt hajtják végre az aminoacil-tRNS szintetázok: mindegyik a 20 aminosav közül csak egyhez tud kötődni, és pontosan azokhoz a tRNS-típusokhoz köti, amelyek ennek az aminosavnak felelnek meg. A genetikai kódot tartalmazó táblázatból látható, hogy minden aminosavat több nukleotid szekvencia kódol, így például mind a négy tRNS-t, amelyek antikodonjai CGA, CGG, CGU és CGC, ugyanaz a szintetáz fogja felismerni, amelyik az alanint köti. nekik. Az ilyen, egy szintetáz által feldolgozott tRNS-eket nevezzük összefüggő.
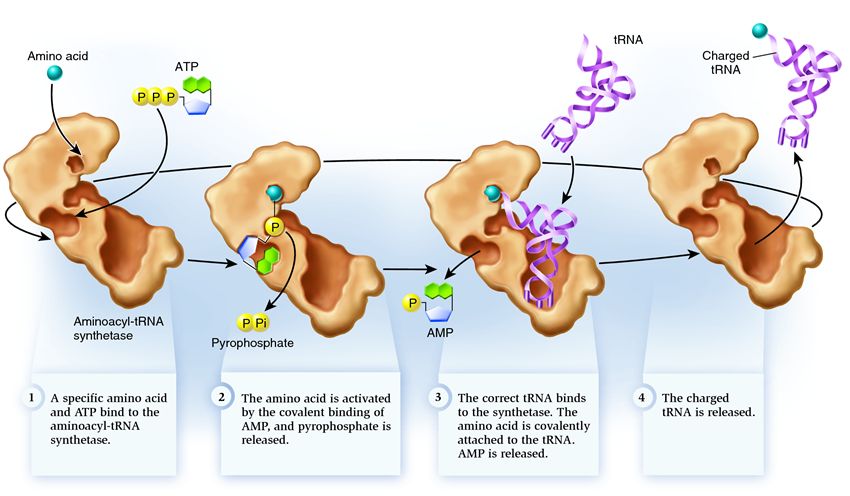
A szintetáz az enzimek azon csoportjába tartozik, amelyek funkciója az, hogy különállóan létező molekulákhoz kötődjenek, és egybe egyesítsék őket:
1 . A szintetáz egy aminosavat és egy ATP-molekulát köt össze. Két foszfátcsoport szakad el az ATP-től, felszabadítva a következő tevékenységekhez szükséges energiát. Az elpusztult molekulából visszamaradt adenozin-monofoszfát (AMP) az aminosavhoz kötődik, előkészítve azt az akceptor hajtűvel való kapcsolódásra.
2 . a szintetáz magához köti az ennek az aminosavnak megfelelő rokon tRNS-ek egyikét.

Ebben a szakaszban ellenőrizzük, hogy a transzfer RNS megfelel-e a szintetáznak. Számos módja van a felismerésnek, és mindegyik szintetáznak egyedi kombinációja van. Legalább egy antikodon nukleotid részt vesz a szintetáz és a tRNS közötti kölcsönhatásban. Az akceptor hajtűt is ellenőrizni kell: meghatározzák azon specifikus nukleotidok jelenlétét, amelyek a kívánt aminosavnak megfelelő rokon tRNS-ekben közösek. A tRNS más részeiből származó nukleotidok bizonyos szintetázhelyekhez kötődve is részt vehetnek az illesztésben. Lehet, hogy a rossz tRNS valamilyen módon egyezik a kívántal, de a hiányos illeszkedés miatt lassan és lazán csatlakozik a szintetázhoz, könnyen leesik. A megfelelő tRNS pedig gyorsan és határozottan tapad a szintetázhoz, aminek következtében a szintetáz szerkezete megváltozik, elindítva a folyamatot. aminoacilezés , azaz egy aminosav tRNS-hez való kapcsolódása.

3 . Az aminoacilezés abból áll, hogy az aminosavhoz kapcsolódó AMP-molekulát tRNS-molekulára cserélik. A csere után az AMP elhagyja a szintetázt, és a tRNS-t feltartják egy utolsó aminosav-ellenőrzésre. Ha a csatolt aminosavat hibásnak ismerik fel, akkor az leválik a tRNS-ről, üres lesz az aminosav helye a szintetázban, és oda csatlakozhat egy másik molekula. Az új aminosav átmegy az ATP-vel és a tRNS-sel való kapcsolódási szakaszokon, és tesztelni is fogják. Ha nem történt hiba, az aminosavval töltött tRNS felszabadul: készen áll a fehérjetranszlációban betöltött szerepére. És a szintetáz készen áll az új aminosavak és tRNS-ek csatolására, és a ciklus újra kezdődik.
Sok múlik az aminoacil-tRNS szintetáz megfelelő működésén: ha ebben a szakaszban meghibásodás következik be, akkor rossz aminosav kötődik a tRNS-hez. És beépül a riboszómán növő fehérjébe, mert a tRNS-nek és a riboszómának nem az a funkciója, hogy ellenőrizze a kodon és az aminosav egyezését. A tévedés következményei lehetnek csekélyek vagy katasztrofálisak, és a természetes szelekció révén az olyan enzimekkel rendelkező lényeket, amelyeknek nincs ilyen ellenőrzési funkciója, kiszorították az alkalmazkodóbb lényeket, amelyek különféle lehetőségeket kínálnak az aminosav és a tRNS közötti egyeztetésre. Ezért a modern sejtekben a szintetáz átlagosan 50 ezerből egy esetben kombinálódik rossz aminosavval, és 100 ezer kapcsolódásból csak egyszer nem megfelelő tRNS-sel.

Egyes aminosavak csak néhány atomban különböznek egymástól. Ha megnézzük a sémáikat, nyilvánvalóvá válik, hogy az arginin és az alanin összekeverésének valószínűsége sokkal kisebb, mint az izoleucin és a leucin vagy valin összetévesztésének valószínűsége. Ezért minden olyan szintetáz, amely az egymáshoz hasonló aminosavak valamelyikéhez kötődik, további ellenőrző mechanizmusokkal rendelkezik. Íme egy példa egy ilyen eszközre az izoleucin-tRNS szintetázban:

Mindegyik szintáznak van szintetikus központ amelyben egy aminosav tRNS-hez kapcsolódik. Oda kerül a szintetáz által megragadott tRNS akceptor hajtűje, ahogy a vele reakcióba lépő aminosav is. Egyes szintetázok munkája az aminosav és a tRNS összekapcsolása után azonnal véget ér. De az Ile-tRNS szintetáznak nagyobb az esélye a hibákra, mivel más izoleucinszerű aminosavak is léteznek. Ezért neki is van javítóközpont: a névből kiderül, milyen szerepet játszik a tRNS és az aminosavak összekapcsolásának folyamatában. A jobb oldali ábra azt mutatja, hogy a tRNS akceptor hajtű végének helyzete az Ile-tRNS szintetáz szintetikus központjában természetellenes hajlítást ad ennek a hajtűnek. A szintetáz azonban ebben a pozícióban tartja a tRNS-t, amíg az aminosav nem kapcsolódik hozzá. Miután ez a kapcsolat létrejött, elfogy az akceptor hajtű megtalálásának igénye a szintetikus központban, és a tRNS kiegyenesedik, és a hozzá kapcsolódó aminosavval a korrekciós központba kerül.

A szintetikus centrum természetesen szerepet játszik a szintetáz számára nem alkalmas aminosavak kiszűrésében is. Ahhoz, hogy bekerüljön, a molekulának számos feltételnek meg kell felelnie, beleértve a megfelelő méretűt is. Annak ellenére, hogy a leucin és az izoleucin azonos számú atomot tartalmaznak, a térszerkezeti különbségek miatt a leucin nagyobb. Ezért nem tud behatolni a szintetikus központba, amelynek mérete a kompaktabb izoleucinnak felel meg, és egyszerűen visszaverődik az Ile-tRNS szintetázról.
Ám a valin, amely a három hasonló atomszerkezetű molekula közül a legkisebb, könnyen átveszi az izoleucin helyét a szintetikus központban, és a szintetáz a tRNS-hez köti. Ebben az esetben a szintetáz korrekciós központja lép működésbe. Ha az egyengető akceptor hajtű megfelelően feltöltött és izoleucint hordoz, akkor nem tud beszorulni a korrekciós központba: egyszerűen túl kicsi ehhez a molekulához. Így a kiegyenesedett tRNS-t már nem tartja meg semmi, és leválik a szintetázról. De ha a valin a tRNS-hez kapcsolódik, becsúszik a korrekciós központba, ezáltal a tRNS-t hozzákapcsolva tartja a szintetázban. A tRNS ilyen túl hosszú bentmaradása hibajelzés a szintetáz számára, megváltoztatva annak térbeli konfigurációját. Ennek eredményeként:
=) a valin leválik a tRNS-ről és eltávolítjuk a szintetázból
=) az akceptor hajtű visszatér a szintetikus helyre, és várja az aminosavhoz való kapcsolódást
=) a szintetáz új aminosavhoz kötődik, azzal „tölti” a tRNS-t, és ismét ellenőrzi, hogy izoleucint használtak-e ehhez.
Hasonló kettős felismerési mechanizmust használnak más szintetázok is.
A DNS fizikai és kémiai tulajdonságai
Különféle, a hidrogénkötéseket megbontó tényezők (80 C feletti hőmérséklet-emelkedés, pH és ionerősség változása, karbamid hatása stb.) DNS denaturációt okoznak, pl. a DNS-láncok térbeli elrendeződésének változása kovalens kötések megszakadása nélkül. A denaturáció során a DNS kettős hélixe teljesen vagy részben felosztódik alkotó láncaira. A DNS denaturációja a purin és pirimidin bázisok UV-régiójában az optikai abszorpció növekedésével jár. Ezt a jelenséget az ún hiperkróm hatás . A denaturáció csökkenti a natív DNS-oldatokban rejlő magas viszkozitást is. Az eredeti kettős szálú DNS szerkezet helyreállításakor a renaturáció eredményeként a nitrogéntartalmú bázisok 260 nm-en történő abszorpciója az „árnyékolásuk” miatt csökken. Ezt a jelenséget az ún hipokróm hatás .
Az egyes DNS-ek "letekercselése" a komponensláncaiba egy bizonyos hőmérsékleti tartományon belül történik. Ennek az intervallumnak a felezőpontját olvadáspontnak nevezzük. A DNS olvadási hőmérséklete standard körülmények között (bizonyos pH és ionerősség) a nitrogénbázisok arányától függ. A három hidrogénkötést tartalmazó G-C párok erősebbek, ezért minél magasabb a G-C párok tartalma a DNS-ben, annál magasabb az olvadáspont.
A DNS funkciói. A DNS-molekulák nukleotidszekvenciájában genetikai információ van kódolva. A DNS fő funkciói egyrészt saját szaporodásának biztosítása sejtgenerációk és organizmusgenerációk sorozatában, másrészt a fehérjék szintézisének biztosítása. Ezek a funkciók annak köszönhetőek, hogy a DNS-molekulák első esetben mátrixként szolgálnak a replikációhoz, azaz a replikációhoz. információk másolása a leány DNS-molekulákban, a másodikban - a transzkripcióhoz, azaz. információ visszakódolása az RNS szerkezetébe.
Rizs. 5 Olvadási görbe (DNS denaturáció)
A denaturáció során elválasztott komplementer DNS-szálak bizonyos körülmények között újra kapcsolódhatnak kettős hélixbe. Ezt a folyamatot RENATURÁLÁSNAK nevezik. Ha a denaturáció nem ment végbe teljesen, és legalább néhány bázis nem veszítette el a kölcsönhatást a hidrogénkötések révén, a renaturáció nagyon gyorsan megy végbe.
A sejtek citoplazmája az RNS három fő funkcionális típusát tartalmazza. Ezek a hírvivő RNS-ek - mRNS-ek, amelyek templátként működnek a fehérjeszintézishez, riboszómális RNS-ek - rRNS-ek, amelyek a riboszómák szerkezeti komponenseiként működnek, és RNS-eket - tRNS-eket szállítanak, amelyek részt vesznek az mRNS információ transzlációjában (transzlációjában) a fehérje aminosavszekvenciájába.
A 2. táblázat bemutatja a DNS és az RNS közötti különbségeket a szerkezet, a sejtben való elhelyezkedés és a funkciók tekintetében.
2. táblázat A DNS és az RNS közötti különbségek
Transzfer RNS, tRNS-ribonukleinsav, melynek feladata az AA szállítása a fehérjeszintézis helyére. Tipikus hossza 73-93 nukleotid, mérete pedig körülbelül 5 nm. A tRNS-ek közvetlenül részt vesznek a polipeptid lánc növekedésében is, kapcsolódnak - aminosavval komplexben lévén - az mRNS kodonhoz és biztosítják az új peptidkötés kialakulásához szükséges komplex konformációját. Minden aminosavnak megvan a saját tRNS-e. A tRNS egyszálú RNS, de funkcionális formájában lóherelevél konformációjú. Az AA kovalensen kötődik a molekula 3"-os végéhez az aminoacil-tRNS szintetáz enzim segítségével, amely minden tRNS-típusra specifikus. A C helyen az AA-te-nek megfelelő antikodon található. A tRNS-eket közönséges RNS polimeráz szintetizálja abban az esetben eukarióták esetében az RNS polimeráz III-mal A tRNS gének transzkriptumai többlépcsős feldolgozáson mennek keresztül, ami a tRNS-re jellemző térszerkezet kialakulásához vezet.
A tRNS feldolgozás 5 fő lépésből áll:
az 5" vezető nukleotid szekvencia eltávolítása;
a 3'-terminális szekvencia eltávolítása;
CCA-szekvencia hozzáadása a 3"-os véghez;
az intronok kivágása (eukariótákban és archaeákban);
az egyes nukleotidok módosításai.
A tRNS szállítása Ran-függő útvonalon történik az exportin t transzportfaktor részvételével, amely felismeri az érett tRNS jellegzetes másodlagos és harmadlagos str-ru-ját: rövid kétszálú szakaszok és helyesen feldolgozott 5 "- és 3" véget ér. Ez a mechanizmus biztosítja, hogy csak az érett tRNS-ek kerüljenek ki a sejtmagból.
62. Translation - mRNS kodon felismerés
A transzláció egy fehérjeszintézis, amelyet riboszómák hajtanak végre aminosavakból egy mRNS (vagy és RNS) templáton. A transzlációs folyamat alkotóelemei: aminosavak, tRNS, riboszómák, mRNS, a tRNS aminoacilezésére szolgáló enzimek, fehérje transzlációs faktorok (inciációs, elongációs, terminációs fehérjefaktorok - a transzlációs folyamatokhoz szükséges specifikus extrariboszomális fehérjék), ATP és GTP energiaforrások , magnéziumionok (stabilizálják a riboszóma szerkezetét). 20 aminosav vesz részt a fehérjeszintézisben. Ahhoz, hogy egy aminosav „felismerje” helyét a jövőbeli polipeptidláncban, kötődnie kell egy transzfer RNS-hez (tRNS), amely adapter funkciót lát el. Az aminosavhoz kötődő tRNS ezután felismeri a megfelelő kodont az mRNS-en. mRNS kodon felismerés:
A kodon-antikodon kölcsönhatás a komplementaritás és az antiparallelizmus elvén alapul:
3'----C - G-A*------5' tRNS antikodon
5'-----G-C-Y*------3' mRNS kodon
A lötyögés-hipotézist F. Crick javasolta:
Az mRNS kodon 3'-bázisa nem szigorú párosítással rendelkezik a tRNS-antikodon 5'-bázisával: például az Y (mRNS) kölcsönhatásba léphet A-val és G-vel (tRNS)
Egyes tRNS-ek több kodonnal is párosodhatnak.
63. A fordítási folyamat alkotóelemeinek jellemzői. A transzláció (translatio-transláció) az információs (mátrix) RNS (mRNS, mRNS) mátrixán lévő aminosavakból a riboszóma által végrehajtott fehérjeszintézis folyamata.
A fehérjeszintézis a sejtek életének alapja. Ennek a folyamatnak az összes szervezet sejtjében történő végrehajtásához speciális organellumok vannak - riboszómák- ribonukleoprotein komplexek, amelyek 2 alegységből épülnek fel: nagy és kicsi. A riboszómák funkciója a hárombetűs (három nukleotid) felismerése. kodonok mRNS-t, összehasonlítva azokat a megfelelő tRNS antikodonokkal aminosavak, és ezen aminosavak hozzáadása a növekvő fehérjelánchoz. Az mRNS-molekula mentén haladva a riboszóma fehérjét szintetizál az mRNS-molekulában található információknak megfelelően.
Az AK-t sejtben történő felismerésére speciális "adapterek" vannak, RNS-molekulák átvitele(tRNS). Ezeknek a lóherelevél alakú molekuláknak van egy helye (antikodon), amely komplementer egy mRNS kodonhoz, valamint egy másik hely, amelyhez az adott kodonnak megfelelő aminosav kapcsolódik. Az aminosavak tRNS-hez való kapcsolódása energiafüggő reakcióban az aminoacil-tRNS szintetáz enzimek segítségével történik, és az így létrejövő molekulát aminoacil-tRNS-nek nevezik. Így a transzláció specifitását az mRNS kodon és a tRNS antikodon közötti kölcsönhatás, valamint azon aminoacil-tRNS szintetázok specifitása határozza meg, amelyek az aminosavakat szigorúan a megfelelő tRNS-ekhez kötik (például a GGU kodon egy CCA antikodont és csak AK glicint tartalmazó tRNS).
prokarióta riboszóma
5S és 23S rRNS 16S rRNS
34 mókus 21 mókus
A prokarióta riboszómák ülepedési állandója 70S, ezért nevezik őket 70S részecskéknek. Két különböző alegységből épülnek fel: 30S és 50S alegységekből. Mindegyik alegység rRNS és riboszomális fehérjék komplexe.
A 30S részecske egy 16S rRNS-molekulát és a legtöbb esetben egy fehérjemolekulát tartalmaz több mint 20 fajból (21). Az 50S alegység két rRNS-molekulából áll (23S és 5S). Több mint 30 különböző fehérjéből áll (34), amelyeket általában egy példány is képvisel. A riboszómális fehérjék többsége szerkezeti funkciót lát el.
eukarióta riboszóma
5S; 5,8S és 28S rRNS 18S rRNS
legalább 50 fehérje legalább 33 fehérje
A riboszóma nagy és kis alegységekből áll. Az egyes alegységek szerkezetének alapja egy komplexen hajtogatott rRNS. A riboszóma fehérjéket az rRNS vázhoz kapcsolták.
Egy teljes eukarióta riboszóma ülepedési együtthatója körülbelül 80 Svedberg-egység (80S), az alrészecskék ülepedési együtthatója pedig 40S és 60S.
A kisebbik 40S alegység egy 18S rRNS molekulából és 30-40 fehérjemolekulából áll. A nagy 60S alegység háromféle rRNS-t tartalmaz, 5S, 5,8S és 28S ülepedési együtthatókkal, valamint 40-50 fehérjét (például a patkány hepatocita riboszómák 49 fehérjét tartalmaznak).
A riboszómák funkcionális régiói
P - peptidil hely a peptidil-tRNS számára
A - aminoacil hely az aminoacil-tRNS számára
E - hely a tRNS felszabadulásához a riboszómából
A riboszóma 2 funkcionális helyet tartalmaz a tRNS-sel való kölcsönhatáshoz: aminoacil (akceptor) és peptidil (donor). Az aminoacil-tRNS belép a riboszóma akceptor helyére, és kölcsönhatásba lépve hidrogénkötéseket hoz létre a kodon és az antikodon hármasok között. A hidrogénkötések kialakulása után a rendszer 1 kodont előrehalad, és a donor helyre kerül. Ezzel egyidejűleg a kiürült akceptor helyen egy új kodon jelenik meg, amelyhez kapcsolódik a megfelelő aminoacil-t-RNS.
Riboszómák: szerkezet, funkció
A riboszómák a fehérje bioszintézis citoplazmatikus központjai. Nagy és kis alegységekből állnak, amelyek ülepedési együtthatóban (centrifugálás közbeni ülepedési sebesség) különböznek, Svedberg - S egységekben kifejezve.
A riboszómák mind az eukarióta, mind a prokarióta sejtekben jelen vannak, mivel fontos szerepet töltenek be fehérje bioszintézis. Minden sejt több tíz, százezer (akár több millió) ilyen kis, lekerekített organellumokat tartalmaz. Ez egy lekerekített ribonukleoprotein részecske. Átmérője 20-30 nm. A riboszóma nagy és kis alegységekből áll, amelyek ülepedési koefficiensükben (süllyedési sebesség centrifugálás közben) különböznek egymástól, Svedberg egységekben kifejezve - S. Ezeket az alegységeket egy m-RNS (mátrix vagy információs RNS) szál jelenlétében kombinálják. Egy riboszómacsoportból álló komplexet, amelyet egyetlen mRNS-molekula egyesít, mint egy gyöngysor, az ún. poliszóma. Ezek a struktúrák vagy szabadon helyezkednek el a citoplazmában, vagy a szemcsés ER membránjaihoz kapcsolódnak (mindkét esetben a fehérjeszintézis aktívan megy végbe rajtuk).
A szemcsés ER poliszómái olyan fehérjéket képeznek, amelyek a sejtből kiválasztódnak és az egész szervezet szükségleteihez felhasználhatók (például emésztőenzimek, emberi anyatej fehérjéi). Emellett a riboszómák a mitokondriális membránok belső felületén is jelen vannak, ahol a fehérjemolekulák szintézisében is aktívan részt vesznek.
A transzfer RNS (tRNS) fontos szerepet játszik abban a folyamatban, hogy a sejt felhasználja az örökletes információkat. A tRNS transzlációs közvetítőként működik, a szükséges aminosavakat a peptidláncok gyülekezési helyére juttatva.
A tRNS-molekulák specifikus DNS-szekvenciákon szintetizált polinukleotid láncok. Viszonylag kis számú nukleotidból állnak -75-95. A tRNS polinukleotid láncának különböző részein elhelyezkedő bázisok komplementer kapcsolódása eredményeként lóherelevélre emlékeztető szerkezetet nyer (3.26. ábra).
Rizs. 3.26. Egy tipikus tRNS-molekula szerkezete.
Négy fő részből áll, amelyek különböző funkciókat látnak el. elfogadó A "szárat" a tRNS két, egymással komplementer módon összekapcsolt terminális része alkotja. Hét bázispárból áll. Ennek a szárnak a 3'-vége valamivel hosszabb, és egyszálú régiót alkot, amely egy szabad OH-csoportot tartalmazó CCA-szekvenciával végződik. Egy szállítható aminosav kapcsolódik ehhez a véghez. A fennmaradó három ág komplementer páros nukleotidszekvenciák, amelyek párosítatlan szakaszokban végződnek, amelyek hurkokat alkotnak. Ezen ágak közepe - antikodon - öt nukleotidpárból áll, és a hurok közepén egy antikodont tartalmaz. Az antikodon három nukleotidból áll, amelyek komplementerek az mRNS kodonnal, amely a tRNS által a peptidszintézis helyére szállított aminosavat kódolja.
Az akceptor és az antikodon ágak között két oldalág található. A hurkokban módosított bázisokat tartalmaznak - dihidrouridint (D-hurok) és a TψC triplettet, ahol \y pszeudouriain (T^C-hurok).
Az aiticodon és a T^C elágazások között van egy további hurok, amely 3-5-13-21 nukleotidot tartalmaz.
Általánosságban elmondható, hogy a tRNS különböző típusait a nukleotidszekvencia bizonyos állandósága jellemzi, amely legtöbbször 76 nukleotidból áll. Számuk eltérése elsősorban a további hurokban lévő nukleotidok számának változásából adódik. A tRNS szerkezetét támogató komplementer régiók általában konzerváltak. A tRNS elsődleges szerkezete, amelyet a nukleotidok sorrendje határoz meg, a tRNS másodlagos szerkezetét alkotja, amely lóhere levél alakú. A másodlagos szerkezet viszont háromdimenziós harmadlagos szerkezetet okoz, amelyet két egymásra merőleges kettős hélix képződése jellemez (3.27. ábra). Az egyiket az akceptor és a TψC ágak, a másikat az antikodon és a D ágak alkotják.
Az egyik kettős hélix végén a szállított aminosav, a másik végén az antikodon található. Ezek a területek vannak a legtávolabb egymástól. A tRNS harmadlagos szerkezetének stabilitását a polinukleotid lánc különböző részein elhelyezkedő, de a tercier szerkezetben térben közeli bázisai között további hidrogénkötések megjelenése tartja fenn.
A különböző típusú tRNS-ek hasonló harmadlagos szerkezettel rendelkeznek, bár bizonyos eltérésekkel.
Rizs. 3.27. A tRNS térbeli szerveződése:
I - a tRNS másodlagos szerkezete "lóherelevél" formájában, amelyet elsődleges szerkezete (a lánc nukleotidjainak szekvenciája) határoz meg;
II - a tRNS harmadlagos szerkezetének kétdimenziós vetülete;
III - a tRNS-molekula elrendezése a térben
FÜGGELÉK (ha valaki nem értené)
Villámfogak - nukleotidok (adenin-timin / uracil /, guanin-citazin). Minden villám DNS.

A DNS-ből való információ átviteléhez 2 szálat kell megtörnie. Az A-T és a G-C közötti kötés hidrogén, ezért a Helicase enzim könnyen felbontja:

A csomók kialakulásának megakadályozása érdekében (Például egy törülközőt csavartam):



A topoizomeráz elvágja a DNS egyik szálát a replikáció origójában, így a lánc nem csavarodik el.

Ha az egyik szál szabadon van, a második könnyen el tud forogni a tengelye körül, ezáltal oldja a feszültséget a "letekercselés" során. A csomópontok nem jelennek meg, energiát takarít meg.
Ezután egy RNS primerre van szükség az RNS gyűjtésének megkezdéséhez. Egy mRNS-t összeállító fehérje nem tudja csak az első nukleotidot összeállítani, az induláshoz kell egy darab RNS (ez ott van részletesen leírva, később kiírom). Ezt a darabot RNS primernek hívják. És ez a fehérje már hozzá is köti az első nukleotidot.


A nukleinsavak szerkezetének leírásánál a makromolekulák különböző szerveződési szintjeit veszik figyelembe: elsődleges és másodlagos szerkezetet.
A nukleinsavak elsődleges szerkezete a nukleotid-összetétel és a polimer láncban a nukleotidegységek bizonyos szekvenciája.
Az RNS másodlagos szerkezete. A ribonukleinsav molekula egyetlen polinukleotid láncból épül fel.
Az RNS másodlagos szerkezete
Az RNS-lánc különálló szakaszai spiralizált hurkokat - "hajtűket" alkotnak a komplementer A-U és G-C nitrogénbázisok közötti hidrogénkötések miatt. Az ilyen spirális struktúrákban az RNS-lánc szakaszai antiparallelek, de nem mindig teljesen komplementerek, párosítatlan nukleotid-maradékokat vagy akár egyszálú hurkokat tartalmaznak, amelyek nem illeszkednek a kettős hélixbe. A spiralizált régiók jelenléte minden RNS-típusra jellemző.
Az RNS fő szerepe a fehérjebioszintézisben való közvetlen részvétel.
A celluláris RNS-nek három típusa ismert, amelyek különböznek egymástól a sejtben elfoglalt helyükben, összetételükben, méretükben és tulajdonságaikban, amelyek meghatározzák a fehérje makromolekulák képződésében betöltött specifikus szerepüket:
- az információs (mátrix) RNS-ek a DNS-ben kódolt információt továbbítják a fehérje szerkezetéről a sejtmagból a riboszómákba, ahol a fehérjeszintézis végbemegy; az összes mRNS elsődleges szerkezete, függetlenül a kódoló szekvenciájuk egyediségétől, az 5'- és 3'-végek szerkezete azonos.
Tehát az 5'-végen van egy módosított nukleotid, a 7-metil-guanozin-5'-trifoszfát (cap). Több tíz nukleotid választja el a sapkát az iniciációs kodontól, általában az -AUG- triplett. A kódoló régiót az -UGA-, -UUA-, -UAG- terminációs kodonok egyike követi. A legtöbb mRNS 3' végén egy 100-200 adenozin-monofoszfát-maradékból álló nukleotidszekvencia található.
- transzfer RNS-ek összegyűjtik az aminosavakat a sejt citoplazmájában, és továbbítják a riboszómába; Az ilyen típusú RNS-molekulák a hírvivő RNS-lánc megfelelő szakaszaiból „megtanulják”, hogy mely aminosavaknak kell részt venniük a fehérjeszintézisben.
Bármely tRNS térbeli szerkezetét, függetlenül a nukleotidszekvencia eltéréseitől, az univerzális lóherelevél modell írja le. Minden tRNS-molekulának vannak olyan láncszakaszok, amelyek nem vesznek részt a nukleotid-maradékok közötti hidrogénkötések kialakításában.
Ezek közé tartozik különösen a molekula 3'-végén lévő aminosavhoz való kötődésért felelős hely és az antikodon, egy specifikus nukleotidhármas, amely komplementeren lép kölcsönhatásba az mRNS kodonnal.
- A riboszómális RNS egy bizonyos szerkezetű fehérjeszintézist biztosít, információolvasást az információs (mátrix) RNS-ből. Az rRNS-ek komplexeket képeznek a riboszómáknak nevezett fehérjékkel.
Minden riboszóma két alegységből áll - kicsi (40S) és nagy (60S). A riboszóma alegységek nemcsak az rRNS-készletben, hanem a fehérjék számában és szerkezetében is különböznek egymástól.
Megjelenés dátuma: 2015-02-03; Olvasás: 2729 | Az oldal szerzői jogainak megsértése

Az RNS egy polimer, amelynek monomerjei ribonukleotidok.
A DNS-től eltérően az RNS-t nem két, hanem egy polinukleotid lánc alkotja (kivétel - egyes RNS-tartalmú vírusok kettős szálú RNS-sel rendelkeznek). Az RNS nukleotidok képesek hidrogénkötéseket kialakítani egymással. Az RNS-láncok sokkal rövidebbek, mint a DNS-láncok.
Az RNS monomer - nukleotid (ribonukleotid) - három anyag maradékaiból áll: 1) nitrogéntartalmú bázis, 2) öt szénatomos monoszacharid (pentóz) és 3) foszforsav. Az RNS nitrogéntartalmú bázisai szintén a pirimidinek és purinok osztályába tartoznak.
Az RNS pirimidin bázisai - uracil, citozin, purin bázisok - adenin és guanin.
31. Az RNS típusai és szerkezetének jellemzői
Az RNS nukleotid monoszacharidot a ribóz képviseli.
Háromféle RNS létezik: 1) információs (mátrix) RNS - mRNS (mRNS), 2) transzfer RNS - tRNS, 3) riboszómális RNS - rRNS.
Az RNS minden típusa el nem ágazó polinukleotid, sajátos térbeli konformációval rendelkezik, és részt vesz a fehérjeszintézis folyamataiban.
Az összes RNS-típus szerkezetére vonatkozó információkat a DNS tárolja. Az RNS-szintézis folyamatát egy DNS-templáton általában transzkripciónak nevezik.

A transzfer RNS-ek általában 76 (75-95) nukleotidot tartalmaznak; molekulatömeg - 25 000-30 000.
A tRNS a sejt teljes RNS-tartalmának körülbelül 10%-át teszi ki. A tRNS funkciói: 1) aminosavak szállítása a fehérjeszintézis helyére, riboszómákba, 2) transzlációs mediátor. Körülbelül 40 fajta tRNS található a sejtben, mindegyiknek csak rá jellemző nukleotidszekvenciája van. Ugyanakkor minden tRNS több intramolekuláris komplementer régióval rendelkezik, amelyeknek köszönhetően a tRNS-ek lóherelevél alakú konformációra tesznek szert.
Bármely tRNS-nek van egy hurok a riboszómával (1), egy antikodon hurok (2), egy hurok az enzimmel (3), egy akceptor szár (4) és egy antikodon (5). Az aminosav az akceptor szár 3' végéhez kapcsolódik. Antikodon - három nukleotid, amely "felismer" egy mRNS kodont.
Hangsúlyozni kell, hogy egy adott tRNS az antikodonjának megfelelő, szigorúan meghatározott aminosavat képes szállítani. Az aminosavak és a tRNS kapcsolatának specifitása az aminoacil-tRNS szintetáz enzim tulajdonságainak köszönhető.
A riboszómális RNS-ek 3000-5000 nukleotidot tartalmaznak; molekulatömeg - 1 000 000-1 500 000.
Az rRNS a sejt teljes RNS-tartalmának 80-85%-át teszi ki. A riboszómális fehérjékkel komplexben az rRNS riboszómákat képez - organellumokat, amelyek fehérjeszintézist hajtanak végre. Az eukarióta sejtekben az rRNS szintézise a sejtmagban megy végbe. Az rRNS funkciói: 1) a riboszómák szükséges szerkezeti alkotóeleme, és ezáltal a riboszómák működésének biztosítása; 2) a riboszóma és a tRNS kölcsönhatásának biztosítása; 3) a riboszóma és az mRNS iniciátor kodon kezdeti kötődése és a leolvasási keret meghatározása, 4) a riboszóma aktív centrumának kialakulása.
A hírvivő RNS-ek nukleotidtartalmukban és molekulatömegükben változatosak (50 000 és 4 000 000 között).
Az mRNS részesedése a sejt teljes RNS-tartalmának legfeljebb 5%-át teszi ki. Az mRNS funkciói: 1) genetikai információ átvitele a DNS-ből a riboszómákba, 2) mátrix egy fehérjemolekula szintéziséhez, 3) a fehérjemolekula elsődleges szerkezetének aminosavszekvenciájának meghatározása.
Olvassa el is
Az RNS egy polimer, amelynek monomerjei nukleotidok.
A három nitrogéntartalmú bázis ugyanaz, mint a DNS-ben (adenin, guanin, citozin); a negyedik - uracil - az RNS-molekulában van jelen a timin helyett. Az RNS-nukleotidok dezoxiribóz helyett ribózt tartalmaznak. Az RNS láncban...
az RNS három fő típusa: információs(mRNS), vagy mátrix(mRNS), riboszómális(rRNS) és szállítás(tRNS). Molekulaméretükben és funkciójukban különböznek egymástól. Minden típusú RNS szintetizálódik a DNS-en enzimek - RNS polimerázok - részvételével. A hírvivő RNS az összes sejt RNS 2-3%-át teszi ki, a riboszómális - 80-85, a transzport - körülbelül 15%-át.
mRNS.
örökletes információt olvas ki egy DNS-szakaszból, és nitrogénbázisok másolt szekvenciája formájában továbbítja a riboszómákba, ahol egy bizonyos fehérje szintetizálódik. Az mRNS-molekulák mindegyike a nukleotidok sorrendjében és méretében megfelel a DNS-ben található génnek, amelyből átírták. Az mRNS átlagosan 1500 nukleotidot (75-3000) tartalmaz. Az mRNS-en minden hármast (három nukleotidot) kodonnak nevezünk. A kodontól függ, hogy egy adott helyen melyik aminosav jelenik meg a fehérjeszintézis során.
(tRNS) viszonylag alacsony molekulatömege, körülbelül 24-29 ezer.
D, és 75-90 nukleotidot tartalmaz a molekulában. Az összes tRNS nukleotid 10%-a kisebb bázis, ami láthatóan megvédi a hidrolitikus enzimek hatásától.A tRNS szerepe az, hogy aminosavakat szállítanak a riboszómákba és részt vesznek a fehérjeszintézis folyamatában. Minden aminosav egy specifikus tRNS-hez kötődik. Számos aminosav egynél több tRNS-t tartalmaz. Eddig több mint 60 tRNS-t fedeztek fel, amelyek primer szerkezetükben (bázisszekvenciájuk) különböznek egymástól.
Az összes tRNS másodlagos szerkezete egy lóherelevél formájában jelenik meg, kétszálú szárral és három egyszálúval). Az egyik lánc végén van egy akceptor hely - a CCA triplett, amelynek adeninéhez egy specifikus aminosav kapcsolódik.
(rRNS). 120-3100 nukleotidot tartalmaznak. A riboszómális RNS a sejtmagban, a sejtmagvakban halmozódik fel.
A riboszómális fehérjék a sejtmagba jutnak a citoplazmából, és ott a fehérjék és a megfelelő rRNS kombinálásával spontán riboszóma-alrészecskék képződnek. A riboszóma részszemcséi együtt vagy külön-külön a magmembrán pórusain keresztül a citoplazmába kerülnek. Riboszómák 20-30 nm méretű organellumok.
Két különböző méretű és formájú részrészecskéből épülnek fel. A sejtben a fehérjeszintézis bizonyos szakaszaiban a riboszómák alrészecskékre oszlanak.
A riboszómális RNS a riboszómák vázaként szolgál, és elősegíti az mRNS kezdeti kötődését a riboszómához a fehérje bioszintézis során.
6. kérdés A DNS és RNS elsődleges és másodlagos szerkezetét alkotó kötések. Az RNS típusai
A genetikai kód a fehérjék aminosav-szekvenciájának kódolása egy olyan nukleotidszekvencia segítségével, amely minden élő szervezetre jellemző.
Tulajdonságok: 1) genetikai kód hármas(minden aminosavat három nukleotid kódol); 2) nem átfedő(a szomszédos hármasoknak nincs közös nukleotidja); 3) elfajzott(a metionin és a triptofán kivételével minden aminosavnak több kodonja van); 4) egyetemes(többnyire minden élő szervezetre ugyanaz); 5) egy aminosav kodonjaiban az első két nukleotid általában azonos, a harmadik pedig változó; 6) lineáris olvasási sorrendje van, és az jellemzi egyvonalasság, t.
e) az mRNS-ben lévő kodonok sorrendjének egybeesése a szintetizált polipeptidláncban lévő aminosavak sorrendjével.
Megjelenés dátuma: 2014-12-08; Olvasás: 11268 | Az oldal szerzői jogainak megsértése
studopedia.org - Studopedia.Org - 2014-2018. (0,001 s) ...
A sejtek citoplazmája az RNS három fő funkcionális típusát tartalmazza:
- hírvivő RNS (mRNS), amely templátként működik a fehérjeszintézisben;
- riboszomális RNS (rRNS), amely a riboszómák szerkezeti komponenseként működik;
- az mRNS információ transzlációjában (transzlációjában) részt vevő RNS-eket (tRNS-eket) egy fehérjemolekula aminosavszekvenciájába szállítják.
A sejtmagban nukleáris RNS található, amely a teljes sejt RNS 4-10%-át teszi ki.
A nukleáris RNS nagy részét a riboszómális és transzfer RNS nagy molekulájú prekurzorai képviselik. A nagy molekulatömegű rRNS-ek (28S, 18S és 5S RNS) prekurzorai főként a sejtmagban lokalizálódnak.
Az RNS a fő genetikai anyag egyes állati és növényi vírusokban (genomiális RNS). A legtöbb RNS-vírust RNS-genomjuk reverz transzkripciója jellemzi, amelyet reverz transzkriptáz irányít.
Minden ribonukleinsav ribonukleotidok polimerje, amelyek DNS-molekulához hasonlóan 3′,5′-foszfor-diészter kötésekkel kapcsolódnak egymáshoz.
A kétszálú DNS-sel ellentétben az RNS egyszálú lineáris polimer molekula.
mRNS szerkezete. Az mRNS az RNS legheterogénebb osztálya méretét és stabilitását tekintve.
tRNS szerkezete.
A transzfer RNS-ek mediátorként (adapterként) működnek az mRNS transzlációja során. A teljes sejt RNS körülbelül 15%-át teszik ki. A 20 proteinogén aminosav mindegyikének megvan a maga tRNS-e. Néhány, két vagy több kodon által kódolt aminosavhoz több tRNS is létezik.
A tRNS-ek viszonylag kicsi, egyszálú molekulák, amelyek 70-93 nukleotidból állnak. Molekulatömegük (2,4-3,1) ,104 kDa.
A tRNS másodlagos szerkezete az intramolekuláris komplementer nitrogénbázispárok közötti maximális számú hidrogénkötés kialakulása miatt jön létre.
Ezen kötések kialakulása következtében a tRNS polinukleotid lánc elcsavarodik, és spirális elágazások képződnek, amelyek párosítatlan nukleotid hurkokban végződnek. Az összes tRNS másodlagos szerkezetének térbeli képe lóhere alakú.
A "lóherelevélben" négy kötelező ágat különböztetnek meg, a hosszabb tRNS-ek emellett egy rövid ötödik (további) ágat is tartalmaznak.
A tRNS adapter funkcióját egy akceptor ág biztosítja, melynek 3'-végéhez éterkötéssel egy aminosav kapcsolódik, és az akceptor ággal szemben egy antikodon ág, melynek tetején egy hurok található egy antikodon.
Az antikodon egy specifikus nukleotidhármas, amely antiparallel irányban komplementer a megfelelő aminosavat kódoló mRNS kodonnal.
A pszeudouridin hurkot (TyC-hurkot) hordozó T-ág biztosítja a tRNS és a riboszómák kölcsönhatását.
A dehidrouridin hurkot hordozó D-ág biztosítja a tRNS kölcsönhatását a megfelelő aminoacil-tRNS szintetázzal.

A tRNS másodlagos szerkezete
Az ötödik további ág funkciói még mindig kevéssé ismertek, valószínűleg kiegyenlíti a különböző tRNS-molekulák hosszát.
A tRNS harmadlagos szerkezete nagyon kompakt, és a lóhere levél egyes ágainak összehozásával jön létre a további hidrogénkötések következtében, és így L-alakú "könyökhajlat" képződik.
A transzport RNS, szerkezete és működési mechanizmusa.
Ebben az esetben az aminosavat megkötő akceptor kar a molekula egyik végén, az antikodon pedig a másik végén található.

A tRNS harmadlagos szerkezete (A.S. Spirin szerint)
Az rRNS és a riboszómák szerkezete. A riboszómális RNS-ek alkotják a gerincet, amelyhez specifikus fehérjék kötődnek, és riboszómákat alkotnak. A riboszómák olyan nukleoprotein organellumok, amelyek fehérjeszintézist biztosítanak az mRNS-ből.
A riboszómák száma egy sejtben nagyon nagy: a prokariótákban található 104-től az eukariótákban lévő 106-ig. A riboszómák elsősorban a citoplazmában, az eukariótákban, ezen kívül a sejtmagban, a mitokondriális mátrixban és a kloroplasztiszok strómájában találhatók. A riboszómák két részrészecskéből állnak: nagy és kicsi. Méret és molekulatömeg szerint az összes vizsgált riboszómát 3 csoportra osztják - prokarióták 70S riboszómái (S-ülepedési együttható), amelyek kis 30S és nagy 50S szubrészecskékből állnak; 80S eukarióta riboszómák, amelyek 40S kis és 60S nagy alegységből állnak.
A 80S riboszómák kis alegységét egy rRNS molekula (18S) és 33 különböző fehérje molekula alkotja.
A nagy alegységet három rRNS-molekula (5S, 5,8S és 28S) és körülbelül 50 fehérje alkotja.
Az rRNS másodlagos szerkezetét a molekula rövid kétszálú szakaszai - hajtűk (az rRNS körülbelül 2/3-a), 1/3-a - purin nukleotidokban gazdag egyszálú szakaszok képviselik.
Közösségi gombok a Joomla számára
A fehérjék képezik az élet alapját. Funkcióik a sejtben nagyon változatosak. A fehérjék azonban „nem tudnak” szaporodni. És a fehérjék szerkezetére vonatkozó összes információt a gének (DNS) tartalmazzák.
A magasabb rendű szervezetekben a fehérjék a sejt citoplazmájában szintetizálódnak, a DNS pedig a sejtmag héja mögött rejtőzik. Ezért a DNS közvetlenül nem szolgálhat templátként a fehérjeszintézishez. Ezt a szerepet egy másik nukleinsav - az RNS - látja el.
Az RNS-molekula egy tercier szerkezetű, el nem ágazó polinukleotid.
Egy polinukleotid lánc alkotja, és bár a benne található komplementer nukleotidok is képesek hidrogénkötést kialakítani egymás között, ezek a kötések egy lánc nukleotidjai között jönnek létre. Az RNS-láncok sokkal rövidebbek, mint a DNS-láncok. Ha egy sejt DNS-tartalma viszonylag állandó, akkor az RNS-tartalom nagymértékben ingadozik. A sejtekben a legnagyobb mennyiségű RNS a fehérjeszintézis során figyelhető meg.
Az RNS fontos szerepet játszik az örökletes információk továbbításában és megvalósításában.
A funkciójuknak és szerkezeti jellemzőknek megfelelően a sejtes RNS-nek több osztályát különböztetjük meg.
A sejtes RNS-nek három fő osztálya van.
- Információs (mRNS), vagy mátrix (mRNS). Molekulái méretüket, molekulatömegüket (0,05x106-tól 4x106-ig) és stabilitásukat tekintve a legváltozatosabbak.
A sejtben lévő RNS teljes mennyiségének körülbelül 2%-át teszik ki. Minden mRNS genetikai információ hordozója a sejtmagtól a citoplazmáig, a fehérjeszintézis helyéig. Mátrixként (munkarajzként) szolgálnak egy fehérjemolekula szintéziséhez, mivel meghatározzák a fehérjemolekula aminosavszekvenciáját (elsődleges szerkezetét).

- Riboszomális RNS (rRNS).
A sejt teljes RNS-tartalmának 80-85%-át teszik ki.
31. Az RNS szerkezete. RNS típusok, szerkezeti jellemzők és funkciók. A tRNS másodlagos szerkezete
A riboszómális RNS 3-5 ezer nukleotidból áll. A sejtmag magjaiban szintetizálódik. A riboszómális fehérjékkel komplexben az rRNS riboszómákat képez - organellumokat, amelyeken fehérjemolekulák állnak össze. Az rRNS fő jelentősége, hogy biztosítja az mRNS és riboszóma kezdeti kötődését, és a riboszóma aktív centrumát képezi, amelyben a polipeptidlánc szintézise során aminosavak között peptidkötések jönnek létre.
- Transzfer RNS-ek (tRNS-ek).
A tRNS-molekulák általában 75-86 nukleotidot tartalmaznak. A tRNS molekulák molekulatömege körülbelül 25 ezer A tRNS molekulák a fehérjebioszintézis közvetítői szerepét töltik be - aminosavakat szállítanak a fehérjeszintézis helyére, vagyis a riboszómákba. A sejt több mint 30 típusú tRNS-t tartalmaz. A tRNS minden típusának egyedi nukleotidszekvenciája van.
Mindazonáltal minden molekulának több intramolekuláris komplementer régiója van, amelyek jelenléte miatt minden tRNS harmadlagos szerkezetű, amely alakjában egy lóherelevélre emlékeztet.
Az RNS másodlagos szerkezete- a tRNS-re jellemző, egyszálú, "lóherelevél" alakú.
Magába foglalja:
- viszonylag rövid kettős spirálok - szárak,
- egyszálú szakaszok - hurkok.
4 szár van (akceptor, antikodon, dihidrouridil, pszeudouridil) és 3 hurok.

"Stem-loop" - sematikusan az RNS másodlagos szerkezetének eleme

"Pseudoknot" - sematikusan az RNS másodlagos szerkezetének eleme

Az akceptor szár tartalmazza a polinukleotid lánc 3'- és 5'-végét, az 5'-vég egy guanilsav-maradékot, a 3'-vég egy CCA triplett, és az AA-val észterkötés kialakítására szolgál.
Az antikodon törzs a komplementaritás elve alapján ismeri fel kodonját a riboszómák mRNS-én.
A pszeudouridil szár a riboszómához való kapcsolódásra szolgál.
A dihidrouridil szár az aminoacil-tRNS szintetázhoz való kötődésre szolgál.
Közösségi gombok a Joomla számára





