Opće karakteristike elemenata skupine V-A. P-elementi skupine V Najveća valencija elemenata skupine 5 glavne podskupine
Sličnosti elemenata:
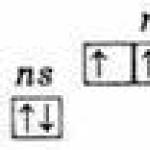
Identična struktura vanjskog elektronskog sloja atoma ns 2 np 3;
P-elementi;
Više selo O. jednako +5;
Donji s. O. jednako -3 (nekarakteristično za Sb i Bi).
Za elemente glavne podskupine skupine V ponekad se koristi naziv skupine "pniktogeni", uveden analogno s pojmovima "halogeni" i "halkogeni" i izveden iz simbola elemenata fosfora P i dušika N.
Valentna stanja atoma
Za atome P, As, Sb, Bi moguća su 2 valentna stanja:
Osnovni ns 2 np 3
Napaljeni ns 1 np 3. 1
Razlika između dušika i ostalih elemenata podskupine
1. Zbog nepostojanja d-orbitala u vanjskom elektroničkom sloju u atomu dušika, broj kovalentnih veza koje tvori atom dušika prema mehanizmu izmjene ne može biti veći od 3.
2. Prisutnost usamljenog elektronskog para na podrazini 2s dušikovog atoma omogućuje stvaranje kovalentne veze putem donor-akceptorskog mehanizma. Dakle, najviša valencija N je IV.
3. U spojevima s kisikom dušik ima oksidacijska stanja +1, +2, +3, +4, +5.
Vertikalna promjena svojstava elemenata i tvari koje tvore
Za razliku od halogena i halkogena, u glavnoj podskupini V skupine dolazi do dramatičnije promjene u svojstvima elemenata i jednostavnih tvari koje tvore kako se povećava naboj jezgre i radijus atoma:
Vertikalna promjena svojstava elemenata i jednostavnih tvari koje tvore |
|||||
nemetali |
metal s nekim znacima nemetaličnosti |
||||
Oksidi i hidroksidi |
Dušik i njegovi kisikovi spojevi razmatraju se zasebno zbog niza razlika. |
||||
E 2 O 3 i odgovarajući hidroksidi |
P 2 O 3 (P 4 O 6) kiselinski oksid |
Kao 2 O 3 kiseli oksid sa znakovima amfoternosti |
Sb 2 O 3 amfoterni oksid |
Bi 2 O 3 bazični oksid |
|
E 2 O 5 i odgovarajući hidroksidi |
P 2 O 5 (P 4 O 10) kiselinski oksid |
Kao 2 O 5 kiselinski oksid |
Sb 2 O 5 kiselinski oksid |
Bi 2 O 5 amfoteran lomljiv |
|
HPO 3 (H 3 PO 4) |
|||||
slabe kiseline |
|||||
Svojstva kiseline slabe |
|||||
Osnovna svojstva su poboljšana |
|||||
Vodikovi spojevi EN 3
Elementi glavne podskupine V. skupine tvore s vodikom hlapljive spojeve koji su otrovni plinovi karakterističnog mirisa. Oni su jaki redukcijski agensi. Za razliku od vodikovih spojeva nemetala VII i VI skupine, oni ne tvore H + ione u vodenim otopinama, tj. ne pokazuju kisela svojstva.
OPĆE KARAKTERISTIKE 5. SKUPINE ELEMENATA.
Glavna podskupina V 0 01 F periodnog sustava uključuje dušik, fosfor, arsen, antimon i bizmut. Ovi elementi, koji imaju pet elektrona u vanjskom sloju atoma, karakterizirani su općenito
poput nemetala. Međutim, njihova sposobnost dodavanja elektrona mnogo je manje izražena nego kod odgovarajućih elemenata VI i VII skupine. Zbog prisutnosti pet vanjskih elektrona, najveća pozitivna oksidacija elemenata ove podskupine je -5, a negativna - 3. Zbog relativno manje elektronegativnosti, veza dotičnih elemenata s vodikom je manje polarna od vezu s vodikom elemenata VI i VII skupine. Stoga vodikovi spojevi ovih elemenata ne eliminiraju vodikove ione H u vodenoj otopini, pa stoga nemaju kisela svojstva. Fizikalna i kemijska svojstva elemenata dušikove podskupine mijenjaju se s
0 0 1 Finpovećanje serijskog broja u istom nizu koji je promatran u
0 0 1 Za prethodno razmatrane skupine, Ali budući da su nemetalna svojstva izražena u
slabiji od kisika i posebno fluora, onda slabljenje tih svojstava pri prijelazu u 0 0 1 F sljedećih elemenata povlači za sobom pojavu i povećanje metalnih svojstava.
Potonji su primjetni već kod arsena, antimon ima oba svojstva približno jednako, a kod bizmuta metalna svojstva prevladavaju nad nemetalnima. OPIS ELEMENATA. DUŠIK(od grč. ázōos - beživotan, lat. Nitrogenium), N, kemijski element V
skupine periodnog sustava Mendeljejeva, atomski broj 7, atomska masa 14,0067; plin bez boje, mirisa i okusa. Povijesna referenca. Dušikovi spojevi - salitra, dušična kiselina, amonijak - bili su
poznat davno prije proizvodnje dušika u slobodnom stanju. Godine 1772. D. Rutherford, spaljivanjem fosfora i drugih tvari u staklenom zvonu, pokazao je da plin koji ostaje nakon izgaranja, a koji je nazvao "zagušljivi zrak", ne podržava disanje i izgaranje. Godine 1787. A. Lavoisier je utvrdio da su "životni" i "zagušljivi" plinovi koji čine zrak jednostavne tvari i predložio naziv "dušik". Godine 1784. G. Cavendish je pokazao da je dušik dio salitre; Odatle potječe latinski naziv dušik (od kasnolatinskog nitrum - salitra i grčkog gennao - rađam, proizvodim), koji je 1790. predložio J. A. Chaptal. Do početka 19.st. Razjašnjena je kemijska inertnost dušika u slobodnom stanju i njegova isključiva uloga u spojevima s drugim elementima kao vezanog dušika. Od tada je "vezivanje" dušika iz zraka postalo jedan od najvažnijih tehničkih problema kemije. Rasprostranjenost u prirodi. Dušik je jedan od najčešćih elemenata na
Zemlja i njezina većina (oko 4´1015 T) koncentriran je u slobodnom stanju u atmosferi. U zraku slobodni dušik (u obliku molekula N2) iznosi 78,09% volumena (ili 75,6% mase), ne računajući njegove manje nečistoće u obliku amonijaka i oksida. Prosječni sadržaj dušika u litosferi je 1,9´10-3% po masi. Prirodni dušikovi spojevi. - amonijev klorid NH4Cl i razni nitrati (vidi.
Salitra.) Velike nakupine salitre karakteristične su za suhu pustinjsku klimu (Čile, središnja Azija). Dugo je vremena nitrat bio glavni dobavljač dušika za industriju (sada je industrijska sinteza amonijaka iz dušika i vodika iz zraka od primarne važnosti za fiksaciju dušika). Male količine vezanog dušika nalaze se u ugljenu (1-2,5%) i nafti (0,02-1,5%), kao iu vodama rijeka, mora i oceana. Dušik se nakuplja u tlu (0,1%) iu živim organizmima (0,3%).
Iako naziv "dušik" znači "neodržavajući život", on je zapravo bitan element za život. Životinjske i ljudske bjelančevine sadrže 16 - 17% dušika. U organizmima životinja mesoždera proteini nastaju zahvaljujući utrošenim proteinskim tvarima prisutnim u organizmima biljojeda iu biljkama. Biljke sintetiziraju proteine asimilacijom dušikovih tvari sadržanih u tlu, uglavnom anorganskih. Značajne količine dušika ulaze u tlo zahvaljujući mikroorganizmima koji fiksiraju dušik i sposobni su pretvoriti slobodni dušik iz zraka u dušikove spojeve. U prirodi se odvija kruženje dušika u kojem glavnu ulogu ima
mikroorganizmi - nitrofirajući, denitrofirajući, fiksirajući dušik, itd. Međutim, kao rezultat ekstrakcije velikih količina fiksnog dušika iz tla od strane biljaka (osobito kod intenzivne poljoprivrede), tla postaju osiromašena dušikom. Nedostatak dušika tipičan je za poljoprivredu u gotovo svim zemljama; nedostatak dušika također je uočen u stočarstvu ("proteinsko gladovanje"). Na tlima siromašnim dostupnim dušikom biljke se slabo razvijaju. Dušična gnojiva i proteinska hranidba životinja najvažnija su sredstva za poticanje poljoprivrede. Ljudske gospodarske aktivnosti ometaju ciklus dušika. Tako izgaranje goriva obogaćuje atmosferu dušikom, a tvornice za proizvodnju gnojiva vežu dušik iz zraka. Prijevoz gnojiva i poljoprivrednih proizvoda redistribuira dušik na površinu zemlje. Dušik je četvrti najzastupljeniji element u Sunčevom sustavu (nakon vodika,
helij i kisik). Izotopi, atom, molekula. Prirodni dušik sastoji se od dva stabilna izotopa: 14N
(99,635%) i 15N (0,365%). Izotop 15N koristi se u kemijskim i biokemijskim istraživanjima kao označeni atom. Od umjetnih radioaktivnih izotopa dušika, 13N ima najdulje vrijeme poluraspada (T1/2 - 10,08 min), ostali su vrlo kratkotrajni. U gornjim slojevima atmosfere, pod utjecajem neutrona iz kozmičkog zračenja, 14N prelazi u radioaktivni izotop ugljika 14C. Ovaj se proces također koristi u nuklearnim reakcijama za proizvodnju 14C. Vanjska elektronska ljuska atoma dušika. sastoji se od 5 elektrona (jedan usamljeni par i tri nesparena - konfiguracija 2 s 22str 3). Najčešće dušik. u spojevima je 3-kovalentan zbog nesparenih elektrona (kao u amonijaku NH3). Prisutnost usamljenog para elektrona može dovesti do stvaranja druge kovalentne veze, a dušik postaje 4-kovalentan (kao u amonijevom ionu NH4+). Oksidacijska stanja dušika variraju od +5 (u N205) do -3 (u NH3). U normalnim uvjetima, u slobodnom stanju, dušik tvori molekulu N2, gdje su atomi N povezani trima kovalentnim vezama. Molekula dušika vrlo je stabilna: energija njezine disocijacije na atome iznosi 942,9 kJ/mol (225,2 kcal/mol), dakle čak i sa t oko 3300°C stupanj disocijacije dušika. je samo oko 0,1%. Fizička i kemijska svojstva. Dušik je nešto lakši od zraka; gustoća 1.2506 kg/
m3(na 0°C i 101325 n/m2 ili 760 mmHg Umjetnost.), tpl-209,86°C, prokuhati-195,8°C. A. se teško ukapljuje: kritična temperatura mu je prilično niska (-147,1 °C), a kritični tlak visok 3,39 Mn/m2 (34,6 kgf/cm2); gustoća tekućeg dušika 808 kg (m3. Dušik je manje topljiv u vodi od kisika: na 0°C u 1 m3 H2O se otapa 23.3 G dušik. Dušik je topljiviji u nekim ugljikovodicima nego u vodi. Samo s aktivnim metalima kao što su litij, kalcij, magnezij, dušik
interagira kada se zagrije na relativno niske temperature. Dušik reagira s većinom drugih elemenata na visokim temperaturama iu prisutnosti katalizatora. Spojevi dušika s kisikom N2O, NO, N2O3, NO2 i N2O5 dobro su proučeni. Iz njih, tijekom izravne interakcije elemenata (4000°C), nastaje NO oksid, koji se hlađenjem lako dalje oksidira u NO2 dioksid. U zraku se tijekom atmosferskih pražnjenja stvaraju dušikovi oksidi. Mogu se dobiti i izlaganjem smjese dušika i kisika ionizirajućem zračenju. Kada dušični N2O3 i
Dušikovi anhidridi N2O5 proizvode dušikastu kiselinu HNO2 i dušičnu kiselinu HNO3, tvoreći soli - nitrite i nitrate. Dušik se spaja s vodikom tek pri visokim temperaturama i u prisutnosti katalizatora te nastaje amonijak NH3. Osim amonijaka, poznati su i brojni drugi spojevi dušika s vodikom, npr. hidrazin H2N-NH2, diimid HN-NH, dušična kiselina HN3(H-N-NºN), oktazon N8H14 itd.; Većina spojeva dušika i vodika izolirana je samo u obliku organskih derivata. Dušik ne stupa u izravnu interakciju s halogenima, stoga se svi dušikovi halogenidi dobivaju samo neizravno, na primjer, dušikov fluorid NF3- kada fluor reagira s amonijakom. Dušikovi halogenidi u pravilu su nisko stabilni spojevi (iznimka je NF3); Dušikovi oksihalidi su stabilniji - NOF, NOCI, NOBr, N02F i NO2CI. Također ne postoji izravna kombinacija dušika sa sumporom; dušični sumpor N4S4 dobiva se kao rezultat reakcije tekućeg sumpora s amonijakom. Kada vrući koks reagira s dušikom, nastaje cijanogen (CN).;. Zagrijavanjem dušika s acetilenom C2H2 na 1500°C može se dobiti cijanovodik HCN. Međudjelovanje dušika s metalima pri visokim temperaturama dovodi do stvaranja nitrida (na primjer, Mg3N2). Kada se obični dušik izloži električnom pražnjenju [tlak 130 - 270 n/m2(1- 2
mmHg)] ili pri razgradnji B, Ti, Mg i Ca nitrida, kao i pri električnim pražnjenjima u zraku, može nastati aktivni dušik, koji je mješavina molekula i atoma dušika s povećanom rezervom energije. Za razliku od molekularnog dušika, aktivni dušik vrlo energično međudjeluje s kisikom, vodikom, parama sumpora, fosforom i nekim metalima. Dušik je dio mnogih važnih organskih spojeva (amini,
aminokiseline, nitro spojevi itd.). Prijem i prijava. U laboratoriju se dušik može lako dobiti
zagrijavanje koncentrirane otopine amonijevog nitrita: NH4NO2 - N2 + 2H2O. Tehnička metoda za proizvodnju dušika temelji se na odvajanju prethodno ukapljenog zraka, koji se zatim podvrgava destilaciji. Glavnina ekstrahiranog slobodnog dušika koristi se za industriju
proizvodnja amonijaka, koji se zatim u značajnim količinama prerađuje u dušičnu kiselinu, gnojiva, eksplozive itd. Uz izravnu sintezu amonijaka iz elemenata, 1905. godine razvila se i cijanamidna metoda, koja se temeljila na činjenici da se na 1000 °C karbid kalcija razvija u 1905. godini. (dobiven zagrijavanjem smjese vapna i ugljena u električnoj peći) reagira sa slobodnim dušikom: CaC2 + N2 = CaCN2 + C. Nastali kalcijev cijanamid razgrađuje se pod djelovanjem pregrijane vodene pare, pri čemu se oslobađa amonijak:
CaCN+3H2O=CaCO3+2NH3.
Slobodni dušik se koristi u mnogim industrijama: kao inertni medij u raznim kemijskim i metalurškim procesima, za popunjavanje slobodnog prostora u živinim termometrima, pri pumpanju zapaljivih tekućina itd. Tekući dušik se koristi u raznim rashladnim uređajima. Pohranjuje se i transportira u čeličnim Dewarovim posudama, plinoviti dušik u komprimiranom obliku - u cilindrima. Mnogi dušikovi spojevi naširoko se koriste; proizvodnja vezanog dušika počela se brzo razvijati nakon 1. svjetskog rata i sada je dosegla goleme razmjere.
Fosfor(lat. Phosphorus), P, kemijski element V skupine periodnog sustava Mendeljejeva, atomski broj 15, atomska masa 30,97376, nemetal. Prirodni fosfor sastoji se od jednog stabilnog izotopa, 31P; dobiveno je šest umjetnih radioaktivnih izotopa: 28P ( T1/2 - 6,27 sek), 29P ( T1/2 - 4,45 sek); 30P ( T1/2 - 2,55 min), 31P ( T1/2
14,22 dana), 32P ( T1/2 - 25 dana), 33P ( T1/2 - 12,5 sek). 32P ima najveću vrijednost , koji posjeduje značajnu energiju b-zračenja i koristi se u kemijskim i biokemijskim istraživanjima kao označeni atom. Povijesna referenca. Prema nekim literaturnim podacima način dobivanja
Fosfor je bio poznat već Arapima. alkemičari 12. stoljeća. Ali općeprihvaćenim datumom otkrića fosfora smatra se 1669. godina, kada je H. Brand (Njemačka), kalciniranjem suhog ostatka od isparavanja urina s pijeskom i naknadnom destilacijom bez pristupa zraka, dobio tvar koja svijetli u tamna, prvo nazvana “hladna vatra”, a kasnije fosfor od grč. fosfor - svjetleći. Ubrzo mu je postao poznat način dobivanja fosfora. kemičari - I. Kraft, I. Kunkel; 1682. ova je metoda objavljena. Godine 1743. A. S. Marggraf razvio je sljedeću metodu za proizvodnju fosfora: smjesa olovnog klorida i urina isparena je do suhog i zagrijavana dok nije prestalo oslobađanje hlapljivih proizvoda; ostatak je pomiješan s ugljenom u prahu i destiliran u glinenoj retorti; Pare fosfora kondenzirane su u prijemniku s vodom. Najjednostavniju metodu dobivanja fosfora kalciniranjem koštanog pepela s ugljenom predložio je tek 1771. K. Scheele. Elementarnu prirodu fosfora utvrdio je A. Lavoisier. U 2. polovici 19.st. nastala je industrijska proizvodnja fosfora iz fosforita u retortnim pećima; početkom 20. stoljeća. zamijenile su ih električne pećnice. Rasprostranjenost u prirodi. Prosječni sadržaj fosfora u zemljinoj kori (klark) -
9,3×10-2% težinski; u srednjim stijenama 1,6×10-1, u bazičnim stijenama 1,4×10-1, manje u granitima i drugim kiselim magmatskim stijenama - 7×10-2 i još manje u ultrabazičnim stijenama (plašt) - 1,7×10-2% ; u sedimentnim stijenama od 1,7×10-2 (pješčenjaci) do 4×10-2% (karbonatne stijene). Fosfor sudjeluje u magmatskim procesima i snažno migrira u biosferi. Oba procesa povezana su s njegovim velikim akumulacijama, tvoreći industrijske naslage apatita i fosforita . Fosfor je izuzetno važan biogeni element; akumuliraju ga mnogi organizmi. Mnogi procesi koncentracije fosfora u zemljinoj kori povezani su s biogenim migracijama. Fosfor se lako taloži iz vode u obliku netopljivih minerala ili ga hvata živa tvar. Stoga morska voda sadrži samo 7 × 10-6% fosfora. Poznato je oko 180 minerala fosfora, uglavnom raznih fosfata, od kojih su najčešći kalcijevi fosfati . Fizička svojstva. Elementarni fosfor postoji u obliku nekoliko
alotropske modifikacije, od kojih su glavne bijele, crvene i crne. Bijeli fosfor je voskasta, prozirna tvar karakterističnog mirisa, koja nastaje kondenzacijom para fosfora. Bijeli fosfor u prisutnosti nečistoća - tragovi crvenog fosfora, arsena, željeza itd. - obojeno žuto, dakle komercijalno bijeli fosfor. zove žuti. Postoje dva oblika bijelog fosfora: a- i b-oblik. a- modifikacija predstavlja kristale kubnog sustava ( A- 18,5); gustoća 1.828 g/cm3, t pl 44,1 °C, t kip 280,5 °C, toplina taljenja 2,5 kJ/mol P4 (0,6 kcal/mol P4), toplina isparavanja 58,6 kJ/mol P4(14.0 kcal/mol P4) , tlak pare na 25 °C 5.7 n/m2 (0,043 mmHg Umjetnost.). Koeficijent linearne ekspanzije u temperaturnom području od 0 do 44 °C je 12,4 × 10-4 , toplinska vodljivost 0,56 uto/(m×K) na 25 °C. Električna svojstva bijelog fosfora. blizu dielektrika: zabranjeni pojas oko 2,1 ev, električni otpor 1,54×1011 ohm× cm, dijamagnetski, specifična magnetska osjetljivost - 0,86×10-6. Tvrdoća po Brinellu 6 Mn/m2 (0,6 kgf/mm2). A-oblik bijelog fosfora dobro se otapa u ugljičnom disulfidu, slabije u tekućem amonijaku, benzenu, ugljikovom tetrakloridu itd. Pri - 76,9 °C i tlaku od 0,1 Mn/m2(1kgf/cm2) a-forma prelazi u niskotemperaturnu b-formu (gustoća 1,88 g/cm3). Uz porast tlaka na 1200 Mn/m2(12 tisuća kgf/cm2) prijelaz se događa na 64,5 °C. b-forma - kristali s dvolomom, struktura im nije definitivno utvrđena. Bijeli fosfor je otrovan: u zraku na temperaturi oko 40 °C
samozapaljiv, stoga ga treba čuvati pod vodom (topljivost u vodi na 25 °C 3,3 × 10-4%) . Višesatnim zagrijavanjem bijelog fosfora bez pristupa zraka na 250-300 °C dobiva se crveni fosfor. Prijelaz je egzoterman, ubrzan ultraljubičastim zrakama, kao i nečistoćama (jod, natrij, selen). Obični komercijalni crveni fosfor je gotovo potpuno amorfan; ima boju od tamno smeđe do ljubičaste. Duljim zagrijavanjem može nepovratno prijeći u jedan od kristalnih oblika (triklinski, kubični itd.) s različitim svojstvima: gustoća od 2,0 do 2,4 g/cm 3, t pl od 585 do 610 °C pri tlaku od nekoliko desetaka atmosfera, temperatura sublimacije od 416 do 423 °C, električni otpor od 109 do 1014 ohm× cm. Crveni fosfor se ne pali spontano na zraku; do temperature 240-250 °C, ali se samozapaljuje pri trenju ili udaru; netopljiv u vodi, kao i u benzenu, ugljikovom disulfidu itd., topiv u fosfornom tribromidu. Na temperaturi sublimacije, crveni fosfor prelazi u paru, nakon hlađenja koja proizvodi uglavnom bijeli fosfor. Kada se bijeli fosfor zagrije na 200-220 °C pod tlakom (1,2-1,7) × 103 Mn/m 2
[(12-17)×103 kgf/cm 2] nastaje crni fosfor. Ova se transformacija može provesti bez pritiska, ali u prisutnosti žive i male količine kristala crnog fosfora (zasječka) na 370 °C tijekom 8 dana Crni fosfor je kristal ortorombske strukture ( A -3,31 , b - 4,38 , S-10.50), rešetka je građena od vlaknastih slojeva s karakterističnim fosforom. piramidalni raspored atoma, gustoća 2,69 g/cm3, t pl oko 1000 °C pod tlakom 1,8×103 Mn/m2(18×103 kgf/cm2). Izgledom je crni fosfor sličan grafitu; poluvodič: razmak između pojaseva 0,33 ev na 25 °C; ima specifični električni otpor od 1,5 ohm× cm, temperaturni koeficijent električnog otpora je 0,0077, dijamagnetski, specifična magnetska osjetljivost je 0,27×10-6. Zagrijavanjem na 560-580 °C pod pritiskom vlastitih para prelazi u crveni fosfor. Crni fosfor je nisko aktivan i teško se zapali kada se zapali, pa se može sigurno prerađivati na zraku. Atomski polumjer fosfora je 1,34, ionski radijus: P5 + 0,35, P3 + 0,44, P3- 1,86.
Atomi fosfora spajaju se u dvoatomne (P2), tetraatomne (P4) i polimerne molekule. Najstabilnije polimerne molekule u normalnim uvjetima su one koje sadrže duge lance međusobno povezanih P4 tetraedara. U tekućini, krutom stanju (bijeli fosfor) i pari ispod 800 °C, fosfor se sastoji od molekula P4. Na temperaturama iznad 800 °C, molekule P4 disociraju u P2 , koji se pak na temperaturama iznad 2000 °C raspadaju na atome. Samo se bijeli fosfor sastoji od molekula P4, sve ostale modifikacije su polimeri. Kemijska svojstva. Konfiguracija vanjskih elektrona atoma fosfora 3 s2 3p3, V
spojeva, najkarakterističnija oksidacijska stanja su + 5, + 3 i - 3. Kao i dušik, fosfor je u spojevima uglavnom kovalentan. Postoji vrlo malo ionskih spojeva poput fosfida Na3P i Ca3P2. Za razliku od dušika, fosfor ima slobodni 3 d- orbitale s prilično niskim energijama, što dovodi do mogućnosti povećanja koordinacijskog broja i stvaranja donor-akceptorskih veza. Fosfor je kemijski aktivan, najveću aktivnost ima bijeli fosfor;
crveni i crni fosfor mnogo su pasivniji u kemijskim reakcijama. Oksidacija bijelog fosfora odvija se mehanizmom lančane reakcije. Oksidaciju fosfora obično prati kemiluminiscencija. Kada fosfor izgara u višku kisika, nastaje pentoksid P4O10 (ili P2O5) kada postoji nedostatak, uglavnom trioksid P4O6 (ili P2O3). Spektroskopski je dokazano postojanje P4O7, P4O8 u parama , P2O6, PO i drugi fosforni oksidi. Fosforov pentoksid se proizvodi u industrijskim razmjerima spaljivanjem elementarnog fosfora u suvišnom suhom zraku. Naknadna hidratacija P4O10 dovodi do proizvodnje orto-(H3PO4) i poli-(H n+2 P n O3 P+ 1) fosforne kiseline. Osim
Osim toga, fosfor tvori fosfornu kiselinu H3PO3, fosfornu kiselinu H4P2O6 i hipofosfornu kiselinu H3PO2, kao i perkiseline: perfosfornu kiselinu H4P2O8 i monoperfosfornu kiselinu H3PO5. Soli fosforne kiseline (fosfati) imaju široku primjenu , u manjoj mjeri - fosfiti i hipofosfiti. Fosfor se spaja izravno sa svim halogenima i oslobađa veliku količinu
količina topline i stvaranje trihalogenida (PX3, gdje je X halogen), pentahalogenida (PX5) i oksihalogenida (na primjer, POX3) . Kada se fosfor stapa sa sumporom ispod 100 °C, nastaju čvrste otopine na bazi fosfora i sumpora, a iznad 100 °C dolazi do egzotermne reakcije u kojoj nastaju kristalni sulfidi P4S3, P4S5, P4S7, P4S10, od kojih se samo P4S5 zagrijavanjem razgrađuje u P4S3 iznad 200 °C i P4S7, a ostatak se rastali bez raspadanja. Poznati su sljedeći fosforni oksisulfidi: P2O3S2, P2O3S3, P4O4S3, P6O10S5 i P4O4S3. Fosfor je, u usporedbi s dušikom, manje sposoban stvarati spojeve s vodikom. Fosfor hidrogen fosfin PH3 i difosfin P2H4 mogu se dobiti samo neizravno. Od spojeva fosfor-dušik poznati su nitridi PN, P2N3, P3N5 - čvrste, kemijski stabilne tvari koje se dobivaju propuštanjem dušika s parama fosfora kroz električni luk; polimerni fosfonitril halidi - (PNX2)n (na primjer, polifosfonitril klorid) , dobiven reakcijom pentahalogenida s amonijakom pod različitim uvjetima; amidoimidofosfati su spojevi, obično polimerni, koji sadrže P-NH-P veze zajedno s P-O-P vezama. Na temperaturama iznad 2000°C, fosfor reagira s ugljikom i nastaje
PC3 karbid je tvar koja je netopljiva u običnim otapalima i ne stupa u interakciju ni s kiselinama ni s alkalijama. Kada se zagrijava s metalima, fosfor stvara fosfide. Fosfor tvori brojne organofosforne spojeve. Priznanica. provodi se proizvodnja elementarnog fosfora
njegova elektrotermalna redukcija iz prirodnih fosfata (apatiti ili fosforiti) na 1400-1600 °C s koksom u prisutnosti silicija (kvarcni pijesak):
2Ca3(PO4)2 + 10C + n SiO2 = P4 + 10CO + 6CaO× n SiO2 Prethodno usitnjena i obogaćena rudača koja sadrži fosfor umiješana je u
specificiranim omjerima sa silicijevim dioksidom i koksom i stavljena u električnu peć. Silicij je neophodan za smanjenje temperature reakcije, kao i za povećanje njezine brzine vezanjem kalcijevog oksida koji se oslobađa tijekom procesa redukcije u kalcijev silikat, koji se kontinuirano uklanja kao rastaljena troska. U trosku prelaze i silikati i oksidi aluminija, magnezija, željeza i druge nečistoće, te ferofosfor (Fe2P, FeP, Fe3P), nastali međudjelovanjem dijela reduciranog željeza s fosforom. Ferofosfor, kao i male količine mangan fosfida i drugih metala otopljenih u njemu, uklanjaju se iz električne peći dok se nakupljaju za kasniju upotrebu u proizvodnji specijalnih čelika. Pare fosfora napuštaju električnu peć zajedno s plinovitim nusproizvodima.
produkti i hlapljive nečistoće (CO, SiF4, PH3, vodena para, produkti pirolize organskih nečistoća naboja itd.) na temperaturi od 250-350 °C. Nakon čišćenja od prašine, plinovi koji sadrže fosfor šalju se u kondenzacijske jedinice u kojima se tekući tehnički bijeli fosfor prikuplja pod vodom na temperaturi od najmanje 50 °C. Razvijaju se metode za proizvodnju fosfora pomoću plinovitih
redukcijskih sredstava, plazma reaktorima kako bi se intenzivirala proizvodnja povećanjem temperatura na 2500-3000 °C, tj. viših od temperatura disocijacije prirodnih fosfata i redukcijskih plinova (npr. metana) koji se koriste kao transportni plin u niskotemperaturnoj plazmi.
Primjena. Najveći dio proizvedenog fosfora prerađuje se u fosfornu kiselinu i fosforna gnojiva i tehničke soli (fosfate) dobivene na njezinoj osnovi. . Bijeli fosfor se koristi u zapaljivim i dimnim granatama, bombama; Crvena
fosfor - u proizvodnji šibica. Fosfor se koristi u proizvodnji legura obojenih metala kao sredstvo za deoksidaciju. Uvođenje do 1% fosfora povećava otpornost na toplinu legura poput fehrala i kromala. Fosfor je uključen u neke bronce, jer povećava njihovu fluidnost i otpornost na abraziju. Fosfidi metala, kao i nekih nemetala (B, Si, As i dr.) koriste se u proizvodnji i dopiranju poluvodičkih materijala. Fosfor se djelomično koristi za proizvodnju klorida i sulfida, koji služe kao polazni materijali za proizvodnju plastifikatora koji sadrže fosfor (na primjer trikrezil fosfat, tributil fosfat itd.), lijekova, organofosfornih pesticida, a koriste se i kao aditivi u mazivima. i goriva. Sigurnosne mjere opreza. Bijeli fosfor i njegovi spojevi vrlo su otrovni. Raditi sa
fosfor zahtijeva pažljivo brtvljenje opreme; pohraniti bijeli fosfor. treba biti pod vodom ili u hermetički zatvorenoj metalnoj posudi. Pri radu s fosforom moraju se strogo poštivati sigurnosni propisi. Fosfor u tijelu. Fosfor je jedan od najvažnijih biogenih elemenata,
neophodan za život svih organizama. U živim stanicama prisutan je u obliku orto- i pirofosforne kiseline i njihovih derivata, a također je dio nukleotida, nukleinskih kiselina, fosfoproteina, fosfolipida, fosfornih estera ugljikohidrata, mnogih koenzima i drugih organskih spojeva. Zbog osobitosti svoje kemijske strukture, atomi fosfora, poput atoma sumpora, sposobni su stvarati energetski bogate veze u visokoenergetskim spojevima; adenozin trifosforna kiselina (ATP), kreatin fosfat itd. U procesu biološke evolucije spojevi fosfora postali su glavni, univerzalni pohranitelji genetskih informacija i nositelji energije u svim živim sustavima. Dr. Važna uloga fosfornih spojeva u tijelu leži u činjenici da enzimsko dodavanje fosforilnog ostatka () različitim organskim spojevima (fosforilacija) služi kao "prolaz" za njihovo sudjelovanje u metabolizmu, i, obrnuto, cijepanje fosforilni ostatak (defosforilacija) isključuje ove spojeve iz aktivne izmjene. Enzimi metabolizma fosfora - kinaze, fosforilaze i fosfataze. Jetra ima glavnu ulogu u transformaciji fosfornih spojeva u tijelu životinja i ljudi. Metabolizam spojeva fosfora reguliran je hormonima i vitaminom D. Sadržaj fosfora (u mg na 100 G suha tvar) u biljnim tkivima - 230-350,
morske životinje - 400-1800, kopnene životinje - 1700-4400, bakterije - oko 3000; u ljudskom tijelu posebno mnogo fosfora ima u koštanom tkivu (nešto više od 5000), u tkivu mozga (oko 4000) i u mišićima (220-270). Dnevna ljudska potreba za fosforom iznosi 1-1,2 G(u djece je veći nego u odraslih). Od prehrambenih proizvoda najbogatiji fosforom su sir, meso, jaja, mahunarke (grašak, grah i dr.). Ravnoteža fosfora u tijelu ovisi o općem stanju metabolizma. Kršenje metabolizma fosfora dovodi do dubokih biokemijskih promjena, prvenstveno u energetskom metabolizmu. S nedostatkom fosfora u organizmu, životinje i ljudi razvijaju osteoporozu i druge bolesti kostiju, a biljke fosforno gladovanje . Izvor fosfora u živoj prirodi su njegovi anorganski spojevi sadržani u tlu i otopljeni u vodi. Fosfor biljke izvlače iz tla u obliku topivih fosfata. Životinje obično dobivaju dovoljno fosfora iz prehrane. Nakon smrti organizama fosfor ponovno ulazi u tlo i pridnene sedimente te tako sudjeluje. u kruženju tvari. Važna uloga fosfora u regulaciji metaboličkih procesa određuje visoku osjetljivost mnogih enzimskih sustava živih stanica na djelovanje organofosfornih spojeva. Ova se okolnost koristi u medicini u razvoju lijekova, u poljoprivredi u proizvodnji fosfora.
gnojiva, kao i u stvaranju učinkovitih insekticida. Mnogi fosforni spojevi su izrazito otrovni, a neki od organofosfornih spojeva mogu se svrstati u kemijska bojna sredstva (sarin, soman, tabun). Radioaktivni izotop fosfora 32P naširoko se koristi u biologiji i medicini kao indikator u proučavanju svih vrsta metabolizma i energije u živim organizmima. . Lijekovi koji sadrže fosfor (adenozin trifosforna kiselina,
fitin, kalcijev glicerofosfat, fosfren itd.), utječu uglavnom na procese metabolizma tkiva i koriste se za bolesti mišića, živčanog sustava, tuberkulozu, gubitak prehrane, anemiju itd. Radioaktivni izotopi fosfora koriste se kao izotopski indikatori za proučavanje metabolizma, dijagnostiku bolesti, kao i za zračenje tumora .
Arsen(lat. Arsenicum), As, kemijski element V skupine periodnog sustava Mendeljejeva, atomski broj 33, atomska masa 74,9216; čelično sivi kristali. Element se sastoji od jednog stabilnog izotopa 75As. Povijesna referenca. Prirodni spojevi arsena sa sumporom (orpiment As2S3,
realgar As4S4) bili su poznati narodima starog svijeta, koji su te minerale koristili kao lijekove i boje. Bio je poznat i proizvod izgaranja arsenovih sulfida - arsenov (III) oksid As2O3 ("bijeli arsen"). Naziv arsenikón nalazimo već kod Aristotela; potječe od grčkog. ársen - snažan, hrabar i služi za označavanje spojeva arsena (na temelju njihovog snažnog djelovanja na tijelo). Vjeruje se da ruski naziv dolazi od riječi "miš" (nakon upotrebe preparata arsena za istrebljenje miševa i štakora). Proizvodnja arsena u slobodnom stanju pripisuje se Albertu Velikom (oko 1250.). Godine 1789. A. Lavoisier uvrstio je arsen u popis kemijskih elemenata. Rasprostranjenost u prirodi. Prosječni sadržaj arsena u zemljinoj kori (klark)
1,7·10-4% (maseni), u takvim količinama prisutan je u većini magmatskih stijena. Budući da su spojevi arsena hlapljivi na visokim temperaturama, element se ne nakuplja tijekom magmatskih procesa; koncentrira se, taloži se iz vrućih dubokih voda (zajedno sa S, Se, Sb, Fe, Co, Ni, Cu i drugim elementima). Tijekom vulkanskih erupcija arsen u obliku svojih hlapljivih spojeva ulazi u atmosferu. Budući da je arsen viševalentan, na njegovu migraciju uvelike utječe redoks okolina. U oksidacijskim uvjetima zemljine površine nastaju arsenati (As5+) i arseniti (As3+). To su rijetki minerali koji se nalaze samo u područjima naslaga arsena. Prirodni arsen i minerali As2+ još su rjeđi. Od brojnih minerala arsena (oko 180) jedino je arsenopirit FeAsS od primarne industrijske važnosti. Male količine arsena neophodne su za život. Međutim, u područjima depozita
arsena i aktivnosti mladih vulkana, tla na nekim mjestima sadrže i do 1% arsena, što se povezuje s bolestima stoke i smrću vegetacije. Akumulacija arsena posebno je tipična za krajolike stepa i pustinja, u čijim je tlima arsen neaktivan. U vlažnim klimatskim uvjetima arsen se lako ispire iz tla. U živoj tvari ima prosječno 3·10-5% arsena, u rijekama 3·10-7%. Arsenik donio
rijeke u ocean, relativno se brzo taloži. U morskoj vodi ima samo 1·10-7% arsena, ali u glinama i škriljevcima 6,6·10-4%. Sedimentne željezne rude i feromanganske nodule često su obogaćene arsenom.
Fizička i kemijska svojstva. Arsen ima nekoliko alotropskih modifikacija. U normalnim uvjetima najstabilniji je takozvani metalni ili sivi arsen (a-As) - čeličnosiva krta kristalna masa; kad je tek slomljen, ima metalni sjaj; na zraku brzo blijedi jer je prekriven tankim slojem As2O3. Kristalna rešetka sivog arsena je romboedarska ( A- 4.123 Å, kut a – 54o10", x- 0,226), slojevito. Gustoća 5,72 g/cm3(pri 20°C), električni otpor 35·10-8 ohm× m, odnosno 35·10-6 ohm× cm, temperaturni koeficijent električnog otpora 3,9·10-3 (0o-100 oC), Brinellova tvrdoća 1470 Mn/ m2, odnosno 147 kgf/mm2(3-4 po Mohsu); Arsen je dijamagnetičan. Pod atmosferskim tlakom, arsen sublimira na 615 °C bez taljenja, budući da se trojna točka (vidi fazni dijagram) a-As nalazi na 816 °C i tlaku od 36 na. Pare arsena sastoje se od molekula As4 do 800°C, iznad 1700°C - samo As2. Kada se pare arsena kondenziraju na površini hlađenoj tekućim zrakom, nastaje žuti arsen - prozirni, meki kristali poput voska, gustoće 1,97 g/cm3, po svojstvima sličan bijelom fosforu. Kada je izložen svjetlu ili niskoj toplini, pretvara se u sivi arsen. Poznate su i staklasto-amorfne modifikacije: crni arsen i smeđi arsen, koji se zagrijavanjem iznad 270?C pretvaraju u sivi M. Konfiguracija vanjskih elektrona atoma arsena 3 d 104s 24str 3. Arsen u spojevima
ima oksidacijska stanja + 5, + 3 i - 3. Sivi arsen je mnogo manje kemijski aktivan od fosfora. Kada se zagrijava na zraku iznad 400°C, arsen gori, stvarajući As2O3. Arsen se spaja izravno s halogenima; pod normalnim uvjetima, AsF5 je plin; AsF3, AsCl3, AsBr3 - bezbojne, vrlo hlapljive tekućine; AsI3 i As2l4 su crveni kristali. Zagrijavanjem arsena i sumpora nastaju sulfidi: narančastocrveni As4S4 i limunžuti As2S3. Blijedožuti sulfid As2S5 taloži se propuštanjem H2S u ledom ohlađenu otopinu arsenske kiseline (ili njezinih soli) u dimećoj solnoj kiselini: 2H3AsO4 + 5H2S = As2S5 + 8H2O; Na oko 500°C raspada se na As2S3 i sumpor. Svi M. sulfidi su netopljivi u vodi i razrijeđenim kiselinama. Jaki oksidansi (smjese HNO3 + HCl, HCl + KClO3) pretvaraju ih u smjesu H3AsO4 i H2SO4. As2S3 sulfid se lako otapa u sulfidima i polisulfidima amonijevih i alkalnih metala, tvoreći soli kiselina - tioarsena H3AsS3 i tioarsena H3AsS4. S kisikom arsen stvara okside: oksid M. (III) As2O3 - arsenov anhidrid i oksid M. (V) As2O5 - arsenov anhidrid. Prvi od njih nastaje djelovanjem kisika na metal ili njegove sulfide, na primjer 2As2S3 + 9O2 - 2As2O3 + 6SO2. Pare As2O3 kondenziraju se u bezbojnu staklastu masu koja s vremenom postaje neprozirna zbog stvaranja malih kubičnih kristala gustoće 3,865 g/cm3. Gustoća pare odgovara formuli As4O6: iznad 1800°C para se sastoji od As2O3. Na 100 G voda otapa 2.1 G As2O3 (na 25oC). M. oksid (III) je amfoteran spoj s prevladavajućim kiselim svojstvima. Poznate su soli (arseniti) koje odgovaraju kiselinama ortoarsenoj H3AsO3 i metaarsenskoj HAsO2; same kiseline nisu dobivene. U vodi su topljivi samo arseniti alkalnih metala i amonij. As2O3 i arseniti su obično redukcijski agensi (npr. As2O3 + 2I2 + 5H2O - 4HI + 2H3AsO4), ali mogu biti i oksidansi (npr. As2O3 + 3C - 2As + 3CO). Arsen(V) oksid se priprema zagrijavanjem arsenove kiseline H3AsO4 (oko
200oC). Bezbojan je i raspada se na oko 500°C na As2O3 i O2. Arsenska kiselina se dobiva djelovanjem koncentrirane HNO3 na As ili As2O3. Soli arsenove kiseline (arsenati) netopljivi su u vodi, osim soli alkalnih metala i amonijaka. Poznate su soli koje odgovaraju kiselinama ortoarsenska H3AsO4, metaarsenska HAsO3 i piroarsenska H4As2O7; posljednje dvije kiseline nisu dobivene u slobodnom stanju. Kada se legira s metalima, arsen uglavnom stvara spojeve (arsenide).
Prijem i prijava. Arsen se industrijski proizvodi zagrijavanjem arsenovog pirita:
FeAsS - FeS + As ili (rjeđe) redukcija As2O3 ugljenom. Oba procesa se provode u retortama iz
vatrostalna glina spojena na prijemnik za kondenzaciju arsenovih para. Anhidrid arsena dobiva se oksidativnim prženjem arsenovih ruda ili kao nusprodukt prženja polimetalnih ruda, koje gotovo uvijek sadrže arsen. Tijekom oksidativnog prženja nastaju pare As2O3 koje se kondenziraju u sabirnim komorama. Sirovi As2O3 pročišćava se sublimacijom na 500-600°C. Pročišćeni As2O3 koristi se za proizvodnju arsena i njegovih pripravaka.
Mali dodaci arsena (0,2-1,0% težine) uvode se u olovo koje se koristi za proizvodnju sačme (arsen povećava površinsku napetost rastaljenog olova, zbog čega sačma poprima oblik blizak sferičnom; arsen malo povećava tvrdoću od olova). Kao djelomična zamjena za antimon, arsen je uključen u neke babitne i tiskarske legure. Čisti arsen nije otrovan, ali svi njegovi spojevi, topljivi u vodi ili sposobni za
ići u otopinu pod utjecajem želučanog soka, izuzetno otrovan; Osobito je opasan arsen vodik. Od spojeva arsena koji se koriste u proizvodnji, anhidrid arsena je najotrovniji. Gotovo sve sulfidne rude obojenih metala, kao i željezni (sumporni) pirit, sadrže primjesu arsena. Stoga pri njihovom oksidativnom prženju uz sumporni dioksid SO2 uvijek nastaje As2O3; Većina se kondenzira u dimnim kanalima, ali u nedostatku ili niskoj učinkovitosti postrojenja za obradu, ispušni plinovi peći za prženje rude odnose zamjetne količine As2O3. Čisti arsen, iako nije otrovan, uvijek je prekriven slojem toksičnog As2O3 kada se skladišti na zraku. U nedostatku odgovarajuće ventilacije, jetkanje metala (željezo, cink) industrijskom sumpornom ili klorovodičnom kiselinom koja sadrži arsen izuzetno je opasno, budući da nastaje arsenski vodik. Arsen u tijelu. Kao element u tragovima, arsen je sveprisutan
u živoj prirodi. Prosječni sadržaj arsena u tlima je 4·10-4%, u biljnom pepelu - 3·10-5%. Sadržaj arsena u morskim organizmima veći je nego u kopnenim organizmima (u ribama 0,6-4,7 mg u 1 kg sirove tvari nakupljaju se u jetri). Prosječni sadržaj arsena u ljudskom tijelu je 0,08-0,2 mg/kg. U krvi se arsen koncentrira u crvenim krvnim stanicama, gdje se veže na molekulu hemoglobina (a globinska frakcija sadrži dvostruko više od hema). Najveća količina toga (po 1 G tkivo) nalazi se u bubrezima i jetri. Mnogo arsena nalazi se u plućima i slezeni, koži i kosi; relativno malo - u cerebrospinalnoj tekućini, mozgu (uglavnom hipofizi), spolnim žlijezdama itd. U tkivima se arsen nalazi u glavnoj frakciji proteina, znatno manje u frakciji topivoj u kiselini, a nalazi se samo mali dio u lipidnoj frakciji. Arsen je uključen u redoks reakcije: oksidacijsku razgradnju složenih ugljikohidrata, fermentaciju, glikolizu itd. Spojevi arsena koriste se u biokemiji kao specifični inhibitori enzima za proučavanje metaboličkih reakcija. Arsen u medicini. Organski spojevi arsena (aminarson, miarsenol,
novarsenal, osarsol) koriste se uglavnom za liječenje sifilisa i protozoalnih bolesti. Anorganski pripravci arsena - natrijev arsenit (natrijeva arsenova kiselina), kalijev arsenit (kalijeva arsenova kiselina), anhidrid arsena As2O3, propisuju se kao opće jačanje i tonik. Kada se primjenjuju lokalno, anorganski pripravci arsena mogu izazvati nekrotizirajući učinak bez prethodne iritacije, čineći ovaj proces gotovo bezbolnim; ovo svojstvo, koje je najizraženije kod As2O3, koristi se u stomatologiji za
razaranja zubne pulpe. Za liječenje psorijaze koriste se i anorganski pripravci arsena. Umjetno dobiveni radioaktivni izotopi M. 74As (T1/2 - 17,5 dana) i 76As (T1/2
26,8 h) koriste se u dijagnostičke i terapijske svrhe. Uz njihovu pomoć, razjašnjava se mjesto tumora mozga i određuje se stupanj radikalnosti njihovog uklanjanja. Radioaktivni arsen se ponekad koristi za bolesti krvi itd. Prema preporukama Međunarodnog povjerenstva za zaštitu od zračenja,
najveći dopušteni sadržaj 76As u tijelu 11 mccurie. Prema sanitarnim standardima usvojenim u SSSR-u, najveće dopuštene koncentracije 76As u vodi i otvorenim rezervoarima su 1·10-7 curie/l, u zraku radnih prostorija 5·10-11 curie/l. Svi preparati arsena vrlo su otrovni. U slučaju akutnog trovanja, opažaju se jaki bolovi u trbuhu, proljev i oštećenje bubrega; Mogući su kolaps i konvulzije. U kroničnim otrovanjima najčešće su gastrointestinalne smetnje, katar sluznice dišnih putova (faringitis, laringitis, bronhitis), kožne lezije (egzantemi, melanoza, hiperkeratoza), te poremećaji osjetljivosti; moguć je razvoj aplastične anemije. U liječenju trovanja preparatima arsena najveći značaj ima unitiol. Treba težiti mjerama za sprječavanje industrijskih trovanja
prvenstveno na mehanizaciji, brtvljenju i otprašivanju tehnološkog procesa, stvaranju učinkovite ventilacije i opskrbi radnika osobnom zaštitnom opremom od izlaganja prašini. Neophodni su redoviti zdravstveni pregledi radnika. Prethodni zdravstveni pregledi obavljaju se prilikom prijema u radni odnos, a za zaposlenike jednom u šest mjeseci.
ANTIMON(lat. Stibium), Sb, kemijski element V skupine periodnog sustava Mendeljejeva; atomski broj 51, atomska masa 121,75; Metal je srebrno-bijel s plavičastom nijansom. U prirodi su poznata dva stabilna izotopa: 121Sb (57,25%) i 123Sb (42,75%). Od umjetno dobivenih radioaktivnih izotopa najvažniji je 122Sb ( T 1/2 - 2,8 cym), 124Sb ( T 1/2 - 60,2 cym) i 125Sb ( T 1/2 - 2 godine).
Povijesna referenca. Antimon je poznat od davnina. U zemljama Istoka korišten je otprilike 3000 godina pr. e. za izradu posuda. U starom Egiptu već u 19.st. PRIJE KRISTA e. Antimonov svjetlucavi prah (prirodni Sb2S3) zvan mesten ili stabljika koristio se za crnjenje obrva. U staroj Grčkoj bio je poznat kao stími i stíbi, otuda latinski stibium. Oko 12-14 stoljeća. n. e. pojavio naziv antimonij. Godine 1789. A. Lavoisier uvrstio je antimon u popis kemijskih elemenata pod nazivom antimoin (moderni engleski antimony, španjolski i talijanski antimonio, njemački Antimon). Ruski "antimon" dolazi od turskog sürme; označavao je olovni svjetlucavi prah PbS, koji se također koristio za crnjenje obrva (prema drugim izvorima, "antimon" - od perz. surme - metal). Detaljan opis svojstava i načina dobivanja antimona i njegovih spojeva prvi je dao alkemičar Vasilij Valentin (Njemačka) 1604. Rasprostranjenost u prirodi. Prosječni sadržaj antimona u zemljinoj kori (clarke) 5 ×10-5
% težine. Antimon je raspršen u magmi i biosferi. Iz vrućih podzemnih voda koncentrira se u hidrotermalne naslage. Poznata su sama nalazišta antimona, kao i antimonsko-živina, antimonsko-olovna, zlato-antimonska i antimonsko-volframova ležišta. Od 27 minerala antimona, stibnit (Sb2S3) je od velike industrijske važnosti. . Zbog svog afiniteta sa sumporom, antimon se često nalazi kao nečistoća u sulfidima arsena, bizmuta, nikla, olova, žive, srebra i drugih elemenata. Fizička i kemijska svojstva. Antimon je poznat u kristalnom i tri
amorfni oblici (eksplozivni, crni i žuti). Eksplozivni antimon (gustoća 5,64-5,97 g/cm 3) eksplodira pri svakom kontaktu: nastaje tijekom elektrolize otopine
SbCl3; crna (gustoća 5,3 g/cm 3) - s brzim hlađenjem para antimona; žuto - kada kisik prelazi u ukapljeni SbH3. Žuti i crni antimon su nestabilni; na niskim temperaturama prelaze u obični antimon. Najstabilniji kristalni antimon , kristalizira u trigonalnom sustavu, A - 4,5064; gustoća 6,61-6,73 g/cm 3 (tekućina - 6,55 g/cm 3); t tt 630,5 °C; t kip 1635-1645 °C; specifični toplinski kapacitet pri 20-100 °C 0,210 kJ/(kg × DO ) ; toplinska vodljivost na 20 °C 17.6 W/M× K. Temperaturni koeficijent linearnog širenja za polikristalni C. 11,5 ×10-6 na 0-100 °C; za monokristal a1 - 8,1×10-a2 - 19,5 × 10-6 na 0-400 °C, električni otpor (20 °C) (43,045 × 10-6 ohm× cm). Antimon je dijamagnetičan, specifična magnetska osjetljivost je -0,66 × 10-6. Za razliku od većine metala, antimon je krt, lako se cijepa duž ravnina cijepanja, melje u prah i ne može se kovati (ponekad se klasificira kao polumetal) . Mehanička svojstva ovise o čistoći metala. Tvrdoća po Brinellu za lijevani metal 325-340 Mn/m 2 (32,5-34,0 kgf/mm 2); modul elastičnosti 285-300; vlačna čvrstoća 86.0 Mn/m 2 (8,6 kgf/mm 2). Konfiguracija vanjskih elektrona atoma Sb5s25r3. U spojevima pokazuje oksidacijska stanja uglavnom +5, +3 i -3. Kemijski, antimon je neaktivan. Ne oksidira na zraku do
temperatura topljenja. Antimon ne reagira s dušikom i vodikom. Ugljik se malo otapa u rastaljenom antimonu. Metal aktivno komunicira s klorom i drugim halogenima, tvoreći antimonove halogenide. Reagira s kisikom na temperaturama iznad 630 °C i nastaje Sb2O3 . Kada se stopi sa sumporom, dobivaju se sulfidi antimona, a također stupa u interakciju s fosforom i arsenom. Antimon je otporan na vodu i razrijeđene kiseline. Koncentrirana klorovodična i sumporna kiselina polagano otapaju antimon i nastaju SbCl3 klorid i Sb2 (SO4)3 sulfat; koncentrirana dušična kiselina oksidira antimon u viši oksid, koji nastaje u obliku hidratiziranog spoja xSb2O5 ×yH2O. Od praktičnog interesa su teško topive soli antimonske kiseline - antimonati (MeSbO3 × 3H2O, gdje je Me Na, K) i soli neizolirane metaantimonske kiseline - metaantimoniti (MeSbO2 × 3H2O), koji imaju redukcijska svojstva. S. spaja se s metalima u antimonide. Priznanica. Antimon se dobiva pirometalurškim i hidrometalurškim metodama
prerada koncentrata ili ruda koje sadrže 20-60% Sb. Pirometalurške metode uključuju taloženje i redukcijsko taljenje. Sirovine za taložno taljenje su koncentrati sulfida; proces se temelji na istiskivanju antimona iz njegova sulfida željezom: Sb2S3 + 3Fe Û 2Sb + 3FeS. Željezo se uvodi u punjenje u obliku otpada. Taljenje se provodi u reverberacijskim ili kratkorotirajućim pećima s bubnjem na 1300-1400 °C. Iskorištenje antimona u grubi metal je više od 90%. Redukcijsko taljenje antimona temelji se na redukciji njegovih oksida u metal s drvenim ugljenom ili ugljenom prašinom i šljakanjem jalovine. Redukcijskom taljenju prethodi oksidativno prženje na 550 °C uz višak zraka. Ugar sadrži nehlapljivi antimonov tetroksid. Električne peći mogu se koristiti i za taloženje i za redukcijsko taljenje. Hidrometalurški postupak za dobivanje antimona sastoji se od dvije faze: obrada sirovine otopinom alkalnog sulfida, prevođenje antimona u otopinu u obliku soli antimonskih kiselina i sulfosoli i odvajanje antimona. elektroliza. Grubi antimon, ovisno o sastavu sirovine i načinu proizvodnje, sadrži od 1,5 do 15% nečistoća: Fe, As, S itd. Za dobivanje čistog antimona koristi se pirometalurška ili elektrolitička rafinacija. Tijekom pirometalurške rafinacije, nečistoće željeza i bakra uklanjaju se u obliku sumpornih spojeva uvođenjem antimonita (cruduma) - Sb2S3 - u talinu antimona, nakon čega se arsen (u obliku natrijevog arsenata) i sumpor uklanjaju upuhivanjem zraka pod soda troska. Tijekom elektrolitičke rafinacije s topljivom anodom, grubi antimon se pročišćava od željeza, bakra i drugih metala preostalih u
elektrolit (Cu, Ag, Au ostaju u mulju). Elektrolit je otopina koja se sastoji od SbF3, H2SO4 i HF. Sadržaj nečistoća u rafiniranom antimonu ne prelazi 0,5-0,8%. Za dobivanje antimona visoke čistoće koristi se zonsko taljenje u atmosferi inertnog plina ili se antimon dobiva iz prethodno pročišćenih spojeva - trioksida ili triklorida. Primjena. Antimon se uglavnom koristi u obliku legura olova i kositra
za baterije, plašteve kablova, ležajeve (babit) , legure koje se koriste u tiskarstvu (hart) , itd. Takve legure imaju povećanu tvrdoću, otpornost na trošenje i otpornost na koroziju. U fluorescentnim svjetiljkama Sb se aktivira kalcijevim halofosfatom. Antimon je uključen u poluvodičke materijale kao dodatak germaniju i siliciju, kao i u antimonide (na primjer, InSb). Radioaktivni izotop 12Sb koristi se u izvorima g-zračenja i neutrona. Antimon u tijelu. Sadržaj antimona (na 100 G suha tvar) nalazi se u
biljke 0,006 mg, u morskih životinja 0,02 mg, kod kopnenih životinja 0,0006 mg. Antimon u tijelo životinja i ljudi ulazi putem dišnog sustava ili gastrointestinalnog trakta. Izlučuje se uglavnom fecesom, au malim količinama mokraćom. Biološka uloga antimona je nepoznata. Selektivno se koncentrira u štitnoj žlijezdi, jetri i slezeni. U eritrocitima se antimon nakuplja pretežno u oksidacijskom stanju + 3, u krvnoj plazmi - u oksidacijskom stanju + 5. Najveća dopuštena koncentracija C. 10-5 - 10-7 G do 100 G suhom krpom. U višim koncentracijama ovaj element inaktivira niz enzima metabolizma lipida, ugljikohidrata i proteina (vjerojatno kao rezultat blokiranja sulfhidrilnih skupina) . U medicinskoj praksi koriste se pripravci antimona (solyusurmin, itd.).
uglavnom za liječenje lišmanijaze i nekih helmintijaza (na primjer, shistosomijaze). Antimon i njegovi spojevi su otrovni. Kod taljenja koncentrata moguće je trovanje
rude antimona i u proizvodnji legura antimona. Kod akutnog trovanja - iritacija sluznice gornjeg dišnog trakta, očiju i kože. Mogu se razviti dermatitis, konjunktivitis i dr. Liječenje: antidoti (unitiol), diuretici i dijaforetici i dr. Prevencija: mehanizacija proizvodnje. procese, učinkovitu ventilaciju itd.
BIZMUT(lat. Bismuthum), Bi, kemijski element V periodne skupine
Mendeljejevljev sustav; atomski broj 83, atomska masa 208.980; srebrno-sivi metal s ružičastom nijansom. Prirodni bizmut sastoji se od jednog stabilnog izotopa, 209Bi. V. je bio poznat u 15-16. stoljeću, ali se dugo vremena smatrao vrstom kositra,
olovo ili antimon. Sredinom 18. stoljeća bizmut je priznat kao samostalni metal. Francuski kemičar A. Lavoisier uvrstio ga je u popis jednostavnih tijela. Podrijetlo imena "bizmut" nije utvrđeno. Sadržaj bizmuta u zemljinoj kori je 2·10-5% mase. Bizmut se prirodno pojavljuje u
u obliku brojnih minerala od kojih su najvažniji bizmut luster Bi2S3, samorodni bizmut Bi, bizmut Bi2O3 i dr. U većim količinama, ali u malim koncentracijama bizmut se nalazi kao izomorfna primjesa u olovo-cinku, bakru, molibdenu. -rude kobalta i kositra-volframa . Oko 90% svjetske potrošnje pokriva se povezanom proizvodnjom bizmuta tijekom prerade polimetalnih ruda. Fizička i kemijska svojstva. Bizmut ima romboedarsku rešetku sa
razdoblje a- 4,7457 A i kut α-57?14 " 13"" . Gustoća 9,80 g/cm 3; t pl 271,3°C; t kip 1560 °C. Specifični toplinski kapacitet (20 °C) 123,5 J/kg K (0,0294 kal/g·S); toplinski koeficijent
linearno širenje na sobnoj temperaturi 13,3·10-6; toplinska vodljivost (20°C) 8,37 W/(m·TO) ; električni otpor (20°C) 106,8 10-8 ohm· m(106.8·10-6 ohm· cm). Bizmut je najdijamagnetičniji metal. Specifična magnetska susceptibilnost je -1,35·10-6. Pod utjecajem magnetskog polja, električni otpor bizmuta se povećava u većoj mjeri nego kod drugih metala, što se koristi za mjerenje indukcije jakih magnetskih polja. Presjek hvatanja toplinskih neutrona bizmuta je mali (34 10-31 m 2 ili 0,034 barna). Na sobnoj temperaturi, bizmut je krhak, lako se cijepa duž ravnina cijepanja i melje se u prah u porculanskom tarioniku. Kovanje na temperaturi od 120-150°C; vrućim prešanjem (na 240-250°C) može se proizvesti žica promjera do 0,1 mm, kao i ploče debljine 0,2-0,3 mm. Brinellova tvrdoća 93 Mn/m 2 (9,3 kgf/mm 2), prema Mohsu 2.5. Pri taljenju V. smanjuje volumen za 3,27%. Bizmut je stabilan na suhom zraku, ali na vlažnom zraku njegova površina
oksidacija. Kada se zagrije iznad 1000°C, gori plavičastim plamenom stvarajući Bi2O3 oksid . U naponskom nizu stoji bizmut izmedju vodika i bakra, zato se ne otapa u razrijeđenoj sumpornoj i solnoj kiselini; otapanje u koncentriranoj sumpornoj i dušičnoj kiselini događa se uz oslobađanje SO2 i odgovarajućih dušikovih oksida. Bizmut pokazuje valencije 2, 3 i 5. Spojevi bizmuta nižih valencija
imaju bazni karakter, viši su kiseli. Od spojeva kisika na svijetu najvažniji je trioksid Bi2O3 koji zagrijavanjem mijenja žutu boju u crveno-smeđu. Bi2O3 se koristi za dobivanje soli bizmuta. U razrijeđenim otopinama bizmutove soli hidroliziraju. BiCl3 klorid se hidrolizira uz taloženje oksiklorida BiOCl, Bi nitrat (NO3)3 - uz taloženje glavne soli BiONO3·BiOOH. Za njegovo pročišćavanje koristi se sposobnost hidrolize V. soli. Spojeve 5-valentnog bizmuta teško je dobiti; jaka su oksidacijska sredstva. Sol KBiO3 (odgovara anhidridu Bi2O5) nastaje u obliku smeđe-crvenog taloga na platinskoj anodi tijekom elektrolize kipuće otopine smjese KOH, KCl i suspenzije Bi2O3. Bizmut se lako spaja s halogenima i sumporom. Djelovanjem kiselina na leguru bizmuta i magnezija nastaje bizmutin (bizmutov vodik) BiH3; Za razliku od arzina AsH3, bizmutin je nestabilan spoj i nije dobiven u čistom obliku (bez viška vodika). S nekim metalima (olovo, kadmij, kositar) bizmut stvara eutektike niskog tališta; s natrijem, kalijem, magnezijem i kalcijem - intermetalnim spojevima s talištem znatno višim od tališta izvornih komponenti. Bizmut ne stupa u interakciju s rastaljenim aluminijem, kromom i željezom. Prijem i prijava. Glavna količina bizmuta nastaje kao nusproizvod
vatreno pročišćavanje grubog olova (werkbley). Pirometalurška metoda temelji se na sposobnosti bizmuta da stvara vatrostalne intermetalne spojeve s K, Na, Mg i Ca. Navedeni metali se dodaju u rastaljeno olovo i dobiveni čvrsti spojevi s V. (šljaka) se odvajaju od taline. Značajna količina bizmuta ekstrahira se iz mulja elektrolitičkog rafiniranja olova u hidrofluorosilicijnoj otopini, kao i iz prašine i mulja iz proizvodnje bakra. Troske i muljevi koji sadrže bizmut tale se pod alkalnim troskama. Dobiveni grubi metal sadrži nečistoće As, Sb, Cu, Pb, Zn, Se, Te, Ag i neke druge elemente. Taljenje bizmuta iz vlastitih ruda provodi se u malom opsegu. Sulfidne rude prerađuju se precipitacijskim taljenjem sa željeznim otpadom. Iz oksidiranih ruda, zlato se reducira ugljenom pod slojem talila niskog tališta. Za grubo čišćenje grube vode koriste se ovisno o sastavu nečistoća.
razne metode: zeigerizacija, oksidativno rafiniranje pod alkalnim fluksevima, taljenje sa sumporom, itd. Najteže odvojiva nečistoća olova uklanja se (do 0,01%) propuhivanjem klora kroz rastaljeni metal. Komercijalni bizmut sadrži
99,9-99,98% bazni metal. V. visoke čistoće dobivaju se zonskom rekristalizacijom u kvarcnim čamcima u atmosferi inertnog plina. Značajne količine bizmuta koriste se za pripremu niskotaljivih legura koje sadrže olovo, kositar, kadmij, koje se koriste u stomatološkoj protetici, za izradu klišea od drvenih matrica, kao kape za taljenje u automatskim vatrogasnim uređajima, kod lemljenja kapica na oklopne projektile itd. Rastaljeni bizmut može poslužiti kao rashladno sredstvo u nuklearnim reaktorima. Potrošnja bizmuta u spojevima s Te za
termoelektrični generatori. Ovi spojevi, zbog povoljne kombinacije toplinske vodljivosti, električne vodljivosti i termoelektromotorne sile, omogućuju pretvaranje toplinske energije u električnu uz visoku učinkovitost (~7%). Dodavanje bizmuta nehrđajućim čelicima poboljšava njihovu obradivost. Spojevi bizmuta koriste se u proizvodnji stakla, keramici, farmaciji
industrija. Topljive soli bizmuta su otrovne i imaju slične učinke kao živa.
Književnost
1. Štetne tvari u industriji, općenito. izd. N. V. Lazareva, 6. izd., 2. dio, Lenjingrad, 1971.
2. Ivanov V.V. Ekološka geokemija elemenata. 3. Istraživanja u području stvaranja nove tehnologije za proizvodnju antimona i njegove
spojeva, u zborniku: Kemija i tehnologija antimona, Francuska, 1965. 4. Kratka kemijska enciklopedija, sv. 5, M., 1967.; 5. Nekrasov B.V., Osnove opće kemije, sv.1, M., 1965.; 6. Pogodin S.A., Arsen, u knjizi: Kratka kemijska enciklopedija, sv. 3, M., 1964. 7. Remy G., Tečaj anorganske kemije, trans. s njemačkog, sv.1, M., 1963, str. 700-712; 8. Thomson J. G., Bizmut, trans. [s engleskog], L., 1932.; 9. Shiyanov A.G., Proizvodnja antimona, M., 1961; Osnove metalurgije, sv. 5, M.,
1968; 10. Kemija i tehnologija vezanog dušika, [M.-L.], 1934.; KHE, tom 1, M., 1961.
Podskupinu dušika čini pet elemenata: dušik, fosfor, arsen, antimon i bizmut. To su p-elementi V skupine periodnog sustava D.I.
Na vanjskoj energetskoj razini atomi ovih elemenata sadrže pet elektrona koji imaju konfiguraciju ns2np3 i raspoređeni su na sljedeći način:

Stoga je najviše oksidacijsko stanje ovih elemenata +5, najniže -3, a tipično je i +3.
Prisutnost tri nesparena elektrona na vanjskoj razini ukazuje da u nepobuđenom stanju atomi elemenata imaju valenciju 3. Vanjska razina atoma dušika sastoji se od samo dvije podrazine - 2s i 2p. Atomi preostalih elemenata ove podskupine imaju prazne ćelije d-podrazine na vanjskim energetskim razinama. Posljedično, jedan od s-elektrona vanjske razine može, nakon ekscitacije, prijeći na d-podrazinu iste razine, što dovodi do stvaranja 5 nesparenih elektrona.

vanjska elektronska ljuska fosfora (nepobuđeni atom)

vanjska elektronska ljuska pobuđenog atoma fosfora.
Dakle, fosfor, arsen, antimon i bizmut u pobuđenom stanju imaju 5 nesparenih elektrona, a njihova valencija u tom stanju je 5.
U atomu dušika nemoguće je pobuditi elektron na ovaj način zbog nepostojanja d-podrazine u drugoj razini. Dakle, dušik ne može biti petovalentan, ali može formirati četvrtu kovalentnu vezu donor-akceptorskim mehanizmom zbog usamljenog elektronskog para 2s2. Za atom dušika moguć je i drugi proces. Kada se ukloni jedan od dva 2s elektrona, dušik se pretvara u jednostruko nabijeni četverovalentni ion N+.

Od dušika do bizmuta atomski radijusi se povećavaju, a ionizacijski potencijali smanjuju. Redukcijska svojstva neutralnih atoma rastu od N do Bi, a oksidacijska svojstva slabe (vidi tablicu 21).
S vodikom, dušik, fosfor i arsen tvore polarne spojeve RH3, koji pokazuju negativno oksidacijsko stanje -3. Molekule RH3 imaju piramidalni oblik. U tim su spojevima veze elemenata s vodikom jače nego u odgovarajućim spojevima elemenata podskupine kisika i posebno podskupine halogena. Stoga vodikovi spojevi elemenata podskupine dušika u vodenim otopinama ne tvore vodikove ione.

S kisikom elementi podskupine dušika tvore okside opće formule R2O3 i R2O5. Oksidi odgovaraju kiselinama HRO2 i HRO3 (i ortokiselinama H3RO4, osim dušika). Unutar podskupine priroda oksida se mijenja na sljedeći način: N2O3 - kiseli oksid; R4O6 - slabo kiseli oksid; As2O3 je amfoterni oksid s pretežno kiselim svojstvima; Sb2O3 je amfoterni oksid s prevlašću bazičnih svojstava; Bi2O3 je glavni oksid. Dakle, kiselinska svojstva oksida sastava R2O3 i R2O5 opadaju s povećanjem atomskog broja elementa.
Kao što se vidi iz tabele. 21, unutar podskupine od dušika do bizmuta, nemetalna svojstva se smanjuju, a metalna svojstva povećavaju. Kod antimona su ova svojstva jednako izražena; kod bizmuta prevladavaju metalna svojstva, a kod dušika prevladavaju nemetalna svojstva. Fosfor, arsen i antimon tvore nekoliko alotropnih spojeva.
Dušik.
Priznanica
U laboratorijima se može dobiti reakcijom razgradnje amonijevog nitrita:
Reakcija je egzotermna, oslobađa 80 kcal (335 kJ), pa se posuda mora hladiti dok se odvija (iako se amonijev nitrit mora zagrijati da bi započela reakcija).
U praksi se ova reakcija izvodi dodavanjem kap po kap zasićene otopine natrijevog nitrita u zagrijanu zasićenu otopinu amonijevog sulfata, a amonijev nitrit nastao kao rezultat reakcije izmjene trenutno se raspada.
Plin koji se oslobađa u ovom slučaju onečišćen je amonijakom, dušikovim oksidom (I) i kisikom, od kojih se pročišćava uzastopnim prolaskom kroz otopine sumporne kiseline, željezovog (II) sulfata i preko vrućeg bakra. Dušik se zatim suši.
Druga laboratorijska metoda za proizvodnju dušika je zagrijavanje smjese kalijevog dikromata i amonijevog sulfata (u omjeru 2:1 po težini). Reakcija se odvija prema jednadžbama:
Najčišći dušik može se dobiti razgradnjom metalnih azida:
Takozvani “zrak” ili “atmosferski” dušik, odnosno mješavina dušika s plemenitim plinovima, dobiva se reakcijom zraka s vrućim koksom, pri čemu nastaje tzv. “generatorski” ili “zračni” plin – sirovina za kemijsku sintezu i gorivo. Ako je potrebno, dušik se iz njega može odvojiti apsorpcijom ugljičnog monoksida.
Molekularni dušik industrijski se proizvodi frakcijskom destilacijom tekućeg zraka. Ova se metoda također može koristiti za dobivanje "atmosferskog dušika". Instalacije i stanice za dušik koje koriste metodu adsorpcije i membranske separacije plinova također se široko koriste.
Jedna od laboratorijskih metoda je propuštanje amonijaka preko bakrovog (II) oksida na temperaturi od ~700 °C:
Amonijak se zagrijavanjem uzima iz njegove zasićene otopine. Količina CuO je 2 puta veća od izračunate. Neposredno prije upotrebe dušik se pročišćava od kisika i amonijaka prolazom preko bakra i njegovog oksida (II) (također ~700 °C), zatim se suši koncentriranom sumpornom kiselinom i suhom lužinom. Proces je prilično spor, ali se isplati: dobiveni plin je vrlo čist.
Na sl. Slika 15.12 prikazuje položaj pet elemenata V skupine u periodnom sustavu. Svi su oni p-elementi, a vanjsku ljusku njihovih atoma karakterizira elektronska konfiguracija. U tablici 15.10 naznačena su neka svojstva elemenata V skupine. Kako se pomičete na dno ove skupine, svojstva njezinih elemenata mijenjaju se iz nemetalnih u metalna. Dušik i fosfor su tipični nemetali. Arsen i antimon pokazuju znakove metalnog karaktera, a bizmut je metal.
DUŠIK I FOSFOR
Ovo su dva najvažnija elementa u skupini V.
U normalnim uvjetima, dušik je plin koji se sastoji od dvoatomnih

Riža. 15.12. Položaj elemenata V skupine u periodnom sustavu.
Tablica 15.10. Svojstva elemenata V skupine

molekule Bezbojan je, bez mirisa i okusa i nema primjetnu reaktivnost.
Fosfor postoji u tri alotropska oblika, od kojih su dva najčešća crveni fosfor i manje stabilan bijeli fosfor. O strukturi ovih alotropa raspravljalo se u Odjeljku. 3.2. U tablici 15.11 uspoređuju se neka svojstva crvenog i bijelog fosfora.
Iako je dušik jedan od najelektronegativnijih elemenata (vidi tablicu 2.2), ima relativno nisku reaktivnost. Razlog tome je što su njegove dvoatomne molekule nepolarne i trostruka veza između dva atoma
Tablica 15.11. Svojstva bijelog i crvenog fosfora


Riža. 15.13. Četverohibridne orbitale atoma dušika.
Dušik u njima ima vrlo visoku čvrstoću. Entalpija ove veze je + 944 kJ/mol.
I dušik i fosfor mogu ući u svoje spojeve s oksidacijskim stupnjem od -3 do 4-5. Na primjer, u amonijaku dušik ima oksidacijski stupanj +3, a u nitratnom ionu njegov oksidacijski stupanj je -1-5.
Atomi oba ova elementa sposobni su vezati tri elektrona, što dovodi do popunjavanja njihove vanjske podljuske; kao rezultat toga nastaju nitridni ioni i fosfidni ioni. Međutim, oba elementa teže stvaranju kovalentnih spojeva. U ovom slučaju, njihovi atomi tvore četiri hibridne orbitale, od kojih svaka ima tetraedarsku orijentaciju (slika 15.13). Tri od ovih orbitala sadrže jedan elektron. Upravo se ti elektroni dijele tijekom stvaranja kovalentnih veza s elektronima drugih atoma. Četvrta orbitala sadrži usamljeni par elektrona. Može se koristiti za stvaranje koordinacijske (donor-akceptorske) veze. Na primjer, u amonijevom ionu, slobodni par dušika preklapa se s praznom -orbitalom vodikovog iona.
ns 2 np 3.
DUŠIK i njegovi spojevi
U prirodi se nalazi u slobodnom obliku (sadržaj u zraku - 78 volumnih %), u obliku minerala (salitra), u ulju, u biljnim i životinjskim bjelančevinama.
Fizička svojstva
U normalnim uvjetima, N 2 je plin bez boje, mirisa i okusa.
t o kip. = -195,8 o C.
Proizvodnja dušika:
a) u industriji - ukapljivanje zraka,
b) u laboratoriju: NH 4 NO 2 ® N 2 + H 2 O.
Kemijska svojstva dušika i njegovih spojeva.
Kemijska aktivnost molekularnog dušika je vrlo niska, jer zahvaljujući trostrukoj kovalentnoj vezi, molekula je vrlo čvrsta (E veza = 946 kJ/mol). Međutim, za dušik je poznato mnogo različitih spojeva, u kojima on pokazuje oksidacijska stanja -3, -2, -1, +1, +2, +3, +4, +5.
Dušikovi spojevi s negativnim oksidacijskim stupnjem.
3
1)NH 3 – amonijak– bezbojni plin oštrog mirisa, lako se ukapljuje.
Proizvodnja amonijaka:
a) N 2 + 3H 2 « 2NH 3 (Kat: Fe, Al 2 O 3, K 2 O)
b) 2NH 4 CI + Ca(OH) 2 = CaCI 2 + 2NH 3 + 2H 2 O
Kemijska svojstva amonijaka:
a) NH 3 + H 2 O « NH 4 OH (maksimalna koncentracija = 25%)
b) NH 3 + HCI « NH 4 CI (don. mehanizam: NH 3 + H + = NH 4 +)
c) izgaranje se odvija različito ovisno o količini kisika:
4NH 3 + 3O 2 (tjedan) = 2N 2 + 6H 2 O
4NH3 + 5O2(g) = 2NO+ 6H2O
d) u OVR, amonijak je uvijek redukcijsko sredstvo:
3CuO + 2NH3 = 3Cu + N2 + 3H2O
2) NH 4 OH – amonijev hidroksid- slaba baza, nestabilna, dobro gradi kompleksne spojeve (amonijak):
Cu(OH)2 + 4NH4OH = (OH)2 + 4H2O
3) Amonijeve soli:
a) otopine uslijed hidrolize imaju blago kiselu reakciju:
NH 4 CI + HON « NH 4 OH + HCI (NH 4 + + HON « NH 4 OH + H +)
b) toplinska razgradnja amonijevih soli odvija se različito ovisno o prirodi aniona: ako je anion oksidacijsko sredstvo, tada je reakcija razgradnje ireverzibilna:
NH4CI «NH3 + HCI
NH4NO3 = N20+ 2H20
4) Amidi nastaju kada se atomi H u amonijaku zamijene metalom:
2K + 2NH3 = 2KNH2 + H2
5) Nitridi poznati su po metalima i nemetalima i ovisno o svojoj prirodi različito se razgrađuju:
a) Li 3 N + 3H 2 O = 3 LiOH + NH 3
Ca3N2 + 6HC1 = 3CaCI2 + 2NH3
b) CI3N + 6HC1 = 3HCIO + NH3
Oksidacijsko stanje – 2
N 2 H 4 – hidrazin(diamid) je bezbojna tekućina, dobro otapalo, manje stabilna od amonijaka.
Priprema hidrazina:
2NH3 + NaCIO = N2H4 + NaCI + H2O
Kemijska svojstva hidrazina:
N 2 H 4 + H 2 O « + +OH -
H 2 O « 2+ +OH -
b) Izgara do dušika: N 2 H 4 + O 2 = N 2 + 2H 2 O
c) Jako redukcijsko sredstvo: N 2 H 4 + 2H 2 O 2 = N 2 + 4H 2 O
Oksidacijsko stanje – 1
NH 2 OH – hidroksilamin, bijela kristalna tvar, zauzima srednji položaj između H 2 O 2 i hidrazina N 2 H 4.
Priprema hidroksilamina:
HNO3 + 6H = NH2OH + 2H20
Kemijska svojstva hidroksilamina:
a) Vodene otopine – slabe baze:
NH 2 OH + H 2 O « + +OH -
b) Hidroksilamonijeve soli (stabilne) dane su s kiselinama:
NH 2 OH + HCI = + + CI -
c) Razgrađuje se (reakcija disproporcioniranja):
3NH2OH = NH3 + N2 + 3H20
d) Kao i H 2 O 2, ovisno o okolini pokazuje redoks dualnost:
u redu: 2NH 2 OH + 4FeSO 4 + 3H 2 SO 4 = 2Fe 2 (SO 4) 3 + (NH 4) 2 SO 4 + 2H 2 O
obnovljeno: 2NH 2 OH + I 2 + 2KOH = N 2 + 2KI + 4H 2 O
Najvažniji dušikovi spojevi s pozitivnim s. O.
Oksidacijsko stanje + 3
1) N 2 O 3- dušikov oksid (III) ili "dušikov anhidrid" je nestabilna plavo-zelena tekućina:
a) N 2 O 3 ® NO 2 (smeđi plin oštrog mirisa) + NO (bezbojni plin);
b) s vodom stvara nestabilnu kiselinu: N 2 O 3 + H 2 O « 2 HNO 2
2) HNO2– dušična kiselina (srednje jakosti):
HNO 2 « H + + NO 2 - (K = 5,1 . 10 -4).
3) Nitriti– soli dušične kiseline, kao i drugi N +3 spojevi u redoks reakcijama, pokazuju dvojnost:
u redu: KNO2 + NH3 = N2 + H2O
obnovljeno: KNO 2 + H 2 O 2 = KNO 3 + H 2 O
Maksimalno oksidacijsko stanje + 5
1) N 2 O 5- dušikov oksid (V) ili "dušikov anhidrid" je bezbojna kristalna tvar; Kada se otopi u vodi daje kiselinu.
2) HNO3– dušična kiselina, jaka: HNO 3 ® H + + NO 3 - .
3) Nitrati– soli dušične kiseline:
a) u laboratoriju možete dobiti N 2 O reakcijom toplinske razgradnje: NH 4 NO 3 ® N 2 O + H 2 O;
b) metalni nitrati se, ovisno o položaju metala u nizu aktivnosti, različito razgrađuju:
lijevo Mg: nitrat ® nitrit + O 2
Mg – Cu: nitrat ® metalni oksid + NO 2 + O 2
desno Cu: nitrat ® metal + NO 2 + O 2 .
4) svi N +5 spojevi su jaki oksidansi; interakcija dušične kiseline s metalima:
a) nijedan metal ne oslobađa vodik iz HNO 3;
b) pri normalnom t o pasiviziraju se metali Al, Zn, Cr, Fe, Pb, Au, Pt;
c) kada se zagrijava, stupa u interakciju s većinom metala, a što je metal aktivniji i što je kiselina razrijeđena, to je jača redukcija N +5:
neaktivan Meh: Cu + 4HNO 3 (konc.) = Cu (NO 3) 2 + 2NO 2 + 2H 2 O
3Cu + 8HNO 3(razrijeđen.) = 3Cu(NO 3) 2 + 2NO + 4H 2 O
imovina. Meh: 4Ca + 10HNO3(konc.) = 4Ca(NO3)2 + N2O + 5H2O
5Ca + 12HNO3 (razrijeđeno) = 5Ca(NO3)2 + N2 + 6H2O
4Ca + 9HNO 3 (ultra razrijeđen) = 4Ca(NO 3) 2 + NH 3 (ili NH 4 NO 3) + 3H 2 O
FOSFOR i njegovi spojevi
U prirodi se nalazi: a) u obliku minerala (fosforiti i apatiti), b) u biljnim i životinjskim bjelančevinama, c) u moždanom tkivu i kostima.
Fizička svojstva
alotropen:
A) bijeli fosfor(P 4) – tetraedarske strukture, otrovan, svijetli u mraku, topiv u ugljikovom disulfidu; tijekom skladištenja postupno prelazi u crveni fosfor, pa se čuva pod vodom;
b) crveni fosfor(P 2 n – polimer) – postoji više oblika strukture, netoksičan, netopljiv u ugljičnom disulfidu, stabilan tijekom skladištenja, manje reaktivan;
V) crni fosfor– piramidalna struktura, slojevita, slična grafitu, poluvodič.
Dobivanje fosfora:
Mineral fosforit je kalciniran s koksom i pijeskom:
Ca 3 (PO 4) + 5C + 3 SiO 2 = 3CaSiO 3 +2P +5CO
Kemijska svojstva fosfora i njegovih spojeva.
Kemijska aktivnost fosfora varira ovisno o njegovoj alotropskoj modifikaciji. Glavna oksidacijska stanja: -3, +1, +3, +5.
1) Reakcije fosfora s jednostavnim tvarima:
obnavljajuća svojstva: a) P + O 2 ® P 2 O 3, P 2 O 5;
b) P + CI 2 ® PCI 3, PCI 5; c) 2P + 3S ® P 2 S 3
oksidacijska svojstva: a) 2P + 3H 2 ® 2RN 3, b) 2P + 3Ca ® Ca 3 P 2
2) Reakcije fosfora sa složenim tvarima:
a) ne dolazi do reakcije s vodom,
b) 2P + 5H2SO4 (konc.)® 2H3PO4 + 5SO2 + 2H2O,
c) P + HNO3 (konc.)® H3PO4 + NO (ili NO2).
3)Minimalno oksidacijsko stanje - 3
A) PH 3– fosfin, otrovni plin s mirisom na češnjak,
lit: 2RH 3 + 4O 2 = R 2 O 5 + 3H 2 O,
s nekim kiselinama daje fosfonijeve soli: RH 3 + HI = RH 4 I
b) metalni fosfidi– ionovalentni spojevi
Mg 3 P 2 + 6 H 2 O = Mg(OH) 2 + 2RN 3,
Ca 3 P 2 + 6HCI = CaCI 2 + 2PH 3.
4)Oksidacijsko stanje + 1
H 3 PO 2 ili H[PO 2 H 2 ] – hipofosforna kiselina, jaka; soli su hipofosfiti, dobro topljivi, dobri redukcijski agensi.
5)Oksidacijsko stanje + 3
a) P 2 O 3 – anhidrid fosfora, ima nekoliko modifikacija (P 2 O 3) n, bezbojni otrovni kristali;
b) H 3 PO 3 ili H 2 [PO 3 H] – fosforna kiselina, srednje jakosti;
c) fosfitne soli, topljive samo u alkalijskim metalima (K 2 [PO 3 H]),
PCI 3 + CI 2 = PCI 5,
PCI 3 + O 2 = PCI 3,
PCI 3 + HCI® N.
6)Maksimalno oksidacijsko stanje +5
a) P 2 O 5 – anhidrid fosfora, bijeli prah, ima modifikaciju (P 2 O 5) 2, jako sredstvo za uklanjanje vode: P 2 O 5 + 2H 2 O = 2HPO 3;
b) HPO 3 - meta, H 4 P 2 O 7 - piro, H 3 PO 4 - ortofosforna kiselina, srednje jakosti;
c) meta-, piro-, orto-fosfatne soli;
d) halogenidi su dosta aktivni:
PCI 5 + 4H 2 O = H 3 PO 4 + 5 HCI,
RF 5 + HF = N.
OPĆE ZNAČAJKE PODSKUPINE
7 N, 15 P, 33 As, 51 Sb, 83 Bi. U podskupini od vrha prema dolje, metalna svojstva prirodno rastu i to je u skladu s vrijednostima oksidacijskih stanja koja pokazuju elementi u spojevima, kao i s nekim fizičkim svojstvima. Iako alotropija P, As i Sb stvara određene poteškoće pri kombiniranju fizičkih svojstava u jednu tablicu:
Tablica 11
Svojstva elemenata pete skupine, glavne podskupine
Kemijska svojstva
1. S jednostavnim tvarima daju niz spojeva, koji pokazuju različite redoks prirode:
a) restorativna svojstva
2P + 3Cl2 = 2PCl3 (ili PCl5);
4As + 5O 2 = 2As 2 O 5;
2Bi + 3Cl 2 = 2BiCl 3.
b) Oksidirajuća svojstva
2P + 3Ca = Ca3P2;
2As + 3Mg = Mg 3 As 2.
2. Različito reagiraju s kiselinama ovisno o prirodi elementa podskupine:
2P + 5H2SO4 = 2H3PO4 + 5SO2 + 2H20;
3As + 5HNO3 + 2H2O = 3H3AsO4 + 5NO;
3Sb + 5HNO3 = 3HSbO3 + 5NO + H2O;
2Sb + 6H2SO4 konc. = Sb2(SO4)3 + 3SO2 + 6H20;
Bi + 4HNO 3 = Bi(NO 3) 3 + NO + 2H 2 O.
Mora se zapamtiti da se elementi podskupine arsena pojavljuju nakon vodika u nizu aktivnosti.
3. Hidroliza spojeva odvija se na različite načine:
a) PCl3 + 3H20 = H3P03 + 3HCl;
BiCl 3 + H 2 O ® BiOCl ¯ + 2HCl.
(SbCl 3) (SbOCl)
b) NaNO 2 + H 2 O Û HNO 2 + NaOH;
K3PO4 + H2O U K2HPO4 + KOH;
K 3 AsO 4 + H 2 O Û K 2 HAsO 4 + KOH.
4. Promjene kiselo-baznih svojstava elemenata manifestiraju se na različite načine
Tablica 12
Najvažniji spojevi elemenata pete podskupine
5. Redoks sposobnost spojeva ovisi o stupnju oksidacije elementa:
A) E -3– redukcijska sredstva
2NH 3 + 6KMnO 4 + 6KOH = 6K 2 MnO 4 + N 2 + 6H 2 O;
2PH 3 + 4O 2 = P 2 O 5 + 3H 2 O.
oksidirajuća sredstva:
2KNO 2 + 4H 2 S = 3S + N 2 + K 2 S + 4H 2 O
E +3 2BiCl 3 + 3SnCl 2 + 18KOH = 2Bi + 3K 2 SnO 3 + 12KCl + 9H 2 O.
redukcijska sredstva:
10KNO 2 +4KMnO 4 +11H 2 SO 4 =10HNO 3 +4MnSO 4 +7K 2 SO 4 +6H 2 O
V) E +5 – oksidirajuća sredstva
Na 3 SbO 4 + 2NaJ + H 2 SO 4 = Na 3 SbO 3 + J 2 + Na 2 SO 4 + H 2 O.
Elementi grupe 6. (Halkogeni)
Struktura elektroničke ljuske: ... ns 2 np 4.
8 O, 16 S, 34 Se, 52 Te, 84 Po (radioaktivan).
KISIK i njegovi spojevi
Najzastupljeniji element na Zemlji: 21% (po volumenu) u zraku, dio H 2 O, minerali i organske tvari.
Fizička svojstva
Postoji u obliku tvari:
a) “kisik” O 2 – plin bez boje, okusa, mirisa, neotrovan; t° prokuhati. = -183°C; ;
b) “ozon” O 3 – plavi plin oštrog mirisa, otrovan, vrlo jak oksidans; t° prokuhati. = -111,8°C.
Kemijska svojstva
1. U samo jednoj reakciji kisik je redukcijsko sredstvo:
O 2 + 2F 2 = 2OF 2 ().
2. U svim ostalim slučajevima kisik je oksidacijsko sredstvo, osobito ako je u atomskom stanju:
a) Oksidacija jednostavnih tvari
2H2 + O2 = 2H20;
S + O2 = SO2;
2Ca + O 2 = 2CaO.
b) Oksidacija složenih tvari
R203 + O2 = R205;
2SO2 + O2 = 2SO3;
2PCl 3 + O 2 = 2POCl 3.
c) Izgaranje složenih anorganskih tvari
2H 2 S + O 2 nedovoljno = 2S + 2H20;
2H2S + 30 2 g. = 2SO2 + 2H20.
d) Izgaranje organskih tvari
CH4 + 202 = CO2 + 2H20;
C2H5OH + 3O2 = 2CO2 + 3H2O.
SUMPOR i njegovi spojevi
Nalazi se u prirodi u svom prirodnom obliku; u obliku minerala (sulfidi, sulfati); u ulju; u bjelančevinama.
Fizička svojstva
Tvrd, krt, žut, netopljiv u H 2 O, ali topiv u ugljičnom disulfidu i anilinu. Alotropni: rombični sumpor (a-forma); monoklinski (b - sumpor); plastika itd. Najstabilnija je modifikacija a (t° pl. » 113°C), pripisuje joj se sastav S 8.
Kemijska svojstva
Spojevi, koji pokazuju različite stupnjeve oksidacije, imaju različite redoks sposobnosti.
Tablica 13
Najvažniji spojevi sumpora
1. Sumpor, u interakciji sa složenim spojevima, mijenja svoje oksidacijsko stanje na različite načine:
a) S + 2H 2 SO 4 konc. = 3S02 + 2H20 ();
b) S + 6HNO 3 konc. = H2S04 + 6NO2 + 2H20 ();
c) 3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
reakcija disproporcioniranja
2. Priključci S-2
A) H2S– sumporovodik, otrovni plin s mirisom pokvarenih jaja, jako redukcijsko sredstvo: 2H 2 S + O 2 = 2S + 2H 2 O;
H2S + Cl2 = 2HCl + S.
b) Otopina H 2 S – slaba kiselina
H 2 S Û N + + HS - (K 1 = 6 × 10 -8).
c) Soli – sulfidi; soli alkalnih i zemnoalkalijskih metala su visoko topljive i hidroliziraju; sulfidi p- i d-metala su praktički netopljivi.
G) Sulfidi izložba metala glavni priroda:
K2S + H2O u KHS + KOH;
Sulfidi nemetala izlažu kiselo priroda:
SiS 2 + 3H 2 O = H 2 SiO 3 + 2H 2 S.
d) Tiosoli: slično običnim solima u kojima su O atomi zamijenjeni S:
Na 2 S + CS 2 = Na 2 CS 3 – natrijev tiokarbonat;
Na 2 CS 3 + 2HCl = 2NaCl + H 2 CS 3
nestabilan
e) Polisulfidi: sumpor, kao i kisik u peroksidima, može tvoriti soli: Otopina Na 2 S + ´S = Na 2 S n - natrijev polisulfid (sadrži sulfidne mostove - S - S - S - S -).
3. S+4 priključci
a) SO 2 – sumporni dioksid oštrog mirisa, otrovan;
b) Otopina SO 2 - sumporna kiselina H 2 SO 3, srednje jakosti
H 2 SO 3 Û H + + HSO 3 - (K 1 = 1,3 × 10 -2);
c) Soli – sulfiti, dobro hidroliziraju
Na 2 SO 3 + H 2 O Û NaHSO 3 + NaOH.
d) U redoks reakcijama svi ovi spojevi pokazuju dualnost:
SO2 + 2H2S = 3S + 2H20;
2SO 2 + O 2 = 2SO 3.
e) tionil klorid: SOCl 2
SOCl2 + 2H20 = H2SO3 + 2HCl.
4. S+6 priključci
A) SO 3– sumporni anhidrid; alotropno, jako oksidirajuće sredstvo. Vrlo burno reagira s vodom
SO3 + H20® H2SO4 + 89,1 kJ/mol;
b) H2SO4– sumporna kiselina, bezbojna uljasta tekućina; snažna.
H2SO4 konc. – vrlo jak oksidans; pougljeni papir, šećer, drvo:
C + 2H2SO4 konc. = CO2 + 2SO2 + 2H2O.
Pojedinačno, njegovo ponašanje s metalima:
na običnim temperaturama ne stupa u interakciju s mnogim metalima (“pasivira” Cr, Fe, Al, Zn, ...);
na povišenim razinama, reagira s gotovo svim metalima osim Au i Pt.
Vrlo je dobro sredstvo za uklanjanje vode jer... s vodom tvori hidrate H 2 SO 4 × nH 2 O:
V) Soli: srednje – K 2 SO 4 (sulfati);
kiseli – KHSO 4 (hidrogensulfati);
vitriol – CuSO 4 × 5H 2 O; ZnSO 4 x 7H20;
stipsa – dvostruke soli, kristalni hidrati
KAl(SO4) 2 x 12H20; NH 4 Fe(SO 4) 2 × 12H 2 O.
G) Oleum– otopina SO 3 u H 2 SO 4, dok se reakcija djelomično odvija
2SO 3 + H 2 O = H 2 S 2 O 7 pirosumporna kiselina.
d) Sulfuril klorid SO2Cl2
SO2Cl2 + 2H20 = H2SO4 + 2HCl.
e) Peroksosumporne kiseline– sadrže peroksidne mostove
H 2 SO 5 – peroksomonosumpor,
H 2 S 2 O 8 – peroksidisulfur;
jaka oksidacijska sredstva.
i) Tiosulfati– sadrže sumpor u različitim oksidacijskim stanjima: S +6 i S -2; zbog prisutnosti S-2, spojevi su jaki redukcijski agensi.
Na 2 S 2 O 3 + Br 2 + H 2 O = 2HBr + S + Na 2 SO 4.
Odgovarajuća kiselina H 2 S 2 O 3 (tiosumporna) je nestabilna:
Na 2 S 2 O 3 + H 2 SO 4 = Na 2 SO 4 + H 2 S 2 O 3.
Elementi skupine 7a. (halogeni )
Struktura elektroničke ljuske: ... ns 2 np 5.
9 F, 17 Cl, 35 Br, 53 J, 85 At (radioaktivan). U slobodnom stanju postoje u obliku dvoatomnih molekula.
Fizička svojstva
Otrovno, oštrog mirisa F 2 – blijedožuti plin, vrelište. = -188,2°C;
Cl 2 – zeleno-žuti plin; t° prokuhati. = -34,1°C;
Br 2 – crvena tekućina; t° prokuhati. = 59,2°C;
J 2 – ljubičasti kristali; t° prokuhati. = +185,5°C.
Kemijska svojstva
1) Najaktivniji je F 2, u njegovoj atmosferi gori čak i staklo i voda:
2F 2 + SiO 2 = SiF 4 + O 2;
2F2 + 2H2O = 4HF + O2.
2) Uzvodni halogeni (kao jači oksidansi) istiskuju nizvodne iz raznih spojeva:
F2 + 2KCl (KBr, KJ) = 2KF + Cl2 (Br 2, J 2).
3) Kada se halogeni otope u vodi i otopinama lužina, dolazi do reakcija disproporcioniranja; Ovisno o temperaturi nastaju različiti produkti reakcije:
Cl2 + H20 = HCl + HClO;
Cl2 + 2NaOH = NaCl + NaClO;
4) Vodikovi halogenidi– svi su bezbojni plinovi (HF, zbog vodikovih veza, tvori asocijate H x F x).
U seriji: HF – HCl – HBr – HJ, snaga veze se smanjuje, a redukcijska svojstva rastu:
MnO 2 + 4HCl = Cl 2 + MnCl 2 + 2H 2 O ().
5) Kada se otopi u vodi, dobivaju se jake kiseline; HJ je najjači (s izuzetkom slabe fluorovodične kiseline:
H 2 F 2 Û H + + HF 2 -)
6) Halidi elementi imaju različit kiselo-bazni karakter, što se očituje:
a) u reakcijama hidrolize
AlCl3 + H2O Û AlOHCl2 + HCl;
PBr3 + 3H2O = H3PO3 + 3HBr.
b) u reakcijama stvaranja kompleksa
2NaF + SiF4® Na2;
za niz liganada F-; Cl-; Br - ; J - smanjuje se stabilnost kompleksa.
7) Halogeni u višim oksidacijskim stupnjevima
a) oksidi: Cl 2 O; (ClO2) 2; (ClO3) 2; Cl207;
b) kiseline: HClO; HClO2; HClO3; HClO4;
za niz kiselina ® snaga se povećava, za kiseline i njihove soli u istom nizu oksidacijska svojstva se smanjuju.
c) kiseline i njihove soli zagrijavanjem se raspadaju:
d) spojevi između halogena: poznati su mnogi; Sastav odgovara položaju elemenata u periodnom sustavu (više elektronegativnih elemenata pojavljuje se na kraju formula):
ClF, BrF, JF; ClF 3, JF 3; ClF 5, ClOF 3; BrF 7, JO 3 F, itd.;
su kisele prirode: JF 7 + 4H 2 O = 7HF + HJO 4;
ClO 3 F + 2NaOH = NaClO 4 + NaF + H 2 O.
Pitanja za konsolidaciju materijala:
1. Koja tvar nastaje kada arsen reagira s koncentriranom dušičnom kiselinom - a)As(NO3)3? b) H 3 AsO 4? c) Kao 2 O 3?
2.Koja tvar reagira s koncentriranom kiselinom pri čemu se oslobađa slobodni klor – a)CaC1 2? b) MnO 2? c) CrC1 3 ?