समूह V-A के तत्वों की सामान्य विशेषताएँ। समूह V के P-तत्व मुख्य उपसमूह के समूह 5 के तत्वों की अधिकतम संयोजकता
तत्वों की समानताएँ:
परमाणुओं की बाहरी इलेक्ट्रॉनिक परत की समान संरचना एनएस 2 एनपी 3;
पी-तत्व;
ऊँचा गाँव ओ +5 के बराबर;
निचला एस. ओ -3 के बराबर (एसबी और बीआई के लिए अस्वाभाविक)।
समूह V के मुख्य उपसमूह के तत्वों के लिए, समूह नाम "पनिक्टोजेन्स" का उपयोग कभी-कभी किया जाता है, जिसे "हैलोजन" और "चेल्कोजेन्स" शब्दों के साथ सादृश्य द्वारा पेश किया जाता है और फॉस्फोरस पी और नाइट्रोजन एन तत्वों के प्रतीकों से लिया गया है।
परमाणुओं की संयोजकता अवस्थाएँ
P, As, Sb, Bi परमाणुओं के लिए, 2 संयोजकता अवस्थाएँ संभव हैं:
बेसिक एनएस 2 एनपी 3
हॉर्नी एनएस 1 एनपी 3 एन डी 1
नाइट्रोजन और उपसमूह के अन्य तत्वों के बीच अंतर
1. नाइट्रोजन परमाणु में बाहरी इलेक्ट्रॉनिक परत में डी-ऑर्बिटल्स की अनुपस्थिति के कारण, विनिमय तंत्र के अनुसार नाइट्रोजन परमाणु द्वारा गठित सहसंयोजक बंधों की संख्या 3 से अधिक नहीं हो सकती है।
2. नाइट्रोजन परमाणु के 2s उपस्तर पर एक अकेले इलेक्ट्रॉन जोड़े की उपस्थिति दाता-स्वीकर्ता तंत्र के माध्यम से एक सहसंयोजक बंधन बनाना संभव बनाती है। इस प्रकार, N की उच्चतम संयोजकता IV है।
3. ऑक्सीजन के साथ यौगिकों में, नाइट्रोजन ऑक्सीकरण अवस्थाएँ +1, +2, +3, +4, +5 प्रदर्शित करता है।
तत्वों और उनसे बनने वाले पदार्थों के गुणों में ऊर्ध्वाधर परिवर्तन
हैलोजन और चाकोजेन के विपरीत, समूह V के मुख्य उपसमूह में नाभिक के आवेश और परमाणुओं की त्रिज्या बढ़ने पर तत्वों और उनके द्वारा बनने वाले सरल पदार्थों के गुणों में अधिक नाटकीय परिवर्तन होता है:
तत्वों और उनसे बनने वाले सरल पदार्थों के गुणों में ऊर्ध्वाधर परिवर्तन |
|||||
nonmetals |
गैर-धात्विकता के कुछ लक्षणों के साथ धातु |
||||
ऑक्साइड और हाइड्रॉक्साइड |
नाइट्रोजन और इसके ऑक्सीजन यौगिकों को कई अंतरों के कारण अलग-अलग माना जाता है। |
||||
ई 2 ओ 3 और संबंधित हाइड्रॉक्साइड |
पी 2 ओ 3 (पी 4 ओ 6) एसिड ऑक्साइड |
उभयचरता के लक्षण के साथ 2 ओ 3 अम्लीय ऑक्साइड के रूप में |
एसबी 2 ओ 3 एम्फोटेरिक ऑक्साइड |
Bi 2 O 3 मूल ऑक्साइड |
|
ई 2 ओ 5 और संबंधित हाइड्रॉक्साइड |
पी 2 ओ 5 (पी 4 ओ 10) एसिड ऑक्साइड |
2 O 5 एसिड ऑक्साइड के रूप में |
एसबी 2 ओ 5 एसिड ऑक्साइड |
द्वि 2 ओ 5 उभयचर नाजुक |
|
एचपीओ 3 (एच 3 पीओ 4) |
|||||
कमजोर अम्ल |
|||||
एसिड गुण कमजोर हो जाते हैं |
|||||
मूल गुणों में वृद्धि होती है |
|||||
हाइड्रोजन यौगिक EN 3
समूह V के मुख्य उपसमूह के तत्व हाइड्रोजन के साथ वाष्पशील यौगिक बनाते हैं, जो विशिष्ट गंध वाली जहरीली गैसें हैं। वे मजबूत कम करने वाले एजेंट हैं। समूह VII और VI के गैर-धातुओं के हाइड्रोजन यौगिकों के विपरीत, वे जलीय घोल में H + आयन नहीं बनाते हैं, अर्थात, वे अम्लीय गुण प्रदर्शित नहीं करते हैं।
तत्वों के 5वें समूह की सामान्य विशेषताएँ।
आवर्त सारणी के मुख्य उपसमूह V 0 01 F में नाइट्रोजन, फास्फोरस, आर्सेनिक, सुरमा और बिस्मथ शामिल हैं। परमाणु की बाहरी परत में पाँच इलेक्ट्रॉनों वाले इन तत्वों की सामान्य विशेषताएँ होती हैं
अधातुओं की तरह. हालाँकि, इलेक्ट्रॉनों को जोड़ने की उनकी क्षमता समूह VI और VII के संबंधित तत्वों की तुलना में बहुत कम स्पष्ट है। पांच बाहरी इलेक्ट्रॉनों की उपस्थिति के कारण, इस उपसमूह के तत्वों का उच्चतम सकारात्मक ऑक्सीकरण -5 है, और नकारात्मक - 3. अपेक्षाकृत कम इलेक्ट्रोनगेटिविटी के कारण, हाइड्रोजन के साथ प्रश्न में तत्वों का बंधन कम ध्रुवीय है समूह VI और VII के तत्वों का हाइड्रोजन के साथ बंधन। इसलिए, इन तत्वों के हाइड्रोजन यौगिक जलीय घोल में हाइड्रोजन आयन एच को खत्म नहीं करते हैं, और इस प्रकार उनमें अम्लीय गुण नहीं होते हैं। नाइट्रोजन उपसमूह के तत्वों के भौतिक एवं रासायनिक गुण बदलते रहते हैं
0 0 1 क्रम संख्या को उसी क्रम में बढ़ाना जिसमें देखा गया था
0 0 1 पहले माने गए समूहों के लिए, लेकिन चूंकि गैर-धातु गुण व्यक्त किए गए हैं
ऑक्सीजन और विशेष रूप से फ्लोरीन की तुलना में कमजोर, तो निम्नलिखित तत्वों के 0 0 1 एफ में संक्रमण के दौरान इन गुणों के कमजोर होने से धातु गुणों की उपस्थिति और वृद्धि होती है।
आर्सेनिक में उत्तरार्द्ध पहले से ही ध्यान देने योग्य हैं, एंटीमोनी में दोनों गुण लगभग समान रूप से होते हैं, और बिस्मथ में धातु गुण गैर-धातु गुणों पर प्रबल होते हैं। तत्वों का विवरण. नाइट्रोजन(ग्रीक एज़ोस से - बेजान, अव्य। नाइट्रोजनियम), एन, रासायनिक तत्व वी
मेंडेलीव की आवधिक प्रणाली के समूह, परमाणु क्रमांक 7, परमाणु द्रव्यमान 14.0067; रंगहीन गैस, गंधहीन और स्वादहीन। ऐतिहासिक सन्दर्भ. नाइट्रोजन यौगिक - सॉल्टपीटर, नाइट्रिक एसिड, अमोनिया - थे
मुक्त अवस्था में नाइट्रोजन के उत्पादन से बहुत पहले से जाना जाता था। 1772 में, डी. रदरफोर्ड ने फॉस्फोरस और अन्य पदार्थों को कांच की घंटी में जलाकर दिखाया कि दहन के बाद बची हुई गैस, जिसे उन्होंने "दम घोंटने वाली हवा" कहा, श्वसन और दहन का समर्थन नहीं करती है। 1787 में, ए. लावोइसियर ने स्थापित किया कि हवा बनाने वाली "महत्वपूर्ण" और "दम घोंटने वाली" गैसें सरल पदार्थ हैं, और "नाइट्रोजन" नाम प्रस्तावित किया। 1784 में, जी. कैवेंडिश ने दिखाया कि नाइट्रोजन साल्टपीटर का हिस्सा है; यहीं से लैटिन नाम नाइट्रोजन आता है (लैटिन लैटिन नाइट्रम से - साल्टपीटर और ग्रीक गेनाओ - मैं जन्म देता हूं, मैं पैदा करता हूं), 1790 में जे. ए. चैप्टल द्वारा प्रस्तावित। 19वीं सदी की शुरुआत तक. मुक्त अवस्था में नाइट्रोजन की रासायनिक जड़ता और बाध्य नाइट्रोजन के रूप में अन्य तत्वों के साथ यौगिकों में इसकी विशिष्ट भूमिका को स्पष्ट किया गया। तब से, वायु नाइट्रोजन का "बंधन" रसायन विज्ञान की सबसे महत्वपूर्ण तकनीकी समस्याओं में से एक बन गया है। प्रकृति में व्यापकता. नाइट्रोजन सबसे आम तत्वों में से एक है
पृथ्वी, और इसका द्रव्यमान (लगभग 4´1015) टी) वायुमंडल में स्वतंत्र अवस्था में संकेंद्रित है। हवा में, मुक्त नाइट्रोजन (एन2 अणुओं के रूप में) आयतन के हिसाब से 78.09% (या द्रव्यमान के हिसाब से 75.6%) है, इसमें अमोनिया और ऑक्साइड के रूप में छोटी अशुद्धियाँ शामिल नहीं हैं। स्थलमंडल में औसत नाइट्रोजन सामग्री द्रव्यमान के अनुसार 1.9´10-3% है। प्राकृतिक नाइट्रोजन यौगिक. - अमोनियम क्लोराइड NH4Cl और विभिन्न नाइट्रेट (देखें)।
साल्टपीटर।) साल्टपीटर का बड़ा संचय शुष्क रेगिस्तानी जलवायु (चिली, मध्य एशिया) की विशेषता है। लंबे समय तक, नाइट्रेट उद्योग के लिए नाइट्रोजन का मुख्य आपूर्तिकर्ता था (अब नाइट्रोजन निर्धारण के लिए वायु नाइट्रोजन और हाइड्रोजन से अमोनिया का औद्योगिक संश्लेषण प्राथमिक महत्व का है)। स्थिर नाइट्रोजन की थोड़ी मात्रा कोयले (1-2.5%) और तेल (0.02-1.5%) के साथ-साथ नदियों, समुद्रों और महासागरों के पानी में पाई जाती है। नाइट्रोजन मिट्टी (0.1%) और जीवित जीवों (0.3%) में जमा होती है।
यद्यपि "नाइट्रोजन" नाम का अर्थ "गैर-जीवन-निर्वाह" है, यह वास्तव में जीवन के लिए एक आवश्यक तत्व है। पशु और मानव प्रोटीन में 16 - 17% नाइट्रोजन होता है। मांसाहारी जानवरों के जीवों में प्रोटीन का निर्माण शाकाहारी जानवरों के जीवों और पौधों में मौजूद उपभोग किए गए प्रोटीन पदार्थों के कारण होता है। पौधे मिट्टी में निहित नाइट्रोजनयुक्त पदार्थों, मुख्यतः अकार्बनिक, को आत्मसात करके प्रोटीन का संश्लेषण करते हैं। नाइट्रोजन-फिक्सिंग सूक्ष्मजीवों के कारण नाइट्रोजन की महत्वपूर्ण मात्रा मिट्टी में प्रवेश करती है जो हवा से मुक्त नाइट्रोजन को नाइट्रोजन यौगिकों में परिवर्तित करने में सक्षम हैं। प्रकृति में नाइट्रोजन चक्र होता है, जिसमें मुख्य भूमिका निभाती है
सूक्ष्मजीव - नाइट्रोफ़िंग, डेनिट्रोफ़िंग, नाइट्रोजन-फिक्सिंग, आदि। हालांकि, पौधों द्वारा मिट्टी से स्थिर नाइट्रोजन की भारी मात्रा में निष्कर्षण (विशेष रूप से गहन खेती के साथ) के परिणामस्वरूप, मिट्टी में नाइट्रोजन की कमी हो जाती है। नाइट्रोजन की कमी लगभग सभी देशों में कृषि के लिए विशिष्ट है; नाइट्रोजन की कमी पशुपालन ("प्रोटीन भुखमरी") में भी देखी जाती है। उपलब्ध नाइट्रोजन की कमी वाली मिट्टी पर, पौधे खराब रूप से विकसित होते हैं। नाइट्रोजन उर्वरक और पशुओं का प्रोटीन आहार कृषि को बढ़ावा देने का सबसे महत्वपूर्ण साधन है। मानव आर्थिक गतिविधियाँ नाइट्रोजन चक्र को बाधित करती हैं। इस प्रकार, ईंधन जलाने से वातावरण नाइट्रोजन से समृद्ध होता है, और उर्वरक बनाने वाली फ़ैक्टरियाँ हवा से नाइट्रोजन बांधती हैं। उर्वरकों और कृषि उत्पादों के परिवहन से पृथ्वी की सतह पर नाइट्रोजन का पुनर्वितरण होता है। नाइट्रोजन सौर मंडल में चौथा सबसे प्रचुर तत्व है (हाइड्रोजन के बाद,
हीलियम और ऑक्सीजन)। आइसोटोप, परमाणु, अणु. प्राकृतिक नाइट्रोजन में दो स्थिर समस्थानिक होते हैं: 14N
(99.635%) और 15एन (0.365%)। 15N आइसोटोप का उपयोग रासायनिक और जैव रासायनिक अनुसंधान में एक लेबल परमाणु के रूप में किया जाता है। नाइट्रोजन के कृत्रिम रेडियोधर्मी समस्थानिकों में से, 13N का आधा जीवन सबसे लंबा है (T1/2 - 10.08) मिन), बाकी बहुत अल्पकालिक हैं। वायुमंडल की ऊपरी परतों में, ब्रह्मांडीय विकिरण से न्यूट्रॉन के प्रभाव में, 14N रेडियोधर्मी कार्बन आइसोटोप 14C में बदल जाता है। इस प्रक्रिया का उपयोग 14C उत्पन्न करने के लिए परमाणु प्रतिक्रियाओं में भी किया जाता है। नाइट्रोजन परमाणु का बाहरी इलेक्ट्रॉन आवरण। इसमें 5 इलेक्ट्रॉन होते हैं (एक अकेला जोड़ा और तीन अयुग्मित - विन्यास 2)। एस 22पी 3). अधिकतर नाइट्रोजन। यौगिकों में यह अयुग्मित इलेक्ट्रॉनों के कारण 3-सहसंयोजक होता है (जैसे अमोनिया NH3 में)। इलेक्ट्रॉनों की एक अकेली जोड़ी की उपस्थिति से एक और सहसंयोजक बंधन का निर्माण हो सकता है, और नाइट्रोजन 4-सहसंयोजक बन जाती है (जैसा कि अमोनियम आयन NH4+ में होता है)। नाइट्रोजन ऑक्सीकरण अवस्थाएँ +5 (N205 में) से -3 (NH3 में) तक भिन्न होती हैं। सामान्य परिस्थितियों में, मुक्त अवस्था में, नाइट्रोजन एक N2 अणु बनाता है, जहाँ N परमाणु तीन सहसंयोजक बंधों से जुड़े होते हैं। नाइट्रोजन अणु बहुत स्थिर है: परमाणुओं में इसकी पृथक्करण ऊर्जा 942.9 है केजे/मोल (225,2 किलो कैलोरी/मोल), इसलिए भी साथ टीनाइट्रोजन पृथक्करण की लगभग 3300°C डिग्री। केवल 0.1% के आसपास है. भौतिक और रासायनिक गुण। नाइट्रोजन हवा से थोड़ा हल्का है; घनत्व 1.2506 किलोग्राम/
एम3(0°C और 101325 पर एन/एम2या 760 एमएमएचजी कला।), टीपीएल-209.86°C, उबालना-195.8?सी. A. कठिनाई से द्रवित होता है: इसका क्रांतिक तापमान काफी कम (-147.1 डिग्री सेल्सियस) है, और इसका क्रांतिक दबाव 3.39 अधिक है एमएन/एम2 (34,6 केजीएफ/सेमी2); तरल नाइट्रोजन का घनत्व 808 किग्रा(एम3.नाइट्रोजन ऑक्सीजन की तुलना में पानी में कम घुलनशील है: 1 में 0°C पर एम3 H2O 23.3 में घुल जाता है जीनाइट्रोजन। नाइट्रोजन पानी की तुलना में कुछ हाइड्रोकार्बन में अधिक घुलनशील है। केवल सक्रिय धातुओं जैसे लिथियम, कैल्शियम, मैग्नीशियम, नाइट्रोजन के साथ
अपेक्षाकृत कम तापमान पर गर्म करने पर परस्पर क्रिया करता है। नाइट्रोजन उच्च तापमान पर और उत्प्रेरकों की उपस्थिति में अधिकांश अन्य तत्वों के साथ प्रतिक्रिया करता है। ऑक्सीजन के साथ नाइट्रोजन के यौगिकों N2O, NO, N2O3, NO2 और N2O5 का अच्छी तरह से अध्ययन किया गया है। उनसे, तत्वों (4000°C) के सीधे संपर्क के दौरान, NO ऑक्साइड बनता है, जो ठंडा होने पर आसानी से NO2 डाइऑक्साइड में ऑक्सीकृत हो जाता है। वायुमंडलीय निर्वहन के दौरान हवा में नाइट्रोजन ऑक्साइड बनते हैं। इन्हें नाइट्रोजन और ऑक्सीजन के मिश्रण को आयनकारी विकिरण के संपर्क में लाकर भी प्राप्त किया जा सकता है। जब नाइट्रोजन युक्त N2O3 और
नाइट्रिक एनहाइड्राइड्स N2O5 क्रमशः नाइट्रस एसिड HNO2 और नाइट्रिक एसिड HNO3 का उत्पादन करते हैं, जिससे लवण बनते हैं - नाइट्राइट और नाइट्रेट। नाइट्रोजन केवल उच्च तापमान पर और उत्प्रेरक की उपस्थिति में हाइड्रोजन के साथ संयोजित होती है और अमोनिया NH3 का निर्माण होता है। अमोनिया के अलावा, हाइड्रोजन के साथ नाइट्रोजन के कई अन्य यौगिक ज्ञात हैं, उदाहरण के लिए, हाइड्राज़ीन H2N-NH2, डायमाइड HN-NH, हाइड्रोनिट्रिक एसिड HN3(H-N-NºN), ऑक्टाज़ोन N8H14, आदि; अधिकांश नाइट्रोजन और हाइड्रोजन यौगिक केवल कार्बनिक व्युत्पन्न के रूप में पृथक होते हैं। नाइट्रोजन हैलोजन के साथ सीधे संपर्क नहीं करता है, इसलिए सभी नाइट्रोजन हैलाइड केवल अप्रत्यक्ष रूप से प्राप्त होते हैं, उदाहरण के लिए, नाइट्रोजन फ्लोराइड NF3- जब फ्लोरीन अमोनिया के साथ प्रतिक्रिया करता है। एक नियम के रूप में, नाइट्रोजन हैलाइड कम-स्थिर यौगिक होते हैं (NF3 के अपवाद के साथ); नाइट्रोजन ऑक्सीहैलाइड अधिक स्थिर होते हैं - NOF, NOCI, NOBr, N02F और NO2CI। नाइट्रोजन सीधे सल्फर के साथ भी संयोजित नहीं होती है; नाइट्रोजनयुक्त सल्फर N4S4 अमोनिया के साथ तरल सल्फर की प्रतिक्रिया के परिणामस्वरूप प्राप्त होता है। जब गर्म कोक नाइट्रोजन के साथ प्रतिक्रिया करता है, तो सायनोजेन (CN) बनता है।; नाइट्रोजन को एसिटिलीन C2H2 के साथ 1500°C तक गर्म करके हाइड्रोजन साइनाइड HCN प्राप्त किया जा सकता है। उच्च तापमान पर धातुओं के साथ नाइट्रोजन की परस्पर क्रिया से नाइट्राइड का निर्माण होता है (उदाहरण के लिए, Mg3N2)। जब साधारण नाइट्रोजन को विद्युत् निर्वहन के संपर्क में लाया जाता है [दबाव 130 - 270 एन/एम2(1- 2
एमएमएचजी)] या बी, टीआई, एमजी और सीए नाइट्राइड के अपघटन के दौरान, साथ ही हवा में विद्युत निर्वहन के दौरान, सक्रिय नाइट्रोजन का गठन किया जा सकता है, जो बढ़ी हुई ऊर्जा आरक्षित के साथ नाइट्रोजन अणुओं और परमाणुओं का मिश्रण है। आणविक नाइट्रोजन के विपरीत, सक्रिय नाइट्रोजन ऑक्सीजन, हाइड्रोजन, सल्फर वाष्प, फास्फोरस और कुछ धातुओं के साथ बहुत ऊर्जावान रूप से संपर्क करता है। नाइट्रोजन कई महत्वपूर्ण कार्बनिक यौगिकों (एमाइन,
अमीनो एसिड, नाइट्रो यौगिक, आदि)। रसीद एवं आवेदन. प्रयोगशाला में नाइट्रोजन आसानी से प्राप्त की जा सकती है
अमोनियम नाइट्राइट के सांद्रित घोल को गर्म करना: NH4NO2 - N2 + 2H2O। नाइट्रोजन के उत्पादन की तकनीकी विधि पूर्व-तरलीकृत हवा को अलग करने पर आधारित है, जिसे बाद में आसवन के अधीन किया जाता है। निकाले गए मुक्त नाइट्रोजन का मुख्य भाग औद्योगिक उपयोग के लिए उपयोग किया जाता है
अमोनिया का उत्पादन, जिसे बाद में महत्वपूर्ण मात्रा में नाइट्रिक एसिड, उर्वरक, विस्फोटक आदि में संसाधित किया जाता है। तत्वों से अमोनिया के प्रत्यक्ष संश्लेषण के अलावा, साइनामाइड विधि 1905 में विकसित हुई, इस तथ्य के आधार पर कि 1000 डिग्री सेल्सियस पर कैल्शियम कार्बाइड होता है (एक विद्युत भट्टी में चूने और कोयले के मिश्रण को गर्म करने से प्राप्त) मुक्त नाइट्रोजन के साथ प्रतिक्रिया करता है: CaC2 + N2 = CaCN2 + C. परिणामी कैल्शियम साइनामाइड अत्यधिक गर्म जल वाष्प की क्रिया के तहत विघटित हो जाता है, जिससे अमोनिया निकलता है:
CaCN+3H2O=CaCO3+2NH3.
मुक्त नाइट्रोजन का उपयोग कई उद्योगों में किया जाता है: विभिन्न रासायनिक और धातुकर्म प्रक्रियाओं में एक अक्रिय माध्यम के रूप में, पारा थर्मामीटर में खाली स्थान भरने के लिए, ज्वलनशील तरल पदार्थ पंप करते समय, आदि। तरल नाइट्रोजन का उपयोग विभिन्न प्रशीतन इकाइयों में किया जाता है। इसे स्टील के देवार जहाजों में, नाइट्रोजन गैस को संपीड़ित रूप में - सिलेंडरों में संग्रहीत और परिवहन किया जाता है। कई नाइट्रोजन यौगिकों का व्यापक रूप से उपयोग किया जाता है; प्रथम विश्व युद्ध के बाद स्थिर नाइट्रोजन का उत्पादन तेजी से विकसित होना शुरू हुआ और अब भारी अनुपात में पहुंच गया है।
फास्फोरस(अव्य. फॉस्फोरस), पी, मेंडेलीव की आवधिक प्रणाली के समूह V का रासायनिक तत्व, परमाणु क्रमांक 15, परमाणु द्रव्यमान 30.97376, अधातु। प्राकृतिक फास्फोरस में एक स्थिर आइसोटोप, 31P होता है; छह कृत्रिम रेडियोधर्मी आइसोटोप प्राप्त किए गए: 28P ( टी1/2 - 6,27 सेकंड), 29पी ( टी1/2 - 4.45 सेकंड); 30पी ( टी1/2 - 2,55 मिन), 31पी ( टी1/2
14,22 दिन), 32पी ( टी1/2 - 25 दिन), 33पी ( टी1/2 - 12,5 सेकंड). 32P का मान सबसे अधिक है , महत्वपूर्ण बी-विकिरण ऊर्जा रखने वाला और एक लेबल परमाणु के रूप में रासायनिक और जैव रासायनिक अनुसंधान में उपयोग किया जाता है। ऐतिहासिक सन्दर्भ. कुछ साहित्यिक आंकड़ों के अनुसार, प्राप्त करने की विधि
फास्फोरस अरबों को पहले से ही ज्ञात था। 12वीं सदी के कीमियागर। लेकिन फॉस्फोरस की खोज के लिए आम तौर पर स्वीकृत तिथि 1669 मानी जाती है, जब एच. ब्रांड (जर्मनी) ने मूत्र के वाष्पीकरण से प्राप्त सूखे अवशेषों को रेत के साथ कैल्सीन करके और बाद में हवा की पहुंच के बिना आसवन करके एक ऐसा पदार्थ प्राप्त किया जो चमकता है। अंधेरा, जिसे पहले "ठंडी आग" कहा जाता था, और बाद में ग्रीक से फॉस्फोरस। फॉस्फोरस - चमकदार। जल्द ही फास्फोरस प्राप्त करने की विधि उन्हें ज्ञात हो गई। रसायनज्ञ - आई. क्राफ्ट, आई. कुंकेल; 1682 में यह विधि प्रकाशित हुई। 1743 में, ए.एस. मार्गग्राफ ने फॉस्फोरस के उत्पादन के लिए निम्नलिखित विधि विकसित की: लेड क्लोराइड और मूत्र के मिश्रण को सूखने तक वाष्पित किया गया और तब तक गर्म किया गया जब तक कि अस्थिर उत्पादों का निकलना बंद नहीं हो गया; अवशेषों को पाउडर चारकोल के साथ मिलाया गया और मिट्टी के रिटॉर्ट में आसुत किया गया; फॉस्फोरस वाष्प पानी के साथ रिसीवर में संघनित होता है। कोयले के साथ हड्डी की राख को कैल्सीन करके फास्फोरस प्राप्त करने की सबसे सरल विधि केवल 1771 में के. शीले द्वारा प्रस्तावित की गई थी। फॉस्फोरस की तात्विक प्रकृति ए. लावोइसियर द्वारा स्थापित की गई थी। 19वीं सदी के दूसरे भाग में. रिटॉर्ट भट्टियों में फॉस्फोराइट्स से फॉस्फोरस का औद्योगिक उत्पादन शुरू हुआ; 20वीं सदी की शुरुआत में. उनकी जगह इलेक्ट्रिक ओवन ने ले ली। प्रकृति में वितरण. पृथ्वी की पपड़ी में औसत फास्फोरस सामग्री (क्लार्क) -
वजन के हिसाब से 9.3×10-2%; मध्यम चट्टानों में 1.6×10-1, बुनियादी चट्टानों में 1.4×10-1, ग्रेनाइट और अन्य अम्लीय आग्नेय चट्टानों में कम - 7×10-2 और अल्ट्राबेसिक चट्टानों (मेंटल) में और भी कम - 1, 7×10-2% ; तलछटी चट्टानों में 1.7×10-2 (बलुआ पत्थर) से 4×10-2% (कार्बोनेट चट्टानें) तक। फॉस्फोरस मैग्मैटिक प्रक्रियाओं में भाग लेता है और जीवमंडल में तीव्रता से प्रवास करता है। दोनों प्रक्रियाएं इसके बड़े संचय से जुड़ी हैं, जिससे एपेटाइट्स और फॉस्फोराइट्स के औद्योगिक भंडार बनते हैं . फास्फोरस एक अत्यंत महत्वपूर्ण बायोजेनिक तत्व है; यह कई जीवों द्वारा संचित होता है। पृथ्वी की पपड़ी में फॉस्फोरस सांद्रता की कई प्रक्रियाएँ बायोजेनिक प्रवासन से जुड़ी हैं। फास्फोरस अघुलनशील खनिजों के रूप में पानी से आसानी से अवक्षेपित हो जाता है या जीवित पदार्थ द्वारा पकड़ लिया जाता है। अत: समुद्री जल में केवल 7×10-6% फॉस्फोरस होता है। लगभग 180 फॉस्फोरस खनिज ज्ञात हैं, मुख्य रूप से विभिन्न फॉस्फेट, जिनमें से कैल्शियम फॉस्फेट सबसे आम हैं . भौतिक गुण। मौलिक फास्फोरस कई रूपों में मौजूद है
एलोट्रोपिक संशोधन, जिनमें से मुख्य सफेद, लाल और काले हैं। सफेद फास्फोरस एक विशिष्ट गंध वाला मोम जैसा पारदर्शी पदार्थ है, जो फास्फोरस वाष्प के संघनन से बनता है। अशुद्धियों की उपस्थिति में सफेद फास्फोरस - लाल फास्फोरस, आर्सेनिक, लौह, आदि के निशान। - पीले रंग से रंगा हुआ, इसलिए वाणिज्यिक सफेद फास्फोरस। पीला कहा जाता है. सफेद फास्फोरस के दो रूप हैं: ए- और बी-फॉर्म। ए- संशोधन घन प्रणाली के क्रिस्टल का प्रतिनिधित्व करता है ( ए- 18.5); घनत्व 1.828 जी/सेमी3, टीपीएल 44.1 डिग्री सेल्सियस, टीकिप 280.5 डिग्री सेल्सियस, संलयन की गर्मी 2.5 केजे/मोलपी4 (0.6 किलो कैलोरी/मोलपी4), वाष्पीकरण की ऊष्मा 58.6 केजे/मोलपी4(14.0 किलो कैलोरी/मोलपी4) , 25 डिग्री सेल्सियस पर भाप का दबाव 5.7 एन/एम2 (0,043 एमएमएचजी कला।). 0 से 44 डिग्री सेल्सियस के तापमान रेंज में रैखिक विस्तार का गुणांक 12.4 × 10-4 है , तापीय चालकता 0.56 मंगल/(एम×K) 25 डिग्री सेल्सियस पर। सफेद फास्फोरस के विद्युत गुण. डाइलेक्ट्रिक्स के करीब: बैंड गैप लगभग 2.1 ईवी,विद्युत प्रतिरोधकता 1.54×1011 ओम× सेमी,प्रतिचुंबकीय, विशिष्ट चुंबकीय संवेदनशीलता - 0.86×10-6. बैगन कठोरता 6 एमएन/एम2 (0,6 केजीएफ/एमएम2). सफेद फॉस्फोरस का ए-रूप कार्बन डाइसल्फ़ाइड में अच्छी तरह से घुल जाता है, तरल अमोनिया, बेंजीन, कार्बन टेट्राक्लोराइड आदि में कम अच्छी तरह से घुल जाता है। - 76.9 डिग्री सेल्सियस और 0.1 के दबाव पर एमएन/एम2(1केजीएफ/सेमी2) ए-फॉर्म कम तापमान वाले बी-फॉर्म (घनत्व 1.88) में बदल जाता है जी/सेमी3). दबाव 1200 तक बढ़ने के साथ एमएन/एम2(12 हजार केजीएफ/सेमी2) संक्रमण 64.5 डिग्री सेल्सियस पर होता है। बी-फॉर्म - द्विअर्थी क्रिस्टल, उनकी संरचना निश्चित रूप से स्थापित नहीं की गई है। सफेद फास्फोरस जहरीला होता है: हवा में लगभग 40 डिग्री सेल्सियस के तापमान पर
स्वयं प्रज्वलित होता है, इसलिए इसे पानी के नीचे संग्रहित किया जाना चाहिए (पानी में घुलनशीलता 25 डिग्री सेल्सियस पर 3.3 × 10-4%) . सफेद फास्फोरस को बिना हवा के 250-300 डिग्री सेल्सियस पर कई घंटों तक गर्म करने से लाल फास्फोरस प्राप्त होता है। संक्रमण एक्ज़ोथिर्मिक है, पराबैंगनी किरणों के साथ-साथ अशुद्धियों (आयोडीन, सोडियम, सेलेनियम) द्वारा त्वरित होता है। साधारण वाणिज्यिक लाल फास्फोरस लगभग पूरी तरह से अनाकार है; इसका रंग गहरे भूरे से बैंगनी तक होता है। लंबे समय तक गर्म करने पर, यह अपरिवर्तनीय रूप से विभिन्न गुणों वाले क्रिस्टलीय रूपों (ट्राइक्लिनिक, क्यूबिक, आदि) में से एक में बदल सकता है: घनत्व 2.0 से 2.4 तक जी/सेमी 3, टीकई दसियों वायुमंडल के दबाव पर पीएल 585 से 610 डिग्री सेल्सियस तक, ऊर्ध्वपातन तापमान 416 से 423 डिग्री सेल्सियस तक, विद्युत प्रतिरोधकता 109 से 1014 तक ओम× सेमी।लाल फास्फोरस हवा में स्वतः प्रज्वलित नहीं होता है; 240-250 डिग्री सेल्सियस के तापमान तक, लेकिन घर्षण या प्रभाव पर स्वयं प्रज्वलित हो जाता है; पानी में अघुलनशील, साथ ही बेंजीन, कार्बन डाइसल्फ़ाइड आदि में, फॉस्फोरस ट्राइब्रोमाइड में घुलनशील। उर्ध्वपातन तापमान पर, लाल फास्फोरस वाष्प में बदल जाता है, ठंडा होने पर मुख्य रूप से सफेद फास्फोरस उत्पन्न होता है। जब सफेद फास्फोरस को दबाव (1.2-1.7) × 103 पर 200-220 डिग्री सेल्सियस तक गर्म किया जाता है एमएन/एम 2
[(12-17)×103 केजीएफ/सेमी 2] काला फास्फोरस बनता है। यह परिवर्तन बिना दबाव के किया जा सकता है, लेकिन पारा और थोड़ी मात्रा में काले फॉस्फोरस क्रिस्टल (बीज) की उपस्थिति में 370 डिग्री सेल्सियस पर 8 दिनब्लैक फ़ॉस्फ़ोरस एक ऑर्थोरोम्बिक संरचना का एक क्रिस्टल है ( ए -3,31 , बी - 4,38 , साथ-10.50), जाली विशिष्ट फास्फोरस के साथ रेशेदार परतों से निर्मित होती है। परमाणुओं की पिरामिडीय व्यवस्था, घनत्व 2.69 जी/सेमी3, टीपीएल 1.8×103 दबाव में लगभग 1000 डिग्री सेल्सियस एमएन/एम2(18×103 केजीएफ/सेमी2). दिखने में काला फास्फोरस ग्रेफाइट के समान होता है; सेमीकंडक्टर: बैंडगैप 0.33 ईवी 25 डिग्री सेल्सियस पर; इसकी विशिष्ट विद्युत प्रतिरोधकता 1.5 है ओम× सेमी,विद्युत प्रतिरोध का तापमान गुणांक 0.0077 है, प्रतिचुंबकीय, विशिष्ट चुंबकीय संवेदनशीलता 0.27×10-6 है। जब इसे अपने वाष्प के दबाव में 560-580 डिग्री सेल्सियस तक गर्म किया जाता है, तो यह लाल फास्फोरस में बदल जाता है। काला फास्फोरस कम सक्रिय होता है और प्रज्वलित होने पर इसे जलाना मुश्किल होता है, इसलिए इसे हवा में सुरक्षित रूप से संसाधित किया जा सकता है। फॉस्फोरस की परमाणु त्रिज्या 1.34, आयनिक त्रिज्या: P5 + 0.35, P3 + 0.44, P3- 1.86 है।
फॉस्फोरस परमाणु मिलकर डायटोमिक (पी2), टेट्राएटोमिक (पी4) और पॉलिमर अणु बनाते हैं। सामान्य परिस्थितियों में सबसे स्थिर बहुलक अणु वे होते हैं जिनमें परस्पर जुड़े पी4 टेट्राहेड्रा की लंबी श्रृंखला होती है। तरल, ठोस (सफेद फास्फोरस) और वाष्प में 800 डिग्री सेल्सियस से नीचे, फास्फोरस में पी4 अणु होते हैं। 800 डिग्री सेल्सियस से ऊपर के तापमान पर, P4 अणु P2 में विघटित हो जाते हैं , जो, बदले में, 2000 डिग्री सेल्सियस से ऊपर के तापमान पर परमाणुओं में विघटित हो जाते हैं। केवल सफेद फास्फोरस में P4 अणु होते हैं, अन्य सभी संशोधन पॉलिमर होते हैं। रासायनिक गुण। फॉस्फोरस परमाणु के बाहरी इलेक्ट्रॉनों का विन्यास 3 एस 2 3पी3,वी
यौगिकों में, सबसे विशिष्ट ऑक्सीकरण अवस्थाएँ + 5, + 3, और - 3 हैं। नाइट्रोजन की तरह, यौगिकों में फास्फोरस मुख्य रूप से सहसंयोजक होता है। फॉस्फाइड Na3P और Ca3P2 जैसे आयनिक यौगिक बहुत कम हैं। नाइट्रोजन के विपरीत, फॉस्फोरस में मुक्त 3 होता है डी- बल्कि कम ऊर्जा वाले ऑर्बिटल्स, जिससे समन्वय संख्या में वृद्धि और दाता-स्वीकर्ता बांड के गठन की संभावना होती है। फास्फोरस रासायनिक रूप से सक्रिय है, सफेद फास्फोरस की गतिविधि सबसे अधिक है;
लाल और काले फास्फोरस रासायनिक प्रतिक्रियाओं में बहुत अधिक निष्क्रिय होते हैं। सफेद फास्फोरस का ऑक्सीकरण एक श्रृंखला प्रतिक्रिया तंत्र के माध्यम से होता है। फॉस्फोरस ऑक्सीकरण आमतौर पर केमिलुमिनसेंस के साथ होता है। जब फॉस्फोरस ऑक्सीजन की अधिकता में जलता है, तो कमी होने पर पेंटोक्साइड P4O10 (या P2O5) बनता है, मुख्य रूप से ट्राइऑक्साइड P4O6 (या P2O3)। वाष्पों में P4O7, P4O8 का अस्तित्व स्पेक्ट्रोस्कोपी से सिद्ध हो चुका है , P2O6, PO और अन्य फॉस्फोरस ऑक्साइड। फास्फोरस पेंटोक्साइड का उत्पादन औद्योगिक पैमाने पर अतिरिक्त शुष्क हवा में मौलिक फास्फोरस को जलाकर किया जाता है। P4O10 के बाद के जलयोजन से ऑर्थो-(H3PO4) और पॉली-(H) का उत्पादन होता है एन+2पी एनओ 3 पी+1) फॉस्फोरिक एसिड। के अलावा
इसके अलावा, फॉस्फोरस फॉस्फोरस एसिड H3PO3, फॉस्फोरिक एसिड H4P2O6 और हाइपोफॉस्फोरस एसिड H3PO2 बनाता है, साथ ही पेरासिड्स: पर्फॉस्फोरिक एसिड H4P2O8 और मोनोपरफॉस्फोरिक एसिड H3PO5 फॉस्फोरिक एसिड (फॉस्फेट) के लवण का व्यापक रूप से उपयोग किया जाता है। , कुछ हद तक - फॉस्फाइट्स और हाइपोफॉस्फाइट्स। फॉस्फोरस सभी हैलोजन के साथ सीधे जुड़कर बड़ी मात्रा में रिलीज करता है
ऊष्मा की मात्रा और ट्राइहैलाइड्स (PX3, जहां X हैलोजन है), पेंटाहैलाइड्स (PX5) और ऑक्सीहैलाइड्स (उदाहरण के लिए, POX3) का निर्माण . जब फॉस्फोरस 100 डिग्री सेल्सियस से नीचे सल्फर के साथ संलयन होता है, तो फॉस्फोरस और सल्फर पर आधारित ठोस घोल बनते हैं, और 100 डिग्री सेल्सियस से ऊपर एक एक्ज़ोथिर्मिक प्रतिक्रिया होती है, जिससे क्रिस्टलीय सल्फाइड P4S3, P4S5, P4S7, P4S10 बनते हैं, जिनमें से केवल P4S5 गर्म होने पर P4S3 में विघटित हो जाता है। 200 डिग्री सेल्सियस से ऊपर और P4S7, और बाकी बिना अपघटन के पिघल जाते हैं। निम्नलिखित फॉस्फोरस ऑक्सीसल्फाइड ज्ञात हैं: P2O3S2, P2O3S3, P4O4S3, P6O10S5 और P4O4S3। फास्फोरस, नाइट्रोजन की तुलना में, हाइड्रोजन के साथ यौगिक बनाने में कम सक्षम है। फॉस्फोरस हाइड्रोजन फॉस्फीन PH3 और डाइफॉस्फीन P2H4 केवल अप्रत्यक्ष रूप से प्राप्त किया जा सकता है। फास्फोरस-नाइट्रोजन यौगिकों में से, नाइट्राइड्स पीएन, पी2एन3, पी3एन5 ज्ञात हैं - एक विद्युत चाप के माध्यम से फास्फोरस वाष्प के साथ नाइट्रोजन पारित करने से प्राप्त ठोस, रासायनिक रूप से स्थिर पदार्थ; पॉलिमेरिक फॉस्फोनिट्राइल हैलाइड्स - (PNX2)n (उदाहरण के लिए, पॉलीफॉस्फोनिट्राइल क्लोराइड) , विभिन्न परिस्थितियों में पेंटाहैलाइड्स को अमोनिया के साथ अभिक्रिया करके प्राप्त किया जाता है; एमिडोइडोफॉस्फेट यौगिक होते हैं, आमतौर पर बहुलक, जिनमें पी-ओ-पी बांड के साथ पी-एनएच-पी बांड होते हैं। 2000 डिग्री सेल्सियस से ऊपर के तापमान पर, फॉस्फोरस कार्बन के साथ प्रतिक्रिया करके बनता है
पीसी3 कार्बाइड एक ऐसा पदार्थ है जो सामान्य सॉल्वैंट्स में अघुलनशील होता है और एसिड या क्षार के साथ परस्पर क्रिया नहीं करता है। धातुओं के साथ गर्म करने पर फॉस्फोरस फॉस्फाइड बनाता है। फॉस्फोरस अनेक ऑर्गनोफॉस्फोरस यौगिक बनाता है। रसीद। मौलिक फास्फोरस का उत्पादन किया जाता है
सिलिका (क्वार्ट्ज रेत) की उपस्थिति में कोक के साथ 1400-1600 डिग्री सेल्सियस पर प्राकृतिक फॉस्फेट (एपेटाइट या फॉस्फोराइट्स) से इसकी इलेक्ट्रोथर्मल कमी:
2Ca3(PO4)2 + 10C + एन SiO2 = P4 + 10CO + 6CaO× एन SiO2 पूर्व-कुचल और समृद्ध फास्फोरस युक्त अयस्क को इसमें मिलाया जाता है
सिलिका और कोक के साथ निर्दिष्ट अनुपात और एक विद्युत भट्टी में लोड किया गया। सिलिका प्रतिक्रिया के तापमान को कम करने के लिए आवश्यक है, साथ ही कमी प्रक्रिया के दौरान जारी कैल्शियम ऑक्साइड को कैल्शियम सिलिकेट में बांधकर इसकी गति को बढ़ाती है, जिसे लगातार पिघले हुए स्लैग के रूप में हटा दिया जाता है। एल्यूमीनियम, मैग्नीशियम, लौह और अन्य अशुद्धियों के सिलिकेट और ऑक्साइड, साथ ही फॉस्फोरस के साथ कम लोहे के हिस्से की बातचीत से गठित फेरोफॉस्फोरस (Fe2P, FeP, Fe3P) भी स्लैग में चले जाते हैं। फेरोफॉस्फोरस, साथ ही थोड़ी मात्रा में मैंगनीज फॉस्फाइड और इसमें घुली अन्य धातुएं, विशेष स्टील्स के उत्पादन में बाद के उपयोग के लिए जमा होने पर विद्युत भट्ठी से हटा दी जाती हैं। फॉस्फोरस वाष्प गैसीय उप-उत्पादों के साथ विद्युत भट्ठी से निकलता है।
250-350 डिग्री सेल्सियस के तापमान पर उत्पाद और अस्थिर अशुद्धियाँ (CO, SiF4, PH3, जल वाष्प, कार्बनिक चार्ज अशुद्धियों के पायरोलिसिस उत्पाद, आदि)। धूल से सफाई के बाद, फास्फोरस युक्त गैसों को संक्षेपण इकाइयों में भेजा जाता है, जिसमें तरल तकनीकी सफेद फास्फोरस को कम से कम 50 डिग्री सेल्सियस के तापमान पर पानी के नीचे एकत्र किया जाता है। गैसीय पदार्थों का उपयोग करके फास्फोरस का उत्पादन करने की विधियाँ विकसित की जा रही हैं
कम तापमान वाले प्लाज्मा में परिवहन गैस के रूप में उपयोग किए जाने वाले प्राकृतिक फॉस्फेट और कम करने वाले गैसों (उदाहरण के लिए, मीथेन) के पृथक्करण तापमान से 2500-3000 डिग्री सेल्सियस तक तापमान बढ़ाकर उत्पादन को तेज करने के लिए एजेंटों, प्लाज्मा रिएक्टरों को कम करना।
आवेदन पत्र। उत्पादित फॉस्फोरस का बड़ा हिस्सा फॉस्फोरिक एसिड और फॉस्फोरस उर्वरकों और इसके आधार पर प्राप्त तकनीकी लवण (फॉस्फेट) में संसाधित किया जाता है। . सफेद फास्फोरस का उपयोग आग लगाने वाले और धुएं के गोले, बमों में किया जाता है; लाल
फॉस्फोरस - मैच उत्पादन में। फॉस्फोरस का उपयोग अलौह धातु मिश्र धातुओं के उत्पादन में डीऑक्सीडाइजिंग एजेंट के रूप में किया जाता है। 1% तक फॉस्फोरस की शुरूआत से फेक्रल और क्रोमल जैसे मिश्र धातुओं की गर्मी प्रतिरोध बढ़ जाती है। फास्फोरस कुछ कांस्य में शामिल है, क्योंकि उनकी तरलता और घर्षण प्रतिरोध बढ़ जाता है। धातुओं के फॉस्फाइड, साथ ही कुछ गैर-धातुओं (बी, सी, एएस, आदि) का उपयोग अर्धचालक सामग्रियों के उत्पादन और डोपिंग में किया जाता है। फॉस्फोरस का उपयोग आंशिक रूप से क्लोराइड और सल्फाइड के उत्पादन के लिए किया जाता है, जो फॉस्फोरस युक्त प्लास्टिसाइज़र (उदाहरण के लिए, ट्राइक्रेसिल फॉस्फेट, ट्रिब्यूटाइल फॉस्फेट, आदि), दवाओं, ऑर्गनोफॉस्फोरस कीटनाशकों के उत्पादन के लिए शुरुआती सामग्री के रूप में काम करते हैं, और स्नेहक में एडिटिव्स के रूप में भी उपयोग किए जाते हैं। और ईंधन. सुरक्षा सावधानियां। सफेद फास्फोरस और इसके यौगिक अत्यधिक विषैले होते हैं। के साथ काम
फॉस्फोरस को उपकरण की सावधानीपूर्वक सीलिंग की आवश्यकता होती है; सफेद फास्फोरस का भण्डारण करें। पानी के नीचे या भली भांति बंद करके सील किए गए धातु के कंटेनर में होना चाहिए। फॉस्फोरस के साथ काम करते समय सुरक्षा नियमों का कड़ाई से पालन किया जाना चाहिए। शरीर में फास्फोरस. फॉस्फोरस सबसे महत्वपूर्ण बायोजेनिक तत्वों में से एक है,
सभी जीवों के जीवन के लिए आवश्यक है। यह जीवित कोशिकाओं में ऑर्थो- और पायरोफॉस्फोरिक एसिड और उनके डेरिवेटिव के रूप में मौजूद है, और न्यूक्लियोटाइड्स, न्यूक्लिक एसिड, फॉस्फोप्रोटीन, फॉस्फोलिपिड्स, कार्बोहाइड्रेट के फॉस्फोरस एस्टर, कई कोएंजाइम और अन्य कार्बनिक यौगिकों का भी हिस्सा है। उनकी रासायनिक संरचना की ख़ासियत के कारण, फॉस्फोरस परमाणु, सल्फर परमाणुओं की तरह, उच्च-ऊर्जा यौगिकों में ऊर्जा-समृद्ध बंधन बनाने में सक्षम हैं; एडेनोसिन ट्राइफॉस्फोरिक एसिड (एटीपी), क्रिएटिन फॉस्फेट, आदि। जैविक विकास की प्रक्रिया में, यह फॉस्फोरस यौगिक थे जो सभी जीवित प्रणालियों में आनुवंशिक जानकारी और ऊर्जा वाहक के मुख्य, सार्वभौमिक भंडारकर्ता बन गए। डॉ। शरीर में फॉस्फोरस यौगिकों की महत्वपूर्ण भूमिका इस तथ्य में निहित है कि विभिन्न कार्बनिक यौगिकों (फॉस्फोराइलेशन) में फॉस्फोरिल अवशेष () का एंजाइमेटिक जोड़ चयापचय में उनकी भागीदारी के लिए "पास" के रूप में कार्य करता है, और, इसके विपरीत, ए का दरार फॉस्फोरिल अवशेष (डीफॉस्फोराइलेशन) इन यौगिकों को सक्रिय विनिमय से बाहर कर देता है। फॉस्फोरस चयापचय एंजाइम - किनेसेस, फॉस्फोराइलेज और फॉस्फेटेस। पशुओं और मनुष्यों के शरीर में फास्फोरस यौगिकों के परिवर्तन में यकृत मुख्य भूमिका निभाता है। फॉस्फोरस यौगिकों का चयापचय हार्मोन और विटामिन डी द्वारा नियंत्रित होता है। फॉस्फोरस सामग्री (प्रति 100 मिलीग्राम में) जीशुष्क पदार्थ) पौधों के ऊतकों में - 230-350,
समुद्री जानवर - 400-1800, स्थलीय जानवर - 1700-4400, बैक्टीरिया - लगभग 3000; मानव शरीर में विशेष रूप से हड्डी के ऊतकों (5000 से थोड़ा अधिक), मस्तिष्क के ऊतकों (लगभग 4000) और मांसपेशियों (220-270) में बहुत अधिक फास्फोरस होता है। फास्फोरस की दैनिक मानव आवश्यकता 1-1.2 है जी(बच्चों में यह वयस्कों की तुलना में अधिक है)। खाद्य उत्पादों में से पनीर, मांस, अंडे, फलियां (मटर, सेम, आदि) फास्फोरस से भरपूर हैं। शरीर में फास्फोरस का संतुलन चयापचय की सामान्य स्थिति पर निर्भर करता है। फॉस्फोरस चयापचय के उल्लंघन से गहरा जैव रासायनिक परिवर्तन होता है, मुख्य रूप से ऊर्जा चयापचय में। शरीर में फास्फोरस की कमी से, जानवरों और मनुष्यों में ऑस्टियोपोरोसिस और अन्य हड्डी रोग विकसित होते हैं, और पौधों में फास्फोरस भुखमरी विकसित होती है। . जीवित प्रकृति में फास्फोरस का स्रोत मिट्टी में निहित और पानी में घुले इसके अकार्बनिक यौगिक हैं। फॉस्फोरस पौधों द्वारा मिट्टी से घुलनशील फॉस्फेट के रूप में निकाला जाता है। पशुओं को आमतौर पर अपने आहार से पर्याप्त फास्फोरस मिलता है। जीवों की मृत्यु के बाद, फास्फोरस फिर से मिट्टी और निचली तलछट में प्रवेश करता है, इस प्रकार भाग लेता है। पदार्थों के चक्र में. चयापचय प्रक्रियाओं के नियमन में फास्फोरस की महत्वपूर्ण भूमिका ऑर्गेनोफॉस्फोरस यौगिकों की क्रिया के लिए जीवित कोशिकाओं के कई एंजाइम प्रणालियों की उच्च संवेदनशीलता को निर्धारित करती है। इस परिस्थिति का उपयोग चिकित्सा में औषधीय उत्पादों के विकास में, कृषि में फास्फोरस के उत्पादन में किया जाता है
उर्वरकों के साथ-साथ प्रभावी कीटनाशकों के निर्माण में भी। कई फॉस्फोरस यौगिक अत्यंत विषैले होते हैं और कुछ ऑर्गेनोफॉस्फोरस यौगिकों को रासायनिक युद्ध एजेंटों (सरीन, सोमन, टैबुन) के रूप में वर्गीकृत किया जा सकता है। फॉस्फोरस 32P का रेडियोधर्मी आइसोटोप जीव विज्ञान और चिकित्सा में व्यापक रूप से जीवित जीवों में सभी प्रकार के चयापचय और ऊर्जा के अध्ययन में एक संकेतक के रूप में उपयोग किया जाता है। . फॉस्फोरस युक्त दवाएं (एडेनोसिन ट्राइफॉस्फोरिक एसिड,
फाइटिन, कैल्शियम ग्लिसरॉफ़ॉस्फेट, फ़ॉस्फ़्रीन, आदि), मुख्य रूप से ऊतक चयापचय की प्रक्रियाओं को प्रभावित करते हैं और मांसपेशियों, तंत्रिका तंत्र, तपेदिक, पोषण की हानि, एनीमिया, आदि के रोगों के लिए उपयोग किए जाते हैं। फॉस्फोरस के रेडियोधर्मी आइसोटोप का उपयोग आइसोटोप संकेतक के रूप में किया जाता है चयापचय, रोगों के निदान, साथ ही ट्यूमर की विकिरण चिकित्सा का अध्ययन करें .
हरताल(अव्य. आर्सेनिकम), जैसे, मेंडेलीव की आवर्त प्रणाली के समूह V का रासायनिक तत्व, परमाणु क्रमांक 33, परमाणु द्रव्यमान 74.9216; स्टील-ग्रे क्रिस्टल। तत्व में एक स्थिर आइसोटोप 75As होता है। ऐतिहासिक सन्दर्भ. प्राकृतिक यौगिक आर्सेनिक सल्फर के साथ (ऑरपिमेंट As2S3,
रियलगर एएस4एस4) प्राचीन दुनिया के लोगों के लिए जाने जाते थे, जो इन खनिजों का उपयोग दवाओं और पेंट के रूप में करते थे। आर्सेनिक सल्फाइड को जलाने का उत्पाद भी ज्ञात था - आर्सेनिक (III) ऑक्साइड As2O3 ("सफेद आर्सेनिक")। आर्सेनिकोन नाम पहले से ही अरस्तू में पाया जाता है; यह ग्रीक से लिया गया है। आर्सेन - मजबूत, साहसी और आर्सेनिक यौगिकों को नामित करने के लिए परोसा जाता है (शरीर पर उनके मजबूत प्रभाव के आधार पर)। माना जाता है कि रूसी नाम "माउस" (चूहों और चूहों को भगाने के लिए आर्सेनिक तैयारी के उपयोग के बाद) से आया है। मुक्त अवस्था में आर्सेनिक के उत्पादन का श्रेय अल्बर्टस मैग्नस (लगभग 1250) को दिया जाता है। 1789 में ए. लेवोज़ियर ने आर्सेनिक को रासायनिक तत्वों की सूची में शामिल किया। प्रकृति में वितरण. पृथ्वी की पपड़ी में औसत आर्सेनिक सामग्री (क्लार्क)
1.7·10-4% (द्रव्यमान द्वारा), इतनी मात्रा में यह अधिकांश आग्नेय चट्टानों में मौजूद होता है। चूँकि आर्सेनिक यौगिक उच्च तापमान पर अस्थिर होते हैं, तत्व मैग्मैटिक प्रक्रियाओं के दौरान जमा नहीं होता है; यह गर्म गहरे पानी (S, Se, Sb, Fe, Co, Ni, Cu और अन्य तत्वों के साथ) से अवक्षेपित होकर केंद्रित होता है। ज्वालामुखी विस्फोट के दौरान आर्सेनिक अपने वाष्पशील यौगिकों के रूप में वायुमंडल में प्रवेश करता है। चूंकि आर्सेनिक बहुसंयोजी है, इसलिए इसका प्रवास रेडॉक्स वातावरण से काफी प्रभावित होता है। पृथ्वी की सतह की ऑक्सीकरण स्थितियों के तहत, आर्सेनेट (As5+) और आर्सेनाइट (As3+) बनते हैं। ये दुर्लभ खनिज हैं जो केवल आर्सेनिक जमा वाले क्षेत्रों में पाए जाते हैं। देशी आर्सेनिक और As2+ खनिज और भी कम आम हैं। असंख्य आर्सेनिक खनिजों (लगभग 180) में से केवल आर्सेनोपाइराइट FeAsS ही प्राथमिक औद्योगिक महत्व का है। आर्सेनिक की थोड़ी मात्रा जीवन के लिए आवश्यक है। हालाँकि, जमा के क्षेत्रों में
आर्सेनिक और युवा ज्वालामुखियों की गतिविधि के कारण, कुछ स्थानों की मिट्टी में 1% तक आर्सेनिक होता है, जो पशुधन रोगों और वनस्पति की मृत्यु से जुड़ा है। आर्सेनिक का संचय विशेष रूप से मैदानों और रेगिस्तानों के परिदृश्यों के लिए विशिष्ट है, जिनकी मिट्टी में आर्सेनिक निष्क्रिय है। आर्द्र जलवायु में, आर्सेनिक मिट्टी से आसानी से धुल जाता है। जीवित पदार्थ में औसतन 3·10-5%, नदियों में 3·10-7% आर्सेनिक होता है। आर्सेनिक लाया
नदियाँ समुद्र में गिरती हैं, तो यह अपेक्षाकृत तेजी से स्थिर हो जाती है। समुद्री जल में केवल 1·10-7% आर्सेनिक होता है, लेकिन मिट्टी और शैलों में यह 6.6·10-4% होता है। तलछटी लौह अयस्क और फेरोमैंगनीज नोड्यूल अक्सर आर्सेनिक से समृद्ध होते हैं।
भौतिक और रासायनिक गुण। आर्सेनिक में कई एलोट्रोपिक संशोधन हैं। सामान्य परिस्थितियों में, सबसे अधिक स्थिर तथाकथित धात्विक, या ग्रे, आर्सेनिक (ए-अस) है - एक स्टील-ग्रे भंगुर क्रिस्टलीय द्रव्यमान; जब यह ताजा टूटता है, तो इसमें धात्विक चमक होती है, हवा में यह जल्दी ही फीकी पड़ जाती है क्योंकि यह As2O3 की पतली फिल्म से ढका होता है। ग्रे आर्सेनिक की क्रिस्टल जाली रॉम्बोहेड्रल है ( ए- 4.123 Å, कोण ए - 54°10", एक्स- 0.226), स्तरित। घनत्व 5.72 जी/सेमी3(20°C पर), विद्युत प्रतिरोधकता 35·10-8 ओम× एम, या 35·10-6 ओम× सेमी, विद्युत प्रतिरोध का तापमान गुणांक 3.9·10-3 (0°-100 оC), ब्रिनेल कठोरता 1470 एमएन/एम2, या 147 केजीएफ/एमएम2(मोहस के अनुसार 3-4); आर्सेनिक प्रतिचुंबकीय है। वायुमंडलीय दबाव में, आर्सेनिक बिना पिघले 615 डिग्री सेल्सियस पर उर्ध्वपातित हो जाता है, क्योंकि त्रिक बिंदु (चरण आरेख देखें) ए-अस 816 डिग्री सेल्सियस पर होता है और दबाव 36 होता है। पर. आर्सेनिक वाष्प में 800°C तक As4 अणु होते हैं, 1700°C से ऊपर - केवल As2। जब आर्सेनिक वाष्प तरल हवा से ठंडी सतह पर संघनित होता है, तो पीला आर्सेनिक बनता है - मोम की तरह पारदर्शी, नरम क्रिस्टल, जिसका घनत्व 1.97 है जी/सेमी3, सफेद फास्फोरस के गुणों के समान। प्रकाश या कम गर्मी के संपर्क में आने पर यह ग्रे आर्सेनिक में बदल जाता है। ग्लासी-अनाकार संशोधनों को भी जाना जाता है: काला आर्सेनिक और भूरा आर्सेनिक, जो 270 डिग्री सेल्सियस से ऊपर गर्म होने पर ग्रे एम में बदल जाता है। आर्सेनिक परमाणु के बाहरी इलेक्ट्रॉनों का विन्यास 3 डी 104एस 24पी 3. यौगिकों में आर्सेनिक
इसकी ऑक्सीकरण अवस्थाएँ +5, +3 और -3 हैं। ग्रे आर्सेनिक फॉस्फोरस की तुलना में रासायनिक रूप से बहुत कम सक्रिय है। 400°C से ऊपर हवा में गर्म करने पर आर्सेनिक जल जाता है, जिससे As2O3 बनता है। आर्सेनिक सीधे हैलोजन के साथ जुड़ जाता है; सामान्य परिस्थितियों में, AsF5 एक गैस है; AsF3, AsCl3, AsBr3 - रंगहीन, अत्यधिक अस्थिर तरल पदार्थ; AsI3 और As2l4 लाल क्रिस्टल हैं। जब आर्सेनिक और सल्फर को गर्म किया जाता है, तो सल्फाइड प्राप्त होते हैं: नारंगी-लाल As4S4 और नींबू-पीला As2S3। धूमिल हाइड्रोक्लोरिक एसिड में आर्सेनिक एसिड (या इसके लवण) के बर्फ-ठंडे घोल में H2S डालने से हल्का पीला As2S5 सल्फाइड अवक्षेपित होता है: 2H3AsO4 + 5H2S = As2S5 + 8H2O; लगभग 500°C पर यह As2S3 और सल्फर में विघटित हो जाता है। सभी एम. सल्फाइड पानी और तनु अम्ल में अघुलनशील होते हैं। मजबूत ऑक्सीकरण एजेंट (HNO3 + HCl, HCl + KClO3 का मिश्रण) उन्हें H3AsO4 और H2SO4 के मिश्रण में बदल देते हैं। As2S3 सल्फाइड आसानी से अमोनियम और क्षार धातुओं के सल्फाइड और पॉलीसल्फाइड में घुल जाता है, जिससे एसिड के लवण बनते हैं - थियोआर्सेनिक H3AsS3 और थियोआर्सेनिक H3AsS4। ऑक्सीजन के साथ, आर्सेनिक ऑक्साइड उत्पन्न करता है: ऑक्साइड M. (III) As2O3 - आर्सेनिक एनहाइड्राइड और ऑक्साइड M. (V) As2O5 - आर्सेनिक एनहाइड्राइड। उनमें से पहला धातु या उसके सल्फाइड पर ऑक्सीजन की क्रिया से बनता है, उदाहरण के लिए 2As2S3 + 9O2 - 2As2O3 + 6SO2। As2O3 वाष्प संघनित होकर एक रंगहीन कांच जैसा द्रव्यमान बनाता है, जो समय के साथ छोटे घन क्रिस्टल के निर्माण के कारण अपारदर्शी हो जाता है, घनत्व 3.865 जी/सेमी3. वाष्प घनत्व As4O6 सूत्र से मेल खाता है: 1800?C से ऊपर वाष्प में As2O3 होता है। 100 पर जीपानी घुल जाता है 2.1 जी As2O3 (25oC पर)। एम. ऑक्साइड (III) अम्लीय गुणों की प्रधानता वाला एक उभयधर्मी यौगिक है। ऑर्थोआर्सेनिक एसिड H3AsO3 और मेटाआर्सेनिक एसिड HAsO2 के अनुरूप लवण (आर्सेनाइट) ज्ञात हैं; अम्ल स्वयं प्राप्त नहीं हुए हैं। केवल क्षार धातु और अमोनियम आर्सेनाइट ही पानी में घुलनशील हैं। As2O3 और आर्सेनाइट आमतौर पर अपचायक एजेंट होते हैं (उदाहरण के लिए, As2O3 + 2I2 + 5H2O - 4HI + 2H3AsO4), लेकिन ऑक्सीकरण एजेंट भी हो सकते हैं (उदाहरण के लिए, As2O3 + 3C - 2As + 3CO)। आर्सेनिक (V) ऑक्साइड आर्सेनिक एसिड H3AsO4 (लगभग) को गर्म करके तैयार किया जाता है
200oC). यह रंगहीन होता है और लगभग 500°C पर As2O3 और O2 में विघटित हो जाता है। आर्सेनिक एसिड As या As2O3 पर सांद्र HNO3 की क्रिया द्वारा तैयार किया जाता है। क्षार धातु और अमोनियम लवण के अपवाद के साथ, आर्सेनिक एसिड लवण (आर्सेनेट) पानी में अघुलनशील होते हैं। ऐसे लवण ज्ञात हैं जो ऑर्थोआर्सेनिक H3AsO4, मेटाआर्सेनिक HAsO3, और पाइरोआर्सेनिक H4As2O7 एसिड से मेल खाते हैं; अंतिम दो अम्ल मुक्त अवस्था में प्राप्त नहीं हुए। जब धातुओं के साथ मिश्रित किया जाता है, तो आर्सेनिक अधिकतर यौगिक (आर्सेनाइड्स) बनाता है।
रसीद एवं आवेदन. आर्सेनिक पाइराइट्स को गर्म करके औद्योगिक रूप से आर्सेनिक का उत्पादन किया जाता है:
FeAsS - कोयले के साथ FeS + As या (कम अक्सर) As2O3 की कमी। दोनों प्रक्रियाएँ प्रत्युत्तर में की जाती हैं
आर्सेनिक वाष्प के संघनन के लिए एक रिसीवर से जुड़ी दुर्दम्य मिट्टी। आर्सेनिक एनहाइड्राइड आर्सेनिक अयस्कों के ऑक्सीडेटिव भूनने से या पॉलीमेटेलिक अयस्कों को भूनने के उप-उत्पाद के रूप में प्राप्त होता है, जिसमें लगभग हमेशा आर्सेनिक होता है। ऑक्सीडेटिव रोस्टिंग के दौरान, As2O3 वाष्प बनते हैं, जो संग्रह कक्षों में संघनित होते हैं। क्रूड As2O3 को 500-600?C पर उर्ध्वपातन द्वारा शुद्ध किया जाता है। शुद्धीकृत As2O3 का उपयोग आर्सेनिक और इसकी तैयारियों के उत्पादन के लिए किया जाता है।
गन शॉट के उत्पादन के लिए उपयोग किए जाने वाले सीसे में आर्सेनिक (वजन के हिसाब से 0.2-1.0%) की छोटी मात्रा मिलाई जाती है (आर्सेनिक पिघले हुए सीसे की सतह के तनाव को बढ़ाता है, जिसके कारण शॉट गोलाकार के करीब एक आकार प्राप्त कर लेता है; आर्सेनिक कठोरता को थोड़ा बढ़ा देता है) सीसा का) सुरमा के आंशिक विकल्प के रूप में, आर्सेनिक को कुछ बैबिट और प्रिंटिंग मिश्र धातुओं में शामिल किया गया है। शुद्ध आर्सेनिक जहरीला नहीं है, लेकिन इसके सभी यौगिक पानी में घुलनशील हैं या करने में सक्षम हैं
गैस्ट्रिक जूस के प्रभाव में घोल में जाना, अत्यंत जहरीला; आर्सेनिक हाइड्रोजन विशेष रूप से खतरनाक है। उत्पादन में उपयोग किए जाने वाले आर्सेनिक यौगिकों में से, आर्सेनिक एनहाइड्राइड सबसे जहरीला है। अलौह धातुओं के लगभग सभी सल्फाइड अयस्कों, साथ ही लौह (सल्फर) पाइराइट में आर्सेनिक का मिश्रण होता है। इसलिए, उनके ऑक्सीडेटिव रोस्टिंग के दौरान, सल्फर डाइऑक्साइड SO2 के साथ, As2O3 हमेशा बनता है; इसका अधिकांश भाग धूम्रपान चैनलों में संघनित होता है, लेकिन उपचार सुविधाओं की अनुपस्थिति या कम दक्षता में, अयस्क भूनने वाली भट्टियों की निकास गैसें As2O3 की ध्यान देने योग्य मात्रा को अपने साथ ले जाती हैं। शुद्ध आर्सेनिक, हालांकि जहरीला नहीं है, हवा में संग्रहित होने पर हमेशा जहरीले As2O3 की परत से ढका रहता है। उचित वेंटिलेशन के अभाव में, आर्सेनिक युक्त औद्योगिक सल्फ्यूरिक या हाइड्रोक्लोरिक एसिड के साथ धातुओं (लोहा, जस्ता) की नक़्क़ाशी बेहद खतरनाक है, क्योंकि इससे आर्सेनिक हाइड्रोजन उत्पन्न होता है। शरीर में आर्सेनिक. एक सूक्ष्म तत्व के रूप में, आर्सेनिक सर्वव्यापी है
जीवित प्रकृति में. मिट्टी में औसत आर्सेनिक सामग्री 4·10-4% है, पौधों की राख में - 3·10-5%। समुद्री जीवों में आर्सेनिक की मात्रा स्थलीय जीवों की तुलना में अधिक होती है (मछली में 0.6-4.7) एमजीपहले में किलोग्रामकच्चा पदार्थ यकृत में जमा हो जाता है)। मानव शरीर में आर्सेनिक की औसत मात्रा 0.08-0.2 है मिलीग्राम/किग्रा. रक्त में, आर्सेनिक लाल रक्त कोशिकाओं में केंद्रित होता है, जहां यह हीमोग्लोबिन अणु से जुड़ता है (और ग्लोबिन अंश में हीम की तुलना में दोगुना होता है)। इसकी सबसे बड़ी मात्रा (प्रति 1 जीऊतक) गुर्दे और यकृत में पाया जाता है। फेफड़ों और प्लीहा, त्वचा और बालों में बहुत सारा आर्सेनिक पाया जाता है; अपेक्षाकृत कम - मस्तिष्कमेरु द्रव, मस्तिष्क (मुख्य रूप से पिट्यूटरी ग्रंथि), गोनाड, आदि में। ऊतकों में, आर्सेनिक मुख्य प्रोटीन अंश में पाया जाता है, एसिड-घुलनशील अंश में बहुत कम, और इसका केवल एक छोटा सा हिस्सा पाया जाता है लिपिड अंश में. आर्सेनिक रेडॉक्स प्रतिक्रियाओं में शामिल है: जटिल कार्बोहाइड्रेट का ऑक्सीडेटिव टूटना, किण्वन, ग्लाइकोलाइसिस, आदि। आर्सेनिक यौगिकों का उपयोग जैव रसायन में चयापचय प्रतिक्रियाओं का अध्ययन करने के लिए विशिष्ट एंजाइम अवरोधक के रूप में किया जाता है। चिकित्सा में आर्सेनिक. कार्बनिक आर्सेनिक यौगिक (एमिनारसोन, मियार्सेनॉल,
नोवार्सेनल, ओसारसोल) का उपयोग मुख्य रूप से सिफलिस और प्रोटोजोअल रोगों के उपचार के लिए किया जाता है। आर्सेनिक की अकार्बनिक तैयारी - सोडियम आर्सेनाइट (सोडियम आर्सेनिक एसिड), पोटेशियम आर्सेनाइट (पोटेशियम आर्सेनिक एसिड), आर्सेनिक एनहाइड्राइड As2O3, सामान्य सुदृढ़ीकरण और टॉनिक एजेंटों के रूप में निर्धारित हैं। जब शीर्ष पर लागू किया जाता है, तो अकार्बनिक आर्सेनिक की तैयारी पूर्व जलन के बिना एक नेक्रोटाइज़िंग प्रभाव पैदा कर सकती है, जिससे यह प्रक्रिया लगभग दर्द रहित हो जाती है; यह गुण, जो As2O3 में सबसे अधिक स्पष्ट है, दंत चिकित्सा में उपयोग किया जाता है
दाँत के गूदे का नष्ट होना। सोरायसिस के इलाज के लिए अकार्बनिक आर्सेनिक तैयारियों का भी उपयोग किया जाता है। कृत्रिम रूप से प्राप्त रेडियोधर्मी आइसोटोप M. 74As (T1/2 - 17.5) दिन) और 76ए (टी1/2
26,8 एच) का उपयोग नैदानिक और चिकित्सीय उद्देश्यों के लिए किया जाता है। उनकी मदद से, ब्रेन ट्यूमर का स्थान स्पष्ट किया जाता है और उनके निष्कासन की कट्टरता की डिग्री निर्धारित की जाती है। रेडियोधर्मी आर्सेनिक का उपयोग कभी-कभी रक्त रोगों आदि के लिए किया जाता है। विकिरण संरक्षण पर अंतर्राष्ट्रीय आयोग की सिफारिशों के अनुसार,
शरीर में 76ए की अधिकतम अनुमेय सामग्री 11 मैकक्यूरी. यूएसएसआर में अपनाए गए स्वच्छता मानकों के अनुसार, पानी और खुले जलाशयों में 76A की अधिकतम अनुमेय सांद्रता 1·10-7 है क्यूरी/एल, कार्य परिसर की हवा में 5·10-11 क्यूरी/एल. सभी आर्सेनिक तैयारियाँ बहुत जहरीली होती हैं। तीव्र विषाक्तता के मामले में, गंभीर पेट दर्द, दस्त और गुर्दे की क्षति देखी जाती है; पतन और आक्षेप संभव है. क्रोनिक विषाक्तता में, सबसे आम हैं गैस्ट्रोइंटेस्टाइनल विकार, श्वसन पथ के श्लेष्म झिल्ली की सर्दी (ग्रसनीशोथ, लैरींगाइटिस, ब्रोंकाइटिस), त्वचा के घाव (एक्सेंथेमा, मेलानोसिस, हाइपरकेराटोसिस), और संवेदनशीलता विकार; अप्लास्टिक एनीमिया का विकास संभव है। आर्सेनिक की तैयारी के साथ विषाक्तता के उपचार में, युनिथिओल का सबसे बड़ा महत्व है। औद्योगिक विषाक्तता को रोकने के उपायों का लक्ष्य होना चाहिए
मुख्य रूप से तकनीकी प्रक्रिया के मशीनीकरण, सीलिंग और धूल हटाने, प्रभावी वेंटिलेशन बनाने और श्रमिकों को धूल के संपर्क से व्यक्तिगत सुरक्षा उपकरण प्रदान करने पर। श्रमिकों की नियमित चिकित्सा जांच आवश्यक है। काम पर रखने पर और कर्मचारियों के लिए - हर छह महीने में एक बार प्रारंभिक चिकित्सा परीक्षाएँ की जाती हैं।
सुरमा(अव्य। स्टिबियम), एसबी, मेंडेलीव की आवधिक प्रणाली के समूह वी का रासायनिक तत्व; परमाणु क्रमांक 51, परमाणु द्रव्यमान 121.75; धातु नीले रंग की टिंट के साथ चांदी-सफेद है। प्रकृति में दो स्थिर आइसोटोप ज्ञात हैं: 121Sb (57.25%) और 123Sb (42.75%)। कृत्रिम रूप से प्राप्त रेडियोधर्मी आइसोटोप में से, सबसे महत्वपूर्ण 122Sb है ( टी 1/2 - 2,8 cym), 124एसबी ( टी 1/2 - 60,2 cym) और 125एसबी ( टी 1/2 - 2 वर्ष)।
ऐतिहासिक सन्दर्भ. सुरमा प्राचीन काल से जाना जाता है। पूर्व के देशों में इसका प्रयोग लगभग 3000 ईसा पूर्व किया जाता था। इ। बर्तन बनाने के लिए. प्राचीन मिस्र में पहले से ही 19वीं शताब्दी में। ईसा पूर्व इ। एंटीमनी ग्लिटर पाउडर (प्राकृतिक Sb2S3) जिसे मेस्टेन या स्टेम कहा जाता है, का उपयोग भौंहों को काला करने के लिए किया जाता था। प्राचीन ग्रीस में इसे स्टिमी और स्टिबी के नाम से जाना जाता था, इसलिए लैटिन स्टिबियम। लगभग 12-14 शताब्दी. एन। इ। एंटीमोनियम नाम प्रकट हुआ। 1789 में, ए. लावोइसियर ने एंटीमनी को एंटीमोइन (आधुनिक अंग्रेजी एंटीमनी, स्पेनिश और इतालवी एंटीमोनियो, जर्मन एंटीमोन) नामक रासायनिक तत्वों की सूची में शामिल किया। रूसी "सुरमा" तुर्की सुरमे से आता है; यह लेड ग्लिटर पाउडर पीबीएस को दर्शाता है, जिसका उपयोग भौंहों को काला करने के लिए भी किया जाता था (अन्य स्रोतों के अनुसार, "सुरमा" - फ़ारसी सुर्मे - धातु से)। सुरमा और उसके यौगिकों के उत्पादन के गुणों और तरीकों का विस्तृत विवरण सबसे पहले 1604 में कीमियागर वासिली वैलेन्टिन (जर्मनी) द्वारा दिया गया था। प्रकृति में वितरण। पृथ्वी की पपड़ी में औसत सुरमा सामग्री (क्लार्क) 5 ×10-5
% वजन से। सुरमा मैग्मा और जीवमंडल में फैला हुआ है। गर्म भूमिगत जल से, यह हाइड्रोथर्मल निक्षेपों में केंद्रित होता है। सुरमा भंडार स्वयं ज्ञात हैं, साथ ही सुरमा-पारा, सुरमा-सीसा, सोना-सुरमा और सुरमा-टंगस्टन जमा भी ज्ञात हैं। 27 सुरमा खनिजों में से, स्टिबनाइट (Sb2S3) प्रमुख औद्योगिक महत्व का है। . सल्फर के साथ अपनी आत्मीयता के कारण, सुरमा अक्सर आर्सेनिक, बिस्मथ, निकल, सीसा, पारा, चांदी और अन्य तत्वों के सल्फाइड में अशुद्धता के रूप में पाया जाता है। भौतिक और रासायनिक गुण। सुरमा क्रिस्टलीय और तीन में जाना जाता है
अनाकार रूप (विस्फोटक, काला और पीला)। विस्फोटक सुरमा (घनत्व 5.64-5.97) जी/सेमी 3) किसी भी संपर्क पर विस्फोट होता है: किसी घोल के इलेक्ट्रोलिसिस के दौरान बनता है
SbCl3; काला (घनत्व 5.3 जी/सेमी 3) - सुरमा वाष्प के तेजी से ठंडा होने के साथ; पीला - जब ऑक्सीजन को तरलीकृत SbH3 में प्रवाहित किया जाता है। पीला और काला सुरमा अस्थिर होता है; कम तापमान पर वे साधारण सुरमे में बदल जाते हैं। सबसे स्थिर क्रिस्टलीय सुरमा , त्रिकोणीय प्रणाली में क्रिस्टलीकृत होता है, ए - 4.5064 ; घनत्व 6.61-6.73 जी/सेमी 3(तरल - 6.55 जी/सेमी 3); टीएमपी 630.5 डिग्री सेल्सियस; टीकिप1635-1645 डिग्री सेल्सियस; 20-100 डिग्री सेल्सियस पर विशिष्ट ताप क्षमता 0.210 केजे/(किलो ×को ) ; 20 डिग्री सेल्सियस पर तापीय चालकता 17.6 डब्ल्यू/एम× के. पॉलीक्रिस्टलाइन सी. के लिए रैखिक विस्तार का तापमान गुणांक 11.5 ×10-6 0-100 डिग्री सेल्सियस पर; एकल क्रिस्टल a1 के लिए - 8.1×10-ए2 - 0-400 डिग्री सेल्सियस पर 19.5×10-6, विद्युत प्रतिरोधकता (20 डिग्री सेल्सियस) (43.045×10-6 ओम× सेमी). सुरमा प्रतिचुंबकीय है, विशिष्ट चुंबकीय संवेदनशीलता -0.66 ×10-6 है। अधिकांश धातुओं के विपरीत, सुरमा भंगुर होता है, आसानी से दरार वाले तल पर विभाजित हो जाता है, पीसकर पाउडर में बदल जाता है और इसे जाली नहीं बनाया जा सकता (कभी-कभी इसे अर्ध-धातु के रूप में वर्गीकृत किया जाता है) . यांत्रिक गुण धातु की शुद्धता पर निर्भर करते हैं। ढली हुई धातु के लिए ब्रिनेल कठोरता 325-340 एमएन/एम 2 (32,5-34,0 केजीएफ/मिमी 2); लोच का मापांक 285-300; तन्य शक्ति 86.0 एमएन/एम 2 (8,6 केजीएफ/मिमी 2). Sb5s25r3 परमाणु के बाहरी इलेक्ट्रॉनों का विन्यास। यौगिकों में यह मुख्य रूप से +5, +3 और -3 ऑक्सीकरण अवस्थाएँ प्रदर्शित करता है। रासायनिक दृष्टि से सुरमा निष्क्रिय होता है। तक वायु में ऑक्सीकरण नहीं होता
पिघलने का तापमान. सुरमा नाइट्रोजन और हाइड्रोजन के साथ प्रतिक्रिया नहीं करता है। पिघले सुरमे में कार्बन थोड़ा घुल जाता है। धातु सक्रिय रूप से क्लोरीन और अन्य हैलोजन के साथ संपर्क करती है, जिससे एंटीमनी हैलाइड बनता है। 630 डिग्री सेल्सियस से ऊपर के तापमान पर ऑक्सीजन के साथ प्रतिक्रिया करके Sb2O3 बनाता है . जब सल्फर के साथ संलयन होता है, तो एंटीमनी सल्फाइड प्राप्त होता है, और यह फॉस्फोरस और आर्सेनिक के साथ भी परस्पर क्रिया करता है। सुरमा पानी और तनु अम्ल के प्रति प्रतिरोधी है। सांद्रित हाइड्रोक्लोरिक और सल्फ्यूरिक एसिड धीरे-धीरे सुरमा को घोलकर SbCl3 क्लोराइड और Sb2 (SO4)3 सल्फेट बनाते हैं; सांद्र नाइट्रिक एसिड सुरमा को एक उच्च ऑक्साइड में ऑक्सीकरण करता है, जो एक हाइड्रेटेड यौगिक xSb2O5 ×yH2O के रूप में बनता है। व्यावहारिक रुचि में एंटीमनी एसिड के अल्प घुलनशील लवण हैं - एंटीमोनेट्स (MeSbO3 × 3H2O, जहां Me Na, K है) और गैर-पृथक मेटाएंटीमोनी एसिड के लवण - मेटाएंटीमोनाइट्स (MeSbO2 × 3H2O), जिनमें कम करने वाले गुण होते हैं। एस. धातुओं के साथ मिलकर एंटीमोनाइड्स बनाता है। रसीद। सुरमा पाइरोमेटालर्जिकल और हाइड्रोमेटालर्जिकल विधियों द्वारा प्राप्त किया जाता है
20-60% एसबी युक्त सांद्रण या अयस्क का प्रसंस्करण। पाइरोमेटालर्जिकल विधियों में अवक्षेपण और कमी गलाने शामिल हैं। अवक्षेपण प्रगलन के लिए कच्चा माल सल्फाइड सांद्रण हैं; यह प्रक्रिया लोहे द्वारा इसके सल्फाइड से सुरमा के विस्थापन पर आधारित है: Sb2S3 + 3Fe Û 2Sb + 3FeS। आयरन को स्क्रैप के रूप में चार्ज में पेश किया जाता है। पिघलने का कार्य 1300-1400 डिग्री सेल्सियस पर रिवरबेरेटरी या कम घूमने वाली ड्रम भट्टियों में किया जाता है। खुरदरी धातु में सुरमा की रिकवरी 90% से अधिक है। सुरमा का अपचयन प्रगलन चारकोल या कोयले की धूल और अपशिष्ट चट्टान के स्लैगिंग के साथ इसके ऑक्साइड को धातु में बदलने पर आधारित है। कमी गलाने से पहले अतिरिक्त हवा के साथ 550 डिग्री सेल्सियस पर ऑक्सीडेटिव भूनना होता है। सिंडर में गैर-वाष्पशील एंटीमनी टेट्रोक्साइड होता है। विद्युत भट्टियों का उपयोग अवक्षेपण और पिघलने में कमी दोनों के लिए किया जा सकता है। सुरमा के उत्पादन के लिए हाइड्रोमेटालर्जिकल विधि में दो चरण होते हैं: कच्चे माल को क्षारीय सल्फाइड समाधान के साथ संसाधित करना, सुरमा को सुरमा एसिड और सल्फोसाल्ट के लवण के रूप में समाधान में स्थानांतरित करना, और सुरमा को अलग करना। इलेक्ट्रोलिसिस. कच्चे माल की संरचना और इसके उत्पादन की विधि के आधार पर, कच्चे सुरमे में 1.5 से 15% अशुद्धियाँ होती हैं: Fe, As, S, आदि। शुद्ध सुरमा प्राप्त करने के लिए, पाइरोमेटालर्जिकल या इलेक्ट्रोलाइटिक रिफाइनिंग का उपयोग किया जाता है। पाइरोमेटालर्जिकल रिफाइनिंग के दौरान, एंटिमनी पिघल में एंटीमोनाइट (क्रूडम) - Sb2S3 - को शामिल करके लोहे और तांबे की अशुद्धियों को सल्फर यौगिकों के रूप में हटा दिया जाता है, जिसके बाद आर्सेनिक (सोडियम आर्सेनेट के रूप में) और सल्फर को हवा के नीचे उड़ाकर हटा दिया जाता है। सोडा लावा. घुलनशील एनोड के साथ इलेक्ट्रोलाइटिक शोधन के दौरान, बचे हुए लोहे, तांबे और अन्य धातुओं से खुरदुरे सुरमा को शुद्ध किया जाता है
इलेक्ट्रोलाइट (Cu, Ag, Au कीचड़ में रहते हैं)। इलेक्ट्रोलाइट एक घोल है जिसमें SbF3, H2SO4 और HF शामिल हैं। परिष्कृत सुरमा में अशुद्धियों की मात्रा 0.5-0.8% से अधिक नहीं होती है। उच्च शुद्धता वाला सुरमा प्राप्त करने के लिए, अक्रिय गैस के वातावरण में ज़ोन पिघलने का उपयोग किया जाता है या सुरमा पूर्व-शुद्ध यौगिकों - ट्राइऑक्साइड या ट्राइक्लोराइड से प्राप्त किया जाता है। आवेदन पत्र। सुरमा का उपयोग मुख्य रूप से सीसा और टिन मिश्र धातु के रूप में किया जाता है
बैटरी प्लेट, केबल शीथ, बियरिंग (बैबिट) के लिए , मुद्रण में प्रयुक्त मिश्रधातु (हार्ट) , आदि। ऐसे मिश्र धातुओं में कठोरता, पहनने के प्रतिरोध और संक्षारण प्रतिरोध में वृद्धि हुई है। फ्लोरोसेंट लैंप में, एसबी कैल्शियम हेलोफॉस्फेट के साथ सक्रिय होता है। एंटीमनी को सेमीकंडक्टर सामग्रियों में जर्मेनियम और सिलिकॉन के डोपेंट के साथ-साथ एंटीमोनाइड्स (उदाहरण के लिए, InSb) में शामिल किया जाता है। रेडियोधर्मी आइसोटोप 12Sb का उपयोग जी-विकिरण और न्यूट्रॉन के स्रोतों में किया जाता है। शरीर में सुरमा. सुरमा सामग्री (प्रति 100 जीशुष्क पदार्थ) में है
पौधे 0.006 एमजी,समुद्री जानवरों में 0.02 एमजी,स्थलीय जानवरों में 0.0006 एमजी.सुरमा श्वसन तंत्र या जठरांत्र पथ के माध्यम से जानवरों और मनुष्यों के शरीर में प्रवेश करता है। यह मुख्य रूप से मल में और थोड़ी मात्रा में मूत्र में उत्सर्जित होता है। सुरमा की जैविक भूमिका अज्ञात है। यह थायरॉयड ग्रंथि, यकृत और प्लीहा में चुनिंदा रूप से केंद्रित होता है। एरिथ्रोसाइट्स में, सुरमा मुख्य रूप से ऑक्सीकरण अवस्था + 3 में, रक्त प्लाज्मा में - ऑक्सीकरण अवस्था + 5 में जमा होता है। अधिकतम अनुमेय सांद्रता सी. 10-5 - 10-7 जी 100 से जीसूखे कपड़े। उच्च सांद्रता में, यह तत्व लिपिड, कार्बोहाइड्रेट और प्रोटीन चयापचय के कई एंजाइमों को निष्क्रिय कर देता है (संभवतः सल्फहाइड्रील समूहों को अवरुद्ध करने के परिणामस्वरूप) . चिकित्सा पद्धति में, सुरमा की तैयारी (सोल्यूसुरमिन, आदि) का उपयोग किया जाता है
मुख्य रूप से लीशमैनियासिस और कुछ हेल्मिंथियासिस (उदाहरण के लिए, शिस्टोसोमियासिस) के उपचार के लिए। सुरमा और इसके यौगिक जहरीले होते हैं। सांद्र गलाने के दौरान विषाक्तता संभव है
सुरमा अयस्कों और सुरमा मिश्र धातुओं के उत्पादन में। तीव्र विषाक्तता में - ऊपरी श्वसन पथ, आंखों और त्वचा की श्लेष्मा झिल्ली में जलन। जिल्द की सूजन, नेत्रश्लेष्मलाशोथ, आदि विकसित हो सकते हैं। उपचार: एंटीडोट्स (यूनिथिओल), मूत्रवर्धक और डायफोरेटिक्स, आदि। रोकथाम: उत्पादन का मशीनीकरण। प्रक्रियाएं, कुशल वेंटिलेशन, आदि।
विस्मुट(अव्य. बिस्मुथम), द्वि, वी आवधिक समूह का रासायनिक तत्व
मेंडेलीव की प्रणाली; परमाणु क्रमांक 83, परमाणु द्रव्यमान 208.980; गुलाबी रंगत के साथ सिल्वर-ग्रे धातु। प्राकृतिक बिस्मथ में एक स्थिर आइसोटोप, 209Bi होता है। वी. को 15-16वीं शताब्दी में जाना जाता था, लेकिन लंबे समय तक इसे एक प्रकार का टिन माना जाता था,
सीसा या सुरमा. 18वीं शताब्दी के मध्य में बिस्मथ को एक स्वतंत्र धातु के रूप में मान्यता दी गई थी। फ़्रांसीसी रसायनशास्त्री ए. लवॉज़ियर ने इसे सरल पिंडों की सूची में शामिल किया। "बिस्मथ" नाम की उत्पत्ति स्थापित नहीं है। पृथ्वी की पपड़ी में बिस्मथ सामग्री द्रव्यमान के अनुसार 2·10-5% है। बिस्मथ प्राकृतिक रूप से होता है
कई खनिजों के रूप में, जिनमें से सबसे महत्वपूर्ण हैं बिस्मथ चमक Bi2S3, देशी बिस्मथ Bi, बिस्माइट Bi2O3, आदि। बड़ी मात्रा में, लेकिन छोटी सांद्रता में, बिस्मथ सीसा-जस्ता, तांबा, मोलिब्डेनम में एक आइसोमोर्फिक अशुद्धता के रूप में पाया जाता है। -कोबाल्ट और टिन-टंगस्टन अयस्क। वैश्विक खपत का लगभग 90% पॉलिमेटैलिक अयस्कों के प्रसंस्करण के दौरान बिस्मथ के संबंधित उत्पादन द्वारा कवर किया जाता है। भौतिक और रासायनिक गुण। बिस्मथ में एक समचतुर्भुज जाली होती है
अवधि ए- 4.7457 ए और कोण α-57?14 " 13"" . घनत्व 9.80 जी/सेमी 3; टीपीएल 271.3°सेल्सियस; टीकिप 1560 डिग्री सेल्सियस। विशिष्ट ताप क्षमता (20 डिग्री सेल्सियस) 123.5 जे/किलोके (0.0294 कैल/जी·साथ); तापीय गुणांक
कमरे के तापमान पर रैखिक विस्तार 13.3·10-6; तापीय चालकता (20°C) 8.37 डब्ल्यू/(एम·को) ; विद्युत प्रतिरोधकता (20°C) 106.8 10-8 ओम· एम(106.8·10-6 ओम· सेमी). बिस्मथ सर्वाधिक प्रतिचुम्बकीय धातु है। विशिष्ट चुंबकीय संवेदनशीलता -1.35·10-6 है। चुंबकीय क्षेत्र के प्रभाव में, बिस्मथ का विद्युत प्रतिरोध अन्य धातुओं की तुलना में काफी हद तक बढ़ जाता है, जिसका उपयोग मजबूत चुंबकीय क्षेत्र के प्रेरण को मापने के लिए किया जाता है। बिस्मथ का थर्मल न्यूट्रॉन कैप्चर क्रॉस सेक्शन छोटा है (34 10-31)। एम 2 या 0.034 खलिहान)। कमरे के तापमान पर, बिस्मथ नाजुक होता है, आसानी से दरार वाले तल पर विभाजित हो जाता है, और चीनी मिट्टी के मोर्टार में पीसकर पाउडर बना लिया जाता है। 120-150 डिग्री सेल्सियस के तापमान पर फोर्जिंग; गर्म दबाव (240-250°C पर) द्वारा इसका उपयोग 0.1 तक के व्यास वाले तार बनाने के लिए किया जा सकता है मिमी, साथ ही 0.2-0.3 की मोटाई वाली प्लेटें मिमी. बैगन कठोरता 93 एमएन/एम 2 (9,3 केजीएफ/मिमी 2), मोह्स 2.5 के अनुसार। पिघलने पर, V. की मात्रा 3.27% कम हो जाती है। बिस्मथ शुष्क हवा में स्थिर रहता है, लेकिन आर्द्र हवा में इसकी सतह स्थिर रहती है
ऑक्सीकरण. 1000°C से ऊपर गर्म करने पर यह नीली लौ के साथ जलकर Bi2O3 ऑक्साइड बनाता है . वोल्टेज श्रृंखला में, बिस्मथ हाइड्रोजन और तांबे के बीच खड़ा होता है, इसलिए यह तनु सल्फ्यूरिक और हाइड्रोक्लोरिक एसिड में नहीं घुलता है; सांद्र सल्फ्यूरिक और नाइट्रिक एसिड में विघटन SO2 और संबंधित नाइट्रोजन ऑक्साइड की रिहाई के साथ होता है। बिस्मथ 2, 3 और 5 की संयोजकता प्रदर्शित करता है। निम्न संयोजकता वाले बिस्मथ यौगिक
इनका मूल चरित्र होता है, उच्चतर वाले अम्लीय होते हैं। दुनिया में ऑक्सीजन यौगिकों में से, सबसे महत्वपूर्ण ट्राइऑक्साइड Bi2O3 है, जो गर्म होने पर अपने पीले रंग को लाल-भूरे रंग में बदल देता है। Bi2O3 का उपयोग बिस्मथ लवण प्राप्त करने के लिए किया जाता है। तनु विलयनों में बिस्मथ लवण जल-अपघटित हो जाते हैं। BiCl3 क्लोराइड ऑक्सीक्लोराइड BiOCl, Bi नाइट्रेट (NO3)3 के अवक्षेपण के साथ हाइड्रोलाइज्ड होता है - मुख्य नमक BiONO3·BiOOH के अवक्षेपण के साथ। इसके शुद्धिकरण के लिए वी. लवण की हाइड्रोलाइज करने की क्षमता का उपयोग किया जाता है। 5-वैलेंट बिस्मथ के यौगिकों को प्राप्त करना कठिन है; वे प्रबल ऑक्सीकरण एजेंट हैं। KBiO3 नमक (एनहाइड्राइड Bi2O5 के अनुरूप) KOH, KCl और Bi2O3 सस्पेंशन के मिश्रण के उबलते घोल के इलेक्ट्रोलिसिस के दौरान प्लैटिनम एनोड पर भूरे-लाल अवक्षेप के रूप में बनता है। बिस्मथ हैलोजन और सल्फर के साथ आसानी से मिल जाता है। जब एसिड बिस्मथ और मैग्नीशियम के मिश्र धातु पर कार्य करते हैं, तो बिस्मथिन (बिस्मथ हाइड्रोजन) BiH3 बनता है; आर्सिन AsH3 के विपरीत, बिस्मथिन एक अस्थिर यौगिक है और इसे इसके शुद्ध रूप में (अतिरिक्त हाइड्रोजन के बिना) प्राप्त नहीं किया गया है। कुछ धातुओं (सीसा, कैडमियम, टिन) के साथ, बिस्मथ कम पिघलने वाली यूटेक्टिक्स बनाता है; सोडियम, पोटेशियम, मैग्नीशियम और कैल्शियम के साथ - इंटरमेटेलिक यौगिक जिनका गलनांक मूल घटकों के गलनांक से काफी अधिक होता है। बिस्मथ पिघले हुए एल्यूमीनियम, क्रोमियम और लोहे के साथ परस्पर क्रिया नहीं करता है। रसीद एवं आवेदन. बिस्मथ की मुख्य मात्रा उप-उत्पाद के रूप में उत्पादित होती है
रफ लेड (वेर्कब्ले) का अग्नि शोधन। पाइरोमेटालर्जिकल विधि K, Na, Mg और Ca के साथ दुर्दम्य इंटरमेटेलिक यौगिक बनाने के लिए बिस्मथ की क्षमता पर आधारित है। निर्दिष्ट धातुओं को पिघले हुए सीसे में मिलाया जाता है और परिणामस्वरूप वी. (सॉस) के साथ ठोस यौगिकों को पिघल से अलग किया जाता है। हाइड्रोफ्लोरोसिलिकिक घोल में सीसे के इलेक्ट्रोलाइटिक शोधन के साथ-साथ तांबे के उत्पादन से धूल और कीचड़ से महत्वपूर्ण मात्रा में बिस्मथ निकाला जाता है। बिस्मथ युक्त मैल और कीचड़ को क्षारीय स्लैग के नीचे गलाया जाता है। परिणामी खुरदरी धातु में As, Sb, Cu, Pb, Zn, Se, Te, Ag और कुछ अन्य तत्वों की अशुद्धियाँ होती हैं। अपने स्वयं के अयस्कों से बिस्मथ को गलाने का काम छोटे पैमाने पर किया जाता है। सल्फाइड अयस्कों को लोहे के स्क्रैप के साथ गलाने द्वारा संसाधित किया जाता है। ऑक्सीकृत अयस्कों से, कम पिघलने वाले प्रवाह की एक परत के नीचे कोयले के साथ सोना कम हो जाता है। खुरदरे पानी की खुरदुरी सफाई के लिए इनका उपयोग अशुद्धियों की संरचना के आधार पर किया जाता है।
विभिन्न विधियाँ: ज़ीगराइजेशन, क्षारीय फ्लक्स के तहत ऑक्सीडेटिव शोधन, सल्फर के साथ संलयन, आदि। पिघली हुई धातु के माध्यम से क्लोरीन प्रवाहित करके सीसे की अशुद्धता को अलग करना (0.01% तक) सबसे कठिन है। वाणिज्यिक बिस्मथ में शामिल है
99.9-99.98% बेस मेटल। उच्च शुद्धता के वी. अक्रिय गैस के वातावरण में क्वार्ट्ज नौकाओं में ज़ोन पुन: क्रिस्टलीकरण द्वारा प्राप्त किए जाते हैं। बिस्मथ की एक महत्वपूर्ण मात्रा का उपयोग सीसा, टिन, कैडमियम युक्त कम पिघलने वाले मिश्र धातुओं की तैयारी के लिए किया जाता है, जिनका उपयोग दंत प्रोस्थेटिक्स में किया जाता है, लकड़ी के मैट्रिक्स से क्लिच के निर्माण के लिए, स्वचालित अग्निशमन उपकरणों में पिघलने वाले कैप के रूप में किया जाता है। जब कवच-भेदी प्रोजेक्टाइल आदि पर सोल्डरिंग कैप। पिघला हुआ बिस्मथ परमाणु रिएक्टरों में शीतलक के रूप में काम कर सकता है। Te के साथ यौगिकों में बिस्मथ की खपत
थर्मोइलेक्ट्रिक जनरेटर। ये यौगिक, तापीय चालकता, विद्युत चालकता और थर्मोइलेक्ट्रोमोटिव बल के अनुकूल संयोजन के कारण, तापीय ऊर्जा को उच्च दक्षता (~7%) के साथ विद्युत ऊर्जा में परिवर्तित करना संभव बनाते हैं। स्टेनलेस स्टील्स में बिस्मथ मिलाने से उनकी मशीनेबिलिटी में सुधार होता है। बिस्मथ यौगिकों का उपयोग कांच निर्माण, चीनी मिट्टी की चीज़ें, फार्मास्यूटिकल्स में किया जाता है
उद्योग। घुलनशील बिस्मथ लवण जहरीले होते हैं और इनका प्रभाव पारे के समान होता है।
साहित्य
1. उद्योग में हानिकारक पदार्थ, सामान्यतः। ईडी। एन. वी. लाज़रेवा, 6वां संस्करण, भाग 2, लेनिनग्राद, 1971।
2. इवानोव वी.वी. तत्वों की पारिस्थितिक भू-रसायन विज्ञान। 3. सुरमा और इसके उत्पादन के लिए एक नई तकनीक बनाने के क्षेत्र में अनुसंधान
यौगिक, संग्रह में: सुरमा की रसायन विज्ञान और प्रौद्योगिकी, फ्रांस, 1965। 4. संक्षिप्त रासायनिक विश्वकोश, खंड 5, एम., 1967; 5. नेक्रासोव बी.वी., जनरल केमिस्ट्री के बुनियादी सिद्धांत, खंड 1, एम., 1965; 6. पोगोडिन एस.ए., आर्सेनिक, पुस्तक में: संक्षिप्त रासायनिक विश्वकोश, खंड 3, एम., 1964 7. रेमी जी., अकार्बनिक रसायन विज्ञान का पाठ्यक्रम, ट्रांस। जर्मन से, खंड 1, एम., 1963, पृ. 700-712; 8. थॉमसन जे.जी., बिस्मथ, ट्रांस। [अंग्रेजी से], एल., 1932; 9. शियानोव ए.जी., एंटीमनी प्रोडक्शन, एम., 1961; धातुकर्म के मूल सिद्धांत, खंड 5, एम.,
1968; 10. बाध्य नाइट्रोजन की रसायन विज्ञान और प्रौद्योगिकी, [एम.-एल.], 1934; केएचई, खंड 1, एम., 1961।
नाइट्रोजन उपसमूह में पाँच तत्व होते हैं: नाइट्रोजन, फास्फोरस, आर्सेनिक, सुरमा और बिस्मथ। ये डी.आई. मेंडेलीव की आवर्त प्रणाली के समूह V के पी-तत्व हैं।
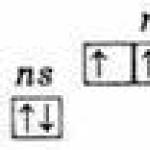
बाहरी ऊर्जा स्तर पर, इन तत्वों के परमाणुओं में पाँच इलेक्ट्रॉन होते हैं, जिनका विन्यास ns2np3 होता है और इन्हें निम्नानुसार वितरित किया जाता है:

इसलिए, इन तत्वों की उच्चतम ऑक्सीकरण अवस्था +5 है, न्यूनतम -3 है, और +3 भी विशिष्ट है।
बाहरी स्तर पर तीन अयुग्मित इलेक्ट्रॉनों की उपस्थिति इंगित करती है कि अउत्तेजित अवस्था में, तत्वों के परमाणुओं की संयोजकता 3 होती है। नाइट्रोजन परमाणु के बाहरी स्तर में केवल दो उपस्तर होते हैं - 2s और 2p। इस उपसमूह के शेष तत्वों के परमाणुओं में बाहरी ऊर्जा स्तर पर डी-उपस्तर की रिक्त कोशिकाएँ होती हैं। नतीजतन, बाहरी स्तर के एस-इलेक्ट्रॉनों में से एक, उत्तेजना पर, उसी स्तर के डी-उपस्तर पर जा सकता है, जिससे 5 अयुग्मित इलेक्ट्रॉनों का निर्माण होता है।

फॉस्फोरस का बाहरी इलेक्ट्रॉन आवरण (अउत्तेजित परमाणु)

उत्तेजित फॉस्फोरस परमाणु का बाहरी इलेक्ट्रॉन आवरण।
इस प्रकार, उत्तेजित अवस्था में फॉस्फोरस, आर्सेनिक, एंटीमनी और बिस्मथ में 5 अयुग्मित इलेक्ट्रॉन होते हैं, और इस अवस्था में उनकी संयोजकता 5 होती है।
नाइट्रोजन परमाणु में, दूसरे स्तर में डी-उपस्तर की अनुपस्थिति के कारण इस तरह से एक इलेक्ट्रॉन को उत्तेजित करना असंभव है। इसलिए, नाइट्रोजन पेंटावेलेंट नहीं हो सकती है, लेकिन यह एकाकी इलेक्ट्रॉन जोड़ी 2s2 के कारण दाता-स्वीकर्ता तंत्र द्वारा चौथा सहसंयोजक बंधन बना सकती है। नाइट्रोजन परमाणु के लिए एक अन्य प्रक्रिया भी संभव है। जब दो 2s इलेक्ट्रॉनों में से एक को हटा दिया जाता है, तो नाइट्रोजन एकल आवेशित टेट्रावेलेंट आयन N+ में बदल जाता है।

नाइट्रोजन से बिस्मथ तक, परमाणु त्रिज्या बढ़ती है, और आयनीकरण क्षमता कम हो जाती है। तटस्थ परमाणुओं के अपचायक गुण N से Bi तक बढ़ जाते हैं, और ऑक्सीकरण गुण कमजोर हो जाते हैं (तालिका 21 देखें)।
हाइड्रोजन, नाइट्रोजन, फॉस्फोरस और आर्सेनिक के साथ ध्रुवीय यौगिक RH3 बनाते हैं, जो -3 की नकारात्मक ऑक्सीकरण अवस्था प्रदर्शित करते हैं। RH3 अणुओं का आकार पिरामिड जैसा होता है। इन यौगिकों में, हाइड्रोजन के साथ तत्वों के बंधन ऑक्सीजन उपसमूह और विशेष रूप से हैलोजन उपसमूह के तत्वों के संबंधित यौगिकों की तुलना में अधिक मजबूत होते हैं। इसलिए, जलीय घोल में नाइट्रोजन उपसमूह के तत्वों के हाइड्रोजन यौगिक हाइड्रोजन आयन नहीं बनाते हैं।

ऑक्सीजन के साथ, नाइट्रोजन उपसमूह के तत्व सामान्य सूत्र R2O3 और R2O5 के ऑक्साइड बनाते हैं। ऑक्साइड एसिड HRO2 और HRO3 (और नाइट्रोजन को छोड़कर ऑर्थो एसिड H3RO4) के अनुरूप हैं। उपसमूह के भीतर, ऑक्साइड की प्रकृति इस प्रकार बदलती है: N2O3 - अम्लीय ऑक्साइड; Р4О6 - कमजोर अम्लीय ऑक्साइड; As2O3 प्रमुख अम्लीय गुणों वाला एक उभयधर्मी ऑक्साइड है; Sb2O3 मूल गुणों की प्रधानता वाला एक उभयधर्मी ऑक्साइड है; Bi2O3 मुख्य ऑक्साइड है। इस प्रकार, R2O3 और R2O5 संरचना वाले ऑक्साइड के अम्लीय गुण तत्व की परमाणु संख्या बढ़ने के साथ कम हो जाते हैं।
जैसा कि तालिका से देखा जा सकता है। 21, नाइट्रोजन से बिस्मथ तक उपसमूह के भीतर, गैर-धातु गुण कम हो जाते हैं और धात्विक गुण बढ़ जाते हैं। सुरमा में, ये गुण समान रूप से व्यक्त होते हैं; बिस्मथ में, धात्विक गुण प्रबल होते हैं, नाइट्रोजन में गैर-धात्विक गुण प्रबल होते हैं। फॉस्फोरस, आर्सेनिक और एंटीमनी कई एलोट्रोपिक यौगिक बनाते हैं।
नाइट्रोजन।
रसीद
प्रयोगशालाओं में इसे अमोनियम नाइट्राइट की अपघटन प्रतिक्रिया द्वारा प्राप्त किया जा सकता है:
प्रतिक्रिया ऊष्माक्षेपी होती है, जिससे 80 किलो कैलोरी (335 kJ) निकलती है, इसलिए ऐसा होने पर बर्तन को ठंडा किया जाना चाहिए (हालाँकि प्रतिक्रिया शुरू करने के लिए अमोनियम नाइट्राइट को गर्म किया जाना चाहिए)।
व्यवहार में, यह प्रतिक्रिया अमोनियम सल्फेट के गर्म संतृप्त घोल में सोडियम नाइट्राइट के संतृप्त घोल को बूंद-बूंद करके की जाती है, और विनिमय प्रतिक्रिया के परिणामस्वरूप बनने वाला अमोनियम नाइट्राइट तुरंत विघटित हो जाता है।
इस मामले में निकलने वाली गैस अमोनिया, नाइट्रोजन ऑक्साइड (I) और ऑक्सीजन से दूषित होती है, जिससे इसे सल्फ्यूरिक एसिड, आयरन (II) सल्फेट और गर्म तांबे के घोल से क्रमिक रूप से गुजारकर शुद्ध किया जाता है। फिर नाइट्रोजन को सुखाया जाता है।
नाइट्रोजन उत्पादन के लिए एक अन्य प्रयोगशाला विधि पोटेशियम डाइक्रोमेट और अमोनियम सल्फेट के मिश्रण को गर्म करना है (वजन के अनुसार 2:1 के अनुपात में)। प्रतिक्रिया समीकरणों के अनुसार आगे बढ़ती है:
शुद्धतम नाइट्रोजन धातु एज़ाइड के अपघटन द्वारा प्राप्त की जा सकती है:
तथाकथित "वायु" या "वायुमंडलीय" नाइट्रोजन, यानी उत्कृष्ट गैसों के साथ नाइट्रोजन का मिश्रण, गर्म कोक के साथ हवा की प्रतिक्रिया से प्राप्त होता है, जो तथाकथित "जनरेटर" या "वायु" गैस - कच्चा माल पैदा करता है रासायनिक संश्लेषण और ईंधन के लिए। यदि आवश्यक हो तो कार्बन मोनोऑक्साइड को अवशोषित करके नाइट्रोजन को इससे अलग किया जा सकता है।
आणविक नाइट्रोजन का उत्पादन औद्योगिक रूप से तरल हवा के आंशिक आसवन द्वारा किया जाता है। इस विधि का उपयोग "वायुमंडलीय नाइट्रोजन" प्राप्त करने के लिए भी किया जा सकता है। सोखना और झिल्ली गैस पृथक्करण विधि का उपयोग करने वाले नाइट्रोजन प्रतिष्ठान और स्टेशन भी व्यापक रूप से उपयोग किए जाते हैं।
प्रयोगशाला विधियों में से एक ~700 डिग्री सेल्सियस के तापमान पर कॉपर (II) ऑक्साइड के ऊपर अमोनिया प्रवाहित करना है:
अमोनिया को उसके संतृप्त घोल से गर्म करके निकाला जाता है। CuO की मात्रा गणना से 2 गुना अधिक है। उपयोग से तुरंत पहले, नाइट्रोजन को तांबे और उसके ऑक्साइड (II) (भी ~700 डिग्री सेल्सियस) से गुजारकर ऑक्सीजन और अमोनिया से शुद्ध किया जाता है, फिर सांद्र सल्फ्यूरिक एसिड और सूखी क्षार के साथ सुखाया जाता है। प्रक्रिया काफी धीमी है, लेकिन यह इसके लायक है: प्राप्त गैस बहुत साफ है।
चित्र में. चित्र 15.12 आवर्त सारणी में पाँच समूह V तत्वों का स्थान दर्शाता है। ये सभी पी-तत्व हैं, और उनके परमाणुओं के बाहरी आवरण की विशेषता एक इलेक्ट्रॉन विन्यास है। तालिका में 15.10 समूह V के तत्वों के कुछ गुण दिखाता है। जैसे-जैसे आप इस समूह के निचले भाग में जाते हैं, इसके तत्वों के गुण अधात्विक से धात्विक में बदल जाते हैं। नाइट्रोजन और फास्फोरस विशिष्ट अधातुएँ हैं। आर्सेनिक और एंटीमनी धात्विक लक्षण दर्शाते हैं और बिस्मथ एक धातु है।
नाइट्रोजन और फास्फोरस
समूह V में ये दो सबसे महत्वपूर्ण तत्व हैं।
सामान्य परिस्थितियों में नाइट्रोजन एक गैस है जिसमें द्विपरमाणुक गैस होती है

चावल। 15.12. आवर्त सारणी में समूह V तत्वों की स्थिति।
तालिका 15.10. समूह V तत्वों के गुण

अणुओं यह रंगहीन, गंधहीन और स्वादहीन है और इसकी कोई ध्यान देने योग्य प्रतिक्रिया नहीं है।
फास्फोरस तीन एलोट्रोपिक रूपों में मौजूद है, जिनमें से दो सबसे आम लाल फास्फोरस और कम स्थिर सफेद फास्फोरस हैं। इन अपरूपों की संरचना पर अनुभाग में चर्चा की गई थी। 3.2. तालिका में 15.11 लाल और सफेद फास्फोरस के कुछ गुणों की तुलना की गई है।
यद्यपि नाइट्रोजन सबसे अधिक विद्युत ऋणात्मक तत्वों में से एक है (तालिका 2.2 देखें), इसकी प्रतिक्रियाशीलता अपेक्षाकृत कम है। इसका कारण यह है कि इसके द्विपरमाणुक अणु गैर-ध्रुवीय होते हैं, और दो परमाणुओं के बीच त्रिबंध होते हैं
तालिका 15.11. सफेद और लाल फास्फोरस के गुण


चावल। 15.13. नाइट्रोजन परमाणु के चार-संकर कक्षक।
इनमें मौजूद नाइट्रोजन की ताकत बहुत अधिक होती है। इस बंधन की एन्थैल्पी +944 kJ/mol है।
नाइट्रोजन और फास्फोरस दोनों -3 से 4-5 तक ऑक्सीकरण अवस्था के साथ अपने यौगिकों में प्रवेश कर सकते हैं। उदाहरण के लिए, अमोनिया में, नाइट्रोजन की ऑक्सीकरण अवस्था +3 होती है, और नाइट्रेट आयन में इसकी ऑक्सीकरण अवस्था -1-5 होती है।
इन दोनों तत्वों के परमाणु तीन इलेक्ट्रॉनों को जोड़ने में सक्षम हैं, जिससे उनका बाहरी उपकोश भर जाता है; परिणामस्वरूप, नाइट्राइड आयन और फ़ॉस्फाइड आयन बनते हैं, हालाँकि, दोनों तत्व सहसंयोजक यौगिक बनाते हैं। इस मामले में, उनके परमाणु चार हाइब्रिड-ऑर्बिटल्स बनाते हैं, जिनमें से प्रत्येक में टेट्राहेड्रल अभिविन्यास होता है (चित्र 15.13)। इनमें से तीन ऑर्बिटल्स में एक इलेक्ट्रॉन होता है। ये वे इलेक्ट्रॉन हैं जो सहसंयोजक बंधों के निर्माण के दौरान अन्य परमाणुओं के इलेक्ट्रॉनों के साथ साझा होते हैं। चौथे कक्षक में इलेक्ट्रॉनों का एक अकेला जोड़ा होता है। इसका उपयोग समन्वय (दाता-स्वीकर्ता) बंधन बनाने के लिए किया जा सकता है। उदाहरण के लिए, अमोनियम आयन में, नाइट्रोजन का अकेला जोड़ा हाइड्रोजन आयन के रिक्त-कक्षक के साथ अतिव्यापन करता है।
एनएस 2 एनपी 3.
नाइट्रोजन और उसके यौगिक
प्रकृति में, यह मुक्त रूप में (हवा में सामग्री - 78 मात्रा%), खनिजों (सॉल्टपीटर) के रूप में, तेल में, पौधे और पशु प्रोटीन में पाया जाता है।
भौतिक गुण
सामान्य परिस्थितियों में, एन 2 एक रंगहीन, गंधहीन और स्वादहीन गैस है।
टी ओ किप. = -195.8 o C.
नाइट्रोजन उत्पादन:
क) उद्योग में - वायु द्रवीकरण,
बी) प्रयोगशाला में: NH 4 NO 2 ® N 2 + H 2 O।
नाइट्रोजन और उसके यौगिकों के रासायनिक गुण।
आणविक नाइट्रोजन की रासायनिक गतिविधि बहुत कम होती है, क्योंकि ट्रिपल सहसंयोजक बंधन के लिए धन्यवाद, अणु बहुत मजबूत है (ई बांड = 946 केजे/मोल)। हालाँकि, नाइट्रोजन के लिए कई अलग-अलग यौगिक ज्ञात हैं, जिनमें यह ऑक्सीकरण अवस्थाएँ -3, -2, -1, +1, +2, +3, +4, +5 प्रदर्शित करता है।
ऋणात्मक ऑक्सीकरण अवस्था वाले नाइट्रोजन यौगिक।
3
1)एनएच 3 - अमोनिया– तीखी गंध वाली रंगहीन गैस, आसानी से द्रवीकृत हो जाती है।
अमोनिया उत्पादन:
ए) एन 2 + 3एच 2 « 2एनएच 3 (कैट: फ़े, अल 2 ओ 3, के 2 ओ)
बी) 2एनएच 4 सीआई + सीए(ओएच) 2 = सीएसीआई 2 + 2एनएच 3 + 2एच 2 ओ
अमोनिया के रासायनिक गुण:
ए) एनएच 3 + एच 2 ओ « एनएच 4 ओएच (अधिकतम एकाग्रता = 25%)
बी) एनएच 3 + एचसीआई « एनएच 4 सीआई (डॉन-एसीसी तंत्र: एनएच 3 + एच + = एनएच 4 +)
ग) दहन ऑक्सीजन की मात्रा के आधार पर अलग-अलग तरीके से होता है:
4एनएच 3 + 3ओ 2 (सप्ताह) = 2एन 2 + 6एच 2 ओ
4NH 3 + 5О 2(g) = 2NO+ 6H 2 O
डी) ओवीआर में, अमोनिया हमेशा एक कम करने वाला एजेंट होता है:
3CuO + 2NH 3 = 3Cu + N 2 + 3H 2 O
2) एनएच 4 ओएच - अमोनियम हाइड्रॉक्साइड- कमजोर आधार, अस्थिर, जटिल यौगिक (अमोनिया) बनाता है:
Cu(OH) 2 + 4NH 4 OH = (OH) 2 + 4H 2 O
3) अमोनियम लवण:
ए) हाइड्रोलिसिस के कारण समाधानों में थोड़ी अम्लीय प्रतिक्रिया होती है:
NH 4 CI + HON « NH 4 OH + HCI (NH 4 + + HON « NH 4 OH + H +)
बी) अमोनियम लवण का थर्मल अपघटन आयन की प्रकृति के आधार पर अलग-अलग होता है: यदि आयन एक ऑक्सीकरण एजेंट है, तो अपघटन प्रतिक्रिया अपरिवर्तनीय है:
एनएच 4 सीआई « एनएच 3 + एचसीआई
NH 4 NO 3 = N 2 O+ 2H 2 O
4) अमाइड्सतब बनते हैं जब अमोनिया में H परमाणुओं को धातु द्वारा प्रतिस्थापित किया जाता है:
2K + 2NH 3 = 2KNH 2 + H 2
5) नाइट्राइड्सधातुओं और अधातुओं के लिए जाना जाता है और, उनकी प्रकृति के आधार पर, अलग-अलग तरीके से विघटित होते हैं:
a)Li 3 N + 3H 2 O = 3LiOH + NH 3
Ca 3 N 2 + 6HCI = 3CaCI 2 + 2NH 3
बी)सीआई 3 एन + 6एचसीआई = 3एचसीआईओ + एनएच 3
ऑक्सीकरण अवस्था - 2
एन 2 एच 4 - हाइड्राज़ीन(डायमाइड) एक रंगहीन तरल, एक अच्छा विलायक, अमोनिया से कम स्थिर है।
हाइड्राज़ीन की तैयारी:
2NH 3 + NaCIO = N 2 H 4 + NaCI + H 2 O
हाइड्राज़ीन के रासायनिक गुण:
एन 2 एच 4 + एच 2 ओ « + +ओएच -
एच 2 ओ « 2+ +ओएच -
बी) नाइट्रोजन में जलना: एन 2 एच 4 + ओ 2 = एन 2 + 2 एच 2 ओ
सी) मजबूत कम करने वाला एजेंट: एन 2 एच 4 + 2 एच 2 ओ 2 = एन 2 + 4 एच 2 ओ
ऑक्सीकरण अवस्था - 1
एनएच 2 ओएच - हाइड्रॉक्सिलमाइन, एक सफेद क्रिस्टलीय पदार्थ, H 2 O 2 और हाइड्राज़ीन N 2 H 4 के बीच एक मध्यवर्ती स्थिति रखता है।
हाइड्रॉक्सिलमाइन की तैयारी:
HNO 3 + 6H = NH 2 OH + 2H 2 O
हाइड्रॉक्सिलमाइन के रासायनिक गुण:
ए) जलीय घोल - कमजोर आधार:
एनएच 2 ओएच + एच 2 ओ « + +ओएच -
बी) हाइड्रॉक्सिलमोनियम लवण (स्थिर) एसिड के साथ दिए जाते हैं:
एनएच 2 ओएच + एचसीआई = + + सीआई -
ग) विघटित (अअनुपातिक प्रतिक्रिया):
3एनएच 2 ओएच = एनएच 3 + एन 2 + 3एच 2 ओ
घ) एच 2 ओ 2 की तरह, पर्यावरण के आधार पर यह रेडॉक्स द्वैत प्रदर्शित करता है:
ठीक है: 2NH 2 OH + 4FeSO 4 + 3H 2 SO 4 = 2Fe 2 (SO 4) 3 + (NH 4) 2 SO 4 + 2H 2 O
बहाल: 2NH 2 OH + I 2 + 2KOH = N 2 + 2KI + 4H 2 O
सकारात्मक एस के साथ सबसे महत्वपूर्ण नाइट्रोजन यौगिक। ओ
ऑक्सीकरण अवस्था + 3
1) एन 2 ओ 3- नाइट्रिक ऑक्साइड (III) या "नाइट्रस एनहाइड्राइड" एक अस्थिर नीला-हरा तरल है:
a) N 2 O 3 ® NO 2 (तीखी गंध वाली भूरी गैस) + NO (रंगहीन गैस);
बी) पानी के साथ एक अस्थिर एसिड बनाता है: एन 2 ओ 3 + एच 2 ओ « 2 एचएनओ 2
2) HNO2- नाइट्रस एसिड (मध्यम शक्ति):
HNO 2 « H + + NO 2 - (K = 5.1 . 10 -4).
3) नाइट्राइट- नाइट्रस एसिड के लवण, रेडॉक्स प्रतिक्रियाओं में अन्य एन +3 यौगिकों की तरह, द्वैत प्रदर्शित करते हैं:
ठीक है: KNO 2 + NH 3 = N 2 + H 2 O
बहाल: KNO 2 + H 2 O 2 = KNO 3 + H 2 O
अधिकतम ऑक्सीकरण अवस्था + 5
1) एन 2 ओ 5- नाइट्रिक ऑक्साइड (वी) या "नाइट्रिक एनहाइड्राइड" एक रंगहीन क्रिस्टलीय पदार्थ है; पानी में घुलने पर यह अम्ल देता है।
2) HNO3- नाइट्रिक एसिड, मजबूत: HNO 3 ® H + + NO 3 -।
3) नाइट्रेट– नाइट्रिक एसिड लवण:
ए) प्रयोगशाला में आप थर्मल अपघटन प्रतिक्रिया द्वारा एन 2 ओ प्राप्त कर सकते हैं: एनएच 4 एनओ 3 ® एन 2 ओ + एच 2 ओ;
बी) धातु नाइट्रेट, गतिविधि श्रृंखला में धातु की स्थिति के आधार पर, अलग-अलग तरीके से विघटित होते हैं:
बाईं ओर एमजी:नाइट्रेट ® नाइट्राइट + ओ 2
एमजी-सीयू:नाइट्रेट ® धातु ऑक्साइड + NO 2 + O 2
दाईं ओर Cu:नाइट्रेट ® धातु + NO 2 + O 2।
4) सभी एन +5 यौगिक प्रबल ऑक्सीकरण एजेंट हैं; धातुओं के साथ नाइट्रिक एसिड की परस्पर क्रिया:
a) कोई भी धातु HNO 3 से हाइड्रोजन नहीं छोड़ती;
बी) सामान्य स्थिति में धातुएं Al, Zn, Cr, Fe, Pb, Au, Pt निष्क्रिय हो जाती हैं;
ग) गर्म होने पर, यह अधिकांश धातुओं के साथ परस्पर क्रिया करता है, और धातु जितनी अधिक सक्रिय होती है और एसिड जितना अधिक पतला होता है, N +5 की कमी उतनी ही मजबूत होती है:
निष्क्रिय हुंह: Cu + 4HNO 3 (सांद्र) = Cu (NO 3) 2 + 2NO 2 + 2H 2 O
3Cu + 8HNO 3(पतला) = 3Cu(NO 3) 2 + 2NO + 4H 2 O
संपत्तियां। हुंह: 4Ca + 10HNO3(सांद्र) = 4Ca(NO3)2 + N2O + 5H2O
5Ca + 12HNO3(पतला) = 5Ca(NO3)2 + N2 + 6H2O
4Ca + 9HNO 3 (अल्ट्रा डिल.) = 4Ca(NO 3) 2 + NH 3 (या NH 4 NO 3) + 3H 2 O
फॉस्फोरस और उसके यौगिक
यह प्रकृति में पाया जाता है: ए) खनिजों (फॉस्फोराइट्स और एपेटाइट्स) के रूप में, बी) पौधों और पशु प्रोटीन में, सी) मस्तिष्क के ऊतकों और हड्डियों में।
भौतिक गुण
एलोट्रोपेन:
ए) सफेद फास्फोरस(पी 4) - चतुष्फलकीय संरचना, जहरीला, अंधेरे में चमकता है, कार्बन डाइसल्फ़ाइड में घुलनशील; भंडारण के दौरान यह धीरे-धीरे लाल फास्फोरस में बदल जाता है, इसलिए इसे पानी के नीचे संग्रहित किया जाता है;
बी) लाल फास्फोरस(पी 2 एन - पॉलिमर) - संरचना के कई रूप हैं, गैर विषैले, कार्बन डाइसल्फ़ाइड में अघुलनशील, भंडारण के दौरान स्थिर, कम प्रतिक्रियाशील;
वी) काला फास्फोरस– पिरामिडनुमा संरचना, स्तरित, ग्रेफाइट के समान, अर्धचालक।
फास्फोरस प्राप्त करना:
फॉस्फोराइट खनिज को कोक और रेत से शांत किया जाता है:
Ca 3 (PO 4) + 5C + 3 SiO 2 = 3CaSiO 3 +2P +5CO
फास्फोरस और उसके यौगिकों के रासायनिक गुण।
फॉस्फोरस की रासायनिक गतिविधि उसके एलोट्रोपिक संशोधन के आधार पर भिन्न होती है। मुख्य ऑक्सीकरण अवस्थाएँ: -3, +1, +3, +5।
1) फास्फोरस की सरल पदार्थों के साथ अभिक्रियाएँ:
पुनर्स्थापनात्मक गुण:ए)पी + ओ 2 ® पी 2 ओ 3, पी 2 ओ 5;
बी) पी + सीआई 2 ® पीसीआई 3, पीसीआई 5; ग) 2पी + 3एस ® पी 2 एस 3
ऑक्सीकरण गुण: a) 2P + 3H 2 ® 2РН 3, b) 2P + 3Ca ® Ca 3 P 2
2) जटिल पदार्थों के साथ फॉस्फोरस की प्रतिक्रियाएँ:
a) पानी के साथ प्रतिक्रिया नहीं होती है,
बी) 2P + 5H 2 SO 4 (संक्षिप्त) ® 2H 3 PO 4 + 5SO 2 + 2H 2 O,
सी) पी + एचएनओ 3 (संक्षिप्त) ® एच 3 पीओ 4 + एनओ (या एनओ 2)।
3)न्यूनतम ऑक्सीकरण अवस्था - 3
ए) पीएच 3- फॉस्फीन, लहसुन जैसी गंध वाली एक जहरीली गैस,
जलाया: 2РH 3 + 4О 2 = Р 2 О 5 + 3H 2 O,
कुछ अम्लों के साथ यह फॉस्फोनियम लवण देता है: РH 3 + HI = РH 4 I
बी) धातु फॉस्फाइड– आयनोसहसंयोजक यौगिक
एमजी 3 पी 2 + 6 एच 2 ओ = एमजी(ओएच) 2 + 2РН 3,
Ca 3 P 2 + 6HCI = CaCI 2 + 2PH 3.
4)ऑक्सीकरण अवस्था + 1
एच 3 पीओ 2 या एच [पीओ 2 एच 2 ] - हाइपोफॉस्फोरस एसिड, मजबूत; लवण हाइपोफॉस्फाइट, अत्यधिक घुलनशील, अच्छे कम करने वाले एजेंट हैं।
5)ऑक्सीकरण अवस्था + 3
ए) पी 2 ओ 3 - फॉस्फोरस एनहाइड्राइड, कई संशोधन हैं (पी 2 ओ 3) एन, रंगहीन जहरीले क्रिस्टल;
बी) एच 3 पीओ 3 या एच 2 [पीओ 3 एच] - फॉस्फोरस एसिड, मध्यम शक्ति;
ग) फ़ॉस्फाइट लवण, केवल क्षार धातुओं में घुलनशील (K 2 [PO 3 H]),
पीसीआई 3 + सीआई 2 = पीसीआई 5,
पीसीआई 3 + ओ 2 = पीसीआई 3,
पीसीआई 3 + एचसीआई ® एन।
6)अधिकतम ऑक्सीकरण अवस्था +5
ए) पी 2 ओ 5 - फॉस्फोरस एनहाइड्राइड, सफेद पाउडर, एक संशोधन (पी 2 ओ 5) 2 है, एक मजबूत पानी हटाने वाला एजेंट: पी 2 ओ 5 + 2 एच 2 ओ = 2 एचपीओ 3;
बी) एचपीओ 3 - मेटा, एच 4 पी 2 ओ 7 - पायरो, एच 3 पीओ 4 - ऑर्थोफॉस्फोरिक एसिड, मध्यम शक्ति;
ग) मेटा-, पायरो-, ऑर्थो-फॉस्फेट लवण;
घ) हैलाइड काफी सक्रिय हैं:
पीसीआई 5 + 4एच 2 ओ = एच 3 पीओ 4 +5एचसीआई,
आरएफ 5 + एचएफ = एन।
उपसमूह की सामान्य विशेषताएँ
7 एन, 15 पी, 33 एएस, 51 एसबी, 83 बीआई। उपसमूह में ऊपर से नीचे तक, धात्विक गुण स्वाभाविक रूप से बढ़ते हैं और यह यौगिकों में तत्वों द्वारा प्रदर्शित ऑक्सीकरण अवस्थाओं के मूल्यों के साथ-साथ कुछ भौतिक गुणों के अनुरूप होता है। हालाँकि भौतिक गुणों को एक तालिका में संयोजित करते समय P, As और Sb की एलोट्रॉपी कुछ कठिनाइयाँ पैदा करती है:
तालिका 11
पांचवें समूह, मुख्य उपसमूह के तत्वों के गुण
रासायनिक गुण
1. सरल पदार्थों के साथ वे विभिन्न प्रकार के यौगिक देते हैं, जो विभिन्न रेडॉक्स प्रकृति प्रदर्शित करते हैं:
ए) पुनर्स्थापनात्मक गुण
2पी + 3सीएल 2 = 2पीसीएल 3 (या पीसीएल 5);
4As + 5O 2 = 2As 2 O 5;
2Bi + 3Cl 2 = 2BiCl 3.
बी) ऑक्सीकरण गुण
2P + 3Ca = Ca 3 P 2 ;
2As + 3Mg = Mg 3 As 2.
2. वे उपसमूह के तत्व की प्रकृति के आधार पर एसिड के साथ अलग-अलग तरह से प्रतिक्रिया करते हैं:
2पी + 5एच 2 एसओ 4 = 2एच 3 पीओ 4 + 5एसओ 2 + 2एच 2 ओ;
3As + 5HNO 3 + 2H 2 O = 3H 3 AsO 4 + 5NO;
3Sb + 5HNO 3 = 3HSbO 3 + 5NO + H 2 O;
2Sb + 6H 2 SO 4 सांद्र। = एसबी 2 (एसओ 4) 3 + 3एसओ 2 + 6एच 2 ओ;
Bi + 4HNO 3 = Bi(NO 3) 3 + NO + 2H 2 O.
यह याद रखना चाहिए कि आर्सेनिक उपसमूह के तत्व गतिविधि श्रृंखला में हाइड्रोजन के बाद दिखाई देते हैं।
3. यौगिकों का जल-अपघटन विभिन्न तरीकों से होता है:
ए) पीसीएल 3 + 3एच 2 ओ = एच 3 पीओ 3 + 3एचसीएल;
BiCl 3 + H 2 O ® BiOCl ¯ + 2HCl।
(एसबीसीएल 3) (एसबीओसीएल)
बी) NaNO 2 + H 2 O Û HNO 2 + NaOH;
K 3 PO 4 + H 2 O Û K 2 HPO 4 + KOH;
K 3 AsO 4 + H 2 O Û K 2 HAsO 4 + KOH।
4. तत्वों के अम्ल-क्षार गुणों में परिवर्तन अलग-अलग तरीकों से प्रकट होते हैं
तालिका 12
पांचवें उपसमूह के तत्वों का सबसे महत्वपूर्ण यौगिक
5. यौगिकों की रेडॉक्स क्षमता तत्व के ऑक्सीकरण की डिग्री पर निर्भर करती है:
ए) ई-3- अपचायक कारक
2NH 3 + 6KМnO 4 + 6KOH = 6K 2 MnO 4 + N 2 + 6H 2 O;
2PH 3 + 4O 2 = P 2 O 5 + 3H 2 O.
ऑक्सीडाइज़िंग एजेंट:
2KNO 2 + 4H 2 S = 3S + N 2 + K 2 S + 4H 2 O
ई +3 2BiCl 3 + 3SnCl 2 + 18KOH = 2Bi + 3K 2 SnO 3 + 12KCl + 9H 2 O.
अपचायक कारक:
10KNO 2 +4KМnO 4 +11H 2 SO 4 =10HNO 3 +4MnSO 4 +7K 2 SO 4 +6H 2 O
वी) ई +5 – ऑक्सीडाइज़िंग एजेंट
Na 3 SbO 4 + 2NaJ + H 2 SO 4 = Na 3 SbO 3 + J 2 + Na 2 SO 4 + H 2 O.
समूह 6 के तत्व. (चाल्कोजेन्स)
इलेक्ट्रॉनिक शेल की संरचना:... एनएस 2 एनपी 4.
8 ओ, 16 एस, 34 से, 52 टी, 84 पो (रेडियोधर्मी)।
ऑक्सीजन और उसके यौगिक
पृथ्वी पर सबसे आम तत्व: हवा में 21% (मात्रा के अनुसार), एच 2 ओ, खनिज और कार्बनिक पदार्थों का हिस्सा।
भौतिक गुण
पदार्थों के रूप में विद्यमान है:
ए) "ऑक्सीजन" ओ 2 - रंग, स्वाद, गंध के बिना, गैर विषैले गैस; टी° उबालें। = -183°C; ;
बी) "ओजोन" ओ 3 - तीखी गंध वाली नीली गैस, जहरीली, बहुत मजबूत ऑक्सीकरण एजेंट; टी° उबालें। = -111.8°C.
रासायनिक गुण
1. केवल एक प्रतिक्रिया में ऑक्सीजन एक कम करने वाला एजेंट है:
О 2 + 2F 2 = 2OF 2()।
2. अन्य सभी मामलों में, ऑक्सीजन एक ऑक्सीकरण एजेंट है, खासकर यदि यह परमाणु अवस्था में है:
a) सरल पदार्थों का ऑक्सीकरण
2एच 2 + ओ 2 = 2एच 2 ओ;
एस + ओ 2 = एसओ 2;
2Ca + O 2 = 2CaO.
बी) जटिल पदार्थों का ऑक्सीकरण
आर 2 ओ 3 + ओ 2 = आर 2 ओ 5;
2SO 2 + O 2 = 2SO 3;
2पीसीएल 3 + ओ 2 = 2पीओसीएल 3.
ग) जटिल अकार्बनिक पदार्थों का दहन
2H 2 S + O 2 अपर्याप्त = 2एस + 2एच 2 ओ;
2H 2 S + 3O 2 ग्राम। = 2SO 2 + 2H 2 O.
घ) कार्बनिक पदार्थों का दहन
सीएच 4 + 2ओ 2 = सीओ 2 + 2एच 2 ओ;
सी 2 एच 5 ओएच + 3ओ 2 = 2सीओ 2 + 3एच 2 ओ।
सल्फर और उसके यौगिक
प्रकृति में अपने मूल रूप में पाया जाता है; खनिजों के रूप में (सल्फाइड्स, सल्फेट्स); तेल मेँ; प्रोटीन में.
भौतिक गुण
कठोर, भंगुर, पीला, H2O में अघुलनशील, लेकिन कार्बन डाइसल्फ़ाइड और एनिलिन में घुलनशील। एलोट्रोपिक: रंबिक सल्फर (ए-फॉर्म); मोनोक्लिनिक (बी - सल्फर); प्लास्टिक, आदि। सबसे स्थिर संशोधन एक (t° pl. »113°C) है, संरचना S 8 को इसके लिए जिम्मेदार ठहराया गया है।
रासायनिक गुण
ऑक्सीकरण की विभिन्न डिग्री प्रदर्शित करने वाले यौगिकों में अलग-अलग रेडॉक्स क्षमताएं होती हैं।
तालिका 13
सबसे महत्वपूर्ण सल्फर यौगिक
1. सल्फर, जटिल यौगिकों के साथ परस्पर क्रिया करके, अपनी ऑक्सीकरण अवस्था को विभिन्न तरीकों से बदलता है:
ए) एस + 2एच 2 एसओ 4 सांद्र। = 3SO 2 + 2H 2 O ();
बी) एस + 6एचएनओ 3 सांद्र। = H 2 SO 4 + 6NO 2 + 2H 2 O ();
ग) 3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
अनुपातहीन प्रतिक्रिया
2. एस-2 कनेक्शन
ए) H2S- हाइड्रोजन सल्फाइड, सड़े अंडे की गंध वाली जहरीली गैस, मजबूत कम करने वाला एजेंट: 2H 2 S + O 2 = 2S + 2H 2 O;
एच 2 एस + सीएल 2 = 2 एचसीएल + एस।
बी) एच 2 एस समाधान - कमजोर एसिड
एच 2 एस Û एन + + एचएस - (के 1 = 6 × 10 -8)।
ग) लवण - सल्फाइड; क्षार और क्षारीय पृथ्वी धातुओं के लवण अत्यधिक घुलनशील और हाइड्रोलाइज होते हैं; पी- और डी-धातुओं के सल्फाइड व्यावहारिक रूप से अघुलनशील होते हैं।
जी) सल्फ़ाइड्सधातुओं का प्रदर्शन मुख्यप्रकृति:
K 2 S + H 2 O Û KHS + KOH;
गैर-धातु सल्फाइड प्रदर्शित होते हैं अम्लीयप्रकृति:
SiS 2 + 3H 2 O = H 2 SiO 3 + 2H 2 S.
डी) थियोसोल्स: साधारण नमक के समान जिसमें O परमाणुओं को S द्वारा प्रतिस्थापित किया जाता है:
Na 2 S + CS 2 = Na 2 CS 3 - सोडियम थायोकार्बोनेट;
Na 2 CS 3 + 2HCl = 2NaCl + H 2 CS 3
अस्थिर
इ) पॉलीसल्फाइड्स: पेरोक्साइड में ऑक्सीजन की तरह सल्फर, लवण बना सकता है: Na 2 S घोल + ´S = Na 2 S n - सोडियम पॉलीसल्फाइड (सल्फाइड ब्रिज होते हैं - S - S - S - S -)।
3. एस+4 कनेक्शन
ए) एसओ 2 - तीखी गंध वाला सल्फर डाइऑक्साइड, जहरीला;
बी) एसओ 2 समाधान - सल्फ्यूरस एसिड एच 2 एसओ 3, मध्यम शक्ति
एच 2 एसओ 3 Û एच + + एचएसओ 3 - (के 1 = 1.3 × 10 -2);
ग) लवण - सल्फाइट्स, अच्छी तरह से हाइड्रोलाइज
Na 2 SO 3 + H 2 O Û NaHSO 3 + NaOH।
डी) रेडॉक्स प्रतिक्रियाओं में, ये सभी यौगिक द्वैत प्रदर्शित करते हैं:
एसओ 2 + 2एच 2 एस = 3एस + 2एच 2 ओ;
2SO 2 + O 2 = 2SO 3.
ई) थियोनिल क्लोराइड: एसओसीएल 2
एसओसीएल 2 + 2एच 2 ओ = एच 2 एसओ 3 + 2एचसीएल।
4. एस+6 कनेक्शन
ए) अत: 3- सल्फ्यूरिक एनहाइड्राइड; एलोट्रोपिक, मजबूत ऑक्सीकरण एजेंट। पानी के साथ बहुत तीव्र प्रतिक्रिया करता है
SO 3 + H 2 O ® H 2 SO 4 + 89.1 kJ/mol;
बी) H2SO4- सल्फ्यूरिक एसिड, रंगहीन तैलीय तरल; मज़बूत।
एच 2 एसओ 4 सांद्र. - बहुत मजबूत ऑक्सीकरण एजेंट; चार्स पेपर, चीनी, लकड़ी:
सी + 2एच 2 एसओ 4 सांद्र। = CO 2 + 2SO 2 + 2H 2 O.
व्यक्तिगत रूप से, धातुओं के साथ इसका व्यवहार:
सामान्य तापमान पर यह कई धातुओं के साथ क्रिया नहीं करता ("निष्क्रिय" Cr, Fe, Al, Zn, ...);
ऊंचे स्तर पर, यह Au और Pt को छोड़कर लगभग सभी धातुओं के साथ प्रतिक्रिया करता है।
यह एक बहुत अच्छा जल-निकालने वाला एजेंट है क्योंकि... पानी के साथ हाइड्रेट्स H 2 SO 4 × nH 2 O बनता है:
वी) लवण: मध्यम - K 2 SO 4 (सल्फेट्स);
अम्लीय - केएचएसओ 4 (हाइड्रोजन सल्फेट्स);
विट्रियल - CuSO 4 × 5H 2 O; ZnSO 4 × 7H 2 O;
फिटकरी - दोहरा लवण, क्रिस्टल हाइड्रेट्स
KAl(SO 4) 2 × 12H 2 O; NH 4 Fe(SO 4) 2 × 12H 2 O.
जी) ओलियम- एच 2 एसओ 4 में एसओ 3 का एक समाधान, जबकि प्रतिक्रिया आंशिक रूप से होती है
2SO 3 + H 2 O = H 2 S 2 O 7 पाइरोसल्फ्यूरिक एसिड.
डी) सल्फ्यूरिल क्लोराइड SO2Cl2
एसओ 2 सीएल 2 + 2एच 2 ओ = एच 2 एसओ 4 + 2एचसीएल।
इ) पेरोक्सोसल्फ्यूरिक एसिड- पेरोक्साइड ब्रिज होते हैं
एच 2 एसओ 5 - पेरोक्सोमोनोसल्फर,
एच 2 एस 2 ओ 8 - पेरोक्सोडीसल्फर;
मजबूत ऑक्सीकरण एजेंट।
और) थायोसल्फेट्स- विभिन्न ऑक्सीकरण अवस्थाओं में सल्फर होता है: S +6 और S -2; S-2 की उपस्थिति के कारण, यौगिक प्रबल अपचायक होते हैं।
Na 2 S 2 O 3 + Br 2 + H 2 O = 2HBr + S + Na 2 SO 4.
संबंधित अम्ल H 2 S 2 O 3 (थियोसल्फ्यूरिक) अस्थिर है:
ना 2 एस 2 ओ 3 + एच 2 एसओ 4 = ना 2 एसओ 4 + एच 2 एस 2 ओ 3।
समूह 7ए के तत्व. (हैलोजन )
इलेक्ट्रॉनिक शेल की संरचना:... एनएस 2 एनपी 5.
9 एफ, 17 सीएल, 35 बीआर, 53 जे, 85 एट (रेडियोधर्मी)। स्वतंत्र अवस्था में ये द्विपरमाणुक अणुओं के रूप में विद्यमान रहते हैं।
भौतिक गुण
ज़हरीली, तीखी गंध के साथ एफ 2 - हल्की पीली गैस, क्वथनांक। = -188.2°C;
सीएल 2 - हरी-पीली गैस; टी° उबालें। = -34.1°C;
बीआर 2 - लाल तरल; टी° उबालें। = 59.2°C;
जे 2 - बैंगनी क्रिस्टल; टी° उबालें। = +185.5°C.
रासायनिक गुण
1) सबसे सक्रिय F2 है, इसके वातावरण में कांच और पानी भी जलते हैं:
2F 2 + SiO 2 = SiF 4 + O 2;
2F 2 + 2H 2 O = 4HF + O 2.
2) अपस्ट्रीम हैलोजन (मजबूत ऑक्सीकरण एजेंटों के रूप में) विभिन्न यौगिकों से डाउनस्ट्रीम हैलोजन को विस्थापित करते हैं:
एफ 2 + 2 केसीएल (केबीआर, केजे) = 2 केएफ + सीएल 2 (बीआर 2, जे 2)।
3) जब हैलोजन पानी और क्षार के घोल में घुल जाते हैं, तो अनुपातहीन प्रतिक्रियाएँ होती हैं; तापमान के आधार पर, विभिन्न प्रतिक्रिया उत्पाद प्राप्त होते हैं:
सीएल 2 + एच 2 ओ = एचसीएल + एचसीएलओ;
सीएल 2 + 2NaOH = NaCl + NaClO;
4) हाइड्रोजन हैलाइड्स- वे सभी रंगहीन गैसें हैं (HF, हाइड्रोजन बांड के कारण, सहयोगी H x F x बनाता है)।
श्रृंखला में: एचएफ - एचसीएल - एचबीआर - एचजे, बंधन शक्ति कम हो जाती है और कम करने वाले गुण बढ़ जाते हैं:
एमएनओ 2 + 4एचसीएल = सीएल 2 + एमएनसीएल 2 + 2एच 2 ओ ()।
5) पानी में घुलने पर प्रबल अम्ल प्राप्त होते हैं; HJ सबसे मजबूत है (कमजोर हाइड्रोफ्लोरिक एसिड के अपवाद के साथ:
एच 2 एफ 2 Û एच + + एचएफ 2 -)
6) हैलाइड्सतत्वों में अलग-अलग एसिड-बेस चरित्र होते हैं, जो स्वयं प्रकट होता है:
ए) हाइड्रोलिसिस प्रतिक्रियाओं में
AlCl 3 + H 2 O Û AlOHCl 2 + HCl;
पीबीआर 3 + 3एच 2 ओ = एच 3 पीओ 3 + 3एचबीआर।
बी) जटिल प्रतिक्रियाओं में
2NaF + SiF 4 ® Na 2 ;
कई लिगेंड्स के लिए एफ - ; सीएल - ; ब्र - ; जे - परिसरों की स्थिरता कम हो जाती है।
7) उच्च ऑक्सीकरण अवस्था में हैलोजन
ए) ऑक्साइड: सीएल 2 ओ; (सीएलओ2)2; (सीएलओ 3) 2; सीएल 2 ओ 7;
बी) एसिड: एचसीएलओ; HClO2; HClO3; HClO4;
कई अम्लों के लिए ® शक्ति बढ़ जाती है, उसी श्रृंखला के अम्लों और उनके लवणों के लिए ऑक्सीकरण गुण कम हो जाते हैं।
ग) गर्म करने पर अम्ल और उनके लवण विघटित हो जाते हैं:
घ) हैलोजन के बीच यौगिक: उनमें से बहुत से ज्ञात हैं; रचना आवर्त सारणी में तत्वों की स्थिति से मेल खाती है (सूत्रों के अंत में अधिक विद्युत ऋणात्मक तत्व दिखाई देते हैं):
सीएलएफ, बीआरएफ, जेएफ; सीएलएफ 3, जेएफ 3; सीएलएफ 5, सीएलओएफ 3; BrF 7, JO 3 F, आदि;
प्रकृति में अम्लीय हैं: JF 7 + 4H 2 O = 7HF + HJO 4;
CloO 3 F + 2NaOH = NaClO 4 + NaF + H 2 O.
सामग्री को समेकित करने के लिए प्रश्न:
1. जब आर्सेनिक सांद्र नाइट्रिक एसिड - a)Аs(NO3)3 के साथ प्रतिक्रिया करता है तो कौन सा पदार्थ बनता है? बी)एच 3 एएसओ 4? ग) 2 ओ 3 के रूप में?
2.कौन सा पदार्थ सांद्र अम्ल के साथ प्रतिक्रिया करके मुक्त क्लोरीन मुक्त करता है - a)CaC1 2? बी)एमएनओ2? ग) सीआरसी1 3 ?