Функціональні ділянки ТРНК. Будова та функції ТРНК, особливості амінокислотної активації
70-90Н | вторинна стр-ра- конюшинний лист | CCA 3" const для всіх tRNA | до кінцевого аденозину приєднується акта |
наявність тиміну, псевдоурідіна-псі, дигіроуридину ДГУ в D-петлі - захист від рибонуклеаз? довгоживучі | Різноманітність первинних структур tРНК - 61+1 - за кількістю кодонів + формилметіонінова tРНК, у кіт антикодон такий же, як у метіонінової tРНК. Різноманітність третинних структур - 20 (за кількістю амінокислот) | рекогніція - утворення ковалентного зв'язку м-у tРНК та актом | аміноацил-тРНК-синтетази приєднують акти до тРНК
Функція тРНК полягає у перенесенні амінокислот з цитоплазми до рибосом, у яких відбувається синтез білків.
тРНК, що зв'язують одну амінокислоту, називаються ізоакцепторними.
Загалом у клітині одночасно існує 64 різних тРНК.
Кожна тРНК спарується лише зі своїм кодоном.
Кожна тРНК розпізнає власний кодон без участі амінокислоти. Зв'язані з тРНК амінокислоти хімічно модифікували, після чого аналізували поліпептид, що вийшов, який містив модифіковану амінокислоту. Цистеїніл-тРНКCys (R=CH2-SH) відновлювали до аланіл-тРНКCys (R=CH3).
Більшість тРНК, незалежно від їх нуклеотидної послідовності, мають вторинну структуру у формі конюшинного листа через наявність у ній трьох шпильок.
Особливості структури тРНК
На 3"-кінці молекули завжди знаходяться чотири неспарені нуклеотиди, причому три з них - це обов'язково ССА. 5"- і 3"-кінці ланцюга РНК утворюють акцепторне стебло. кінця з сімома нуклеотидами, що знаходяться поблизу 3"-кінця. 2. У всіх молекул є шпилька T? C, що позначається так тому, що вона містить два незвичайні залишки: рибо-тимідин (Т) і псевдоурідін (? ) Шпилька складається з дволанцюжкового стебла з п'яти спарених основ, включаючи пару GC, і петлі довжиною сім нуклеотидів.
в тому самому місці петлі. 3. В антикодоновій шпильці стебло завжди представлене сім'ю спарен-
ними підставами. Триплет, комплементарний родинному кодону, - антикодон - знаходиться в петлі.
ле, що складається із семи нуклеотидів. З 5"-кінця антикодон фланкують інваріантний залишок ура-
цила і модифікований цитозин, а до його 3"-кінця примикає модифікований пурин, як правило
аденін. 4. Ще одна шпилька складається з стебла довжиною три-чотири пари нуклеотидів і петлі вар-
іруючого розміру, що часто містить урацил у відновленій формі – дигідроурацил (DU). Найбільш сильно варіюють нуклеотидні послідовності стебел, число нуклеотидів між антикодоновим стеблом і стеблом Т?С (варіабельна петля), а також розмір петлі і локалізація залишків дигідроурацилу в DU-петлі.
[Сінгер, 1998].
Третинна структура тРНК
L-подібна структура.
Приєднання амінокислот до тРНК
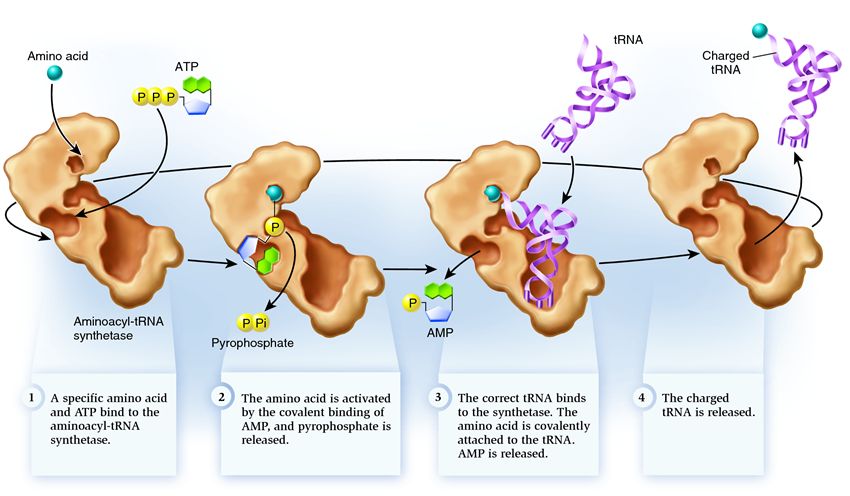
Для того, щоб амінокислота могла утворювати поліпептидний ланцюг, вона повинна приєднатися до тРНК за допомогою ферменту аміноацил-тРНК-синтетази. Цей фермент утворює ковалентний зв'язок між карбоксильною групою амінокислоти та гідроксильною групою рибози на 3'-кінці тРНК за участю АТФ. Аміноацил-тРНК-синтетаза дізнається про специфічний кодон не через наявність антикодону на тРНК, а за наявності специфічного сайту впізнавання на тРНК.
Загалом у клітині є 21 різних аміноацил-тРНК-синтетаз.
Приєднання відбувається у дві стадії:
1. Карбоксильна група амінокислоти приєднується до афосфату АТФ. Отриманий нестабільний аміноацил-аденилат стабілізується, зв'язуючись з ферментом.
2. Перенесення аміноацильної групи аміноацил-аденілату на 2' або 3'-OH-групу кінцевої рибози тРНК
Деякі аміноацил-тРНК-синтетази складаються з одного поліпептидного ланцюга, інші – з двох або чотирьох ідентичних ланцюгів, кожна молекулярною масою від 35 до 115 кДа. Деякі димерні та тетрамерні ферменти складаються із субодиниць двох типів. Чіткої кореляції між розміром молекули ферменту чи характером його субодиничної структури та специфічністю не існує.
Специфічність ферменту визначається його міцним зв'язуванням з акцепторним кінцем тРНК, DU-дільницею та варіабельною петлею. Деякі ферменти, мабуть, не розпізнають антикодоновий триплет та каталізують реакцію аміноацетилювання навіть при зміненому антикодоні. Однак окремі ферменти виявляють знижену активність стосовно таких модифікованих тРНК і при заміні антикодону приєднують не ту амінокислоту.
70-90н | вторинна стр-ра- конюшинний лист | CCA 3" const для всіх tRNA | до кінцевого аденозину приєднується акта |
наявність тиміну, псевдоурідіна-псі, дигіроуридину ДГУ в D-петлі - захист від рибонуклеаз? довгоживучі | Різноманітність первинних структур tРНК - 61+1 - за кількістю кодонів + формилметіонінова tРНК, у кіт антикодон такий же, як у метіонінової tРНК. Різноманітність третинних структур - 20 (за кількістю амінокислот)
Є два види тРНК що зв'язують метіонін тРНКFMet і тРНКMMet у прокаріотів і, тРНКIMetі тРНКMMet - у еукаріотів. До кожної тРНК додається метіонін за допомогою відповідних аміноацил-тРНК-синтетез. метіонін приєднаний до тРНКFMet та тРНКIMet формується ферментом метіоніл-тРНК-трансформілазою до Fmet-тРНКFMet. тРНК навантажені формілметіоніном дізнаються про ініціаторний кодон AUG.
Література:
На жаль, списку літератури немає.
Підручник. Незважаючи на те, що тРНК значно дрібніша, розповідь про її будову, особливості та функціонування заслуговує на окремий розділ.
Отже, тРНК є «адаптером», який одним своїм кінцем розпізнає трилітерну послідовність генетичного коду, зіставляючи їй єдину відповідну амінокислоту, закріплену на іншому кінці тРНК. На торкається до матричної РНК кінці транспортної РНК знаходяться 3 нуклеотиди, що утворюють антикодон. Тільки у разі комплементарності антикодону до ділянки мРНК транспортна РНК може приєднатися до неї. Але навіть у цьому випадку тРНК не може приєднатися до мРНК самостійно, їй необхідна допомога рибосоми, яка є місцем їхньої взаємодії, а також активним учасником трансляції. Наприклад, саме рибосома створює зв'язок між принесеними тРНК амінокислотами, формуючи протеїновий ланцюжок.
Особливості будови тРНК обумовлені генетичним кодом, тобто правил побудови протеїну за геном, які транспортна РНК прочитує. Цей код працює в кожному з істот, що живуть на Землі: створення вірусу записано тими ж трилітерними кодонами, які використовуються для запису «інструкції зі складання» дельфіна. Експериментально перевірено, що гени однієї живої істоти, поміщені в клітину іншої, відмінно копіюються і транслюються в протеїни, які не відрізняються від генів, що відтворюються в клітинах господаря. На одноманітності генетичного коду засновано виробництво колоніями модифікованих кишкових паличок інсуліну та багатьох інших людських ферментів, що використовуються як ліки для людей, чий організм не здатний їх виробляти або виробляє недостатньо. Незважаючи на очевидну різницю між людиною та кишковою паличкою, протеїни людини легко створюються за її кресленнями за допомогою копіювального апарату кишкової палички. Не дивно, що транспортні РНК різних істот відрізняються дуже мало.

Кожен кодон із цього списку, за винятком трьох стоп-кодонів, що дають сигнал про завершення трансляції, має розпізнаватись транспортною РНК. Впізнання здійснюється за допомогою приєднання до матричної РНК антикодону, який може зв'язатися тільки з одним кодоном зі списку, тому тРНК може розпізнати лише один кодон. Отже, у клітині існує щонайменше 61 вид цих молекул. Насправді їх навіть більше, тому що в деяких ситуаціях для зчитування матричної РНК недостатньо просто мати потрібний антикодон: потрібне виконання інших умов, відповідно до яких створюється спеціальна модифікована тРНК.
На перший погляд, така різноманітність тРНК має суттєво ускладнювати процес трансляції: адже кожна з цих молекул перевірятиме підставлений їй рибосомою кодон матричної РНК на відповідність своєму антикодону — здавалося б, стільки безглуздої механічної роботи, стільки марно витраченого часу та енергії. Але в результаті еволюції сформувалися також і клітинні механізми, що запобігають цій проблемі. Наприклад, кількість тРНК кожного виду в клітині відповідає тому, як часто амінокислота, несучи цим видом, зустрічається в протеїнах, що будуються. Є амінокислоти, які рідко використовуються клітиною, а часто використовуються, і якби кількість несучих їх тРНК була однаковою, це значно ускладнило б складання протеїнів. Тому «рідкісних» амінокислот і відповідних їм тРНК у клітці мало, а ті, що часто зустрічаються, виробляються у великій кількості.

При такому розмаїтті молекул тРНК всі вони дуже схожі, тому розглядаючи їх будову та функції, в основному ми вивчатимемо загальні для всіх видів риси. Якщо глянути на тривимірну схему тРНК, вона здається щільним нагромадженням атомів. Здається неймовірним, що ця складнозакручена молекула отримана в результаті згортання довгого ланцюга нуклеотидів, але саме так і утворюється.
Можна простежити етапи її утворення, починаючи з найпершого: складання РНК-полімеразою послідовності нуклеотидів відповідно до гена, що містить інформацію про дану транспортну РНК. Порядок слідування один за одним цих нуклеотидів та їх кількість називається первинною структурою тРНК. Виходить, що первинна структура тРНК закодована в гені, прочитуваному РНК-полімеразою. Взагалі первинної структурою називають послідовність порівняно простих молекул одного типу, у тому числі складена складніша, згорнута молекула-полімер. Наприклад, первинною структурою молекули протеїну є проста послідовність складових її амінокислот.

Будь-який ланцюжок нуклеотидів не може перебувати в клітці у розгорнутому стані, просто витягнувшись у лінію. На краях нуклеотидів знаходиться дуже багато позитивно і негативно заряджених частин, які просто утворюють водневі зв'язки один з одним. Про те, як такі ж зв'язки утворюються між нуклеотидами двох молекул ДНК, з'єднуючи їх у подвійну спіраль, розказано в , а за подробицями про водневі зв'язки можна залізти в . Водневі зв'язки менш міцні, ніж зв'язки між атомами в молекулах, але їх достатньо для того, щоб химерно скрутити тРНК і тримати її в такому положенні. Спочатку ці зв'язки утворюються лише між деякими нуклеотидами, згортаючи тРНК у фігуру на зразок листа конюшини. Результат цього початкового згортання називають вторинною структурою тРНК. На схемі зліва видно, що деякі нуклеотиди зв'язуються водневими зв'язками, інші залишаються неспареними, утворюючи кільця і петлі. Відмінності між вторинною структурою різних видів тРНК обумовлені відмінностями у їх первинній структурі. Виявляється це в різній довжині «конюшинних листів» або «стеблинка» за рахунок різної довжини вихідного ланцюжка нуклеотидів.
Іншою відмінністю первинної структури різних тРНК і те, що у деяких позиціях вони стоять одні й самі нуклеотиди (на схемі вгорі вони відзначені першими літерами своїх назв), більшість нуклеотидів у різних тРНК відрізняються друг від друга. Наведена вище схема є загальною для всіх тРНК, тому нуклеотиди, що відрізняються, відзначені числами.
Головними функціональними частинами тРНК є:
=) антикодон, тобто послідовність нуклеотидів, комплементарна єдиному кодону матричної РНК, що знаходиться на антикодонової шпильки
=) акцепторний кінець, До якого може бути приєднана амінокислота. Він знаходиться з протилежного боку від антикодонової шпильки.
Насправді, жодна тРНК не виглядає так, як на схемі вторинної структури, тому що для її утворення з'єдналися між собою лише деякі нуклеотиди, а решта залишилися неспареними. За рахунок утворення водневих зв'язків між нуклеотидами з різних частин листа конюшини він згортається далі в набагато складнішу. третинну структуруу формі літери L. Ти можеш зрозуміти, як саме зігнулися різні частини вторинної структури для утворення третинної, зіставивши кольори на їхніх схемах нижче. Антикодонова шпилька, позначена блакитним і сірим кольорами, залишається внизу (варто пам'ятати, що це «внизу» є умовним: зручно зображати тРНК саме в такій просторовій орієнтації у схемах трансляції білка), а акцепторний кінець (жовтого кольору) загнутий убік.

Саме так виглядає тРНК, яка готова до приєднання амінокислоти. Самостійно з'єднатися з амінокислотою тРНК не здатна, для цього потрібна участь спеціального ферменту: аміноацил-тРНК-синтетази. Число видів синтетаз у клітині збігається з числом видів тРНК.
Одноманітність форми всіх видів тРНК необхідна для того, щоб рибосома могла розпізнавати будь-яку з них, сприяти їх стиковці з мРНК, переміщувати в собі з одного сайту в інший. Якби різні види тРНК суттєво відрізнялися один від одного, це надзвичайно ускладнило б роботу рибосоми, критично зменшивши швидкість синтезу протеїну. Природний відбір в такий спосіб спрямовано те, щоб зробити тРНК схожими друг на друга. Але водночас є й інший фактор, що вимагає існування помітних відмінностей між різними видами тРНК: адже необхідно розпізнати кожен вид і прикріпити до нього єдину амінокислоту, що відповідає йому. Очевидно, що ці відмінності мають бути хоч і помітними, але не надто суттєвими, тому робота з розпізнавання видів тРНК перетворюється на ювелірний процес. І саме його здійснюють аміноацил-тРНК-синтетази: кожна з них може зв'язатися лише з однією з 20 амінокислот та приєднати її саме до тих видів тРНК, які цій амінокислоті відповідають. З таблиці з генетичним кодом видно, що кожна амінокислота кодується декількома послідовностями нуклеотидів, тому, наприклад, всі чотири тРНК з антикодонами CGA, CGG, CGU і CGC будуть розпізнаватись однією і тією ж синтетазою, що приєднує до них аланін. Такі оброблювані однією синтетазою тРНК називаються спорідненими.
Синтетаза належить до групи ферментів, чия функція полягає у зв'язуванні з окремими молекулами та об'єднанні їх в одну:
1 . синтетаза поєднує амінокислоту та молекулу АТФ. Від АТФ відриваються дві фосфатні групи, вивільняючи енергію, необхідну наступних дій. Аденозинмонофосфат (АМФ), що залишається від зруйнованої молекули, приєднується до амінокислоти, підготувавши її до з'єднання з акцепторною шпилькою.
2 . синтетаза приєднує себе одну з відповідних цієї амінокислоті споріднених тРНК.

На цьому етапі відбувається перевірка відповідності транспортної РНК-синтетазі. Існує кілька способів розпізнавання, і в кожній синтетазі є їх унікальна комбінація. У взаємодії синтетази та тРНК бере участь як мінімум один нуклеотид антикодону. Також вимагає перевірки акцепторна шпилька: визначається наявність на ній специфічних нуклеотидів, загальних для відповідних потрібної амінокислоті споріднених тРНК. Нуклеотиди інших частин тРНК також можуть брати участь у перевірці відповідності, поєднуючись із певними місцями синтетази. Неправильна тРНК може збігатися з потрібною за якими параметрами, але через неповний збіг приєднуватиметься до синтетази повільно і нещільно, легко відвалюючись. А правильна тРНК прилипне до синтетази швидко та міцно, внаслідок чого структура синтетази змінюється, запускаючи процес аміноацилювання , тобто приєднання амінокислоти до тРНК

3 . аміноацилювання полягає у заміні приєднаної до амінокислоти молекули АМФ на молекулу тРНК. Після цієї заміни АМФ залишає синтетазу, а тРНК затримується для останньої перевірки амінокислоти. Якщо приєднана амінокислота розпізнається як неправильна, вона буде від'єднана від тРНК, місце амінокислоти в синтетазі спорожніє, і туди може приєднатися інша молекула. Нова амінокислота пройде стадії з'єднання з АТФ і тРНК, і теж піддасться перевірці. Якщо ж помилок не було допущено, заряджена амінокислотою тРНК звільняється: вона готова зіграти свою роль у трансляції протеїну. А синтетаза готова приєднати нові амінокислоти та тРНК, і цикл почнеться заново.
Від правильності роботи аміноацил-тРНК-синтетази залежить багато що: якщо на цьому етапі відбудеться збій, то до тРНК буде приєднана неправильна амінокислота. І вона буде вбудована в протеїн, що росте на рибосомі, адже тРНК і рибосома не мають функції перевірки відповідності кодону і амінокислоти. Наслідки помилки можуть бути незначними або катастрофічними, і в ході природного відбору істоти з ферментами, які не мають функції таких перевірок, були витіснені більш пристосованими, що мають різні варіанти встановлення відповідності між амінокислотою та тРНК. Тому в сучасних клітинах синтетаза з'єднується з невірною амінокислотою в середньому в одному випадку з 50 тисяч, а з помилковою тРНК лише один раз на 100 тисяч приєднань.

Деякі амінокислоти відрізняються один від одного лише кількома атомами. Якщо поглянути на їх схеми, стає очевидним, що можливість переплутати аргінін з аланіном набагато менше, ніж прийняти ізолейцин за лейцин або валін. Тому кожна синтетаза, що зв'язується з однією з схожих один на одного амінокислот, має додаткові механізми перевірки. Ось приклад такого пристосування у ізолейцин-тРНК-синтетази:

Кожна синтетаза існує синтетичний центр, В якому відбувається приєднання амінокислоти до тРНК Акцепторна шпилька тРНК, захопленої синтетазою, потрапляє саме туди, як і амінокислота, готова вступити у реакцію із нею. Робота деяких синтетаз закінчується відразу після з'єднання амінокислоти та тРНК. Але Ile-тРНК-синтетаза має підвищену ймовірність помилок через існування інших схожих на ізолейцин амінокислот. Тому вона має ще й корекційний центр: з назви зрозуміло, яку роль він грає у процесі з'єднання тРНК та амінокислоти. На малюнку праворуч видно, що положення кінця шпильки акцепторної тРНК в синтетичному центрі Ile-тРНК-синтетази надає цій шпильці неприродний вигин. Тим не менш, синтетаза утримує тРНК у такому положенні до моменту приєднання до неї амінокислоти. Після того, як це з'єднання сталося, необхідність знаходження акцепторної шпильки в синтетичному центрі вичерпана, і тРНК розпрямляється, потрапляючи своїм кінцем з насадженою на нього амінокислотою корекційний центр.

Звичайно ж, синтетичний центр теж грає свою роль у відсіюванні амінокислот, що не підходять синтетазі. Щоб потрапити до нього, молекулі необхідно відповідати ряду умов, зокрема мати відповідний розмір. Незважаючи на те, що лейцин і ізолейцин містять одну й ту саму кількість атомів, через відмінності в просторовій структурі лейцин більший. Тому він не може проникнути в синтетичний центр, розміри якого відповідають компактнішому ізолейцину, і просто відскакує від Ile-тРНК-синтетази.
Але ось валін, що є найдрібнішою з цих трьох молекул зі схожою атомною структурою, легко займає місце ізолейцину в синтетичному центрі, і синтетаза приєднує його до тРНК. Саме в цьому випадку входить у гру корекційний центр синтетази. Якщо акцепторна шпилька, що розпрямляється, заряджена правильно і несе ізолейцин, то вона не може протиснутися всередину корекційного центру: він просто занадто малий для цієї молекули. Таким чином, тРНК, що розпрямилася, більше ніщо не тримає, і вона від'єднується від синтетази. А от якщо до тРНК приєднаний валін, він прослизає в корекційний центр, тим самим утримуючи сполучену з ним тРНК у синтетазі. Таке надмірно тривале перебування тРНК усередині є для синтетази сигналом помилки, змінюючи її просторову конфігурацію. В результаті цього:
=) валін від'єднується від тРНК і видаляється із синтетази
=) акцепторна шпилька повертається до синтетичного центру, очікуючи приєднання до амінокислоти
=) синтетаза пов'язується з новою амінокислотою, «заряджає» їй тРНК і знову перевіряє, чи був використаний саме цього изолейцин.
Такий механізм подвійного розпізнавання вживається й іншими синтетазами.
Фізико-хімічні властивості ДНК
Різні фактори, що порушують водневі зв'язки (підвищення температури вище 80 С, зміна рН та іонної сили, дію сечовини та ін.), Спричиняють денатурацію ДНК, тобто. зміна просторового розташування ланцюгів ДНК без розриву ковалентних зв'язків Подвійна спіраль ДНК під час денатурації повністю або частково поділяється на складові ланцюга. Денатурація ДНК супроводжується посиленням оптичного поглинання в УФ області пуринових та піримідинових основ. Це явище називають гіперхромним ефектом . При денатурації зменшується висока в'язкість, властива розчинам нативної ДНК. При відновленні початкової двоспіральної структури ДНК, внаслідок ренатурації, поглинання при 260 нм азотистими основами внаслідок їхньої «екранованості» зменшується. Це явище називають гіпохромним ефектом .
"Розплетення" кожної ДНК на складові її ланцюга здійснюється в межах певного інтервалу температур. Середня точка цього інтервалу називається температурою плавлення. Температура плавлення ДНК залежить в стандартних умовах (певна рН та іонна сила) від співвідношення азотистих основ. Г-Ц пари, що містять три водневі зв'язки, більш міцні, тому чим більше в ДНК вміст Г-Ц пар, тим вище температура плавлення.
Функції ДНК. У послідовності молекул нуклеотидів ДНК закодована генетична інформація. Основними функціями ДНК є, по-перше, забезпечення відтворення самої себе у ряді клітинних поколінь та поколінь організмів, по-друге, забезпечення синтезу білків. Ці функції зумовлені тим, що молекули ДНК є матрицею у першому випадку для реплікації, тобто. копіювання інформації у дочірніх молекулах ДНК, у другому – для транскрипції, тобто. для перекодування інформації у структуру РНК.
Рис. 5 Крива плавлення (денатурація ДНК)
Комплементарні ланцюги ДНК, розділені при денатурації, за певних умов можуть знову з'єднатися у подвійну спіраль. Цей процес називається РЕНАТУРАЦІЄЮ. Якщо денатурація відбулася в повному обсязі і хоча кілька підстав не втратили взаємодії водневими зв'язками, ренатурація протікає дуже швидко.
У цитоплазмі клітин містяться три основні функціональні види РНК. Це матричні РНК – мРНК, що виконують функції матриць білкового синтезу, рибосомні РНК – рРНК, що виконують роль структурних компонентів рибосом, та транспортні РНК – тРНК, що беруть участь у трансляції (перекладі) інформації мРНК у послідовність амінокислот у білку.
У таблиці 2 представлені відмінності ДНК від РНК за будовою, локалізації у клітині та функцій.
Таблиця 2 Відмінності ДНК від РНК
Транспортна РНК, тРНК-рибонуклеїнова кислота, функцією якої є транспортування АК до місця синтезу білка Має типову довжину від 73 до 93 нуклеотидів та розміри близько 5 нм. ТРНК також беруть безпосередню участь у нарощуванні поліпептидного ланцюга, приєднуючись - будучи в комплексі з амінокислотою - до кодону мРНК та забезпечуючи необхідну для утворення нового пептидного зв'язку конформацію комплексу. Для кожної амінокислоти є своя тРНК. тРНК є одноланцюгової РНК, однак у функціональній формі має конформацію «конюшинного листа». АК ковалентно приєднується до 3"-кінця молекули за допомогою специфічного для кожного типу тРНК ферменту аміноацил-тРНК-синтетази. На ділянці C знаходиться антикодон, відповідний АК-ті. еукаріот Транскрипти генів тРНК піддаються багатостадійному процесингу, що призводить до формування типової для тРНК просторової структури.
Процесинг тРНК включає 5 ключових етапів:
видалення 5"-лідерної нуклеотидної послідовності;
видалення 3"-кінцевої послідовності;
додавання послідовності CCA на 3"-кінець;
вирізання інтронів (у еукаріотів та архей);
модифікації окремих нуклеотидів
Транспорт тРНК здійснюється по Ran-залежному шляху за участю транспортного фактора экспортина t, кот.розпізнає характерну вторинну і третич.стр-ру зрілої тРНК: короткі двоспіральні ділянки і правильно процесовані 5 "- і 3"-кінці. Такий механізм забезпечує експорт із ядра лише зрілих тРНК.
62. Трансляція - впізнавання кодону мРНК
Трансляція – це здійснюваний рибосомами синтез білка з амінокислот на матриці мРНК (або РНК). Складові елементи процесу трансляції: амінокислоти, тРНК, рибосоми, мРНК, ферменти для аміноацилування тРНК, білкові фактори трансляції (білкові фактори ініціації, елонгації, термінації - специфічні позарибосомні білки, необхідні для процесів трансляції) структуру рибосом). У синтезі білка бере участь 20 амінокислот. Щоб амінокислота «дізналася» своє місце у майбутньому поліпепетидному ланцюгу, вона повинна зв'язатися з транспортною РНК (тРНК), що виконує адапторну функцію. Потім тРНК, що зв'язалася з амінокислотою, «пізнає» відповідний кодон на мРНК. Впізнавання кодону мРНК:
Взаємодія кодон-антикодон заснована на принципах комплементарності та антипаралельності:
3'----Ц - Г-А*------5' Антикодон тРНК
5'-----Г- Ц-У*------3' Кодон мРНК
Гіпотеза гойдання (wobble) була запропонована Ф. Криком:
3′- основа кодону мРНК має не суворе спарювання з 5′- основою антикодону тРНК: наприклад, У (мРНК) може взаємодіяти з А та Г (тРНК)
Деякі тРНК можуть спаровуватися з більш ніж одним кодоном.
63. Характеристика складових елементів процесу трансляції.Трансляція (translatio-переклад) - процес синтезу білка з амінокислот на матриці інформаційної (матричної) РНК (іРНК, мРНК), який здійснюється рибосомою.
Синтез білка є основою життєдіяльності клітини. Для здійснення цього процесу в клітинах всіх організмів є спец. рибосоми- рибонуклеопротеїдні комплекси, побудовані з 2 субодиниць: великої та малої. Функція рибосом полягає у розпізнаванні трибуквенних (тринуклеотидних) кодонівмРНК, зіставленні ним відповідних антикодонів тРНК, що несуть амінокислоти, і приєднання цих амінокислот до зростаючого білкового ланцюга. Рухаючись уздовж молекули мРНК, рибосома синтезує білок відповідно до інформації, закладеної молекули мРНК.
Для впізнавання АК-т у клітці є спеціальні «адаптери», молекули транспортної РНК(ТРНК). Ці молекули, що мають форму конюшинного листа, мають ділянку (антикодон), комплементарний кодону мРНК, а також іншу ділянку, до якої приєднується амінокислота, що відповідає цьому кодону. Приєднання амінокислот до тРНК здійснюється в енергозалежній реакції ферментами аміноацил-тРНК-синтетазами, а молекула, що вийшла, називається аміноацил-тРНК. Таким чином, специфічність трансляції визначається взаємодією між кодоном мРНК і антикодоном тРНК, а також специфічністю аміноацил-тРНК-синтетаз, що приєднують амінокислоти строго до відповідних їм тРНК (наприклад, кодону GGU буде відповідати тРНК, що містить антико АК гліцин).
Прокаріотична рибосома
5S та 23S рРНК 16S рРНК
34 білки 21 білок
Рибосоми прокаріотів мають константу седиментації 70S, чому отримали назву 70S-частинок. Вони побудовані з двох неоднакових субчастинок: 30S- та 50S-субодиниць. Кожна субодиниця представляє комплекс рРНК та рибосомних білків.
30S-частка містить одну молекулу 16S-рРНК і в більшості випадків по одній молекулі білка з понад 20 видів (21). 50S-субодиниця складається з двох молекул рРНК (23S та 5S). До її складу входять понад 30 різних білків (34), також представлених, як правило, однією копією. Більшість рибосомальних білків виконує структурну функцію.
Еукаріотична рибосома
5S; 5,8S та 28S рРНК 18S рРНК
не менше 50 білків не менше 33 білків
Рибосома складається з великої та малої субодиниць. Основу структури кожної субодиниці становить складно згорнута рРНК. До каркасу з рРНК прикріпив рибосомні білки.
Коефіцієнт седиментації повної еукаріотичної рибосоми становить близько 80 одиниць Сведберга (80S), а коефіцієнт седиментації субчастинок її становить 40S і 60S.
Найменша 40S-субчастиця складається з однієї молекули 18S-рРНК та 30-40 білкових молекул. Велика 60S-субчастиця містить три типи рРНК з коефіцієнтами седиментації 5S, 5,8S та 28S та 40-50 білків (наприклад, рибосоми гепатоцитів щури включають 49 білків).
Функціональні ділянки рибосом
Р – пептидильна ділянка для пептидилу тРНК
А – аміноацильна ділянка для аміноацил тРНК
Е – ділянка для виходу тРНК із рибосоми
Рибосома містить 2 функціональні ділянки для взаємодії з тРНК: аміноацильний (акцепторний) і пептидильний (донорний). Аміноацил-тРНК потрапляє в акцепторну ділянку рибосоми та взаємодіє з утворенням водневих зв'язків між триплетами кодону та антикодону. Після утворення водневих зв'язків система просувається на 1 кодон і опиняється у донорній ділянці. Одночасно в акцепторній ділянці, що звільнилася, виявляється новий кодон, і до нього приєднується відповідний аміноацил-т-РНК.
Рибосоми: будова, фінція
Рибосоми є цитоплазматичними центрами біосинтезу білка. Вони складаються з великої та малої субодиниць, що відрізняються коефіцієнтами седиментації (швидкістю осадження при центрифугуванні), що виражаються в одиницях Сведберга - S.
Рибосоми присутні в клітинах як еукаріотів, так і прокаріотів, оскільки виконують важливу функцію в біосинтезу білків.У кожній клітині є десятки, сотні тисяч (до кількох мільйонів) цих дрібних округлих органоїдів. Це округла рибонуклеопротеїнова частка. Діаметр її складає 20-30 нм. Складається рибосома з великої та малої субодиниць, що відрізняються коефіцієнтами седиментації (швидкістю осадження при центрифугуванні), що виражаються в одиницях Сведберга – S. Ці субодиниці об'єднуються у присутності нитки м-РНК (матричної або інформаційної РНК). Комплекс із групи рибосом, об'єднаних однією молекулою м-РНК на кшталт нитки бус, називається полісомою. Ці структури або вільно розташовані в цитоплазмі, або прикріплені до мембран гранулярної ЕПС (в обох випадках ними активно протікає синтез білка).
Полісоми гранулярної ЕПС утворюють білки, що виводяться з клітини та використовуються для потреб всього організму (наприклад, травні ферменти, білки жіночого грудного молока). Крім цього, рибосоми присутні на внутрішній поверхні мембран мітохондрій, де також беруть активну участь у синтезі білкових молекул.
Важлива роль процесі використання спадкової інформації клітиною належить транспортної РНК (тРНК). Доставляючи необхідні амінокислоти до місця збирання пептидних ланцюгів, тРНК виконує функцію трансляційного посередника.
Молекули тРНК є полінуклеотидними ланцюгами, що синтезуються на певних послідовностях ДНК. Вони складаються із відносно невеликої кількості нуклеотидів -75-95. В результаті комплементарної сполуки основ, що знаходяться в різних ділянках полінуклеотидного ланцюга тРНК, вона набуває структури, що нагадує формою лист конюшини (рис. 3.26).
Рис. 3.26. Будова типової молекули тРНК.
У ній виділяють чотири основні частини, що виконують різні функції. Акцепторний"стебло" утворюється двома комплементарно з'єднаними кінцевими частинами тРНК. Він складається із семи пар основ. 3′-кінець цього стебла трохи довше і формує одноланцюжкову ділянку, яка закінчується послідовністю ЦЦА з вільною ОН-групою. До цього кінця приєднується амінокислота, що транспортується. Інші три гілки є комплементарно спареними послідовностями нуклеотидів, які закінчуються неспареними ділянками, що утворюють петлі. Середня з цих гілок – антикодонова – складається з п'яти пар нуклеотидів і містить у центрі своєї петлі антикодону. Антикодон – це три нуклеотиди, комплементарні кодону мРНК, який шифрує амінокислоту, що транспортується даною тРНК до місця синтезу пептиду.
Між акцепторною та антикодоновою гілками розташовуються дві бічні гілки. У своїх петлях вони містять модифіковані основи - дигідроуридин (D-петля) і триплет TψC, де \у - псевдоуріаїн (Т^С-петля).
Між аитикодоновой і Т^С-гілками міститься додаткова петля, що включає від 3-5 до 13-21 нуклеотидів.
Загалом різні види тРНК характеризуються певною сталістю нуклеотидної послідовності, яка найчастіше складається з 76 нуклеотидів. Варіювання їх числа пов'язане головним чином із зміною кількості нуклеотидів у додатковій петлі. Комплементарні ділянки, що підтримують структуру тРНК, зазвичай консервативні. Первинна структура тРНК, яка визначається послідовністю нуклеотидів, формує вторинну структуру тРНК, що має форму листа конюшини. У свою чергу, вторинна структура обумовлює тривимірну третинну структуру, для якої характерне утворення двох перпендикулярно розташованих подвійних спіралей (рис. 3.27). Одна з них утворена акцепторною та Т?С-гілками, інша -антикодоновою і D-гілками.
На кінці однієї з подвійних спіралей розташовується амінокислота, що транспортується, на кінці іншої - антикодон. Ці ділянки виявляються максимально віддаленими одна від одної. Стабільність третинної структури тРНК підтримується завдяки виникненню додаткових водневих зв'язків між основами полінуклеотидного ланцюга, що знаходяться у різних її ділянках, але просторово зближених до третинної структури.
Різні види тРНК мають подібну третинну структуру, хоч і з деякими варіаціями.
Рис. 3.27. Просторова організація тРНК:
I-вторинна структура тРНК у вигляді «конюшинного листа», що визначається її первинною структурою (послідовністю нуклеотидів у ланцюзі);
II – двовимірна проекція третинної структури тРНК;
III - схема укладання молекули тРНК у просторі
ДОДАТОК (на випадок, якщо хтось це не розуміє)
Зубці блискавки - нуклеотиди (Аденін-Тімін/Ураціл/, Гуанін-Цитазін). Вся блискавка – ДНК.

Щоб передати інформацію з ДНК, треба розірвати 2 нитки. Зв'язок між А-Т та Г-Ц - воднева, тому легко розривається ферментом Геліказа:

Щоб не утворювалися вузли (Як приклад скрутив рушник):



Щоб ланцюжок не скручувати одну нитку ДНК в точці початку реплікації розрізає Топоізомераза.

Коли одна нитка вільна - друга може легко обертатися навколо своєї осі, тим самим знімаючи напругу під час розкручування. Вузли не з'являються, заощаджується енергія.
Потім, щоб почати збирати РНК, потрібна РНК затравка. Білок, який збирає мРНК не може просто так зібрати перший нуклеотид, йому потрібен шматок РНК, щоб почати (там докладно написано, потім випишу). Цей шматок називається РНК затравка. І вже цей білок приєднує перший нуклеотид.


При описі будови нуклеїнових кислот враховують різні рівні організації макромолекул: первинну та вторинну структуру.
Первинна структура нуклеїнових кислот – це нуклеотидний склад та певна послідовність нуклеотидних ланок у полімерному ланцюзі.
Вторинна структура РНК. Молекула рибонуклеїнової кислоти побудована з одного полінуклеотидного ланцюга.
Вторинна структура рНК
Окремі ділянки ланцюга РНК утворюють спіралізовані петлі - "шпильки", рахунок водневих зв'язків між комплементарними азотистими основами A-U і G-C. Ділянки ланцюга РНК у таких спіральних структурах антипаралельні, але не завжди повністю комплементарні, у них зустрічаються неспарені нуклеотидні залишки або навіть одноланцюжкові петлі, що не вписуються у подвійну спіраль. Наявність спіралізованих ділянок притаманно всіх типів РНК.
Основна роль РНК - безпосередня участь у біосинтезі білка.
Відомі три види клітинних РНК, які відрізняються за місцем розташування в клітині, складі, розмірах і властивостях, що визначають їх специфічну роль в утворенні білкових макромолекул:
- інформаційні (матричні) РНК передають закодовану в ДНК інформацію про структуру білка від ядра клітини до рибосом, де здійснюється синтез білка; первинна структура всіх мРНК, незалежно від унікальності їх послідовності, що кодує, має однакову будову 5'- і З'-кінців.
Так, на 5'- кінці присутній модифікований нуклеотид 7-метилгуанозин-5'-трифосфат (кеп). Декілька десятків нуклеотидів відокремлюють кеп від ініціюючого кодону, зазвичай це триплет -AUG-. За діючою ділянкою слід один з термінуючих кодонів -UGA-, -UUA-, -UAG-. На 3-кінці більшості мРНК присутня послідовність нуклеотидів з 100-200 аденозинмонофосфатних залишків.
- Транспортні РНК збирають амінокислоти в цитоплазмі клітини і переносять їх у рибосому; молекули РНК цього типу "дізнаються" по відповідних ділянках ланцюга інформаційної РНК, які амінокислоти повинні брати участь у синтезі білка.
Просторову структуру будь-яких тРНК, незалежно від відмінностей у послідовності нук-леотидів, описують універсальною моделлю "конюшинного листа". У кожній молекулі тРНК є ділянки ланцюга, які беруть участь у освіті водневих зв'язків між нуклеотидними залишками.
До них, зокрема, відносять ділянку, відповідальну за зв'язування з амінокислотою на 3′ кінці молекули та антикодон — специфічний триплет нуклеотидів, що взаємодіє комплементарно з кодоном мРНК.
- Рибосомні РНК забезпечують синтез білка певної будови, зчитуючи інформацію з інформаційної (матрової) РНК. рРНК утворюють комплекси із білками, які називають рибосомами.
Кожна рибосома складається з двох субодиниць – малої (40S) та великої (60S). Субодиниці рибосом розрізняються не тільки набором рРНК, а й кількістю та структурою білків.
Дата публікації: 2015-02-03; Прочитано: 2729 | Порушення авторського права сторінки

РНК – полімер, мономерами якої є рибонуклеотиди.
На відміну від ДНК, РНК утворена не двома, а одним полінуклеотидним ланцюжком (виняток - деякі РНК-віруси мають дволанцюжкову РНК). Нуклеотиди РНК здатні утворювати водневі зв'язки між собою. Ланцюги РНК значно коротші за ланцюги ДНК.
Мономер РНК – нуклеотид (рибонуклеотид) – складається з залишків трьох речовин: 1) азотистої основи, 2) п'ятивуглецевого моносахариду (пентози) та 3) фосфорної кислоти. Азотисті основи РНК також відносяться до класів піримідинів та пуринів.
Піримидинові основи РНК – урацил, цитозин, пуринові основи – аденін та гуанін.
31. Типи РНК та особливості її структури
Моносахарид нуклеотиду РНК представлений рибозою.
Виділяють три види РНК: 1) інформаційна (матрична) РНК – іРНК (мРНК); 2) транспортна РНК – тРНК; 3) рибосомна РНК – рРНК.
Усі види РНК являють собою нерозгалужені полінуклеотиди, мають специфічну просторову конформацію і беруть участь у процесах синтезу білка.
Інформація про будову всіх видів РНК зберігається в ДНК. Процес синтезу РНК на матриці ДНК називається транскрипцією.

Транспортні РНК містять зазвичай 76 (від 75 до 95) нуклеотидів; молекулярна маса – 25 000–30 000.
Перед тРНК припадає близько 10% від загального вмісту РНК у клітині. Функції тРНК: 1) транспорт амінокислот до місця синтезу білка, рибосом, 2) трансляційний посередник. У клітині зустрічається близько 40 видів тРНК, кожен із них має характерну лише йому послідовність нуклеотидів. При цьому у всіх тРНК є кілька внутрішньомолекулярних комплементарних ділянок, через які тРНК набувають конформації, що нагадує формою лист конюшини.
Будь-яка тРНК має петлю для контакту з рибосомою (1), антикодонову петлю (2), петлю для контакту з ферментом (3), акцепторне стебло (4), антикодону (5). Амінокислота приєднується до 3-кінця акцепторного стебла. Антикодон - три нуклеотиди, що «пізнають» кодон іРНК.
Слід підкреслити, що конкретна тРНК може транспортувати певну амінокислоту, що відповідає її антикодону. Специфічність з'єднання амінокислоти і тРНК досягається завдяки властивостям ферменту аміноацил-тРНК-синтетазу.
Рибосомні РНК містять 3000-5000 нуклеотидів; молекулярна маса - 1000000-1500000.
Перед рРНК припадає 80–85% від загального вмісту РНК у клітині. У комплексі з рибосомними білками рРНК утворює рибосоми – органоїди, які здійснюють синтез білка. В еукаріотичних клітин синтез рРНК відбувається в ядерцях. Функції рРНК: 1) необхідний структурний компонент рибосом та, таким чином, забезпечення функціонування рибосом; 2) забезпечення взаємодії рибосоми та тРНК; 3) початкове зв'язування рибосоми та кодону-ініціатора іРНК та визначення рамки зчитування; 4) формування активного центру рибосоми.
Інформаційні РНК різноманітні за вмістом нуклеотидів та молекулярної маси (від 50 000 до 4 000 000).
Перед іРНК припадає до 5% від загального вмісту РНК у клітині. Функції іРНК: 1) перенесення генетичної інформації від ДНК до рибосом, 2) матриця для синтезу молекули білка; 3) визначення амінокислотної послідовності первинної структури білкової молекули.
Читайте також
Будова РНК – полімер, мономерами якого є нуклеотиди.
Три азотисті основи ті ж, що у складі ДНК (аденін, гуанін, цитозин); четверте – урацил – присутній у молекулі РНК замість тиміну. Нуклеотиди РНК містять замість дизоксирибози рібозу. У ланцюжку РНК.
три основні види РНК: інформаційна(іРНК), або матрична(МРНК), рибосомна(РРНК), та транспортна(ТРНК). Вони різняться за величиною молекул та функцій. Усі типи РНК синтезуються на ДНК з участю ферментів - РНК-полимераз. Інформаційна РНК становить 2-3% всієї клітинної РНК, рибосомна - 80-85, транспортна - близько 15%.
іРНК.
вона зчитує спадкову інформацію з ділянки ДНК і у формі скопійованої послідовності азотистих основ переносить її в рибосоми, де відбувається синтез певного білка. Кожна з молекул іРНК по порядку розташування нуклеотидів і за розміром відповідає гену в ДНК, з якого вона була транскрибована. У середньому іРНК містить 1500 нуклеотидів (75-3000). Кожен триплет (три нуклеотиди) на іРНК називається кодоном.Від кодону залежить, яка амінокислота постане в даному місці при синтезі білка.
(ТРНК)має відносно невисоку молекулярну масу порядку 24-29 тис.
Д і містить у молекулі від 75 до 90 нуклеотидів. До 10 % всіх нуклеотидів тРНК припадає на частку мінорних основ, що, мабуть, захищає її від дії гідролітичних ферментів. Роль тРНК полягає в тому, що вони переносять амінокислоти до рибосом і беруть участь у процесі синтезу білка. Кожна амінокислота приєднується до певної тРНК. Ряд амінокислот має більше однієї тРНК. На цей час виявлено понад 60 тРНК, які відрізняються між собою первинною структурою (послідовністю підстав).
Вторинна структура у всіх тРНК представлена у вигляді конюшинного листа з дволанцюжковим стеблом і трьома одноланцюжковими). На кінці одного з ланцюгів знаходиться акцепторна ділянка - триплет ЦЦА, до аденіну якого приєднується специфічна амінокислота.
(РРНК). Вони містять 120-3100 нуклеотидів. Рибосомна РНК накопичується в ядрі, у ядерцях.
У ядерця з цитоплазми транспортуються рибосомні білки, і там відбувається спонтанне утворення субчастинок рибосом шляхом поєднання білків з відповідними рРНК. Субчастки рибосоми разом або нарізно транспортуються через пори ядерної мембрани в цитоплазму. Рибосомиявляють собою органели завбільшки 20-30 нм.
Вони побудовані з двох субчастинок різного розміру та форми. На певних стадіях білкового синтезу у клітині відбувається поділ рибосом на субчастинки.
Рибосомна РНК служить хіба що каркасом рибосом і сприяє початковому зв'язування иРНК з рибосомою у процесі біосинтезу білка.
Питання 6 Зв'язки, що формують первинну та вторинну структури ДНК та РНК. Види РНК
Генетичний код- властивий усім живим організмам спосіб кодування амінокислотної послідовності білків за допомогою послідовності нуклеотидів.
Властивості: 1) генетичний код триплетний(кожна амінокислота кодується трьома нуклеотидами); 2) неперекривається(сусідні триплети немає загальних нуклеотидів); 3) вироджений(за винятком метіоніну та триптофану всі амінокислоти мають більше одного кодону); 4) універсальний(переважно однаковий всім живих організмів); 5) у кодонах для однієї амінокислоти перші два нуклеотиди, як правило, однакові, а третій варіює; 6) має лінійний порядок зчитування та характеризується колін-арністю,т.е.
е. збігом порядку розташування кодонів в іРНК з порядком розташування амінокислот в синтезується поліпептидного ланцюга.
Дата публікації: 2014-12-08; Прочитано: 11268 | Порушення авторського права сторінки
studopedia.org - Студопедія. Орг - 2014-2018 рік. (0.001 с) ...
У цитоплазмі клітин містяться три основні функціональні види РНК:
- матричні РНК (мРНК), що виконують функції матриць синтезу білка;
- рибосомні РНК (рРНК), що виконують роль структурних компонентів рибосом;
- транспортні РНК (тРНК), що у трансляції (перекладі) інформації мРНК в послідовність амінокислот молекули білка.
У ядрі клітин виявляють ядерну РНК, що становить від 4 до 10% від сумарної клітинної РНК.
Переважна більшість ядерної РНК представлена висококомолекулярними попередниками рибосомних і транспортних РНК. Попередники високомолекулярних рРНК (28 S, 18 S і 5 S РНК) в основному локалізуються в ядерці.
РНК є основним генетичним матеріалом у деяких вірусів тварин та рослин (геномні РНК). Для більшості РНК вірусів характерна зворотна транскрипція їхньої РНК геному, що спрямовується зворотною транскриптазою.
Всі рибонуклеїнові кислоти являють собою полімери рибонуклеотидів, з'єднаних, як у молекулі ДНК, 3′,5′-фосфорнодіефірними зв'язками.
На відміну від ДНК, що має дволанцюжкову структуру, РНК представляє собою одноланцюгові лінійні полімерні молекули.
Будова мРНК. мРНК - найбільш гетерогенний у відношенні розмірів та стабільності клас РНК.
Будова тРНК.
Транспортні РНК виконують функції посередників (адаптерів) в ході трансляції мРНК. На їхню частку припадає приблизно 15% сумарної клітинної РНК. Кожній із 20 протеїногенних амінокислот відповідає своя тРНК. Для деяких амінокіс-лот, що кодуються двома та більше кодонами, існують кілька тРНК.
тРНК є порівняно невеликі одноланцюгові молекули, що складаються з 70-93 нуклеотидів. Їхня молекулярна маса становить (2,4-3,1) .104 кДа.
Вторинна структура тРНК формується за рахунок утворення максимального числа водневих зв'язків між внутрішньомолекулярними комплементарними парами азотистих основ.
Внаслідок утворення цих зв'язків полінуклеотидний ланцюг тРНК закручується з утворенням спіралізованих гілок, що закінчуються петлями з неспарених нуклеотидів. Просторове зображення вторинних структур всіх тРНК має форму конюшинного листа.
У «конюшинному листі» розрізняють чотири обов'язкові гілки, більш довгі тРНК, крім того, містять коротку п'яту (додаткову) гілку.
Адапторну функцію тРНК забезпечують акцепторна гілка, до 3′-кінця якої приєднується ефірним зв'язком амінокислотний залишок, і протистояча акцепторної гілки антикодонова гілка, на вершині якої знаходиться петля, що містить антикодон.
Антикодон являє собою специфічний триплет нуклеотидів, який комплементарний в антипаралельному напрямку кодону мРНК, що кодує відповідну амінокислоту.
Т-гілка, що несе петлю псевдоурідіна (ТyС-петлю), забезпечує взаємодію тРНК з рибосомами.
Д-гілка, що несе дегідроуридинову петлю, забезпечує взаємодію тРНК з відповідною аміноацил-тРНК-синтетазою.

Вторинна структура тРНК
Функції п'ятої додаткової гілки поки що мало досліджені, найімовірніше вона зрівнює довжину різних молекул тРНК.
Третинна структура тРНК дуже компактна і утворюється шляхом зближення окремих гілок конюшинного листа за рахунок додаткових водневих зв'язків з утворенням L-подібної структури «ліктьового згину».
Транспортні РНК, будова та функціональний механізм.
При цьому акцепторне плече, що зв'язує амінокислоту, виявляється розташованим на одному кінці молекули, а анти-кодон - на іншому.

Третинна структура тРНК (за А.С. Спіріном)
Будова рРНК та рибосом. Рибосомні РНК формують основу, з якою зв'язуються специфічні білки при утворенні рибосом. Рибосоми – це нуклеопротеїнові органели, що забезпечують синтез білка на мРНК.
Число рибосом у клітині дуже велике: від 104 у прокаріотів до 106 у еукаріотів. Локалізуються рибосоми головним чином у цитоплазмі, у еукаріотів, крім того, в ядерці, в матриксі мітохондрій і стромі хлоропластів. Рибосоми складаються з двох субчастинок: великий і малої. За розмірами та молекулярною масою всі вивчені рибосоми ділять на 3 групи - 70S рибосоми прокаріотів (S-коефіцієнт седиментації), що складаються з малої 30S і великий 50S субчастинок; 80S рибосоми еукаріотів, що складаються з 40S малої та 60S великої субчастинок.
Мала субчастка 80S рибосом утворена однією молекулою рРНК (18S) та 33 молекулами різних білків.
Велика субчастиця утворена трьома молекулами рРНК (5S, 5,8S і 28S) і приблизно 50 білками.
Вторинна структура рРНК утворюється за рахунок коротких двоспіральних ділянок молекули - шпильок (близько 2/3 рРНК), 1/3 - представлена однотяжовими ділянками, багатими пуриновими нуклеотидами.
Соціальні кнопки для Joomla
Основу життя утворюють білки. Функції в клітці дуже різноманітні. Однак білки "не вміють" розмножуватися. А вся інформація про будову білків міститься у генах (ДНК).
У вищих організмів білки синтезуються у цитоплазмі клітини, а ДНК прихована за оболонкою ядра. Тому ДНК безпосередньо може бути матрицею для синтезу білка. Цю роль виконує інша нуклеїнова кислота – РНК.
Молекула РНК є нерозгалуженим полінуклеотидом, що володіє третинною структурою.
Вона утворена одним полінуклеотидним ланцюжком, і, хоча комплементарні нуклеотиди, що входять до її складу, також здатні утворювати між собою водневі зв'язки, ці зв'язки виникають між нуклеотидами одного ланцюжка. Ланцюги РНК значно коротші за ланцюги ДНК. Якщо вміст ДНК у клітині щодо постійно, то вміст РНК сильно коливається. Найбільше РНК у клітинах спостерігається під час синтезу білка.
РНК належить головна роль передачі та реалізації спадкової інформації.
Відповідно до функції та структурних особливостей розрізняють кілька класів клітинних РНК.
Існує три основні класи клітинних РНК.
- Інформаційна (іРНК) або матрична (мРНК). Її молекули найбільш різноманітні за розмірами, молекулярною масою (від 0,05х106 до 4х106) та стабільністю.
Складають близько 2% від загальної кількості РНК у клітині. Всі іРНК є переносниками генетичної інформації з ядра до цитоплазми, до місця синтезу білка. Вони є матрицею (робочим кресленням) для синтезу молекули білка, оскільки визначають амінокислотну послідовність (первинну структуру) білкової молекули.

- Рибосомальні РНК (РРНК).
Складають 80-85% від загального вмісту РНК у клітині.
31. Будова РНК. Типи РНК, особливості будови та функції. Вторинна структура т-РНК
Рибосомальна РНК складається із 3–5 тис. нуклеотидів. Вона синтезується в ядерцях ядра. У комплексі з рибосомними білками рРНК утворює рибосоми – органоїди, у яких відбувається складання білкових молекул. Основне значення рРНК полягає в тому, що вона забезпечує початкове зв'язування іРНК та рибосоми та формує активний центр рибосоми, в якому відбувається утворення пептидних зв'язків між амінокислотами у процесі синтезу поліпептидного ланцюга.
- Транспортні РНК (ТРНК).
Молекули тРНК зазвичай містять 75-86 нуклеотидів. Молекулярна маса молекул тРНК близько 25 тис. Молекули тРНК грають роль посередників у біосинтезі білка – вони доставляють амінокислоти до місця синтезу білка, тобто рибосоми. У клітині міститься понад 30 видів тРНК. Кожен вид тРНК має характерну лише йому послідовність нуклеотидів.
Однак у всіх молекул є кілька внутрішньомолекулярних комплементарних ділянок, завдяки наявності яких всі тРНК мають третинну структуру, що нагадує формою конюшинний лист.
Вторинна структура РНК– характерна для тРНК, одноланцюжкова, формою нагадує «конюшинний лист».
Включає:
- порівняно короткі подвійні спіралі – стебла,
- одновагові ділянки - петлі.
Є 4 стебла (акцепторний, антикодоновий, дигідроуридиловий, псевдоуріділовий) та 3 петлі.

"Стебель-петля" - елемент вторинної структури РНК, схематично

«Псевдовузол» - елемент вторинної структури РНК, схематично

Акцепторне стебло – містить 3'- і 5'- кінці полінуклеотидного ланцюга, 5'-кінець закінчується залишком гуанілової кислоти, 3'-кінець – триплетом ЦЦА і служить для утворення складноефірного зв'язку з АК.
Антикодонове стебло впізнає свій кодон на і-РНК у рибосомах за принципом комплементарності.
Псевдоуридилове стебло служить для прикріплення до рибосоми.
Дигідроуридилове стебло служить для зв'язку з аміноацил-тРНК-синтетазою.
Соціальні кнопки для Joomla





