Funkcinės tRNR sritys. tRNR struktūra ir funkcijos, aminorūgščių aktyvacijos ypatumai
70-90N | antrinis puslapis - dobilas | CCA 3" const visoms tRNR |
timino, pseudouridino-psi, digirouridino DGU buvimas D kilpoje – apsauga nuo ribonukleazių? ilgaamžės | Įvairių pirminių tRNR struktūrų – 61 + 1 – pagal kodonų skaičių + formilmetionino tRNR, katės antikodonas yra toks pat kaip ir metionino tRNR. Tretinių struktūrų įvairovė - 20 (pagal aminorūgščių skaičių) | atpažinimas – kovalentinio ryšio m-y tRNR susidarymas ir veikti | aminoacil-tRNR sintetazės prisijungia prie tRNR
tRNR funkcija yra pernešti aminorūgštis iš citoplazmos į ribosomas, kuriose vyksta baltymų sintezė.
tRNR, kurios suriša vieną aminorūgštį, vadinamos izoakceptoriais.
Iš viso ląstelėje vienu metu egzistuoja 64 skirtingos tRNR.
Kiekviena tRNR poruojasi tik su savo kodonu.
Kiekviena tRNR atpažįsta savo kodoną nedalyvaudama aminorūgštyje. Prie tRNR prisijungusios aminorūgštys buvo chemiškai modifikuotos, po to analizuojamas gautas polipeptidas, kuriame buvo modifikuota aminorūgštis. Cisteinil-tRNACys (R = CH2-SH) buvo redukuotas į alanil-tRNACys (R = CH3).
Dauguma tRNR, nepaisant jų nukleotidų sekos, turi dobilo lapo formos antrinę struktūrą, nes joje yra trys plaukų segtukai.
tRNR struktūriniai ypatumai
3 "molekulės gale" visada yra keturi nesuporuoti nukleotidai, iš kurių trys būtinai yra CCA. 5" ir 3" RNR grandinės galai sudaro akceptoriaus kamieną. Grandinės laikomos kartu dėl komplementarios poros. septyni nukleotidai 5" - galas su septyniais nukleotidais, esančiais netoli 3 "galo. 2. Visos molekulės turi T?C plaukų segtuką, taip pavadintą, nes jame yra dvi neįprastos liekanos: ribotimidinas (T) ir pseudouridinas (? plaukų segtukas susideda iš dvigubo - penkių suporuotų bazių stiebas, įskaitant G-C porą, ir septynių nukleotidų ilgio kilpa.
tame pačiame kilpos taške. 3. Antikodoniniame plaukų segtelyje kamieną visada atstovauja porinių šeima
pagrindu. Kilpoje yra tripletas, papildantis giminingą kodoną, antikodoną.
le, susidedantis iš septynių nukleotidų. Nekintama ura-
cilas ir modifikuotas citozinas, o modifikuotas purinas, kaip taisyklė, ribojasi su jo 3 colių galu
adeninas. 4. Kitas plaukų segtukas susideda iš trijų ar keturių nukleotidų porų ilgio kotelio ir kintamos kilpos
dydžio, dažnai turintis sumažintos formos uracilo – dihidrouracilo (DU). Labiausiai skiriasi kamienų nukleotidų sekos, nukleotidų skaičius tarp antikodono kamieno ir T?C kamieno (kintamoji kilpa), taip pat kilpos dydis ir dihidrouracilo liekanų lokalizacija DU kilpoje.
[Dainininkė, 1998].
Tretinė tRNR struktūra
L formos konstrukcija.
Aminorūgščių prijungimas prie tRNR
Kad aminorūgštis sudarytų polipeptidinę grandinę, ji turi būti prijungta prie tRNR fermentu aminoacil-tRNR sintetaze. Šis fermentas, dalyvaujant ATP, sudaro kovalentinį ryšį tarp aminorūgščių karboksilo grupės ir ribozės hidroksilo grupės tRNR 3' gale. Aminoacil-tRNR sintetazė atpažįsta specifinį kodoną ne dėl to, kad tRNR yra antikodonas, bet dėl to, kad tRNR yra specifinė atpažinimo vieta.
Iš viso ląstelėje yra 21 skirtinga aminoacil-tRNR sintetazė.
Prisijungimas vyksta dviem etapais:
1. Aminorūgščių karboksilo grupė yra prijungta prie ATP a-fosfato. Gautas nestabilus aminoaciladenilatas stabilizuojamas prisijungiant prie fermento.
2. Aminoaciladenilato aminoacilo grupės perkėlimas į tRNR galinės ribozės 2' arba 3'-OH grupę
Kai kurios aminoacil-tRNR sintetazės susideda iš vienos polipeptidinės grandinės, o kitos – iš dviejų ar keturių identiškų grandinių, kurių kiekvienos molekulinė masė yra nuo 35 iki 115 kDa. Kai kurie dimeriniai ir tetrameriniai fermentai susideda iš dviejų tipų subvienetų. Nėra aiškios koreliacijos tarp fermento molekulės dydžio ar jo subvieneto struktūros pobūdžio ir specifiškumo.
Fermento specifiškumą lemia stiprus jo prisijungimas prie tRNR akceptoriaus galo, DU srities ir kintamos kilpos. Atrodo, kad kai kurie fermentai neatpažįsta antikodono tripleto ir katalizuoja aminoacetilinimo reakciją net tada, kai antikodonas yra pakeistas. Tačiau kai kurie fermentai rodo sumažintą aktyvumą, susijusį su tokiomis modifikuotomis tRNR, ir, pakeičiant antikodoną, prideda netinkamą aminorūgštį.
70-90n | antrinis puslapis - dobilas | CCA 3" const visoms tRNR |
timino, pseudouridino-psi, digirouridino DGU buvimas D kilpoje – apsauga nuo ribonukleazių? ilgaamžės | Įvairių pirminių tRNR struktūrų – 61 + 1 – pagal kodonų skaičių + formilmetionino tRNR, katės antikodonas yra toks pat kaip ir metionino tRNR. Tretinių struktūrų įvairovė - 20 (pagal aminorūgščių skaičių)
Prokariotuose yra dviejų tipų tRNR surišantis metioninas tRNAFMet ir tRNAMMet, o eukariotuose – tRNAIMet ir tRNAMMet. Metioninas pridedamas prie kiekvienos tRNR naudojant atitinkamą aminoacil-tRNR sintezę. metioniną, prijungtą prie tRNAFMet ir tRNAIMet, sudaro fermentas metionil-tRNR-transformilazė į Fmet-tRNAFMet. tRNR, pakrautos su formilmetioninu, atpažįsta iniciacijos kodoną AUG.
Literatūra:
Deja, bibliografijos nėra.
Vadovėlis. Nepaisant to, kad tRNR yra daug mažesnė, istorija apie jos struktūrą, ypatybes ir veikimą nusipelno atskiro skyriaus.
Taigi, tRNR yra „adapteris“, kuris viename gale atpažįsta trijų raidžių genetinio kodo seką, suderindamas ją su vienintele atitinkama aminorūgštimi, fiksuota kitame tRNR gale. Pernešimo RNR, kuri liečiasi su pasiuntinio RNR, pabaigoje susidaro 3 nukleotidai. antikodonas. Tik tuo atveju, jei antikodonas yra komplementarus mRNR sričiai, gali prisijungti pernešanti RNR. Tačiau net ir šiuo atveju tRNR negali pati prisijungti prie mRNR, jai reikia ribosomų pagalbos, kuri yra jų sąveikos vieta, taip pat aktyvaus vertimo dalyvio. Pavyzdžiui, tai yra ribosoma, kuri sukuria ryšius tarp aminorūgščių, kurias atneša tRNR, sudarydama baltymų grandinę.
tRNR struktūrines ypatybes lemia genetinis kodas, tai yra baltymo konstravimo pagal geną, kurį skaito pernešančioji RNR, taisyklės. Šis kodas veikia kiekviename gyvame Žemės padare: viruso sukūrimas parašytas tais pačiais trijų raidžių kodonais, kuriais rašomos delfino „surinkimo instrukcijos“. Eksperimentiškai patikrinta, kad vienos gyvos būtybės genai, patalpinti į kito ląstelę, puikiai nukopijuojami ir paverčiami baltymais, kurie nesiskiria nuo šeimininko ląstelėse besidauginančių genų. Genetinio kodo vienodumas yra pagrindas modifikuotų E. coli gamybai insulino ir daugelio kitų žmogaus fermentų kolonijose, kurie naudojami kaip vaistai žmonėms, kurių organizmas nepajėgia jų pasigaminti arba gamina nepakankamai. Nepaisant akivaizdaus skirtumo tarp žmonių ir E. coli, žmogaus baltymai lengvai sukuriami iš žmogaus brėžinių naudojant E. coli kopijavimo aparatą. Nenuostabu, kad skirtingų būtybių perdavimo RNR skiriasi labai mažai.

Kiekvienas kodonas iš šio sąrašo, išskyrus tris stop kodonai, signalizuojantį apie vertimo pabaigą, turėtų atpažinti perdavimo RNR. Atpažinimas atliekamas prijungus antikodoną prie pasiuntinio RNR, kuris gali prisijungti tik prie vieno kodono iš sąrašo, todėl tRNR gali atpažinti tik vieną kodoną. Tai reiškia, kad ląstelėje yra mažiausiai 61 šių molekulių tipas. Tiesą sakant, jų yra dar daugiau, nes kai kuriose situacijose pasiuntinei RNR nuskaityti neužtenka tik turėti tinkamą antikodoną: reikalingos kitos sąlygos, pagal kurias sukuriama speciali modifikuota tRNR.
Iš pirmo žvilgsnio tokia tRNR įvairovė turėtų gerokai apsunkinti vertimo procesą: juk kiekviena iš šių molekulių patikrins, ar matricos RNR kodonas, pakeistas ribosoma, atitinka jo antikodoną – atrodytų, tiek beprasmiško mechaninio darbo. , tiek sugaišto laiko ir energijos. Tačiau dėl evoliucijos taip pat susiformavo ląstelių mechanizmai, kurie užkerta kelią šiai problemai. Pavyzdžiui, kiekvienos rūšies tRNR kiekis ląstelėje atitinka tai, kaip dažnai tos rūšies nešama aminorūgštis randama statomuose baltymuose. Yra aminorūgščių, kurias ląstelė naudoja retai, ir yra tokių, kurios dažnai naudojamos, ir jei jas pernešančių tRNR skaičius būtų vienodas, tai labai apsunkintų baltymų surinkimą. Todėl „retų“ aminorūgščių ir jas atitinkančių tRNR ląstelėje yra nedaug, o dažnai pasitaikančios jų gaminamos dideliais kiekiais.

Esant tokiai tRNR molekulių įvairovei, jos visos labai panašios, todėl, atsižvelgdami į jų struktūrą ir funkcijas, daugiausia tirsime visoms rūšims būdingus požymius. Kai žiūrite į 3D tRNR išdėstymą, jis atrodo kaip tanki atomų krūva. Atrodo neįtikėtina, kad ši sudėtingai susukta molekulė yra ilgos nukleotidų grandinės sulankstymo rezultatas, tačiau taip ji susidaro.
Galima atsekti jo formavimosi etapus, pradedant nuo pat pirmųjų: nukleotidų sekos sudarymas RNR polimeraze pagal geną, kuriame yra informacijos apie šią pernešamąją RNR. Vadinama tvarka, kuria šie nukleotidai seka vienas po kito ir jų skaičius pirminė tRNR struktūra. Pasirodo, būtent pirminė tRNR struktūra yra užkoduota RNR polimerazės nuskaitytame gene. Apskritai pirminė struktūra yra gana paprastų to paties tipo molekulių seka, iš kurių sudaryta sudėtingesnė, sulankstyta polimero molekulė. Pavyzdžiui, pirminė baltymo molekulės struktūra yra paprasta ją sudarančių aminorūgščių seka.

Jokia nukleotidų grandinė ląstelėje negali būti išsiskleidusi, tiesiog ištempta linija. Nukleotidų pakraščiuose yra per daug teigiamai ir neigiamai įkrautų dalių, kurios lengvai sudaro vandenilinius ryšius tarpusavyje. Kaip susidaro tie patys ryšiai tarp dviejų DNR molekulių nukleotidų, sujungiančių juos į dvigubą spiralę, aprašyta, o daugiau apie vandenilinius ryšius galite rasti. Vandeniliniai ryšiai yra ne tokie stiprūs nei ryšiai tarp atomų molekulėse, tačiau jų pakanka, kad išgalvotai susuktų tRNR grandinę ir išlaikytų ją tokioje padėtyje. Iš pradžių šie ryšiai susidaro tik tarp kai kurių nukleotidų, sulenkdami tRNR į dobilo lapo formą. Šio pradinio lankstymo rezultatas vadinamas antrinė struktūra tRNR. Diagrama kairėje rodo, kad tik kai kurie nukleotidai yra susieti vandeniliniais ryšiais, o kiti lieka nesuporuoti, sudarydami žiedus ir kilpas. Skirtingų tipų tRNR antrinės struktūros skirtumai atsiranda dėl jų pirminės struktūros skirtumų. Tai pasireiškia skirtingais „dobilų lapų“ ar „stiebelių“ ilgiais dėl skirtingo pradinės nukleotidų grandinės ilgio.
Kitas skirtingų tRNR pirminės struktūros skirtumas yra tas, kad tik kai kuriose padėtyse jie turi tuos pačius nukleotidus (aukščiau esančioje diagramoje jie pažymėti pirmosiomis jų pavadinimų raidėmis), tuo tarpu dauguma skirtingų tRNR nukleotidų skiriasi vienas nuo kito. Aukščiau pateikta schema yra bendra visoms tRNR, todėl skirtingi nukleotidai pažymėti skaičiais.
Pagrindinės funkcinės tRNR dalys yra:
=) antikodonas, tai yra nukleotidų seka, kuri yra komplementari vienam pasiuntinio RNR kodonui, esančiam antikodono plaukų segtukas
=) akceptoriaus pabaiga prie kurios gali būti prijungta aminorūgštis. Jis yra priešingoje antikodono plaukų segtuko pusėje.
Tiesą sakant, ne viena tRNR atrodo taip, kaip antrinės struktūros diagramoje, nes tik kai kurie nukleotidai susijungė, kad sudarytų ją, o likusieji liko nesuporuoti. Dėl vandenilinių ryšių tarp nukleotidų iš skirtingų dobilo lapo dalių susidarymo, jis toliau susilanksto į daug sudėtingesnį tretinė struktūra L formos. Galite tiksliai suprasti, kaip skirtingos antrinės struktūros dalys išlinko, kad sudarytų tretinę struktūrą, suderinę spalvas toliau pateiktose diagramose. Antikodono plaukų segtukas, pažymėtas mėlyna ir pilka spalva, lieka apačioje (vertėtų atsiminti, kad šis „apačia“ yra sąlyginis: baltymų transliacijos schemose patogu vaizduoti tRNR šioje erdvinėje orientacijoje), o akceptoriaus galas (geltonas) yra sulenktas į šoną.

Taip atrodo tRNR, kai ji yra pasirengusi prijungti aminorūgštį. tRNR pati negali susijungti su aminorūgštimi, tam reikia specialaus fermento: aminoacil-tRNR sintetazės. Sintetazės tipų skaičius ląstelėje sutampa su tRNR tipų skaičiumi.
Visų tipų tRNR formos vienodumas būtinas, kad ribosoma galėtų atpažinti bet kurią iš jų, palengvinti jų prijungimą prie mRNR ir judėti savyje iš vienos vietos į kitą. Jei skirtingų tipų tRNR labai skirtųsi viena nuo kitos, tai labai apsunkintų ribosomų darbą, kritiškai sumažinant baltymų sintezės greitį. Taigi natūralios atrankos tikslas yra padaryti tRNR panašias viena į kitą. Tačiau tuo pat metu yra dar vienas veiksnys, reikalaujantis pastebimų skirtumų tarp skirtingų tRNR tipų: juk reikia atpažinti kiekvieną tipą ir prie jo prijungti vienintelę atitinkamą aminorūgštį. Akivaizdu, kad šie skirtumai turėtų būti pastebimi, bet ne per dideli, kad tRNR rūšių atpažinimo darbas virstų juvelyrikos procesu. Ir būtent tai atlieka aminoacil-tRNR sintetazės: kiekviena iš jų gali prisijungti tik prie vienos iš 20 aminorūgščių ir prijungti ją būtent prie tų tRNR tipų, kurie atitinka šią aminorūgštį. Iš lentelės su genetiniu kodu matyti, kad kiekvieną aminorūgštį koduoja kelios nukleotidų sekos, todėl, pavyzdžiui, visas keturias tRNR su antikodonais CGA, CGG, CGU ir CGC atpažins ta pati sintetazė, kuri jungiasi alaniną. jiems. Tokios vienos sintetazės apdorotos tRNR vadinamos susijęs.
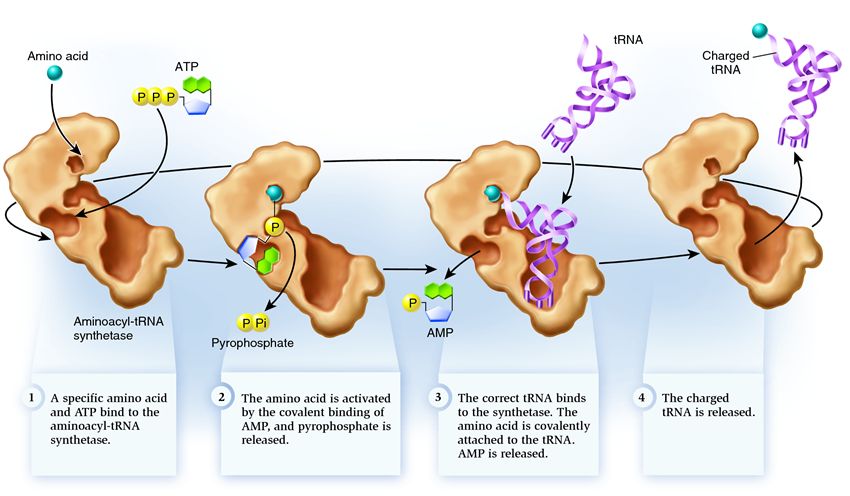
Sintetazė priklauso fermentų grupei, kurios funkcija yra prisijungti prie atskirai egzistuojančių molekulių ir sujungti jas į vieną:
1 . sintetazė jungia aminorūgštį ir ATP molekulę. Dvi fosfatų grupės atsiskiria nuo ATP, išskirdamos energiją, reikalingą toliau nurodytai veiklai. Adenozino monofosfatas (AMP), likęs iš sunaikintos molekulės, prisijungia prie aminorūgšties, paruošdamas ją jungtis su akceptoriaus plaukų segtuku.
2 . sintetazė prisitvirtina prie savęs vieną iš giminingų tRNR, atitinkančių šią aminorūgštį.

Šiame etape patikrinama pernešančios RNR atitiktis sintetazei. Yra keletas atpažinimo būdų, ir kiekviena sintetazė turi unikalų jų derinį. Bent vienas antikodono nukleotidas dalyvauja sintetazės ir tRNR sąveikoje. Taip pat reikia patikrinti akceptorių plaukų segtuką: nustatoma, ar ant jo yra specifinių nukleotidų, bendrų giminingoms tRNR, atitinkančioms norimą aminorūgštį. Nukleotidai iš kitų tRNR dalių taip pat gali dalyvauti suderinime, prisijungdami prie tam tikrų sintetazės vietų. Neteisinga tRNR tam tikru būdu gali atitikti norimą, tačiau dėl nepilno atitikimo ji lėtai ir laisvai prisijungs prie sintetazės, lengvai nukris. O teisinga tRNR greitai ir tvirtai prilips prie sintetazės, ko pasekoje pasikeičia sintetazės struktūra, prasidės procesas aminoacilinimas , tai yra, aminorūgšties prijungimas prie tRNR.

3 . aminoacilinimas susideda iš AMP molekulės, prijungtos prie aminorūgšties, pakeitimo tRNR molekule. Po šio pakeitimo AMP palieka sintetazę ir tRNR sulaikomas paskutiniam aminorūgščių patikrinimui. Jei prijungta aminorūgštis bus atpažinta kaip neteisinga, ji bus atskirta nuo tRNR, aminorūgšties vieta sintetazėje bus tuščia ir gali prisijungti kita molekulė. Naujoji aminorūgštis pereis jungties su ATP ir tRNR stadijas, taip pat bus išbandyta. Jei nebuvo padaryta klaidų, aminorūgštimi įkrauta tRNR išsiskiria: ji yra pasirengusi atlikti savo vaidmenį baltymų vertime. Ir sintetazė yra pasirengusi prijungti naujas aminorūgštis ir tRNR, ir ciklas prasidės iš naujo.
Daug kas priklauso nuo teisingo aminoacil-tRNR sintetazės veikimo: jei šiame etape įvyksta gedimas, tada prie tRNR bus prijungta netinkama aminorūgštis. Ir jis bus įterptas į ribosomoje augantį baltymą, nes tRNR ir ribosoma neatlieka kodono ir aminorūgšties atitikimo tikrinimo funkcijos. Klaidos pasekmės gali būti nedidelės arba katastrofiškos, o natūralios atrankos būdu būtybės su fermentais, kurios neatlieka tokių patikrinimų funkcijos, buvo išstumtos labiau prisitaikančiais su įvairiomis aminorūgščių ir tRNR derinimo galimybėmis. Todėl šiuolaikinėse ląstelėse sintetazė su netinkama aminorūgštimi susijungia vidutiniškai vienu atveju iš 50 tūkst., o su netinkama tRNR – tik kartą iš 100 tūkst.

Kai kurios aminorūgštys viena nuo kitos skiriasi tik keliais atomais. Jei pažvelgsite į jų schemas, tampa akivaizdu, kad tikimybė supainioti argininą su alaninu yra daug mažesnė nei painiojus izoleuciną su leucinu ar valinu. Todėl kiekviena sintetazė, kuri jungiasi su viena iš panašių viena į kitą aminorūgščių, turi papildomų patikros mechanizmų. Štai tokio izoleucino-tRNR sintetazės pritaikymo pavyzdys:

Kiekviena sintazė turi sintetinis centras kurioje aminorūgštis yra prijungta prie tRNR. Sintetazės užfiksuotos tRNR akceptoriaus plaukų segtukas eina ten, kaip ir aminorūgštis, kuri yra pasirengusi su ja reaguoti. Kai kurių sintetazių darbas baigiasi iš karto po aminorūgšties ir tRNR sujungimo. Tačiau Ile-tRNR sintetazė turi didesnę galimybę suklysti dėl kitų į izoleuciną panašių aminorūgščių. Todėl ji taip pat turi pataisos centras: iš pavadinimo aišku, kokį vaidmenį ji atlieka tRNR ir aminorūgščių sujungimo procese. Paveikslėlis dešinėje rodo, kad tRNR akceptoriaus plaukų segtuko galo padėtis sintetiniame Ile-tRNR sintetazės centre suteikia šiam plaukų segtukui nenatūralų lenkimą. Tačiau sintetazė išlaiko tRNR šioje padėtyje tol, kol prie jos prisijungia aminorūgštis. Įvykus šiam ryšiui, poreikis rasti akceptorių plaukų segtuką sintetiniame centre išsenka, o tRNR išsitiesina, o jo galas su prijungta aminorūgštimi patenka į korekcijos centrą.

Žinoma, sintetinis centras taip pat atlieka tam tikrą vaidmenį išskiriant aminorūgštis, kurios netinka sintetazei. Kad į ją patektų, molekulė turi atitikti tam tikras sąlygas, įskaitant tinkamo dydžio. Nepaisant to, kad leucine ir izoleucine yra vienodas atomų skaičius, dėl erdvinės struktūros skirtumų leucinas yra didesnis. Todėl jis negali prasiskverbti į sintetinį centrą, kurio dydis atitinka kompaktiškesnį izoleuciną, ir tiesiog atsimuša nuo Ile-tRNR sintetazės.
Tačiau valinas, kuris yra mažiausia iš šių trijų panašios atominės struktūros molekulių, lengvai užima izoleucino vietą sintetiniame centre, o sintetazė prijungia jį prie tRNR. Būtent šiuo atveju pradeda veikti korekcinis sintetazės centras. Jei tiesinimo akceptorius plaukų segtukas yra tinkamai įkrautas ir turi izoleuciną, tada jis negali išspausti korekcijos centro: jis tiesiog per mažas šiai molekulei. Taigi ištiesintos tRNR niekas nebelaiko ir ji atsiskiria nuo sintetazės. Bet jei valinas yra prijungtas prie tRNR, jis nuslysta į korekcijos centrą, taip išlaikydamas tRNR prijungtą prie jo sintetazėje. Toks pernelyg ilgas tRNR buvimas viduje yra sintetazės klaidos signalas, keičiantis jos erdvinę konfigūraciją. Kaip rezultatas:
=) valinas atsiskiria nuo tRNR ir pašalinamas iš sintetazės
=) akceptorius plaukų segtukas grįžta į sintetinę vietą, laukdamas prisijungimo prie aminorūgšties
=) sintetazė prisijungia prie naujos aminorūgšties, ja „pakrauna“ tRNR ir vėl patikrina, ar tam nebuvo panaudotas izoleucinas.
Panašų dvigubo atpažinimo mechanizmą naudoja ir kitos sintetazės.
Fizinės ir cheminės DNR savybės
Įvairūs veiksniai, ardantys vandenilinius ryšius (temperatūros kilimas virš 80 C, pH ir jonų stiprumo pokyčiai, karbamido veikimas ir kt.) sukelia DNR denatūraciją, t.y. DNR grandinių erdvinio išsidėstymo pasikeitimas nenutrūkstant kovalentiniams ryšiams. Dviguba DNR spiralė denatūracijos metu yra visiškai arba iš dalies suskirstyta į sudedamąsias grandines. DNR denatūraciją lydi purino ir pirimidino bazių UV srities optinės sugerties padidėjimas. Šis reiškinys vadinamas hiperchrominis poveikis . Denatūravimas taip pat sumažina didelį klampumą, būdingą natūraliems DNR tirpalams. Atkūrus pirminę dvigrandę DNR struktūrą, dėl renatūracijos sumažėja azoto bazių absorbcija esant 260 nm dėl jų „ekranavimo“. Šis reiškinys vadinamas hipochrominis poveikis .
Kiekvienos DNR „išvyniojimas“ į sudedamąsias grandines vyksta tam tikrame temperatūros diapazone. Šio intervalo vidurio taškas vadinamas lydymosi tašku. DNR lydymosi temperatūra standartinėmis sąlygomis (tam tikra pH ir jonų stiprumas) priklauso nuo azoto bazių santykio. G-C poros, kuriose yra trys vandenilio ryšiai, yra stipresnės, todėl kuo didesnis G-C porų kiekis DNR, tuo aukštesnė lydymosi temperatūra.
DNR funkcijos. Nukleotidų sekoje DNR molekulėse užkoduota genetinė informacija. Pagrindinės DNR funkcijos yra, pirma, užtikrinti savo pačios dauginimąsi ląstelių kartų ir organizmų kartų serijoje, antra, užtikrinti baltymų sintezę. Šios funkcijos atsiranda dėl to, kad DNR molekulės pirmuoju atveju tarnauja kaip matrica replikacijai, t.y. informacijos kopijavimas dukterinėse DNR molekulėse, antroje – transkripcijai, t.y. perkoduoti informaciją į RNR struktūrą.
Ryžiai. 5 Lydymosi kreivė (DNR denatūracija)
Denatūracijos metu atskirtos papildomos DNR grandinės tam tikromis sąlygomis gali vėl susijungti į dvigubą spiralę. Šis procesas vadinamas RENATURACIJA. Jei denatūracija neįvyko iki galo ir bent kelios bazės neprarado sąveikos vandeniliniais ryšiais, renatūracija vyksta labai greitai.
Ląstelių citoplazmoje yra trys pagrindiniai funkciniai RNR tipai. Tai pasiuntinių RNR – mRNR, kurios veikia kaip baltymų sintezės šablonai, ribosominės RNR – rRNR, kurios veikia kaip struktūriniai ribosomų komponentai, ir perneša RNR – tRNR, dalyvaujančias iRNR informacijos vertime (vertimu) į baltymo aminorūgščių seką.
2 lentelėje parodyti DNR ir RNR skirtumai pagal struktūrą, lokalizaciją ląstelėje ir funkcijas.
2 lentelė DNR ir RNR skirtumai
Perneškite RNR, tRNR-ribonukleino rūgštis, kurios funkcija yra transportuoti AA į baltymų sintezės vietą. Įprastas jo ilgis yra nuo 73 iki 93 nukleotidų, o dydis yra apie 5 nm. tRNR taip pat tiesiogiai dalyvauja polipeptidinės grandinės augime, prisijungdamos – būdamos komplekse su aminorūgštimi – prie mRNR kodono ir suteikdamos komplekso konformaciją, reikalingą naujam peptidiniam ryšiui susidaryti. Kiekviena aminorūgštis turi savo tRNR. tRNR yra vienagrandė RNR, tačiau funkcine forma ji turi dobilo lapų konformaciją. AA yra kovalentiškai prijungtas prie 3" molekulės galo naudojant fermentą aminoacil-tRNR sintetazę, būdingą kiekvienam tRNR tipui. C vietoje yra antikodonas, atitinkantis AA-te. tRNR sintetina įprasta RNR polimerazė. prokariotų atveju ir RNR polimerazės III – eukariotų atveju tRNR genų nuorašai apdorojami daugiapakopiais, todėl susidaro tRNR būdinga erdvinė struktūra.
tRNR apdorojimas apima 5 pagrindinius veiksmus:
5" lyderio nukleotidų sekos pašalinimas;
3'-galinės sekos pašalinimas;
CCA sekos pridėjimas 3 colių gale;
intronų išskyrimas (eukariotuose ir archėjose);
atskirų nukleotidų modifikacijos.
tRNR transportavimas atliekamas nuo Ran priklausomu keliu, dalyvaujant transportavimo faktoriui eksportin t, kuris atpažįsta būdingą antrinį ir tretinį subrendusios tRNR str-ru: trumpas dvigrandės dalis ir teisingai apdorotas 5 "- ir 3" baigiasi. Šis mechanizmas užtikrina, kad iš branduolio būtų eksportuojamos tik subrendusios tRNR.
62. Vertimas – mRNR kodono atpažinimas
Vertimas yra baltymų sintezė, kurią atlieka ribosomos iš aminorūgščių, esančių mRNR (arba ir RNR) šablone. Transliacijos proceso sudedamosios dalys: aminorūgštys, tRNR, ribosomos, mRNR, tRNR aminoacilinimo fermentai, baltymų transliacijos faktoriai (baltymų inicijavimo, pailgėjimo, pabaigos faktoriai – specifiniai ekstraribosominiai baltymai, reikalingi transliacijos procesams), ATP ir GTP energijos šaltiniai. , magnio jonai (stabilizuoja ribosomų struktūrą). Baltymų sintezėje dalyvauja 20 aminorūgščių. Kad aminorūgštis „atpažintų“ savo vietą būsimoje polipeptidinėje grandinėje, ji turi prisijungti prie pernešančios RNR (tRNR), kuri atlieka adapterio funkciją. Tada tRNR, kuri jungiasi su aminorūgštimi, atpažįsta atitinkamą kodoną mRNR. mRNR kodono atpažinimas:
Kodono ir antikodono sąveika grindžiama komplementarumo ir antiparaleliškumo principais:
3'----C - G-A*------5' tRNR antikodonas
5'-----G-C-Y*------3' mRNR kodonas
Svyravimo hipotezę pasiūlė F. Crickas:
iRNR kodono 3' bazė turi negriežtą porą su tRNR antikodono 5' baze: pavyzdžiui, Y (mRNR) gali sąveikauti su A ir G (tRNR)
Kai kurios tRNR gali susieti su daugiau nei vienu kodonu.
63. Vertimo proceso sudedamųjų dalių charakteristikos. Vertimas (translatio-translation) yra baltymų sintezės iš aminorūgščių, esančių informacinės (matricos) RNR (mRNR, mRNR) matricoje, procesas, kurį atlieka ribosoma.
Baltymų sintezė yra ląstelių gyvybės pagrindas. Šiam procesui atlikti visų organizmų ląstelėse yra specialios organelės - ribosomos- ribonukleoproteinų kompleksai, sudaryti iš 2 subvienetų: didelio ir mažo. Ribosomų funkcija yra atpažinti trijų raidžių (trijų nukleotidų) kodonai mRNR, lyginant juos su atitinkamais tRNR antikodonais, turinčiais amino rūgštys, ir šių aminorūgščių pridėjimas prie augančios baltymų grandinės. Judant išilgai mRNR molekulės, ribosoma sintetina baltymą pagal mRNR molekulėje esančią informaciją.
AK-t atpažinimui ląstelėje yra specialūs „adapteriai“, perneša RNR molekules(tRNR). Šios dobilo lapo formos molekulės turi vietą (antikodoną), kuri yra komplementari mRNR kodonui, taip pat kitą vietą, prie kurios yra prijungta tą kodoną atitinkanti aminorūgštis. Aminorūgščių prijungimas prie tRNR vyksta nuo energijos priklausomoje reakcijoje, naudojant fermentus aminoacil-tRNR sintetazes, o gauta molekulė vadinama aminoacil-tRNR. Taigi vertimo specifiškumą lemia sąveika tarp mRNR kodono ir tRNR antikodono, taip pat aminoacil-tRNR sintetazių, kurios griežtai prijungia aminorūgštis prie atitinkamų tRNR, specifiškumas (pavyzdžiui, GGU kodonas atitiks tRNR, turintis CCA antikodoną ir tik AK gliciną).
prokariotinė ribosoma
5S ir 23S rRNR 16S rRNR
34 voverės 21 voveraitė
Prokariotinių ribosomų sedimentacijos konstanta yra 70S, todėl jos vadinamos 70S dalelėmis. Jie yra sudaryti iš dviejų skirtingų subvienetų: 30S ir 50S subvienetų. Kiekvienas subvienetas yra rRNR ir ribosomų baltymų kompleksas.
30S dalelėje yra viena 16S rRNR molekulė ir daugeliu atvejų viena baltymo molekulė iš daugiau nei 20 rūšių (21). 50S subvienetas susideda iš dviejų rRNR molekulių (23S ir 5S). Jį sudaro daugiau nei 30 skirtingų baltymų (34), taip pat, kaip taisyklė, viena kopija. Dauguma ribosomų baltymų atlieka struktūrinę funkciją.
eukariotinė ribosoma
5S; 5,8S ir 28S rRNR 18S rRNR
ne mažiau 50 baltymų mažiausiai 33 baltymai
Ribosoma susideda iš didelių ir mažų subvienetų. Kiekvieno subvieneto struktūros pagrindas yra sudėtingai sulankstyta rRNR. Ribosomų baltymai buvo pritvirtinti prie rRNR karkaso.
Pilnos eukariotinės ribosomos sedimentacijos koeficientas yra apie 80 Svedbergo vienetų (80S), o jos dalelių nusėdimo koeficientas yra 40S ir 60S.
Mažesnįjį 40S subvienetą sudaro viena 18S rRNR molekulė ir 30–40 baltymų molekulių. Dideliame 60S subvienete yra trijų tipų rRNR, kurių sedimentacijos koeficientai yra 5S, 5,8S ir 28S, ir 40-50 baltymų (pavyzdžiui, žiurkės hepatocitų ribosomose yra 49 baltymai).
Funkcinės ribosomų sritys
P – peptidilo vieta peptidilo tRNR
A - aminoacilo vieta aminoacilo tRNR
E – vieta tRNR išlaisvinimui iš ribosomos
Ribosomoje yra 2 funkcinės vietos sąveikai su tRNR: aminoacilas (akceptorius) ir peptidilas (donoras). Aminoacil-tRNR patenka į ribosomos akceptoriaus vietą ir sąveikauja sudarydama vandenilinius ryšius tarp kodono ir antikodono tripletų. Susidarius vandeniliniams ryšiams, sistema pajudina 1 kodoną ir patenka į donoro vietą. Tuo pačiu metu atsilaisvinusioje akceptoriaus vietoje atsiranda naujas kodonas, prie jo prijungiama atitinkama aminoacil-t-RNR.
Ribosomos: struktūra, funkcija
Ribosomos yra citoplazminiai baltymų biosintezės centrai. Jie susideda iš didelių ir mažų subvienetų, kurie skiriasi sedimentacijos koeficientais (nusėdimo greitis centrifugavimo metu), išreikšti Svedberg - S vienetais.
Ribosomų yra ir eukariotinėse, ir prokariotinėse ląstelėse, nes jos atlieka svarbią funkciją baltymų biosintezė. Kiekvienoje ląstelėje yra dešimtys, šimtai tūkstančių (iki kelių milijonų) šių mažų apvalių organelių. Tai suapvalinta ribonukleoproteino dalelė. Jo skersmuo yra 20-30 nm. Ribosoma susideda iš didelių ir mažų subvienetų, besiskiriančių sedimentacijos koeficientais (sedimentacijos greitis centrifugavimo metu), išreikštų Svedbergo vienetais – S. Šie subvienetai jungiami esant m-RNR grandinei (matricai, arba informacinei, RNR). Ribosomų grupės, kurią vienija viena mRNR molekulė kaip karoliukų virtinė, kompleksas vadinamas polisomas. Šios struktūros yra laisvai išsidėsčiusios citoplazmoje arba pritvirtintos prie granuliuoto ER membranų (abiem atvejais jose aktyviai vyksta baltymų sintezė).
Granuliuotos ER polisomos sudaro baltymus, kurie išsiskiria iš ląstelės ir naudojami viso organizmo poreikiams tenkinti (pavyzdžiui, virškinimo fermentai, žmogaus motinos pieno baltymai). Be to, ribosomos yra vidiniame mitochondrijų membranų paviršiuje, kur jos taip pat aktyviai dalyvauja baltymų molekulių sintezėje.
Pernešimo RNR (tRNR) vaidina svarbų vaidmenį ląstelėje naudojant paveldimą informaciją. Pristatydama reikiamas aminorūgštis į peptidinių grandinių surinkimo vietą, tRNR veikia kaip transliacijos tarpininkas.
tRNR molekulės yra polinukleotidinės grandinės, susintetintos konkrečiose DNR sekose. Jie susideda iš palyginti nedidelio nukleotidų skaičiaus -75-95. Dėl bazių, esančių skirtingose tRNR polinukleotidinės grandinės dalyse, komplementariai sujungus, jis įgauna struktūrą, savo forma primenančią dobilo lapą (3.26 pav.).
Ryžiai. 3.26. Tipiškos tRNR molekulės struktūra.
Jį sudaro keturios pagrindinės dalys, kurios atlieka skirtingas funkcijas. priėmėjas„Stiebelį“ sudaro dvi viena kitą papildančios, sujungtos galinės tRNR dalys. Jį sudaro septynios bazinės poros. Šio stiebo 3' galas yra šiek tiek ilgesnis ir sudaro vienos grandinės sritį, kuri baigiasi CCA seka su laisva OH grupe. Prie šio galo pritvirtinama transportuojama aminorūgštis. Likusios trys šakos yra viena kitą papildančios suporuotos nukleotidų sekos, kurios baigiasi nesuporuotomis sekcijomis, kurios sudaro kilpas. Šių šakų vidurys – antikodonas – susideda iš penkių nukleotidų porų, o kilpos centre yra antikodonas. Antikodonas yra trys nukleotidai, papildantys mRNR kodoną, kuris koduoja aminorūgštį, kurią ši tRNR perneša į peptidų sintezės vietą.
Tarp akceptoriaus ir antikodono šakų yra dvi šoninės šakos. Jų kilpose yra modifikuotų bazių – dihidrouridinas (D-kilpa) ir TψC tripletas, kur \y yra pseudouriain (T^C-kilpa).
Tarp aitikodono ir T^C šakų yra papildoma kilpa, kurią sudaro nuo 3-5 iki 13-21 nukleotidų.
Apskritai skirtingiems tRNR tipams būdingas tam tikras nukleotidų sekos pastovumas, kuris dažniausiai susideda iš 76 nukleotidų. Jų skaičiaus kitimas daugiausia susijęs su nukleotidų skaičiaus pasikeitimu papildomoje kilpoje. Papildomi regionai, palaikantys tRNR struktūrą, paprastai yra konservuoti. Pirminė tRNR struktūra, nulemta nukleotidų sekos, sudaro antrinę tRNR struktūrą, kuri turi dobilo lapo formą. Savo ruožtu antrinė struktūra sukelia trimatę tretinę struktūrą, kuriai būdingas dviejų statmenų dvigubų spiralių susidarymas (3.27 pav.). Vieną jų sudaro akceptoriaus ir TψC šakos, kitą – antikodonas ir D šakos.
Vienos iš dvigubų spiralių gale yra pernešama aminorūgštis, kitos – antikodonas. Šios sritys yra labiausiai nutolusios viena nuo kitos. Tretinės tRNR struktūros stabilumas išlaikomas dėl papildomų vandenilio ryšių atsiradimo tarp polinukleotidinės grandinės bazių, esančių skirtingose jos dalyse, tačiau tretinėje struktūroje erdviškai arti.
Įvairių tipų tRNR turi panašią tretinę struktūrą, nors ir su tam tikrais variantais.
Ryžiai. 3.27. Erdvinė tRNR struktūra:
I – antrinė tRNR struktūra „dobilo lapo“ pavidalu, nulemta jos pirminės struktūros (grandinės nukleotidų sekos);
II - dvimatė tRNR tretinės struktūros projekcija;
III – tRNR molekulės išsidėstymas erdvėje
PRIEDAS (jei kas nors to nesupranta)
Žaibo dantys – nukleotidai (Adenine-Thymine / Uracil /, Guanine-Citazine). Visi žaibai yra DNR.

Norėdami perkelti informaciją iš DNR, turite sulaužyti 2 sruogas. Ryšys tarp A-T ir G-C yra vandenilis, todėl jį lengvai suardo Helicase fermentas:

Kad nesusidarytų mazgų (pavyzdžiui, susukau rankšluostį):



Topoizomerazė nupjauna vieną DNR grandinę replikacijos pradžioje, kad grandinė nesusisuktų.

Kai vienas sriegis yra laisvas, antrasis gali lengvai suktis aplink savo ašį, taip sumažindamas įtampą „atsivyniodamas“. Mazgai neatsiranda, taupoma energija.
Tada, norint pradėti rinkti RNR, reikalingas RNR pradmuo. Baltymas, kuris surenka mRNR, negali surinkti tik pirmojo nukleotido, jam pradėti reikia RNR gabalo (ten parašyta išsamiai, parašysiu vėliau). Šis gabalas vadinamas RNR pradmeniu. Ir šis baltymas jau pritvirtina prie jo pirmąjį nukleotidą.


Apibūdinant nukleorūgščių struktūrą, atsižvelgiama į skirtingus makromolekulių organizavimo lygius: pirminę ir antrinę struktūrą.
Pirminė nukleorūgščių struktūra yra nukleotidų sudėtis ir tam tikra nukleotidų seka polimero grandinėje.
Antrinė RNR struktūra. Ribonukleorūgšties molekulė yra sudaryta iš vienos polinukleotidinės grandinės.
Antrinė RNR struktūra
Atskiros RNR grandinės atkarpos sudaro spiralines kilpas – „plaukų segtukus“, dėl vandenilinių ryšių tarp komplementarių azoto bazių A-U ir G-C. RNR grandinės atkarpos tokiose spiralinėse struktūrose yra antilygiagrečios, bet ne visada visiškai viena kitą papildančios, jose yra nesuporuotų nukleotidų liekanų ar net vienos grandinės kilpų, kurios netelpa į dvigubą spiralę. Spiralizuotų sričių buvimas būdingas visų tipų RNR.
Pagrindinis RNR vaidmuo yra tiesioginis dalyvavimas baltymų biosintezėje.
Yra žinomi trys ląstelių RNR tipai, kurie skiriasi savo vieta ląstelėje, sudėtimi, dydžiu ir savybėmis, kurios lemia specifinį jų vaidmenį formuojant baltymų makromolekules:
- informacinės (matricos) RNR perduoda DNR užkoduotą informaciją apie baltymo struktūrą iš ląstelės branduolio į ribosomas, kuriose vyksta baltymų sintezė; visų mRNR pirminė struktūra, nepaisant jų kodavimo sekos unikalumo, turi tą pačią 5' ir 3' galų struktūrą.
Taigi, 5' gale yra modifikuotas nukleotidas 7-metilguanozin-5'-trifosfatas (dangtelis). Kelios dešimtys nukleotidų atskiria dangtelį nuo iniciacijos kodono, dažniausiai -AUG- tripleto. Po koduojančios srities eina vienas iš galinių kodonų -UGA-, -UUA-, -UAG-. Daugumos mRNR 3' gale yra 100-200 adenozino monofosfato liekanų nukleotidų seka.
- pernešančios RNR surenka aminorūgštis ląstelės citoplazmoje ir perneša jas į ribosomą; Šio tipo RNR molekulės iš atitinkamų pasiuntinio RNR grandinės atkarpų „sužinosi“, kurios aminorūgštys turi dalyvauti baltymų sintezėje.
Bet kurios tRNR erdvinė struktūra, nepaisant nukleotidų sekos skirtumų, aprašoma universaliu dobilo lapo modeliu. Kiekviena tRNR molekulė turi grandinės dalis, kurios nedalyvauja formuojant vandenilinius ryšius tarp nukleotidų liekanų.
Tai visų pirma vieta, atsakinga už prisijungimą prie aminorūgšties molekulės 3' gale ir antikodoną, specifinį nukleotidų tripletą, kuris sąveikauja komplementariai su mRNR kodonu.
- ribosominė RNR užtikrina tam tikros struktūros baltymų sintezę, informacijos nuskaitymą iš informacinės (matricos) RNR. rRNR sudaro kompleksus su baltymais, vadinamais ribosomomis.
Kiekviena ribosoma susideda iš dviejų subvienetų – mažo (40S) ir didelio (60S). Ribosomų subvienetai skiriasi ne tik rRNR rinkiniu, bet ir baltymų skaičiumi bei struktūra.
Paskelbimo data: 2015-02-03; Skaityta: 2729 | Puslapio autorių teisių pažeidimas

RNR yra polimeras, kurio monomerai yra ribonukleotidai.
Skirtingai nei DNR, RNR formuoja ne dvi, o viena polinukleotidų grandinė (išimtis – kai kurie RNR turintys virusai turi dvigrandę RNR). RNR nukleotidai gali sudaryti vandenilinius ryšius vienas su kitu. RNR grandinės yra daug trumpesnės nei DNR grandinės.
RNR monomeras – nukleotidas (ribonukleotidas) – susideda iš trijų medžiagų likučių: 1) azoto bazės, 2) penkių anglies monosacharido (pentozės) ir 3) fosforo rūgšties. Azotinės RNR bazės taip pat priklauso pirimidinų ir purinų klasėms.
RNR pirimidino bazės – uracilas, citozinas, purino bazės – adeninas ir guaninas.
31. RNR tipai ir jos sandaros ypatumai
RNR nukleotido monosacharidas pavaizduotas riboze.
Yra trys RNR tipai: 1) informacinė (matrica) RNR – mRNR (mRNR), 2) pernešanti RNR – tRNR, 3) ribosominė RNR – rRNR.
Visų tipų RNR yra neišsišakoję polinukleotidai, turi specifinę erdvinę konformaciją ir dalyvauja baltymų sintezės procesuose.
Informacija apie visų tipų RNR struktūrą yra saugoma DNR. RNR sintezės procesas DNR šablone paprastai vadinamas transkripcija.

Pernešančiosios RNR paprastai turi 76 (nuo 75 iki 95) nukleotidus; molekulinė masė - 25 000–30 000.
tRNR sudaro apie 10% viso RNR kiekio ląstelėje. tRNR funkcijos: 1) aminorūgščių pernešimas į baltymų sintezės vietą, į ribosomas, 2) transliacijos tarpininkas. Ląstelėje randama apie 40 tRNR tipų, kiekvienas iš jų turi tik jai būdingą nukleotidų seką. Tuo pačiu metu visos tRNR turi keletą intramolekulinių papildomų sričių, dėl kurių tRNR įgauna konformaciją, primenančią dobilo lapą.
Bet kuri tRNR turi kilpą kontaktui su ribosoma (1), antikodono kilpą (2), kilpą kontaktui su fermentu (3), akceptoriaus kamieną (4) ir antikodoną (5). Amino rūgštis yra prijungta prie akceptoriaus kamieno 3' galo. Antikodonas – trys nukleotidai, „atpažįstantys“ mRNR kodoną.
Reikėtų pabrėžti, kad tam tikra tRNR gali transportuoti griežtai apibrėžtą aminorūgštį, atitinkančią jos antikodoną. Aminorūgščių ir tRNR jungties specifiškumas pasiekiamas dėl fermento aminoacil-tRNR sintetazės savybių.
Ribosomų RNR yra 3000–5000 nukleotidų; molekulinė masė - 1 000 000-1 500 000.
rRNR sudaro 80–85% viso RNR kiekio ląstelėje. Komplekse su ribosomų baltymais rRNR sudaro ribosomas - organelius, kurie vykdo baltymų sintezę. Eukariotinėse ląstelėse rRNR sintezė vyksta branduolyje. rRNR funkcijos: 1) būtinas ribosomų struktūrinis komponentas, taigi, užtikrinantis ribosomų funkcionavimą; 2) ribosomos ir tRNR sąveikos užtikrinimas; 3) pradinis ribosomos ir iRNR iniciatoriaus kodono surišimas ir skaitymo rėmo nustatymas, 4) ribosomos aktyvaus centro susidarymas.
Messenger RNR skiriasi nukleotidų kiekiu ir molekuline svoriu (nuo 50 000 iki 4 000 000).
MRNR dalis sudaro iki 5% viso RNR kiekio ląstelėje. iRNR funkcijos: 1) genetinės informacijos perkėlimas iš DNR į ribosomas, 2) matrica baltymo molekulės sintezei, 3) baltymo molekulės pirminės struktūros aminorūgščių sekos nustatymas.
Taip pat skaitykite
RNR yra polimeras, kurio monomerai yra nukleotidai.
Trys azotinės bazės yra tokios pačios kaip ir DNR (adeninas, guaninas, citozinas); ketvirtasis – uracilas – yra RNR molekulėje vietoj timino. RNR nukleotiduose vietoj dezoksiribozės yra ribozės. RNR grandinėje...
trys pagrindiniai RNR tipai: informaciniai(mRNR), arba matrica(mRNR), ribosominės(rRNR) ir transporto(tRNR). Jie skiriasi molekuliniu dydžiu ir funkcija. Visų tipų RNR sintetinama DNR, dalyvaujant fermentams - RNR polimerazėms. Messenger RNR sudaro 2-3% visos ląstelių RNR, ribosominė - 80-85, transportinė - apie 15%.
mRNR.
jis nuskaito paveldimą informaciją iš DNR segmento ir nukopijuotos azotinių bazių sekos pavidalu perduoda ją į ribosomas, kuriose sintetinamas tam tikras baltymas. Kiekviena mRNR molekulė nukleotidų tvarka ir dydžiu atitinka DNR geną, iš kurio ji buvo transkribuota. Vidutiniškai mRNR yra 1500 nukleotidų (75-3000). Kiekvienas tripletas (trys nukleotidai) ant mRNR vadinamas kodonu. Nuo kodono priklauso, kokia aminorūgštis tam tikroje vietoje atsiras baltymų sintezės metu.
(tRNR) turi palyginti mažą molekulinę masę – apie 24-29 tūkst.
D ir molekulėje yra nuo 75 iki 90 nukleotidų. Iki 10% visų tRNR nukleotidų yra smulkios bazės, kurios, matyt, apsaugo ją nuo hidrolizinių fermentų veikimo, tRNR vaidmuo yra tas, kad jie perneša aminorūgštis į ribosomas ir dalyvauja baltymų sintezės procese. Kiekviena aminorūgštis prisijungia prie konkrečios tRNR. Daugybė aminorūgščių turi daugiau nei vieną tRNR. Iki šiol buvo atrasta daugiau nei 60 tRNR, kurios skiriasi savo pirmine struktūra (bazine seka).
Visų tRNR antrinė struktūra pateikiama kaip dobilo lapas su dvisriegiu stiebu ir trimis viengrandžiais). Vienos iš grandinių gale yra akceptoriaus vieta – CCA tripletas, prie kurio adenino yra prijungta specifinė aminorūgštis.
(rRNR). Juose yra 120-3100 nukleotidų. Ribosominė RNR kaupiasi branduolyje, branduoliuose.
Ribosominiai baltymai iš citoplazmos yra pernešami į branduolį, o ten spontaniškai susidaro ribosomų dalelės, jungiantis baltymams su atitinkama rRNR. Ribosomos dalelės kartu arba atskirai per branduolinės membranos poras pernešamos į citoplazmą. Ribosomos yra 20-30 nm dydžio organelės.
Jie yra pagaminti iš dviejų skirtingų dydžių ir formų dalelių. Tam tikrose baltymų sintezės ląstelėje stadijose ribosomos yra suskirstytos į daleles.
Ribosominė RNR tarnauja kaip ribosomų karkasas ir palengvina pradinį mRNR prisijungimą prie ribosomos baltymų biosintezės metu.
6 klausimas Ryšiai, sudarantys pirminę ir antrinę DNR ir RNR struktūras. RNR tipai
Genetinis kodas yra būdas koduoti baltymų aminorūgščių seką, naudojant nukleotidų seką, būdingą visiems gyviems organizmams.
Savybės: 1) genetinis kodas trynukas(kiekvieną aminorūgštį koduoja trys nukleotidai); 2) nesutampa(kaimyniniai trynukai neturi bendrų nukleotidų); 3) išsigimęs(išskyrus metioniną ir triptofaną, visos aminorūgštys turi daugiau nei vieną kodoną); 4) Universalus(dažniausiai vienodai visiems gyviems organizmams); 5) vienos aminorūgšties kodonuose pirmieji du nukleotidai dažniausiai yra vienodi, o trečiasis skiriasi; 6) turi linijinę skaitymo tvarką ir pasižymi kolineariškumas, t.
e) mRNR kodonų eilės sutapimas su aminorūgščių eiliškumu susintetintoje polipeptidinėje grandinėje.
Paskelbimo data: 2014-12-08; Skaityti: 11268 | Puslapio autorių teisių pažeidimas
studopedia.org - Studopedia.Org - 2014-2018. (0,001 s) ...
Ląstelių citoplazmoje yra trys pagrindiniai funkciniai RNR tipai:
- pasiuntinio RNR (mRNR), kurios veikia kaip baltymų sintezės šablonai;
- ribosominė RNR (rRNR), veikianti kaip ribosomų struktūriniai komponentai;
- perkelia RNR (tRNR), dalyvaujančias iRNR informacijos vertime (vertimu) į baltymo molekulės aminorūgščių seką.
Ląstelių branduolyje randama branduolinė RNR, kuri sudaro nuo 4 iki 10% visos ląstelės RNR.
Didžiąją branduolinės RNR dalį sudaro didelės molekulinės ribosominės ir pernešančios RNR pirmtakai. Didelės molekulinės masės rRNR pirmtakai (28 S, 18 S ir 5 S RNR) daugiausia yra lokalizuoti branduolyje.
RNR yra pagrindinė kai kurių gyvūnų ir augalų virusų genetinė medžiaga (genominė RNR). Daugumai RNR virusų būdinga atvirkštinė jų RNR genomo transkripcija, nukreipta atvirkštinės transkriptazės.
Visos ribonukleorūgštys yra ribonukleotidų polimerai, sujungti, kaip ir DNR molekulėje, 3′,5′-fosforodiesterio jungtimis.
Skirtingai nuo DNR, kurios struktūra yra dvigrandė, RNR yra viengrandė linijinė polimerinė molekulė.
mRNR struktūra. mRNR yra pati nevienalyčiausia RNR klasė pagal dydį ir stabilumą.
tRNR struktūra.
Transfer RNR veikia kaip tarpininkai (adapteriai) mRNR transliacijos metu. Jie sudaro maždaug 15% visos ląstelių RNR. Kiekviena iš 20 proteinogeninių aminorūgščių turi savo tRNR. Kai kurioms aminorūgštims, kurias koduoja du ar daugiau kodonų, yra kelios tRNR.
tRNR yra santykinai mažos vienagrandės molekulės, susidedančios iš 70–93 nukleotidų. Jų molekulinė masė yra (2,4-3,1) ,104 kDa.
Antrinė tRNR struktūra susidaro dėl to, kad susidaro didžiausias vandenilinių jungčių skaičius tarp intramolekulinių komplementarių azotinių bazių porų.
Dėl šių ryšių susidarymo tRNR polinukleotidų grandinė susisuka ir susidaro spiralizuotos šakos, kurios baigiasi nesuporuotų nukleotidų kilpomis. Visų tRNR antrinių struktūrų erdvinis vaizdas yra dobilo lapo formos.
„Dobilelapyje“ išskiriamos keturios privalomos šakos, ilgesnės tRNR, be to, turi trumpą penktąją (papildomą) šaką.
tRNR adapterio funkciją atlieka akceptoriaus šaka, prie kurios 3' galo eterio jungtimi yra prijungta aminorūgšties liekana, ir priešinga akceptoriaus šakai esanti antikodono šaka, kurios viršuje yra kilpa, kurioje yra antikodonas.
Antikodonas yra specifinis nukleotidų tripletas, kuris yra komplementarus antiparaleline kryptimi mRNR kodonui, koduojančiam atitinkamą aminorūgštį.
T-šaka, turinti pseudouridino kilpą (TyC-kilpa), užtikrina tRNR sąveiką su ribosomomis.
D-šaka, turinti dehidrouridino kilpą, užtikrina tRNR sąveiką su atitinkama aminoacil-tRNR sintetaze.

Antrinė tRNR struktūra
Penktosios papildomos šakos funkcijos vis dar menkai suprantamos, greičiausiai ji sulygina skirtingų tRNR molekulių ilgį.
Tretinė tRNR struktūra yra labai kompaktiška ir susidaro dėl papildomų vandenilinių ryšių sujungiant atskiras dobilo lapo šakas, kad susidarytų L formos „alkūnės lenkimo“ struktūra.
Transporto RNR, struktūra ir funkcinis mechanizmas.
Šiuo atveju aminorūgštį surišanti akceptoriaus ranka yra viename molekulės gale, o antikodonas – kitame.

Tretinė tRNR struktūra (pagal A.S. Spirin)
RRNR ir ribosomų struktūra. Ribosominės RNR sudaro pagrindą, prie kurio jungiasi specifiniai baltymai, sudarydami ribosomas. Ribosomos yra nukleoproteinų organelės, užtikrinančios baltymų sintezę iš mRNR.
Ribosomų skaičius ląstelėje yra labai didelis: nuo 104 prokariotuose iki 106 eukariotuose. Ribosomos yra lokalizuotos daugiausia citoplazmoje, eukariotuose, be to, branduolyje, mitochondrijų matricoje ir chloroplastų stromoje. Ribosomos susideda iš dviejų dalelių: didelių ir mažų. Pagal dydį ir molekulinę masę visos tirtos ribosomos suskirstytos į 3 grupes – prokariotų 70S ribosomas (S-sedimentacijos koeficientas), susidedančias iš mažų 30S ir didelių 50S subdalelių; 80S eukariotinės ribosomos, susidedančios iš 40S mažų ir 60S didelių subvienetų.
Nedidelį 80S ribosomų subvienetą sudaro viena rRNR molekulė (18S) ir 33 įvairių baltymų molekulės.
Didelį subvienetą sudaro trys rRNR molekulės (5S, 5,8S ir 28S) ir maždaug 50 baltymų.
Antrinė rRNR struktūra susidaro dėl trumpų dvigrandžių molekulės atkarpų – plaukų segtukų (apie 2/3 rRNR), 1/3 – atstovauja viengrandžiai, kuriuose gausu purino nukleotidų.
Socialiniai mygtukai, skirti Joomla
Baltymai sudaro gyvybės pagrindą. Jų funkcijos ląstelėje yra labai įvairios. Tačiau baltymai „negali“ daugintis. O visa informacija apie baltymų struktūrą yra genuose (DNR).
Aukštesniuose organizmuose baltymai sintetinami ląstelės citoplazmoje, o DNR yra paslėpta už branduolio apvalkalo. Todėl DNR negali būti tiesiogiai naudojamas kaip baltymų sintezės šablonas. Šį vaidmenį atlieka kita nukleorūgštis – RNR.
RNR molekulė yra išsišakojęs polinukleotidas, turintis tretinę struktūrą.
Jį sudaro viena polinukleotidų grandinė, ir nors joje esantys papildomi nukleotidai taip pat gali sudaryti vandenilinius ryšius tarpusavyje, šie ryšiai atsiranda tarp vienos grandinės nukleotidų. RNR grandinės yra daug trumpesnės nei DNR grandinės. Jei DNR kiekis ląstelėje yra gana pastovus, tai RNR kiekis labai svyruoja. Didžiausias RNR kiekis ląstelėse stebimas baltymų sintezės metu.
RNR vaidina svarbų vaidmenį perduodant ir įgyvendinant paveldimą informaciją.
Pagal funkciją ir struktūrines ypatybes išskiriamos kelios ląstelinės RNR klasės.
Yra trys pagrindinės ląstelių RNR klasės.
- Informacinė (mRNR) arba matrica (mRNR). Jo molekulės yra pačios įvairiausios pagal dydį, molekulinę masę (nuo 0,05x106 iki 4x106) ir stabilumą.
Jie sudaro apie 2% viso RNR kiekio ląstelėje. Visos mRNR yra genetinės informacijos nešėjai iš branduolio į citoplazmą, į baltymų sintezės vietą. Jie tarnauja kaip matrica (darbinis brėžinys) baltymo molekulės sintezei, nes nustato baltymo molekulės aminorūgščių seką (pirminę struktūrą).

- Ribosominė RNR (rRNR).
Jie sudaro 80–85% viso RNR kiekio ląstelėje.
31. RNR sandara. RNR tipai, struktūriniai ypatumai ir funkcijos. Antrinė tRNR struktūra
Ribosominė RNR susideda iš 3–5 tūkstančių nukleotidų. Jis sintetinamas branduolio branduoliuose. Komplekse su ribosomų baltymais rRNR sudaro ribosomas – organelius, ant kurių kaupiasi baltymų molekulės. Pagrindinė rRNR reikšmė yra ta, kad ji suteikia pirminį mRNR ir ribosomos surišimą ir sudaro aktyvųjį ribosomos centrą, kuriame polipeptidinės grandinės sintezės metu tarp aminorūgščių susidaro peptidiniai ryšiai.
- Perneškite RNR (tRNR).
tRNR molekulėse paprastai yra 75-86 nukleotidai. tRNR molekulių molekulinė masė yra apie 25 tūkst.. tRNR molekulės atlieka baltymų biosintezės tarpininkų vaidmenį – tiekia aminorūgštis į baltymų sintezės vietą, tai yra į ribosomas. Ląstelėje yra daugiau nei 30 tipų tRNR. Kiekvienas tRNR tipas turi savo unikalią nukleotidų seką.
Tačiau visos molekulės turi keletą intramolekulinių papildomų sričių, dėl kurių visos tRNR turi tretinę struktūrą, savo forma primenančią dobilo lapą.
Antrinė RNR struktūra– būdinga tRNR, vienagrandė, „dobilo lapelio“ formos.
Apima:
- santykinai trumpos dvigubos spiralės - stiebai,
- vienos grandinės sekcijos - kilpos.
Yra 4 stiebai (akceptorius, antikodonas, dihidrouridilas, pseudouridilas) ir 3 kilpos.

„Stem-kilpa“ – schematiškai RNR antrinės struktūros elementas

„Pseudoknot“ – schematiškai RNR antrinės struktūros elementas

Akceptoriaus kamiene yra polinukleotidinės grandinės 3' ir 5' galai, 5' galai su guanilo rūgšties liekana, 3' galas yra CCA tripletas ir sudaro esterio ryšį su AA.
Antikodono kamienas atpažįsta savo kodoną mRNR ribosomose pagal komplementarumo principą.
Pseudouridilo stiebas prisitvirtina prie ribosomos.
Dihidrouridilo stiebas jungiasi prie aminoacil-tRNR sintetazės.
Socialiniai mygtukai, skirti Joomla





