Mi a vérlemezke-aggregáció gátlása? A vaszkuláris thrombocyta hemosztázist befolyásoló gyógyszerek A thrombocyta aggregációt ca2-blokkoló gátolja
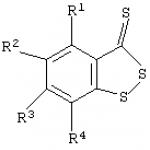
A találmány fiziológiára, farmakológiára és orvosi kémiára vonatkozik, különös tekintettel a vérlemezke-aggregáció gátlására szolgáló javított eljárásra. Ezt a célt a thrombocytaaggregáció gátlásának ismertetett továbbfejlesztett módszerével érik el kéntartalmú heterociklusos vegyületek alkalmazásával, amely abból áll, hogy az ismert benzo-1,2-ditiol-3-tiont (BDTT) vagy általános képletû származékait kéntartalmúként használjuk. heterociklusos vegyületek
 ahol R1-R4=H vagy 1-4 szénatomos alkilcsoport. Technikai eredmény: lehetővé teszi a vérlemezke-aggregáció hatékonyabb gátlását in vitro. A találmány tárgya a fiziológia, a farmakológia és a gyógyászati kémia, különösen a vérlemezke-aggregáció gátlásának továbbfejlesztett módszere kulcsszerepe számos szív- és érrendszeri betegség (pl. artériás trombózis, szívinfarktus, instabil angina) patogenezisében. Az endogén induktorok (például adenozin-5'-difoszfát/ADP) által előidézett vérlemezke-aktivációt megakadályozó vegyületeket jelenleg széles körben alkalmazzák a hemosztatikus rendszer kóros elváltozásainak hatékony befolyásolására (B. A. Sidorenko, D. .V. Preobrazhensky Az antitrombotikus gyógyszerek klinikai alkalmazása – M., 1998). vérlemezke-aggregáció (I) általános képletű ,5,6,7-tetrahidrotienopiridin (tiklopidin).
ahol R1-R4=H vagy 1-4 szénatomos alkilcsoport. Technikai eredmény: lehetővé teszi a vérlemezke-aggregáció hatékonyabb gátlását in vitro. A találmány tárgya a fiziológia, a farmakológia és a gyógyászati kémia, különösen a vérlemezke-aggregáció gátlásának továbbfejlesztett módszere kulcsszerepe számos szív- és érrendszeri betegség (pl. artériás trombózis, szívinfarktus, instabil angina) patogenezisében. Az endogén induktorok (például adenozin-5'-difoszfát/ADP) által előidézett vérlemezke-aktivációt megakadályozó vegyületeket jelenleg széles körben alkalmazzák a hemosztatikus rendszer kóros elváltozásainak hatékony befolyásolására (B. A. Sidorenko, D. .V. Preobrazhensky Az antitrombotikus gyógyszerek klinikai alkalmazása – M., 1998). vérlemezke-aggregáció (I) általános képletű ,5,6,7-tetrahidrotienopiridin (tiklopidin).  a thrombocyta P 2T ADP receptorok antagonistája (US 4963559 számú szabadalom, cl. 514-301, op. 1990). Azt is kimutatták, hogy a kalciumcsatorna-blokkoló a D-cisz-3-acetoxi-2,3-. (II) képletű dihidro-5-2-(2-metoxi-fenil)-1,5-benzotiazepin-4(5H)-on-hidroklorid (diltiazem)
a thrombocyta P 2T ADP receptorok antagonistája (US 4963559 számú szabadalom, cl. 514-301, op. 1990). Azt is kimutatták, hogy a kalciumcsatorna-blokkoló a D-cisz-3-acetoxi-2,3-. (II) képletű dihidro-5-2-(2-metoxi-fenil)-1,5-benzotiazepin-4(5H)-on-hidroklorid (diltiazem)  antitrombotikus hatással rendelkezik (A.R.Dehpour, T.Samadian et al. „Effects of diltiazem and verapamil on ADP-induced nyúl thrombocyta alakváltozás és aggregáció” Gen. Pharmacol, 1995, v.26, No. 6, p.1295-1299 A fenti vegyületek in vitro gátolták az ADP által okozott vérlemezke-aggregációt >300 μM koncentrációban benzo-1,2-ditiol-3-tion (BDTT) és származékai (III. általános képlet).
antitrombotikus hatással rendelkezik (A.R.Dehpour, T.Samadian et al. „Effects of diltiazem and verapamil on ADP-induced nyúl thrombocyta alakváltozás és aggregáció” Gen. Pharmacol, 1995, v.26, No. 6, p.1295-1299 A fenti vegyületek in vitro gátolták az ADP által okozott vérlemezke-aggregációt >300 μM koncentrációban benzo-1,2-ditiol-3-tion (BDTT) és származékai (III. általános képlet).  ahol R1R4 = H vagy 1-6 szénatomos alkilcsoport, benzoilcsoport, (szubsztituált) aminoszulfonilcsoport stb., mint szerves szintézis termékei (0043936. számú európai szabadalom, op. 1981). thrombocyta aggregációt nem vizsgáltak .A leírtakhoz legközelebb az az ismert módszer áll, hogy ezeket a sejteket tartalmazó táptalajba kéntartalmú heterociklusos vegyületeket - szubsztituált 3,4-dihidro-1,2-ditiin-2 -t juttatnak. Ez a módszer különösen a (IV) általános képletű 3,4-dihidro-3-vinil-1,2-ditiin-2-oxid alkalmazásával csökkentette a vérlemezkék aggregációját.
ahol R1R4 = H vagy 1-6 szénatomos alkilcsoport, benzoilcsoport, (szubsztituált) aminoszulfonilcsoport stb., mint szerves szintézis termékei (0043936. számú európai szabadalom, op. 1981). thrombocyta aggregációt nem vizsgáltak .A leírtakhoz legközelebb az az ismert módszer áll, hogy ezeket a sejteket tartalmazó táptalajba kéntartalmú heterociklusos vegyületeket - szubsztituált 3,4-dihidro-1,2-ditiin-2 -t juttatnak. Ez a módszer különösen a (IV) általános képletű 3,4-dihidro-3-vinil-1,2-ditiin-2-oxid alkalmazásával csökkentette a vérlemezkék aggregációját.  viszonylag magas koncentrációban (például egy adott vegyület in vitro körülmények között, IC 50 = 100 μM) (02204487 japán szabadalom, C 07 D 339/08, op. 1991, Chem. Abstr., 1991, v. 114, 6523s - prototípus. A találmány célja egy hatékonyabb módszer kifejlesztése a vérlemezke-aggregáció gátlására. azzal jellemezve, hogy ismert BDTT-t vagy a fenti (III) általános képletű származékait, ahol R1-R4 a megadott értékekkel rendelkezik. - vagy o-bróm-benzil-klorid vagy -bromid kénnel 50-200 °C hőmérsékleten glikol-monoalkil-éterben alkálifém-alkoxid jelenlétében. A leírt találmányt az alábbi példákkal szemléltetjük aggregáció a BDTT és származékai hatására A találmány szerinti termékek humán vérlemezke-aggregációra gyakorolt hatását a jól ismert Born turbidimetriás módszerrel vizsgáltuk. Ehhez az egészséges donoroktól reggel 8 órakor vett vénás vért 450 g-vel szobahőmérsékleten, műanyag edényben 10 percig centrifugáltuk, véralvadásgátlóként nátrium-citrátot használva. A felülúszót, azaz a vérlemezkében gazdag plazmát összegyűjtöttük, és 650 g-vel 30 percig centrifugáltuk, hogy vérlemezkékben szegény plazmát kapjunk. A vérlemezkében dús plazmában a vérlemezkék koncentrációját 2,510 8 sejt/ml-re állítottuk be vérlemezkékben szegény plazmával történő hígítással, és a kapott szuszpenziót 0,5 ml-es küvettába öntöttük. Az aggregációt 20 μM koncentrációjú ADP hozzáadásával váltottuk ki. Az ADP koncentrációját minden kísérletben úgy választottuk meg, hogy az aggregáció reverzibilis legyen, és a maximum az ADP hozzáadása után 2 perccel következett be, nem haladva meg az 50%-ot. A vérlemezke-szuszpenzió fényszóródását a Moszkvai Állami Egyetem Biológiai Karán kifejlesztett aggregométerrel mértük. M.V. Lomonoszov. A vizsgált vegyületet (szükség esetén 0,2%-ig DMSO-t tartalmazó vizes oldat formájában) adtuk a mintához, mielőtt hozzáadtuk az aggregációt indukáló anyagot (ADP). μM gátolta a 20 μM ADP által okozott thrombocyta aggregációt, míg a hatásos hatás koncentrációnál volt megfigyelhető<30 мкМ. В частности, значение концентрации, при которой достигалось полумаксимальное ингибирование, (IC 50) для БДТТ составляло 6,4 мкМ. Согласно данным прототипа, для известного аналога (3,4-дигидро-3-винил-1,2-дитиин-2-оксида) в условиях in vitro IC 50 имела значение 100 мкМ.Пример 2. Острая токсичность БДТТ и его производных.Острую токсичность соединений настоящего изобретения определяли известным способом по ЛД 50 с использованием беспородных мышей обоего пола средней массой 21 г при комнатной температуре; стандартное питание и воду давали ad libitum в течение всего эксперимента; подвижность животных не ограничивали. Растворы соединений в ДМСО вводили с помощью стерильного шприца внутрибрюшинно. После инъекции за животными вели наблюдение в течение 48 ч по истечении этого времени за мышами наблюдали дополнительно в течение 72 ч (ни одно из животных не погибло в течение дополнительного промежутка времени). Полученные результаты свидетельствуют о том, что значение ЛД 50 для БДТТ составляет >100 mg/kg, származékainál pedig legalább 50 mg/kg. Az 1. példában bemutatott adatok azt mutatják, hogy a leírt módszer az ismert módszerhez képest hatékonyabban teszi lehetővé a vérlemezke-aggregáció in vitro gátlását.
viszonylag magas koncentrációban (például egy adott vegyület in vitro körülmények között, IC 50 = 100 μM) (02204487 japán szabadalom, C 07 D 339/08, op. 1991, Chem. Abstr., 1991, v. 114, 6523s - prototípus. A találmány célja egy hatékonyabb módszer kifejlesztése a vérlemezke-aggregáció gátlására. azzal jellemezve, hogy ismert BDTT-t vagy a fenti (III) általános képletű származékait, ahol R1-R4 a megadott értékekkel rendelkezik. - vagy o-bróm-benzil-klorid vagy -bromid kénnel 50-200 °C hőmérsékleten glikol-monoalkil-éterben alkálifém-alkoxid jelenlétében. A leírt találmányt az alábbi példákkal szemléltetjük aggregáció a BDTT és származékai hatására A találmány szerinti termékek humán vérlemezke-aggregációra gyakorolt hatását a jól ismert Born turbidimetriás módszerrel vizsgáltuk. Ehhez az egészséges donoroktól reggel 8 órakor vett vénás vért 450 g-vel szobahőmérsékleten, műanyag edényben 10 percig centrifugáltuk, véralvadásgátlóként nátrium-citrátot használva. A felülúszót, azaz a vérlemezkében gazdag plazmát összegyűjtöttük, és 650 g-vel 30 percig centrifugáltuk, hogy vérlemezkékben szegény plazmát kapjunk. A vérlemezkében dús plazmában a vérlemezkék koncentrációját 2,510 8 sejt/ml-re állítottuk be vérlemezkékben szegény plazmával történő hígítással, és a kapott szuszpenziót 0,5 ml-es küvettába öntöttük. Az aggregációt 20 μM koncentrációjú ADP hozzáadásával váltottuk ki. Az ADP koncentrációját minden kísérletben úgy választottuk meg, hogy az aggregáció reverzibilis legyen, és a maximum az ADP hozzáadása után 2 perccel következett be, nem haladva meg az 50%-ot. A vérlemezke-szuszpenzió fényszóródását a Moszkvai Állami Egyetem Biológiai Karán kifejlesztett aggregométerrel mértük. M.V. Lomonoszov. A vizsgált vegyületet (szükség esetén 0,2%-ig DMSO-t tartalmazó vizes oldat formájában) adtuk a mintához, mielőtt hozzáadtuk az aggregációt indukáló anyagot (ADP). μM gátolta a 20 μM ADP által okozott thrombocyta aggregációt, míg a hatásos hatás koncentrációnál volt megfigyelhető<30 мкМ. В частности, значение концентрации, при которой достигалось полумаксимальное ингибирование, (IC 50) для БДТТ составляло 6,4 мкМ. Согласно данным прототипа, для известного аналога (3,4-дигидро-3-винил-1,2-дитиин-2-оксида) в условиях in vitro IC 50 имела значение 100 мкМ.Пример 2. Острая токсичность БДТТ и его производных.Острую токсичность соединений настоящего изобретения определяли известным способом по ЛД 50 с использованием беспородных мышей обоего пола средней массой 21 г при комнатной температуре; стандартное питание и воду давали ad libitum в течение всего эксперимента; подвижность животных не ограничивали. Растворы соединений в ДМСО вводили с помощью стерильного шприца внутрибрюшинно. После инъекции за животными вели наблюдение в течение 48 ч по истечении этого времени за мышами наблюдали дополнительно в течение 72 ч (ни одно из животных не погибло в течение дополнительного промежутка времени). Полученные результаты свидетельствуют о том, что значение ЛД 50 для БДТТ составляет >100 mg/kg, származékainál pedig legalább 50 mg/kg. Az 1. példában bemutatott adatok azt mutatják, hogy a leírt módszer az ismert módszerhez képest hatékonyabban teszi lehetővé a vérlemezke-aggregáció in vitro gátlását.
Követelés
1. Eljárás vérlemezke-aggregáció gátlására kéntartalmú heterociklusos vegyületeknek ezeket a sejteket tartalmazó tápközegbe való bejuttatásával, azzal jellemezve, hogy a benzo-1,2-ditiol-3-tiont és általános képletű származékait kéntartalmú heterociklusos vegyületekként alkalmazzák.  ahol R1-R4 jelentése hidrogénatom vagy 1-4 szénatomos alkilcsoport.
ahol R1-R4 jelentése hidrogénatom vagy 1-4 szénatomos alkilcsoport.
Hasonló szabadalmak:
A találmány szerves kémiára és farmakológiára vonatkozik, nevezetesen a 2-ecetsav káliumsójának izomereinek 1:3 mólarányú keverékére, amely kardiotonikus aktivitást mutat.
A hemosztázis rendszer a következő fő funkciókat látja el a szervezetben:
Folyékony állapotban tartja a vért az edényekben, ami szükséges a szervek és szövetek normál vérellátásához;
Vérzésmegállítást biztosít az érfal károsodása esetén.
A vérzés megállítása (hemosztázis - görögül hemo- vér, sztázis- stop) több mechanizmus részvételével valósul meg. Az érfal károsodása után érgörcs lép fel. Ez a sérülésre adott azonnali válasz csak akkor állíthatja meg a vérzést, ha a kis érsérülések kisebbek. A vérzés megállítását alapvetően vérrögök képződésével érik el, amelyek a sérülés helyének lezárásával megakadályozzák a vérveszteséget. Az ilyen lokális vérrögképződés (hemosztatikus dugó) érkárosodás esetén védőreakció.
Bizonyos körülmények között azonban vérrögök képződnek az erek belsejében, bezárják lumenüket és megakadályozzák a normális véráramlást. Az intravaszkuláris thrombus képződés a vaszkuláris endotélium kóros elváltozásaival fordulhat elő, beleértve annak érelmeszesedéssel, megnövekedett vérnyomással vagy más tényezőkkel összefüggő károsodását. A vérrögképződés oka lehet a véráramlás kóros változása (például sebességének csökkenése) vagy bizonyos fehérjék hiánya, amelyek megakadályozzák a vérrögképződést.
A trombózis két fő folyamat részvételével következik be: a vérlemezke-aggregáció és a véralvadás (hemocoaguláció).
Thrombocyta-aggregáció - ez a vérlemezkék különböző méretű és sűrűségű konglomerátumokká (aggregátumokká) való kombinációja. Ez a folyamat akkor indul be, ha az érfal megsérül. A sérülés helyén a vérlemezkék először a von Willebrand faktorhoz és a szubendoteliális réteg kollagénjéhez kötődnek (előfordul trombocita adhézió). A kollagénnel való kölcsönhatás vérlemezke-aktivációt okoz (27-1. ábra). Ebben az esetben maguk a vérlemezkék olyan anyagok forrásaivá válnak, amelyek serkentik az aggregációt, mint például a tromboxán A2, ADP,
szerotonin. A véralvadás során lokálisan képződő trombin szintén vérlemezke-aggregációt vált ki. Ezenkívül a katekolaminok, a vérlemezke-aktiváló faktor és néhány más endogén anyag aggregációt indukálnak.
A vérlemezke-aggregációt a prosztaciklin és az endothel relaxáló faktor akadályozza meg, amelyeket az ér endothel sejtjei termelnek és a véráramba juttatnak. Ha az endothelsejtek károsodnak, ezeknek az anyagoknak a szintézise csökken, és ennek hátterében az aggregációt serkentő anyagok hatása dominál. Ennek eredményeként a vérlemezkék aggregátumokká egyesülnek, amelyekből vérlemezke trombus képződik.
A thrombocyta trombus a folyamat során keletkező fibrinszálaknak köszönhetően erősebbé válik véralvadási. Ennek a folyamatnak a fő résztvevői a vérplazmafehérjék, az úgynevezett véralvadási faktorok.
A plazma koagulációs faktorok a májban szintetizálódnak, és inaktív formában keringenek a vérben. Ha az érfal károsodik, a VII-es faktor gyorsan aktiválódik a részvétellel szöveti faktor- transzmembrán fehérje, amelyet különböző sejtek (beleértve az aktivált endotélsejteket is) szintetizálnak, és általában nem érintkezik a vérrel. A szöveti faktor expressziója a sejtfelszínen az endothel károsodás során jelentősen felgyorsítja a VII-es faktor aktiválódását (a VIIa faktorrá való átalakulását) Ca 2+ -ionok jelenlétében. A VIIa faktor hatására (szöveti faktorral kombinálva) más véralvadási faktorok (IX és X) egymás utáni aktiválódása megy végbe a véralvadási kaszkádnak nevezett komplex autokatalitikus rendszerben. Ennek eredményeként a Xa faktor hatására trombin képződik (Ha faktor), amely a vérben keringő oldható protein fibrinogént (I. faktor) oldhatatlan fibrinné alakítja (27-5. ábra). A fibrin polimerizál, és kitölti a vérlemezkék közötti teret, erősíti a vérlemezkék trombusát. A fibrinszálak behatolnak a vérrögbe, és olyan hálózatot alkotnak, amely megfogja a vérben keringő vörösvérsejteket. Vörös vérrög képződik.
A véralvadást olyan anyagok ellensúlyozzák, amelyek az aktív véralvadási faktorok természetes gátlói.
Az X faktor VIIa faktor általi aktiválása megakadályozható szöveti faktor útvonal gátló, endothel szintetizálja
sejteket. A trombin és néhány más aktív véralvadási faktor (Xa, IXa, XIa, XIIa) inhibitora antitrombin III- a vérplazmában keringő fehérje, amely heparinnal vagy heparinszerű anyagokkal (az ép endotélsejtek felszínén jelenlévő) együtt hat. Ezek az anyagok nagymértékben felgyorsítják a véralvadási faktorok inaktiválását az antitrombin III hatására.
A trombin képződéséhez szükséges VIIIa és Va faktor gátlója - aktivált protein C. Ez a fehérje a májban szintetizálódik a K-vitamin részvételével, inaktív formában kering a vérben, és a trombin aktiválja az ép endoteliális sejtek felületén. A Protein C aktivációja fokozódik a túlzott trombinképződéssel. Amikor helyi vérrögök képződnek az érfal károsodásának helyén, a fenti inhibitorok segítenek fenntartani a vért folyékony állapotban, megakadályozva a vérrög kialakulását az érben.
A vérlemezke-aggregáció és a véralvadás egymással összefügg. Az egyik vagy másik folyamat túlsúlya a trombusképződés mechanizmusában az ér kaliberétől és a véráramlás sebességétől függ. A vérlemezkék aggregációja nagyobb jelentőséggel bír a vérrögképződés szempontjából nagy véráramlási sebesség mellett, pl. az artériákban. A vénás erekben, ahol a véráramlás sebessége alacsony, a véralvadási folyamat dominál.
A thrombus későbbi sorsa a fibrinolitikus rendszer aktivitásától függ. Ha ez a rendszer normálisan működik, a fibrin fokozatosan oldódik (fibrinolízis) a plazmin enzim részvételével, amely egy inaktív prekurzorból (plazminogénből) képződik aktivátorok hatására. A plazmin hatását a vérben keringő antiplazminek akadályozzák meg. A plazminogén aktivátorokat specifikus inhibitorok semlegesítik.
A vérlemezke-aggregációs és véralvadási folyamatok megzavarása és/vagy a fibrinolitikus rendszer fokozott aktivitása vérzéshez vezethet, ezen folyamatok túlzott aktiválódása vagy a fibrinolízis gátlása intravascularis vérrögök (trombózis) kialakulásához vezethet. Az artériás erek trombózisa következtében a szövetek véráramlása csökken, és ischaemia alakul ki. Az ischaemia következménye a sejthalál (nekrózis). A trombózis olyan súlyos szövődményeket okozhat, mint a szívizominfarktus (koszorúér-trombózis), az ischaemiás stroke (agyi vaszkuláris trombózis) stb. A vénás trombózis tüdőembóliát okozhat.
A trombózis megelőzésére olyan anyagokat alkalmaznak, amelyek gátolják a vérlemezke-aggregációt és a véralvadást, így megakadályozzák a vérrögképződést. A trombózishoz olyan anyagokat is használnak, amelyek a vérrögök lízisét okozzák - trombolitikus (fibrinolitikus) szerek.
A vérzés megállítására olyan szereket alkalmaznak, amelyek fokozzák a véralvadást és a fibrinolízist gátló szereket. Az egyik vagy másik kiválasztása a vérzés okától függ.
Gyakorlati jelentőséggel bírnak a következő gyógyszercsoportok, amelyek befolyásolják a trombusképződést.
A vérlemezke-aggregációt csökkentő szerek(thrombocyta-aggregáció gátló szerek).
A véralvadást befolyásoló gyógyszerek.
Véralvadást csökkentő gyógyszerek (antikoagulánsok).
Véralvadást fokozó gyógyszerek (vérzéscsillapítók).
A fibrinolízist befolyásoló szerek.
Fibrinolitikus (trombolitikus) szerek.
Antifibrinolitikus szerek (fibrinolízis-gátlók).
27.1. A TROMBOCITA AGGREGÁCIÓT CSÖKKENTŐ GYÓGYSZEREK (ANTI PLACECITÁK)
A vérlemezkék kicsi, korong alakú vérelemek, amelyek csontvelői megakariociták töredékeiként képződnek. A vérlemezkék 6-12 napig keringenek a vérben, majd a szöveti makrofágok felveszik őket.
A vaszkuláris endotélium befolyásolja a vérlemezkék funkcionális aktivitását. Az endothelsejtek prosztaciklint (prosztaglandin I 2) és endoteliális relaxációs faktort bocsátanak ki, amelyet nitrogén-monoxiddal (NO) azonosítanak a véráramba. Ezek az anyagok megakadályozzák a vérlemezke-aggregációt. Ezenkívül az endothel sejtek olyan anyagokat választanak ki, amelyek csökkentik a véralvadást és elősegítik a vérrög lízisét. Mindez biztosítja az ép vaszkuláris endotélium antitrombogén tulajdonságait.
A vaszkuláris endotélium károsodása esetén, amelyet különböző tényezők okozhatnak (mechanikai trauma, fertőzések, érfali atherosclerotikus elváltozások, megnövekedett vérnyomás stb.), az endotélium antitrombogén tulajdonságai csökkennek, ami megteremti a feltételeket a kialakulásához egy vérrögtől. A prosztaciklin és az endothel relaxáló faktor szintézise megszakad, és ez megkönnyíti az érintkezést
sérült endothel felületű vérlemezkék. A vérlemezkék felhalmozódnak a károsodás helyén, és kölcsönhatásba lépnek a vaszkuláris szubendoteliummal: közvetlenül vagy von Willebrand faktoron keresztül (aktivált vérlemezkék és endoteliális sejtek választják ki) a kollagénhez és a szubendotélium egyéb fehérjéihez kötődnek a vérlemezkében lokalizált specifikus glikoproteinek részvételével membrán. A von Willebrand faktor az Ib glikoproteinhez, a kollagén pedig a vérlemezkemembrán Ia glikoproteinjéhez kötődik (lásd 27-1. ábra). A kollagén (valamint a trombin, amely kis mennyiségben lokálisan már a trombusképződés kezdeti szakaszában képződik) vérlemezkékre gyakorolt hatása állapotváltozást - aktivációt okoz. A vérlemezkék megváltoztatják alakjukat (a korong alakúakból sok folyamattal szétterülnek - pszeudopodiák) és befedik az ér sérült felületét.
A vérlemezkék aktiválásakor különféle biológiailag aktív anyagokat bocsátanak ki, amelyek a nem aktivált vérlemezkékben granulátumban (α-granulátum, sűrű granulátum) helyezkednek el. A sűrű granulátumok olyan anyagok tárháza, amelyek serkentik a vérlemezke-aggregációt: ADP és szerotonin. Ezeknek az anyagoknak a felszabadulása a thrombocyta granulátumokból a Ca 2+ intracelluláris koncentrációjának növekedése következtében következik be, a kollagén, a trombin és más aggregációt indukáló szerek, köztük maga az ADP vérlemezkékre gyakorolt hatása miatt. A véráramba kerülő ADP stimulálja a vérlemezke membránjában lokalizált specifikus (purinerg) receptorokat. A G-protein-kapcsolt receptorokon (P2Y 12 purinerg receptorokon) keresztül az ADP az adenilát-cikláz gátlását és a cAMP-szint csökkenését okozza, ami a vérlemezkék citoplazmájában a Ca 2 -szint növekedéséhez vezet (27-2. ábra).
Ezen túlmenően, amikor a vérlemezkék aktiválódnak, megnő a vérlemezke membrán foszfolipáz A2 aktivitása, egy enzim, amely részt vesz az arachidonsav képződésében a membrán foszfolipidekből. A vérlemezkékben a ciklikus endoperoxidok (G2/H2 prosztaglandinok) először arachidonsavból szintetizálódnak ciklooxigenáz hatására, majd belőlük tromboxánezin közreműködésével.
A tetáz tromboxán A 2 -t termel, amely a vérlemezke-aggregáció aktív stimulátora és érösszehúzó. A véráramba kerülve a tromboxán A 2 stimulálja a trombocita membránokon lévő tromboxán receptorokat. Ennek eredményeként a C-n keresztül ezekhez a receptorokhoz kapcsolódik q -fehérjékben a foszfolipáz C aktiválódik és képződése
Rizs.27-1. A vérlemezkék adhéziója és aggregációja az érfal károsodása során: EC - endothel sejt; VW – von Willebrand faktor; TxA2 - tromboxán A2; PGI 2 - prosztaciklin; NO - endoteliális relaxációs faktor; GP - glikoproteinek; GP llb/llla – glikoproteinek llb/llla (Feladó: Katzung B.G. Bazic and Clinical Pharmacology – NY, 2001, a módosításokkal)
inozitol-1,4,5-trifoszfát, amely elősegíti a Ca 2+ felszabadulását a vérlemezkék intracelluláris depójából (a kalcium depó szerepét a vérlemezkékben sűrű tubulusok rendszere látja el). Ez a Ca 2+ citoplazmatikus koncentrációjának növekedéséhez vezet (27-2. ábra). A tromboxán A 2 a Ca 2+ koncentrációjának növekedését okozza a vaszkuláris simaizomsejtekben, ami érszűkülethez vezet.

Rizs. 27-2. Thrombocyta-aggregációt gátló szerek (acetilszalicilsav, tiklopidin és epoprosztenol) hatásmechanizmusai: EC - endothel sejt; PL - sejtmembránok foszfolipidei; AA - archidonsav; PLA 2 - foszfolipáz A2; COX - ciklooxigenáz; TS - tromboxán-szintetáz; PS - prosztaciklin szintetáz; PGG 2 /H 2 - ciklikus endoperoxidok; TxA2 - tromboxán A2; PGI 2 - prosztaciklin; AC - adenilát-cikláz; PLS - foszfolipáz C; IP 3 - inozitol-1, 4, 5-trifoszfát
Így az ADP és a tromboxán A 2 növeli a Ca 2+ szintjét a vérlemezkék citoplazmájában. A citoplazmatikus Ca 2+ megváltoztatja a IIb/IIIa glikoproteinek konformációját a vérlemezke membránjában, aminek eredményeként fibrinogénkötő képességre tesznek szert. Egy fibrinogén molekulának két kötőhelye van a IIb/IIIa glikoproteinekhez, és így képes egyesíteni két vérlemezkét (27-3. ábra). Számos vérlemezke fibrinogén hidak általi összekapcsolása vérlemezke-aggregátumok kialakulásához vezet.
A prosztaciklin (prosztaglandin I 2) ellenkező hatást fejt ki a vérlemezke-aggregációra. Mint a tromboxán, a prosztaciklin
ciklikus endoperoxidokból képződik, de egy másik enzim - a prosztaciklin szintetáz - hatására. A prosztaciklint az endothel sejtek szintetizálják és a véráramba juttatják, ahol stimulálja a vérlemezke membránjában lévő prosztaciklin receptorokat és a G s fehérjén keresztül a hozzájuk kapcsolódó adenilát ciklázt. Ennek eredményeként a cAMP szintje a vérlemezkékben növekszik és a citoplazmatikus Ca 2+ koncentrációja csökken (lásd 27-2. ábra). Ez megakadályozza, hogy a IIb/IIIa glikoproteinek konformációja megváltozzon, és elveszítsék fibrinogénkötő képességüket. Így a prosztaciklin megakadályozza a vérlemezke-aggregációt. A prosztaciklin hatására csökken a Ca 2+ koncentrációja a vaszkuláris simaizomsejtekben, ami értágulathoz vezet.

A thrombocyta-aggregációhoz vezető fő események alábbi sorozata különböztethető meg (lásd 27-1. ábra).
A klinikai gyakorlatban jelenleg használt thrombocyta-aggregáció gátló szerek hatásának fő fókusza a tromboxán A 2 és az ADP hatásának kiküszöbölésével, valamint a vérlemezkemembránok IIb/IIIa glikoproteinek blokkolásával kapcsolatos. Más hatásmechanizmusú anyagokat is alkalmaznak, amelyek növelik a cAMP koncentrációját a vérlemezkékben, és ezáltal csökkentik a Ca 2+ koncentrációját bennük.
A vérlemezke-aggregációt csökkentő szerek alábbi csoportjait különböztetjük meg.
A tromboxán A2 szintézisét gátló szerek. - Ciklooxigenáz inhibitorok:
acetilszalicilsav.

27.1. A vérlemezke-aggregáció mechanizmusa
Ciklooxigenáz és tromboxán szintetáz inhibitorok: indobufen.
A prosztaciklin receptorokat stimuláló szerek:
epoprosztenol**.
Az ADP vérlemezkékre gyakorolt hatását befolyásoló szerek:
tiklopidin; klopidogrél.
A vérlemezke-foszfodiészterázt gátló szerek:
dipiridamol
Olyan szerek, amelyek blokkolják a vérlemezke membránok IIb/IIIa glikoproteinekjét.
Monoklonális antitestek: abciximab.
A IIb/IIIa glikoproteinek szintetikus blokkolói: eptifibatid; tirofiban.
A tromboxán A szintézisét gátló szerek 2
Az acetilszalicilsav (aszpirin*) jól ismert gyulladáscsökkentő, fájdalomcsillapító és lázcsillapító szer. Jelenleg széles körben használják vérlemezke-gátló szerként. Az acetilszalicilsav thrombocyta-aggregáció-gátló hatása a trombocitákban a tromboxán A2 szintézisére kifejtett gátló hatásával függ össze.
Az acetilszalicilsav irreverzibilisen gátolja a ciklooxigenázt (az enzim irreverzibilis acetilezését okozza), és így megzavarja a ciklikus endoperoxidok, a tromboxán A2 prekurzorai és az arachidonsavból származó prosztaglandinok képződését. Ezért az acetilszalicilsav hatására nemcsak a trombociták tromboxán A 2 szintézise, hanem a prosztaciklin szintézise is csökken az ér endotél sejtjeiben (lásd 27-2. ábra). A megfelelő dózisok és kezelési rend megválasztásával azonban elérhető az acetilszalicilsavnak a tromboxán A 2 szintézisére gyakorolt előnyös hatása. Ennek oka a vérlemezkék és az endothelsejtek közötti jelentős különbségek.
A vérlemezkék – sejtmagvú sejtek – nem rendelkeznek fehérje-újraszintézis rendszerrel, ezért nem képesek ciklooxigenázt szintetizálni. Ezért ennek az enzimnek a visszafordíthatatlan gátlása esetén a tromboxán A2 szintézis zavara a vérlemezkék teljes élettartama alatt fennáll, azaz. 7-10 napon belül. Az új vérlemezkék képződése miatt az acetilszalicilsav thrombocyta-aggregáció gátló hatása rövidebb ideig tart, ezért a gyógyszer stabil hatásának (vagyis a tromboxánszint stabil csökkenése) elérése érdekében felírása javasolt. naponta egyszer.
A cikloxigenáz újraszintetizálódik a vaszkuláris endoteliális sejtekben, és ennek az enzimnek az aktivitása az acetilszalicilsav bevétele után néhány órán belül helyreáll. Ezért a gyógyszer napi egyszeri felírásakor nem csökken a prosztaciklin szintézis jelentős mértékben.

Ezenkívül az acetilszalicilsav körülbelül 30%-a a májban megy keresztül first-pass metabolizmuson, így koncentrációja a szisztémás keringésben alacsonyabb, mint a portális vérben. Ennek eredményeként az acetilszalicilsav nagyobb koncentrációban hat a portális véráramban keringő vérlemezkékre, mint a szisztémás erek endotélsejtjeire. Ezért a tromboxán A2 szintézisének elnyomásához a vérlemezkékben kisebb dózisú acetilszalicilsavra van szükség, mint a prosztaciklin szintézisének elnyomására az endotélsejtekben.
Ezen okok miatt az acetilszalicilsav dózisának és beadási gyakoriságának növelésével a prosztaciklin szintézisre gyakorolt gátló hatása kifejezettebbé válik, ami a vérlemezke-gátló hatás csökkenéséhez vezethet. Ezekkel a tulajdonságokkal összefüggésben az acetilszalicilsavat, mint thrombocyta-aggregációt gátló szert, kis adagokban (átlagosan 100 mg) ajánlott naponta egyszer felírni.
Az acetilszalicilsavat thrombocyta-aggregáció gátló szerként használják instabil angina kezelésére, szívinfarktus, ischaemiás stroke és perifériás erek trombózisának megelőzésére, vérrögképződés megelőzésére a koszorúér bypass és koszorúér angioplasztika során. Az acetilszalicilsavat szájon át 75-160 mg-os adagokban (bizonyos indikációk esetén - 50-325 mg dózistartományban) írják fel naponta egyszer hosszú ideig. Jelenleg az orvosok rendelkezésére állnak a trombózis megelőzésére szolgáló acetilszalicilsav készítmények, amelyek 50-325 mg hatóanyagot tartalmaznak, beleértve a bélben oldódó tablettákat - Acecardol *, Aspicor *, Cardiopyrin *, Aspirin Cardio *, Novandol *, Thrombo ACC * stb. Az acetilszalicilsav thrombocyta-aggregáció gátló hatása gyorsan (20-30 percen belül) jelentkezik. A bélben oldódó bevonatú gyógyszerformák lassabban kezdenek hatni, de hosszú távú használat esetén hatékonyságuk gyakorlatilag nem különbözik a hagyományos tablettákétól. A gyorsabb hatás elérése érdekében az acetilszalicilsav tablettákat meg kell rágni.
Az acetilszalicilsav fő mellékhatásai a ciklooxigenáz gátlásával kapcsolatosak. Ez megzavarja az E 2 és I 2 prosztaglandinok képződését, amelyek antiszekréciós és gyomorvédő hatásúak (csökkentik a gyomor parietális sejtjeinek sósav szekrécióját, növelik a nyálka és a bikarbonát szekrécióját). Ennek eredményeként az acetilszalicilsav még rövid ideig tartó használat esetén is károsíthatja a gyomor és a nyombél hámszövetét (ulcerogén hatás). A gyomor nyálkahártyájára gyakorolt hatás kevésbé kifejezett bélben oldódó bevonatú adagolási formák alkalmazásakor. Az acetilszalicilsav alkalmazásakor gyomor-bélrendszeri vérzés és egyéb vérzéses szövődmények lehetségesek. Az ilyen szövődmények kockázata kisebb, ha az acetilszalicilsavat 100 mg/nap vagy annál kisebb adagban írják fel. A COX szelektív gátlása az arachidonsav átalakulását és a hörgőösszehúzó tulajdonságokkal rendelkező leukotriének képződését szolgáló lipoxigenáz útvonal aktiválásához vezet. A bronchiális asztmában szenvedő betegeknél az acetilszalicilsav rohamot válthat ki („aszpirin asztma”). Allergiás reakciók lehetségesek.
Az acetilszalicilsav fekélyes hatásának csökkentésére javasolták a Cardiomagnyl* kombinációs gyógyszert, amely magnézium-hidroxidot tartalmaz. A magnézium-hidroxid semlegesíti a sósavat a gyomorban (antacid hatás), csökkentve a nyálkahártya károsító hatását. A gyógyszert ugyanazokra az indikációkra használják, mint az acetilszalicilsav, beleértve az ischaemiás stroke másodlagos megelőzését.
Az indobufen (ibusztrin *) csökkenti a tromboxán A 2 szintézisét, miközben egyidejűleg gátolja a ciklooxigenázt és a tromboxán szintetázt. Az acetilszalicilsavval ellentétben az indobufen a ciklooxigenáz reverzibilis gátlását okozza. A gyógyszer szedése során a prosztaciklin mennyisége relatíve megnő (a prosztaciklin/tromboxán A 2 arány növekszik). Az indobufen gátolja a vérlemezkék adhézióját és aggregációját. A használati javallatok és a mellékhatások ugyanazok, mint az acetilszalicilsav esetében.
A prosztaciklin receptorokat stimuláló szerek
A vérlemezke-aggregáció csökkentésének másik módja a prosztaciklin receptorok stimulálása. Erre a célra használnak
prosztaciklin készítmény e p o pro s t e n o l * . A prosztaciklin hatása ellentétes a tromboxán A 2 hatásával, nemcsak a vérlemezkékre, hanem az erek tónusára is. Vasodilatációt és vérnyomáscsökkenést okoz. A prosztaciklinnek ezt a hatását pulmonális hipertóniában alkalmazzák. Mivel a prosztaciklin gyorsan elpusztul a vérben (t 1/2 körülbelül 2 perc), és ezért nem hat sokáig, a gyógyszert infúzióban adják be. Rövid hatásának köszönhetően az epoprostenol* nem talált széles körben használatos thrombocyta-aggregációt gátló szerként. Az epoprosztenol thrombocyta-aggregációját gátló hatás egyik lehetséges felhasználási területe a vérlemezke-aggregáció megelőzése az extracorporalis keringés során.
Olyan szerek, amelyek megzavarják az ADP vérlemezkékre gyakorolt hatását
A tiklopidin (ticlid*), egy tienopiridin-származék, gátolja az ADP által okozott vérlemezke-aggregációt. A tiklopidin egy prodrug, amelynek vérlemezke-ellenes hatása a mikroszomális májenzimek részvételével aktív metabolit képződésével jár. A tiklopidin metabolitja tiolcsoportokat tartalmaz, amelyeken keresztül irreverzibilisen kötődik a vérlemezke membránjában található P2Y 12 purinerg receptorokhoz. Ez az ADP vérlemezkékre gyakorolt stimuláló hatásának megszűnéséhez és a citoplazmatikus Ca 2+ koncentrációjának csökkenéséhez vezet bennük. Ennek eredményeként csökken a IIb/IIIa glikoproteinek expressziója a vérlemezke membránjában és a fibrinogénhez való kötődésük (lásd 27-2. ábra). Hatásának visszafordíthatatlan jellege miatt a tiklopidin hosszan tartó thrombocyta-aggregáció gátló hatással rendelkezik.
A maximális hatás a tiklopidin állandó használatával 7-11 nap elteltével érhető el (az aktív metabolit kialakulásához és kifejlődéséhez szükséges idő), és a gyógyszer abbahagyása után a vérlemezkék teljes élettartama alatt fennmarad (7-10). napok).
A tiklopidint az ischaemiás stroke másodlagos megelőzésére, a trombózis megelőzésére az alsó végtagok obliteráló betegségeinél, a koszorúér bypass graftolás és a koszorúerek stentelése során írják fel. A gyógyszer hatásos szájon át szedve, naponta kétszer, étkezés közben.
A tiklopidin alkalmazása mellékhatásai miatt korlátozott. Lehetséges étvágytalanság, hányinger, hányás, hasmenés (20%), hasi fájdalom, bőrkiütések (11-14%). Neves
az aterogén lipoproteinek vérplazma szintjének emelkedése. A vérzés gyakori szövődmény a vérlemezke-gátló szerek alkalmazásakor. Veszélyes szövődmény a neutropenia, amely a kezelés első három hónapjában a betegek 1-2,4%-ánál jelentkezik. Thrombocytopenia, agranulocytosis és nagyon ritkán aplasztikus anémia lehetséges. Ebben a tekintetben a kezelés első hónapjaiban a vérkép szisztematikus monitorozása szükséges.
A klopidogrél (Plavix*, Zilt*) kémiai szerkezetében, főbb hatásaiban és hatásmechanizmusában hasonló a tiklopidinhez. A tiklopidinhez hasonlóan ez is egy prodrug, és a májban átalakul aktív metabolittá. A thrombocyta-aggregáció jelentős gátlását a kezelés második napjától észlelték, a maximális hatást 4-7 nap után érik el. A gyógyszer abbahagyása után hatása 7-10 napig tart. A klopidogrél aktivitása jobb, mint a tiklopidin – napi 75 mg-os adagban ugyanolyan csökkenést okoz a vérlemezke-aggregációban és meghosszabbítja a vérzési időt, mint a tiklopidin napi 500 mg-os adagban.

A klopidogrél ugyanazon indikációkra alkalmazható, mint az acetilszalicilsav, intolerancia esetén. Szájon át naponta 1 alkalommal, étkezéstől függetlenül. A klopidogrél kombinálható acetilszalicilsavval, mivel a gyógyszerek gátolják a vérlemezke-aggregáció különböző mechanizmusait, így fokozzák egymás hatását (azonban ezzel a kombinációval nagyobb a vérzéses szövődmények kockázata).
A tiklopidinnel összehasonlítva a klopidogrél mellékhatásai kevésbé kifejezettek (hasmenés - 4,5%, kiütés - 6%). A klopidogrél alkalmazása csökkenti az olyan súlyos szövődmények kockázatát, mint a neutropenia (0,1%), és a thrombocytopenia ritkábban fordul elő. Ritka szövődményként, csakúgy, mint a tiklopidin esetében, trombotikus thrombocytopeniás purpura alakulhat ki.
Thrombocyta foszfodiészteráz inhibitorok
A dipiridamolt (curantyl*, persantine*) először koszorúér-tágítóként javasolták. Később kiderült, hogy képes gátolni a vérlemezke-aggregációt. Jelenleg a dipiridamolt főként trombocita-gátló szerként használják trombózis megelőzésére. A dipiridamol thrombocyta-aggregáció-gátló hatása a vérlemezkék cAMP szintjének emelkedésével jár, aminek következtében a citoplazmatikus Ca 2+ koncentrációja csökken bennük. Ez több okból is előfordul. Először is, a dipiridamol gátolja a foszfodiészterázt, amely inaktiválja a cAMP-t. Ezenkívül a dipiridamol gátolja az endothelsejtek és eritrociták adenozin felvételét és metabolizmusát (gátolja az adenozin-deaminázt), ezáltal növeli az adenozin szintjét a vérben (27-4. ábra). Az adenozin stimulálja a thrombocyta A 2 receptorokat, és növeli az ezekhez a receptorokhoz kapcsolódó adenilát-cikláz aktivitását, ennek eredményeként nő a cAMP képződése a vérlemezkékben, és csökken a citoplazmatikus Ca 2+ szintje. A dipiridamol növeli a cAMP szintjét a vaszkuláris simaizomsejtekben is, ami érrelaxációt okoz.

A dipiridamolt az ischaemiás stroke megelőzésére, valamint a perifériás artériák betegségeire használják (főleg acetilszalicilsavval kombinálva, mivel maga a dipiridamol gyenge vérlemezke-gátló hatással rendelkezik). Napi 3-4 alkalommal szájon át, étkezés előtt 1 órával írják fel. Orális antikoagulánsokkal kombinálva dipiridamolt írnak fel a vérrögképződés megelőzésére mitrális szívbetegségben.
Dipiridamol alkalmazásakor fejfájás, szédülés, artériás hipotenzió, dyspeptikus tünetek,
bőrkiütések. A vérzés kockázata kisebb, mint az acetilszalicilsav alkalmazása esetén. A dipiridamol ellenjavallt angina pectoris (esetleges „lopás szindróma”) esetén.

Rizs. 27-4. A dipiridamol vérlemezke-ellenes hatásának mechanizmusa: EC - endothel sejt; A2-P-adenozin A2 receptor; PDE - cAMP foszfodiészteráz; AC - adenilát-cikláz; GP IIb/IIIa - glikoproteinek IIb/IIIa
A pentoxifillin (agapurin*, trental*), a dipiridamolhoz hasonlóan gátolja a foszfodiészterázt és növeli a cAMP szintjét. Ennek eredményeként a citoplazmatikus Ca 2 + szintje a vérlemezkékben csökken, ami aggregációjuk csökkenéséhez vezet. A pentoxifillin egyéb tulajdonságokkal is rendelkezik: növeli a vörösvértestek deformálhatóságát, csökkenti a vér viszkozitását, értágító hatású, javítja a mikrokeringést.
A pentoxifillint cerebrovaszkuláris balesetek, különböző eredetű perifériás keringési zavarok, valamint a szem vaszkuláris patológiái esetén alkalmazzák (lásd „Agyi balesetek kezelésére használt gyógyszerek” című fejezetet). Lehetséges mellékhatások: dyspeptikus tünetek, szédülés, arcvörösség, valamint vérnyomáscsökkenés, tachycardia, allergiás reakciók, vérzés. A dipiridamolhoz hasonlóan angina pectoris során rohamokat válthat ki.
A vérlemezkemembránok IIb/IIIa glikoproteinek blokkolását gátló szerek
A vérlemezke-membránok IIb/IIIa glikoproteinjeivel közvetlenül kölcsönhatásba lépő és a fibrinogénhez való kötődésüket megzavaró thrombocyta-aggregáció-gátló szerek ezen csoportja viszonylag nemrégiben jelent meg.
Abciximab (reopro*) – az első gyógyszer ebből a csoportból egy „kiméra” egér/humán monoklonális antitest (a IIb/IIIa glikoproteinek elleni egérantitestek Fab-fragmentuma kombinálva a humán Ig Fc-fragmensével). Az abciximab nem kompetitív módon gátolja a fibrinogén kötődését a IIb/IIIa glikoproteinekhez a vérlemezke membránján, megzavarva azok aggregációját (lásd 27-3. ábra). A vérlemezke-aggregáció egyetlen injekció után 48 órával normalizálódik. A gyógyszert intravénásan (infúzió formájában) adják be a trombózis megelőzésére a koszorúér angioplasztikája során. Az abciximab alkalmazásakor vérzés lehetséges, beleértve a belső (gasztrointesztinális, intrakraniális, húgyúti vérzést), émelygést, hányást, hipotenziót, bradycardiát, allergiás reakciókat az anafilaxiás sokkig, thrombocytopeniát.
Az azonos hatásmechanizmusú, kevésbé allergén gyógyszerek keresése a IIb/IIIa glikoproteinek szintetikus blokkolóinak létrehozásához vezetett. A barborin (a törpe csörgőkígyó mérgéből izolált peptid) alapján az e p t i f i b a t i d (integrilin *) gyógyszert kapták - egy ciklikus hektapeptidet, amely utánozza a fibrinogén lánc aminosavszekvenciáját, amely közvetlenül kötődik a IIb/IIIa glikoproteinekhez. Az eptifibatid kompetitív módon kiszorítja a fibrinogént a receptorokhoz való kötődésből, ami a vérlemezke-aggregáció reverzibilis zavarát okozza. A gyógyszert intravénásan adják be infúzió formájában; a thrombocyta-aggregáció gátló hatás 5 percen belül jelentkezik, és az alkalmazás abbahagyása után 6-12 órával megszűnik. A gyógyszer a perkután koszorúér angioplasztika során a trombusképződés megelőzésére, instabil angina esetén, szívinfarktus megelőzésére javasolt. Az eptifibatid alkalmazása során veszélyes szövődmény a vérzés; thrombocytopenia lehetséges.
A tirofibán (agrastat*) a IIb/IIIa glikoproteinek nem peptid blokkolója, amely a tirozin analógja. Az eptifibatidhoz hasonlóan a tirofiban kompetitív módon blokkolja a glikoprotein IIb/IIIa receptorokat. A gyógyszert intravénásan adják be (infúzió). A hatás kezdetének sebessége, a hatás időtartama és a használati javallatok megegyeznek az eptifibatiddal. Mellékhatások - vérzés, thrombocytopenia.
Az ebbe a csoportba tartozó gyógyszerek alkalmazási lehetőségeinek bővítése érdekében a IIb/IIIa glikoproteinek blokkolókat hozták létre, amelyek orálisan alkalmazva is hatékonyak - xemilofiban *, sibrafiban * stb. Ezeknek a gyógyszereknek a tesztjei azonban nem kielégítő hatékonyságot és mellékhatásukat mutatták ki a betegek körében. súlyos thrombocytopenia formája.
27.2. VÉRALVADÁST BEFOLYÁSOLÓ GYÓGYSZEREK
Az érfal károsodása nemcsak a vérlemezke-aggregációt, hanem a véralvadást is elindítja. Számos ismert tényező (plazma, szövet, vérlemezke) vesz részt ebben a folyamatban. Legtöbbjük plazmafehérje, amely inaktív állapotban kering, de később a véralvadási folyamat során aktiválódik. A gyógyszerek hatásának magyarázatához szükséges megemlíteni a VII-es faktort (prokonvertin), a IX-es faktort (karácsony), a X-es faktort (Stuart-Prower), a II-es faktort (protrombin). Ezek a véralvadási faktorok proenzimek, és ha aktiválódnak, proteolitikus enzimekké alakulnak (GCa, Xa és Na faktorok). A VIII-as és V-ös faktor aktiválás után kofaktorfehérjeként működik az enzimek számára (IXa és Xa faktorok), növelve azok proteolitikus aktivitását.
A VII. faktor kezdetben alacsony proteolitikus aktivitással rendelkezik, de a szöveti faktorral való interakció eredményeként (lásd 481. oldal) gyorsan megnövekszik. Az aktivált VII-es faktor (VIIa-faktor) a szöveti faktorral és a Ca 2+-mal együtt egy komplexet képez, amely a IX-es és X-es faktor részleges proteolízisét idézi elő. A IXa-faktor pedig emellett aktiválja a X-es faktort (Xa-faktor képződik). A Xa faktor a protrombinra (II. faktor) hat, és trombinná (Ha faktor) alakítja át. A trombin a fibrinogén részleges proteolízisét okozza fibrinné (27-5. ábra).
A véralvadási faktorok proteolitikus aktiválása jelentősen felgyorsul, ha Ca 2+ ionokon keresztül kötődnek a sejtmembránok negatív töltésű foszfolipidjeihez. Ezek a foszfolipidek egyfajta mátrixként működnek, amelyen a koagulációs faktorok Ca 2 + -ionok részvételével komplexekké állnak össze. Ugyanakkor ezekben a komplexekben a faktorok aktiválódási sebessége 10 ezerszer vagy még többre nő. Az ilyen komplexek képződésének szükséges feltétele a II., VII., IX. és X. faktor Ca 2 +-hoz való kötődési képessége. Ezek a tényezők negatív töltésűek
γ-karboxiglutaminsavak maradékai, amelyek biztosítják ezek Ca 2+-hoz való kötődését. A γ-karboxiglutaminsavak képződése a májban megy végbe K-vitamin részvételével. K-vitamin-hiány esetén hibás II-es, VII-es, IX-es és X-es véralvadási faktor jelenik meg a vérben, ami megzavarja a fibrin képződését.

Rizs. 27-5. A véralvadás aktiválásának sémája az érfal károsodása esetén (From: Katzung B. G. Alapvető és klinikai farmakológia. - NY, 2001, módosított): a sejtmembránok negatív töltésű foszfolipidjeihez kapcsolódó véralvadási faktorok komplexei aláhúzottak félkövér vonal. A VIIa + TF + Ca 2+ komplex aktiválja a X és IX faktort (TF - szöveti faktor). A IXa + VIIIa + Ca 2+ komplex emellett aktiválja a X faktort. Az Xa + Va + Ca 2+ (protrombináz) komplex elősegíti a protrombin trombinná történő átalakulását. A dobozokba zárt faktorokat a heparin gátolja
A γ-karboxiglutaminsav-maradékokat tartalmazó vérplazmafehérjék, amelyek a májban K-vitamin részvételével képződnek, magukban foglalják a C- és S-fehérjéket is. A fehérje C (Ca) aktiválás után a VIIIa és Va faktor proteolitikus hasítását okozza. Ez a trombin képződés megzavarásához vezet. A Protein S kofaktorként működik a proteolízis reakciókban. A protein C aktivációja trombin hatására megy végbe az ép (sértetlen) endotélsejtek felszínén, amelyek a thrombomodulin fehérjét expresszálják, amely egyidejűleg köti meg a C proteint és a trombint.
27.2.1. Antikoagulánsok (antikoagulánsok)
A klinikai gyakorlatban használt antikoagulánsok vagy közvetlenül a vérben gátolják az aktív alvadási faktorokat, vagy zavarják azok képződését a májban. Ezért 2 csoportra oszthatók:
(közvetlenül a vérben hat).
- Heparin standard(frakcionálatlan).
- Alacsony molekulatömegű heparinok:
enoxaparin-nátrium;
Nadroparin kalcium;
dalteparin-nátrium;
Reviparin-nátrium.
- Heparinoidok:
szulodexid;
Danaparoid**.
- Antitrombin III gyógyszer.
- Hirudin készítmények:
Lepirudin*.
- Aktivált C fehérje:
Drotrekogin alfa.
(gátolják a véralvadási faktorok szintézisét a májban).
- Kumarin származékok:
acenokumarol (syncumar*);
Warfarin (warfarex*).
- Indándion származékok:
Fenindion (fenilin*).
Közvetlen véralvadásgátlók
Heparin- szulfatált glikozaminoglikán (mukopoliszacharid), amely D-glükózamin és D-glükuronsav maradékokból áll. A heparint számos szövetben hízósejtek termelik; nagy mennyiségben tartalmazza a máj, a tüdő és a bélnyálkahártya. Gyógyászati célokra a heparint a sertések bélnyálkahártyájából és a szarvasmarhák tüdejéből izolálják. Folyamatban
az izolálás különböző poliszacharid lánchosszúságú és különböző molekulatömegű (3000-40 000 D) frakciók keverékét eredményezi. A különböző molekulatömegű frakciók biológiai aktivitásában és farmakokinetikai tulajdonságaiban kissé eltérnek. Ezért a különböző módszerekkel és különböző forrásokból előállított heparin készítmények eltérő véralvadásgátló aktivitással rendelkezhetnek, aminek következtében szükséges a biológiai standardizálásuk. A heparin aktivitását a véralvadási időt meghosszabbító képessége határozza meg (1 mg standard heparin 130 egységet tartalmaz).
A heparin csak azután fejti ki hatását a véralvadási faktorokra, miután komplex képződik az endogén antikoaguláns antitrombin III-mal. Az antitrombin III, a vérplazma glikoproteinje gátolja a szerin proteázokat, amelyek magukban foglalják a IIa (trombin), EXa és Xa (valamint a XIa és XIIa) véralvadási faktorokat. A faktorinaktiválás folyamata önmagában az antitrombin III hatására nagyon lassan megy végbe. A heparin konformációs változásokat okoz az antitrombin III molekulában, ami a folyamat körülbelül 1000-szeres felgyorsulásához vezet.

A heparin-antitrombin III komplex fő hatása a trombin és a Xa faktor ellen irányul, de ezeknek a faktoroknak a gátlási mechanizmusa némi eltérést mutat. A trombin inaktiválásához a heparinnak kötődnie kell mind az antitrombin III-molekulához, mind a trombinmolekulához. Ugyanakkor a Xa faktor heparin-antitrombin III komplex általi gyors inaktiválásához nincs szükség ennek a faktornak a heparinhoz való kötődéséhez. A viszonylag rövid polimerláncú (kevesebb mint 18 szacharidegységből álló) heparinfrakciók nem képesek egyidejűleg megkötni az antitrombin III-at és a trombint, ezért nem rendelkeznek antitrombin aktivitással. Hatásuk főként a Xa faktor inaktiválásával és ezért a protrombin trombinná történő átalakulásának megszakításával függ össze.
A heparinnak a véralvadást kiváltó hatása mellett néhány egyéb hatása is van: a lipoprotein lipáz aktiválása miatt csökkenti a vér lipidszintjét (ez az enzim hidrolizálja a triglicerideket), gátolja a simaizomsejtek szaporodását.
A heparin szájon át adva rosszul szívódik fel, ezért intravénásan, esetenként szubkután adják be. Intravénás beadás esetén a hatás azonnal jelentkezik és 2-6 órán át tart Subcutan beadva a heparin 1-2 óra múlva kezd hatni, a hatás időtartama 8-12 óra (napi 2-3 alkalommal írják elő). A vérben lévő heparin számos fehérjéhez kötődik, beleértve azokat is, amelyek semlegesítik (a vérlemezke 4-es faktor és néhány más). E fehérjék magas szintje a vérben relatív rezisztenciát okozhat a gyógyszerrel szemben. Ezenkívül a heparin a makrofágokhoz és az endothel sejtekhez kötődik, és lebomlása (depolimerizációja) következik be. A heparin a májban is metabolizálódik, és a vesén keresztül választódik ki.
A heparint mélyvénás trombózis és tüdőembólia megelőzésére és kezelésére, instabil anginára és szívinfarktusra, perifériás artériák trombózisának megelőzésére, szívbillentyű pótlásra és extracorporalis keringésre használják. A heparint akcióegységekben (AU) adagolják.
A heparinterápia leggyakoribb szövődménye a vérzés, amelyet a vérlemezkék működésének gátlása vagy számuk csökkenése (thrombocytopenia) okozhat. Úgy tűnik, hogy a heparin kötődése von Willebrand faktorhoz magyarázza a vérlemezkék adhézióját és aggregációját gátló hatását. Ilyenkor a heparint abbahagyják, súlyos vérzés esetén pedig intravénásan protamin-szulfátot is adnak, amely oldhatatlan komplexet képezve semlegesíti a heparint.
A thrombocytopenia a kezelés 7-14. napján jelentkezik a heparint kapó betegek körülbelül 1-5%-ánál. A heparin-thrombocyta faktor 4 komplex elleni antitestek (IgG) megjelenése okozza. Ez a komplex kötődik a vérlemezke membránhoz, amikor a heparint 4-es faktorral semlegesítjük, egy vérlemezkéből származó glikoproteinnel, amely a vérlemezke-aggregáció során szabadul fel. A thrombocytopeniás betegek kevesebb mint 1%-a tapasztal trombózist az endothel károsodása miatt
sejtek és a vérlemezkék aktiválása a heparin-4-es faktor komplex elleni antitestekkel Ez az állapot megköveteli a heparin kezelés leállítását és olyan antikoagulánsok kijelölését, amelyek nem okoznak thrombocytopeniát: danaparoid** és lepirudin**.
A heparin hosszú távú (több mint 3 hónapos) alkalmazása esetén csontritkulás alakulhat ki. Ezt különösen fontos figyelembe venni a heparin terhesség alatti felírásakor. A mellékvesékben az aldoszteron szintézis gátlásával összefüggő hiperkalémia a heparinterápia meglehetősen ritka szövődménye.
Kis molekulatömegű (frakcionált) heparinok 1000-10 000 D (átlagosan 4000-5000 D) molekulatömegű heparin fragmentumokból áll. Ezeket a hagyományos (nem frakcionált) heparin frakcionálásával, hidrolízisével vagy depolimerizálásával állítják elő. Ezek a gyógyszerek, mint a heparin, az antitrombin III-on keresztül hatnak a véralvadási faktorokra, de a következő tulajdonságokban különböznek a heparintól:
A Xa faktor aktivitását nagyobb mértékben gátolják, mint a IIa faktort (3-4-szer);
Szubkután beadva nagyobb a biológiai hozzáférhetőségük (kis molekulatömegű heparinok - körülbelül 90%, standard heparin - 20%);
Hosszabb ideig hatnak, ami lehetővé teszi napi 1-2 alkalommal történő beadásukat;
Kisebb affinitással rendelkeznek a 4-es thrombocyta-faktorhoz, így kisebb valószínűséggel okoznak thrombocytopeniát, mint a standard heparin;
Ritkábban okoz csontritkulást.
A hazai gyakorlatban a következő kis molekulatömegű heparinkészítményeket használják: en o x a parin-nátrium (Clexane *), nadroparin-kalcium (Fraxiparin *), d alte parin-nátrium (Fragmin *), reviparin-nátrium (klivarin*). Ezek a gyógyszerek összetételükben heterogének (különböző heparinfrakciókat tartalmaznak), ezért fizikai-kémiai, farmakokinetikai tulajdonságaikban és aktivitásukban némileg eltérnek egymástól.
Az alacsony molekulatömegű heparinokat mélyvénás trombózis megelőzésére és kezelésére (főleg műtét után), tüdőembólia megelőzésére, valamint instabil angina és szívinfarktus kezelésére használják. Profilaxis céljára alacsony molekulatömegű heparin készítmények javasoltak
tics és trombózis terápia a szülészeti gyakorlatban. Csak szubkután adják be. Az adagolás ME-ben (nemzetközi egység) van megadva.
Az alacsony molekulatömegű heparinok, akárcsak a frakcionálatlan heparinkészítmények, vérzést okozhatnak. A kezelés első napjaiban mérsékelt thrombocytopenia lehetséges. Az alacsony molekulatömegű heparinok bizonyos esetekben növelik a májenzimek aktivitását, és allergiás reakciókat okozhatnak. A protamin-szulfát nem szünteti meg teljesen az alacsony molekulatömegű heparinok hatását.
A közelmúltban a klinikai gyakorlatban megjelent a fo n d a p a - nátrium rinux - egy szintetikus pentaszacharid, amely az antitrombin III-hoz kötődve felgyorsítja a Xa faktor inaktivációját. A gyógyszert nátriumsó formájában állítják elő, és a vénás trombózis és a tüdőembólia megelőzésére használják ortopédiai sebészetben.
Heparinoidok- szulfatált glikozaminoglikánok, szerkezetileg a heparinokkal rokon. A heparinhoz hasonlóan fokozzák az antitrombin III gátló hatását a véralvadási faktorokra. Számos fontos jellemzőjükben különböznek a heparintól és a kis molekulatömegű heparinoktól, ezért külön csoportba sorolhatók. Ebbe a csoportba tartozik a Danaparoid* és a szulodexid. Ezeket a gyógyszereket a sertések bélnyálkahártyájából nyerik.
A Danaparoid** (organon**) heparán-szulfát, dermatán-szulfát és kondroitin-szulfát keverékét tartalmazza. A Danaparoid p szignifikánsan gátolja a Xa faktort, mint a protrombin. A gyógyszert szubkután adják be a vénás trombózis megelőzésére és kezelésére. A Danaparoid p nem kötődik a 4-es thrombocyta-faktorhoz, és nem okoz thrombocytopeniát. Ezért olyan esetekben javasolt, amikor a heparin terápiát thrombocytopenia bonyolítja.
A Sulodexide (Wessel Due F*) heparán-szulfát és dermatán-szulfát keverékéből áll. A szulodexid nagymértékben csökkenti a Xa faktor aktivitását, csekély hatással van a protrombinra. A gyógyszer fokozza a fibrinolitikus aktivitást, védő hatást fejt ki a vaszkuláris endotéliumra, és hipolipidémiás tulajdonságokkal rendelkezik. A Sulodexide olyan perifériás érbetegségek kezelésére javallt, amelyeknél fokozott a trombózis kockázata. A gyógyszernek vannak adagolási formái parenterális (intravénás és intramuszkuláris) beadásra és orális adagolásra.
Antitrombin IIIszükséges a heparin, a kis molekulatömegű heparinok és a heparinoidok véralvadásgátló hatásához.
Az antitrombin III örökletes hiánya esetén gyógyszerét intravénásan alkalmazzák és adják be. A heparin hosszú távú alkalmazása esetén az antitrombin III fogyasztása nő, így koncentrációja a vérben jelentősen csökken. Ez csökkenti a heparinterápia hatékonyságát. Ilyen esetekben antitrombin III-at is beadnak.
Hirudin- 7 kDa molekulatömegű fehérje, amelyet először gyógypiócák nyálmirigyében fedeztek fel Hirudo medicalis. A hirudin a heparinhoz hasonlóan egy antikoaguláns, amely közvetlenül a vérben fejti ki hatását, de a heparinnal ellentétben a hirudin közvetlenül gátolja a trombint: szelektíven kötődik hozzá, és az antitrombin III részvétele nélkül inaktiválja. A gátlás visszafordíthatatlan. A heparinnal ellentétben a hirudin képes gátolni a vérröghöz kapcsolódó trombint, és így késlelteti a vérrög növekedését. A hirudin nem lép kölcsönhatásba a 4-es thrombocyta-faktorral, ezért nem okoz thrombocytopeniát.
A hirudin - le p i r u d i n * (refludan *) rekombináns készítményét klinikai használatra kapták. Alkalmazása javasolt a heparin okozta thrombocytopenia esetleges thromboemboliás szövődményeinek megelőzésére. A Lepirudint* intravénásan adják be. Használat közben vérzés léphet fel. A hirudin készítményeknek nincs specifikus ellenszere.
Az alfa-drotrekogin (Zigris*) az aktivált protein C rekombináns készítménye. Gátolja a trombin képződését, ami a VIIIa és Va véralvadási faktorok proteolitikus inaktiválását okozza. Ezen túlmenően a drotrekogin növeli a vérplazma fibrinolitikus aktivitását, csökkentve a vérben keringő 1-es típusú plazminogén aktivátor inhibitor mennyiségét. monocitákból. A drotrekogin mindezen tulajdonságai meghatározzák a szeptikus sokk kezelésében való hatékonyságát (a gyulladás és a fokozott véralvadás ennek az állapotnak a fő tünetei). Más antikoagulánsokhoz hasonlóan a gyógyszer is okozhat vérzéses szövődményeket.
Közvetett antikoagulánsok
Ezek a gyógyszerek a heparinnal ellentétben nem befolyásolják közvetlenül a véralvadási faktorokat. gátolják a szin-
a K-vitamintól függő vérplazmafehérjék szintézise a májban - II. faktor (protrombin), VII., IX. és X. faktor (lásd 27-5. ábra). A K-vitamin a funkcionálisan értékes faktorok kialakulásához szükséges, mivel a glutaminsavmaradékok γ-karboxilezési reakciójában koenzimként működik. A K-vitamin redukált formája, a hidrokinon koenzimaktivitást mutat. A karboxilezés során a K-vitamin-hidrokinon oxidálódik, és inaktív K-vitamin-epoxid keletkezik. Az indirekt antikoagulánsok megakadályozzák az inaktív K-vitamin-epoxid átalakulását (redukcióját) aktív K-vitamin-hidrokinonná az epoxid-reduktáz és a DT-diaforáz hatására, gátolják ezeket az enzimeket. Ezért K-vitamin antagonistáknak minősülnek (27-6. ábra).

Rizs. 27-6.A K-vitamin és az indirekt antikoagulánsok hatásmechanizmusa
A közvetett antikoagulánsok nem csökkentik azonnal a véralvadási faktorok koncentrációját a vérben. Cselekvésüket látens időszak jellemzi. Így az acenokumarol véralvadásgátló hatása 48 óra vagy több óra elteltével éri el maximális értékét. A hatás lassú kifejlődése azzal magyarázható, hogy ezeknek a gyógyszereknek a beadásakor még egy ideig teljes értékű alvadási faktorok keringenek a vérben (a hatás kialakulásának sebességét az az idő határozza meg, amely alatt a véralvadási faktorok a protrombin komplex lebomlik). Az indirekt antikoagulánsok hatása körülbelül 2-4 napig tart, a gyógyszerek felhalmozódhatnak.

Az indirekt antikoagulánsokat a trombózisok és thromboemboliák (mélyvénás trombózis, tüdőembólia, thromboemboliás szövődmények pitvarfibrillációban, szívinfarktus, szívbillentyű pótlás) hosszú távú megelőzésére és kezelésére alkalmazzák, a műtéti gyakorlatban a posztoperatív időszakban a trombusképződés megelőzésére. Belépett a belsejébe. A kezelést a vérplazma protrombin szintjének kötelező ellenőrzése mellett végzik a protrombin idő meghatározásával - egy mutató, amelynek értéke a vér protrombin tartalmától és a IX és X faktoroktól függ.
Az indirekt antikoagulánsok alkalmazásakor a leggyakoribb szövődmények a vérzés. A vérzés kockázata nő az aszpirin * és más vérlemezke-gátló szerek egyidejű alkalmazása esetén. Az indirekt antikoagulánsok által okozott vérzés megállítására K1-vitamin készítményeket és protrombin komplex koncentrátumot (II, VII, IX és X faktort tartalmaz) kell alkalmazni. Egyéb mellékhatások is előfordulhatnak: allergiás reakciók, hasmenés, májműködési zavarok, bőrelhalás. A közvetett antikoagulánsok terhesség alatt ellenjavallt: behatolnak a méhlepénybe és teratogén hatást fejtenek ki (zavarják a csontváz kialakulását, mivel
gátolja az oszteokalcin, egy K-vitamin-függő csontfehérje képződését). A fenindion (phenilin*) gátolja a vérképzést.
27.2.2. Véralvadási szerek
A véralvadást fokozó gyógyszereket a vérzés megállítására használják, ezért vérzéscsillapító szerek (vérzéscsillapítók) vagy vérzéscsillapítók közé sorolják őket. Ebbe a csoportba tartoznak a véralvadási faktorok képződéséhez szükséges anyagok (K-vitamin készítmények) és maguk a véralvadási faktorok készítményei.
K-vitamin készítmények
A K-vitamin két formában létezik - a növényekben található K1-vitamin (filokinon) és a K2-vitamin - mikroorganizmusok (különösen az emberi bélmikroflóra) által szintetizált vegyületcsoport (menakinonok). A K 1 és K 2 vitaminok zsírban oldódó vegyületek, a 2-metil-1,4-naftokinon származékai, amelyek az oldalszénlánc hosszában és jellegében különböznek egymástól. A K j-vitamint szintetikus úton nyerik, előállítása fitomenadion néven ismert. A K-vitamin vízoldható prekurzorát, a 2-metil-1,4-naftokinont (menadion) szintetizálták, amely provitamin aktivitással rendelkezik. Ezt a vegyületet K3-vitaminnak nevezték el. A K 3-vitamin származékát - a menadion-nátrium-hidrogén-szulfitot - az orvosi gyakorlatban b és k a - szol * néven használják.
A K-vitamin szükséges a májban a protrombin (II. faktor) és a VII., IX. és X. véralvadási faktorok, valamint a C és S fehérjék szintéziséhez. A K-vitaminról ismert, hogy részt vesz az oszteokalcin csontszövet fehérje szintézisében.
Valamennyi K-vitamin-függő fehérje szerkezetében van egy közös vonás: ezek a fehérjék γ-karboxiglutaminsav-maradékokat tartalmaznak, amelyek megkötik a Ca 2+ -ionokat. A K-vitamin-hidrokinon koenzimként működik a glutaminsavmaradékok γ-karboxilezési reakciójában (lásd 27-6. ábra). K-vitamin hiány esetén a véralvadási faktorok inaktív prekurzorai jelennek meg, amelyek nem képesek megkötni a Ca 2+ -ot. A K-vitamin hiánya a szervezetben a leggyorsabban a véralvadás zavarához vezet. Ezért a fő
a K-vitamin-hiány legkorábbi megnyilvánulása pedig a vérzés és a vérzés.
A K-vitamin készítményeket vérzések és egyéb vérzéses szövődmények megelőzésére és leállítására használják, amelyeket K-vitamin-hiány okoz a szervezetben, például újszülöttek vérzéses szindrómáját. Az újszülöttek K-vitamin-hiányát mind a K 1 -vitamin elégtelen bevitele, mind a K 2 -vitamint szintetizáló bélmikroflóra hiánya okozhatja. Az ilyen szövődmények megelőzése érdekében az újszülöttek számára az élet első óráiban K 1 -vitamin profilaktikus adása javasolt.
A K-vitamin készítmények a K-vitamin bélben történő csökkent felszívódása esetén javallottak az epekiválasztás károsodása miatt obstruktív sárgaság (az epe szükséges a zsírban oldódó K-vitamin felszívódásához) vagy felszívódási zavar szindróma esetén (sprue, enterocolitis, Crohn-betegség stb. .)
A K 1-vitamin készítmények hatásosak az indirekt antikoagulánsok okozta vérzéseknél. Lassan orálisan és intravénásan adják be.
A K-vitamin készítmények allergiás reakciókat (kiütés, viszketés, bőrpír, hörgőgörcs) okozhatnak. Intravénás beadás esetén fennáll az anafilaktoid reakciók veszélye. A K 3-vitamin készítmények (Vikasol*) újszülötteknél történő alkalmazása esetén fennáll a hemolitikus anémia és a hyperbilirubinémia kialakulásának veszélye.
Alvadási faktor készítmények
Ilyen gyógyszerekre akkor van szükség, ha egy vagy több véralvadási faktor hiányos.
Az antihemofil véralvadási faktor VIII (hemofil M*, immunat* stb.) a VIII-as faktor száraz koncentrátuma. A gyógyszereket olyan donor vérplazmából nyerik, amely kétszeres vírusinaktiváción esett át, és a VIII-as faktor tartalma szerint standardizáltak. Aktívabbak és biztonságosabbak, mint a krioprecipitátum*.
A krioprecipitát* vérplazmafehérjék koncentrátuma, amely VIII-as faktort, von Willebrand faktort, fibronektint, valamint kisebb mértékben egyéb véralvadási faktorokat és kis mennyiségű fibrinogént tartalmaz.
A gyógyszereket intravénásan adják be örökletes (hemofília A) és szerzett VIII-as faktor hiány esetén. krioprecipitátum*,
emellett a von Willebrand-betegség (a von Willebrand-faktor örökletes hiánya) és az afibrinogenemia helyettesítő terápiájára is alkalmazzák. Beadáskor nemkívánatos reakciók lehetségesek tachycardia, artériás hipotenzió, légszomj, allergiás reakciók (urticaria, láz, anafilaxiás sokk), valamint a vörösvértestek hemolízise formájában.
A vérplazmából nyert összes alvadási faktor készítménynek jelentős hátránya van - a vírusfertőzések (HIV, hepatitis) átvitelének lehetősége. Jelenleg a VIII-as faktor és a von Willebrand faktor rekombináns készítményeit kapták, amelyek alkalmazása csökkenti a fertőzés kockázatát.
A véralvadási faktor gyógyszerek mellett a hemofília A és a von Willebrand-betegség enyhe formáira az arginin vazopresszin analóg dezmopresszint alkalmazzák. A dezmopresszin növeli a von Willebrand faktor tartalmát a vérplazmában, elősegíti annak felszabadulását az endothel sejtekből, és növeli a faktor aktivitását
VIII. A gyógyszert parenterálisan adják be.
A IX-es véralvadási faktor (agemphil B*, immunin*, oktanin*) a humán plazma tisztított, IX-es faktorral dúsított frakciója. A IX-es faktor veleszületett (hemofília B) és szerzett hiánya esetén, valamint indirekt antikoagulánsok túladagolásakor alkalmazzák. A mellékhatások ugyanazok, mint a VIII-as faktor gyógyszerek esetében.
Az Eptacog alfa aktivált (novoseven *) egy rekombináns VIIa véralvadási faktor. VII-es faktor és más alvadási faktorok (V, II,
IX, X).
Helyileg a kis kapillárisok és parenchymás szervek vérzésének megállítására a thrombinát (a donor vérplazmájából nyerjük), valamint a vérzéscsillapító szivacsokat (kollagén, zselatin) használják.
Méh-, tüdő-, vese-, bél- és egyéb vérzések megállítására gyógynövénykészítményeket használnak: csalánlevél, cickafarkfű, paprikafűfű, göncfű, viburnum kéreg, árnika virágok, bódító lagochilus. A gyógynövényeket infúziók, tinktúrák és kivonatok formájában használják belsőleg és helyileg.
27.3. A FIBRINOLÍZIST BEFOLYÁSOLÓ GYÓGYSZEREK
A vérrögök kialakulásakor a fibrinolitikus rendszer aktiválódik, amely biztosítja a fibrin feloldódását (lízisét) és a vérrög pusztulását. Ez a normális véráramlás helyreállításához vezet.
A fibrinolízis folyamata során az inaktív plazminogén plazminná (fibrinolizin) alakul plazminogén aktivátorok részvételével. A plazmin hidrolizálja a fibrint, így oldható peptideket képez. A plazmin nem rendelkezik specifikussággal, és a fibrinogén és néhány más véralvadási faktor elpusztítását is okozza, ami növeli a vérzés kockázatát. A vérben keringő plazmint az α 2 -antiplazmin és más inhibitorok gyorsan inaktiválják, ezért általában nincs szisztémás fibrinogenolitikus hatása. Bizonyos kóros állapotok vagy fibrinolitikus szerek alkalmazása esetén azonban lehetséges a plazmaplazminogén túlzott aktiválódása, ami vérzést okozhat.
27.3.1. Fibrinolitikus (trombolitikus) szerek
A fibrinolitikus szereket a vérrögök feloldására használják koszorúér-trombózis (akut miokardiális infarktus), mélyvénás trombózis, perifériás artériák akut trombózisa és tüdőembólia esetén.
Fibrinolitikus szerekként olyan gyógyszereket használnak, amelyek aktiválják a plazminogént: sztreptokináz gyógyszerek, szöveti plazminogén aktivátorok, urokináz gyógyszerek.
Streptokináz gyógyszerek
A streptokináz (cabikinase *) egy nagy tisztaságú fehérjekészítmény, amelyet β-hemolitikus streptococcus tenyészetéből nyernek. A sztreptokináz csak plazminogénnel kombinálva válik proteolitikus aktivitásra. A streptokináz beadásakor egy ekvimoláris sztreptokináz-plazminogén komplex képződik, amely a plazminogént plazminná alakítja. A sztreptokináz a vérrögben és a vérplazmában egyaránt hat a plazminogénre (27-7. ábra).
A sztreptokinázt intravénásan adják be akut szívizominfarktusban, amelyet a koszorúerek trombózisa okoz (a legtöbb
hatásos az első 3-6 órában), mélyvénás trombózis, tüdőembólia és retina vaszkuláris trombózis esetén. A sztreptokinázt ME-ben (nemzetközi egységekben) adagolják.
A sztreptokináz használatakor gyakori szövődmény a vérzés, amely mind a vérben keringő plazminogén aktiválódásával (a keletkező plazmin elpusztítja a fibrinogént, ami csökkenti a vérlemezke-aggregációt), mind a fiziológiás vérrögök feloldódásával járhat együtt. Hányinger, hányás és artériás hipotenzió lehetséges. Az antigén tulajdonságok jelenléte miatt a sztreptokináz allergiás reakciókat okozhat, beleértve az anafilaxiás sokkot is. Veszélyük a gyógyszer ismételt beadásával nő. A vérben keringő antitestek inaktiválhatják a streptokinázt és csökkenthetik a terápia hatékonyságát.
Az anistreplase** (emináz**) sztreptokináz és acilezett lizin plazminogén komplexe. A plazminogén molekulában lévő acilcsoport lezárja a katalitikus helyet, ami megakadályozza a plazminogén aktiválódását. A gyógyszer prodrug, és csak az acilcsoport hasítása után képes a plazminogént plazminná alakítani. A deacilezés sebessége és így az aktív hatóanyag képződésének ideje az acilcsoport természetétől függ, és 40 perctől több óráig terjedhet. Az Anistreplase**-t intravénásan adják be. Egyetlen injekció után a fibrinolitikus hatás 4-6 óráig tart. A felhasználásra vonatkozó javallatok és mellékhatások megegyeznek a streptokinázéval.
Szövetplazminogén aktivátor és urokináz készítmények
A szöveti plazminogén aktivátor és az urokináz a fő fiziológiás plazminogén aktivátorok.
A szöveti plazminogén aktivátort az endotélsejtek termelik. A plazminogén részleges proteolízisét okozza, ami plazminná alakul át. A szövetaktivátor megkülönböztető jellemzője a fibrin iránti nagy affinitása, amely több százszorosára gyorsítja a plazminogénre gyakorolt hatását. Ennek eredményeként a szöveti aktivátor nagyobb sebességgel aktiválja azokat a plazminogén molekulákat, amelyek a fibrinszálakon adszorbeálódnak. Így a szöveti plazminogén aktivátor hatását a thrombus fibrin korlátozza. Bekerülni a véráramba,

Rizs. 27-7.Fibrinolitikus szerek hatásmechanizmusa: tPA - szöveti plazminogén aktivátor; FDP - fibrinogén bomlástermékek; EC - endoteliális sejt; ? - aktiválás; Θ - lízis
a szövetaktivátor specifikus inhibitorhoz kötődik, ezért a vérben keringő plazminogénre csekély hatással van, és kisebb mértékben csökkenti a fibrinogén szintet.
Klinikai felhasználásra szöveti plazminogén aktivátor rekombináns készítményeit szerezték be: altepláz (actilyse *) és tenekteláz (metalise *). A gyógyszereket intravénásan adják be a szívkoszorúér trombózisa által okozott akut miokardiális infarktus (az első 6-12 órában hatásos), tüdőembólia esetén. Annak ellenére, hogy az altepláz csekély hatással van a vérben keringő plazminogénre, alkalmazása során gyakran előfordulnak vérzéses szövődmények. Nincs antigén tulajdonsága. A tenekteplasz fokozott specifitást mutat a thrombus fibrinnel szemben.
Az urokinázt a vesesejtek termelik, és a vizeletben található. A vesékben egyláncú urokináz (prourokináz) képződik, amely a plazmin hatására átalakul aktív formává - kettős láncú urokinázzá. A kettős láncú urokináz közvetlen aktiváló hatással van a plazminogénre (nem szükséges komplexet képezni a plazminogénnel). A kettős láncú urokináz készítményt humán embrionális vesesejtek tenyészetéből nyerik. Akut szívinfarktus, vénás és artériás trombózis, tüdőembólia esetén alkalmazzák. Intravénásan beadva. ME-ben adagolva. A szöveti plazminogén aktivátorhoz képest az urokináz nagyobb mértékben hat a vérben keringő plazminogénre, ennek következtében a vérben képződő plazmin a fibrinogén lebomlását okozza (lásd 27-7. ábra). Ezzel párhuzamosan csökken a thrombocyta aggregáció, és fibrinogén bomlástermékek képződnek, amelyek véralvadásgátló hatásúak. A fő mellékhatások a vérzés. Nem rendelkezik antigén tulajdonságokkal.
Egyláncú urokináz (prourokináz) - c a p u p l a z a * - rekombináns készítményt kaptak, amely nagyobb specificitást mutat a thrombus fibrinre, mint az urokináz.
27.3.2. Antifibrinolitikus szerek
Az antifibrinolitikus gyógyszereket a fibrinolitikus rendszer fokozott aktivitása által okozott vérzés megállítására használják sérülések, sebészeti beavatkozások, szülés során,
májbetegségek, prosztatagyulladás, menorrhagia, valamint fibrinolitikus gyógyszerek túladagolása. E célokra olyan gyógyszereket használnak, amelyek gátolják a plazminogén aktiválását vagy plazmininhibitorok.
Az aminokapronsav a plazminogénhez kötődik, és megakadályozza annak plazminná történő átalakulását. Ezenkívül zavarja a plazmin fibrinre gyakorolt hatását. A gyógyszert orálisan és intravénásan adják be. Lehetséges mellékhatások: artériás hipotenzió, bradycardia, aritmiák, szédülés, hányinger, hasmenés. Az aminometil-benzoesav (Ambene*, Pamba*) hasonló hatású.
A tranexámsav (tranexam*, ciklokapron*) gátolja a plazminogén aktivációt. A gyógyszert orálisan és intravénásan adják be. Hatékonyabb, mint az aminokapronsav, és tovább tart. A mellékhatások közé tartoznak a dyspeptikus tünetek (étvágytalanság, hányinger, hányás, hasmenés), szédülés, álmosság; allergiás bőrreakciók lehetségesek.
Az aprotinin (Gordox*, Contrical*, Trasylol*, Ingitril*) gátolja a plazmint és más proteolitikus enzimeket. A gyógyszert intravénásan adják be. Mellékhatások: artériás hipotenzió, tachycardia, hányinger, hányás, allergiás reakciók.
A vérlemezkék, a legkisebb vérsejtek (a leukocitákhoz és a vörösvértestekhez képest), a legfontosabb funkciót látják el - megvédik a szervezetet a vérveszteségtől. A vérlemezke-aggregáció a sejtek egymáshoz tapadásának folyamata, a vérrögképződés kezdeti szakasza.
A második szakasz a vérlemezkék rögzítése a sérült ér falához. A fibrinszálakat, más elemeket és az új tapadó sejteket rétegezik a vérlemezke tömegére. Így a trombus olyan méretűre nő, amely képes elzárni az ér átmérőjét és megállítani a vérzést. Néha az ember élete a folyamat sebességétől függ.
A vérlemezke-aggregáció szerepe a véralvadás folyamatában
A véralvadás sok tényezőtől függ. Ezek egyike, a vérlemezke-aggregáció egészséges szervezetben védekező adaptív jellegű. A sejtek csak vérző edényben tapadnak össze. Ebben az esetben a folyamat pozitív szerepet játszik.
De ismertek olyan kóros állapotok, amelyekben a vérrögképződés nem kívánatos, mivel ez a létfontosságú szervek táplálkozásának megzavarásához vezet. Például szívinfarktus, stroke, vezető artériák trombózisa esetén. A vérlemezkék aggregációs aktivitása a kóros elváltozások oldalát veszi át. Különféle gyógyszerek segítségével kell felvenni a harcot ellene.
Gyakorlatilag szükség van a jó és a rossz vérlemezke-aggregáció számszerűsítésére. Ehhez a normát kell használnia, és meg kell különböztetnie az eltéréseket.
Hogyan lehet meghatározni a normalitást és a patológiát?
Kimutathatja-e egy vérvizsgálat egy adott személy vérlemezke-aggregációs képességét? Végül is a vizsgálat elvégzéséhez vért vesznek egy vénából, és attól a pillanattól kezdve a test „megrendelései” nem hatnak a vérsejtekre. Ezt a fajta elemzést „in vitro”-nak nevezik, szó szerinti fordítása a latinból „üvegen, kémcsőben”. A tudósok mindig az emberi testhez közeli körülmények között próbálják tanulmányozni a reakciót. Csak az így nyert adatok tekinthetők megbízhatónak és használhatók fel a diagnosztikában.
A vérlemezkék képességeit az indukált aggregáció határozza meg. Ez azt jelenti, hogy induktor anyagként olyan anyagokat használnak, amelyek kémiai összetételükben nem idegenek a szervezet számára, és amelyek vérrögképződést okozhatnak. Induktorként az érfal komponenseit használják: adenozin-difoszfát (ADP), risztocetin (ristomicin), kollagén, szerotonin, arachidonsav, adrenalin.
A spontán aggregációt induktorok nélkül határozzuk meg.
A mennyiségi meghatározási technikák a fényhullámok vérlemezkékben gazdag vérplazmán való átengedésén alapulnak. Az aggregációs aktivitás mértékét a plazma fénysűrűségének különbsége vizsgálja a koaguláció megkezdése előtt és a maximális eredmény elérése után. Az aggregáció sebessége az első percben, a hullámok jellege és alakja is meghatározásra kerül.
A sebesség az induktor anyagától és koncentrációjától függ.
Az ADP-vel végzett trombocita-aggregációt általában kollagénnel, ristomicinnel és adrenalinnal kombinálva írják elő és értékelik.
Az ADP-vel végzett analízis normája 30,7-77,7%. Az adrenalinnal történő vérlemezke-aggregáció mértéke 35 és 92,5% között változik. Egy kollagénnel végzett vizsgálat során a normál értékek 46,4 és 93,1% között vannak.
Az elemzésre való felkészülés szabályai
Az aggregációs képesség vérvizsgálatához meg kell értenie, hogy a teszt pontatlan lesz, ha megsértik az előkészítési szabályokat. A vérben olyan anyagok lesznek, amelyek befolyásolják az eredményt.
- Egy héttel a véradás előtt abba kell hagyni az összes aszpirin gyógyszert, a dipiridamolt, az indometacint, a szulfapiridazint és az antidepresszánsokat. Ezen gyógyszerek alkalmazása gátolja (elnyomja) a trombusképződést. Ha nem tudja abbahagyni a szedését, értesítse a laboratóriumi technikust.
- Legalább 12 órán keresztül nem szabad enni a zsíros ételeket, amelyek különösen befolyásolják az eredményeket.
- A betegnek a lehető legnyugodtabbnak kell lennie, és nem szabad fizikai munkát végeznie.
- Egy nappal korábban zárja ki a kávét, az alkoholt, a fokhagymát az ételből, és ne dohányozzon.
- Az elemzést nem végezzük el, ha aktív gyulladásos folyamat van.
Az összetapadt vérlemezkék mikroszkóp alatt láthatóak
A vérlemezke-aggregáció vérvizsgálatát az orvos írja elő, ha antikoaguláns kezelésre van szükség, figyelemmel kísérve azok hatékonyságát, kiválasztva az optimális adagot, a fokozott vérzés diagnosztizálására.
Az eredmények dekódolása
Az egyik koagulációs faktor aktiválásának domináns mechanizmusa az oka annak, hogy egyszerre három standard induktorral kell vizsgálatokat végezni, és ha szükséges, újakat hozzáadni. Az azonosított megváltozott normának, például az ADP-vel, ha nincs dinamika más induktorokkal, diagnosztikai jelentősége van. Az eredményeket orvos értékeli.
A csökkent vérlemezke-aggregációt a következők okozhatják:
- a trombocita-ellenes terápia sikeres alkalmazása;
- a thrombocytopathiának nevezett betegségek csoportja.

Aggregációs elemző készülékek
A thrombocytopathia szerepe
A thrombocytopathiák lehetnek örökletesek vagy más betegségek eredményeként szerzettek. A statisztikák azt mondják, hogy a bolygó lakosságának akár 10% -a szenved ettől a patológiától. Mindegyikük bizonyos anyagok felhalmozódásában a vérlemezkék működési zavarával jár.
Ennek eredményeként a véralvadás és a vérrögképződés nem következik be, ami a kis sebek és zúzódások fokozott vérzéséhez vezet (belső vérzés).
A betegségek már gyermekkorban megjelennek fogínyvérzéssel, gyakori orrvérzéssel, sok zúzódással a gyermek testén, zúzódások miatti ízületi duzzanatokkal. A pubertás alatt a lányoknak hosszú és erős menstruációjuk van. A vérzés vérszegénység (vérszegénység) kialakulásához vezet.
A thrombocytopathia alacsony aggregációs képességét vírusos és bakteriális fertőzések, gyógyszerek és fizioterápiás eljárások aktiválhatják.

Az orrvérzést az esetek 80%-ában thrombocytopathia okozza, és csak 20%-ban a fül-orr-gégészeti szervek betegségei.
Másodlagos thrombocytopathiák
Tüneti (másodlagos) thrombocytopathiák alakulnak ki krónikus leukémiában, myelomában,. Ez az állapot a veseelégtelenség (urémia) végső szakaszára, a pajzsmirigy csökkent működésére jellemző.
A sebészek trombocitopátiával találkoznak, ha a sebészeti beavatkozások során fokozott vérzés lép fel.
A vérlemezke-aggregáció növekedése figyelhető meg:
- széles körben elterjedt vaszkuláris atherosclerosis;
- magas vérnyomás;
- belső szervek infarktusa;
- a hasi artériák trombózisa;
- stroke;
- diabetes mellitus
Az aggregáció változásai a terhesség alatt
A terhesség alatti vérlemezke-aggregáció eltérhet a normál értékektől.
Az aggregáció csökken a vérlemezkék elégtelen termelése vagy minőségi összetételük megsértése miatt. Ez vérzésben és zúzódásban nyilvánul meg. A szülés során számolni kell a tömeges vérzés lehetőségével.
Az aggregáció leggyakrabban toxikózis során fokozódik a hányás és hasmenés következtében fellépő folyadékvesztés miatt. A vérkoncentráció növekedése fokozott trombusképződéshez vezet. Ez korai vetéléshez vezethet. A mérsékelt hiperaggregáció normálisnak tekinthető a terhesség alatt, és a placenta keringésének kialakulásához kapcsolódik.
- vetélés esetén;
- meddőségi kezelés;
- fogamzásgátló szedése előtt és alatt;
- tervezett terhesség előtt.
A vérlemezke-aggregációs tulajdonságok elemzése lehetővé teszi a kockázatok azonosítását, a betegségek során fellépő veszélyes szövődmények előrejelzését és a megelőző terápia azonnali végrehajtását.
A vérlemezkék olyan vérsejtek, amelyeknek nincs színük. Fontos funkciót töltenek be a szervezetben, megvédik a vérveszteségtől. Ez a folyamat a vérlemezke-aggregáció a vérben, saját szabványos mutatói vannak.
Ahhoz, hogy megértsük, mi ez, ismernie kell a vérrögképződést, a meglévő szabványokat és a normál értékektől való eltérések veszélyét.
Leírás és szerepe az emberi szervezetben
A szövetek sérülése után a vérlemezkék a sérült ér falához tapadnak. Ennek eredményeként a sejtek összetapadnak. Idővel fibrinszálakat, új ragasztott sejteket és egyéb elemeket adnak a kapott masszához.
Ennek hátterében egy vérrög növekszik, amely nagy méreteket ér el, ami az ér elzáródásához és a vérzés leállításához vezethet. Egy ilyen folyamat gyorsasága nagyon fontos, mivel néha az emberi élet megőrzése függ tőle.

A véralvadást számos tényező befolyásolja. Az egyik az aggregáció. Kóros állapotok hiányában védő adaptív funkciót lát el.
Az aggregációs jellemzők abból állnak, hogy a sejtek csak a sérült edényben ragadnak össze. Ebben az esetben a folyamat pozitívnak tekinthető.
.jpg)
Vannak azonban olyan helyzetek, amikor a trombózis nem kívánatos. Például ha stroke-ot vagy szívinfarktust diagnosztizálnak.
Ez azzal magyarázható, hogy a vérrögképződés megakadályozza a szükséges anyagok normális áramlását a létfontosságú szervekbe.
Ebben az esetben a vérlemezkék a kóros folyamatok oldalára állnak. A normától való eltérések csak gyógyszerek segítségével kezelhetők.
A normál és abnormális mutatók azonosításához kvantitatív elemzést kell végezni a pozitív és negatív aggregációról.
Fajták
Az orvosi gyakorlatban az aggregáció típus szerinti besorolása létezik. Ezek tartalmazzák:

- Mérsékelt összesítés. Főleg terhesség alatt diagnosztizálják. Az állapotot a placenta keringése válthatja ki.
- Spontán aggregáció. Az észleléshez nincs szükség induktorra. Az aggregációs aktivitás kimutatására vért öntenek egy kémcsőbe, amelyet egy speciális eszközbe helyeznek, ahol 37 fokra melegítik.
- Indukált aggregáció. A vizsgálat elvégzéséhez induktorokat adnak a plazmához. Ebben az esetben aggregáció történik ADP-vel, kollagénnel, ristomicinnel és adrenalinnal. Ezt a módszert olyan esetekben alkalmazzák, amikor szükség van a vérfolyadék bizonyos patológiáinak diagnosztizálására.
- A fokozott aggregáció elősegíti a vérrögképződést. Ennek a kóros állapotnak a jellegzetes tünetei a zsibbadás és a duzzanat.
- A csökkent aggregációt leggyakrabban a keringési rendszer működésének zavarai esetén észlelik. A vérlemezkeszám csökkenése különféle vérzéseket vált ki. A tisztességes nemnél a menstruációs ciklus alatt fordul elő.
Mind a megnövekedett, mind a csökkent aggregáció veszélyes az emberi egészségre. Ezért rendszeresen ellenőrizni kell a vérlemezkék szintjét a vérben.
A mutatóktól való eltérés tünetei
A hiperaggregációt a vér viszkozitásának növekedése és áramlási sebességének csökkenése kíséri, ami hátrányosan érinti az összes emberi rendszert és szervet.
Vannak azonban kóros állapotok, amikor a kifejezett aggregáció normális jelenség, ami viszont nem tekinthető oknak a véralvadási mutatók állandó tanulmányozásának megtagadására.
Ilyen betegségek közé tartoznak:
- megnövekedett vérnyomás;
- cukorbetegség;
- rák;
- érrendszeri patológiák.
A hiperaggregáció idő előtti észlelése és a segítség hiánya szívinfarktus, stroke és vénás trombózis kialakulásához vezethet.
Az aggregációs mutatók csökkenését elhúzódó vérzés kíséri, beleértve a belső vérzést is, amely hematómák képződésében nyilvánul meg.
Mi a norma
A vérlemezkeszint normái felnőtteknél és gyermekeknél kissé eltérnek. A mutatók optimális értékeit az alábbi táblázat mutatja be.
Ha normál aggregációs értékekről beszélünk, akkor ez 25-75 százalék lesz. Ebben az esetben a vérlemezkék eltérések nélkül összetapadnak, és nem jelentenek veszélyt az emberi szervezetre.
Milyen kutatások zajlanak?
A thrombocyta-aggregációs analizátor teljes vérkép. Vannak azonban más tanulmányok is, amelyek pontosabb eredményeket adnak. A fő módszerek a következő teszteket tartalmazzák:
.jpg)
- Lee-White szerint;
- koagulogram.
Lényük abban rejlik, hogy speciális anyagokat adnak a vérhez, amelyek gátolják az aggregációt.
Ezek az összetevők hasonlóak az emberi szervezetben lévő anyagokhoz, amelyek vérrögképződést okoznak. Az ilyen alkatrészeket induktoroknak nevezzük.
Felkészülés az elemzésre
Az elemzés elvégzése előtt bizonyos előkészületeken kell átesni. A lehető legpontosabb eredmények érdekében a vérfolyadék nem tartalmazhat olyan anyagokat, amelyek negatív hatással lehetnek rá.
Előkészítő tevékenységek:
- Egy héttel az elemzés előtt néhány aszpirin gyógyszert kizárnak, mivel használatuk elnyomja a trombusképződést. Ha ezeket a gyógyszereket nem lehet lemondani, értesíteni kell a vizsgálatot végző laboratóriumi technikust.
- 12 órára abba kell hagynia az étkezést. A termékek, különösen a magas zsírtartalmúak, szintén negatívan befolyásolják az eredményeket.
- Kerülje a fizikai és érzelmi stresszt.
- Napközben ne igyon alkoholos italokat, kávét, fokhagymát és ne dohányozzon.
Az elemzést elhalasztják, ha aktív gyulladásos folyamat van.
Véghezvitel
A vérvétel reggel 7 és 10 óra között történik. A vizsgálatot csak éhgyomorra lehet elvégezni. Csodálatos víz fogyasztása megengedett.
A hemoteszt elvégzéséhez vérfolyadékot vesznek a vénából. Erre a célra egy eldobható fecskendőt használnak. Ezt követően az anyagot 4%-os nátrium-citrát oldatot tartalmazó aggregométerbe helyezzük. Ezután a tartályt többször meg kell fordítani. Ezt követően a vércsövet a laboratóriumba küldik további vizsgálatokra.
Az eredmények dekódolása
A vizsgálat során használt anyag figyelembevételével az elemzés megfejtésre kerül. Ehhez a kapott mutatókat összehasonlítják a normál értékekkel, amelyeket az alábbiakban mutatunk be.
Ha a normához képest növekedést észlel, hiperaggregációt diagnosztizálnak. Olyan kóros állapotokban fordulhat elő, mint például:
.jpg)
- leukémia;
- a gyomor-bél traktus vagy a vesék patológiái;
- érelmeszesedés;
- cukorbetegség;
- magas vérnyomás;
- vérmérgezés;
- lymphogranulomatosis.
Ha az eltérések lefelé mutatnak, hipoaggregációt diagnosztizálnak. Ennek oka lehet a vér patológiája vagy a vérlemezke-gátló szerekkel végzett kezelés.
A százalék a plazma fényáteresztő képességének szintjét mutatja az induktor anyag hozzáadása után. Ha a vérlemezkeszám alacsony, ez az érték 100 százalék, ha pedig magas, akkor nulla.
Az aggregáció jellemzői terhes nőknél
Terhesség alatt megengedettek a normától való eltérések, amelyek ebben az időszakban 30-60 százalék.
A vérlemezkék hiánya, valamint minőségi összetételének változása esetén a szétesés figyelhető meg, amely vérzésben és zúzódásban nyilvánul meg.
Fokozott aggregáció lép fel a toxikózis során, amikor a beteg hányás vagy hasmenés következtében nagy folyadékveszteséget tapasztal. A vérkoncentráció növekedése fokozott vérrögképződést vált ki. Ez korai vetéléssel fenyeget.
Hogyan lehet normalizálni az értékeket?
Ha véralvadási rendellenességet diagnosztizálnak, azonnal intézkedni kell a kóros állapot megszüntetésére. Az aggregáció növekedése trombózishoz, a csökkenés pedig erős és veszélyes vérzéshez vezethet.
A hiperaggregáció kialakulásának kezdeti szakaszában a szakemberek olyan gyógyszereket írnak fel, amelyek hígíthatják a vért. A rendszeres aszpirin képes megbirkózni a feladattal.
A kiegészítő vizsgálat eredményei alapján gyakran a következőket írják elő:
.jpg)
- fájdalomcsillapítók;
- novokain blokád;
- vazodilatációt elősegítő gyógyszerek;
- antikoagulánsok, amelyek megakadályozzák a gyors véralvadást.
Néha a hagyományos módszerek nem kevésbé hatékonyak. Érdemes megjegyezni, hogy az ilyen kezelést a kezelőorvossal kell megegyezni.
A bevált receptek közé tartoznak a következők:
- Öntsön egy evőkanál édes lóherét 200 ml forralt vízbe, és hagyja 30 percig főzni. Használja az elkészített keveréket naponta több adagban. A terápia időtartama egy hónap.
- Főzzön másfél liter forrásban lévő vizet egyenlő mennyiségben (egy teáskanál) gyömbért és zöld teát. Adjunk hozzá egy csipet fahéjat. Hagyja hatni negyed órát, és vegye be a nap folyamán.
- Igyál minden nap frissen facsart narancslevet. Egyenlő arányban keverhető sütőtökkel.
Fontos a megfelelő táplálkozás fenntartása is. Az étrendnek tartalmaznia kell:
- citrusfélék;
- gyömbér;
- fokhagyma;
- piros és zöld zöldségek;
- tenger gyümölcsei.
Ha rossz a véralvadása, ne szedjen gyógyszereket. amelyek hígítják a vérfolyadékot. Ha a folyamat előrehaladott formát kapott, akkor a terápiás intézkedéseket csak álló körülmények között hajtják végre.
A következő gyógyszereket írják fel:

- Emosint;
- aminokapronsav és tranexámsav;
- ATP injekció;
Az étrendnek tartalmaznia kell hajdina zabkását, tojást, céklát és sárgarépát, gránátalmát, marhamájat és vörös húst.
A vér normál állapotának fenntartása érdekében szigorúan be kell tartani az ivási rendszert. Naponta legalább másfél liter tiszta víz számít normának. Az élelmiszernek frissnek és kiegyensúlyozottnak kell lennie.
A táplálkozási szabályok betartása az emberi szervezet számos betegségének megelőzése. Ugyanilyen fontos szerepet játszik a fizikai aktivitás is. Segítenek nemcsak a test erősítésében, hanem az összes belső folyamat normalizálásában is.
Az aggregációs mutatók eltéréseinek időben történő diagnosztizálásával számos betegség és szövődmény megelőzhető. A vérlemezke-aggregáció szintjét rendszeresen ellenőrizni kell.
A vérlemezkék kis vérsejtek, amelyek a véralvadásért felelősek. Segítenek megállítani a vérveszteséget, ha vérzés lép fel.
Seb esetén a vérlemezkék a sérült területre költöznek. Itt rögzítik a sérült ér falához, aminek következtében a vérzés leáll. Ezt a folyamatot vérlemezke-aggregációnak nevezik.
A vérlemezke-aggregáció egy olyan folyamat, amelyben a vérsejtek egymáshoz tapadnak, és rögzítik őket a sérült ér falán. Ez megállítja a vérzést. Egy ilyen folyamat azonban veszélyes is lehet a szervezetre. Ebben az esetben vérrög képződik, amely bizonyos körülmények között szívrohamot és szélütést okozhat. Ez akkor fordulhat elő, ha a vérlemezkék túlzottan aktívak, és az aggregáció túl gyorsan megy végbe.
Ráadásul a lassú folyamat sem ígér semmi jót a szervezetnek. Ebben az esetben a vérlemezkék lassú adhéziója miatt rossz véralvadás léphet fel. Ez a patológia vérszegénységet okoz. Ha rossz a véralvadás, nehéz megállítani a vérzést, ami egészségügyi problémákhoz és akár halálhoz is vezethet. Ennek elkerülése érdekében ellenőrizni kell a vérlemezkék szintjét a vérben és összetapadási képességüket.
A vérlemezke-aggregáció folyamata a terhesség alatt
 Rendkívül fontos, hogy a vérlemezke-aggregáció normálisan menjen végbe a terhesség alatt. Ha a folyamat túl lassan megy végbe, akkor a szülés során vagy a szülés utáni időszakban méhvérzés léphet fel, ami a nő halálához vezethet. Ezen túlmenően, ha a vérlemezke-aggregáció a terhesség alatt gyorsan megtörténik, vérrögök képződhetnek, amelyek a terhesség alatt bármely szakaszban a megszakításhoz vezethetnek.
Rendkívül fontos, hogy a vérlemezke-aggregáció normálisan menjen végbe a terhesség alatt. Ha a folyamat túl lassan megy végbe, akkor a szülés során vagy a szülés utáni időszakban méhvérzés léphet fel, ami a nő halálához vezethet. Ezen túlmenően, ha a vérlemezke-aggregáció a terhesség alatt gyorsan megtörténik, vérrögök képződhetnek, amelyek a terhesség alatt bármely szakaszban a megszakításhoz vezethetnek.
Ezt a helyzetet elkerülheti, ha előre megtervezi a terhességet és gondoskodik egészségéről. Már a fogantatás előtt meg kell találni, hogy a vérlemezkék milyen állapotban vannak, és szükség esetén intézkedéseket kell tenni a helyzet javítására. Ha a terhességet nem tervezték, akkor az aggregáció patológiája elkerülhető a korai regisztrációval. Ezután az orvos előírja a szükséges vizsgálatokat, és segít megszabadulni a vérlemezkék patológiás állapotától, ha észlel.
Normál vérlemezkeszám a vérben
A vérlemezkeszintek állapotának megismeréséhez ismernie kell a normális szintjét.
Ha az összesítési arányról beszélünk, akkor ez 25-75%. Ebben az esetben a vérlemezkék ragasztási folyamata jól megy végbe, és nem jelent egészségügyi veszélyt.
Ha a normától való eltéréseket észlelik, megfelelő kezelést írnak elő a helyzet javítása érdekében.Vérvizsgálat a vérlemezke-aggregációra
Az indukált aggregációnak nevezett vérvizsgálat segít a vérlemezkék állapotának tanulmányozásában. Ebben az esetben a vért a páciens vénájából veszik, és speciális anyagokkal keverik össze. Az ilyen szerek összetétele hasonló az aggregációs folyamatban részt vevő testsejtek összetételéhez. A következő anyagokat leggyakrabban induktornak tekintik:
- adenozin-difoszfát (ADP);
- kollagén;
- szerotonin;
- risztocetin;
- adrenalin;
- arachidonsav.
A leggyakrabban végzett eljárás a vérlemezke-aggregáció ADP-vel. A vizsgálat elvégzéséhez speciális eszközt kell venni. Ezt vérlemezke-aggregációs analizátornak hívják. Segítségével fényhullámok haladnak át a véren, mielőtt az elkezd alvadni, és miután ez a folyamat befejeződött. Ezután az eredményt értékelik.
Felkészülés a tesztekre
 Annak érdekében, hogy az eredmény a lehető legpontosabb legyen, a következő szabályokat kell követnie a vérvizsgálat során:
Annak érdekében, hogy az eredmény a lehető legpontosabb legyen, a következő szabályokat kell követnie a vérvizsgálat során:
- A vizsgálatot üres gyomorban végzik. Ebben az esetben a vizsgálat előtt 12 órával abba kell hagynia az evést. Ebben az esetben tiszta szénsavmentes vizet ihat.
- 7 nappal a vizsgálat előtt le kell állítani a gyógyszeres kezelést bizonyos gyógyszerekkel. Ha ez nem lehetséges, akkor értesítenie kell az elemzést végző orvost.
- Néhány nappal az elemzés előtt kerülni kell a stresszes helyzeteket és a fizikai aktivitást.
- 24 órával korábban abba kell hagynia a kávézást, a dohányzást, az alkoholfogyasztást és a fokhagymát.
- Nem végezhető kutatás, ha gyulladásos folyamat lép fel a szervezetben.
Az elemzés indikációi
 Saját kezdeményezésére időről időre elvégezhet vérlemezke-aggregációs tesztet.
Saját kezdeményezésére időről időre elvégezhet vérlemezke-aggregációs tesztet. Az indukált aggregáció elemzésének eredményének értelmezése
A mutatók értelmezése attól függ, hogy a vizsgálatot milyen eszközökkel végezték el. Ehhez az adatokat összehasonlítják a normával.
Ha az eredmények felfelé eltérnek a normától, akkor fokozott vérlemezke-aggregációt diagnosztizálnak. Ez az állapot akkor fordul elő, ha: 
- magas vérnyomás;
- érelmeszesedés;
- leukémia;
- diabetes mellitus;
- a gyomor-bél traktus vagy a vesék onkológiai betegségei;
- limfogranulomatózis;
- vérmérgezés;
- a lép sebészeti eltávolítása.
A megnövekedett thrombocyta-aggregáció szívrohamhoz, stroke-hoz, trombózishoz és halálhoz vezethet az ér trombus általi elzáródása miatt.
Ha az eredmények eltérnek a normától a csökkenés felé, akkor a trombózis csökkent aggregációját diagnosztizálják. Ennek oka, hogy:
- vérbetegségek;
- thrombocytopathia;
- vérlemezke-gátló szerek alkalmazása.
A csökkent aggregáció miatt az edények törékennyé válnak. Ezenkívül nehéz a vérzés megállításának folyamata, ami halált okozhat.
Az aggregációs folyamatot csökkentő eszközök
Egyes szerek gátolják az aggregációs folyamatot. Ezek a gyógyszerek közé tartoznak a vérlemezke-gátló szerek. A vérlemezke-aggregációt gátló szerek közé tartoznak az olyan gyógyszerek, mint az acetilszalicilsav, ibusztrin, mikrisztin és mások. Az ilyen gyógyszereket bizonyos betegségek kezelésére írják fel. Ha azonban az aggregációs folyamat élesen eltér a normától, akkor az inhibitorokat más szerekkel kell helyettesíteni, amelyek nem vezetnek ilyen következményekhez. Ha ez nem lehetséges, akkor az orvos speciális gyógyszereket írhat fel, amelyek elősegítik az aggregációt.
Mind a megnövekedett, mind a csökkent aggregáció súlyos következményekkel járhat. Ezért az ilyen helyzeteket nem lehet figyelmen kívül hagyni. Ilyen esetekben orvoshoz kell fordulni, hogy megfelelő kezelést írjon elő.