H2SO4 का आणविक सूत्र। सल्फ्यूरिक एसिड - रासायनिक गुण और औद्योगिक उत्पादन
संरचनात्मक सूत्र
सही, अनुभवजन्य या सकल सूत्र: H2SO4
सल्फ्यूरिक एसिड की रासायनिक संरचना
आणविक भार: 98.076
गंधक का तेजाबएच 2 एसओ 4 एक मजबूत डिबासिक एसिड है, जो सल्फर (+6) के उच्चतम ऑक्सीकरण राज्य के अनुरूप है। सामान्य परिस्थितियों में, केंद्रित सल्फ्यूरिक एसिड एक भारी तैलीय तरल, रंगहीन और गंधहीन होता है, जिसमें खट्टा "कॉपरी" स्वाद होता है। प्रौद्योगिकी में, सल्फ्यूरिक एसिड को पानी और सल्फ्यूरिक एनहाइड्राइड SO3 दोनों के साथ इसका मिश्रण कहा जाता है। यदि SO 3: H 2 O का दाढ़ अनुपात 1 से कम है, तो यह सल्फ्यूरिक एसिड का एक जलीय घोल है, यदि 1 से अधिक - सल्फ्यूरिक एसिड (ओलियम) में SO 3 का घोल।
नाम
XVIII-XIX सदियों में, विट्रियल पौधों में सल्फर पाइराइट्स (पाइराइट) से बारूद के लिए सल्फर का उत्पादन किया गया था। उस समय सल्फ्यूरिक एसिड को "विट्रियल ऑयल" कहा जाता था (एक नियम के रूप में यह एक क्रिस्टलीय हाइड्रेट था, जो स्थिरता में तेल जैसा दिखता था), इसलिए इसके लवण (या बल्कि क्रिस्टलीय हाइड्रेट्स) के नाम की उत्पत्ति - विट्रियल।
सल्फ्यूरिक एसिड प्राप्त करना
औद्योगिक (संपर्क) विधि
उद्योग में, सल्फ्यूरिक एसिड का उत्पादन सल्फर डाइऑक्साइड (सल्फर या पाइराइट के दहन के दौरान उत्पन्न सल्फर गैस) के ऑक्सीकरण से ट्राइऑक्साइड (सल्फ्यूरिक एनहाइड्राइड) में होता है, इसके बाद पानी के साथ SO 3 की बातचीत होती है। इस विधि द्वारा प्राप्त सल्फ्यूरिक अम्ल को संपर्क (एकाग्रता 92-94%) भी कहा जाता है।
नाइट्रस (टॉवर) विधि
पहले, सल्फ्यूरिक एसिड विशेष रूप से विशेष टावरों में नाइट्रस विधि द्वारा प्राप्त किया जाता था, और एसिड को टॉवर एसिड (75% एकाग्रता) कहा जाता था। इस विधि का सार पानी की उपस्थिति में नाइट्रोजन डाइऑक्साइड के साथ सल्फर डाइऑक्साइड का ऑक्सीकरण है।
एक और तरीका
उन दुर्लभ मामलों में जब हाइड्रोजन सल्फाइड (एच 2 एस) नमक से सल्फेट (एसओ 4 -) को विस्थापित करता है (धातुओं क्यू, एजी, पीबी, एचजी के साथ), सल्फ्यूरिक एसिड एक उप-उत्पाद है। इन धातुओं के सल्फाइड में सबसे अधिक ताकत होती है, साथ ही एक विशिष्ट काला रंग भी होता है।
भौतिक और भौतिक-रासायनिक गुण
एक बहुत मजबूत एसिड, 18 o C pK a (1) \u003d -2.8, pK a (2) \u003d 1.92 (K z 1.2 10 -2) पर; अणु में बंधन लंबाई एस = ओ 0.143 एनएम, एस-ओएच 0.154 एनएम, कोण एचओएसओएच 104 डिग्री, ओएसओ 119 डिग्री; फोड़े, एक एज़ोट्रोपिक मिश्रण (98.3% एच 2 एसओ 4 और 1.7% एच 2 ओ 338.8 डिग्री सेल्सियस के क्वथनांक के साथ) बनाते हैं। सल्फ्यूरिक एसिड, 100% एच 2 एसओ 4 सामग्री के अनुरूप, एक संरचना (%) है: एच 2 एसओ 4 99.5, एचएसओ 4 - - 0.18, एच 3 एसओ 4 + - 0.14, एच 3 ओ + - 0.09, एच 2 एस 2 ओ 7, - 0.04, एचएस 2 ओ 7 - - 0.05। पानी के साथ मिश्रणीय और सभी अनुपात में SO 3। जलीय घोल में, सल्फ्यूरिक एसिड लगभग पूरी तरह से एच 3 ओ +, एचएसओ 3 + और 2 एचएसओ 4 - में अलग हो जाता है। एच 2 एसओ 4 एनएच 2 ओ को हाइड्रेट करता है, जहां एन = 1, 2, 3, 4 और 6.5।
ओलियम
सल्फ्यूरिक एसिड में सल्फ्यूरिक एनहाइड्राइड SO 3 के घोल को ओलियम कहा जाता है, वे दो यौगिक H 2 SO 4 SO 3 और H 2 SO 4 2SO 3 बनाते हैं। ओलियम में पाइरोसल्फ्यूरिक एसिड भी होता है। सल्फ्यूरिक एसिड के जलीय घोल का क्वथनांक इसकी सांद्रता में वृद्धि के साथ बढ़ता है और अधिकतम 98.3% एच 2 एसओ 4 की सामग्री तक पहुंच जाता है। SO3 की मात्रा बढ़ने के साथ ओलियम का क्वथनांक कम हो जाता है। सल्फ्यूरिक एसिड के जलीय घोल की सांद्रता में वृद्धि के साथ, घोल पर कुल वाष्प दबाव कम हो जाता है और 98.3% H 2 SO 4 की सामग्री न्यूनतम तक पहुँच जाती है। ओलियम में SO3 की सांद्रता में वृद्धि के साथ, इसके ऊपर का कुल वाष्प दाब बढ़ जाता है। सल्फ्यूरिक एसिड और ओलियम के जलीय घोल पर वाष्प दबाव की गणना समीकरण द्वारा की जा सकती है:
लॉग पी=ए-बी/टी+2.126
गुणांक ए और बी के मान सल्फ्यूरिक एसिड की एकाग्रता पर निर्भर करते हैं। सल्फ्यूरिक एसिड के जलीय घोल पर भाप में जल वाष्प, एच 2 एसओ 4 और एसओ 3 का मिश्रण होता है, जबकि वाष्प की संरचना तरल की संरचना से संबंधित एज़ोट्रोपिक मिश्रण को छोड़कर, सल्फ्यूरिक एसिड की सभी सांद्रता में भिन्न होती है। जैसे-जैसे तापमान बढ़ता है, पृथक्करण बढ़ता है। ओलियम एच 2 एसओ 4 · एसओ 3 में अधिकतम चिपचिपाहट होती है, बढ़ते तापमान के साथ, घट जाती है। सल्फ्यूरिक एसिड का विद्युत प्रतिरोध SO 3 और 92% H 2 SO 4 की सांद्रता में न्यूनतम और 84 और 99.8% H 2 SO 4 की सांद्रता पर अधिकतम होता है। ओलियम के लिए, न्यूनतम 10% SO3 की सांद्रता पर होता है। जैसे-जैसे तापमान बढ़ता है, सल्फ्यूरिक एसिड का बढ़ता है। 100% सल्फ्यूरिक एसिड 101 (298.15 K), 122 (281.15 K) का ढांकता हुआ स्थिरांक; क्रायोस्कोपिक स्थिरांक 6.12, एबुलियोस्कोपिक स्थिरांक 5.33; हवा में सल्फ्यूरिक एसिड वाष्प का प्रसार गुणांक तापमान के साथ बदलता रहता है; डी = 1.67 10⁻⁵T3/2 सेमी²/एस।
रासायनिक गुण
गर्म होने पर सांद्रित रूप में सल्फ्यूरिक एसिड काफी मजबूत ऑक्सीकरण एजेंट होता है। HI और आंशिक रूप से HBr को मुक्त हैलोजन में ऑक्सीकृत करता है। कई धातुओं का ऑक्सीकरण करता है (अपवाद: Au, Pt, Ir, Rh, Ta.)। इस मामले में, केंद्रित सल्फ्यूरिक एसिड SO 2 तक कम हो जाता है। ठंड में सांद्र सल्फ्यूरिक एसिड में, Fe, Al, Cr, Co, Ni, Ba निष्क्रिय हो जाते हैं और प्रतिक्रियाएँ आगे नहीं बढ़ती हैं। सबसे मजबूत कम करने वाले एजेंटों के साथ, केंद्रित सल्फ्यूरिक एसिड एस और एच 2 एस तक कम हो जाता है। केंद्रित सल्फ्यूरिक एसिड जल वाष्प को अवशोषित करता है, इसलिए इसका उपयोग गैसों, तरल पदार्थों और ठोस पदार्थों को सुखाने के लिए किया जाता है, उदाहरण के लिए, desiccators में। हालांकि, हाइड्रोजन द्वारा सांद्र H2SO4 आंशिक रूप से कम हो जाता है, यही वजह है कि इसे सुखाने के लिए इसका उपयोग नहीं किया जा सकता है। कार्बनिक यौगिकों से पानी को अलग करने और एक ही समय में ब्लैक कार्बन (कोयला) छोड़ने से, केंद्रित सल्फ्यूरिक एसिड लकड़ी, चीनी और अन्य पदार्थों को जलाने का कारण बनता है। पतला एच 2 एसओ 4 उन सभी धातुओं के साथ बातचीत करता है जो हाइड्रोजन के बाईं ओर वोल्टेज की विद्युत रासायनिक श्रृंखला में हैं। तनु H2SO4 के लिए ऑक्सीकरण गुण अप्राप्य हैं। सल्फ्यूरिक एसिड लवण की दो श्रृंखला बनाता है: मध्यम - सल्फेट्स और अम्लीय - हाइड्रोसल्फेट्स, साथ ही एस्टर। Peroxomonosulfuric (या Caro's acid) H 2 SO 5 और peroxodisulfuric H 2 S 2 O 8 एसिड ज्ञात हैं। सल्फ्यूरिक एसिड भी मूल ऑक्साइड के साथ सल्फेट और पानी बनाने के लिए प्रतिक्रिया करता है। धातु संयंत्रों में, धातु उत्पादों की सतह से धातु ऑक्साइड की एक परत को हटाने के लिए एक सल्फ्यूरिक एसिड समाधान का उपयोग किया जाता है जो निर्माण प्रक्रिया के दौरान मजबूत हीटिंग के अधीन होते हैं। तो, सल्फ्यूरिक एसिड के गर्म घोल की क्रिया द्वारा लोहे के ऑक्साइड को शीट आयरन की सतह से हटा दिया जाता है। सल्फ्यूरिक एसिड और इसके घुलनशील लवण के लिए एक गुणात्मक प्रतिक्रिया घुलनशील बेरियम लवण के साथ उनकी बातचीत है, जिसमें बेरियम सल्फेट का एक सफेद अवक्षेप बनता है, उदाहरण के लिए पानी और एसिड में अघुलनशील।
आवेदन
सल्फ्यूरिक एसिड का उपयोग किया जाता है:
- अयस्कों के प्रसंस्करण में, विशेष रूप से यूरेनियम, इरिडियम, ज़िरकोनियम, ऑस्मियम, आदि सहित दुर्लभ तत्वों के निष्कर्षण में;
- खनिज उर्वरकों के उत्पादन में;
- लीड बैटरी में इलेक्ट्रोलाइट के रूप में;
- विभिन्न खनिज अम्ल और लवण प्राप्त करने के लिए;
- रासायनिक फाइबर, रंजक, धुआं बनाने और विस्फोटक पदार्थों के उत्पादन में;
- तेल, धातु, कपड़ा, चमड़ा और अन्य उद्योगों में;
- खाद्य उद्योग में - एक खाद्य योज्य E513 (पायसीकारक) के रूप में पंजीकृत;
- प्रतिक्रियाओं में औद्योगिक कार्बनिक संश्लेषण में:
- निर्जलीकरण (डायथाइल ईथर, एस्टर प्राप्त करना);
- जलयोजन (एथिलीन से इथेनॉल);
- सल्फोनेशन (रंगों के उत्पादन में सिंथेटिक डिटर्जेंट और मध्यवर्ती);
- क्षारीकरण (आइसोक्टेन, पॉलीइथाइलीन ग्लाइकॉल, कैप्रोलैक्टम प्राप्त करना), आदि।
- आसुत जल के उत्पादन में फिल्टर में रेजिन की वसूली के लिए।
सल्फ्यूरिक एसिड का विश्व उत्पादन लगभग। प्रति वर्ष 160 मिलियन टन। सल्फ्यूरिक एसिड का सबसे बड़ा उपभोक्ता खनिज उर्वरकों का उत्पादन है। पी 2 ओ 5 फॉस्फेट उर्वरकों के लिए, द्रव्यमान द्वारा 2.2-3.4 गुना अधिक सल्फ्यूरिक एसिड की खपत होती है, और (एनएच 4) 2 एसओ 4 सल्फ्यूरिक एसिड के लिए खपत के द्रव्यमान का 75% (एनएच 4) 2 एसओ 4। इसलिए, खनिज उर्वरकों के उत्पादन के लिए पौधों के संयोजन में सल्फ्यूरिक एसिड संयंत्रों का निर्माण किया जाता है।
ऐतिहासिक जानकारी
सल्फ्यूरिक एसिड प्राचीन काल से जाना जाता है, प्रकृति में मुक्त रूप में होता है, उदाहरण के लिए, ज्वालामुखियों के पास झीलों के रूप में। शायद फिटकरी या आयरन सल्फेट "ग्रीन स्टोन" को कैल्सीन करने से प्राप्त एसिड गैसों का पहला उल्लेख अरब कीमियागर जाबिर इब्न हेयान के लेखन में पाया जाता है। 9वीं शताब्दी में, फ़ारसी कीमियागर अर-राज़ी ने, लोहे और कॉपर सल्फेट (FeSO 4 7H 2 O और CuSO 4 5H 2 O) के मिश्रण को शांत करते हुए, सल्फ्यूरिक एसिड का एक घोल भी प्राप्त किया। इस पद्धति को यूरोपीय रसायनज्ञ अल्बर्ट मैग्नस द्वारा सिद्ध किया गया था, जो 13वीं शताब्दी में रहते थे। फेरस सल्फेट से सल्फ्यूरिक एसिड के उत्पादन की योजना - मिश्रण को ठंडा करने के बाद आयरन (II) सल्फेट का थर्मल अपघटन। कीमियागर वैलेंटाइन (XIII सदी) के लेखन में सल्फर और सॉल्टपीटर पाउडर के मिश्रण को पानी में जलाने से निकलने वाली गैस (सल्फ्यूरिक एनहाइड्राइड) को अवशोषित करके सल्फ्यूरिक एसिड बनाने की एक विधि का वर्णन किया गया है। इसके बाद, इस पद्धति ने तथाकथित का आधार बनाया। "कक्ष" विधि, सीसा के साथ पंक्तिबद्ध छोटे कक्षों में की जाती है, जो सल्फ्यूरिक एसिड में नहीं घुलती है। यूएसएसआर में, इस तरह की एक विधि 1955 तक मौजूद थी। 15 वीं शताब्दी के कीमियागर भी पाइराइट से सल्फ्यूरिक एसिड प्राप्त करने की एक विधि जानते थे - सल्फर पाइराइट, सल्फर की तुलना में एक सस्ता और अधिक सामान्य कच्चा माल। सल्फ्यूरिक एसिड इस तरह से 300 वर्षों तक कांच के मुंहतोड़ जवाबों में कम मात्रा में उत्पादित किया गया था। बाद में, कटैलिसीस के विकास के कारण, इस विधि ने सल्फ्यूरिक एसिड के संश्लेषण के लिए चैम्बर विधि को बदल दिया। वर्तमान में, सल्फ्यूरिक एसिड सल्फर ऑक्साइड (IV) के सल्फर ऑक्साइड (VI) के उत्प्रेरक ऑक्सीकरण (V 2 O 5 पर) द्वारा निर्मित होता है, और बाद में सल्फर ऑक्साइड (VI) के 70% सल्फ्यूरिक एसिड में ओलियम बनाने के लिए विघटन होता है। रूस में, सल्फ्यूरिक एसिड का उत्पादन पहली बार 1805 में मास्को के पास ज़ेवेनिगोरोड जिले में आयोजित किया गया था। 1913 में, रूस सल्फ्यूरिक एसिड के उत्पादन में दुनिया में 13 वें स्थान पर था।
अतिरिक्त जानकारी
सल्फर की बड़ी मात्रा में जल वाष्प और ज्वालामुखीय राख की प्रतिक्रिया के परिणामस्वरूप सल्फ्यूरिक एसिड की सबसे छोटी बूंदें मध्य और ऊपरी वातावरण में बन सकती हैं। सल्फ्यूरिक एसिड बादलों के उच्च एल्बीडो के कारण परिणामी निलंबन, सूर्य के प्रकाश को ग्रह की सतह तक पहुंचने में मुश्किल बनाता है। इसलिए (और ऊपरी वायुमंडल में बड़ी संख्या में ज्वालामुखी राख के छोटे कणों के परिणामस्वरूप, जो सूर्य के प्रकाश को ग्रह तक पहुंचने में भी मुश्किल बनाते हैं), विशेष रूप से मजबूत ज्वालामुखी विस्फोट के बाद महत्वपूर्ण जलवायु परिवर्तन हो सकते हैं। उदाहरण के लिए, Ksudach ज्वालामुखी (कामचटका प्रायद्वीप, 1907) के विस्फोट के परिणामस्वरूप, वातावरण में धूल की एक बढ़ी हुई सांद्रता लगभग 2 वर्षों तक बनी रही, और पेरिस में भी सल्फ्यूरिक एसिड के विशिष्ट चांदी के बादल देखे गए। 1991 में पिनातुबो ज्वालामुखी का विस्फोट, जिसने 3 10 7 टन सल्फर को वायुमंडल में भेजा, इस तथ्य को जन्म दिया कि 1992 और 1993 1991 और 1994 की तुलना में बहुत अधिक ठंडे थे।
मानकों
- सल्फ्यूरिक एसिड तकनीकी GOST 2184-77
- सल्फ्यूरिक एसिड बैटरी। निर्दिष्टीकरण गोस्ट 667-73
- विशेष शुद्धता का सल्फ्यूरिक अम्ल। निर्दिष्टीकरण गोस्ट 1422-78
- अभिकर्मक। सल्फ्यूरिक एसिड। निर्दिष्टीकरण गोस्ट 4204-77
सल्फ्यूरिक एसिड के भौतिक गुण:
भारी तैलीय तरल ("विट्रियल");
घनत्व 1.84 ग्राम/सेमी3; गैर-वाष्पशील, पानी में अत्यधिक घुलनशील - मजबूत हीटिंग के साथ; टी डिग्री पीएल। = 10.3 डिग्री सेल्सियस, बीपी \u003d 296 ° C, बहुत हीड्रोस्कोपिक, में पानी हटाने वाले गुण होते हैं (कागज, लकड़ी, चीनी का जलना)।
जलयोजन की गर्मी इतनी अधिक होती है कि मिश्रण उबल सकता है, छींटे पड़ सकता है और जलने का कारण बन सकता है। इसलिए, पानी में एसिड मिलाना आवश्यक है, न कि इसके विपरीत, क्योंकि जब एसिड में पानी मिलाया जाता है, तो हल्का पानी एसिड की सतह पर होगा, जहां से निकलने वाली सारी गर्मी केंद्रित होगी।

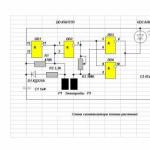
सल्फ्यूरिक एसिड का औद्योगिक उत्पादन (संपर्क विधि):
 1) 4FeS 2 + 11O 2 → 2Fe 2 O 3 + 8SO 2
1) 4FeS 2 + 11O 2 → 2Fe 2 O 3 + 8SO 2
2) 2SO 2 + O 2 V 2 O 5 → 2SO 3
3) एनएसओ 3 + एच 2 एसओ 4 → एच 2 एसओ 4 एनएसओ 3 (ओलियम)
कुचला हुआ शुद्ध गीला पाइराइट (सल्फर पाइराइट) ऊपर से भट्ठे में फायरिंग के लिए डाला जाता है " द्रविकृत बिस्तर". नीचे से (काउंटरफ्लो सिद्धांत) ऑक्सीजन से समृद्ध हवा के माध्यम से पारित किया जाता है।
फर्नेस गैस भट्ठी से निकलती है, जिसकी संरचना है: SO 2, O 2, जल वाष्प (पाइराइट गीला था) और सिंडर के सबसे छोटे कण (लौह ऑक्साइड)। गैस को ठोस कणों (एक चक्रवात और इलेक्ट्रोस्टैटिक प्रीसिपिटेटर में) और जल वाष्प (एक सुखाने वाले टॉवर में) की अशुद्धियों से शुद्ध किया जाता है।
संपर्क तंत्र में, प्रतिक्रिया दर बढ़ाने के लिए सल्फर डाइऑक्साइड को वी 2 ओ 5 उत्प्रेरक (वैनेडियम पेंटोक्साइड) का उपयोग करके ऑक्सीकरण किया जाता है। एक ऑक्साइड के दूसरे ऑक्साइड में ऑक्सीकरण की प्रक्रिया उत्क्रमणीय है। इसलिए, प्रत्यक्ष प्रतिक्रिया के दौरान इष्टतम स्थितियों का चयन किया जाता है - बढ़ा हुआ दबाव (क्योंकि प्रत्यक्ष प्रतिक्रिया कुल मात्रा में कमी के साथ आगे बढ़ती है) और तापमान 500 C से अधिक नहीं होता है (क्योंकि प्रतिक्रिया एक्ज़ोथिर्मिक है)।
अवशोषण टॉवर में, सल्फर ऑक्साइड (VI) को केंद्रित सल्फ्यूरिक एसिड द्वारा अवशोषित किया जाता है।
जल अवशोषण का उपयोग नहीं किया जाता है, क्योंकि सल्फर ऑक्साइड बड़ी मात्रा में गर्मी की रिहाई के साथ पानी में घुल जाता है, इसलिए परिणामस्वरूप सल्फ्यूरिक एसिड उबलता है और भाप में बदल जाता है। सल्फ्यूरिक एसिड धुंध के गठन से बचने के लिए, 98% केंद्रित सल्फ्यूरिक एसिड का उपयोग करें। सल्फर ऑक्साइड ऐसे एसिड में बहुत अच्छी तरह से घुल जाता है, जिससे ओलियम बनता है: एच 2 एसओ 4 एनएसओ 3
सल्फ्यूरिक एसिड के रासायनिक गुण:
एच 2 एसओ 4 एक मजबूत डिबासिक एसिड है, जो सबसे मजबूत खनिज एसिड में से एक है, उच्च ध्रुवीयता के कारण, एच - ओ बंधन आसानी से टूट जाता है।
1)
सल्फ्यूरिक एसिड जलीय घोल में घुल जाता है
, एक हाइड्रोजन आयन और एक एसिड अवशेष बनाते हैं:
एच 2 एसओ 4 \u003d एच + + एचएसओ 4 -;
एचएसओ 4 - \u003d एच + + एसओ 4 2-।
सारांश समीकरण:
एच 2 एसओ 4 \u003d 2 एच + + एसओ 4 2-।
2) धातुओं के साथ सल्फ्यूरिक एसिड की परस्पर क्रिया:
पतला सल्फ्यूरिक एसिड केवल हाइड्रोजन के बाईं ओर वोल्टेज श्रृंखला में धातुओं को घोलता है:
Zn 0 + H 2 +1 SO 4 (razb) → Zn +2 SO 4 + H 2
3)
सल्फ्यूरिक एसिड इंटरैक्शनमूल आक्साइड के साथ:
CuO + H 2 SO 4 → CuSO 4 + H 2 O
4)
सल्फ्यूरिक एसिड के साथ बातचीतहाइड्रॉक्साइड्स:
H 2 SO 4 + 2NaOH → Na 2 SO 4 + 2H 2 O
एच 2 SO 4 + Cu(OH) 2 → CuSO 4 + 2H 2 O
5)
लवण के साथ विनिमय अभिक्रियाएँ:
BaCl 2 + H 2 SO 4 → BaSO 4 ↓ + 2HCl
BaSO 4 (एसिड में अघुलनशील) के एक सफेद अवक्षेप के गठन का उपयोग सल्फ्यूरिक एसिड और घुलनशील सल्फेट्स (सल्फेट आयन के लिए गुणात्मक प्रतिक्रिया) का पता लगाने के लिए किया जाता है।
केंद्रित एच 2 एसओ 4 के विशेष गुण:
1) केंद्रित सल्फ्यूरिक एसिड है मजबूत ऑक्सीकरण एजेंट ; धातुओं के साथ बातचीत करते समय (एयू, पीटी को छोड़कर) धातु की गतिविधि के आधार पर एस +4 ओ 2, एस 0 या एच 2 एस -2 में पुनर्प्राप्त हो जाते हैं। गर्म किए बिना, यह Fe, Al, Cr - पैशन के साथ प्रतिक्रिया नहीं करता है। परिवर्तनीय वैलेंस वाली धातुओं के साथ बातचीत करते समय, बाद वाले ऑक्सीकृत हो जाते हैं उच्च ऑक्सीकरण राज्यों के लिए एक पतला एसिड समाधान के मामले में: Fe0→ फे 3+, सीआर 0→ सीआर 3+, एमएन 0→एमएन4+,एसएन 0→ एसएन 4+

सक्रिय धातु
8 अल + 15 एच 2 एसओ 4 (संक्षिप्त) → 4 एएल 2 (एसओ 4) 3 + 12 एच 2 ओ + 3 एच 2 एस
4│2अल 0 - 6 इ- → 2Al 3+ - ऑक्सीकरण
3│ एस 6+ + 8ई → एस 2- बहाली
4एमजी+ 5एच 2 एसओ 4 → 4एमजीएसओ 4 + एच 2 एस + 4एच 2 ओ
मध्यम गतिविधि धातु
2Cr + 4 H 2 SO 4 (संक्षिप्त) → Cr 2 (SO 4) 3 + 4 H 2 O + एस
1│ 2Cr 0 - 6e → 2Cr 3+ - ऑक्सीकरण
1│ एस 6+ + 6ई → एस 0 - रिकवरी
धातु निष्क्रिय
2Bi + 6H 2 SO 4 (संक्षिप्त) → Bi 2 (SO 4) 3 + 6H 2 O + 3 SO2
1│ 2Bi 0 - 6e → 2Bi 3+ - ऑक्सीकरण
3│ एस 6+ + 2ई →एस 4+ - रिकवरी
2Ag + 2H 2 SO 4 → Ag 2 SO 4 + SO 2 + 2H 2 O
2) सांद्र सल्फ्यूरिक एसिड कुछ गैर-धातुओं का ऑक्सीकरण करता है, एक नियम के रूप में, अधिकतम ऑक्सीकरण अवस्था में, यह स्वयं कम हो जाता हैएस+4O2:
C + 2H 2 SO 4 (संक्षिप्त) → CO 2 + 2SO 2 + 2H 2 O
S+ 2H 2 SO 4 (संक्षिप्त) → 3SO 2 + 2H 2 O
2P+ 5H 2 SO 4 (संक्षिप्त) → 5SO 2 + 2H 3 PO 4 + 2H 2 O
3) जटिल पदार्थों का ऑक्सीकरण:
सल्फ्यूरिक एसिड HI और HBr को मुक्त हैलोजन में ऑक्सीकृत करता है:
2 KBr + 2H 2 SO 4 \u003d K 2 SO 4 + SO 2 + Br 2 + 2H 2 O
2 केआई + 2एच 2 एसओ 4 \u003d के 2 एसओ 4 + एसओ 2 + आई 2 + 2 एच 2 ओ
केंद्रित सल्फ्यूरिक एसिड क्लोराइड आयनों को मुक्त क्लोरीन में ऑक्सीकरण नहीं कर सकता है, जिससे विनिमय प्रतिक्रिया द्वारा एचसीएल प्राप्त करना संभव हो जाता है:
NaCl + H 2 SO 4 (संक्षिप्त) = NaHSO 4 + HCl
सल्फ्यूरिक एसिड हाइड्रॉक्सिल समूहों वाले कार्बनिक यौगिकों से रासायनिक रूप से बाध्य पानी को हटा देता है। केंद्रित सल्फ्यूरिक एसिड की उपस्थिति में एथिल अल्कोहल के निर्जलीकरण से एथिलीन का उत्पादन होता है:
सी 2 एच 5 ओएच \u003d सी 2 एच 4 + एच 2 ओ।
सल्फ्यूरिक एसिड के संपर्क में आने पर चीनी, सेल्युलोज, स्टार्च और अन्य कार्बोहाइड्रेट का जलना भी उनके निर्जलीकरण द्वारा समझाया गया है:
सी 6 एच 12 ओ 6 + 12एच 2 एसओ 4 = 18 एच 2 ओ + 12एसओ 2 + 6सीओ 2।

लक्ष्य:सल्फ्यूरिक एसिड की संरचना, भौतिक और रासायनिक गुणों से परिचित होने के लिए।
शैक्षिक कार्य:सल्फ्यूरिक एसिड के भौतिक और रासायनिक गुणों (अन्य एसिड और विशिष्ट के साथ सामान्य) पर विचार करें, प्राप्त करना, राष्ट्रीय अर्थव्यवस्था में सल्फ्यूरिक एसिड और इसके लवण के महान महत्व को दर्शाता है।
शैक्षिक कार्य:छात्रों के बीच प्रकृति की द्वंद्वात्मक-भौतिकवादी समझ का निर्माण जारी रखना।
विकास कार्य:सामान्य शैक्षिक कौशल और क्षमताओं का विकास, पाठ्यपुस्तक और अतिरिक्त साहित्य के साथ काम करना, डेस्कटॉप पर काम करने के नियम, व्यवस्थित और सामान्यीकरण करने की क्षमता, कारण और प्रभाव संबंध स्थापित करना, अपने विचारों को निर्णायक और सक्षम रूप से व्यक्त करना, निष्कर्ष निकालना, चित्र बनाना , स्केच।
कक्षाओं के दौरान
1. अतीत की पुनरावृत्ति।
फ्रंटल क्लास सर्वे क्रिस्टलीय और प्लास्टिक सल्फर के गुणों की तुलना करें। अपररूपता का सार समझाइए।
2. नई सामग्री सीखना।
कहानी को ध्यान से सुनने के बाद, हम पाठ के अंत में समझाएंगे कि सल्फ्यूरिक एसिड ने पानी, लकड़ी और सोने की अंगूठी के साथ अजीब व्यवहार क्यों किया।
एक ऑडियो रिकॉर्डिंग की तरह लगता है।
सल्फ्यूरिक एसिड के एडवेंचर्स।
एक रासायनिक साम्राज्य में एक जादूगरनी रहती थी, उसका नाम था सल्फ्यूरिक एसिड. यह इतना बुरा नहीं लग रहा था, यह एक रंगहीन तरल, तेल जैसा चिपचिपा, गंधहीन था। गंधक का तेजाबमैं प्रसिद्ध होना चाहता था, इसलिए मैं एक यात्रा पर गया।
वह पहले से ही 5 घंटे से चल रही थी, और चूंकि दिन बहुत गर्म था, उसे बहुत प्यास लगी थी। और अचानक उसने एक कुआँ देखा। "पानी!" तेजाब चिल्लाया, और कुएँ की ओर दौड़ते हुए, उसने पानी को छुआ। पानी बुरी तरह फुफकार रहा था। एक रोने के साथ, भयभीत जादूगरनी भाग गई। बेशक, युवा एसिड को नहीं पता था कि मिश्रित होने पर सल्फ्यूरिक एसिडपानी बड़ी मात्रा में गर्मी छोड़ता है।
"अगर पानी के संपर्क में आता है सल्फ्यूरिक एसिड, तो पानी, एसिड के साथ मिश्रण करने का समय नहीं होने पर, उबाल सकता है और छींटे फेंक सकता है सल्फ्यूरिक एसिड. यह प्रविष्टि एक युवा यात्री की डायरी में दिखाई दी, और फिर पाठ्यपुस्तकों में प्रवेश किया।
चूंकि तेजाब ने उनकी प्यास नहीं बुझाई, इसलिए, एक विशाल पेड़ ने लेटने और छाया में आराम करने का फैसला किया। लेकिन वह भी सफल नहीं हुई। अस सून अस गंधक का तेजाबपेड़ को छुआ, वह चरने लगा। इसका कारण न जानकर भयभीत तेजाब भाग गया।
जल्द ही वह शहर आ गई और अपने रास्ते में आने वाली पहली दुकान में जाने का फैसला किया। वे गहने निकले। दुकान की खिड़कियों के पास तेजाब ने कई खूबसूरत अंगूठियां देखीं। गंधक का तेजाबमैंने एक अंगूठी की कोशिश करने का फैसला किया। विक्रेता से सोने की अंगूठी माँगते हुए यात्री ने उसे अपनी लंबी सुंदर उंगली पर रख दिया। जादूगरनी को वास्तव में अंगूठी पसंद आई और उसने इसे खरीदने का फैसला किया। यही वह अपने दोस्तों के लिए घमंड कर सकती थी!
शहर छोड़कर तेजाब घर चला गया। रास्ते में विचार ने उसका साथ नहीं छोड़ा, उसे छूने पर पानी और लकड़ी ने इतना अजीब व्यवहार क्यों किया, लेकिन इस सुनहरी चीज को कुछ नहीं हुआ? "हाँ, क्योंकि सोना अंदर है सल्फ्यूरिक एसिडऑक्सीकरण नहीं करता। ये उनकी डायरी में तेजाब द्वारा लिखे गए आखिरी शब्द थे।
शिक्षक की व्याख्या।
सल्फ्यूरिक एसिड के इलेक्ट्रॉनिक और संरचनात्मक सूत्र।
चूंकि सल्फर आवर्त प्रणाली की तीसरी अवधि में है, ऑक्टेट नियम (आठ इलेक्ट्रॉनिक संरचना) का सम्मान नहीं किया जाता है और एक सल्फर परमाणु बारह इलेक्ट्रॉनों तक प्राप्त कर सकता है। सल्फ्यूरिक एसिड के इलेक्ट्रॉनिक और संरचनात्मक सूत्र इस प्रकार हैं:
(सल्फर के छह इलेक्ट्रॉनों को तारक से चिह्नित किया जाता है)
रसीद।
सल्फ्यूरिक एसिड पानी के साथ सल्फर ऑक्साइड (5) की बातचीत से बनता है (SO 3 + H 2 O -> H 2 SO 4)।
भौतिक गुण।
सल्फ्यूरिक एसिड एक रंगहीन, भारी, गैर-वाष्पशील तरल है। पानी में घुलने पर बहुत तेज ताप होता है। उसे याद रखो सांद्र सल्फ्यूरिक एसिड में पानी न डालें!
सांद्र सल्फ्यूरिक एसिड हवा से जल वाष्प को अवशोषित करता है। यह देखा जा सकता है कि यदि केंद्रित सल्फ्यूरिक एसिड वाला एक खुला बर्तन पैमाने पर संतुलित है: थोड़ी देर बाद, बर्तन वाला कप डूब जाएगा।
रासायनिक गुण।
तनु सल्फ्यूरिक अम्ल में सभी अम्लों में समान गुण होते हैं। इसके अलावा, सल्फ्यूरिक एसिड में विशिष्ट गुण होते हैं।
सल्फ्यूरिक के रासायनिक गुण - अनुबंध .
एक मनोरंजक अनुभव के शिक्षक द्वारा प्रदर्शन।
संक्षिप्त सुरक्षा ब्रीफिंग।
एस्किमो (चीनी से चारकोल)
| उपकरण | अनुभव योजना | उत्पादन |
|
एक बीकर में 30 ग्राम पिसी चीनी डालें। 12 मिली सांद्र सल्फ्यूरिक एसिड को मापने के लिए एक बीकर का उपयोग करें। एक गिलास रॉड के साथ एक गिलास में चीनी और एसिड को एक भावपूर्ण द्रव्यमान में मिलाएं (कांच की छड़ को हटा दें और इसे एक गिलास पानी में डाल दें)। कुछ समय बाद, मिश्रण काला हो जाता है, गर्म हो जाता है, और जल्द ही कांच से एक झरझरा कोयला द्रव्यमान रेंगने लगता है - popsicle | सल्फ्यूरिक एसिड (केंद्रित) के साथ चीनी का कार्बोनाइजेशन इस एसिड के ऑक्सीकरण गुणों द्वारा समझाया गया है। कम करने वाला एजेंट कार्बन है। प्रक्रिया एक्ज़ोथिर्मिक है। 2H 2 SO 4 + C 12 O 11 + H22 -> 11C + 2SO 2 + 13H 2 O + CO 2 |
छात्र एक नोटबुक में मनोरंजक अनुभव के साथ एक तालिका भरते हैं।
छात्रों का तर्क है कि सल्फ्यूरिक एसिड ने पानी, लकड़ी और सोने के साथ इतना अजीब व्यवहार क्यों किया।
आवेदन।
इसके गुणों (पानी को अवशोषित करने की क्षमता, ऑक्सीकरण गुण, गैर-अस्थिरता) के कारण, राष्ट्रीय अर्थव्यवस्था में सल्फ्यूरिक एसिड का व्यापक रूप से उपयोग किया जाता है। यह रासायनिक उद्योग के मुख्य उत्पादों के अंतर्गत आता है।

- रंग प्राप्त करना;
- खनिज उर्वरक प्राप्त करना;
- तेल उत्पादों की सफाई;
- तांबे का इलेक्ट्रोलाइटिक उत्पादन;
- बैटरी में इलेक्ट्रोलाइट;
- विस्फोटक प्राप्त करना;
- रंग प्राप्त करना;
- कृत्रिम रेशम प्राप्त करना;
- ग्लूकोज प्राप्त करना;
- लवण प्राप्त करना;
- अम्ल प्राप्त करना।
उदाहरण के लिए, सल्फ्यूरिक एसिड के लवण व्यापक रूप से उपयोग किए जाते हैं
ना 2 एसओ 4 * 10एच 2 ओ- सोडियम सल्फेट क्रिस्टलीय हाइड्रेट (ग्लॉबर का नमक)- सोडा, कांच, दवा और पशु चिकित्सा में उपयोग किया जाता है।
CaSO4*2H2O- हाइड्रेटेड कैल्शियम सल्फेट (प्राकृतिक जिप्सम)- अर्ध-जलीय जिप्सम प्राप्त करने के लिए उपयोग किया जाता है, जो निर्माण में आवश्यक है, और दवा में - प्लास्टर पट्टियां लगाने के लिए।
CuSO4*5H2O- हाइड्रेटेड कॉपर सल्फेट (2) (कॉपर सल्फेट)- कीटों और पौधों की बीमारियों के खिलाफ लड़ाई में उपयोग किया जाता है।
पाठ्यपुस्तक के अतिरिक्त पाठ्य घटक के साथ छात्रों का कार्य।
यह दिलचस्प है
... कारा-बोगाज़-गोल खाड़ी में, पानी में +5 डिग्री सेल्सियस के तापमान पर 30% ग्लौबर का नमक होता है, यह नमक बर्फ की तरह सफेद अवक्षेप के रूप में और गर्म मौसम की शुरुआत के साथ अवक्षेपित होता है, नमक फिर से घुल जाता है। चूंकि इस खाड़ी में ग्लौबर का नमक प्रकट होता है और गायब हो जाता है, इसलिए इसका नाम रखा गया चमत्कारी, जिसका अर्थ है "अद्भुत नमक"।
3. बोर्ड पर लिखित शैक्षिक सामग्री को समेकित करने के लिए प्रश्न।
- सर्दियों में, कभी-कभी खिड़की के फ्रेम के बीच केंद्रित सल्फ्यूरिक एसिड वाला एक बर्तन रखा जाता है। ऐसा करने का उद्देश्य क्या है, बर्तन में ऊपर तक तेजाब क्यों नहीं भरा जा सकता?
- सल्फ्यूरिक एसिड को रसायन शास्त्र की "रोटी" क्यों कहा जाता है?
इसके कार्यान्वयन के लिए गृहकार्य और निर्देश।

जहाँ उपयुक्त हो, समीकरणों को आयनिक रूप में लिखिए।
पाठ पर निष्कर्ष, सेटिंग और टिप्पणी अंक।
सन्दर्भ।
- रुडजाइटिस जीई फेल्डमैन एफजी, रसायन विज्ञान: 2 घंटे में एक शाम (शिफ्ट) माध्यमिक विद्यालय के ग्रेड 7-11 के लिए एक पाठ्यपुस्तक। भाग 1-3 संस्करण - एम।: शिक्षा, 1987।
- स्कूल नंबर 6, 1991 में रसायन विज्ञान।
- स्ट्रेम्पलर जेनरिख इवानोविच, अवकाश पर रसायन विज्ञान: पुस्तक। छात्रों के लिए बुधवार। और पुराना। आयु / अंजीर। ईडी। वी.एन. की भागीदारी के साथ रस्तोपचिनी।- एफ।: चौ। ईडी। केएसई, 1990।
इसका एक ऐतिहासिक नाम है: विट्रियल ऑयल। एसिड का अध्ययन प्राचीन काल में शुरू हुआ, यह उनके लेखन में ग्रीक चिकित्सक डायोस्कोराइड्स, रोमन प्रकृतिवादी प्लिनी द एल्डर, इस्लामिक कीमियागर गेबर, रज़ी और इब्न सिना और अन्य द्वारा वर्णित किया गया था। सुमेरियों में, विट्रियल की एक सूची थी, जिसे पदार्थ के रंग के अनुसार वर्गीकृत किया गया था। आजकल, शब्द "विट्रियल" द्विसंयोजक धातु सल्फेट्स के क्रिस्टलीय हाइड्रेट्स को जोड़ता है।
17वीं शताब्दी में, जर्मन-डच केमिस्ट जोहान ग्लौबर ने किसकी उपस्थिति में सल्फर (KNO3) को जलाकर सल्फ्यूरिक एसिड प्राप्त किया। 1736 में, जोशुआ वार्ड (लंदन के फार्मासिस्ट) ने उत्पादन में इस पद्धति का इस्तेमाल किया। इस समय को एक प्रारंभिक बिंदु माना जा सकता है, जब सल्फ्यूरिक एसिड का बड़े पैमाने पर उत्पादन शुरू हुआ। इसका सूत्र (H2SO4), जैसा कि आमतौर पर माना जाता है, स्वीडिश रसायनज्ञ बर्ज़ेलियस (1779-1848) द्वारा थोड़ी देर बाद स्थापित किया गया था।
बर्ज़ेलियस ने अक्षर प्रतीकों (रासायनिक तत्वों को दर्शाते हुए) और सबस्क्रिप्ट (एक अणु में दिए गए प्रकार के परमाणुओं की संख्या को इंगित करते हुए) का उपयोग करते हुए पाया कि एक अणु में 1 सल्फर परमाणु (S), 2 हाइड्रोजन परमाणु (H) और 4 ऑक्सीजन परमाणु होते हैं। ओ)। उस समय से, अणु की गुणात्मक और मात्रात्मक संरचना ज्ञात हो गई है, अर्थात, रसायन विज्ञान की भाषा में सल्फ्यूरिक एसिड का वर्णन किया गया है।
एक अणु में परमाणुओं की पारस्परिक व्यवस्था और उनके बीच रासायनिक बंधन (वे आमतौर पर रेखाओं द्वारा दर्शाए जाते हैं) को ग्राफिकल रूप में दिखाते हुए सूचित करता है कि अणु के केंद्र में एक सल्फर परमाणु होता है, जो दो ऑक्सीजन के साथ दोहरे बंधन से जुड़ा होता है परमाणु। अन्य दो ऑक्सीजन परमाणुओं के साथ, जिनमें से प्रत्येक में एक हाइड्रोजन परमाणु जुड़ा होता है, वही सल्फर परमाणु एकल बंधों द्वारा जुड़ा होता है।
गुण
सल्फ्यूरिक एसिड थोड़ा पीला या रंगहीन, चिपचिपा तरल होता है, जो किसी भी सांद्रता में पानी में घुलनशील होता है। यह एक मजबूत खनिज है और धातुओं के प्रति अत्यधिक आक्रामक है (केंद्रित बिना गर्म किए लोहे के साथ बातचीत नहीं करता है, लेकिन इसे निष्क्रिय कर देता है), चट्टानों, जानवरों के ऊतकों या अन्य सामग्री। यह एक मजबूत ऑक्सीकरण एजेंट के उच्च हीड्रोस्कोपिसिटी और स्पष्ट गुणों की विशेषता है। 10.4 डिग्री सेल्सियस के तापमान पर, एसिड जम जाता है। जब 300 डिग्री सेल्सियस तक गर्म किया जाता है, तो लगभग 99% एसिड सल्फ्यूरिक एनहाइड्राइड (SO3) खो देता है।
इसके जलीय घोल की सांद्रता के आधार पर इसके गुण बदलते हैं। अम्ल विलयन के सामान्य नाम हैं। पतला एसिड 10% तक माना जाता है। बैटरी - 29 से 32% तक। 75% से कम की सांद्रता पर (जैसा कि GOST 2184 में स्थापित किया गया है), इसे टॉवर कहा जाता है। यदि सांद्रता 98% है, तो यह पहले से ही केंद्रित सल्फ्यूरिक एसिड होगा। सूत्र (रासायनिक या संरचनात्मक) सभी मामलों में अपरिवर्तित रहता है।
जब सांद्र सल्फ्यूरिक एनहाइड्राइड सल्फ्यूरिक एसिड में घुल जाता है, तो ओलियम या फ्यूमिंग सल्फ्यूरिक एसिड बनता है, इसका सूत्र इस प्रकार लिखा जा सकता है: H2S2O7। शुद्ध अम्ल (H2S2O7) 36°C के गलनांक वाला ठोस है। सल्फ्यूरिक एसिड जलयोजन प्रतिक्रियाओं को बड़ी मात्रा में गर्मी की रिहाई की विशेषता है।
एक तनु अम्ल धातुओं के साथ प्रतिक्रिया करता है, जिसके साथ यह एक मजबूत ऑक्सीकरण एजेंट के गुणों को प्रदर्शित करता है। इस मामले में, सल्फ्यूरिक एसिड कम हो जाता है, गठित पदार्थों का सूत्र कम (+4, 0 या -2 तक) सल्फर परमाणु हो सकता है: SO2, S या H2S।
गैर-धातुओं जैसे कार्बन या सल्फर के साथ प्रतिक्रिया करता है:
2 H2SO4 + C → 2 SO2 + CO2 + 2 H2O
2 H2SO4 + S → 3 SO2 + 2 H2O
सोडियम क्लोराइड के साथ प्रतिक्रिया करता है:
H2SO4 + NaCl → NaHSO4 + HCl
यह -SO3H समूह द्वारा एक सुगंधित यौगिक के बेंजीन रिंग से जुड़े हाइड्रोजन परमाणु के इलेक्ट्रोफिलिक प्रतिस्थापन की प्रतिक्रिया की विशेषता है।
रसीद
1831 में, H2SO4 प्राप्त करने के लिए संपर्क विधि का पेटेंट कराया गया था, जो वर्तमान में मुख्य है। आज अधिकांश सल्फ्यूरिक अम्ल इसी विधि से निर्मित होते हैं। सल्फाइड अयस्क (ज्यादातर लौह पाइराइट FeS2) का उपयोग कच्चे माल के रूप में किया जाता है, जिसे विशेष भट्टियों में जलाया जाता है, और रोस्टिंग गैस बनती है। चूंकि गैस का तापमान 900 डिग्री सेल्सियस है, इसलिए इसे सल्फ्यूरिक एसिड से 70% की एकाग्रता के साथ ठंडा किया जाता है। फिर गैस को चक्रवात और इलेक्ट्रोस्टैटिक प्रीसिपिटेटर में धूल से साफ किया जाता है, 40 और 10% उत्प्रेरक जहर (As2O5 और फ्लोरीन) के साथ एसिड के साथ टावरों को धोने में, और एसिड एरोसोल से गीले इलेक्ट्रोस्टैटिक प्रीसिपिटेटर पर। इसके बाद, 9% सल्फर डाइऑक्साइड (SO2) युक्त रोस्टिंग गैस को सुखाया जाता है और संपर्क तंत्र में डाला जाता है। वैनेडियम उत्प्रेरक की 3 परतों से गुजरने के बाद, SO2 को SO3 में ऑक्सीकृत किया जाता है। गठित सल्फ्यूरिक एनहाइड्राइड को भंग करने के लिए, केंद्रित सल्फ्यूरिक एसिड का उपयोग किया जाता है। निर्जल सल्फ्यूरिक एसिड में सल्फ्यूरिक एनहाइड्राइड (SO3) के घोल का सूत्र H2S2O7 है। इस रूप में, ओलियम को स्टील के टैंकों में उपभोक्ता तक पहुँचाया जाता है, जहाँ इसे वांछित सांद्रता में पतला किया जाता है।
आवेदन
इसके विभिन्न रासायनिक गुणों के कारण, H2SO4 में अनुप्रयोगों की एक विस्तृत श्रृंखला है। एसिड के उत्पादन में, सीसा-एसिड बैटरी में इलेक्ट्रोलाइट के रूप में, विभिन्न सफाई एजेंटों के निर्माण के लिए, यह रासायनिक उद्योग में एक महत्वपूर्ण अभिकर्मक भी है। इसका उपयोग अल्कोहल, प्लास्टिक, रंजक, रबर, ईथर, चिपकने वाले, साबुन और डिटर्जेंट, फार्मास्यूटिकल्स, लुगदी और कागज, पेट्रोलियम उत्पादों के उत्पादन में भी किया जाता है।
कोई भी अम्ल एक जटिल पदार्थ होता है, जिसके अणु में एक या अधिक हाइड्रोजन परमाणु और एक अम्ल अवशेष होता है।
सल्फ्यूरिक अम्ल का सूत्र H2SO4 होता है। इसलिए, सल्फ्यूरिक एसिड अणु की संरचना में दो हाइड्रोजन परमाणु और एसिड अवशेष SO4 शामिल हैं।
सल्फ्यूरिक एसिड तब बनता है जब सल्फर ऑक्साइड पानी के साथ प्रतिक्रिया करता है
SO3+H2O -> H2SO4
शुद्ध 100% सल्फ्यूरिक एसिड (मोनोहाइड्रेट) एक खट्टा "तांबे" स्वाद के साथ एक भारी तरल, तेल जैसा चिपचिपा, रंगहीन और गंधहीन होता है। पहले से ही +10 डिग्री सेल्सियस के तापमान पर, यह जम जाता है और क्रिस्टलीय द्रव्यमान में बदल जाता है।
सांद्र सल्फ्यूरिक एसिड में लगभग 95% H2SO4 होता है। और यह -20 डिग्री सेल्सियस से नीचे के तापमान पर जम जाता है।
पानी के साथ बातचीत

सल्फ्यूरिक एसिड पानी में अत्यधिक घुलनशील होता है, इसके साथ किसी भी अनुपात में मिलाता है। इससे बड़ी मात्रा में गर्मी निकलती है।
सल्फ्यूरिक एसिड हवा से जल वाष्प को अवशोषित करने में सक्षम है। इस संपत्ति का उपयोग उद्योग में गैसों को सुखाने के लिए किया जाता है। गैसों को सल्फ्यूरिक एसिड वाले विशेष कंटेनरों से गुजार कर सुखाया जाता है। बेशक, इस पद्धति का उपयोग केवल उन गैसों के लिए किया जा सकता है जो इसके साथ प्रतिक्रिया नहीं करते हैं।
यह ज्ञात है कि जब सल्फ्यूरिक एसिड कई कार्बनिक पदार्थों, विशेष रूप से कार्बोहाइड्रेट के संपर्क में आता है, तो ये पदार्थ जल जाते हैं। तथ्य यह है कि पानी की तरह कार्बोहाइड्रेट में हाइड्रोजन और ऑक्सीजन दोनों होते हैं। सल्फ्यूरिक अम्ल इन तत्वों को नष्ट कर देता है। जो बचा है वह कोयला है।
H2SO4 के जलीय घोल में संकेतक लिटमस और मिथाइल ऑरेंज लाल हो जाते हैं, जो दर्शाता है कि इस घोल का स्वाद खट्टा है।
धातुओं के साथ बातचीत
किसी भी अन्य एसिड की तरह, सल्फ्यूरिक एसिड अपने अणु में धातु परमाणुओं के साथ हाइड्रोजन परमाणुओं को बदलने में सक्षम है। यह लगभग सभी धातुओं के साथ परस्पर क्रिया करता है।
तनु सल्फ्यूरिक अम्लएक सामान्य अम्ल की तरह धातुओं के साथ प्रतिक्रिया करता है। प्रतिक्रिया के परिणामस्वरूप, एक अम्लीय अवशेष SO4 और हाइड्रोजन के साथ एक नमक बनता है।
Zn + H2SO4 = ZnSO4 + H2
लेकिन केंद्रित सल्फ्यूरिक एसिडएक बहुत मजबूत ऑक्सीकरण एजेंट है। वोल्टेज श्रृंखला में उनकी स्थिति की परवाह किए बिना, यह सभी धातुओं का ऑक्सीकरण करता है। और धातुओं के साथ प्रतिक्रिया करने पर, यह स्वयं SO2 में कम हो जाता है। हाइड्रोजन नहीं निकलती है।
u + 2 H2SO4 (संक्षिप्त) = CuSO4 + SO2 + 2H2O
Zn + 2 H2SO4 (संक्षिप्त) = ZnSO4 + SO2 + 2H2O
लेकिन सल्फ्यूरिक एसिड में सोना, लोहा, एल्युमिनियम, प्लेटिनम समूह की धातुएं ऑक्सीकृत नहीं होती हैं। इसलिए, सल्फ्यूरिक एसिड को स्टील के टैंकों में ले जाया जाता है।
सल्फ्यूरिक एसिड लवण, जो ऐसी प्रतिक्रियाओं के परिणामस्वरूप प्राप्त होते हैं, सल्फेट कहलाते हैं। वे रंगहीन होते हैं और आसानी से क्रिस्टलीकृत हो जाते हैं। उनमें से कुछ पानी में अत्यधिक घुलनशील हैं। केवल CaSO4 और PbSO4 विरल रूप से घुलनशील हैं। BaSO4 पानी में लगभग अघुलनशील है।
ठिकानों के साथ बातचीत

अम्ल और क्षार की अभिक्रिया उदासीनीकरण अभिक्रिया कहलाती है। सल्फ्यूरिक एसिड न्यूट्रलाइजेशन प्रतिक्रिया के परिणामस्वरूप, एसिड अवशेष SO4 और पानी H2O युक्त एक नमक बनता है।
सल्फ्यूरिक एसिड न्यूट्रलाइजेशन प्रतिक्रियाओं के उदाहरण:
H2SO4 + 2 NaOH = Na2SO4 + 2 H2O
H2SO4 + CaOH = CaSO4 + 2 H2O
सल्फ्यूरिक एसिड घुलनशील और अघुलनशील दोनों आधारों के साथ एक उदासीनीकरण प्रतिक्रिया में प्रवेश करता है।
चूंकि सल्फ्यूरिक एसिड अणु में दो हाइड्रोजन परमाणु होते हैं, और इसे बेअसर करने के लिए दो आधारों की आवश्यकता होती है, यह डिबासिक एसिड से संबंधित है।
बुनियादी आक्साइड के साथ बातचीत
स्कूल रसायन विज्ञान पाठ्यक्रम से हम जानते हैं कि ऑक्साइड जटिल पदार्थ कहलाते हैं, जिनमें दो रासायनिक तत्व शामिल होते हैं, जिनमें से एक ऑक्सीकरण अवस्था -2 में ऑक्सीजन होता है। मूल ऑक्साइड 1, 2 और कुछ 3 संयोजकता धातुओं के ऑक्साइड कहलाते हैं। मूल ऑक्साइड के उदाहरण: Li2O, Na2O, CuO, Ag2O, MgO, CaO, FeO, NiO।
मूल ऑक्साइड के साथ, सल्फ्यूरिक एसिड एक उदासीनीकरण प्रतिक्रिया में प्रवेश करता है। ऐसी प्रतिक्रिया के परिणामस्वरूप, जैसे कि क्षार के साथ प्रतिक्रिया में, नमक और पानी बनते हैं। नमक में एसिड अवशेष SO4 होता है।
CuO + H2SO4 = CuSO4 + H2O
नमक बातचीत
सल्फ्यूरिक एसिड कमजोर या वाष्पशील एसिड के लवण के साथ प्रतिक्रिया करता है, इन एसिड को उनसे विस्थापित करता है। इस प्रतिक्रिया के परिणामस्वरूप, एक अम्लीय अवशेष SO4 और एक एसिड के साथ एक नमक
H2SO4+BaCl2=BaSO4+2HCl
सल्फ्यूरिक एसिड और उसके यौगिकों का उपयोग

बेरियम दलिया BaSO4 एक्स-रे में देरी करने में सक्षम है। इसे मानव शरीर के खोखले अंगों से भरकर रेडियोलॉजिस्ट उनकी जांच करते हैं।
दवा और निर्माण में, प्राकृतिक जिप्सम CaSO4 * 2H2O, कैल्शियम सल्फेट हाइड्रेट का व्यापक रूप से उपयोग किया जाता है। Glauber का नमक Na2SO4 * 10H2O का उपयोग दवा और पशु चिकित्सा में, रासायनिक उद्योग में - सोडा और कांच के उत्पादन के लिए किया जाता है। कॉपर सल्फेट CuSO4 * 5H2O बागवानों और कृषिविदों के लिए जाना जाता है जो इसका उपयोग कीटों और पौधों की बीमारियों को नियंत्रित करने के लिए करते हैं।
सल्फ्यूरिक एसिड का व्यापक रूप से विभिन्न उद्योगों में उपयोग किया जाता है: रासायनिक, धातु, पेट्रोलियम, कपड़ा, चमड़ा और अन्य।