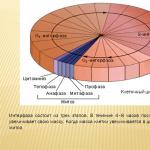
Застосування кисню презентація до уроку з хімії (8 клас) на тему. Презентація на тему "застосування кисню"; б) розкладанням води
1 слайд
Презентацію підготувала Учениця 9 класу МОУ «Ліцей м. Відрадне» Смирнова Роксана

2 слайд
Кисень як елемент. 1. Елемент кисень знаходиться у VI групі, головній підгрупі, II періоді, порядковий номер №8, 2. Будова атома: P11 = 8; n01 = 8; ē = 8 валентність II, ступінь окислення -2 (рідко +2; +1; -1). 3. Входить до складу оксидів, основ, солей, кислот, органічних речовин, у тому числі живих організмів – до 65% за масою.

3 слайд
Кисень як елемент. Кисень є найпоширенішим елементом нашої планети. За вагою його припадає приблизно половина загальної маси всіх елементів земної кори. Склад повітря: О2 - 20-21%; N2 – 78%; CO2 – 0,03%, решта посідає інертні гази, пари води, домішки. 4. У земній корі його 49% масою, в гідросфері – 89% масою. 5. У складі повітря (у вигляді простої речовини) – 20-21% за обсягом. 6. Входить до складу більшості мінеральних і гірських порід (пісок, глини та ін). У складі повітря (у вигляді простої речовини). 7. Життєво важливий елемент для всіх організмів, що міститься в більшості органічних речовин, бере участь у багатьох біохімічних процесах, що забезпечують розвиток та функціонування життя. 8. Кисень відкритий у 1769-1771 рр. шведським хіміком К.-В. Шеєле

4 слайд
Фізичні властивості. Кисень – хімічно активний неметал, є найлегшим елементом із групи халькогенів. Проста речовина кисень за нормальних умов - газ без кольору, смаку та запаху, молекула якого складається з двох атомів кисню, у зв'язку з чим його також називають дикисень. Рідкий кисень має світло-блакитний колір, а твердий є кристалами світло-синього кольору.

5 слайд
Хімічні властивості. З неметалами C + O2 CO2 S + O2 SO2 2H2 + O2 2H2O Зі складними речовинами 4FeS2 + 11O2 2Fe2O3 + 8SO2 uO Взаємодія речовин з киснем називається окисленням. З киснем реагують всі елементи, крім Au, Pt, He, Ne та Ar, у всіх реакціях (крім взаємодії з фтором) кисень - окислювач. 1. Нестійкий: O3 O2 + O 2. Сильний окислювач: 2KI + O3 + H2O 2KOH + I2 + O2 Знебарвлює барвники, відбиває УФ - промені, знищує мікроорганізми.

6 слайд
Способи одержання. Промисловий метод (перегонка рідкого повітря). Лабораторний спосіб (розкладання деяких кисневмісних речовин) 2KClO3 –t; MnO2 2KCl + 3O2 2H2O2 –MnO2 2H2O + O2

7 слайд
Перевірка кисню, що зібрався. Отримання 3O2 2O3 Під час грози (в природі), (в лабораторії) в озонаторі калію перманганату при нагріванні: 2KMnO4 –t K2MnO4 + MnO2 + O2 Розкладання цієї солі йде при нагріванні її вище 2000 С.

8 слайд
Застосування кисню: Знаходить широке застосування в медицині та промисловості. При висотних польотах льотчиків постачають спеціальними приладами з киснем. При багатьох легеневих та серцевих захворюваннях, а також при операціях дають вдихати кисень із кисневих подушок. Киснем у балонах постачають підводні човни. Горіння пухкого пального матеріалу, просоченого рідким киснем, супроводжується вибухом, що дозволяє застосовувати кисень при вибухових роботах. Рідкий кисень застосовують у реактивних двигунах, в автогенному зварюванні та різанні металів, навіть під водою.
Слайд 2
КИСНЕ
Кисень - 16-й елемент головної підгрупи VI групи, другого періоду періодичної системи хімічних елементів Д. І. Менделєєва, з атомним номером 8. Позначається символом O (лат. Oxygenium). Кисень – хімічно активний неметал, є найлегшим елементом із групи халькогенів. Проста речовина кисень за нормальних умов - газ без кольору, смаку та запаху, молекула якого складається з двох атомів кисню (формула O2), у зв'язку з чим його також називають дикисень. Рідкий кисень має світло-блакитний колір, а твердий є кристалами світло-синього кольору.
Слайд 3
Офіційно вважається, що кисень був відкритий англійським хіміком Джозефом Прістлі 1 серпня 1774 шляхом розкладання оксиду ртуті в герметично закритій посудині (Прістлі направляв на це з'єднання сонячні промені за допомогою потужної лінзи). Однак Прістлі спочатку не зрозумів, що відкрив нову просту речовину, він вважав, що виділив одну із складових частин повітря (і назвав цей газ «дефлогістованим повітрям»). Про своє відкриття Прістлі повідомив видатному французькому хіміку Антуану Лавуазьє. У 1775 році А. Лавуазьє встановив, що кисень є складовою повітря, кислот і міститься в багатьох речовинах. Декількома роками раніше (1771 року) кисень отримав шведський хімік Карл Шееле. Він прожарював селітру з сірчаною кислотою і потім розкладав оксид азоту, що вийшов. Шееле назвав цей газ «вогненним повітрям» і описав своє відкриття у виданій у 1777 році книзі (саме тому, що книга опублікована пізніше, ніж повідомив про своє відкриття Прістлі, останній і вважається першовідкривачем кисню). Шееле також повідомив про свій досвід Лавуазьє. Важливим етапом, який сприяв відкриттю кисню, були роботи французького хіміка П'єра Байєна, який опублікував роботи з окислення ртуті та подальшого розкладання її оксиду. Нарешті остаточно розібрався в природі отриманого газу А. Лавуазьє, який скористався інформацією від Прістлі та Шееле. Його робота мала величезне значення, тому що завдяки їй була повалена панувала на той час і гальмувала розвиток хімії флогістонна теорія. Лавуазьє провів досвід зі спалювання різних речовин і спростував теорію флогістону, опублікувавши результати ваги спалених елементів. Вага золи перевищувала початкову вагу елемента, що дало Лавуазьє право стверджувати, що при горінні відбувається хімічна реакція (окислення) речовини, у зв'язку з цим маса вихідної речовини збільшується, що спростовує теорію флогістону. Таким чином, заслугу відкриття кисню фактично ділять між собою Прістлі, Шееле та Лавуазьє. ВІДКРИТТЯ КИСНУ
Слайд 4
Слайд 5
Широке промислове застосування кисню почалося в середині ХХ століття, після винаходу турбодетандерів - пристроїв для зрідження та поділу. Застосування кисню дуже різноманітне і ґрунтується на його хімічних властивостях. Хімічна та нафтохімічна промисловість. Кисень використовується для окислення вихідних реагентів, утворюючи азотну кислоту, етиленоксид, пропіленоксид, вінілхлорид та інші основні сполуки. Крім цього він може використовуватися для збільшення продуктивності сміттєспалювальних печей. Нафтогазова промисловість. Збільшення продуктивності процесів крекінгу нафти, переробки високооктанових сполук, закачування в пласт підвищення енергії витіснення.
Слайд 6
Застосування кисню
Скляна промисловість. У скловарних печах кисень використовується для покращення горіння. Крім цього, він застосовується для зменшення викидів оксидів азоту до безпечних рівнів. Целюлозно-паперова промисловість. Кисень використовується при делігніфікації, спиртуванні та інших процесах. Медичний кисень зберігається в металевих газових балонах високого тиску (для стиснутих або зріджених газів) блакитного кольору різної ємності від 1,2 до 10,0 літрів під тиском до 15 МПа (150 атм) і використовується для збагачення дихальних газових сумішей в наркозі при порушенні дихання, для усунення нападу бронхіальної астми, усунення гіпоксії будь-якого генезу, при декомпресійній хворобі, для лікування патології шлунково-кишкового тракту у вигляді кисневих коктейлів. Для індивідуального застосування медичним киснем із балонів заповнюють спеціальні прогумовані ємності – кисневі подушки. Для подачі кисню або киснево-повітряної суміші одночасно одному або двом потерпілим у польових умовах або в умовах стаціонару застосовуються кисневі інгалятори різних моделей та модифікацій. Перевагою кисневого інгалятора є наявність конденсатора-зволожувача газової суміші, що використовує вологу повітря, що видихається. Для розрахунку кількості кисню в літрах, що залишився в балоні, зазвичай величину тиску в балоні в атмосферах (за манометром редуктора) множать на величину ємності балона в літрах. Наприклад, у балоні місткістю 2 літри манометр показує тиск кисню 100 атм. Об'єм кисню в цьому випадку дорівнює 100×2 = 200 літрів.
Достойний той газ подиву – Його застосовують зараз Для різання металів, в сталеварення І у доменних потужних печах. Бере його льотчик у висотні дали. Підводник із собою бере. Ви, мабуть, уже вгадали, Що цей газ – …
Кисень


Тема урока: Кисень. Отримання. Властивості.
Мета уроку:Вивчити історію відкриття, основні способи одержання та властивості кисню.
План уроку:
- Значення кисню. Біологічна роль.
2. Поширеність у природі.
3. Історія відкриття.
4. Положення елемента кисню в ПСХЕ Д.І. Менделєєва.
5. Фізичні властивості.
6. Отримання кисню
7. Хімічні характеристики.
8. Застосування кисню.



Джозеф Прістлі
(1743 – 1794)
Карл Шеєле
(1742 – 1786)
Антуан Лавуазьє
(1743 – 1794)


t = – 1 83 °C
t = –219 °C
Рідина блідо-синього кольору
Газ, без кольору, запаху, смаку, малорозчинний у воді
Кристали синього кольору
Тяжче повітря.

Світло, хлорофіл
6СО 2 + 6Н 2 Про
З 6 Н 12 Про 6 + 6О 2

Зрідження повітря під тиском при t = – 1 83 °C

Витісненням в повітря
Витісненням води

Розкладання води
H 2 O H 2 + O 2
Розкладання перекису водню
H 2 O 2 H 2 O + O 2
Розкладання перманганату калію
KMnO 4 K 2 MnO 4 + MnO 2 + O 2
перманганат калію
манганат калію
Розкладання бертолетової солі (хлорату калію)
KClO 3 KCl + O 2
Кисень у лабораторії отримують розкладанням кисневмісних сполук

З простими речовинами:
З неметалами:
S+O 2 SO 2
P+O 2 P 2 O 5
З металами:
Mg+O 2 MgO
Fe + O 2 Fe 3 O 4 (FeO Fe 2 O 3 )
При взаємодії простих речовин із киснем утворюються – оксиди

Подумай та відповідай
а
1
б
2
в
3
г
4
д
5

Подумай та відповідай
- Вчені, які займалися отриманням та вивченням кисню:
а) Дмитро Іванович Менделєєв;
б) Джозеф Прістлі;
в) Антуан Лоран Лавуазьє;
г) Карл Шееле;
д) Михайло Васильович Ломоносов

Подумай та відповідай
2. У трьох різних колбах є повітря, вуглекислий газ, кисень. Розпізнати кожен із газів можна:
а) порівнявши маси колб, заповнених газами
б) за допомогою тліючої лучинки
в) щодо розчинності газів у воді
г) за запахом
д) за допомогою інших речовин

Подумай та відповідай
3. У лабораторії кисень одержують:
а) зрідженням повітря
б) розкладанням води
в) розкладання перманганату калію
г) із перекису водню
д) окисленням речовин

Подумай та відповідай
4. Кисень можна зібрати шляхом витіснення води, оскільки він:
а) легше за повітря
б) добре розчинний у воді
в) важче за повітря
г) погано розчинний у воді
д ) не має кольору, запаху, смаку

Подумай та відповідай
5. Мова йде про кисень як про просту речовину:
а) кисень входить до складу води;
б) кисень погано розчинний у воді;
в) кисень підтримує дихання та горіння;
г) є складовим компонентом повітря;
д) входить до складу вуглекислого газу.

а
1
2
б
в
3
г
4
д
5

Ar(O)=16 неметал В= II
t = – 1 83 °C
Рідина блідо-синього кольору
Ме Неме
t = –219 °C
у пром-ті: охолодження повітря до -183 °C
окислення
Е х Про у
Кристали синього кольору
в лабораторії:
Н 2 Про Н 2 Про 2 KMnO 4 KClO 3
Методи збирання:
Витиснення повітря
Витиснення води

Домашнє завдання
§3 2–34
«3» - с. 111 питання 1,2
«4» - с. 111 питання 3,4
«5» - с. 111 питання 5,6
Завдання:Відомо, що в людини міститься за масою 65% кисню. Обчисліть скільки кисню міститься у вашому організмі.
Творче завдання:
Скласти кросворд, ребус, ЛОС на тему «Кисень»

Кисень елемент головної підгрупи шостої групи, другого періоду періодичної системи хімічних елементів Д. І. Менделєєва, з атомним номером 8. Позначається символом O (лат. Oxygenium). Кисень хімічно активний неметал є найлегшим елементом з групи халькогенів. Проста речовина кисень (CAS-номер:) за нормальних умов газ без кольору, смаку та запаху, молекула якого складається з двох атомів кисню (формула O 2), у зв'язку з чим його також називають дикисень. Рідкий кисень має світло-блакитний колір.
Існують інші алотропні форми кисню, наприклад, озон (CAS-номер:) за нормальних умов газ блакитного кольору зі специфічним запахом, молекула якого складається з трьох атомів кисню (формула O 3).

Історія відкриття Офіційно вважається, що кисень був відкритий англійським хіміком Джозефом Прістлі 1 серпня 1774 шляхом розкладання оксиду ртуті в герметично закритій посудині (Прістлі направляв на це з'єднання сонячні промені за допомогою потужної лінзи). 2HgO (t) 2Hg + O 2

Однак Прістлі спочатку не зрозумів, що відкрив нову просту речовину, він вважав, що виділив одну із складових частин повітря (і назвав цей газ «дефлогістованим повітрям»). Про своє відкриття Прістлі повідомив видатному французькому хіміку Антуану Лавуазьє. У 1775 році А. Лавуазьє встановив, що кисень є складовою повітря, кислот і міститься в багатьох речовинах.

Декількома роками раніше (1771 року) кисень отримав шведський хімік Карл Шееле. Він прожарював селітру з сірчаною кислотою і потім розкладав оксид азоту, що вийшов. Шееле назвав цей газ «вогненним повітрям» і описав своє відкриття у виданій у 1777 році книзі (саме тому, що книга опублікована пізніше, ніж повідомив про своє відкриття Прістлі, останній і вважається першовідкривачем кисню). Шееле також повідомив про свій досвід Лавуазьє.


Нарешті остаточно розібрався в природі отриманого газу А. Лавуазьє, який скористався інформацією від Прістлі та Шееле. Його робота мала величезне значення, тому що завдяки їй була повалена панувала на той час і гальмувала розвиток хімії флогістонна теорія. Лавуазьє провів досвід зі спалювання різних речовин і спростував теорію флогістону, опублікувавши результати ваги спалених елементів. Вага золи перевищувала початкову вагу елемента, що дало Лавуазьє право стверджувати, що при горінні відбувається хімічна реакція (окислення) речовини, у зв'язку з цим маса вихідної речовини збільшується, що спростовує теорію флогістону. Таким чином, заслугу відкриття кисню фактично ділять між собою Прістлі, Шееле та Лавуазьє.

Походження назви Слово кисень (йменувався на початку XIX століття ще «киснем») своєю появою в російській мові до певної міри зобов'язане М. В. Ломоносову, який увів у вживання, поряд з іншими неологізмами, слово «кислота»; в такий спосіб слово «кисень», своєю чергою, стало калькою терміну «оксиген» (фр. l"oxygène), запропонованого А. Лавуазьє (грецьке όξύγενναω від ξύς «кислий» і γενναω «народжую»), який перекладається як «породжує» », що пов'язано з первісним значенням його «кислота», що раніше мали на увазі оксиди, іменовані за сучасною міжнародною номенклатурою оксидами.

Знаходження у природі Кисень найпоширеніший Землі елемент, з його частку (у складі різних сполук, переважно силікатів), припадає близько 47,4 % маси твердої земної кори. Морські та прісні води містять велику кількість зв'язаного кисню 88,8 % (за масою), в атмосфері вміст вільного кисню становить 20,95 % за обсягом та 23,12 % за масою. Понад 1500 з'єднань земної кори у своєму складі містять кисень. Кисень входить до складу багатьох органічних речовин і є присутнім у всіх живих клітинах. За кількістю атомів у живих клітинах він становить близько 25 %, масовою часткою близько 65 %.

В даний час в промисловості кисень отримують з повітря. У лабораторіях користуються киснем промислового виробництва, що постачається у сталевих балонах під тиском близько 15 МПа. Найважливішим лабораторним способом його отримання є електроліз водних розчинів лугів. Невеликі кількості кисню можна також отримувати взаємодією розчину калію перманганату з підкисленим розчином пероксиду водню. Також добре відомі та успішно застосовуються в промисловості кисневі установки, що працюють на основі мембранної та азотної технологій. При нагріванні перманганат калію KMnO 4 розкладається до манганату калію K 2 MnO 4 та діоксиду марганцю MnO 2 з одночасним виділенням газоподібного кисню O 2 : 2KMnO 4 K2MnO 4 + MnO 2 + O 2

У лабораторних умовах отримують також каталітичним розкладанням пероксиду водню Н 2 Про 2: 2Н 2 Про 2 2Н 2 Про + О 2 Каталізатором є діоксид марганцю (MnO 2) або шматочок сирих овочів (в них містяться ферменти, що прискорюють розкладання пероксиду водню). Кисень можна також отримати каталітичним розкладанням хлорату калію (бертолетової солі) KClO 3: 2KClO 3 2KCl + 3O 2 Крім викладеного лабораторного методу кисень отримують методом поділу повітря на установках повітророзділу з чистотою до 99,9999% по O 2 .

Фізичні властивості За нормальних умов кисень це газ без кольору, смаку та запаху. 1л його важить 1,429 р. Трохи важче за повітря. Слабо розчиняється у воді (4,9 мл/100г при 0°C, 2,09мл/100г при 50°C) та спирті (2,78мл/100г при 25°C). Добре розчиняється у розплавленому сріблі (22 об'єми O 2 в 1 об'ємі Ag при 961 °C). Є парамагнетиком. При нагріванні газоподібного кисню відбувається його оборотна дисоціація на атоми: при 2000 °C 0,03 %, при 2600 °C 1 %, 4000 °C 59 %, 6000 °C 99,5 %. Рідкий кисень (темп. кипіння 182,98 ° C) це блідо-блакитна рідина. Фазова діаграма O 2 Твердий кисень (температура плавлення 218,79 °C) сині кристали. Відомі шість кристалічних фаз, з яких три існують при тиску в 1 атм.

α-Про 2 існує при температурі нижче 23,65 К; яскраво-сині кристали відносяться до моноклінної сингонії, параметри осередку a=5,403 Å, b=3,429 Å, c=5,086 Å; β=132,53° β-О 2 існує в інтервалі температур від 23,65 до 43,65 К; блідо-сині кристали (при підвищенні тиску колір переходить у рожевий) мають ромбоедричні грати, параметри осередку a=4,21 Å, α=46,25° γ-О 2 існує при температурах від 43,65 до 54,21 К; блідо-сині кристали мають кубічну симетрію, період решітки a=6,83 Å

Ще три фази утворюються при високих тисках: -2 інтервал температур до 300 К і тиск 6-10 ГПа, помаранчеві кристали; ε-О 2 тиск від 10 до 96 ГПа, колір кристалів від темно червоного до чорного, моноклінна сингонія; ζ-О 2 тиск більше 96 ГПа, металевий стан з характерним металевим блиском, при низьких температурах переходить у надпровідний стан.

Хімічні властивості Сильний окислювач, взаємодіє практично з усіма елементами, утворюючи оксиди. Ступінь окиснення 2. Як правило, реакція окиснення протікає з виділенням тепла та прискорюється при підвищенні температури. Приклад реакцій, що протікають при кімнатній температурі: 4K + O 2 2K 2 O 2Sr + O 2 2SrO Окислює сполуки, які містять елементи з не максимальним ступенем окислення: 2NO + O 2 2NO 2


Кисень не окислює Au та Pt, галогени та інертні гази. Кисень утворює пероксиди зі ступенем окислення 1. Наприклад, пероксиди виходять при згорянні лужних металів у кисні: 2Na + O 2 Na 2 O 2 Деякі оксиди поглинають кисень: 2BaO + O 2 2BaO 2

За теорією горіння, розробленою А. Н. Бахом і К. О. Енглером, окислення відбувається у дві стадії з утворенням проміжної пероксидної сполуки. Це проміжне з'єднання можна виділити, наприклад, при охолодженні полум'я льодом, що горить, поряд з водою, утворюється перекис водню: H 2 + O 2 H 2 O 2 Надпероксиди мають ступінь окислення 1/2, тобто один електрон на два атоми кисню (іон O 2 -). Отримують взаємодією пероксидів з киснем при підвищених тисках і температурі: Na 2 O 2 + O 2 2NaO 2 Озоніди містять іон O 3 - зі ступенем окиснення 1/3. Отримують дією озону на гідроксиди лужних металів: КОН(тв.) + О 3 КО 3 + КОН + O 2 Іон діоксигеніл O 2 + має ступінь окиснення +1/2. Отримують реакції: PtF 6 + O 2 O 2 PtF 6

Фториди кисню Дифторид кисню, OF 2 ступінь окислення +2, отримують пропусканням фтору через розчин лугу: 2F 2 + 2NaOH OF 2 + 2NaF + H 2 O Монофторид кисню (Діоксидифторид), O 2 F 2, нестабільний. Отримують із суміші фтору з киснем у тліючому розряді при температурі 196 °C. Пропускаючи тліючий розряд через суміш фтору з киснем при певних тиску і температурі виходять суміші вищих фторидів кисню O 3 F 2 О 4 F 2 О 5 F 2 і О 6 F 2. Кисень підтримує процеси дихання, горіння, гниття. У вільному вигляді елемент існує у двох алотропних модифікаціях: O 2 та O 3 (озон).

Хімія, нафтохімія: Створення інертного середовища в ємностях, азотне пожежогасіння, продування та випробування трубопроводів, регенерація каталізаторів, упаковка продукції в азотному середовищі, інтенсифікація окисних процесів, виділення метану, водню, вуглекислого газу.








Слайд 1
Презентація з хімії на тему: «Застосування кисню»
учениці ____ класу _____________________ ____________________

Слайд 6
Корнеліус Дреббель
Цікавим фактом є те, що вперше кисень виділили не хіміки. Це зробив винахідник підводного човна К. Дреббель на початку XVII ст. Цей газ він використовував для дихання в човні, при зануренні у воду. Але роботи винахідника було засекречено. Тому роботи К. Дреббеля не зіграли великої роботи у розвиток хімії.

Слайд 7
Першовідкривачі кисню
Джозеф Прістлі Карл Шееле Антуан Лавуазьє

Слайд 10
Широке промислове застосування кисню почалося в середині ХХ століття, після винаходу турбодетандерів - пристроїв для зрідження та поділу. Застосування кисню дуже різноманітне і ґрунтується на його хімічних властивостях. Хімічна та нафтохімічна промисловість. Кисень використовується для окислення вихідних реагентів, утворюючи азотну кислоту, етиленоксид, пропіленоксид, вінілхлорид та інші основні сполуки. Крім цього він може використовуватися для збільшення продуктивності сміттєспалювальних печей. Нафтогазова промисловість. Збільшення продуктивності процесів крекінгу нафти, переробки високооктанових сполук, закачування в пласт підвищення енергії витіснення.

Слайд 11
Застосування кисню
Металургія та гірничодобувна промисловість. Кисень використовується при конвертерному виробництві сталі, кисневому дутті в доменних печах, витягуванні золота з руд, виробництві феросплавів, виплавці нікелю, цинку, свинцю, цирконію та інших кольорових металів, пряме відновлення заліза, вогнева зачистка слябів у ливарному порід.

Слайд 12
Зварювання та різання металів. Кисень у балонах широко використовується для газополум'яного різання та зварювання металів, для високоточного плазмового розкрою металів.

Слайд 13
Військова техніка. У барокамерах для роботи дизельних двигунів під водою паливо для ракетних двигунів. Використовують у водолазному, космічному та пожежному спорядженні.