Utilizarea oxigenului este o prezentare pentru o lecție de chimie (clasa a VIII-a) pe această temă. Prezentare pe tema „utilizarea oxigenului” b) descompunerea apei
1 tobogan
Prezentarea a fost pregătită de Roxana Smirnova, elevă în clasa a IX-a la Liceul Otradnoye.

2 tobogan
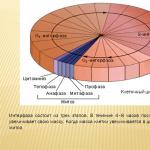
Oxigenul ca element. 1. Elementul oxigen este în grupa VI, subgrupa principală, perioada II, număr de serie Nr. 8, 2. Structura atomică: P11 = 8; n01 = 8; ē = 8 valență II, stare de oxidare -2 (rar +2; +1; -1). 3. Parte din oxizi, baze, săruri, acizi, substanțe organice, inclusiv organismele vii - până la 65% din greutate.

3 slide
Oxigenul ca element. Oxigenul este cel mai comun element de pe planeta noastră. În greutate, reprezintă aproximativ jumătate din masa totală a tuturor elementelor scoarței terestre. Compoziția aerului: O2 – 20-21%; N2 – 78%; CO2 – 0,03%, restul provine din gaze inerte, vapori de apă și impurități. 4. În scoarța terestră este de 49% din masă, în hidrosferă - 89% din masă. 5. Compus din aer (sub formă de substanță simplă) – 20-21% în volum. 6. Inclus în majoritatea mineralelor și rocilor (nisip, argilă etc.). Compus din aer (sub formă de substanță simplă). 7. Un element vital pentru toate organismele, aflat in majoritatea substantelor organice, implicate in multe procese biochimice care asigura dezvoltarea si functionarea vietii. 8. Oxigenul a fost descoperit în 1769-1771. Chimistul suedez K.-V. Scheele

4 slide
Proprietăți fizice. Oxigenul este un nemetal activ din punct de vedere chimic și este cel mai ușor element din grupul calcogenilor. Substanța simplă oxigenul în condiții normale este un gaz incolor, insipid și inodor, a cărui moleculă este formată din doi atomi de oxigen, motiv pentru care se mai numește și dioxigen. Oxigenul lichid este de culoare albastru deschis, în timp ce oxigenul solid este cristale de culoare albastru deschis.

5 slide
Proprietăți chimice. Cu nemetale C + O2 CO2 S + O2 SO2 2H2 + O2 2H2O Cu substanțe complexe 4FeS2 + 11O2 2Fe2O3 + 8SO2 2H2S + 3O2 2SO2 + 2H2O CH4 + 2O2 CO2 + 2H2O Cu metale Interacțiune 2Cu2Mg +O2Cut2Mg +O2Cut2MgO2 substanțele cu oxigen se numește oxidare. Toate elementele reacționează cu oxigenul, cu excepția Au, Pt, He, Ne și Ar în toate reacțiile (cu excepția interacțiunii cu fluor), oxigenul este un agent oxidant. 1. Instabil: O3 O2 + O 2. Agent oxidant puternic: 2KI + O3 + H2O 2KOH + I2 + O2 Decolorează coloranții, reflectă razele UV, distruge microorganismele.

6 slide
Metode de obținere. Metodă industrială (distilarea aerului lichid). Metoda de laborator (descompunerea unor substanțe care conțin oxigen) 2KClO3 –t ;MnO2 2KCl + 3O2 2H2O2 –MnO2 2H2O + O2

7 slide
Verificarea oxigenului colectat. Obţinerea 3O2 2O3 În timpul unei furtuni (în natură), (în laborator) într-un ozonizator de permanganat de potasiu la încălzire: 2KMnO4 –t K2MnO4 + MnO2 + O2 Descompunerea acestei săruri are loc când este încălzită peste 2000 C.

8 slide
Aplicații ale oxigenului: este utilizat pe scară largă în medicină și industrie. În timpul zborurilor la mare altitudine, piloții sunt dotați cu dispozitive speciale de oxigen. Pentru multe boli pulmonare și cardiace, precum și în timpul operațiilor, oxigenul este administrat pentru inhalare din pernele de oxigen. Submarinele sunt alimentate cu oxigen în cilindri. Arderea materialului combustibil liber impregnat cu oxigen lichid este însoțită de o explozie, ceea ce face posibilă utilizarea oxigenului în operațiunile de sablare. Oxigenul lichid este folosit în motoarele cu reacție, în sudarea autogenă și tăierea metalelor, chiar și sub apă.
Slide 2
OXIGEN
Oxigenul este al 16-lea element al subgrupului principal al grupului VI, a doua perioadă a sistemului periodic de elemente chimice al lui D.I Mendeleev, cu număr atomic 8. Este desemnat prin simbolul O (lat. Oxigen). Oxigenul este un nemetal activ din punct de vedere chimic și este cel mai ușor element din grupul calcogenilor. Substanța simplă oxigenul în condiții normale este un gaz incolor, insipid și inodor, a cărui moleculă este formată din doi atomi de oxigen (formula O2), motiv pentru care se mai numește și dioxigen. Oxigenul lichid este de culoare albastru deschis, în timp ce oxigenul solid este cristale de culoare albastru deschis.
Slide 3
Se crede oficial că oxigenul a fost descoperit de chimistul englez Joseph Priestley la 1 august 1774 prin descompunerea oxidului de mercuric într-un vas închis ermetic (Priestley a direcționat lumina soarelui către acest compus folosind o lentilă puternică). Cu toate acestea, Priestley nu și-a dat seama inițial că a descoperit o nouă substanță simplă, el a crezut că a izolat una dintre părțile constitutive ale aerului (și a numit acest gaz „aer deflogistic”). Priestley a raportat descoperirea sa remarcabilului chimist francez Antoine Lavoisier. În 1775, A. Lavoisier a stabilit că oxigenul este o componentă a aerului, acizilor și se găsește în multe substanțe. Cu câțiva ani mai devreme (în 1771), oxigenul a fost obținut de chimistul suedez Karl Scheele. A calcinat salitrul cu acid sulfuric și apoi a descompus oxidul de azot rezultat. Scheele a numit acest gaz „aer de foc” și a descris descoperirea sa într-o carte publicată în 1777 (tocmai pentru că cartea a fost publicată mai târziu decât Priestley și-a anunțat descoperirea, acesta din urmă fiind considerat descoperitorul oxigenului). Scheele a raportat și lui Lavoisier experiența sa. Un pas important care a contribuit la descoperirea oxigenului a fost lucrarea chimistului francez Pierre Bayen, care a publicat lucrări despre oxidarea mercurului și descompunerea ulterioară a oxidului acestuia. În cele din urmă, A. Lavoisier și-a dat seama în cele din urmă de natura gazului rezultat, folosind informații de la Priestley și Scheele. Opera sa a fost de o importanță enormă, deoarece datorită ei, teoria flogistului, care era dominantă la acea vreme și împiedica dezvoltarea chimiei, a fost răsturnată. Lavoisier a efectuat experimente privind arderea diferitelor substanțe și a infirmat teoria flogistonului, publicând rezultate privind greutatea elementelor arse. Greutatea cenușii a depășit greutatea inițială a elementului, ceea ce i-a dat lui Lavoisier dreptul de a susține că în timpul arderii are loc o reacție chimică (oxidare) a substanței și, prin urmare, masa substanței inițiale crește, ceea ce respinge teoria flogistonului. . Astfel, meritul pentru descoperirea oxigenului este de fapt împărțit între Priestley, Scheele și Lavoisier. DESCOPERIREA OXIGENULUI
Slide 4
Slide 5
Utilizarea oxigenului Utilizarea industrială pe scară largă a oxigenului a început la mijlocul secolului al XX-lea, după inventarea turboexpansoarelor - dispozitive pentru lichefiere și separare. Utilizarea oxigenului este foarte diversă și se bazează pe proprietățile sale chimice. Industria chimică și petrochimică. Oxigenul este utilizat pentru a oxida reactanții de pornire, producând acid azotic, oxid de etilenă, oxid de propilenă, clorură de vinil și alți compuși bazici. În plus, poate fi folosit pentru a crește productivitatea incineratoarelor de deșeuri. Industria petrolului și gazelor. Creșterea productivității proceselor de cracare a petrolului, procesarea compușilor cu octan ridicat, injectarea în rezervor pentru a crește energia de deplasare.
Slide 6
Aplicarea oxigenului
Industria sticlei. Cuptoarele de topire a sticlei folosesc oxigen pentru a îmbunătăți arderea. În plus, este utilizat pentru a reduce emisiile de oxid de azot la niveluri sigure. Industria celulozei și hârtiei. Oxigenul este folosit în delignificare, alcoolizare și alte procese. În medicină, oxigenul medical este stocat în butelii metalice de gaz de înaltă presiune (pentru gaze comprimate sau lichefiate) de culoare albastră de diferite capacități de la 1,2 până la 10,0 litri sub presiune de până la 15 MPa (150 atm) și este utilizat pentru îmbogățirea amestecurilor de gaze respiratorii. în echipament de anestezie, în caz de probleme de respirație, pentru ameliorarea unui atac de astm bronșic, eliminarea hipoxiei de orice origine, pentru boala de decompresie, pentru tratarea patologiilor tractului gastro-intestinal sub formă de cocktailuri de oxigen. Pentru uz individual, recipientele cauciucate speciale - perne de oxigen - sunt umplute din butelii cu oxigen medical. Inhalatoarele de oxigen de diferite modele și modificări sunt utilizate pentru a furniza oxigen sau un amestec oxigen-aer simultan uneia sau două victime pe teren sau într-un spital. Avantajul unui inhalator de oxigen este prezența unui condensator-umidificator al amestecului de gaze, care utilizează umiditatea aerului expirat. Pentru a calcula cantitatea de oxigen rămasă în cilindru în litri, presiunea din butelie în atmosfere (conform manometrului reductorului) este de obicei înmulțită cu capacitatea cilindrului în litri. De exemplu, într-un cilindru cu o capacitate de 2 litri, manometrul indică o presiune a oxigenului de 100 atm. Volumul de oxigen în acest caz este 100 × 2 = 200 litri.
Gazul acela merită surprins - Este folosit acum Pentru tăierea metalelor, în fabricarea oțelului Și în furnalele puternice. Pilotul o duce la altitudini mari. Submarinerul o ia cu el. Probabil ai ghicit deja, Ce este acest gaz...
Oxigen


Subiectul lecției: Oxigen. chitanta. Proprietăți.
Scopul lecției: Studiați istoria descoperirii, principalele metode de producere și proprietățile oxigenului.
Planul lecției:
- Semnificația oxigenului. Rolul biologic.
2. Prevalența în natură.
3. Istoria descoperirii.
4. Poziția elementului oxigen în PSHE D.I. Mendeleev.
5. Proprietăți fizice.
6. Obținerea oxigenului
7. Proprietăți chimice.
8. Utilizarea oxigenului.



Joseph Priestley
(1743 – 1794)
Karl Scheele
(1742 – 1786)
Antoine Lavoisier
(1743 – 1794)


t = – 1 83 °C
t = –219 °C
Lichid albastru pal
Gaz, incolor, inodor, insipid, ușor solubil în apă
Cristale albastre
Mai greu decât aerul.

Lumină, clorofilă
6СО 2 + 6 ore 2 DESPRE
CU 6 N 12 DESPRE 6 + 6O 2

Lichefierea aerului sub presiune la t = – 1 83 °C

Prin represiune V aer
Prin deplasarea apei

Descompunerea apei
H 2 O H 2 + O 2
Descompunerea peroxidului de hidrogen
H 2 O 2 H 2 O+O 2
Descompunerea permanganatului de potasiu
KMnO 4 K 2 MnO 4 +MnO 2 + O 2
permanganat de potasiu
manganat de potasiu
Descompunerea sării Berthollet (clorat de potasiu)
KClO 3 KCI + O 2
Oxigenul se obține în laborator prin descompunerea compușilor care conțin oxigen

Cu substanțe simple:
Cu nemetale:
S+O 2 ASA DE 2
P+O 2 P 2 O 5
Cu metale:
Mg+O 2 MgO
Fe+O 2 Fe 3 O 4 (FeO Fe 2 O 3 )
Când substanțele simple interacționează cu oxigenul, se formează oxizi

Gândește și răspunde
A
1
b
2
V
3
G
4
d
5

Gândește și răspunde
- Oamenii de știință implicați în producerea și studiul oxigenului:
a) Dmitri Ivanovici Mendeleev;
b) Joseph Priestley;
c) Antoine Laurent Lavoisier;
d) Karl Scheele;
d) Mihail Vasilievici Lomonosov

Gândește și răspunde
2. Trei baloane diferite conțin aer, dioxid de carbon și oxigen. Puteți recunoaște fiecare dintre gaze:
a) compararea maselor baloanelor umplute cu gaze
b) folosind o așchie care mocnește
c) prin solubilitatea gazelor în apă
d) prin miros
e) cu ajutorul altor substanţe

Gândește și răspunde
3. În laborator se obține oxigen:
a) lichefierea aerului
b) descompunerea apei
c) descompunerea permanganatului de potasiu
d) din peroxid de hidrogen
e) oxidarea substanţelor

Gândește și răspunde
4. Oxigenul poate fi colectat prin deplasarea apei deoarece:
a) mai ușor decât aerul
b) foarte solubil în apă
c) mai greu decât aerul
d) slab solubil în apă
d ) nu are culoare, miros, gust

Gândește și răspunde
5. Vorbim despre oxigen ca o substanță simplă:
a) oxigenul face parte din apă;
b) oxigenul este slab solubil în apă;
c) oxigenul susține respirația și arderea;
d) este o componentă a aerului;
e) face parte din dioxidul de carbon.

A
1
2
b
V
3
G
4
d
5

Ar(O)=16 nemetal B= II
t = – 1 83 °C
Lichid albastru pal
Eu Neme
t = –219 °C
in industrie: răcire cu aer la -183 °C
oxidare
E X DESPRE la
Cristale albastre
in laborator:
H 2 O H 2 O 2 KMnO 4 KClO 3
Metode de colectare:
Deplasarea aerului
Deplasarea apei

Teme pentru acasă
§3 2–34
"3" - Cu. 111 întrebări 1,2
"4" - Cu. 111 întrebări 3.4
"5" - Cu. 111 întrebări 5.6
Sarcină: Se știe că corpul uman conține 65% oxigen din greutate. Calculează cât de mult oxigen este în corpul tău.
Sarcina creativă:
Compuneți un cuvinte încrucișate, rebus, VOC pe tema „Oxigen”

Oxigenul Oxigenul este un element al subgrupului principal al celui de-al șaselea grup, a doua perioadă a sistemului periodic de elemente chimice a lui D.I Mendeleev, cu număr atomic 8. Notat cu simbolul O (lat. Oxigen). Oxigenul este un nemetal activ din punct de vedere chimic și este cel mai ușor element al grupului de calcogen. Substanța simplă oxigen (număr CAS:) în condiții normale este un gaz incolor, insipid și inodor, a cărui moleculă este formată din doi atomi de oxigen (formula O 2) și, prin urmare, este numit și dioxigen. Oxigenul lichid este de culoare albastru deschis.
Există și alte forme alotrope de oxigen, de exemplu, ozonul (număr CAS:) în condiții normale, un gaz albastru cu un miros specific, a cărui moleculă este formată din trei atomi de oxigen (formula O 3).

Istoria descoperirii Se crede oficial că oxigenul a fost descoperit de chimistul englez Joseph Priestley la 1 august 1774 prin descompunerea oxidului de mercur într-un vas închis ermetic (Priestley a direcționat razele solare către acest compus folosind o lentilă puternică). 2HgO (t) 2Hg + O2

Cu toate acestea, Priestley nu și-a dat seama inițial că a descoperit o nouă substanță simplă, el a crezut că a izolat una dintre părțile constitutive ale aerului (și a numit acest gaz „aer deflogistic”). Priestley a raportat descoperirea sa remarcabilului chimist francez Antoine Lavoisier. În 1775, A. Lavoisier a stabilit că oxigenul este o componentă a aerului, acizilor și se găsește în multe substanțe.

Cu câțiva ani mai devreme (în 1771), oxigenul a fost obținut de chimistul suedez Karl Scheele. A calcinat salitrul cu acid sulfuric și apoi a descompus oxidul de azot rezultat. Scheele a numit acest gaz „aer de foc” și a descris descoperirea sa într-o carte publicată în 1777 (tocmai pentru că cartea a fost publicată mai târziu decât Priestley și-a anunțat descoperirea, acesta din urmă fiind considerat descoperitorul oxigenului). Scheele a raportat și lui Lavoisier experiența sa.


În cele din urmă, A. Lavoisier și-a dat seama în cele din urmă natura gazului rezultat, folosind informații de la Priestley și Scheele. Lucrarea sa a avut o importanță enormă, deoarece datorită ei, teoria flogistului, care era dominantă la acea vreme și împiedica dezvoltarea chimiei, a fost răsturnată. Lavoisier a efectuat experimente privind arderea diferitelor substanțe și a infirmat teoria flogistonului, publicând rezultate privind greutatea elementelor arse. Greutatea cenușii a depășit greutatea inițială a elementului, ceea ce i-a dat lui Lavoisier dreptul de a susține că în timpul arderii are loc o reacție chimică (oxidare) a substanței și, prin urmare, masa substanței inițiale crește, ceea ce respinge teoria flogistonului. . Astfel, meritul pentru descoperirea oxigenului este de fapt împărțit între Priestley, Scheele și Lavoisier.

Originea numelui Cuvântul oxigen (numit și „soluție acidă” la începutul secolului al XIX-lea) își datorează într-o oarecare măsură apariția în limba rusă lui M.V Lomonosov, care a introdus cuvântul „acid”, împreună cu alte neologisme; astfel, cuvântul „oxigen”, la rândul său, a fost un traseu al termenului „oxigen” (franceză l „oxygène), propus de A. Lavoisier (greacă όξύγενναω din ξύς „acru” și γενναω „născ”), care este tradus ca „acid generator”, care se datorează semnificației sale inițiale de „acid”, care anterior însemna oxizi, numiți oxizi conform nomenclaturii internaționale moderne.

Apariția în natură Oxigenul este cel mai comun element de pe Pământ (în diverși compuși, în principal silicați) reprezintă aproximativ 47,4% din masa scoarței terestre solide. Apele maritime și dulci conțin o cantitate imensă de oxigen legat 88,8% (în masă), în atmosferă conținutul de oxigen liber este de 20,95% în volum și 23,12% în masă. Peste 1.500 de compuși din scoarța terestră conțin oxigen. Oxigenul face parte din multe substanțe organice și este prezent în toate celulele vii. După numărul de atomi din celulele vii este de aproximativ 25%, iar după fracția de masă este de aproximativ 65%.

Obţinerea În prezent, în industrie, oxigenul se obţine din aer. Laboratoarele folosesc oxigen produs industrial, furnizat în cilindri de oțel la o presiune de aproximativ 15 MPa. Cea mai importantă metodă de laborator pentru producerea sa este electroliza soluțiilor apoase de alcalii. Cantități mici de oxigen pot fi obținute și prin reacția unei soluții de permanganat de potasiu cu o soluție acidificată de peroxid de hidrogen. Instalațiile de oxigen care funcționează pe baza tehnologiilor cu membrane și azot sunt, de asemenea, bine cunoscute și utilizate cu succes în industrie. Când este încălzit, permanganatul de potasiu KMnO 4 se descompune în manganat de potasiu K 2 MnO 4 și dioxid de mangan MnO 2 cu eliberarea simultană de oxigen gazos O 2: 2KMnO 4 K2MnO 4 + MnO 2 + O 2

În condiții de laborator, se obține și prin descompunerea catalitică a peroxidului de hidrogen H 2 O 2: 2H 2 O 2 2H 2 O + O 2 Catalizatorul este dioxid de mangan (MnO 2) sau o bucată de legume crude (conțin enzime care accelerează descompunerea peroxidului de hidrogen). Oxigenul poate fi obtinut si prin descompunerea catalitica a cloratului de potasiu (sare Berthollet) KClO 3: 2KClO 3 2KCl + 3O 2 Pe langa metoda de laborator de mai sus, oxigenul se obtine prin metoda separarii aerului in instalatiile de separare a aerului cu o puritate de până la 99,9999% în O2.

Proprietăți fizice În condiții normale, oxigenul este un gaz incolor, insipid și inodor. 1 litru cântărește 1,429 g puțin mai greu decât aerul. Puțin solubil în apă (4,9 ml/100g la 0 °C, 2,09 ml/100g la 50 °C) și alcool (2,78 ml/100g la 25 °C). Se dizolvă bine în argint topit (22 volume de O 2 în 1 volum de Ag la 961 °C). Este paramagnetic. Când oxigenul gazos este încălzit, are loc disocierea lui reversibilă în atomi: la 2000 °C 0,03%, la 2600 °C 1%, 4000 °C 59%, 6000 °C 99,5%. Oxigenul lichid (punctul de fierbere 182,98 °C) este un lichid albastru pal. Diagrama de fază O 2 Oxigen solid (punct de topire 218,79 °C) cristale albastre. Sunt cunoscute șase faze cristaline, dintre care trei există la o presiune de 1 atm:

α-O 2 există la temperaturi sub 23,65 K; cristalele albastre strălucitoare aparțin sistemului monoclinic, parametrii celulei a=5,403 Å, b=3,429 Å, c=5,086 Å; p=132,53° P-O2 există în intervalul de temperatură de la 23,65 la 43,65 K; cristalele albastru pal (cu creșterea presiunii culoarea devine roz) au o rețea romboedrică, parametrii celulei a=4,21 Å, α=46,25° γ-O 2 există la temperaturi de la 43,65 la 54,21 K; cristalele albastru pal au simetrie cubică, parametrul rețelei a=6,83 Å

Alte trei faze se formează la presiuni mari: intervalul de temperatură δ-O 2 până la 300 K și presiune 6-10 GPa, cristale portocalii; presiune ε-O 2 de la 10 la 96 GPa, culoarea cristalului de la roșu închis la negru, sistem monoclinic; Presiunea ζ-O 2 este mai mare de 96 GPa, o stare metalica cu un luciu metalic caracteristic, la temperaturi scazute se transforma in stare supraconductoare.

Proprietăți chimice Agent oxidant puternic, interacționează cu aproape toate elementele, formând oxizi. Starea de oxidare 2. De regulă, reacția de oxidare are loc cu degajarea de căldură și accelerează odată cu creșterea temperaturii. Un exemplu de reacții care au loc la temperatura camerei: 4K + O 2 2K 2 O 2Sr + O 2 2SrO Oxidează compuși care conțin elemente cu o stare de oxidare non-maximum: 2NO + O 2 2NO 2


Oxigenul nu oxidează Au și Pt, halogenii și gazele inerte. Oxigenul formează peroxizi cu starea de oxidare 1. De exemplu, peroxizii se obțin prin arderea metalelor alcaline în oxigen: 2Na + O 2 Na 2 O 2 Unii oxizi absorb oxigenul: 2BaO + O 2 2BaO 2

Conform teoriei arderii dezvoltate de A. N. Bach și K. O. Engler, oxidarea are loc în două etape cu formarea unui compus intermediar de peroxid. Acest compus intermediar poate fi izolat, de exemplu, atunci când o flacără de hidrogen arzând este răcită cu gheață, împreună cu apă, se formează peroxid de hidrogen: H 2 + O 2 H 2 O 2 Superoxizii au o stare de oxidare de 1/2, care este, un electron pentru doi atomi de oxigen (ion O 2 -). Se obţine prin reacţia peroxizilor cu oxigenul la presiuni şi temperaturi ridicate: Na 2 O 2 + O 2 2NaO 2 Ozonidele conţin ionul O 3 - cu o stare de oxidare de 1/3. Se obţine prin acţiunea ozonului asupra hidroxizilor de metale alcaline: KOH(solid) + O 3 KO 3 + KOH + O 2 Ionul dioxigenil O 2 + are o stare de oxidare de +1/2. Obținut prin reacție: PtF 6 + O 2 O 2 PtF 6

Fluoruri de oxigen Difluorura de oxigen, OF 2 stare de oxidare +2, se obține prin trecerea fluorului printr-o soluție alcalină: 2F 2 + 2NaOH OF 2 + 2NaF + H 2 O Monofluorura de oxigen (Dioxidifluorura), O 2 F 2, instabilă, stare de oxidare + 1. Se obține dintr-un amestec de fluor și oxigen într-o descărcare strălucitoare la o temperatură de 196 °C. Prin trecerea unei descărcări strălucitoare printr-un amestec de fluor și oxigen la o anumită presiune și temperatură, se obțin amestecuri de fluoruri de oxigen mai mari O 3 F 2, O 4 F 2, O 5 F 2 și O 6 F 2 Oxigenul susține procesele de respirație, ardere și descompunere. În forma sa liberă, elementul există în două modificări alotropice: O 2 și O 3 (ozon).

Aplicație Chimie, petrochimie: Crearea unui mediu inert în containere, stingerea incendiilor cu azot, purjarea și testarea conductelor, regenerarea catalizatorilor, ambalarea produselor în mediu cu azot, intensificarea proceselor de oxidare, eliberare de metan, hidrogen, dioxid de carbon.








Slide 1
Prezentare despre chimie pe tema: „Utilizarea oxigenului”
elevi din clasa __________ ____________________

Slide 6
Cornelius Drebbel
Un fapt interesant este că, pentru prima dată, oxigenul nu a fost izolat de chimiști. Acest lucru a fost făcut de inventatorul submarinului K. Drebbel la începutul secolului al XVII-lea. El a folosit acest gaz pentru a respira în barcă când era scufundat în apă. Dar opera inventatorului a fost clasificată. Prin urmare, munca lui K. Drebbel nu a jucat un rol important în dezvoltarea chimiei.

Slide 7
Descoperitorii oxigenului
Joseph Priestley Karl Scheele Antoine Lavoisier

Slide 10
Utilizarea oxigenului Utilizarea industrială pe scară largă a oxigenului a început la mijlocul secolului al XX-lea, după inventarea turboexpansoarelor - dispozitive pentru lichefiere și separare. Utilizarea oxigenului este foarte diversă și se bazează pe proprietățile sale chimice. Industria chimică și petrochimică. Oxigenul este utilizat pentru a oxida reactanții de pornire, producând acid azotic, oxid de etilenă, oxid de propilenă, clorură de vinil și alți compuși bazici. În plus, poate fi folosit pentru a crește productivitatea incineratoarelor de deșeuri. Industria petrolului și gazelor. Creșterea productivității proceselor de cracare a petrolului, procesarea compușilor cu octan ridicat, injectarea în rezervor pentru a crește energia de deplasare.

Slide 11
Aplicarea oxigenului
Metalurgie și industria minieră. Oxigenul este utilizat în producția de oțel de transformare, sablare cu oxigen în furnalele înalte, extracția aurului din minereuri, producția de feroaliaje, topirea nichelului, zincului, plumbului, zirconiului și a altor metale neferoase, reducerea directă a fierului, îndepărtarea la foc a plăcilor în turnatorii, foraj la foc de roci dure.

Slide 12
Sudarea si taierea metalelor. Oxigenul din cilindri este utilizat pe scară largă pentru tăierea cu flacără și sudarea metalelor, pentru tăierea cu plasmă de înaltă precizie a metalelor.

Slide 13
Echipament militar. În camere hiperbare, pentru funcționarea sub apă a motoarelor diesel, combustibil pentru motoarele de rachetă. Folosit în echipamente pentru scufundări, spații și stingerea incendiilor.