L'uso dell'ossigeno è una presentazione per una lezione di chimica (ottava elementare) sull'argomento. Presentazione sul tema "uso dell'ossigeno" b) decomposizione dell'acqua
1 diapositiva
La presentazione è stata preparata da Roxana Smirnova, una studentessa del 9° anno del Liceo di Otradnoye.

2 diapositive
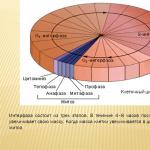
L'ossigeno come elemento. 1. L'elemento ossigeno è nel gruppo VI, sottogruppo principale, periodo II, numero di serie n. 8, 2. Struttura atomica: P11 = 8; n01 = 8; ē = 8 valenza II, stato di ossidazione -2 (raramente +2; +1; -1). 3. Parte di ossidi, basi, sali, acidi, sostanze organiche, compresi organismi viventi - fino al 65% in peso.

3 diapositive
L'ossigeno come elemento. L’ossigeno è l’elemento più comune sul nostro pianeta. In peso, rappresenta circa la metà della massa totale di tutti gli elementi della crosta terrestre. Composizione dell'aria: O2 – 20-21%; N2 – 78%; CO2 – 0,03%, il resto proviene da gas inerti, vapore acqueo e impurità. 4. Nella crosta terrestre è pari al 49% in massa, nell'idrosfera - 89% in massa. 5. Composto da aria (sotto forma di sostanza semplice) – 20-21% in volume. 6. Incluso nella maggior parte dei minerali e delle rocce (sabbia, argilla, ecc.). Composto da aria (sotto forma di sostanza semplice). 7. Un elemento vitale per tutti gli organismi, presente nella maggior parte delle sostanze organiche, coinvolto in molti processi biochimici che assicurano lo sviluppo e il funzionamento della vita. 8. L'ossigeno fu scoperto nel 1769-1771. Il chimico svedese K.-V. Scheele

4 diapositive
Proprietà fisiche. L'ossigeno è un non metallo chimicamente attivo ed è l'elemento più leggero del gruppo dei calcogeni. La sostanza semplice ossigeno in condizioni normali è un gas incolore, insapore e inodore, la cui molecola è composta da due atomi di ossigeno, per questo motivo è chiamato anche diossigeno. L'ossigeno liquido è di colore azzurro, mentre l'ossigeno solido è costituito da cristalli azzurri.

5 diapositive
Proprietà chimiche. Con non metalli C + O2 CO2 S + O2 SO2 2H2 + O2 2H2O Con sostanze complesse 4FeS2 + 11O2 2Fe2O3 + 8SO2 2H2S + 3O2 2SO2 + 2H2O CH4 + 2O2 CO2 + 2H2O Con metalli 2Mg + O2 2MgO 2Cu + O2 –t 2CuO Interazione sostanze con ossigeno si chiama ossidazione. Tutti gli elementi reagiscono con l'ossigeno tranne Au, Pt, He, Ne e Ar in tutte le reazioni (ad eccezione dell'interazione con il fluoro), l'ossigeno è un agente ossidante; 1. Instabile: O3 O2 + O 2. Agente ossidante forte: 2KI + O3 + H2O 2KOH + I2 + O2 Scolorisce i coloranti, riflette i raggi UV, distrugge i microrganismi.

6 diapositive
Modalità di ottenimento. Metodo industriale (distillazione di aria liquida). Metodo di laboratorio (decomposizione di alcune sostanze contenenti ossigeno) 2KClO3 –t ;MnO2 2KCl + 3O2 2H2O2 –MnO2 2H2O + O2

Diapositiva 7
Controllo dell'ossigeno raccolto. Ottenere 3O2 2O3 Durante un temporale (in natura), (in laboratorio) in un ozonizzatore di permanganato di potassio quando riscaldato: 2KMnO4 –t K2MnO4 + MnO2 + O2 La decomposizione di questo sale avviene quando viene riscaldato oltre i 2000 C.

8 diapositive
Applicazioni dell'ossigeno: è ampiamente utilizzato in medicina e nell'industria. Durante i voli ad alta quota, ai piloti vengono forniti speciali dispositivi di ossigeno. Per molte malattie polmonari e cardiache, nonché durante le operazioni, l'ossigeno viene somministrato per inalare dai cuscini di ossigeno. I sottomarini vengono riforniti di ossigeno in bombole. La combustione di materiale combustibile sfuso impregnato di ossigeno liquido è accompagnata da un'esplosione, che rende possibile l'utilizzo dell'ossigeno nelle operazioni di brillamento. L'ossigeno liquido viene utilizzato nei motori a reazione, nella saldatura autogena e nel taglio dei metalli, anche sott'acqua.
Diapositiva 2
OSSIGENO
L'ossigeno è il sedicesimo elemento del sottogruppo principale del gruppo VI, il secondo periodo del sistema periodico di elementi chimici di D.I Mendeleev, con numero atomico 8. È designato con il simbolo O (lat. Oxygenium). L'ossigeno è un non metallo chimicamente attivo ed è l'elemento più leggero del gruppo dei calcogeni. La sostanza semplice ossigeno in condizioni normali è un gas incolore, insapore e inodore, la cui molecola è composta da due atomi di ossigeno (formula O2), per questo motivo è anche chiamato diossigeno. L'ossigeno liquido è di colore azzurro, mentre l'ossigeno solido è costituito da cristalli azzurri.
Diapositiva 3
Si ritiene ufficialmente che l'ossigeno sia stato scoperto dal chimico inglese Joseph Priestley il 1 agosto 1774 decomponendo l'ossido di mercurio in un recipiente ermeticamente chiuso (Priestley diresse la luce solare su questo composto usando una potente lente). Tuttavia Priestley inizialmente non si rese conto di aver scoperto una nuova sostanza semplice: credeva di aver isolato una delle parti costitutive dell'aria (e chiamò questo gas “aria deflogisticata”); Priestley riferì la sua scoperta all'eccezionale chimico francese Antoine Lavoisier. Nel 1775 A. Lavoisier stabilì che l'ossigeno è un componente dell'aria, degli acidi e si trova in molte sostanze. Alcuni anni prima (nel 1771), l'ossigeno fu ottenuto dal chimico svedese Karl Scheele. Calciò il salnitro con acido solforico e poi decompose l'ossido nitrico risultante. Scheele chiamò questo gas “aria di fuoco” e descrisse la sua scoperta in un libro pubblicato nel 1777 (proprio perché il libro fu pubblicato più tardi rispetto all'annuncio della sua scoperta da parte di Priestley, quest'ultimo è considerato lo scopritore dell'ossigeno). Scheele riferì la sua esperienza anche a Lavoisier. Un passo importante che ha contribuito alla scoperta dell'ossigeno è stato il lavoro del chimico francese Pierre Bayen, che ha pubblicato lavori sull'ossidazione del mercurio e sulla successiva decomposizione del suo ossido. Alla fine, A. Lavoisier capì finalmente la natura del gas risultante, utilizzando le informazioni di Priestley e Scheele. La sua opera fu di enorme importanza poiché grazie ad essa la teoria del flogisto, allora dominante e che ostacolava lo sviluppo della chimica, venne rovesciata. Lavoisier condusse esperimenti sulla combustione di varie sostanze e confutò la teoria del flogisto, pubblicando risultati sul peso degli elementi bruciati. Il peso della cenere superava il peso originale dell'elemento, il che ha dato a Lavoisier il diritto di affermare che durante la combustione si verifica una reazione chimica (ossidazione) della sostanza, e quindi aumenta la massa della sostanza originale, il che confuta la teoria del flogisto . Pertanto, il merito della scoperta dell'ossigeno è in realtà condiviso tra Priestley, Scheele e Lavoisier. SCOPERTA DELL'OSSIGENO
Diapositiva 4
Diapositiva 5
Uso dell'ossigeno L'uso industriale diffuso dell'ossigeno iniziò a metà del XX secolo, dopo l'invenzione dei turboespansori, dispositivi per la liquefazione e la separazione. L'uso dell'ossigeno è molto vario e si basa sulle sue proprietà chimiche. Industria chimica e petrolchimica. L'ossigeno viene utilizzato per ossidare i reagenti di partenza, producendo acido nitrico, ossido di etilene, ossido di propilene, cloruro di vinile e altri composti basici. Inoltre, può essere utilizzato per aumentare la produttività degli inceneritori di rifiuti. Industria del petrolio e del gas. Aumento della produttività dei processi di cracking del petrolio, lavorazione di composti ad alto numero di ottano, iniezione nel giacimento per aumentare l'energia di spostamento.
Diapositiva 6
Applicazione di ossigeno
Industria del vetro. I forni per la fusione del vetro utilizzano l'ossigeno per migliorare la combustione. Inoltre, viene utilizzato per ridurre le emissioni di ossido di azoto a livelli di sicurezza. Industria della pasta e della carta. L'ossigeno viene utilizzato nella delignificazione, nell'alcolizzazione e in altri processi. In medicina, l'ossigeno medico viene immagazzinato in bombole di gas metallico ad alta pressione (per gas compressi o liquefatti) di colore blu di varie capacità da 1,2 a 10,0 litri sotto pressione fino a 15 MPa (150 atm) e viene utilizzato per arricchire le miscele di gas respiratori nelle apparecchiature per anestesia, in caso di problemi respiratori, per alleviare un attacco di asma bronchiale, eliminando l'ipossia di qualsiasi origine, per la malattia da decompressione, per il trattamento di patologie del tratto gastrointestinale sotto forma di cocktail di ossigeno. Per uso individuale, speciali contenitori gommati - cuscini di ossigeno - vengono riempiti da bombole con ossigeno medico. Gli inalatori di ossigeno di vari modelli e modifiche vengono utilizzati per fornire ossigeno o una miscela di ossigeno e aria contemporaneamente a una o due vittime sul campo o in ambiente ospedaliero. Il vantaggio di un inalatore di ossigeno è la presenza di un condensatore-umidificatore della miscela di gas, che utilizza l'umidità dell'aria espirata. Per calcolare la quantità di ossigeno rimanente nella bombola in litri, la pressione nella bombola in atmosfere (secondo il manometro del riduttore) viene solitamente moltiplicata per la capacità della bombola in litri. Ad esempio, in una bombola con una capacità di 2 litri, il manometro mostra una pressione di ossigeno di 100 atm. Il volume di ossigeno in questo caso è 100 × 2 = 200 litri.
Quel gas è degno di sorpresa - Viene utilizzato adesso Per il taglio dei metalli, nella produzione dell'acciaio E in potenti altiforni. Il pilota lo porta ad alta quota. Il sottomarino lo porta con sé. Probabilmente lo hai già indovinato, Cos'è questo gas...?
Ossigeno


Argomento della lezione: Ossigeno. Ricevuta. Proprietà.
Lo scopo della lezione: Studia la storia della scoperta, i principali metodi di produzione e le proprietà dell'ossigeno.
Piano della lezione:
- Il significato dell'ossigeno. Ruolo biologico.
2. Prevalenza in natura.
3. Storia della scoperta.
4. Posizione dell'elemento ossigeno nel PSHE D.I. Mendeleev.
5. Proprietà fisiche.
6. Ottenere ossigeno
7. Proprietà chimiche.
8. Utilizzo dell'ossigeno.



Giuseppe Priestley
(1743 – 1794)
Karl Scheele
(1742 – 1786)
Antonio Lavoisier
(1743 – 1794)


T = – 1 83 °C
T = –219 °C
Liquido blu pallido
Gas, incolore, inodore, insapore, leggermente solubile in acqua
Cristalli blu
Più pesante dell'aria.

Luce, clorofilla
6СО 2 + 6 ore 2 DI
CON 6 N 12 DI 6 +6O 2

Liquefazione dell'aria sotto pressione a T = – 1 83 °C

Con la repressione V aria
Spostando l'acqua

Decomposizione dell'acqua
H 2 O H 2 +O 2
Decomposizione del perossido di idrogeno
H 2 O 2 H 2 O+O 2
Decomposizione del permanganato di potassio
KMnO 4 K 2 MnO 4 +MnO 2 +O 2
Permanganato di Potassio
manganato di potassio
Decomposizione del sale di Berthollet (clorato di potassio)
KClO 3 KCl+O 2
L'ossigeno si ottiene in laboratorio mediante decomposizione di composti contenenti ossigeno

Con sostanze semplici:
Con non metalli:
S+O 2 COSÌ 2
P+O 2 P 2 O 5
Con metalli:
Mg+O 2 MgO
Fe+O 2 Fe 3 O 4 (FeO Fe 2 O 3 )
Quando le sostanze semplici interagiscono con l'ossigeno, si formano gli ossidi

Pensa e rispondi
UN
1
B
2
V
3
G
4
D
5

Pensa e rispondi
- Scienziati coinvolti nella produzione e nello studio dell'ossigeno:
a) Dmitrij Ivanovic Mendeleev;
b) Joseph Priestley;
c) Antoine Laurent Lavoisier;
d) Karl Scheele;
d) Michail Vasilievich Lomonosov

Pensa e rispondi
2. Tre diverse boccette contengono aria, anidride carbonica e ossigeno. Puoi riconoscere ciascuno dei gas:
a) confrontare le masse dei palloni pieni di gas
b) utilizzando una scheggia fumante
c) dalla solubilità dei gas in acqua
d) dall'olfatto
e) con l'ausilio di altre sostanze

Pensa e rispondi
3. In laboratorio l'ossigeno si ottiene:
a) liquefazione dell'aria
b) decomposizione dell'acqua
c) decomposizione del permanganato di potassio
d) dal perossido di idrogeno
e) ossidazione delle sostanze

Pensa e rispondi
4. L’ossigeno può essere raccolto spostando l’acqua perché:
a) più leggero dell'aria
b) altamente solubile in acqua
c) più pesante dell'aria
d) scarsamente solubile in acqua
D ) non ha colore, odore, sapore

Pensa e rispondi
5. Stiamo parlando dell'ossigeno come sostanza semplice:
a) l'ossigeno fa parte dell'acqua;
b) l'ossigeno è scarsamente solubile in acqua;
c) l'ossigeno favorisce la respirazione e la combustione;
d) è un componente dell'aria;
e) fa parte dell'anidride carbonica.

UN
1
2
B
V
3
G
4
D
5

Ar(O)=16 non metallo B= II
T = – 1 83 °C
Liquido blu pallido
Io Neme
T = –219 °C
nell'industria: raffreddamento ad aria a -183 °C
ossidazione
E X DI A
Cristalli blu
in laboratorio:
H2O H2O2 KMnO4 KClO3
Metodi di raccolta:
Spostamento dell'aria
Spostamento dell'acqua

Compiti a casa
§3 2–34
"3" - Con. 111 domande 1,2
"4" - Con. 111 domande 3.4
"5" - Con. 111 domande 5.6
Compito:È noto che il corpo umano contiene il 65% di ossigeno in peso. Calcola quanto ossigeno c'è nel tuo corpo.
Compito creativo:
Componi un cruciverba, rebus, VOC sull'argomento "Ossigeno"

Ossigeno L'ossigeno è un elemento del sottogruppo principale del sesto gruppo, il secondo periodo del sistema periodico degli elementi chimici di D.I. Mendeleev, con numero atomico 8. Indicato con il simbolo O (lat. Oxygenium). L'ossigeno è un non metallo chimicamente attivo ed è l'elemento più leggero del gruppo calcogeno. La sostanza semplice ossigeno (numero CAS:) in condizioni normali è un gas incolore, insapore e inodore, la cui molecola è composta da due atomi di ossigeno (formula O 2), e quindi è anche chiamata diossigeno. L'ossigeno liquido è di colore azzurro.
Esistono altre forme allotropiche di ossigeno, ad esempio l'ozono (numero CAS:) in condizioni normali, un gas blu con un odore specifico, la cui molecola è composta da tre atomi di ossigeno (formula O 3).

Storia della scoperta Si ritiene ufficialmente che l'ossigeno sia stato scoperto dal chimico inglese Joseph Priestley il 1 agosto 1774 decomponendo l'ossido di mercurio in un recipiente ermeticamente chiuso (Priestley diresse i raggi del sole su questo composto usando una potente lente). 2HgO(t)2Hg + O2

Tuttavia Priestley inizialmente non si rese conto di aver scoperto una nuova sostanza semplice: credeva di aver isolato una delle parti costitutive dell'aria (e chiamò questo gas “aria deflogisticata”); Priestley riferì la sua scoperta all'eccezionale chimico francese Antoine Lavoisier. Nel 1775 A. Lavoisier stabilì che l'ossigeno è un componente dell'aria, degli acidi e si trova in molte sostanze.

Alcuni anni prima (nel 1771), l'ossigeno fu ottenuto dal chimico svedese Karl Scheele. Calciò il salnitro con acido solforico e poi decompose l'ossido nitrico risultante. Scheele chiamò questo gas “aria di fuoco” e descrisse la sua scoperta in un libro pubblicato nel 1777 (proprio perché il libro fu pubblicato più tardi rispetto all'annuncio della sua scoperta da parte di Priestley, quest'ultimo è considerato lo scopritore dell'ossigeno). Scheele riferì la sua esperienza anche a Lavoisier.


Alla fine, A. Lavoisier capì finalmente la natura del gas risultante, utilizzando le informazioni di Priestley e Scheele. La sua opera fu di enorme importanza poiché grazie ad essa la teoria del flogisto, allora dominante e che ostacolava lo sviluppo della chimica, venne rovesciata. Lavoisier condusse esperimenti sulla combustione di varie sostanze e confutò la teoria del flogisto, pubblicando risultati sul peso degli elementi bruciati. Il peso della cenere superava il peso originale dell'elemento, il che ha dato a Lavoisier il diritto di affermare che durante la combustione si verifica una reazione chimica (ossidazione) della sostanza, e quindi aumenta la massa della sostanza originale, il che confuta la teoria del flogisto . Pertanto, il merito della scoperta dell'ossigeno è in realtà condiviso tra Priestley, Scheele e Lavoisier.

Origine del nome La parola ossigeno (chiamata anche “soluzione acida” all'inizio del XIX secolo) deve in qualche modo la sua comparsa nella lingua russa a M.V Lomonosov, che introdusse la parola “acido”, insieme ad altri neologismi; quindi, la parola “ossigeno”, a sua volta, era una traccia del termine “ossigeno” (francese l "oxygène), proposto da A. Lavoisier (greco όξύγενναω da ξύς "aspro" e γενναω "partorire"), che è tradotto come "generatore di acido", dovuto al suo significato originale di "acido", che in precedenza significava ossidi, chiamati ossidi secondo la moderna nomenclatura internazionale.

Presenza in natura L'ossigeno è l'elemento più comune sulla Terra; la sua quota (in vari composti, soprattutto silicati) rappresenta circa il 47,4% della massa della crosta terrestre solida; Il mare e le acque dolci contengono un'enorme quantità di ossigeno legato, pari all'88,8% (in massa), nell'atmosfera il contenuto di ossigeno libero è del 20,95% in volume e del 23,12% in massa. Più di 1.500 composti nella crosta terrestre contengono ossigeno. L'ossigeno fa parte di molte sostanze organiche ed è presente in tutte le cellule viventi. Per il numero di atomi nelle cellule viventi è circa il 25% e per la frazione di massa è circa il 65%.

Ottenimento Attualmente, nell'industria, l'ossigeno viene ottenuto dall'aria. I laboratori utilizzano ossigeno prodotto industrialmente, fornito in bombole di acciaio ad una pressione di circa 15 MPa. Il metodo di laboratorio più importante per la sua produzione è l'elettrolisi di soluzioni acquose di alcali. Piccole quantità di ossigeno possono essere ottenute anche facendo reagire una soluzione di permanganato di potassio con una soluzione acidificata di perossido di idrogeno. Anche gli impianti di ossigeno che funzionano sulla base delle tecnologie a membrana e ad azoto sono ben noti e utilizzati con successo nell'industria. Quando riscaldato, il permanganato di potassio KMnO 4 si decompone in manganato di potassio K 2 MnO 4 e biossido di manganese MnO 2 con il rilascio simultaneo di ossigeno gassoso O 2: 2KMnO 4 K2MnO 4 + MnO 2 + O 2

In condizioni di laboratorio, si ottiene anche dalla decomposizione catalitica del perossido di idrogeno H 2 O 2: 2H 2 O 2 2H 2 O + O 2 Il catalizzatore è il biossido di manganese (MnO 2) o un pezzo di verdura cruda (contengono enzimi che accelerare la decomposizione del perossido di idrogeno). L'ossigeno può anche essere ottenuto mediante decomposizione catalitica del clorato di potassio (sale di Berthollet) KClO 3: 2KClO 3 2KCl + 3O 2 Oltre al metodo di laboratorio di cui sopra, l'ossigeno viene ottenuto con il metodo di separazione dell'aria in impianti di separazione dell'aria con una purezza di fino al 99,9999% in O2.

Proprietà fisiche In condizioni normali, l'ossigeno è un gas incolore, insapore e inodore. 1 litro pesa 1.429 g Leggermente più pesante dell'aria. Leggermente solubile in acqua (4,9 ml/100 g a 0 °C, 2,09 ml/100 g a 50 °C) e alcol (2,78 ml/100 g a 25 °C). Si dissolve bene nell'argento fuso (22 volumi di O 2 in 1 volume di Ag a 961 °C). È paramagnetico. Quando l'ossigeno gassoso viene riscaldato, avviene la sua dissociazione reversibile in atomi: a 2000 °C 0,03%, a 2600 °C 1%, a 4000 °C 59%, a 6000 °C 99,5%. L'ossigeno liquido (punto di ebollizione 182,98 °C) è un liquido blu pallido. Diagramma di fase O 2 Ossigeno solido (punto di fusione 218,79 °C) cristalli blu. Si conoscono sei fasi cristalline, tre delle quali esistono alla pressione di 1 atm:

α-O 2 esiste a temperature inferiori a 23,65 K; i cristalli blu brillante appartengono al sistema monoclino, parametri cellulari a=5.403 Å, b=3.429 Å, c=5.086 Å; β=132,53° β-O 2 esiste nell'intervallo di temperature da 23,65 a 43,65 K; i cristalli di colore azzurro (con l'aumentare della pressione il colore vira al rosa) hanno un reticolo romboedrico, parametri cellulari a=4,21 Å, α=46,25° γ-O 2 esiste a temperature da 43,65 a 54,21 K; i cristalli blu pallidi hanno simmetria cubica, parametro reticolare a = 6,83 Å

Ad alte pressioni si formano altre tre fasi: intervallo di temperatura δ-O 2 fino a 300 K e pressione 6-10 GPa, cristalli arancioni; Pressione ε-O 2 da 10 a 96 GPa, colore del cristallo dal rosso scuro al nero, sistema monoclino; La pressione di ζ-O 2 è superiore a 96 GPa, uno stato metallico dalla caratteristica lucentezza metallica, a basse temperature si trasforma in uno stato superconduttore.

Proprietà chimiche Forte agente ossidante, interagisce con quasi tutti gli elementi, formando ossidi. Stato di ossidazione 2. Di norma, la reazione di ossidazione procede con il rilascio di calore e accelera con l'aumentare della temperatura. Un esempio di reazioni che avvengono a temperatura ambiente: 4K + O 2 2K 2 O 2Sr + O 2 2SrO Ossida i composti che contengono elementi con uno stato di ossidazione non massimo: 2NO + O 2 2NO 2


L'ossigeno non ossida Au e Pt, alogeni e gas inerti. L'ossigeno forma perossidi con stato di ossidazione 1. Ad esempio, i perossidi si ottengono mediante combustione di metalli alcalini in ossigeno: 2Na + O 2 Na 2 O 2 Alcuni ossidi assorbono ossigeno: 2BaO + O 2 2BaO 2

Secondo la teoria della combustione sviluppata da A. N. Bach e K. O. Engler, l'ossidazione avviene in due fasi con la formazione di un composto intermedio di perossido. Questo composto intermedio può essere isolato, ad esempio, quando una fiamma di idrogeno in fiamme viene raffreddata con ghiaccio, insieme all'acqua si forma il perossido di idrogeno: H 2 + O 2 H 2 O 2 I superossidi hanno uno stato di ossidazione di 1/2, che cioè un elettrone per due atomi di ossigeno (ione O 2 -). Si ottiene facendo reagire i perossidi con l'ossigeno a pressioni e temperature elevate: Na 2 O 2 + O 2 2NaO 2 Gli ozonidi contengono lo ione O 3 - con uno stato di ossidazione di 1/3. Si ottiene dall'azione dell'ozono sugli idrossidi di metalli alcalini: KOH(solido) + O 3 KO 3 + KOH + O 2 Lo ione diossigenile O 2 + ha uno stato di ossidazione di +1/2. Ottenuto dalla reazione: PtF 6 + O 2 O 2 PtF 6

Fluoruri di ossigeno Il difluoruro di ossigeno, OF 2 stato di ossidazione +2, si ottiene facendo passare il fluoro attraverso una soluzione alcalina: 2F 2 + 2NaOH OF 2 + 2NaF + H 2 O Monofluoruro di ossigeno (diossidifluoruro), O 2 F 2, instabile, stato di ossidazione + 1. Si ottiene da una miscela di fluoro e ossigeno in una scarica luminescente alla temperatura di 196 °C. Facendo passare una scarica luminescente attraverso una miscela di fluoro e ossigeno ad una determinata pressione e temperatura, si ottengono miscele di fluoruri di ossigeno superiori O 3 F 2, O 4 F 2, O 5 F 2 e O 6 F 2. L'ossigeno supporta i processi di respirazione, combustione e decadimento. Nella sua forma libera, l'elemento esiste in due modifiche allotropiche: O 2 e O 3 (ozono).

Applicazione Chimica, petrolchimica: creazione di un ambiente inerte in contenitori, spegnimento di incendi con azoto, spurgo e collaudo di tubazioni, rigenerazione di catalizzatori, confezionamento di prodotti in ambiente di azoto, intensificazione di processi di ossidazione, rilascio di metano, idrogeno, anidride carbonica.








Diapositiva 1
Presentazione sulla chimica sul tema: "Uso dell'ossigeno"
studenti della classe ____ _______________________ ____________________

Diapositiva 6
Cornelio Drebbel
Un fatto interessante è che per la prima volta l'ossigeno non fu isolato dai chimici. Ciò fu fatto dall'inventore del sottomarino K. Drebbel all'inizio del XVII secolo. Ha usato questo gas per respirare nella barca immersa nell'acqua. Ma il lavoro dell'inventore era riservato. Pertanto, il lavoro di K. Drebbel non ha avuto un ruolo importante nello sviluppo della chimica.

Diapositiva 7
Scopritori dell'ossigeno
Joseph Priestley Karl Scheele Antoine Lavoisier

Diapositiva 10
Uso dell'ossigeno L'uso industriale diffuso dell'ossigeno iniziò a metà del XX secolo, dopo l'invenzione dei turboespansori, dispositivi per la liquefazione e la separazione. L'uso dell'ossigeno è molto vario e si basa sulle sue proprietà chimiche. Industria chimica e petrolchimica. L'ossigeno viene utilizzato per ossidare i reagenti di partenza, producendo acido nitrico, ossido di etilene, ossido di propilene, cloruro di vinile e altri composti basici. Inoltre, può essere utilizzato per aumentare la produttività degli inceneritori di rifiuti. Industria del petrolio e del gas. Aumento della produttività dei processi di cracking del petrolio, lavorazione di composti ad alto numero di ottano, iniezione nel giacimento per aumentare l'energia di spostamento.

Diapositiva 11
Applicazione di ossigeno
Metallurgia e industria mineraria. L'ossigeno viene utilizzato nella produzione di acciaio di conversione, sabbiatura con ossigeno negli altiforni, estrazione dell'oro dai minerali, produzione di ferroleghe, fusione di nichel, zinco, piombo, zirconio e altri metalli non ferrosi, riduzione diretta del ferro, sverniciatura di bramme in fonderie, perforazione antincendio di rocce dure.

Diapositiva 12
Saldatura e taglio dei metalli. L'ossigeno nelle bombole è ampiamente utilizzato per il taglio a fiamma e la saldatura dei metalli, per il taglio dei metalli al plasma ad alta precisione.

Diapositiva 13
Equipaggiamento militare. Nelle camere iperbariche, per il funzionamento dei motori diesel sott'acqua, carburante per motori a razzo. Utilizzato nelle attrezzature subacquee, spaziali e antincendio.