V-A guruh elementlarining umumiy xarakteristikalari. V guruhning P-elementlari Asosiy kichik guruhning 5-guruhi elementlarining maksimal valentligi
Elementlarning o'xshashligi:
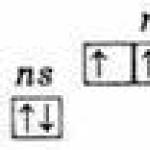
Atomlarning tashqi elektron qatlamining bir xil tuzilishi ns 2 np 3;
P-elementlar;
Yuqori qishloq O. +5 ga teng;
Pastki s. O. -3 ga teng (Sb va Bi uchun xaraktersiz).
V guruhning asosiy kichik guruhining elementlari uchun ba'zan "galogenlar" va "kalkogenlar" atamalariga o'xshashlik yo'li bilan kiritilgan va fosfor P va azot N elementlarining belgilaridan olingan "pniktojenlar" guruhi nomi ishlatiladi.
Atomlarning valentlik holatlari
P, As, Sb, Bi atomlari uchun 2 ta valentlik holati mumkin:
Asosiy ns 2 np 3
Shoxli ns 1 np 3 nd 1
Azot va kichik guruhning boshqa elementlari o'rtasidagi farq
1. Azot atomida tashqi elektron qatlamda d-orbitallar yo’qligi sababli almashinish mexanizmiga ko’ra azot atomi hosil qilgan kovalent bog’lanishlar soni 3 tadan ko’p bo’lishi mumkin emas.
2. Azot atomining 2s ostki sathida yolg‘iz elektron juftining mavjudligi donor-akseptor mexanizmi orqali kovalent bog‘ hosil qilish imkonini beradi. Shunday qilib, N ning eng yuqori valentligi IV ga teng.
3. Kislorod bilan birikmalarda azot +1, +2, +3, +4, +5 oksidlanish darajalarini namoyon qiladi.
Elementlar va ular hosil qiladigan moddalar xossalarining vertikal o'zgarishi
Galogenlar va xalkogenlardan farqli o'laroq, V guruhning asosiy kichik guruhida yadro zaryadi va atomlar radiusi ortishi bilan elementlar va ular hosil qiladigan oddiy moddalarning xususiyatlari keskinroq o'zgaradi:
Elementlar va ular hosil qiladigan oddiy moddalar xossalarining vertikal o'zgarishi |
|||||
metall bo'lmaganlar |
metall bo'lmagan ayrim belgilarga ega bo'lgan metall |
||||
Oksidlar va gidroksidlar |
Azot va uning kislorodli birikmalari bir qator farqlari tufayli alohida ko'rib chiqiladi. |
||||
E 2 O 3 va tegishli gidroksidlar |
P 2 O 3 (P 4 O 6) kislota oksidi |
Amfoterlik belgilari bilan 2 O 3 kislotali oksid sifatida |
Sb 2 O 3 amfoter oksidi |
Bi 2 O 3 asosli oksidi |
|
E 2 O 5 va tegishli gidroksidlar |
P 2 O 5 (P 4 O 10) kislota oksidi |
2 O 5 kislota oksidi sifatida |
Sb 2 O 5 kislota oksidi |
Bi 2 O 5 amfoter mo'rt |
|
HPO 3 (H 3 PO 4) |
|||||
kuchsiz kislotalar |
|||||
Kislota xossalari zaiflashadi |
|||||
Asosiy xususiyatlar yaxshilanadi |
|||||
Vodorod birikmalari EN 3
V guruhning asosiy kichik guruhining elementlari vodorod bilan uchuvchi birikmalar hosil qiladi, ular xarakterli hidli zaharli gazlardir. Ular kuchli kamaytiruvchi moddalardir. VII va VI guruhdagi metall bo'lmagan vodorod birikmalaridan farqli o'laroq, ular suvli eritmalarda H + ionlarini hosil qilmaydi, ya'ni ular kislotali xususiyatni ko'rsatmaydi.
5-GURUH ELEMENTLARNING UMUMIY XUSUSIYATLARI.
Davriy sistemaning V 0 01 F asosiy kichik guruhiga azot, fosfor, mishyak, surma va vismut kiradi. Atomning tashqi qatlamida beshta elektronga ega bo'lgan bu elementlar umumiy xususiyatga ega
metall bo'lmaganlar kabi. Biroq, ularning elektronlarni biriktirish qobiliyati VI va VII guruhlarning mos keladigan elementlariga qaraganda ancha kam aniqlanadi. Beshta tashqi elektron mavjudligi sababli ushbu kichik guruh elementlarining eng yuqori musbat oksidlanishi -5, manfiy - 3. Elektromanfiyligi nisbatan past bo'lganligi sababli, ko'rib chiqilayotgan elementlarning vodorod bilan bog'lanishi kamroq qutbga ega. VI va VII guruh elementlarining vodorod bilan bog'lanishi. Shuning uchun bu elementlarning vodorod birikmalari suvli eritmada H vodorod ionlarini yo'qotmaydi va shuning uchun kislotali xususiyatga ega emas. Azot kichik guruhi elementlarining fizik va kimyoviy xossalari o'zgaradi
0 0 1 Seriya raqamini kuzatilgan ketma-ketlikda oshirish
0 0 1 Oldin ko'rib chiqilgan guruhlar uchun, Ammo metall bo'lmagan xususiyatlar ifodalanganligi sababli
kislorodga va ayniqsa ftorga qaraganda zaifroq bo'lsa, unda 0 0 1 F ga o'tish paytida bu xususiyatlarning zaiflashishi quyidagi elementlarning paydo bo'lishiga va metall xususiyatlarining oshishiga olib keladi.
Ikkinchisi mishyakda allaqachon seziladi, surma ikkala xususiyatga ham taxminan teng darajada ega va vismutda metall xususiyatlar metall bo'lmaganlarga nisbatan ustunlik qiladi. ELEMENTLARNING TA'RIFI. AZOT(yunoncha ázōos — jonsiz, lot. Nitrogenium), N, kimyoviy element V
Mendeleyev davriy sistemasi guruhlari, atom raqami 7, atom massasi 14,0067; rangsiz gaz, hidsiz va ta'msiz. Tarixiy ma'lumotnoma. Azotli birikmalar - selitra, azot kislotasi, ammiak bo'lgan
erkin holatda azot ishlab chiqarilishidan ancha oldin ma'lum. 1772 yilda D. Ruterford shisha qo'ng'iroqda fosfor va boshqa moddalarni yoqib, "bo'g'uvchi havo" deb atagan yonishdan keyin qolgan gaz nafas olish va yonishni qo'llab-quvvatlamasligini ko'rsatdi. 1787 yilda A.Lavuazye havoni tashkil etuvchi "hayotiy" va "bo'g'uvchi" gazlar oddiy moddalar ekanligini aniqladi va "azot" nomini taklif qildi. 1784 yilda G. Kavendish azotning selitraning bir qismi ekanligini ko'rsatdi; Bu erdan lotincha azot nomi kelib chiqqan (kech lotincha nitrum - selitra va yunoncha gennao - men tug'aman, ishlab chiqaraman), 1790 yilda J. A. Chaptal tomonidan taklif qilingan. 19-asr boshlariga kelib. Azotning erkin xolatdagi kimyoviy inertligi va bog'langan azot sifatida boshqa elementlar bilan birikmalardagi eksklyuziv roli aniqlandi. O'shandan beri havo azotining "bog'lanishi" kimyoning eng muhim texnik muammolaridan biriga aylandi. Tabiatda tarqalishi. Azot eng keng tarqalgan elementlardan biridir
Yer va uning asosiy qismi (taxminan 4'1015 T) atmosferada erkin holatda to'plangan. Havoda erkin azot (N2 molekulalari shaklida) ammiak va oksidlar ko'rinishidagi kichik aralashmalarini hisobga olmaganda, hajmi bo'yicha 78,09% (yoki massa bo'yicha 75,6%). Litosferadagi azotning o'rtacha miqdori massa bo'yicha 1,9´10-3% ni tashkil qiladi. Tabiiy azot birikmalari. - ammoniy xlorid NH4Cl va turli xil nitratlar (qarang.
Selitra.) Selitraning katta toʻplanishi quruq choʻl iqlimi uchun xarakterlidir (Chili, Oʻrta Osiyo). Uzoq vaqt davomida nitrat sanoat uchun azotning asosiy yetkazib beruvchisi edi (hozirda havo azotidan va vodoroddan ammiakning sanoat sintezi azotni biriktirish uchun birinchi darajali ahamiyatga ega). Oʻzgarmas azotning oz miqdori koʻmir (1-2,5%) va neftda (0,02-1,5%), shuningdek, daryolar, dengizlar va okeanlar suvlarida uchraydi. Azot tuproqlarda (0,1%) va tirik organizmlarda (0,3%) to'planadi.
"Azot" nomi "hayotni saqlamaydigan" degan ma'noni bildirsa-da, aslida u hayot uchun muhim element hisoblanadi. Hayvon va odam oqsilida 16 - 17% azot mavjud. Yirtqich hayvonlarning organizmlarida oqsil o'txo'r hayvonlar organizmlarida va o'simliklarda mavjud bo'lgan iste'mol qilingan oqsil moddalari hisobiga hosil bo'ladi. O'simliklar tuproq tarkibidagi azotli moddalarni, asosan noorganik moddalarni o'zlashtirib, oqsil sintez qiladi. Azotning katta miqdori havodagi erkin azotni azot birikmalariga aylantirishga qodir bo'lgan azotni biriktiruvchi mikroorganizmlar tufayli tuproqqa kiradi. Azot aylanishi tabiatda sodir bo'ladi, unda asosiy rol o'ynaydi
mikroorganizmlar - nitrofiyalash, denitrofiyalash, azot fiksatsiyalash va boshqalar.Ammo o'simliklar tomonidan tuproqdan qattiq azotning katta miqdorda olinishi natijasida (ayniqsa, intensiv dehqonchilikda) tuproqlarda azot kamayib ketadi. Azot tanqisligi deyarli barcha mamlakatlarda qishloq xo'jaligiga xosdir; Mavjud azotga ega bo'lmagan tuproqlarda o'simliklar yomon rivojlanadi. Azotli o'g'itlar va hayvonlarni oqsil bilan oziqlantirish qishloq xo'jaligini rivojlantirishning eng muhim vositasidir. Insonning iqtisodiy faoliyati azot aylanishini buzadi. Shunday qilib, yoqilg'ining yonishi atmosferani azot bilan boyitadi va o'g'itlar ishlab chiqaradigan zavodlar azotni havodan bog'laydi. O'g'itlar va qishloq xo'jaligi mahsulotlarini tashish azotni er yuzasiga qayta taqsimlaydi. Azot quyosh sistemasida toʻrtinchi eng keng tarqalgan element (vodoroddan keyin,
geliy va kislorod). Izotoplar, atom, molekula. Tabiiy azot ikkita barqaror izotopdan iborat: 14N
(99,635%) va 15N (0,365%). 15N izotopi kimyoviy va biokimyoviy tadqiqotlarda etiketlangan atom sifatida ishlatiladi. Azotning sun'iy radioaktiv izotoplaridan 13N eng uzun yarimparchalanish davriga ega (T1/2 - 10,08) min), qolganlari juda qisqa muddatli. Atmosferaning yuqori qatlamlarida kosmik nurlanish neytronlari ta'sirida 14N 14C radioaktiv uglerod izotopiga aylanadi. Bu jarayon 14C hosil qilish uchun yadro reaktsiyalarida ham qo'llaniladi. Azot atomining tashqi elektron qobig'i. 5 elektrondan iborat (bitta yolg'iz juft va uchta juftlashtirilmagan - konfiguratsiya 2 s 22p 3). Ko'pincha azot. birikmalarda juftlashtirilmagan elektronlar tufayli 3-kovalent bo'ladi (ammiak NH3 kabi). Yagona juft elektronning mavjudligi boshqa kovalent bog'ning paydo bo'lishiga olib kelishi mumkin va azot 4-kovalent bo'ladi (ammiak ioni NH4+ kabi). Azotning oksidlanish darajasi +5 dan (N205 da) -3 gacha (NH3 da). Oddiy sharoitlarda, erkin holatda, azot N2 molekulasini hosil qiladi, bu erda N atomlari uchta kovalent aloqa bilan bog'lanadi. Azot molekulasi juda barqaror: uning atomlarga dissotsilanish energiyasi 942,9 ga teng. kJ/mol (225,2 kkal/mol), shuning uchun hatto bilan t azot dissotsiatsiyasining taxminan 3300 ° C darajasi. atigi 0,1% ni tashkil qiladi. Fizikaviy va kimyoviy xossalari. Azot havodan bir oz engilroq; zichligi 1.2506 kg/
m3(0 ° C va 101325 da n/m2 yoki 760 mmHg Art.), tpl-209,86°C, qaynamoq-195,8?S. A. qiyinchilik bilan suyultiriladi: kritik harorati ancha past (-147,1°S), kritik bosimi esa yuqori 3,39 Mn/m2 (34,6 kgf/sm2); suyuq azotning zichligi 808 kg (m3. Azot suvda kislorodga qaraganda kamroq eriydi: 0 ° C da 1 m3 H2O 23.3 ni eritadi G azot. Azot baʼzi uglevodorodlarda suvga qaraganda koʻproq eriydi. Faqat litiy, kaltsiy, magniy, azot kabi faol metallar bilan
nisbatan past haroratgacha qizdirilganda o'zaro ta'sir qiladi. Azot yuqori haroratlarda va katalizatorlar ishtirokida boshqa elementlarning ko'pchiligi bilan reaksiyaga kirishadi. Azotning kislorod N2O, NO, N2O3, NO2 va N2O5 bilan birikmalari yaxshi o'rganilgan. Bulardan elementlarning toʻgʻridan-toʻgʻri oʻzaro taʼsirida (4000°C) NO oksidi hosil boʻladi, u sovigandan soʻng NO2 dioksidigacha oson oksidlanadi. Havoda azot oksidlari atmosfera chiqindilari paytida hosil bo'ladi. Ularni azot va kislorod aralashmasini ionlashtiruvchi nurlanish ta'sirida ham olish mumkin. Qachon azotli N2O3 va
Nitrat angidridlari N2O5 mos ravishda azot kislotasi HNO2 va nitrat kislota HNO3 ni hosil qilib, tuzlar - nitritlar va nitratlar hosil qiladi. Azot vodorod bilan faqat yuqori haroratda va katalizatorlar ishtirokida birlashadi va ammiak NH3 hosil bo'ladi. Ammiakdan tashqari, azotning vodorod bilan ko'plab boshqa birikmalari ham ma'lum, masalan, gidrazin H2N-NH2, diimid HN-NH, gidronitrat kislota HN3 (H-N-NºN), oktazon N8H14 va boshqalar; Ko'pgina azot va vodorod birikmalari faqat organik hosilalar shaklida ajratiladi. Azot galogenlar bilan to'g'ridan-to'g'ri o'zaro ta'sir qilmaydi, shuning uchun barcha azot galogenidlari faqat bilvosita olinadi, masalan, ftor ammiak bilan reaksiyaga kirishganda azot ftorid NF3-. Qoida tariqasida, azot galogenidlari past barqaror birikmalardir (NF3 dan tashqari); Azot oksigalidlari barqarorroq - NOF, NOCI, NOBr, N02F va NO2CI. Azot ham to'g'ridan-to'g'ri oltingugurt bilan birikmaydi; azotli oltingugurt N4S4 suyuq oltingugurtning ammiak bilan reaksiyaga kirishishi natijasida olinadi. Issiq koks azot bilan reaksiyaga kirishganda, siyanogen (CN) hosil bo'ladi.;. Azotni asetilen C2H2 bilan 1500°C ga qizdirish orqali vodorod siyanidi HCN ni olish mumkin. Azotning yuqori haroratda metallar bilan oʻzaro taʼsiri nitridlar hosil boʻlishiga olib keladi (masalan, Mg3N2). Oddiy azotga elektr razryadlari ta'sir qilganda [bosim 130 - 270 n/m2(1- 2
mmHg)] yoki B, Ti, Mg va Ca nitridlarining parchalanishi paytida, shuningdek havodagi elektr razryadlari paytida faol azot hosil bo'lishi mumkin, bu azot molekulalari va atomlarning energiya zaxirasi ortib borayotgan aralashmasidir. Molekulyar azotdan farqli o'laroq, faol azot kislorod, vodorod, oltingugurt bug'lari, fosfor va ba'zi metallar bilan juda energetik o'zaro ta'sir qiladi. Azot ko'plab muhim organik birikmalarning bir qismidir (aminlar,
aminokislotalar, nitro birikmalar va boshqalar). Kvitansiya va ariza. Laboratoriyada azotni osongina olish mumkin
ammoniy nitritning konsentrlangan eritmasini qizdirish: NH4NO2 - N2 + 2H2O. Azot ishlab chiqarishning texnik usuli oldindan suyultirilgan havoni ajratishga asoslangan bo'lib, u keyinchalik distillashdan o'tkaziladi. Olingan erkin azotning asosiy qismi sanoat uchun ishlatiladi
ammiak ishlab chiqarish, keyinchalik u nitrat kislota, o'g'itlar, portlovchi moddalar va boshqalarga sezilarli miqdorda qayta ishlanadi. Elementlardan ammiakni to'g'ridan-to'g'ri sintez qilishdan tashqari, siyanamid usuli 1905 yilda 1000 ° C da karbid kaltsiyiga asoslangan holda ishlab chiqilgan. (elektr pechida ohak va ko'mir aralashmasini qizdirish natijasida olingan) erkin azot bilan reaksiyaga kirishadi: CaC2 + N2 = CaCN2 + C. Hosil bo'lgan kaltsiy siyanamid o'ta qizdirilgan suv bug'lari ta'sirida parchalanadi va ammiakni chiqaradi:
CaCN+3H2O=CaCO3+2NH3.
Erkin azot ko'plab sanoat tarmoqlarida qo'llaniladi: turli xil kimyoviy va metallurgiya jarayonlarida inert muhit sifatida, simob termometrlarida bo'sh joyni to'ldirish uchun, yonuvchi suyuqliklarni pompalashda va hokazo. Suyuq azot turli xil sovutgichlarda qo'llaniladi. U po'lat Dewar idishlarida, siqilgan shaklda azot gazida - silindrlarda saqlanadi va tashiladi. Ko'pgina azotli birikmalar keng qo'llaniladi, fiksatsiyalangan azot ishlab chiqarish 1-jahon urushidan keyin tez rivojlana boshladi va hozirda juda katta nisbatlarga erishdi.
Fosfor(lot. Fosfor), P, Mendeleyev davriy sistemasining V guruhining kimyoviy elementi, atom raqami 15, atom massasi 30,97376, metall bo'lmagan. Tabiiy fosfor bitta barqaror izotopdan iborat, 31P; oltita sun'iy radioaktiv izotoplar olindi: 28P ( T1/2 - 6,27 sek), 29P ( T1/2 - 4,45 sek); 30P ( T1/2 - 2,55 min), 31P ( T1/2
14,22 kunlar), 32P ( T1/2 - 25 kunlar), 33P ( T1/2 - 12,5 sek). 32P eng katta qiymatga ega , muhim b-nurlanish energiyasiga ega va kimyoviy va biokimyoviy tadqiqotlarda belgilangan atom sifatida ishlatiladi. Tarixiy ma'lumotnoma. Ba'zi adabiyot ma'lumotlariga ko'ra, olish usuli
Fosfor arablarga allaqachon ma'lum bo'lgan. 12-asrning alkimyogarlari. Ammo fosforni kashf qilishning umume'tirof etilgan sanasi 1669 yil hisoblanadi, o'shanda H. Brand (Germaniya) siydikning bug'lanishidan quruq qoldiqni qum bilan kaltsiylash va keyinchalik havoga kirmasdan distillash yo'li bilan porlab turadigan moddani olgan. qorong'i, dastlab "sovuq olov" deb nomlangan, keyin esa yunoncha fosfor. fosfor - yorqin. Tez orada unga fosfor olish usuli ma'lum bo'ldi. kimyogarlar - I. Kraft, I. Kunkel; 1682 yilda bu usul nashr etilgan. 1743 yilda A. S. Marggraf fosfor olishning quyidagi usulini ishlab chiqdi: qo'rg'oshin xlorid va siydik aralashmasi quruq bo'lgunga qadar bug'landi va uchuvchi mahsulotlarning ajralib chiqishi to'xtaguncha qizdirildi; qoldiq kukunli ko'mir bilan aralashtiriladi va loy retortida distillangan; Qabul qilgichda suv bilan kondensatsiyalangan fosfor bug'i. Suyak kulini ko'mir bilan kaltsiylash orqali fosfor olishning eng oddiy usuli faqat 1771 yilda K. Scheele tomonidan taklif qilingan. Fosforning elementar tabiati A.Lavuazye tomonidan asos solingan. 19-asrning 2-yarmida. retort pechlarida fosforitlardan fosforni sanoat ishlab chiqarish vujudga keldi; 20-asr boshlarida. ular o'rnini elektr pechlar egalladi. Tabiatda tarqalishi. Yer qobig'idagi o'rtacha fosfor miqdori (klark) -
og'irligi bo'yicha 9,3×10-2%; o'rtacha jinslarda 1,6×10-1, asosli jinslarda 1,4×10-1, granitlarda va boshqa kislotali magmatik jinslarda kamroq - 7×10-2 va undan ham kamroq o'ta asosli jinslarda (mantiya) - 1, 7×10-2%. ; choʻkindi jinslarda 1,7×10-2 (qumtoshlar) dan 4×10-2% gacha (karbonatli jinslar). Fosfor magmatik jarayonlarda ishtirok etadi va biosferada kuchli migratsiya qiladi. Ikkala jarayon ham uning katta to'planishi bilan bog'liq bo'lib, apatitlar va fosforitlarning sanoat konlarini hosil qiladi. . Fosfor juda muhim biogen element bo'lib, u ko'plab organizmlar tomonidan to'planadi. Yer qobig'ida fosfor kontsentratsiyasining ko'plab jarayonlari biogen migratsiya bilan bog'liq. Fosfor suvdan erimaydigan minerallar shaklida osongina cho'kadi yoki tirik moddalar tomonidan ushlanadi. Shuning uchun dengiz suvida faqat 7 × 10-6% fosfor mavjud. 180 ga yaqin fosfor minerallari ma'lum, asosan turli xil fosfatlar, ulardan kaltsiy fosfatlari eng keng tarqalgan. . Jismoniy xususiyatlar. Elemental fosfor bir necha shaklda mavjud
allotropik modifikatsiyalar, ularning asosiylari oq, qizil va qora. Oq fosfor - fosfor bug'ining kondensatsiyasidan hosil bo'lgan, o'ziga xos hidli, mumsimon, shaffof modda. Nopokliklar mavjud bo'lganda oq fosfor - qizil fosfor, mishyak, temir va boshqalar izlari. - sariq rangga bo'yalgan, shuning uchun tijorat oq fosfor. sariq deb ataladi. Oq fosforning ikki shakli mavjud: a- va b-shakli. a- modifikatsiya kub tizimining kristallarini ifodalaydi ( A- 18,5); zichligi 1,828 g/sm3, t havo harorati 44,1 °C, t kip 280,5 °C, termoyadroviy issiqlik 2,5 kJ/mol P4 (0,6 kkal/mol P4), bug'lanish issiqligi 58,6 kJ/mol P4 (14.0 kkal/mol P4) , 25 °C da bug 'bosimi 5.7 n/m2 (0,043 mmHg Art.). 0 dan 44 ° S gacha bo'lgan harorat oralig'ida chiziqli kengayish koeffitsienti 12,4 × 10-4 ni tashkil qiladi. , issiqlik o'tkazuvchanligi 0,56 sess/(m×K) 25 °C da. Oq fosforning elektr xossalari. dielektriklarga yaqin: tarmoqli bo'shlig'i taxminan 2,1 ev, elektr qarshiligi 1,54×1011 ohm× sm, diamagnit, xususiy magnit sezuvchanlik - 0,86×10-6. Brinell qattiqligi 6 Mn/m2 (0,6 kgf/mm2). Oq fosforning a-shakli uglerod disulfidida yaxshi eriydi, suyuq ammiak, benzol, uglerod tetraxlorid va boshqalarda kamroq yaxshi eriydi - 76,9 °C va bosim 0,1. Mn/m2(1kgf/sm2) a-shakl past haroratli b-shaklga aylanadi (zichlik 1,88 g/sm3). Bosim 1200 ga oshishi bilan Mn/m2(12 ming kgf/sm2) o'tish 64,5 ° S da sodir bo'ladi. b-shakl - ikki sinishi bo'lgan kristallar, ularning tuzilishi aniq o'rnatilmagan. Oq fosfor zaharli hisoblanadi: havoda taxminan 40 ° C haroratda
o'z-o'zidan yonadi, shuning uchun uni suv ostida saqlash kerak (25 ° C da suvda eruvchanligi 3,3 × 10-4%) . Oq fosforni havoga kirmasdan 250-300 ° S haroratda bir necha soat qizdirish orqali qizil fosfor olinadi. O'tish ekzotermik, ultrabinafsha nurlar, shuningdek, aralashmalar (yod, natriy, selen) bilan tezlashadi. Oddiy tijorat qizil fosfor deyarli butunlay amorf; to'q jigarrangdan binafsha ranggacha rangga ega. Uzoq muddatli isitish bilan u turli xil xususiyatlarga ega bo'lgan kristalli shakllardan biriga (triklin, kub va boshqalar) qaytmas tarzda aylanishi mumkin: zichligi 2,0 dan 2,4 gacha. g/sm 3,t pl bir necha o'nlab atmosfera bosimida 585 dan 610 ° C gacha, sublimatsiya harorati 416 dan 423 ° C gacha, elektr qarshiligi 109 dan 1014 gacha ohm× sm. Qizil fosfor havoda o'z-o'zidan yonmaydi; 240-250 ° S haroratgacha, lekin ishqalanish yoki zarba natijasida o'z-o'zidan yonadi; suvda erimaydi, shuningdek, benzol, uglerod disulfidi va boshqalarda eriydi, fosfor tribromidida eriydi. Sublimatsiya haroratida qizil fosfor bug'ga aylanadi, soviganida esa asosan oq fosfor hosil bo'ladi. Oq fosfor bosim ostida (1,2-1,7) × 103 200-220 ° C gacha qizdirilganda Mn/m 2
[(12-17)×103 kgf/sm 2] qora fosfor hosil bo'ladi. Bu o'zgarish bosimsiz amalga oshirilishi mumkin, lekin simob va oz miqdorda qora fosfor kristallari (urug') mavjudligida 370 ° C da 8 ga. kunlar Qora fosfor ortorombik tuzilishga ega kristalldir ( A -3,31 , b - 4,38 , Bilan-10.50), panjara xarakterli fosforli tolali qatlamlardan qurilgan. atomlarning piramidal joylashishi, zichligi 2.69 g/sm3, t pl taxminan 1000 °C bosim ostida 1,8 × 103 Mn/m2(18×103 kgf/sm2). Tashqi ko'rinishida qora fosfor grafitga o'xshaydi; yarimo'tkazgich: tarmoqli oralig'i 0,33 ev 25 ° C da; 1,5 o'ziga xos elektr qarshiligiga ega ohm× sm, elektr qarshiligining harorat koeffitsienti 0,0077, diamagnit, solishtirma magnit sezuvchanligi 0,27×10-6. O'z bug'lari bosimi ostida 560-580 ° S gacha qizdirilganda qizil fosforga aylanadi. Qora fosforning faolligi past va yoqilganda yonishi qiyin, shuning uchun uni havoda xavfsiz qayta ishlash mumkin. Fosforning atom radiusi 1,34, ion radiusi: P5 + 0,35, P3 + 0,44, P3- 1,86.
Fosfor atomlari ikki atomli (P2), tetraatomik (P4) va polimer molekulalarini hosil qiladi. Oddiy sharoitlarda eng barqaror polimer molekulalari o'zaro bog'langan P4 tetraedralarining uzun zanjirlarini o'z ichiga olgan molekulalardir. Suyuq, qattiq (oq fosfor) va 800 ° C dan past bo'lgan bug'da fosfor P4 molekulalaridan iborat. 800 °C dan yuqori haroratlarda P4 molekulalari P2 ga ajraladi , bu esa, o'z navbatida, 2000 ° C dan yuqori haroratlarda atomlarga parchalanadi. Faqat oq fosfor P4 molekulalaridan iborat, boshqa barcha modifikatsiyalar polimerlardir. Kimyoviy xossalari. Fosfor atomining tashqi elektronlarining konfiguratsiyasi 3 s2 3p3, V
birikmalar, eng xarakterli oksidlanish darajalari + 5, + 3 va - 3. Azot kabi, birikmalardagi fosfor asosan kovalentdir. Na3P va Ca3P2 fosfidlari kabi juda kam ionli birikmalar mavjud. Azotdan farqli o'laroq, fosfor erkin 3 ga ega d- ancha past energiyaga ega bo'lgan orbitallar, bu koordinatsion sonni oshirish va donor-akseptor aloqalarini shakllantirish imkoniyatiga olib keladi. Fosfor kimyoviy faol, oq fosfor eng katta faollikka ega;
qizil va qora fosfor kimyoviy reaksiyalarda ancha passivdir. Oq fosforning oksidlanishi zanjir reaktsiyasi mexanizmi orqali sodir bo'ladi. Fosforning oksidlanishi odatda xemiluminesans bilan kechadi. Fosfor ortiqcha kislorodda yonganda, pentoksid P4O10 (yoki P2O5) yetishmaydi, asosan trioksid P4O6 (yoki P2O3) hosil bo'ladi. Bug'larda P4O7, P4O8 mavjudligi spektroskopik jihatdan isbotlangan , P2O6, PO va boshqa fosfor oksidlari. Fosfor pentoksidi sanoat miqyosida elementar fosforni ortiqcha quruq havoda yoqish orqali ishlab chiqariladi. P4O10 ning keyingi hidratsiyasi orto-(H3PO4) va poli-(H) hosil bo'lishiga olib keladi. n+2 P n O3 P+ 1) fosfor kislotalari. Bundan tashqari
Bundan tashqari, fosfor fosfor kislotasi H3PO3, fosfor kislotasi H4P2O6 va gipofosfor kislotasi H3PO2, shuningdek perkislotalar: perfosfor kislotasi H4P2O8 va monoperfosfor kislotasi H3PO5 Fosfor kislotalarning tuzlari (fosfatlar) hosil qiladi. , kamroq darajada - fosfitlar va gipofosfitlar. Fosfor to'g'ridan-to'g'ri barcha halogenlar bilan birlashadi va katta miqdorda chiqariladi
issiqlik miqdori va trigalidlar (PX3, bu erda X halogen), pentahalidlar (PX5) va oksigalidlar (masalan, POX3) hosil bo'lishi. . Fosfor oltingugurt bilan 100 ° C dan past haroratda birlashganda, fosfor va oltingugurtga asoslangan qattiq eritmalar hosil bo'ladi va 100 ° C dan yuqori haroratda P4S3, P4S5, P4S7, P4S10 kristalli sulfidlarini hosil qilish uchun ekzotermik reaktsiya sodir bo'ladi, ulardan faqat P4S5S3 issiqlik bilan ajralib turadi. 200 ° C va P4S7 dan yuqori, qolganlari esa parchalanmasdan eriydi. Quyidagi fosfor oksisulfidlari ma'lum: P2O3S2, P2O3S3, P4O4S3, P6O10S5 va P4O4S3. Fosfor, azot bilan solishtirganda, vodorod bilan birikmalar hosil qilish qobiliyatiga ega. Fosforli vodorod fosfin PH3 va difosfin P2H4 faqat bilvosita olinishi mumkin. Fosfor-azot birikmalaridan PN, P2N3, P3N5 nitridlari ma'lum - azotni fosfor bug'i bilan elektr yoyi orqali o'tkazish natijasida olingan qattiq, kimyoviy barqaror moddalar; polimerik fosfonitril galogenidlari - (PNX2)n (masalan, polifosfonitril xlorid) , pentagalidlarni ammiak bilan har xil sharoitlarda reaksiyaga kiritish natijasida olinadi; amidoimidofosfatlar P-O-P aloqalari bilan birga P-NH-P aloqalarini o'z ichiga olgan, odatda polimerik birikmalardir. 2000 ° C dan yuqori haroratlarda fosfor uglerod bilan reaksiyaga kirishadi
PC3 karbid oddiy erituvchilarda erimaydigan va kislotalar yoki ishqorlar bilan o'zaro ta'sir qilmaydigan moddadir. Metallar bilan qizdirilganda fosfor fosfidlar hosil qiladi. Fosfor ko'plab fosfororganik birikmalarni hosil qiladi. Kvitansiya. elementar fosfor ishlab chiqarish amalga oshiriladi
uni tabiiy fosfatlardan (apatitlar yoki fosforitlar) 1400-1600 ° S da kremniy (kvars qumi) ishtirokida koks bilan elektrotermik qaytarilishi:
2Ca3(PO4)2 + 10C + n SiO2 = P4 + 10CO + 6CaO × n SiO2 Oldindan maydalangan va boyitilgan fosforli ruda aralashtiriladi.
kremniy va koks bilan belgilangan nisbatlarda va elektr o'choqqa yuklangan. Kremniy oksidi reaksiya haroratini pasaytirish, shuningdek, qaytarilish jarayonida ajralib chiqqan kaltsiy oksidini erigan cüruf sifatida doimiy ravishda chiqariladigan kaltsiy silikatiga bog'lash orqali uning tezligini oshirish uchun zarurdir. Alyuminiy, magniy, temir va boshqa aralashmalarning silikatlar va oksidlari, shuningdek, qaytarilgan temirning bir qismining fosfor bilan o'zaro ta'siridan hosil bo'lgan ferrofosfor (Fe2P, FeP, Fe3P) ham cürufga o'tadi. Ferrofosfor, shuningdek, unda erigan marganets fosfidlari va boshqa metallarning oz miqdori, keyinchalik maxsus po'latlarni ishlab chiqarishda foydalanish uchun to'planganligi sababli elektr pechidan chiqariladi. Fosfor bug'i gazsimon qo'shimcha mahsulotlar bilan birga elektr pechdan chiqib ketadi.
mahsulotlar va uchuvchi aralashmalar (CO, SiF4, PH3, suv bug'lari, organik zaryadli aralashmalarning piroliz mahsulotlari va boshqalar) 250-350 ° S haroratda. Changdan tozalashdan so'ng, fosfor o'z ichiga olgan gazlar kondensatsiya qurilmalariga yuboriladi, ularda suyuq texnik oq fosfor kamida 50 ° C haroratda suv ostida to'planadi. Fosforni gazsimon holda olish usullari ishlab chiqilmoqda
past haroratli plazmada transport gazi sifatida ishlatiladigan tabiiy fosfatlar va qaytaruvchi gazlarning (masalan, metan) dissotsilanish haroratidan yuqori bo'lgan haroratni 2500-3000 ° S ga oshirish orqali ishlab chiqarishni faollashtirish uchun reduktorlar, plazma reaktorlari.
Ilova. Ishlab chiqarilgan fosforning asosiy qismi fosfor kislotasi va fosforli o'g'itlarga qayta ishlanadi va uning asosida olingan texnik tuzlar (fosfatlar). . Oq fosfor yondiruvchi va tutunli qobiqlarda, bombalarda ishlatiladi; qizil
fosfor - gugurt ishlab chiqarishda. Fosfor rangli metallar qotishmalarini ishlab chiqarishda oksidlovchi vosita sifatida ishlatiladi. 1% gacha fosforning kiritilishi fechral va xrom kabi qotishmalarning issiqlikka chidamliligini oshiradi. Fosfor ba'zi bronzalar tarkibiga kiradi, chunki ularning suyuqligini va ishqalanishga chidamliligini oshiradi. Metalllarning fosfidlari, shuningdek, ba'zi metall bo'lmaganlar (B, Si, As va boshqalar) yarim o'tkazgich materiallarni ishlab chiqarish va doping qilishda ishlatiladi. Fosfor qisman fosforli plastifikatorlar (masalan, trikresilfosfat, tributilfosfat va boshqalar), dori-darmonlar, fosfororganik pestitsidlar ishlab chiqarish uchun boshlang'ich material bo'lib xizmat qiladigan xloridlar va sulfidlarni ishlab chiqarish uchun ishlatiladi va shuningdek, moylashda qo'shimchalar sifatida ishlatiladi. va yoqilg'i. Xavfsizlik choralari. Oq fosfor va uning birikmalari juda zaharli hisoblanadi. Bilan ishlash
fosfor uskunani ehtiyotkorlik bilan muhrlashni talab qiladi; oq fosforni saqlang. suv ostida yoki germetik yopiq metall idishda bo'lishi kerak. Fosfor bilan ishlashda xavfsizlik qoidalariga qat'iy rioya qilish kerak. Tanadagi fosfor. Fosfor eng muhim biogen elementlardan biridir,
barcha organizmlarning hayoti uchun zarur. U tirik hujayralarda orto- va pirofosfor kislotalari va ularning hosilalari shaklida mavjud bo'lib, nukleotidlar, nuklein kislotalar, fosfoproteinlar, fosfolipidlar, uglevodlarning fosfor efirlari, ko'plab kofermentlar va boshqa organik birikmalar tarkibiga kiradi. Kimyoviy tuzilishining o'ziga xos xususiyatlaridan kelib chiqqan holda, fosfor atomlari, oltingugurt atomlari kabi, yuqori energiyali birikmalarda energiyaga boy aloqalar hosil qilish qobiliyatiga ega; adenozin trifosfor kislotasi (ATP), kreatin fosfat va boshqalar. Biologik evolyutsiya jarayonida aynan fosfor birikmalari barcha tirik tizimlarda genetik ma'lumot va energiya tashuvchilarning asosiy, universal saqlovchilariga aylandi. Dr. Fosfor birikmalarining organizmdagi muhim roli shundaki, fosfor qoldig'ining () turli organik birikmalarga fermentativ qo'shilishi (fosforlanish) ularning metabolizmida ishtirok etishi uchun "o'tish" va aksincha, ajralish uchun xizmat qiladi. fosforil qoldig'i (defosforilatsiya) bu birikmalarni faol almashinuvdan chiqarib tashlaydi. Fosfor almashinuvi fermentlari - kinazlar, fosforilazalar va fosfatazalar. Jigar hayvonlar va odamlar organizmida fosfor birikmalarining o'zgarishida asosiy rol o'ynaydi. Fosfor birikmalarining almashinuvi gormonlar va D vitamini bilan tartibga solinadi. Fosfor miqdori (100 ga mg da) G quruq moddalar) o'simlik to'qimalarida - 230-350,
dengiz hayvonlari - 400-1800, quruqlik hayvonlari - 1700-4400, bakteriyalar - 3000 ga yaqin; inson tanasida fosfor suyak to'qimalarida (bir oz ko'proq 5000), miya to'qimalarida (taxminan 4000) va mushaklarda (220-270) juda ko'p. Insonning kunlik fosforga bo'lgan ehtiyoji 1-1,2 ni tashkil qiladi G(bolalarda bu kattalarnikidan yuqori). Oziq-ovqat mahsulotlaridan fosforga eng boylari pishloq, go'sht, tuxum, dukkaklilar (no'xat, loviya va boshqalar). Tanadagi fosforning muvozanati metabolizmning umumiy holatiga bog'liq. Fosfor almashinuvining buzilishi, birinchi navbatda, energiya almashinuvida chuqur biokimyoviy o'zgarishlarga olib keladi. Organizmda fosfor etishmasligi bilan hayvonlar va odamlarda osteoporoz va boshqa suyak kasalliklari, o'simliklarda esa fosfor ochligi rivojlanadi. . Fosforning tirik tabiatdagi manbai uning tuproqdagi va suvda erigan noorganik birikmalaridir. Fosfor tuproqdan o'simliklar tomonidan eruvchan fosfatlar shaklida olinadi. Hayvonlar odatda o'z dietasidan etarli miqdorda fosfor oladi. Organizmlarning o'limidan so'ng fosfor yana tuproqqa va pastki cho'kindilarga kiradi va shu bilan ishtirok etadi. moddalar aylanishida. Metabolik jarayonlarni tartibga solishda fosforning muhim roli tirik hujayralarning ko'plab ferment tizimlarining fosfororganik birikmalar ta'siriga yuqori sezuvchanligini belgilaydi. Bu holat tibbiyotda dorivor mahsulotlar ishlab chiqarishda, qishloq xoʻjaligida fosfor ishlab chiqarishda qoʻllaniladi.
o'g'itlar, shuningdek samarali insektitsidlarni yaratishda. Ko'pgina fosfor birikmalari juda zaharli bo'lib, ba'zi fosfororganik birikmalar kimyoviy urush agentlari (zarin, soman, tabun) sifatida tasniflanishi mumkin. Fosforning radioaktiv izotopi 32P biologiya va tibbiyotda tirik organizmlardagi barcha turdagi metabolizm va energiyani o'rganishda indikator sifatida keng qo'llaniladi. . Fosforni o'z ichiga olgan dorilar (adenozin trifosfor kislotasi,
fitin, kaltsiy glitserofosfat, fosfren va boshqalar), asosan to'qimalar almashinuvi jarayonlariga ta'sir qiladi va mushaklar, asab tizimi, sil kasalliklari, ovqatlanishni yo'qotish, anemiya va boshqalar uchun ishlatiladi. Fosforning radioaktiv izotoplari izotop ko'rsatkichlari sifatida ishlatiladi. metabolizmni o'rganish, kasalliklar diagnostikasi, shuningdek o'smalarni radiatsiya terapiyasi uchun .
Arsenik(lat. Arsenicum), As, Mendeleyev davriy sistemasining V guruhi kimyoviy elementi, atom raqami 33, atom massasi 74,9216; po'lat-kulrang kristallar. Element bitta barqaror 75A izotopidan iborat. Tarixiy ma'lumotnoma. Oltingugurt bilan mishyakning tabiiy birikmalari (orpiment As2S3,
realgar As4S4) qadimgi dunyo xalqlariga ma'lum bo'lib, bu minerallardan dori va bo'yoq sifatida foydalangan. Mishyak sulfidlarini yoqish mahsuloti ham ma'lum edi - mishyak (III) oksidi As2O3 ("oq mishyak"). Arsenikón nomi allaqachon Aristotelda topilgan; u yunon tilidan olingan. arsen - kuchli, jasur va mishyak birikmalarini belgilash uchun xizmat qilgan (ularning tanaga kuchli ta'siriga asoslanib). Ruscha nomi "sichqoncha" dan (sichqonlar va kalamushlarni yo'q qilish uchun mishyak preparatlarini qo'llaganidan keyin) kelib chiqqan deb ishoniladi. Arsenikning erkin holatda ishlab chiqarilishi Albertus Magnusga tegishli (taxminan 1250). 1789 yilda A.Lavoisier mishyakni kimyoviy elementlar ro'yxatiga kiritdi. Tabiatda tarqalishi. Yer qobig'idagi mishyakning o'rtacha miqdori (klark)
1,7·10-4% (massa bo'yicha), bunday miqdorda u ko'pchilik magmatik jinslarda mavjud. Mishyak birikmalari yuqori haroratda uchuvchan bo'lganligi sababli, element magmatik jarayonlarda to'planmaydi; issiq chuqur suvlardan (S, Se, Sb, Fe, Co, Ni, Cu va boshqa elementlar bilan birga) cho'kma hosil qiladi. Vulqon otilishi paytida mishyak o'zining uchuvchi birikmalari shaklida atmosferaga kiradi. Mishyak ko'p valentli bo'lgani uchun uning migratsiyasiga oksidlanish-qaytarilish muhiti katta ta'sir ko'rsatadi. Er yuzasining oksidlanish sharoitida arsenatlar (As5+) va arsenitlar (As3+) hosil bo'ladi. Bular kamdan-kam uchraydigan minerallar bo'lib, faqat mishyak konlari joylashgan hududlarda uchraydi. Mahalliy mishyak va As2+ minerallari kamroq tarqalgan. Ko'p sonli mishyak minerallaridan (taxminan 180) faqat arsenopirit FeAsS asosiy sanoat ahamiyatiga ega. Kichik miqdordagi mishyak hayot uchun zarurdir. Biroq, konning hududlarida
mishyak va yosh vulqonlarning faolligi, ba'zi joylarda tuproqlarda 1% gacha mishyak mavjud bo'lib, bu chorvachilik kasalliklari va o'simliklarning nobud bo'lishi bilan bog'liq. Mishyakning to'planishi, ayniqsa, tuproqlarida mishyak faol bo'lmagan dasht va cho'llarning landshaftlari uchun xosdir. Nam iqlim sharoitida mishyak osongina tuproqdan yuviladi. Tirik moddada oʻrtacha 3·10-5%, daryolarda 3·10-7% mishyak bor. Arsenik olib keldi
daryolar okeanga quyiladi, u nisbatan tez joylashadi. Dengiz suvida faqat 1·10-7% mishyak bo'lsa, gil va slanetslarda 6,6·10-4% ni tashkil qiladi. Cho'kindi temir rudalari va ferromarganets nodullari ko'pincha mishyak bilan boyitiladi.
Fizikaviy va kimyoviy xossalari. Arsenik bir nechta allotropik modifikatsiyaga ega. Oddiy sharoitlarda, eng barqaror deb atalmish metall, yoki kulrang, mishyak (a-As) - po'lat-kulrang mo'rt kristall massa; yangi singan bo'lsa, u havoda tez so'nadi, chunki u yupqa As2O3 plyonkasi bilan qoplangan. Kulrang mishyakning kristall panjarasi rombedrdir ( A- 4,123 Å, burchak a – 54o10", X- 0,226), qatlamli. Zichlik 5,72 g/sm3(20°C da), elektr qarshiligi 35·10-8 ohm× m, yoki 35·10-6 ohm× sm, elektr qarshiligining harorat koeffitsienti 3,9·10-3 (0o-100 oC), Brinell qattiqligi 1470 Mn/m2, yoki 147 kgf/mm2(Mohs bo'yicha 3-4); Arsenik diamagnitdir. Atmosfera bosimi ostida mishyak erimasdan 615 °C da sublimlanadi, chunki a-As uchlik nuqtasi (faza diagrammasiga qarang) 816 °C va bosim 36 ga teng. da. Mishyak bug'i As4 molekulalaridan 800?C gacha, 1700?C dan yuqori - faqat As2 molekulalaridan iborat. Suyuq havo bilan sovutilgan sirtda mishyak bug'i kondensatsiyalanganda sariq mishyak hosil bo'ladi - zichligi 1,97 bo'lgan mum kabi shaffof, yumshoq kristallar. g/sm3, xossalari bo'yicha oq fosforga o'xshash. Yorug'lik yoki past issiqlik ta'sirida kulrang mishyakga aylanadi. Shishasimon-amorf modifikatsiyalari ham ma'lum: qora mishyak va jigarrang mishyak, ular 270 C dan yuqori qizdirilganda kulrang M ga aylanadi. Mishyak atomining tashqi elektronlari konfiguratsiyasi 3 d 104s 24p 3. Mishyak birikmalarida
oksidlanish darajalariga ega + 5, + 3 va - 3. Kulrang mishyak fosforga qaraganda ancha kam kimyoviy faoldir. Havoda 400°C dan yuqori qizdirilganda mishyak yonib, As2O3 hosil qiladi. Arsenik to'g'ridan-to'g'ri halogenlar bilan birlashadi; normal sharoitda AsF5 gazdir; AsF3, AsCl3, AsBr3 - rangsiz, juda uchuvchan suyuqliklar; AsI3 va As2l4 qizil kristallardir. Mishyak va oltingugurt qizdirilganda sulfidlar olinadi: apelsin-qizil As4S4 va limon-sariq As2S3. Och sariq rangli As2S5 sulfid H2S ni mishyak kislotasining (yoki uning tuzlarining) dumanli xlorid kislotadagi muz bilan sovutilgan eritmasiga o'tkazish orqali cho'ktiriladi: 2H3AsO4 + 5H2S = As2S5 + 8H2O; Taxminan 500 ° C da As2S3 va oltingugurtga parchalanadi. Barcha M. sulfidlari suvda va suyultirilgan kislotalarda erimaydi. Kuchli oksidlovchi moddalar (HNO3 + HCl, HCl + KClO3 aralashmalari) ularni H3AsO4 va H2SO4 aralashmasiga aylantiradi. As2S3 sulfid ammoniy va ishqoriy metallarning sulfidlari va polisulfidlarida oson eriydi, kislotalarning tuzlarini - tioarsen H3AsS3 va tioarsen H3AsS4 hosil qiladi. Kislorod bilan mishyak oksidlarni hosil qiladi: oksid M. (III) As2O3 - arsenli angidrid va oksid M. (V) As2O5 - mishyak angidrid. Ulardan birinchisi kislorodning metallga yoki uning sulfidlariga ta'siridan hosil bo'ladi, masalan, 2As2S3 + 9O2 - 2As2O3 + 6SO2. As2O3 bug'lari rangsiz shishasimon massaga kondensatsiyalanadi, vaqt o'tishi bilan mayda kubik kristallar hosil bo'lishi tufayli shaffof bo'lib qoladi, zichligi 3,865 g/sm3. Bug 'zichligi As4O6 formulasiga to'g'ri keladi: 1800?C dan yuqori bug' As2O3 dan iborat. 100 da G suv eriydi 2.1 G As2O3 (25oS da). M. oksidi (III) kislotali xossalari ustun boʻlgan amfoter birikma. Ortoarsen kislotalari H3AsO3 va metaarsenik kislotalar HAsO2 ga mos keladigan tuzlar (arsenitlar) ma'lum; kislotalarning o'zi olinmagan. Suvda faqat gidroksidi metall va ammoniy arsenitlari eriydi. As2O3 va arsenitlar odatda qaytaruvchi moddalardir (masalan, As2O3 + 2I2 + 5H2O - 4HI + 2H3AsO4), lekin oksidlovchi moddalar ham bo'lishi mumkin (masalan, As2O3 + 3C - 2As + 3CO). Mishyak (V) oksidi mishyak kislota H3AsO4 (taxminan) ni qizdirish orqali olinadi.
200oC). Rangsiz va taxminan 500°C da As2O3 va O2 ga parchalanadi. Mishyak kislotasi konsentrlangan HNO3 ning As yoki As2O3 ga ta'siridan olinadi. Mishyak kislota tuzlari (arsenatlar) suvda erimaydi, ishqoriy metallar va ammoniy tuzlari bundan mustasno. Ortoarsen H3AsO4, metaarsenik HAsO3 va piroarsen H4As2O7 kislotalariga mos keladigan tuzlar ma'lum; oxirgi ikki kislota erkin holatda olinmagan. Metall bilan qotishganda, mishyak asosan birikmalar (arsenidlar) hosil qiladi.
Kvitansiya va ariza. Arsenik sanoatda mishyak piritlarini isitish orqali ishlab chiqariladi:
FeAsS - FeS + As yoki (kamroq) ko'mir bilan As2O3 ning kamayishi. Har ikki jarayon dan retorts amalga oshiriladi
mishyak bug'ining kondensatsiyasi uchun qabul qiluvchiga ulangan o'tga chidamli loy. Mishyak angidridi mishyak rudalarini oksidlovchi qovurish natijasida yoki deyarli har doim tarkibida mishyak bo'lgan polimetall rudalarni qovurishning qo'shimcha mahsuloti sifatida olinadi. Oksidlanish bilan qovurish jarayonida As2O3 bug'lari hosil bo'ladi, ular yig'ish kameralarida kondensatsiyalanadi. As2O3 xom ashyosi 500-600°C da sublimatsiya bilan tozalanadi. Tozalangan As2O3 mishyak va uning preparatlarini ishlab chiqarish uchun ishlatiladi.
Mishyakning kichik qo'shimchalari (og'irligi bo'yicha 0,2-1,0%) qurol ishlab chiqarish uchun ishlatiladigan qo'rg'oshinga kiritiladi (mishyak eritilgan qo'rg'oshinning sirt tarangligini oshiradi, buning natijasida o'q sharsimon shaklga yaqin shaklga ega bo'ladi; mishyak qattiqlikni biroz oshiradi. qo'rg'oshin). Surmaning qisman o'rnini bosuvchi sifatida mishyak ba'zi babbitt va bosma qotishmalarga kiradi. Sof mishyak zaharli emas, lekin uning barcha birikmalari suvda eriydi yoki
me'da shirasining ta'siri ostida eritma ichiga kirish, o'ta zaharli; Arsenik vodorod ayniqsa xavflidir. Ishlab chiqarishda ishlatiladigan mishyak birikmalaridan mishyak angidridi eng zaharli hisoblanadi. Rangli metallarning deyarli barcha sulfidli rudalarida, shuningdek, temir (oltingugurt) piritida mishyak aralashmasi mavjud. Shuning uchun ularni oksidlovchi qovurish jarayonida oltingugurt dioksidi SO2 bilan birga doimo As2O3 hosil bo'ladi; Uning ko'p qismi tutun kanallarida kondensatsiyalanadi, lekin tozalash inshootlari mavjud bo'lmaganda yoki unumdorligi past bo'lsa, rudani qovurish pechlarining chiqindi gazlari sezilarli miqdorda As2O3 ni olib ketadi. Sof mishyak, garchi zaharli bo'lmasa ham, havoda saqlanganda har doim zaharli As2O3 qoplamasi bilan qoplanadi. Tegishli shamollatish bo'lmasa, metalllarni (temir, rux) sanoat oltingugurt yoki mishyakni o'z ichiga olgan xlorid kislotalar bilan ishqalash juda xavflidir, chunki bu mishyakli vodorod hosil qiladi. Tanadagi mishyak. Arsenik iz element sifatida hamma joyda mavjud.
tirik tabiatda. Tuproqlarda oʻrtacha mishyak miqdori 4·10-4%, oʻsimlik kulida 3·10-5%. Dengiz organizmlarida mishyak miqdori quruqlikdagi organizmlarga qaraganda yuqori (baliqlarda 0,6-4,7). mg 1 da kg xom ashyo jigarda to'planadi). Inson tanasida o'rtacha mishyak miqdori 0,08-0,2 ni tashkil qiladi mg/kg. Qonda mishyak qizil qon hujayralarida to'plangan bo'lib, u erda gemoglobin molekulasi bilan bog'lanadi (va globin fraktsiyasi gemdan ikki baravar ko'p). Uning eng katta miqdori (1 uchun G to'qima) buyrak va jigarda uchraydi. O'pka va taloq, teri va sochda juda ko'p mishyak topiladi; nisbatan kam - miya omurilik suyuqligida, miyada (asosan gipofiz bezida), jinsiy bezlarda va boshqalarda.. To'qimalarda mishyak asosiy oqsil fraktsiyasida, kislotada eriydigan fraktsiyada ancha kam va uning faqat kichik qismi topiladi. lipid fraktsiyasida. Arsenik oksidlanish-qaytarilish reaktsiyalarida ishtirok etadi: murakkab uglevodlarning oksidlanish jarayoni, fermentatsiya, glikoliz va boshqalar. Mishyak birikmalari biokimyoda metabolik reaktsiyalarni o'rganish uchun o'ziga xos ferment ingibitorlari sifatida ishlatiladi. Tibbiyotda mishyak. Organik mishyak birikmalari (aminarson, miarsenol,
novarsenal, osarsol) asosan sifilis va protozoal kasalliklarni davolash uchun ishlatiladi. Mishyakning noorganik preparatlari - natriy arsenit (natriy mishyak kislotasi), kaliy arsenit (kaliy mishyak kislotasi), arsenli angidrid As2O3, umumiy mustahkamlovchi va tonik vositalar sifatida buyuriladi. Mahalliy ravishda qo'llanilganda, noorganik mishyak preparatlari oldingi tirnash xususiyatisiz nekrotik ta'sirga olib kelishi mumkin, bu jarayonni deyarli og'riqsiz qiladi; As2O3 da eng aniq ifodalangan bu xususiyat stomatologiyada ishlatiladi
tish pulpasini yo'q qilish. Psoriazni davolash uchun noorganik mishyak preparatlari ham qo'llaniladi. Sun'iy ravishda olingan radioaktiv izotoplar M. 74As (T1/2 - 17,5) kunlar) va 76As (T1/2
26,8 h) diagnostika va davolash maqsadlarida qo'llaniladi. Ularning yordami bilan miya shishlarining joylashuvi aniqlanadi va ularni olib tashlashning radikallik darajasi aniqlanadi. Radioaktiv mishyak ba'zan qon kasalliklari va boshqalar uchun ishlatiladi.. Radiatsiyadan himoya qilish bo'yicha xalqaro komissiya tavsiyalariga ko'ra.
tanadagi maksimal ruxsat etilgan 76A miqdori 11 mccurie. SSSRda qabul qilingan sanitariya me'yorlariga ko'ra, suv va ochiq suv havzalarida 76A ning ruxsat etilgan maksimal konsentratsiyasi 1 · 10-7 ni tashkil qiladi. kuri/l, ish joylari havosida 5·10-11 kuri/l. Barcha mishyak preparatlari juda zaharli. O'tkir zaharlanishda kuchli qorin og'rig'i, diareya va buyraklarning shikastlanishi kuzatiladi; Yiqilish va konvulsiyalar mumkin. Surunkali zaharlanishda eng ko'p uchraydigan oshqozon-ichak kasalliklari, nafas yo'llarining shilliq qavatining katarasi (faringit, laringit, bronxit), terining shikastlanishi (ekzantema, melanoz, giperkeratoz) va sezgirlikning buzilishi; aplastik anemiya rivojlanishi mumkin. Mishyak preparatlari bilan zaharlanishni davolashda unitiol katta ahamiyatga ega. Sanoat zaharlanishining oldini olish bo'yicha chora-tadbirlarga yo'naltirilgan bo'lishi kerak
birinchi navbatda texnologik jarayonni mexanizatsiyalash, muhrlash va changdan tozalash, samarali ventilyatsiya yaratish va ishchilarni chang ta'siridan shaxsiy himoya vositalari bilan ta'minlash. Ishchilarni muntazam ravishda tibbiy ko'rikdan o'tkazish kerak. Dastlabki tibbiy ko'riklar ishga qabul qilinganda, xodimlar uchun esa - har olti oyda bir marta o'tkaziladi.
SURMA(lot. Stibium), Sb, Mendeleyev davriy sistemasining V guruhining kimyoviy elementi; atom raqami 51, atom massasi 121,75; Metall kumushrang-oq rangga ega, zangori rangga ega. Tabiatda ikkita barqaror izotop ma'lum: 121Sb (57,25%) va 123Sb (42,75%). Sun'iy ravishda olingan radioaktiv izotoplardan eng muhimi 122Sb ( T 1/2 - 2,8 cym), 124Sb ( T 1/2 - 60,2 cym) va 125Sb ( T 1/2 - 2 yil).
Tarixiy ma'lumotnoma. Surma qadim zamonlardan beri ma'lum. Sharq mamlakatlarida u miloddan avvalgi 3000 yilda ishlatilgan. e. idishlarni yasash uchun. Qadimgi Misrda allaqachon 19-asrda. Miloddan avvalgi e. Qoshlarni qoralash uchun mesten yoki poya deb ataladigan surma yaltiroq kukuni (tabiiy Sb2S3) ishlatilgan. Qadimgi Yunonistonda u stími va stíbi nomi bilan tanilgan, shuning uchun lotincha stibium. Taxminan 12-14 asrlar. n. e. antimonium nomi paydo bo'ldi. 1789 yilda A.Lavuazye surmani antimon deb ataladigan kimyoviy elementlar ro'yxatiga kiritdi (zamonaviy ingliz surma, ispan va italyan antimoni, nemis antimoni). Ruscha “surma” turkcha surme so‘zidan kelib chiqqan; u qoshlarni qorayish uchun ham ishlatilgan (boshqa manbalarga ko'ra, "surma" - forscha surme - metalldan) qo'rg'oshin porlashi kukuni PbS ni bildirgan. Surma va uning birikmalarini olish xususiyatlari va usullarining batafsil tavsifi birinchi marta 1604 yilda kimyogar Vasiliy Valentin (Germaniya) tomonidan berilgan. Tabiatda tarqalishi. Yer qobig'idagi o'rtacha surma miqdori (klark) 5 × 10-5
og'irlik bo'yicha %. Surma magma va biosferada tarqalgan. Issiq er osti suvlaridan gidrotermal konlarda to'plangan. Surma-simob, surma-qoʻrgʻoshin, oltin-surma, surma-volfram konlari ham maʼlum. 27 ta surma minerallaridan stibnit (Sb2S3) yirik sanoat ahamiyatiga ega. . Oltingugurtga yaqinligi tufayli surma ko'pincha mishyak, vismut, nikel, qo'rg'oshin, simob, kumush va boshqa elementlarning sulfidlarida nopoklik sifatida topiladi. Fizikaviy va kimyoviy xossalari. Antimon kristalli va uchta ma'lum
amorf shakllar (portlovchi, qora va sariq). Portlovchi surma (zichligi 5,64-5,97 g/sm 3) har qanday kontaktda portlaydi: eritmaning elektrolizi paytida hosil bo'ladi
SbCl3; qora (zichlik 5,3 g/sm 3) - antimon bug'ini tez sovutish bilan; sariq - kislorod suyultirilgan SbH3 ga o'tganda. Sariq va qora surma beqaror, past haroratlarda ular oddiy surmaga aylanadi. Eng barqaror kristalli surma , trigonal tizimda kristallanadi, A - 4.5064; zichligi 6,61-6,73 g/sm 3 (suyuqlik - 6,55 g/sm 3); t mp 630,5 °C; t kip1635-1645 °C; 20-100 ° S da solishtirma issiqlik sig'imi 0,210 kJ/(kg × TO ) ; 20 °C da issiqlik o'tkazuvchanligi 17.6 W/M× K. Polikristal uchun chiziqli kengayishning harorat koeffitsienti C. 0-100 ° S da 11,5 × 10-6; yagona kristalli a1 uchun - 8,1×10-a2 - 0-400 °C da 19,5×10-6, elektr qarshiligi (20 °C) (43,045×10-6) ohm× sm). Surma diamagnit, maxsus magnit sezuvchanligi -0,66 ×10-6. Aksariyat metallardan farqli o'laroq, surma mo'rt, parchalanish tekisliklari bo'ylab osongina bo'linadi, kukunga aylanadi va uni soxtalash mumkin emas (ba'zida u yarim metallga kiradi) . Mexanik xususiyatlar metallning tozaligiga bog'liq. Quyma metall uchun brinell qattiqligi 325-340 Mn/m 2 (32,5-34,0 kgf/mm 2); elastik modul 285-300; kuchlanish kuchi 86,0 Mn/m 2 (8,6 kgf/mm 2). Sb5s25r3 atomining tashqi elektronlarining konfiguratsiyasi. Birikmalarda u asosan +5, +3 va -3 oksidlanish darajasini ko'rsatadi. Kimyoviy jihatdan surma faol emas. gacha havoda oksidlanmaydi
erish harorati. Surma azot va vodorod bilan reaksiyaga kirishmaydi. Uglerod eritilgan surmada ozgina eriydi. Metall xlor va boshqa galogenlar bilan faol ta'sir o'tkazib, antimon galogenidlarini hosil qiladi. 630 °C dan yuqori haroratda kislorod bilan reaksiyaga kirishib, Sb2O3 hosil qiladi . Oltingugurt bilan eritilganda surma sulfidlari olinadi va u fosfor va mishyak bilan ham o'zaro ta'sir qiladi. Surma suv va suyultirilgan kislotalarga chidamli. Konsentrlangan xlorid va sulfat kislotalar surmani asta-sekin eritib, SbCl3 xlorid va Sb2 (SO4) sulfat hosil qiladi; konsentrlangan nitrat kislota surmani yuqoriroq oksidga oksidlaydi, u gidratlangan birikma xSb2O5 ×yH2O shaklida hosil bo'ladi. Surma kislotasining kam eriydigan tuzlari - antimonatlar (MeSbO3 × 3H2O, bu erda Me Na, K) va izolyatsiyalanmagan metaantimon kislotasining tuzlari - qaytaruvchi xususiyatlarga ega bo'lgan metaantimonitlar (MeSbO2 × 3H2O) amaliy qiziqish uyg'otadi. S. metallar bilan birikib antimonidlar hosil qiladi. Kvitansiya. Surma pirometallurgiya va gidrometallurgiya usullari bilan olinadi
20-60% Sb bo'lgan konsentratlar yoki rudalarni qayta ishlash. Pirometallurgiya usullari cho'kindi va qaytaruvchi eritishni o'z ichiga oladi. Yog'ingarchilik bilan eritish uchun xom ashyo sulfidli kontsentratlardir; jarayon surmani uning sulfididan temir bilan almashtirishga asoslangan: Sb2S3 + 3Fe Û 2Sb + 3FeS. Temir zaryadga hurda shaklida kiritiladi. Erish 1300-1400 ° S haroratda reverberator yoki qisqa aylanadigan barabanli pechlarda amalga oshiriladi. Surmaning qo'pol metallga aylanishi 90% dan ortiq. Surmani qaytaruvchi eritish uning oksidlarini koʻmir yoki koʻmir changi bilan metallga qaytarish va chiqindi jinslarni shlaklashga asoslangan. Reduksion eritish 550 °C da ortiqcha havo bilan oksidlovchi qovurishdan oldin amalga oshiriladi. Shlak tarkibida uchuvchan bo'lmagan surma tetroksidi mavjud. Elektr pechlari ham yog'ingarchilik, ham reduktiv eritmalar uchun ishlatilishi mumkin. Surma olishning gidrometallurgik usuli ikki bosqichdan iborat: xom ashyoni ishqoriy sulfid eritmasi bilan qayta ishlash, surmani surma kislotalari va sulfotuzlar tuzlari shaklida eritmaga o‘tkazish va surmani ajratish. elektroliz. Dag'al surma, xom ashyo tarkibiga va uni ishlab chiqarish usuliga qarab, 1,5 dan 15% gacha aralashmalarni o'z ichiga oladi: Fe, As, S va boshqalar. Sof surma olish uchun pirometallurgik yoki elektrolitik tozalash qo'llaniladi. Pirometallurgiyani qayta ishlash jarayonida temir va mis aralashmalari antimonit (krudum) - Sb2S3 - ni surma eritmasiga kiritish orqali oltingugurt birikmalari shaklida chiqariladi, shundan so'ng mishyak (natriy arsenat shaklida) va oltingugurt suv ostida havo puflash orqali chiqariladi. sodali shlak. Eriydigan anod bilan elektrolitik tozalash jarayonida qo'pol surma temir, mis va boshqa metallardan tozalanadi.
elektrolitlar (Cu, Ag, Au loyda qoladi). Elektrolit SbF3, H2SO4 va HF dan tashkil topgan eritmadir. Tozalangan surma tarkibidagi aralashmalar miqdori 0,5-0,8% dan oshmaydi. Yuqori tozalikdagi surmani olish uchun zonali eritish inert gaz atmosferasida qo'llaniladi yoki surma oldindan tozalangan birikmalardan - trioksid yoki trikloriddan olinadi. Ilova. Surma asosan qoʻrgʻoshin va qalay qotishmalari shaklida qoʻllaniladi
batareya plitalari, kabel qoplamalari, podshipniklar uchun (babbitt) , bosmaxonada ishlatiladigan qotishmalar (hart) , va hokazo. Bunday qotishmalarning qattiqligi, aşınma qarshiligi va korroziyaga chidamliligi oshdi. Floresan lampalarda Sb kaltsiy halofosfat bilan faollashtiriladi. Surma germaniy va kremniyga qoʻshimcha sifatida yarimoʻtkazgichli materiallarga, shuningdek antimonidlarga (masalan, InSb) kiradi. Radioaktiv izotopi 12Sb g-nurlanish va neytron manbalarida ishlatiladi. Tanadagi surma. Surma tarkibi (100 G quruq modda) mavjud
o'simliklar 0,006 mg, dengiz hayvonlarida 0,02 mg, quruqlikdagi hayvonlarda 0,0006 mg. Surma hayvonlar va odamlarning tanasiga nafas olish tizimi yoki oshqozon-ichak trakti orqali kiradi. U asosan najas bilan, oz miqdorda esa siydik bilan chiqariladi. Surmaning biologik roli noma'lum. U qalqonsimon bez, jigar va taloqda tanlab to'plangan. Eritrositlarda surma asosan oksidlanish holatida + 3, qon plazmasida - oksidlanish holatida + 5 to'planadi. Maksimal ruxsat etilgan kontsentratsiya C. 10-5 - 10-7 G 100 tomonidan G quruq mato. Yuqori konsentratsiyalarda bu element lipidlar, uglevodlar va oqsillar almashinuvining bir qator fermentlarini inaktiv qiladi (ehtimol sulfgidril guruhlarini blokirovka qilish natijasida). . Tibbiyot amaliyotida surma preparatlari (solyusurmin va boshqalar) qo'llaniladi
asosan leyshmanioz va ba'zi gelmintozlarni davolash uchun (masalan, shistosomiaz). Surma va uning birikmalari zaharli hisoblanadi. Konsentratni eritishda zaharlanish mumkin
surma rudalari va surma qotishmalari ishlab chiqarishda. O'tkir zaharlanishda - yuqori nafas yo'llarining shilliq pardalari, ko'zlar va terining tirnash xususiyati. Dermatit, kon'yunktivit va boshqalar rivojlanishi mumkin Davolash: antidotlar (unithiol), diuretiklar va diaforetiklar va boshqalar Oldini olish: ishlab chiqarishni mexanizatsiyalash. jarayonlar, samarali shamollatish va boshqalar.
BISMUT(lat. Bismutum), Bi, V davriy guruhning kimyoviy elementi
Mendeleyev tizimi; atom raqami 83, atom massasi 208,980; pushtirang tusli kumush-kulrang metall. Tabiiy vismut bitta barqaror izotopdan iborat, 209Bi. V. 15—16-asrlarda maʼlum boʻlgan, lekin uzoq vaqt qalayning bir turi hisoblangan,
qo'rg'oshin yoki surma. Vismut mustaqil metall sifatida 18-asr oʻrtalarida tan olingan. Fransuz kimyogari A.Lavuazye uni oddiy jismlar qatoriga kiritgan. "Vismut" nomining kelib chiqishi aniqlanmagan. Yer poʻstida vismut miqdori 2·10-5% ni tashkil qiladi. Vismut tabiatda uchraydi
ko'plab minerallar shaklida, ulardan eng muhimi vismut jilosi Bi2S3, mahalliy vismut Bi, bismit Bi2O3 va boshqalar. Ko'proq miqdorda, lekin kichik konsentratsiyalarda vismut qo'rg'oshin-rux, mis, molibdenda izomorf aralashma sifatida topiladi. -kobalt va qalay-volfram rudalari. Global iste'molning 90% ga yaqini polimetall rudalarni qayta ishlash jarayonida vismut ishlab chiqarish bilan qoplanadi. Fizikaviy va kimyoviy xossalari. Vismutning rombedral panjarasi bor
davr a- 4,7457 A va burchak a-57?14 " 13"" . Zichlik 9,80 g/sm 3; t havo harorati 271,3°C; t harorat 1560 ° S. Maxsus issiqlik quvvati (20 ° C) 123,5 J/kg K (0,0294 kal/g·BILAN); issiqlik koeffitsienti
xona haroratida chiziqli kengayish 13,3·10-6; issiqlik o'tkazuvchanligi (20 ° C) 8.37 Vt/(m·TO); elektr qarshiligi (20 ° S) 106,8 10-8 ohm· m(106,8·10-6 ohm· sm). Vismut eng diamagnitli metalldir. Maxsus magnit sezuvchanlik -1,35·10-6. Magnit maydon ta'sirida vismutning elektr qarshiligi kuchli magnit maydonlarning induksiyasini o'lchash uchun ishlatiladigan boshqa metallarga qaraganda ko'proq darajada oshadi. Vismutning termal neytronni ushlab turish kesimi kichik (34 10-31 m 2 yoki 0,034 ombor). Xona haroratida vismut mo'rt bo'lib, parchalanish tekisliklari bo'ylab osongina bo'linadi va chinni ohakda kukunga aylanadi. 120-150 ° S haroratda zarb qilish; issiq presslash orqali (240-250 ° S da) diametri 0,1 gacha bo'lgan simni ishlab chiqarish uchun ishlatilishi mumkin. mm, shuningdek, qalinligi 0,2-0,3 bo'lgan plitalar mm. Brinell qattiqligi 93 Mn/m 2 (9,3 kgf/mm 2), Mohs 2.5 ga muvofiq. Eriganda V. hajmi 3,27% ga kamayadi. Vismut quruq havoda barqaror, ammo nam havoda uning yuzasi
oksidlanish. 1000 ° C dan yuqori qizdirilganda u ko'k rangli olov bilan yonib, Bi2O3 oksidini hosil qiladi. . Voltaj qatorida vismut vodorod va mis o'rtasida turadi, shuning uchun u suyultirilgan sulfat va xlorid kislotalarda erimaydi; konsentrlangan sulfat va nitrat kislotalarda erishi SO2 va tegishli azot oksidlarining chiqishi bilan sodir bo'ladi. Vismut 2, 3 va 5 valentliklarga ega. Pastroq valentli vismut birikmalari
asosiy xarakterga ega, yuqorilari kislotali. Dunyodagi kislorodli birikmalardan eng muhimi uch oksidi Bi2O3 bo'lib, qizdirilganda sariq rangini qizil-jigarrangga o'zgartiradi. Bi2O3 vismut tuzlarini olish uchun ishlatiladi. Suyultirilgan eritmalarda vismut tuzlari gidrolizlanadi. BiCl3 xlorid oksixlorid BiOCl, Bi nitrat (NO3)3 - asosiy tuz BiONO3·BiOOH cho'kmasi bilan gidrolizlanadi. Uni tozalash uchun V. tuzlarining gidrolizlanish qobiliyatidan foydalaniladi. 5 valentli vismutning birikmalarini olish qiyin; ular kuchli oksidlovchi moddalardir. KBiO3 tuzi (Bi2O5 angidridiga mos keladi) KOH, KCl va Bi2O3 suspenziyasi aralashmasining qaynayotgan eritmasini elektroliz qilish jarayonida platina anodida jigarrang-qizil cho'kma shaklida hosil bo'ladi. Vismut halogenlar va oltingugurt bilan osongina birlashadi. Kislotalar vismut va magniy qotishmasiga ta'sir qilganda, vismutin (vismut vodorodi) BiH3 hosil bo'ladi; Arsin AsH3 dan farqli o'laroq, vismutin beqaror birikma bo'lib, uning sof shaklida (ortiqcha vodorodsiz) olinmagan. Ba'zi metallar (qo'rg'oshin, kadmiy, qalay) bilan vismut past eriydigan evtektikani hosil qiladi; natriy, kaliy, magniy va kaltsiy bilan - erish nuqtasi dastlabki komponentlarning erish nuqtasidan sezilarli darajada yuqori bo'lgan intermetalik birikmalar. Vismut eritilgan alyuminiy, xrom va temir bilan o'zaro ta'sir qilmaydi. Kvitansiya va ariza. Vismutning asosiy miqdori qo'shimcha mahsulot sifatida ishlab chiqariladi
qo'pol qo'rg'oshinni yong'inga tozalash (werkbley). Pirometallurgiya usuli vismutning K, Na, Mg va Ca bilan oʻtga chidamli intermetalik birikmalar hosil qilish qobiliyatiga asoslangan. Belgilangan metallar eritilgan qoʻrgʻoshinga qoʻshiladi va hosil boʻlgan V. (shpal) bilan qattiq birikmalar eritmadan ajratiladi. Qo'rg'oshinni gidroftorsilik eritmada elektrolitik tozalashdan olingan loydan, shuningdek, mis ishlab chiqarishdagi chang va loydan katta miqdordagi vismut olinadi. Tarkibida vismut boʻlgan shlaklar va loylar ishqoriy shlaklar ostida eritiladi. Olingan qo'pol metall tarkibida As, Sb, Cu, Pb, Zn, Se, Te, Ag va boshqa ba'zi elementlarning aralashmalari mavjud. O'zining rudalaridan vismut eritish kichik miqyosda amalga oshiriladi. Sulfid rudalari temir qoldiqlari bilan cho'kma eritish yo'li bilan qayta ishlanadi. Oksidlangan rudalardan oltin past eriydigan oqim qatlami ostida ko'mir bilan qaytariladi. Dag'al suvni qo'pol tozalash uchun ular aralashmalar tarkibiga qarab ishlatiladi.
turli usullar: zeigerizatsiya, gidroksidi oqimlar ostida oksidlovchi tozalash, oltingugurt bilan sintez va boshqalar. Eng qiyin ajratilgan qo'rg'oshin nopokligi eritilgan metall orqali xlorni puflash orqali (0,01% gacha) chiqariladi. Tijorat vismut o'z ichiga oladi
99,9-99,98% asosiy metall. Yuqori tozalikdagi V.lar inert gaz atmosferasida kvarsli qayiqlarda zonali qayta kristallanish yoʻli bilan olinadi. Vismutning katta miqdori tish protezlarida ishlatiladigan qo'rg'oshin, qalay, kadmiy o'z ichiga olgan past eriydigan qotishmalarni tayyorlash uchun, yog'och matritsalardan klişelar ishlab chiqarish uchun, avtomatik yong'inga qarshi qurilmalarda erituvchi qopqoqlar sifatida ishlatiladi. zirhli teshuvchi snaryadlarda qopqoqlarni lehimlashda va hokazo. Eritilgan vismut yadroviy reaktorlarda sovutuvchi sifatida xizmat qilishi mumkin. Te bilan birikmalarda vismut iste'moli
termoelektr generatorlari. Ushbu birikmalar issiqlik o'tkazuvchanligi, elektr o'tkazuvchanligi va termoelektromotor kuchning qulay kombinatsiyasi tufayli issiqlik energiyasini yuqori samaradorlik bilan (~ 7%) elektr energiyasiga aylantirish imkonini beradi. Zanglamaydigan po'latlarga vismut qo'shilishi ularning ishlov berish qobiliyatini yaxshilaydi. Vismut birikmalari shishasozlik, keramika, farmatsevtikada qo'llaniladi
sanoat. Eriydigan vismut tuzlari zaharli va simobga o'xshash ta'sirga ega.
Adabiyot
1. Sanoatdagi zararli moddalar, umumiy. ed. N. V. Lazareva, 6-nashr, 2-qism, Leningrad, 1971 yil.
2. Ivanov V.V. Elementlarning ekologik geokimyosi. 3. Surma va uni ishlab chiqarishning yangi texnologiyasini yaratish sohasidagi tadqiqotlar
birikmalar, to'plamda: Kimyo va surma texnologiyasi, Frantsiya, 1965. 4. Qisqacha kimyoviy ensiklopediya, 5-jild, M., 1967; 5. Nekrasov B.V., Umumiy kimyo asoslari, 1-jild, M., 1965; 6. Pogodin S.A., Arsenik, kitobda: Qisqacha kimyoviy ensiklopediya, 3-jild, M., 1964 7. Remy G., Noorganik kimyo kursi, trans. Nemis tilidan, 1-jild, M., 1963, bet. 700-712; 8. Tomson J. G., Vismut, trans. [ingliz tilidan], L., 1932; 9. Shiyanov A.G., Surma ishlab chiqarish, M., 1961; Metallurgiya asoslari, 5-jild, M.,
1968; 10. Bog‘langan azotning kimyosi va texnologiyasi, [M.-L.], 1934; KHE, 1-jild, M., 1961.
Azot kichik guruhi besh elementdan iborat: azot, fosfor, mishyak, surma va vismut. Bular D.I.Mendeleyev davriy sistemasining V guruhining p-elementlari.
Tashqi energiya darajasida ushbu elementlarning atomlari beshta elektronni o'z ichiga oladi, ular ns2np3 konfiguratsiyasiga ega va quyidagicha taqsimlanadi:

Shuning uchun bu elementlarning eng yuqori oksidlanish darajasi +5, eng pasti -3 va +3 ham tipikdir.
Tashqi sathda uchta juftlashtirilmagan elektronning mavjudligi, qo'zg'atmagan holatda, elementlarning atomlari 3 valentlikka ega ekanligini ko'rsatadi. Azot atomining tashqi darajasi faqat ikkita pastki sathdan iborat - 2s va 2p. Ushbu kichik guruhning qolgan elementlarining atomlari tashqi energiya darajasida d-kichik darajadagi bo'sh hujayralarga ega. Binobarin, tashqi sathning s-elektronlaridan biri qo`zg`alganda bir xil darajadagi d-kichik darajaga o`tishi mumkin, bu esa 5 ta juftlanmagan elektron hosil bo`lishiga olib keladi.

fosforning tashqi elektron qobig'i (qo'zg'almas atom)

qo'zg'atilgan fosfor atomining tashqi elektron qobig'i.
Shunday qilib, hayajonlangan holatda fosfor, mishyak, surma va vismut 5 ta juftlanmagan elektronga ega va ularning bu holatda valentligi 5 ga teng.
Azot atomida ikkinchi darajali d-pastki daraja yo'qligi sababli elektronni bu tarzda qo'zg'atish mumkin emas. Shuning uchun azot besh valentli bo'la olmaydi, lekin u 2s2 yolg'iz elektron juftligi tufayli donor-akseptor mexanizmi orqali to'rtinchi kovalent bog' hosil qilishi mumkin. Azot atomi uchun boshqa jarayon ham mumkin. Ikki 2s elektrondan biri chiqarilganda azot bir zaryadlangan tetravalent ion N+ ga aylanadi.

Azotdan vismutgacha atom radiuslari ortadi, ionlanish potentsiallari esa kamayadi. Neytral atomlarning qaytaruvchi xossalari N dan Bi gacha oshadi, oksidlovchi xossalari esa zaiflashadi (21-jadvalga qarang).
Vodorod, azot, fosfor va mishyak bilan RH3 qutbli birikmalar hosil bo'lib, salbiy oksidlanish holatini -3 ko'rsatadi. RH3 molekulalari piramidal shaklga ega. Ushbu birikmalarda elementlarning vodorod bilan bog'lanishi kislorod kichik guruhi va ayniqsa halogen kichik guruhi elementlarining mos keladigan birikmalariga qaraganda kuchliroqdir. Shuning uchun, suvli eritmalarda azot kichik guruhi elementlarining vodorod birikmalari vodorod ionlarini hosil qilmaydi.

Kislorod bilan azot kichik guruhining elementlari R2O3 va R2O5 umumiy formulali oksidlarni hosil qiladi. Oksidlar HRO2 va HRO3 kislotalariga (va H3RO4 orto kislotalariga, azotdan tashqari) mos keladi. Kichik guruh ichida oksidlarning tabiati quyidagicha o'zgaradi: N2O3 - kislotali oksid; R4O6 - kuchsiz kislotali oksid; As2O3 - kislotali xossalari ustun bo'lgan amfoter oksid; Sb2O3 - asosiy xossalari ustun bo'lgan amfoter oksid; Bi2O3 asosiy oksid hisoblanadi. Shunday qilib, R2O3 va R2O5 tarkibidagi oksidlarning kislotali xossalari elementning atom raqami ortishi bilan kamayadi.
Jadvaldan ko'rinib turibdiki. 21, azotdan vismutgacha bo'lgan kichik guruh ichida metall bo'lmagan xususiyatlar pasayadi va metall xususiyatlar ortadi. Surmada bu xossalar teng ifodalanadi, vismutda metall xossalari, azotda esa metall bo'lmagan xossalar ustunlik qiladi. Fosfor, mishyak va surma bir qancha allotropik birikmalar hosil qiladi.
Azot.
Kvitansiya
Laboratoriyalarda uni ammoniy nitritning parchalanish reaktsiyasi orqali olish mumkin:
Reaktsiya ekzotermik bo'lib, 80 kkal (335 kJ) chiqaradi, shuning uchun u sodir bo'lganda idishni sovutish kerak (garchi reaksiyani boshlash uchun ammoniy nitrit qizdirilishi kerak).
Amaliyotda bu reaksiya ammoniy sulfatning qizdirilgan to‘yingan eritmasiga natriy nitritning to‘yingan eritmasini tomchilab qo‘shish orqali amalga oshiriladi va almashinish reaksiyasi natijasida hosil bo‘lgan ammoniy nitrit bir zumda parchalanadi.
Bu holda ajralib chiqadigan gaz ammiak, azot oksidi (I) va kislorod bilan ifloslangan bo'lib, undan sulfat kislota, temir (II) sulfat eritmalari va issiq misdan ketma-ket o'tish orqali tozalanadi. Keyin azot quritiladi.
Azot olishning yana bir laboratoriya usuli kaliy bixromat va ammoniy sulfat aralashmasini (og'irligi bo'yicha 2: 1 nisbatda) isitishdir. Reaktsiya tenglamalar bo'yicha davom etadi:
Eng toza azotni metall azidlarni parchalash orqali olish mumkin:
"Havo" yoki "atmosfera" azot deb ataladigan azot, ya'ni azotning asil gazlar bilan aralashmasi havoni issiq koks bilan reaksiyaga kiritish orqali olinadi, bu esa "generator" yoki "havo" gaz deb ataladigan xom ashyoni hosil qiladi. kimyoviy sintez va yoqilg'i uchun. Agar kerak bo'lsa, uglerod oksidini yutish orqali azotni undan ajratish mumkin.
Molekulyar azot sanoatda suyuq havoni fraksiyonel distillash orqali ishlab chiqariladi. Ushbu usuldan "atmosfera azotini" olish uchun ham foydalanish mumkin. Gazni adsorbsion va membranani ajratish usulidan foydalanadigan azotli qurilmalar va stantsiyalar ham keng qo'llaniladi.
Laboratoriya usullaridan biri ammiakni mis (II) oksidi ustidan ~700 °C haroratda o'tkazishdir:
Ammiak uning to'yingan eritmasidan qizdirish yo'li bilan olinadi. CuO miqdori hisoblanganidan 2 barobar ko'p. Ishlatishdan oldin darhol azot mis va uning oksidi (II) (shuningdek ~ 700 °C) ustidan o'tkazib kislorod va ammiakdan tozalanadi, so'ngra konsentrlangan sulfat kislota va quruq ishqor bilan quritiladi. Jarayon juda sekin, lekin bunga arziydi: olingan gaz juda toza.
Shaklda. 15.12-rasmda V guruhning beshta elementining davriy sistemadagi joylashuvi ko‘rsatilgan. Ularning barchasi p-elementlar bo'lib, ularning atomlarining tashqi qobig'i elektron konfiguratsiya bilan tavsiflanadi. Jadvalda 15.10 da V guruh elementlarining ba'zi xossalari ko'rsatilgan. Ushbu guruhning pastki qismiga o'tsangiz, uning elementlarining xususiyatlari metall bo'lmagandan metallga o'zgaradi. Azot va fosfor odatiy bo'lmagan metallardir. Mishyak va surma metall xarakterli belgilarni ko'rsatadi, vismut esa metalldir.
AZOT VA FOSFOR
Bular V guruhdagi ikkita eng muhim elementdir.
Oddiy sharoitlarda azot ikki atomli gazdan iborat

Guruch. 15.12. V guruh elementlarining davriy sistemadagi o‘rni.
15.10-jadval. V guruh elementlarining xossalari

molekulalar Rangsiz, hidsiz va ta'msiz va sezilarli reaktivlikka ega emas.
Fosfor uchta allotropik shaklda mavjud bo'lib, ulardan ikkitasi eng keng tarqalgani qizil fosfor va kamroq barqaror oq fosfordir. Ushbu allotroplarning tuzilishi Sektda muhokama qilingan. 3.2. Jadvalda 15.11 qizil va oq fosforning ayrim xossalari solishtiriladi.
Azot eng elektromanfiy elementlardan biri bo'lsa ham (2.2-jadvalga qarang), u nisbatan past reaktivlikka ega. Buning sababi shundaki, uning diatomik molekulalari qutbsiz va ikki atom o'rtasidagi uch aloqa
15.11-jadval. Oq va qizil fosforning xossalari


Guruch. 15.13. Azot atomining to'rt gibrid orbitallari.
Ulardagi azot juda yuqori quvvatga ega. Bu bog'lanishning entalpiyasi + 944 kJ/mol.
Azot ham, fosfor ham oksidlanish darajasi -3 dan 4-5 gacha bo'lgan birikmalariga kirishi mumkin. Masalan, ammiakda azotning oksidlanish darajasi +3 ga, nitrat ionida esa -1-5 ga teng.
Ushbu ikkala elementning atomlari uchta elektronni biriktirishga qodir, bu ularning tashqi pastki qavatini to'ldirishga olib keladi; natijada nitrid ionlari va fosfid ionlari hosil bo'ladi, ammo ikkala element ham kovalent birikmalar hosil qiladi. Bunday holda, ularning atomlari to'rtta gibrid -orbitallarni hosil qiladi, ularning har biri tetraedral yo'nalishga ega (15.13-rasm). Ushbu orbitallarning uchtasida bitta elektron mavjud. Aynan shu elektronlar boshqa atomlarning elektronlari bilan kovalent bog'lanishlar hosil bo'lganda taqsimlanadi. To'rtinchi orbitalda yolg'iz elektronlar juftligi mavjud. U koordinatsion (donor-akseptor) aloqasini shakllantirish uchun ishlatilishi mumkin. Masalan, ammoniy ionida azotning yolg'iz juftligi vodorod ionining bo'sh -orbitali bilan ustma-ust tushadi.
ns 2 np 3.
AZOT va uning birikmalari
Tabiatda erkin shaklda (havodagi miqdori - 78 hajm %), minerallar shaklida (selitra), yog'da, o'simlik va hayvon oqsillarida uchraydi.
Jismoniy xususiyatlar
Oddiy sharoitlarda N 2 rangsiz, hidsiz va ta'msiz gazdir.
t o kip. = -195,8 o S.
Azot ishlab chiqarish:
a) sanoatda - havoni suyultirish;
b) laboratoriyada: NH 4 NO 2 ® N 2 + H 2 O.
Azot va uning birikmalarining kimyoviy xossalari.
Molekulyar azotning kimyoviy faolligi juda past, chunki uch karra kovalent aloqa tufayli molekula juda kuchli (E aloqasi = 946 kJ/mol). Biroq, azot uchun juda ko'p turli xil birikmalar ma'lum bo'lib, ularda -3, -2, -1, +1, +2, +3, +4, +5 oksidlanish darajalarini ko'rsatadi.
Salbiy oksidlanish darajasiga ega azotli birikmalar.
3
1)NH 3 - ammiak– o‘tkir hidli rangsiz gaz, oson suyultiriladi.
Ammiak ishlab chiqarish:
a) N 2 + 3H 2 « 2NH 3 (Kat: Fe, Al 2 O 3, K 2 O)
b) 2NH 4 CI + Ca(OH) 2 = CaCI 2 + 2NH 3 + 2H 2 O
Ammiakning kimyoviy xossalari:
a) NH 3 + H 2 O « NH 4 OH (maksimal konsentratsiya = 25%)
b) NH 3 + HCI « NH 4 CI (don.-mexanizmi: NH 3 + H + = NH 4 +)
c) kislorod miqdoriga qarab yonish har xil bo'ladi:
4NH 3 + 3O 2 (hafta) = 2N 2 + 6H 2 O
4NH 3 + 5O 2(g) = 2NO+ 6H 2 O
d) OVRda ammiak har doim qaytaruvchi vositadir:
3CuO + 2NH 3 = 3Cu + N 2 + 3H 2 O
2) NH 4 OH - ammoniy gidroksidi- zaif asos, beqaror, murakkab birikmalar (ammiak) yaxshi hosil qiladi:
Cu(OH) 2 + 4NH 4 OH = (OH) 2 + 4H 2 O
3) Ammoniy tuzlari:
a) gidroliz natijasida hosil bo'lgan eritmalar ozgina kislotali reaksiyaga ega:
NH 4 CI + HON « NH 4 OH + HCI (NH 4 + + HON « NH 4 OH + H +)
b) ammoniy tuzlarining termik parchalanishi anionning tabiatiga qarab har xil kechadi: agar anion oksidlovchi bo'lsa, parchalanish reaksiyasi qaytmas bo'ladi:
NH 4 CI « NH 3 + HCI
NH 4 NO 3 = N 2 O+ 2H 2 O
4) Amidlar ammiakdagi H atomlari metall bilan almashtirilganda hosil bo'ladi:
2K + 2NH 3 = 2KNH 2 + H 2
5) Nitridlar metallar va metall bo'lmaganlar uchun ma'lum va ularning tabiatiga qarab, turli xil parchalanadi:
a)Li 3 N + 3H 2 O = 3LiOH + NH 3
Ca 3 N 2 + 6HCI = 3CaCI 2 + 2NH 3
b)CI 3 N + 6HCI = 3HCIO + NH 3
Oksidlanish holati - 2
N 2 H 4 - gidrazin(diamid) rangsiz suyuqlik, yaxshi erituvchi, ammiakdan kamroq barqaror.
Gidrazinni tayyorlash:
2NH 3 + NaCIO = N 2 H 4 + NaCI + H 2 O
Gidrazinning kimyoviy xossalari:
N 2 H 4 + H 2 O « + +OH -
H 2 O « 2+ +OH -
b) azotgacha yonadi: N 2 H 4 + O 2 = N 2 + 2H 2 O
c) Kuchli qaytaruvchi: N 2 H 4 + 2H 2 O 2 = N 2 + 4H 2 O
Oksidlanish holati - 1
NH 2 OH - gidroksilamin, oq kristall modda, H 2 O 2 va gidrazin N 2 H 4 o'rtasida oraliq joyni egallaydi.
Gidroksilaminni tayyorlash:
HNO 3 + 6H = NH 2 OH + 2H 2 O
Gidroksilaminning kimyoviy xossalari:
a) suvli eritmalar - kuchsiz asoslar:
NH 2 OH + H 2 O « + +OH -
b) gidroksilammoniy tuzlari (barqaror) kislotalar bilan beriladi:
NH 2 OH + HCI = + + CI -
c) parchalanadi (disproporsiya reaksiyasi):
3NH 2 OH = NH 3 + N 2 + 3H 2 O
d) H 2 O 2 kabi, atrof-muhitga qarab, oksidlanish-qaytarilish dualligini namoyon qiladi:
Kelishdikmi: 2NH 2 OH + 4FeSO 4 + 3H 2 SO 4 = 2Fe 2 (SO 4) 3 + (NH 4) 2 SO 4 + 2H 2 O
tiklangan: 2NH 2 OH + I 2 + 2KOH = N 2 + 2KI + 4H 2 O
Ijobiy s bo'lgan eng muhim azotli birikmalar. O.
Oksidlanish holati + 3
1) N 2 O 3- azot oksidi (III) yoki "azot angidrid" beqaror ko'k-yashil suyuqlikdir:
a) N 2 O 3 ® NO 2 (o'tkir hidli jigarrang gaz) + NO (rangsiz gaz);
b) suv bilan beqaror kislota hosil qiladi: N 2 O 3 + H 2 O « 2 HNO 2
2) HNO2- azot kislotasi (o'rtacha quvvat):
HNO 2 « H + + NO 2 - (K = 5.1 . 10 -4).
3) Nitritlar– oksidlanish-qaytarilish reaksiyalarida boshqa N+3 birikmalari kabi azot kislota tuzlari ikkilikni namoyon qiladi:
Kelishdikmi: KNO 2 + NH 3 = N 2 + H 2 O
tiklangan: KNO 2 + H 2 O 2 = KNO 3 + H 2 O
Maksimal oksidlanish darajasi + 5
1) N 2 O 5- azot oksidi (V) yoki "azot angidrid" rangsiz kristall moddadir; Suvda eriganida kislota beradi.
2) HNO3– azot kislotasi, kuchli: HNO 3 ® H + + NO 3 - .
3) Nitratlar- nitrat kislota tuzlari:
a) laboratoriyada N 2 O ni termik parchalanish reaksiyasi orqali olish mumkin: NH 4 NO 3 ® N 2 O + H 2 O;
b) metall nitratlar metalning faollik qatoridagi o'rniga qarab, turlicha parchalanadi:
chapga Mg: nitrat ® nitrit + O 2
Mg - Cu: nitrat ® metall oksidi + NO 2 + O 2
o'ngga Cu: nitrat ® metall + NO 2 + O 2.
4) barcha N +5 birikmalar kuchli oksidlovchi moddalardir; nitrat kislotaning metallar bilan o'zaro ta'siri:
a) hech qanday metall HNO 3 dan vodorod ajratmaydi;
b) normal t o zida Al, Zn, Cr, Fe, Pb, Au, Pt metallar passivlanadi;
v) qizdirilganda u ko'pchilik metallar bilan o'zaro ta'sir qiladi va metall qanchalik faol va kislota qanchalik suyultirilsa, N +5 ning qaytarilishi shunchalik kuchli bo'ladi:
harakatsiz Meh: Cu + 4HNO 3 (konk.) = Cu (NO 3) 2 + 2NO 2 + 2H 2 O
3Cu + 8HNO 3(dil.) = 3Cu(NO 3) 2 + 2NO + 4H 2 O
aktivlar. Meh: 4Ca + 10HNO 3 (konk.) = 4Ca (NO 3) 2 + N 2 O + 5H 2 O
5Ca + 12HNO3(suyultirilgan) = 5Ca(NO3)2 + N2 + 6H2O
4Ca + 9HNO 3 (ultra dil.) = 4Ca(NO 3) 2 + NH 3 (yoki NH 4 NO 3) + 3H 2 O
FOSFOR va uning birikmalari
Tabiatda: a) minerallar (fosforitlar va apatitlar) shaklida, b) o'simlik va hayvon oqsillarida, v) miya to'qimalarida va suyaklarda uchraydi.
Jismoniy xususiyatlar
Allotropen:
A) oq fosfor(P 4) - tetraedral tuzilish, zaharli, qorong'ida porlaydi, uglerod disulfidida eriydi; saqlash vaqtida u asta-sekin qizil fosforga aylanadi, shuning uchun u suv ostida saqlanadi;
b) qizil fosfor(P 2 n – polimer) – strukturaning bir necha shakllari mavjud, toksik bo‘lmagan, uglerod disulfidida erimaydigan, saqlash vaqtida barqaror, kam reaktiv;
V) qora fosfor- piramidal tuzilish, qatlamli, grafitga o'xshash, yarim o'tkazgich.
Fosforni olish:
Fosforit minerali koks va qum bilan kalsinlanadi:
Ca 3 (PO 4) + 5C + 3 SiO 2 = 3CaSiO 3 +2P +5CO
Fosfor va uning birikmalarining kimyoviy xossalari.
Fosforning kimyoviy faolligi uning allotropik modifikatsiyasiga qarab o'zgaradi. Asosiy oksidlanish darajalari: -3, +1, +3, +5.
1) Fosforning oddiy moddalar bilan reaksiyalari:
tiklash xususiyatlari: a)P + O 2 ® P 2 O 3, P 2 O 5;
b)P + CI 2 ® PCI 3, PCI 5; c) 2P + 3S ® P 2 S 3
Oksidlanish xususiyatlari: a) 2P + 3H 2 ® 2RN 3, b) 2P + 3Ca ® Ca 3 P 2
2) Fosforning murakkab moddalar bilan reaksiyalari:
a) suv bilan reaksiya sodir bo'lmaydi;
b) 2P + 5H 2 SO 4 (konk.) ® 2H 3 PO 4 + 5SO 2 + 2H 2 O,
c) P + HNO 3 (kons.) ® H 3 PO 4 + NO (yoki NO 2).
3)Minimal oksidlanish holati - 3
A) PH 3- fosfin, sarimsoq hidli zaharli gaz;
yoniq: 2RH 3 + 4O 2 = R 2 O 5 + 3H 2 O,
ba'zi kislotalar bilan fosfoniy tuzlarini beradi: RH 3 + HI = RH 4 I
b) metall fosfidlar- ionokovalen birikmalar
Mg 3 P 2 + 6 H 2 O = Mg(OH) 2 + 2PH 3,
Ca 3 P 2 + 6HCI = CaCI 2 + 2PH 3.
4)Oksidlanish holati + 1
H 3 PO 2 yoki H[PO 2 H 2 ] – gipofosfor kislotasi, kuchli; tuzlar gipofosfitlar, yaxshi eriydigan, yaxshi qaytaruvchi moddalardir.
5)Oksidlanish holati + 3
a) P 2 O 3 – fosforli angidrid, bir nechta modifikatsiyaga ega (P 2 O 3) n, rangsiz zaharli kristallar;
b) H 3 PO 3 yoki H 2 [PO 3 H] - fosfor kislotasi, o'rtacha quvvat;
c) faqat gidroksidi metallarda eriydigan fosfit tuzlari (K 2 [PO 3 H]),
PCI 3 + CI 2 = PCI 5,
PCI 3 + O 2 = PCI 3,
PCI 3 + HCI ® N.
6)Maksimal oksidlanish darajasi +5
a) P 2 O 5 - fosfor angidrid, oq kukun, modifikatsiyaga ega (P 2 O 5) 2, kuchli suvni olib tashlaydigan vosita: P 2 O 5 + 2H 2 O = 2HPO 3;
b) HPO 3 - meta, H 4 P 2 O 7 - piro, H 3 PO 4 - ortofosfor kislotasi, o'rtacha quvvatli;
v) meta-, piro-, orto-fosfat tuzlari;
d) galogenidlar ancha faol:
PCI 5 + 4H 2 O = H 3 PO 4 + 5HCI,
RF 5 + HF = N.
KICHIK GURUHNING UMUMIY XUSUSIYATLARI
7 N, 15 P, 33 As, 51 Sb, 83 Bi. Yuqoridan pastgacha bo'lgan kichik guruhda metall xususiyatlar tabiiy ravishda oshadi va bu birikmalardagi elementlar tomonidan ko'rsatiladigan oksidlanish darajalarining qiymatlariga, shuningdek, ba'zi fizik xususiyatlarga mos keladi. P, As va Sb ning allotropiyasi jismoniy xususiyatlarni bitta jadvalga birlashtirishda ma'lum qiyinchiliklarni keltirib chiqarsa ham:
11-jadval
Beshinchi guruh, asosiy kichik guruh elementlarining xossalari
Kimyoviy xossalari
1. Oddiy moddalar bilan turli xil oksidlanish-qaytarilish xususiyatiga ega turli birikmalar olinadi:
a) tiklash xususiyatlari
2P + 3Cl 2 = 2PCl 3 (yoki PCl 5);
4As + 5O 2 = 2As 2 O 5;
2Bi + 3Cl 2 = 2BiCl 3.
b) Oksidlanish xossalari
2P + 3Ca = Ca 3 P 2;
2As + 3Mg = Mg 3 As 2.
2. Kichik guruh elementining tabiatiga qarab kislotalar bilan turlicha reaksiyaga kirishadi:
2P + 5H 2 SO 4 = 2H 3 PO 4 + 5SO 2 + 2H 2 O;
3As + 5HNO 3 + 2H 2 O = 3H 3 AsO 4 + 5NO;
3Sb + 5HNO 3 = 3HSbO 3 + 5NO + H 2 O;
2Sb + 6H 2 SO 4 kons. = Sb 2 (SO 4) 3 + 3SO 2 + 6H 2 O;
Bi + 4HNO 3 = Bi(NO 3) 3 + NO + 2H 2 O.
Shuni esda tutish kerakki, mishyak kichik guruhining elementlari faollik qatorida vodoroddan keyin paydo bo'ladi.
3. Birikmalarning gidrolizi turli yo'llar bilan sodir bo'ladi:
a) PCl 3 + 3H 2 O = H 3 PO 3 + 3HCl;
BiCl 3 + H 2 O ® BiOCl ¯ + 2HCl.
(SbCl 3) (SbOCl)
b) NaNO 2 + H 2 O Û HNO 2 + NaOH;
K 3 PO 4 + H 2 O Û K 2 HPO 4 + KOH;
K 3 AsO 4 + H 2 O Û K 2 HAsO 4 + KOH.
4. Elementlarning kislota-ishqor xossalarining o'zgarishi turlicha namoyon bo'ladi
12-jadval
Beshinchi kichik guruh elementlarining eng muhim birikmalari
5. Birikmalarning oksidlanish-qaytarilish qobiliyati elementning oksidlanish darajasiga bog'liq:
A) E -3- kamaytiruvchi vositalar
2NH 3 + 6KMnO 4 + 6KOH = 6K 2 MnO 4 + N 2 + 6H 2 O;
2PH 3 + 4O 2 = P 2 O 5 + 3H 2 O.
oksidlovchi moddalar:
2KNO 2 + 4H 2 S = 3S + N 2 + K 2 S + 4H 2 O
E +3 2BiCl 3 + 3SnCl 2 + 18KOH = 2Bi + 3K 2 SnO 3 + 12KCl + 9H 2 O.
kamaytiruvchi vositalar:
10KNO 2 +4KMnO 4 +11H 2 SO 4 =10HNO 3 +4MnSO 4 +7K 2 SO 4 +6H 2 O
V) E +5 – oksidlovchi moddalar
Na 3 SbO 4 + 2NaJ + H 2 SO 4 = Na 3 SbO 3 + J 2 + Na 2 SO 4 + H 2 O.
6-guruh elementlari. (Xalkogenlar)
Elektron qobiqning tuzilishi: ... ns 2 np 4.
8 O, 16 S, 34 Se, 52 Te, 84 Po (radioaktiv).
KSILGEN va uning birikmalari
Erdagi eng keng tarqalgan element: havoda 21% (hajm bo'yicha), H 2 O, minerallar va organik moddalarning bir qismidir.
Jismoniy xususiyatlar
Moddalar shaklida mavjud:
a) "kislorod" O 2 - rangsiz, ta'msiz, hidsiz, toksik bo'lmagan gaz; t° qaynatiladi. = -183°C; ;
b) "ozon" O 3 - o'tkir hidli ko'k gaz, zaharli, juda kuchli oksidlovchi; t° qaynatiladi. = -111,8 ° S.
Kimyoviy xossalari
1. Faqat bitta reaksiyada kislorod qaytaruvchi hisoblanadi:
O 2 + 2F 2 = 2OF 2 ().
2. Boshqa barcha holatlarda kislorod oksidlovchi moddadir, ayniqsa atom holatida bo'lsa:
a) Oddiy moddalarning oksidlanishi
2H 2 + O 2 = 2H 2 O;
S + O 2 = SO 2;
2Ca + O 2 = 2CaO.
b) Murakkab moddalarning oksidlanishi
R 2 O 3 + O 2 = R 2 O 5;
2SO 2 + O 2 = 2SO 3;
2PCl 3 + O 2 = 2POCl 3.
v) Murakkab noorganik moddalarning yonishi
2H 2 S + O 2 yetarli emas = 2S + 2H 2 O;
2H 2 S + 3O 2 g. = 2SO 2 + 2H 2 O.
d) Organik moddalarning yonishi
CH 4 + 2O 2 = CO 2 + 2H 2 O;
C 2 H 5 OH + 3O 2 = 2CO 2 + 3H 2 O.
Oltingugurt va uning birikmalari
Tabiatda o'zining ona shaklida topilgan; minerallar (sulfidlar, sulfatlar) shaklida; yog'da; oqsillarda.
Jismoniy xususiyatlar
Qattiq, mo'rt, sariq, H 2 O da erimaydi, lekin uglerod disulfidi va anilinda eriydi. Allotropik: rombsimon oltingugurt (a-shakl); monoklinik (b - oltingugurt); plastmassa va boshqalar. Eng barqaror modifikatsiya a (t° pl. » 113°C), S 8 tarkibi unga tegishli.
Kimyoviy xossalari
Har xil oksidlanish darajasini ko'rsatadigan birikmalar turli xil oksidlanish-qaytarilish qobiliyatiga ega.
13-jadval
Eng muhim oltingugurt birikmalari
1. Oltingugurt kompleks birikmalar bilan o'zaro ta'sirlashib, oksidlanish darajasini turli yo'llar bilan o'zgartiradi:
a) S + 2H 2 SO 4 kons. = 3SO 2 + 2H 2 O ();
b) S + 6HNO 3 kons. = H 2 SO 4 + 6NO 2 + 2H 2 O ();
c) 3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
nomutanosiblik reaktsiyasi
2. Ulanishlar S-2
A) H2S– vodorod sulfidi, chirigan tuxum hidli zaharli gaz, kuchli qaytaruvchi: 2H 2 S + O 2 = 2S + 2H 2 O;
H 2 S + Cl 2 = 2HCl + S.
b) H 2 S eritmasi – kuchsiz kislota
H 2 S Û N + + HS - (K 1 = 6 × 10 -8).
v) tuzlar – sulfidlar; ishqoriy va ishqoriy tuproq metallarining tuzlari yaxshi eriydi va gidrolizlanadi; p- va d-metallarning sulfidlari amalda erimaydi.
G) Sulfidlar metallar ko'rgazmasi asosiy tabiat:
K 2 S + H 2 O Û KHS + KOH;
Metall bo'lmagan sulfidlar ko'rgazmasi kislotali tabiat:
SiS 2 + 3H 2 O = H 2 SiO 3 + 2H 2 S.
d) Tiozollar: oddiy tuzlarga o'xshash, ulardagi O atomlari S bilan almashtiriladi:
Na 2 S + CS 2 = Na 2 CS 3 - natriy tiokarbonat;
Na 2 CS 3 + 2HCl = 2NaCl + H 2 CS 3
beqaror
e) Polisulfidlar: oltingugurt, peroksidlardagi kislorod kabi, tuzlar hosil qilishi mumkin: Na 2 S eritmasi + ´S = Na 2 S n - natriy polisulfidi (tarkibida sulfid ko'prigi bor - S - S - S - S -).
3. S+4 ulanishlari
a) SO 2 – o‘tkir hidli oltingugurt dioksidi, zaharli;
b) SO 2 eritmasi - oltingugurt kislotasi H 2 SO 3, o'rtacha quvvat
H 2 SO 3 Û H + + HSO 3 - (K 1 = 1,3 × 10 -2);
v) Tuzlar – sulfitlar, yaxshi gidrolizlanadi
Na 2 SO 3 + H 2 O Û NaHSO 3 + NaOH.
d) Oksidlanish-qaytarilish reaksiyalarida bu birikmalarning barchasi ikkilikni namoyon qiladi:
SO 2 + 2H 2 S = 3S + 2H 2 O;
2SO 2 + O 2 = 2SO 3.
e) tionilxlorid: SOCl 2
SOCl 2 + 2H 2 O = H 2 SO 3 + 2HCl.
4. S+6 ulanishlari
A) SO 3- sulfat angidrid; allotropik, kuchli oksidlovchi. Suv bilan juda kuchli reaksiyaga kirishadi
SO 3 + H 2 O ® H 2 SO 4 + 89,1 kJ/mol;
b) H2SO4– sulfat kislota, rangsiz yog‘li suyuqlik; kuchli.
H 2 SO 4 kons. - juda kuchli oksidlovchi; qog'oz, shakar, yog'och:
C + 2H 2 SO 4 kons. = CO 2 + 2SO 2 + 2H 2 O.
Individual ravishda uning metallar bilan munosabati:
oddiy haroratda u ko'plab metallar bilan ta'sir qilmaydi ("Cr, Fe, Al, Zn, ... passivatlar");
yuqori darajada, Au va Pt dan tashqari deyarli barcha metallar bilan reaksiyaga kirishadi.
Bu juda yaxshi suvni olib tashlash vositasi, chunki ... suv bilan H 2 SO 4 × nH 2 O gidratlarini hosil qiladi:
V) Tuzlar: o'rtacha - K 2 SO 4 (sulfatlar);
kislotali - KHSO 4 (vodorod sulfatlari);
vitriol - CuSO 4 × 5H 2 O; ZnSO 4 × 7H 2 O;
alum - qo'sh tuzlar, kristallgidratlar
KAl(SO 4) 2 × 12H 2 O; NH 4 Fe(SO 4) 2 × 12H 2 O.
G) Oleum– SO 3 ning H 2 SO 4 dagi eritmasi, reaksiya qisman sodir bo‘ladi
2SO 3 + H 2 O = H 2 S 2 O 7 pirosulfat kislota.
d) Oltingugurt xlorid SO2Cl2
SO 2 Cl 2 + 2H 2 O = H 2 SO 4 + 2HCl.
e) Peroksosulfat kislotalar- tarkibida peroksid ko'prigi mavjud
H 2 SO 5 - peroksomonosulfur,
H 2 S 2 O 8 - peroksodisulfur;
kuchli oksidlovchi moddalar.
va) Tiosulfatlar– tarkibida turli oksidlanish darajalarida oltingugurt bor: S +6 va S -2; S-2 mavjudligi sababli, birikmalar kuchli qaytaruvchi moddalardir.
Na 2 S 2 O 3 + Br 2 + H 2 O = 2HBr + S + Na 2 SO 4.
Tegishli kislota H 2 S 2 O 3 (tiosulfat) beqaror:
Na 2 S 2 O 3 + H 2 SO 4 = Na 2 SO 4 + H 2 S 2 O 3.
7a guruhining elementlari. (Galogenlar )
Elektron qobiqning tuzilishi: ... ns 2 np 5.
9 F, 17 Cl, 35 Br, 53 J, 85 At (radioaktiv). Erkin holatda ular ikki atomli molekulalar shaklida mavjud.
Jismoniy xususiyatlar
Zaharli, o'tkir hidli F 2 - och sariq gaz, qaynash nuqtasi. = -188,2 ° S;
Cl 2 - yashil-sariq gaz; t° qaynatiladi. = -34,1°C;
Br 2 - qizil suyuqlik; t° qaynatiladi. = 59,2 ° S;
J 2 - binafsha rangli kristallar; t° qaynatiladi. = +185,5 ° S.
Kimyoviy xossalari
1) Eng faol F 2, uning atmosferasida hatto shisha va suv yonadi:
2F 2 + SiO 2 = SiF 4 + O 2;
2F 2 + 2H 2 O = 4HF + O 2.
2) Yuqori oqimdagi galogenlar (kuchli oksidlovchi moddalar sifatida) quyi oqimdagilarni turli birikmalardan siqib chiqaradi:
F 2 + 2KCl (KBr, KJ) = 2KF + Cl 2 (Br 2, J 2).
3) Galogenlarni suvda va ishqor eritmalarida eritganda disproporsiya reaksiyalari sodir bo'ladi; Haroratga qarab turli xil reaksiya mahsulotlari olinadi:
Cl 2 + H 2 O = HCl + HClO;
Cl 2 + 2NaOH = NaCl + NaClO;
4) Vodorod galogenidlari– ularning barchasi rangsiz gazlardir (HF, vodorod aloqalari tufayli H x F x assotsiatsiyalarini hosil qiladi).
Seriyada: HF – HCl – HBr – HJ, bog‘lanish kuchi pasayadi va qaytaruvchi xossalari ortadi:
MnO 2 + 4HCl = Cl 2 + MnCl 2 + 2H 2 O ().
5) Suvda eritilganda kuchli kislotalar olinadi; HJ eng kuchli (kuchsiz gidroflorik kislotadan tashqari:
H 2 F 2 Û H + + HF 2 -)
6) Xolidlar elementlar turli xil kislota-ishqor xarakteriga ega, bu o'zini namoyon qiladi:
a) gidroliz reaksiyalarida
AlCl 3 + H 2 O Û AlOHCl 2 + HCl;
PBr 3 + 3H 2 O = H 3 PO 3 + 3HBr.
b) murakkab hosil bo'lish reaksiyalarida
2NaF + SiF 4 ® Na 2;
bir qator ligandlar uchun F - ; Cl - ; Br -; J - komplekslarning barqarorligi pasayadi.
7) Yuqori oksidlanish darajasidagi halogenlar
a) oksidlar: Cl 2 O; (ClO 2) 2; (ClO 3) 2; Cl 2 O 7;
b) kislotalar: HClO; HClO2; HClO3; HClO4;
bir qator kislotalar uchun ® kuch kuchayadi, bir xil seriyadagi kislotalar va ularning tuzlari uchun oksidlovchi xususiyatlar pasayadi.
v) kislotalar va ularning tuzlari qizdirilganda parchalanadi:
d) galogenlar orasidagi birikmalar: ularning ko'pi ma'lum; Tarkibi davriy jadvaldagi elementlarning holatiga mos keladi (formulalar oxirida ko'proq elektron manfiy elementlar paydo bo'ladi):
ClF, BrF, JF; ClF 3, JF 3; ClF 5, ClOF 3; BrF 7, JO 3 F va boshqalar;
kislotali tabiatga ega: JF 7 + 4H 2 O = 7HF + HJO 4;
ClO 3 F + 2NaOH = NaClO 4 + NaF + H 2 O.
Materialni mustahkamlash uchun savollar:
1. Mishyak konsentrlangan nitrat kislota - a)As(NO3)3 bilan reaksiyaga kirishganda qanday modda hosil bo'ladi? b) H 3 AsO 4? c) 2 O 3 sifatida?
2.Qanday modda konsentrlangan kislota bilan reaksiyaga kirishib erkin xlor – a)CaC1 2 ni chiqaradi? b) MnO 2? c) CrC1 3?