यौगिक की प्रतिक्रियाएँ इस प्रकार हैं। सामान्य रसायन विज्ञान का परिचय
रासायनिक प्रतिक्रिया- यह एक अलग संरचना और रासायनिक संरचना के साथ एक या एक से अधिक पदार्थों का दूसरे पदार्थ में "परिवर्तन" है। परिणामी पदार्थ या पदार्थों को "प्रतिक्रिया उत्पाद" कहा जाता है। रासायनिक प्रतिक्रियाओं के दौरान, नाभिक और इलेक्ट्रॉन नए यौगिक (पुनर्वितरित) बनाते हैं, लेकिन उनकी मात्रा नहीं बदलती है और रासायनिक तत्वों की समस्थानिक संरचना वही रहती है।
सभी रासायनिक प्रतिक्रियाओं को सरल और जटिल में विभाजित किया गया है।
आरंभिक और परिणामी पदार्थों की संख्या और संरचना के आधार पर, सरल रासायनिक प्रतिक्रियाओं को कई मुख्य प्रकारों में विभाजित किया जा सकता है।
अपघटन अभिक्रियाएँ वे अभिक्रियाएँ होती हैं जिनमें एक जटिल पदार्थ से कई अन्य पदार्थ प्राप्त होते हैं। इसी समय, गठित पदार्थ सरल और जटिल दोनों हो सकते हैं। एक नियम के रूप में, रासायनिक अपघटन प्रतिक्रिया होने के लिए, हीटिंग आवश्यक है (यह एक एंडोथर्मिक प्रक्रिया है, गर्मी अवशोषण)।
उदाहरण के लिए, जब मैलाकाइट पाउडर को गर्म किया जाता है, तो तीन नए पदार्थ बनते हैं: कॉपर ऑक्साइड, पानी और कार्बन डाइऑक्साइड:
Cu 2 CH 2 O 5 = 2CuO + H 2 O + CO 2
मैलाकाइट → कॉपर ऑक्साइड + पानी + कार्बन डाइऑक्साइड
यदि प्रकृति में केवल विघटन प्रतिक्रियाएं होती हैं, तो सभी जटिल पदार्थ जो विघटित हो सकते हैं, विघटित हो जाएंगे और रासायनिक घटनाएं अब घटित नहीं हो सकेंगी। लेकिन अन्य प्रतिक्रियाएं भी हैं.
यौगिक प्रतिक्रियाओं में, कई सरल या जटिल पदार्थ एक जटिल पदार्थ का निर्माण करते हैं। इससे पता चलता है कि यौगिक अभिक्रियाएँ अपघटन अभिक्रियाओं के विपरीत होती हैं।
उदाहरण के लिए, जब तांबे को हवा में गर्म किया जाता है, तो उस पर काली परत चढ़ जाती है। कॉपर को कॉपर ऑक्साइड में परिवर्तित किया जाता है:
2Cu + O 2 = 2CuO
कॉपर + ऑक्सीजन → कॉपर ऑक्साइड
एक सरल और एक जटिल पदार्थ के बीच होने वाली रासायनिक प्रतिक्रियाएँ, जिसमें सरल पदार्थ को बनाने वाले परमाणु जटिल पदार्थ के किसी एक तत्व के परमाणुओं को प्रतिस्थापित कर देते हैं, प्रतिस्थापन प्रतिक्रियाएँ कहलाती हैं।
 उदाहरण के लिए, यदि आप एक लोहे की कील को कॉपर क्लोराइड (CuCl2) के घोल में डुबोते हैं, तो यह (कील) इसकी सतह पर निकले तांबे से ढकने लगेगी। और प्रतिक्रिया के अंत तक, घोल नीले से हरे रंग में बदल जाता है: कॉपर क्लोराइड के बजाय, इसमें अब फेरिक क्लोराइड होता है:
उदाहरण के लिए, यदि आप एक लोहे की कील को कॉपर क्लोराइड (CuCl2) के घोल में डुबोते हैं, तो यह (कील) इसकी सतह पर निकले तांबे से ढकने लगेगी। और प्रतिक्रिया के अंत तक, घोल नीले से हरे रंग में बदल जाता है: कॉपर क्लोराइड के बजाय, इसमें अब फेरिक क्लोराइड होता है:
Fe + CuCl 2 = Cu + FeCl 2
आयरन + कॉपर क्लोराइड → कॉपर + फेरिक क्लोराइड
कॉपर क्लोराइड में तांबे के परमाणुओं को लोहे के परमाणुओं से बदल दिया गया।
विनिमय प्रतिक्रिया एक ऐसी प्रतिक्रिया है जिसमें दो जटिल पदार्थ अपने घटक भागों का आदान-प्रदान करते हैं। अधिकतर, ऐसी प्रतिक्रियाएँ जलीय घोलों में होती हैं।
एसिड के साथ धातु ऑक्साइड की प्रतिक्रियाओं में, दो जटिल पदार्थ - एक ऑक्साइड और एक एसिड - अपने घटक भागों का आदान-प्रदान करते हैं: एसिड अवशेषों के लिए ऑक्सीजन परमाणु, और धातु परमाणुओं के लिए हाइड्रोजन परमाणु।
उदाहरण के लिए, यदि कॉपर ऑक्साइड (CuO) को सल्फ्यूरिक एसिड H2SO4 के साथ मिलाकर गर्म किया जाए, तो एक घोल प्राप्त होता है जिससे कॉपर सल्फेट को अलग किया जा सकता है:
CuO + H 2 SO 4 = CuSO 4 + H 2 O
कॉपर ऑक्साइड + सल्फ्यूरिक एसिड → कॉपर सल्फेट + पानी
ब्लॉग.साइट, सामग्री को पूर्ण या आंशिक रूप से कॉपी करते समय, मूल स्रोत के लिंक की आवश्यकता होती है।
7.1. रासायनिक प्रतिक्रियाओं के मूल प्रकार
पदार्थों के परिवर्तन, साथ में उनकी संरचना और गुणों में परिवर्तन को रासायनिक प्रतिक्रिया या रासायनिक अंतःक्रिया कहा जाता है। रासायनिक अभिक्रियाओं के दौरान परमाणु नाभिक की संरचना में कोई परिवर्तन नहीं होता है।
ऐसी घटनाएँ जिनमें पदार्थों का आकार या भौतिक अवस्था बदल जाती है या परमाणु नाभिक की संरचना बदल जाती है, भौतिक कहलाती है। भौतिक घटनाओं का एक उदाहरण धातुओं का ताप उपचार है, जिसके दौरान उनका आकार बदलता है (फोर्जिंग), धातु का पिघलना, आयोडीन का ऊर्ध्वपातन, पानी का बर्फ या भाप में परिवर्तन, आदि, साथ ही परमाणु प्रतिक्रियाएँ, जिसके परिणामस्वरूप कुछ तत्वों के परमाणुओं से दूसरे तत्वों का निर्माण होता है।
रासायनिक घटनाओं के साथ-साथ भौतिक परिवर्तन भी हो सकते हैं। उदाहरण के लिए, गैल्वेनिक सेल में होने वाली रासायनिक प्रतिक्रियाओं के परिणामस्वरूप, एक विद्युत प्रवाह उत्पन्न होता है।
रासायनिक प्रतिक्रियाओं को विभिन्न मानदंडों के अनुसार वर्गीकृत किया जाता है।
1. तापीय प्रभाव के संकेत के अनुसार सभी प्रतिक्रियाओं को विभाजित किया गया है एन्दोठेर्मिक(गर्मी अवशोषण के साथ आगे बढ़ना) और एक्ज़ोथिर्मिक(गर्मी के निकलने के साथ बहना) (§ 6.1 देखें)।
2. प्रारंभिक पदार्थों और प्रतिक्रिया उत्पादों के एकत्रीकरण की स्थिति के आधार पर, उन्हें प्रतिष्ठित किया जाता है:
सजातीय प्रतिक्रियाएँ, जिसमें सभी पदार्थ एक ही चरण में होते हैं:
2 KOH (पी-पी) + एच 2 एसओ 4 (पी-पी) = के 2 एसओ (पी-पी) + 2 एच 2 ओ (एल),
सीओ (जी) + सीएल 2 (जी) = सीओसीएल 2 (जी),
SiO 2(k) + 2 Mg (k) = Si (k) + 2 MgO (k)।
विषम प्रतिक्रियाएं, वे पदार्थ जिनमें विभिन्न चरण होते हैं:
CaO (k) + CO 2 (g) = CaCO 3 (k),
CuSO 4 (समाधान) + 2 NaOH (समाधान) = Cu(OH) 2 (k) + Na 2 SO 4 (समाधान),
Na 2 SO 3 (समाधान) + 2HCl (समाधान) = 2 NaCl (समाधान) + SO 2 (g) + H 2 O (l)।
3. केवल आगे की दिशा में प्रवाहित होने की क्षमता के अनुसार, साथ ही आगे और पीछे की दिशा में भी भेद किया जाता है अचलऔर प्रतिवर्तीरासायनिक प्रतिक्रियाएँ (§ 6.5 देखें)।
4. उत्प्रेरकों की उपस्थिति या अनुपस्थिति के आधार पर वे भेद करते हैं उत्प्रेरकऔर गैर उत्प्रेरकप्रतिक्रियाएँ (§ 6.5 देखें)।
5. उनकी घटना के तंत्र के अनुसार, रासायनिक प्रतिक्रियाओं को विभाजित किया गया है ईओण का, मौलिकआदि (कार्बनिक यौगिकों की भागीदारी से होने वाली रासायनिक प्रतिक्रियाओं के तंत्र पर कार्बनिक रसायन विज्ञान के पाठ्यक्रम में चर्चा की गई है)।
6. अभिकारक पदार्थों के संघटन में सम्मिलित परमाणुओं की ऑक्सीकरण अवस्था के अनुसार अभिक्रियाएँ होती हैं ऑक्सीकरण अवस्था को बदले बिनापरमाणु, और परमाणुओं की ऑक्सीकरण अवस्था में परिवर्तन के साथ ( रेडॉक्स प्रतिक्रियाएं) (§ 7.2 देखें) .
7. प्रारंभिक पदार्थों और प्रतिक्रिया उत्पादों की संरचना में परिवर्तन से प्रतिक्रियाओं को अलग किया जाता है कनेक्शन, अपघटन, प्रतिस्थापन और विनिमय. ये प्रतिक्रियाएँ तत्वों की ऑक्सीकरण अवस्था में परिवर्तन के साथ और उसके बिना भी हो सकती हैं, तालिका . 7.1.
तालिका 7.1
रासायनिक प्रतिक्रियाओं के प्रकार
सामान्य योजना |
तत्वों की ऑक्सीकरण अवस्था को बदले बिना होने वाली प्रतिक्रियाओं के उदाहरण |
रेडॉक्स प्रतिक्रियाओं के उदाहरण |
|
सम्बन्ध (दो या दो से अधिक पदार्थों से एक नया पदार्थ बनता है) |
एचसीएल + एनएच 3 = एनएच 4 सीएल; एसओ 3 + एच 2 ओ = एच 2 एसओ 4 |
एच 2 + सीएल 2 = 2एचसीएल; 2Fe + 3Cl 2 = 2FeCl 3 |
|
विघटन (एक पदार्थ से अनेक नये पदार्थ बनते हैं) |
ए = बी + सी + डी |
एमजीसीओ 3 एमजीओ + सीओ 2; एच 2 SiO 3 SiO 2 + H 2 O |
2AgNO 3 2Ag + 2NO 2 + O 2 |
प्रतिस्थापन (जब पदार्थ परस्पर क्रिया करते हैं, तो एक अणु में एक पदार्थ के परमाणु दूसरे पदार्थ के परमाणुओं का स्थान ले लेते हैं) |
ए + बीसी = एबी + सी |
CaCO 3 + SiO 2 CaSiO 3 + CO 2 |
Pb(NO 3) 2 + Zn = एमजी + 2एचसीएल = एमजीसीएल 2 + एच 2 |
|
(दो पदार्थ अपने घटक भागों का आदान-प्रदान करते हैं, जिससे दो नए पदार्थ बनते हैं) |
एबी + सीडी = एडी + सीबी |
AlCl 3 + 3NaOH = Ca(OH) 2 + 2HCl = CaCl 2 + 2H 2 O |
7.2. रेडॉक्स प्रतिक्रियाएं
जैसा कि ऊपर बताया गया है, सभी रासायनिक प्रतिक्रियाओं को दो समूहों में विभाजित किया गया है:
रासायनिक प्रतिक्रियाएँ जो अभिकारकों को बनाने वाले परमाणुओं की ऑक्सीकरण अवस्था में परिवर्तन के साथ होती हैं, रेडॉक्स प्रतिक्रियाएँ कहलाती हैं।
ऑक्सीकरणकिसी परमाणु, अणु या आयन द्वारा इलेक्ट्रॉन छोड़ने की प्रक्रिया है:
Na o – 1e = Na + ;
Fe 2+ – e = Fe 3+ ;
एच 2 ओ – 2ई = 2एच + ;
2 Br – – 2e = Br 2 o.
वसूलीकिसी परमाणु, अणु या आयन में इलेक्ट्रॉन जोड़ने की प्रक्रिया है:
एस ओ + 2ई = एस 2– ;
सीआर 3+ + ई = सीआर 2+ ;
सीएल 2 ओ + 2ई = 2सीएल - ;
एमएन 7+ + 5ई = एमएन 2+।
वे परमाणु, अणु या आयन जो इलेक्ट्रॉन ग्रहण करते हैं, कहलाते हैं ऑक्सीडाइज़िंग एजेंट. संरक्षणकर्ताओंपरमाणु, अणु या आयन हैं जो इलेक्ट्रॉन दान करते हैं।
इलेक्ट्रॉनों को स्वीकार करने से, प्रतिक्रिया के दौरान ऑक्सीकरण एजेंट कम हो जाता है, और कम करने वाला एजेंट ऑक्सीकृत हो जाता है। ऑक्सीकरण हमेशा कमी के साथ होता है और इसके विपरीत भी। इस प्रकार, कम करने वाले एजेंट द्वारा छोड़े गए इलेक्ट्रॉनों की संख्या हमेशा ऑक्सीकरण एजेंट द्वारा स्वीकार किए गए इलेक्ट्रॉनों की संख्या के बराबर होती है.
7.2.1. ऑक्सीकरण अवस्था
ऑक्सीकरण अवस्था एक यौगिक में एक परमाणु का सशर्त (औपचारिक) आवेश है, जिसकी गणना इस धारणा के तहत की जाती है कि इसमें केवल आयन होते हैं। ऑक्सीकरण अवस्था को आमतौर पर तत्व प्रतीक के ऊपर "+" या "-" चिह्न के साथ अरबी अंक द्वारा दर्शाया जाता है। उदाहरण के लिए, अल 3+, एस 2–।
ऑक्सीकरण अवस्थाएँ ज्ञात करने के लिए निम्नलिखित नियमों का उपयोग किया जाता है:
सरल पदार्थों में परमाणुओं की ऑक्सीकरण अवस्था शून्य होती है;
एक अणु में परमाणुओं की ऑक्सीकरण अवस्थाओं का बीजगणितीय योग शून्य के बराबर होता है, एक जटिल आयन में - आयन का आवेश;
क्षार धातु परमाणुओं की ऑक्सीकरण अवस्था हमेशा +1 होती है;
गैर-धातुओं (सीएच 4, एनएच 3, आदि) वाले यौगिकों में हाइड्रोजन परमाणु +1 की ऑक्सीकरण अवस्था प्रदर्शित करता है, और सक्रिय धातुओं के साथ इसकी ऑक्सीकरण अवस्था -1 (NaH, CaH 2, आदि) प्रदर्शित करता है;
यौगिकों में फ्लोरीन परमाणु हमेशा -1 की ऑक्सीकरण अवस्था प्रदर्शित करता है;
यौगिकों में ऑक्सीजन परमाणु की ऑक्सीकरण अवस्था आमतौर पर -2 होती है, पेरोक्साइड (H 2 O 2, Na 2 O 2) को छोड़कर, जिसमें ऑक्सीजन की ऑक्सीकरण अवस्था -1 होती है, और कुछ अन्य पदार्थ (सुपरऑक्साइड, ओजोनाइड, ऑक्सीजन) फ्लोराइड्स)।
किसी समूह में तत्वों की अधिकतम धनात्मक ऑक्सीकरण अवस्था आमतौर पर समूह संख्या के बराबर होती है। अपवाद फ्लोरीन और ऑक्सीजन हैं, क्योंकि उनकी उच्चतम ऑक्सीकरण अवस्था उस समूह की संख्या से कम है जिसमें वे पाए जाते हैं। कॉपर उपसमूह के तत्व ऐसे यौगिक बनाते हैं जिनमें उनकी ऑक्सीकरण अवस्था समूह संख्या (CuO, AgF 5, AuCl 3) से अधिक होती है।
आवर्त सारणी के मुख्य उपसमूहों में स्थित तत्वों की अधिकतम नकारात्मक ऑक्सीकरण अवस्था समूह संख्या को आठ से घटाकर निर्धारित की जा सकती है। कार्बन के लिए यह 8 - 4 = 4 है, फॉस्फोरस के लिए - 8 - 5 = 3.
मुख्य उपसमूहों में, जब तत्व ऊपर से नीचे की ओर बढ़ते हैं, तो उच्चतम सकारात्मक ऑक्सीकरण अवस्था की स्थिरता कम हो जाती है; इसके विपरीत, माध्यमिक उपसमूहों में, ऊपर से नीचे की ओर जाने पर उच्च ऑक्सीकरण अवस्था की स्थिरता बढ़ जाती है।
ऑक्सीकरण अवस्था की अवधारणा की पारंपरिकता को कुछ अकार्बनिक और कार्बनिक यौगिकों के उदाहरण का उपयोग करके प्रदर्शित किया जा सकता है। विशेष रूप से, फॉस्फिनिक (फॉस्फोरस) H 3 PO 2, फॉस्फोनिक (फॉस्फोरस) H 3 PO 3 और फॉस्फोरिक H 3 PO 4 एसिड में, फॉस्फोरस की ऑक्सीकरण अवस्थाएँ क्रमशः +1, +3 और +5 होती हैं, जबकि इन सभी यौगिकों में फॉस्फोरस पेंटावैलेंट है. मीथेन सीएच 4, मेथनॉल सीएच 3 ओएच, फॉर्मेल्डिहाइड सीएच 2 ओ, फॉर्मिक एसिड एचसीओओएच और कार्बन मोनोऑक्साइड (IV) सीओ 2 में कार्बन के लिए, कार्बन की ऑक्सीकरण अवस्थाएँ क्रमशः -4, -2, 0, +2 और +4 हैं। , जबकि इन सभी यौगिकों में कार्बन परमाणु की संयोजकता चार है।
इस तथ्य के बावजूद कि ऑक्सीकरण अवस्था एक पारंपरिक अवधारणा है, इसका व्यापक रूप से रेडॉक्स प्रतिक्रियाओं की रचना में उपयोग किया जाता है।
7.2.2. सबसे महत्वपूर्ण ऑक्सीकरण और कम करने वाले एजेंट
विशिष्ट ऑक्सीकरण एजेंट हैं:
1. सरल पदार्थ जिनके परमाणुओं में उच्च विद्युत ऋणात्मकता होती है। ये, सबसे पहले, आवर्त सारणी के समूहों के मुख्य उपसमूह VI और VII के तत्व हैं: ऑक्सीजन, हैलोजन। सरल पदार्थों में सबसे शक्तिशाली ऑक्सीकरण एजेंट फ्लोरीन है।
2. उच्च ऑक्सीकरण अवस्था में कुछ धातु धनायन युक्त यौगिक: Pb 4+, Fe 3+, Au 3+, आदि।
3. कुछ जटिल आयनों वाले यौगिक, जिनमें तत्व उच्च सकारात्मक ऑक्सीकरण अवस्था में हैं: 2–, -, आदि।
कम करने वाले एजेंटों में शामिल हैं:
1. सरल पदार्थ जिनके परमाणुओं की विद्युत ऋणात्मकता कम होती है, सक्रिय धातु होते हैं। गैर-धातुएं, जैसे हाइड्रोजन और कार्बन, भी कम करने वाले गुण प्रदर्शित कर सकते हैं।
2. कुछ धातु यौगिकों में धनायन (Sn 2+, Fe 2+, Cr 2+) होते हैं, जो इलेक्ट्रॉन दान करके अपनी ऑक्सीकरण अवस्था को बढ़ा सकते हैं।
3. कुछ यौगिक जिनमें सरल आयन होते हैं जैसे I- , S 2- ।
4. जटिल आयन (S 4+ O 3) 2–, (НР 3+ O 3) 2– युक्त यौगिक, जिनमें तत्व इलेक्ट्रॉन दान करके अपनी धनात्मक ऑक्सीकरण अवस्था को बढ़ा सकते हैं।
प्रयोगशाला अभ्यास में, निम्नलिखित ऑक्सीकरण एजेंटों का सबसे अधिक उपयोग किया जाता है:
पोटेशियम परमैंगनेट (KMnO 4);
पोटेशियम डाइक्रोमेट (K 2 Cr 2 O 7);
नाइट्रिक एसिड (HNO 3);
सांद्र सल्फ्यूरिक एसिड (H 2 SO 4);
हाइड्रोजन पेरोक्साइड (एच 2 ओ 2);
मैंगनीज (IV) और लेड (IV) के ऑक्साइड (MnO 2, PbO 2);
पिघला हुआ पोटेशियम नाइट्रेट (KNO 3) और कुछ अन्य नाइट्रेट का पिघला हुआ।
प्रयोगशाला अभ्यास में उपयोग किए जाने वाले कम करने वाले एजेंटों में शामिल हैं:
- मैग्नीशियम (एमजी), एल्यूमीनियम (अल) और अन्य सक्रिय धातुएँ;
- हाइड्रोजन (एच 2) और कार्बन (सी);
- पोटेशियम आयोडाइड (KI);
- सोडियम सल्फाइड (Na 2 S) और हाइड्रोजन सल्फाइड (H 2 S);
- सोडियम सल्फाइट (Na 2 SO 3);
- टिन क्लोराइड (SnCl 2)।
7.2.3. रेडॉक्स प्रतिक्रियाओं का वर्गीकरण
रेडॉक्स प्रतिक्रियाओं को आम तौर पर तीन प्रकारों में विभाजित किया जाता है: अंतर-आणविक, इंट्रामोल्युलर, और अनुपातहीन प्रतिक्रियाएं (स्व-ऑक्सीकरण-स्व-कमी)।
अंतरआण्विक प्रतिक्रियाएंविभिन्न अणुओं में पाए जाने वाले परमाणुओं की ऑक्सीकरण अवस्था में परिवर्तन के साथ होता है। उदाहरण के लिए:
2 अल + Fe 2 O 3 Al 2 O 3 + 2 Fe,
C + 4 HNO 3(conc) = CO 2 + 4 NO 2 + 2 H 2 O.
को इंट्रामोल्युलर प्रतिक्रियाएंये ऐसी प्रतिक्रियाएं हैं जिनमें ऑक्सीकरण एजेंट और कम करने वाला एजेंट एक ही अणु का हिस्सा होते हैं, उदाहरण के लिए:
(एनएच 4) 2 सीआर 2 ओ 7 एन 2 + सीआर 2 ओ 3 + 4 एच 2 ओ,
2 KNO 3 2 KNO 2 + O 2।
में अनुपातहीन प्रतिक्रियाएँ(स्व-ऑक्सीकरण-स्व-अपचयन) एक ही तत्व का एक परमाणु (आयन) ऑक्सीकरण एजेंट और कम करने वाला एजेंट दोनों है:
सीएल 2 + 2 केओएच केसीएल + केसीएलओ + एच 2 ओ,
2 NO 2 + 2 NaOH = NaNO 2 + NaNO 3 + H 2 O.
7.2.4. रेडॉक्स प्रतिक्रियाओं की रचना के लिए बुनियादी नियम
रेडॉक्स प्रतिक्रियाओं की संरचना तालिका में प्रस्तुत चरणों के अनुसार की जाती है। 7.2.
तालिका 7.2
रेडॉक्स प्रतिक्रियाओं के लिए समीकरण संकलित करने के चरण
कार्रवाई |
|
ऑक्सीकरण एजेंट और कम करने वाले एजेंट का निर्धारण करें। |
|
रेडॉक्स प्रतिक्रिया के उत्पादों की पहचान करें। |
|
एक इलेक्ट्रॉन संतुलन बनाएं और इसका उपयोग उन पदार्थों के लिए गुणांक निर्दिष्ट करने के लिए करें जो उनकी ऑक्सीकरण अवस्था को बदलते हैं। |
|
अन्य पदार्थों के लिए गुणांक व्यवस्थित करें जो रेडॉक्स प्रतिक्रिया में भाग लेते हैं और बनते हैं। |
|
प्रतिक्रिया समीकरण के बाईं और दाईं ओर स्थित परमाणुओं (आमतौर पर हाइड्रोजन और ऑक्सीजन) के पदार्थ की मात्रा की गणना करके गुणांक की शुद्धता की जांच करें। |
आइए अम्लीय वातावरण में पोटेशियम परमैंगनेट के साथ पोटेशियम सल्फाइट की बातचीत के उदाहरण का उपयोग करके रेडॉक्स प्रतिक्रियाओं की रचना के नियमों पर विचार करें:
1. ऑक्सीकरण एजेंट और कम करने वाले एजेंट का निर्धारण
मैंगनीज, जो उच्चतम ऑक्सीकरण अवस्था में है, इलेक्ट्रॉनों को नहीं छोड़ सकता। एमएन 7+ इलेक्ट्रॉनों को स्वीकार करेगा, अर्थात। एक ऑक्सीकरण एजेंट है.
S 4+ आयन दो इलेक्ट्रॉन दान कर सकता है और S 6+ में जा सकता है, अर्थात। एक कम करने वाला एजेंट है. इस प्रकार, विचाराधीन प्रतिक्रिया में, K 2 SO 3 एक कम करने वाला एजेंट है, और KMnO 4 एक ऑक्सीकरण एजेंट है।
2. प्रतिक्रिया उत्पादों की स्थापना
K2SO3 + KMnO4 + H2SO4?
एक इलेक्ट्रॉन को दो इलेक्ट्रॉन दान करने से S 4+, S 6+ बन जाता है। इस प्रकार पोटेशियम सल्फाइट (K 2 SO 3) सल्फेट (K 2 SO 4) में बदल जाता है। अम्लीय वातावरण में, Mn 7+ 5 इलेक्ट्रॉनों को स्वीकार करता है और सल्फ्यूरिक एसिड (मध्यम) के घोल में मैंगनीज सल्फेट (MnSO 4) बनाता है। इस प्रतिक्रिया के परिणामस्वरूप, पोटेशियम सल्फेट के अतिरिक्त अणु (परमैंगनेट में शामिल पोटेशियम आयनों के कारण), साथ ही पानी के अणु भी बनते हैं। इस प्रकार, विचाराधीन प्रतिक्रिया इस प्रकार लिखी जाएगी:
के 2 एसओ 3 + केएमएनओ 4 + एच 2 एसओ 4 = के 2 एसओ 4 + एमएनएसओ 4 + एच 2 ओ।
3. इलेक्ट्रॉन संतुलन संकलित करना
इलेक्ट्रॉन संतुलन संकलित करने के लिए, उन ऑक्सीकरण अवस्थाओं को इंगित करना आवश्यक है जो विचाराधीन प्रतिक्रिया में बदलते हैं:
के 2 एस 4+ ओ 3 + केएमएन 7+ ओ 4 + एच 2 एसओ 4 = के 2 एस 6+ ओ 4 + एमएन 2+ एसओ 4 + एच 2 ओ।
एमएन 7+ + 5 ई = एमएन 2+ ;
एस 4+ - 2 ई = एस 6+।
कम करने वाले एजेंट द्वारा छोड़े गए इलेक्ट्रॉनों की संख्या ऑक्सीकरण एजेंट द्वारा स्वीकार किए गए इलेक्ट्रॉनों की संख्या के बराबर होनी चाहिए। इसलिए, दो एमएन 7+ और पांच एस 4+ को प्रतिक्रिया में भाग लेना चाहिए:
एमएन 7+ + 5 ई = एमएन 2+ 2,
एस 4+ – 2 ई = एस 6+ 5.
इस प्रकार, कम करने वाले एजेंट (10) द्वारा छोड़े गए इलेक्ट्रॉनों की संख्या ऑक्सीकरण एजेंट (10) द्वारा स्वीकार किए गए इलेक्ट्रॉनों की संख्या के बराबर होगी।
4. प्रतिक्रिया समीकरण में गुणांकों की व्यवस्था
इलेक्ट्रॉनों के संतुलन के अनुसार, K 2 SO 3 के सामने 5 का गुणांक और KMnO 4 के सामने 2 का गुणांक लगाना आवश्यक है। दाईं ओर, पोटेशियम सल्फेट के सामने हम 6 का गुणांक निर्धारित करते हैं। चूंकि परमैंगनेट में शामिल पोटेशियम आयनों के बंधन के परिणामस्वरूप पोटेशियम सल्फाइट के 2 एसओ 4 के ऑक्सीकरण के दौरान गठित के 2 एसओ 4 के पांच अणुओं में एक अणु जोड़ा जाता है। चूंकि प्रतिक्रिया शामिल है दोदाहिनी ओर परमैंगनेट अणु भी बनते हैं दोमैंगनीज सल्फेट अणु. प्रतिक्रिया उत्पादों (परमैंगनेट में शामिल पोटेशियम और मैंगनीज आयन) को बांधने के लिए यह आवश्यक है तीनसल्फ्यूरिक एसिड के अणु, इसलिए, प्रतिक्रिया के परिणामस्वरूप, तीनपानी के अणु. अंततः हमें मिलता है:
5 K 2 SO 3 + 2 KMnO 4 + 3 H 2 SO 4 = 6 K 2 SO 4 + 2 MnSO 4 + 3 H 2 O.
5. प्रतिक्रिया समीकरण में गुणांकों की शुद्धता की जाँच करना
प्रतिक्रिया समीकरण के बाईं ओर ऑक्सीजन परमाणुओं की संख्या है:
5 3 + 2 4 + 3 4 = 35.
दाहिनी ओर यह संख्या होगी:
6 4 + 2 4 + 3 1 = 35.
प्रतिक्रिया समीकरण के बाईं ओर हाइड्रोजन परमाणुओं की संख्या छह है और प्रतिक्रिया समीकरण के दाईं ओर इन परमाणुओं की संख्या से मेल खाती है।
7.2.5. विशिष्ट ऑक्सीकरण और कम करने वाले एजेंटों से युक्त रेडॉक्स प्रतिक्रियाओं के उदाहरण
7.2.5.1. अंतरआण्विक ऑक्सीकरण-कमी प्रतिक्रियाएं
नीचे, उदाहरण के तौर पर, हम पोटेशियम परमैंगनेट, पोटेशियम डाइक्रोमेट, हाइड्रोजन पेरोक्साइड, पोटेशियम नाइट्राइट, पोटेशियम आयोडाइड और पोटेशियम सल्फाइड से युक्त रेडॉक्स प्रतिक्रियाओं पर विचार करते हैं। अन्य विशिष्ट ऑक्सीकरण और कम करने वाले एजेंटों से जुड़ी रेडॉक्स प्रतिक्रियाओं पर मैनुअल के दूसरे भाग ("अकार्बनिक रसायन") में चर्चा की गई है।
पोटेशियम परमैंगनेट से जुड़ी रेडॉक्स प्रतिक्रियाएं
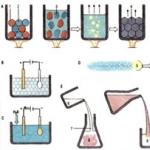
पर्यावरण (अम्लीय, तटस्थ, क्षारीय) के आधार पर, पोटेशियम परमैंगनेट, ऑक्सीकरण एजेंट के रूप में कार्य करते हुए, विभिन्न कमी उत्पाद देता है, अंजीर। 7.1.

चावल। 7.1. विभिन्न मीडिया में पोटेशियम परमैंगनेट कटौती उत्पादों का निर्माण
नीचे विभिन्न वातावरणों में एक कम करने वाले एजेंट के रूप में पोटेशियम सल्फाइड के साथ KMnO 4 की प्रतिक्रियाएं दी गई हैं, जो योजना को दर्शाती है, चित्र। 7.1. इन प्रतिक्रियाओं में, सल्फाइड आयन ऑक्सीकरण का उत्पाद मुक्त सल्फर होता है। क्षारीय वातावरण में, KOH अणु प्रतिक्रिया में भाग नहीं लेते हैं, बल्कि केवल पोटेशियम परमैंगनेट की कमी के उत्पाद का निर्धारण करते हैं।
5 के 2 एस + 2 केएमएनओ 4 + 8 एच 2 एसओ 4 = 5 एस + 2 एमएनएसओ 4 + 6 के 2 एसओ 4 + 8 एच 2 ओ,
3 K 2 S + 2 KMnO 4 + 4 H 2 O 2 MnO 2 + 3 S + 8 KOH,
के 2 एस + 2 केएमएनओ 4 – (केओएच) 2 के 2 एमएनओ 4 + एस।
पोटेशियम डाइक्रोमेट से युक्त रेडॉक्स प्रतिक्रियाएं
अम्लीय वातावरण में, पोटेशियम डाइक्रोमेट एक मजबूत ऑक्सीकरण एजेंट है। K 2 Cr 2 O 7 और सांद्र H 2 SO 4 (क्रोमियम) का मिश्रण प्रयोगशाला अभ्यास में ऑक्सीकरण एजेंट के रूप में व्यापक रूप से उपयोग किया जाता है। एक कम करने वाले एजेंट के साथ बातचीत करते हुए, पोटेशियम डाइक्रोमेट का एक अणु छह इलेक्ट्रॉनों को स्वीकार करता है, जिससे त्रिसंयोजक क्रोमियम यौगिक बनते हैं:
6 FeSO 4 +K 2 Cr 2 O 7 +7 H 2 SO 4 = 3 Fe 2 (SO 4) 3 +Cr 2 (SO 4) 3 +K 2 SO 4 +7 H 2 O;
6 KI + K 2 Cr 2 O 7 + 7 H 2 SO 4 = 3 I 2 + Cr 2 (SO 4) 3 + 4 K 2 SO 4 + 7 H 2 O.
हाइड्रोजन पेरोक्साइड और पोटेशियम नाइट्राइट से युक्त रेडॉक्स प्रतिक्रियाएं
हाइड्रोजन पेरोक्साइड और पोटेशियम नाइट्राइट मुख्य रूप से ऑक्सीकरण गुण प्रदर्शित करते हैं:
एच 2 एस + एच 2 ओ 2 = एस + 2 एच 2 ओ,
2 KI + 2 KNO 2 + 2 H 2 SO 4 = I 2 + 2 K 2 SO 4 + H 2 O,
हालाँकि, मजबूत ऑक्सीकरण एजेंटों (जैसे, उदाहरण के लिए, KMnO 4) के साथ बातचीत करते समय, हाइड्रोजन पेरोक्साइड और पोटेशियम नाइट्राइट कम करने वाले एजेंटों के रूप में कार्य करते हैं:
5 एच 2 ओ 2 + 2 केएमएनओ 4 + 3 एच 2 एसओ 4 = 5 ओ 2 + 2 एमएनएसओ 4 + के 2 एसओ 4 + 8 एच 2 ओ,
5 KNO 2 + 2 KMnO 4 + 3 H 2 SO 4 = 5 KNO 3 + 2 MnSO 4 + K 2 SO 4 + 3 H 2 O.
यह ध्यान दिया जाना चाहिए कि हाइड्रोजन पेरोक्साइड, पर्यावरण पर निर्भर करता है, योजना के अनुसार कम हो जाता है, चित्र। 7.2.

चावल। 7.2. संभावित हाइड्रोजन पेरोक्साइड कटौती उत्पाद
इस मामले में, प्रतिक्रियाओं के परिणामस्वरूप, पानी या हाइड्रॉक्साइड आयन बनते हैं:
2 FeSO 4 + H 2 O 2 + H 2 SO 4 = Fe 2 (SO 4) 3 + 2 H 2 O,
2 KI + H 2 O 2 = I 2 + 2 KOH।
7.2.5.2. इंट्रामोल्युलर ऑक्सीकरण-कमी प्रतिक्रियाएं
इंट्रामोल्युलर रेडॉक्स प्रतिक्रियाएं आमतौर पर तब होती हैं जब उन पदार्थों को गर्म किया जाता है जिनके अणुओं में एक कम करने वाला एजेंट और एक ऑक्सीकरण एजेंट होता है। इंट्रामोल्युलर कमी-ऑक्सीकरण प्रतिक्रियाओं के उदाहरण नाइट्रेट और पोटेशियम परमैंगनेट के थर्मल अपघटन की प्रक्रियाएं हैं:
2 NaNO 3 2 NaNO 2 + O 2,
2 Cu(NO 3) 2 2 CuO + 4 NO 2 + O 2,
एचजी(एनओ 3) 2 एचजी + एनओ 2 + ओ 2,
2 KMnO 4 K 2 MnO 4 + MnO 2 + O 2.
7.2.5.3. अनुपातहीन प्रतिक्रियाएँ
जैसा कि ऊपर बताया गया है, अनुपातहीन प्रतिक्रियाओं में एक ही परमाणु (आयन) ऑक्सीकरण एजेंट और कम करने वाला एजेंट दोनों होता है। आइए क्षार के साथ सल्फर की अन्योन्यक्रिया के उदाहरण का उपयोग करके इस प्रकार की प्रतिक्रिया की रचना करने की प्रक्रिया पर विचार करें।
सल्फर की विशिष्ट ऑक्सीकरण अवस्थाएँ: – 2, 0, +4 और +6. एक कम करने वाले एजेंट के रूप में कार्य करते हुए, मौलिक सल्फर 4 इलेक्ट्रॉन दान करता है:
इसलिए – 4ई = एस 4+।
गंधक – ऑक्सीकरण एजेंट दो इलेक्ट्रॉनों को स्वीकार करता है:
एस ओ + 2ई = एस 2– .
इस प्रकार, सल्फर असंतुलन की प्रतिक्रिया के परिणामस्वरूप, ऐसे यौगिक बनते हैं जिनकी तत्व की ऑक्सीकरण अवस्थाएँ होती हैं – 2 और दाएँ +4:
3 एस + 6 केओएच = 2 के 2 एस + के 2 एसओ 3 + 3 एच 2 ओ।
जब नाइट्रोजन ऑक्साइड (IV) क्षार में अनुपातहीन होता है, तो नाइट्राइट और नाइट्रेट प्राप्त होते हैं - ऐसे यौगिक जिनमें नाइट्रोजन की ऑक्सीकरण अवस्थाएँ क्रमशः +3 और +5 हैं:
2 एन 4+ ओ 2 + 2 केओएच = केएन 3+ ओ 2 + केएन 5+ ओ 3 + एच 2 ओ,
ठंडे क्षार घोल में क्लोरीन के अनुपातहीन होने से हाइपोक्लोराइट बनता है, और गर्म क्षार घोल में क्लोरेट बनता है:
सीएल 0 2 + 2 केओएच = केसीएल - + केसीएल + ओ + एच 2 ओ,
सीएल 0 2 + 6 केओएच 5 केसीएल - + केसीएल 5+ ओ 3 + 3एच 2 ओ।
7.3. इलेक्ट्रोलीज़
रेडॉक्स प्रक्रिया जो विलयनों में होती है या तब पिघलती है जब उनमें प्रत्यक्ष विद्युत धारा प्रवाहित की जाती है, इलेक्ट्रोलिसिस कहलाती है। इस मामले में, आयनों का ऑक्सीकरण सकारात्मक इलेक्ट्रोड (एनोड) पर होता है। ऋणात्मक इलेक्ट्रोड (कैथोड) पर धनायन कम हो जाते हैं।
2 Na 2 CO 3 4 Na + O 2 + 2CO 2।
इलेक्ट्रोलाइट्स के जलीय घोल के इलेक्ट्रोलिसिस के दौरान, विघटित पदार्थ के परिवर्तनों के साथ, हाइड्रोजन आयनों और पानी के हाइड्रॉक्साइड आयनों की भागीदारी के साथ इलेक्ट्रोकेमिकल प्रक्रियाएं हो सकती हैं:
कैथोड (-): 2 Н + + 2е = Н 2,
एनोड (+): 4 OH – – 4e = O 2 + 2 H 2 O.
इस मामले में, कैथोड पर कमी की प्रक्रिया निम्नानुसार होती है:
1. कैथोड पर सक्रिय धातुओं (एएल 3+ तक) के धनायन कम नहीं होते हैं; इसके बजाय हाइड्रोजन कम हो जाता है।
2. हाइड्रोजन के दाईं ओर मानक इलेक्ट्रोड क्षमता (वोल्टेज श्रृंखला में) की श्रृंखला में स्थित धातु धनायन इलेक्ट्रोलिसिस के दौरान कैथोड पर मुक्त धातुओं में कम हो जाते हैं।
3. अल 3+ और एच + के बीच स्थित धातु धनायन हाइड्रोजन धनायन के साथ-साथ कैथोड पर कम हो जाते हैं।
एनोड पर जलीय घोल में होने वाली प्रक्रियाएं उस पदार्थ पर निर्भर करती हैं जिससे एनोड बनाया जाता है। अघुलनशील एनोड हैं ( अक्रिय) और घुलनशील ( सक्रिय). ग्रेफाइट या प्लैटिनम का उपयोग निष्क्रिय एनोड की सामग्री के रूप में किया जाता है। घुलनशील एनोड तांबे, जस्ता और अन्य धातुओं से बने होते हैं।
अक्रिय एनोड के साथ समाधान के इलेक्ट्रोलिसिस के दौरान, निम्नलिखित उत्पाद बन सकते हैं:
1. जब हैलाइड आयनों का ऑक्सीकरण होता है, तो मुक्त हैलोजन निकलते हैं।
2. आयनों SO 2 2–, NO 3 –, PO 4 3– युक्त विलयनों के इलेक्ट्रोलिसिस के दौरान, ऑक्सीजन निकलती है, अर्थात। ये आयन नहीं हैं जो एनोड पर ऑक्सीकृत होते हैं, बल्कि पानी के अणु होते हैं।
उपरोक्त नियमों को ध्यान में रखते हुए, आइए एक उदाहरण के रूप में, निष्क्रिय इलेक्ट्रोड के साथ NaCl, CuSO 4 और KOH के जलीय घोल के इलेक्ट्रोलिसिस पर विचार करें।
1). घोल में सोडियम क्लोराइड आयनों में वियोजित हो जाता है।




1. एक यौगिक प्रतिक्रिया की सही परिभाषा बताएं: ए. एक साधारण पदार्थ से कई पदार्थों के निर्माण की प्रतिक्रिया; बी. एक प्रतिक्रिया जिसमें एक जटिल पदार्थ कई सरल या जटिल पदार्थों से बनता है। B. एक प्रतिक्रिया जिसमें पदार्थ अपने घटकों का आदान-प्रदान करते हैं।

2. प्रतिस्थापन प्रतिक्रिया की सही परिभाषा बताएं: ए. क्षार और एसिड के बीच प्रतिक्रिया; बी. दो सरल पदार्थों की परस्पर क्रिया की प्रतिक्रिया; B. पदार्थों के बीच एक प्रतिक्रिया जिसमें एक साधारण पदार्थ के परमाणु एक जटिल पदार्थ में किसी एक तत्व के परमाणुओं को प्रतिस्थापित कर देते हैं।

3. अपघटन प्रतिक्रिया की सही परिभाषा बताएं: ए. एक प्रतिक्रिया जिसमें एक जटिल पदार्थ से कई सरल या जटिल पदार्थ बनते हैं; बी. एक प्रतिक्रिया जिसमें पदार्थ अपने घटकों का आदान-प्रदान करते हैं; बी. ऑक्सीजन और हाइड्रोजन अणुओं के निर्माण के साथ प्रतिक्रिया।


5. क्षारीय ऑक्साइड के साथ अम्लीय ऑक्साइड की परस्पर क्रिया किस प्रकार की प्रतिक्रिया है: 5. क्षारीय ऑक्साइड के साथ अम्लीय ऑक्साइड की परस्पर क्रिया किस प्रकार की प्रतिक्रिया है: A. विनिमय प्रतिक्रिया; बी. यौगिक प्रतिक्रिया; बी. अपघटन प्रतिक्रिया; डी. प्रतिस्थापन प्रतिक्रिया.


7. वे पदार्थ जिनके सूत्र KNO 3 FeCl 2, Na 2 SO 4 हैं, कहलाते हैं: 7. वे पदार्थ जिनके सूत्र KNO 3 FeCl 2, Na 2 SO 4 हैं, कहलाते हैं: A) लवण; बी) कारण; बी) एसिड; डी) ऑक्साइड। ए) लवण; बी) कारण; बी) एसिड; डी) ऑक्साइड। 8. वे पदार्थ जिनके सूत्र HNO 3, HCl, H 2 SO 4 हैं, कहलाते हैं: 8. वे पदार्थ जिनके सूत्र HNO 3, HCl, H 2 SO 4 हैं, कहलाते हैं: A) लवण; बी) एसिड; बी) कारण; डी) ऑक्साइड। ए) लवण; बी) एसिड; बी) कारण; डी) ऑक्साइड। 9. वे पदार्थ जिनके सूत्र KOH, Fe(OH) 2, NaOH कहलाते हैं: 9. वे पदार्थ जिनके सूत्र KOH, Fe(OH) 2, NaOH कहलाते हैं: A) लवण; बी) एसिड; बी) कारण; डी) ऑक्साइड। 10. वे पदार्थ जिनके सूत्र NO 2, Fe 2 O 3, Na 2 O कहलाते हैं: A) लवण; बी) एसिड; बी) कारण; डी) ऑक्साइड। 10. वे पदार्थ जिनके सूत्र NO 2, Fe 2 O 3, Na 2 O कहलाते हैं: A) लवण; बी) एसिड; बी) कारण; डी) ऑक्साइड। ए) लवण; बी) एसिड; बी) कारण; डी) ऑक्साइड। 11. उन धातुओं को इंगित करें जो क्षार बनाते हैं: 11. उन धातुओं को इंगित करें जो क्षार बनाते हैं: Cu, Fe, Na, K, Zn, Li। Cu, Fe, Na, K, Zn, Li.


"यौगिक प्रतिक्रिया" की अवधारणा "विघटन प्रतिक्रिया" की अवधारणा का विलोम है। कंट्रास्ट की तकनीक का उपयोग करके, "यौगिक प्रतिक्रिया" की अवधारणा को परिभाषित करने का प्रयास करें। सही! आपके पास निम्नलिखित सूत्रीकरण है.
आइए रासायनिक प्रक्रियाओं को रिकॉर्ड करने के एक अन्य रूप का उपयोग करके इस प्रकार की प्रतिक्रिया पर विचार करें जो आपके लिए नया है - संक्रमणों की तथाकथित श्रृंखलाएं, या परिवर्तन। उदाहरण के लिए, सर्किट
फॉस्फोरस के फॉस्फोरस ऑक्साइड (वी) पी 2 ओ 5 में परिवर्तन को दर्शाता है, जो बदले में फॉस्फोरिक एसिड एच 3 पीओ 4 में परिवर्तित हो जाता है।
पदार्थों के परिवर्तन के आरेख में तीरों की संख्या रासायनिक परिवर्तनों की न्यूनतम संख्या - रासायनिक प्रतिक्रियाओं से मेल खाती है। विचाराधीन उदाहरण में, ये दो रासायनिक प्रक्रियाएँ हैं।
पहली प्रक्रिया. फॉस्फोरस से फॉस्फोरस ऑक्साइड (V) P 2 O 5 प्राप्त करना। जाहिर है, यह फॉस्फोरस और ऑक्सीजन के बीच एक प्रतिक्रिया है।
आइए एक जलते हुए चम्मच में थोड़ा सा लाल फास्फोरस डालें और आग लगा दें। फॉस्फोरस एक चमकदार लौ के साथ जलता है जिससे सफेद धुआं निकलता है जिसमें फॉस्फोरस (वी) ऑक्साइड के छोटे कण होते हैं:
4पी + 5ओ 2 = 2पी 2 ओ 5.
दूसरी प्रक्रिया. आइए फ्लास्क में एक चम्मच जलता हुआ फॉस्फोरस डालें। यह फॉस्फोरस (V) ऑक्साइड के गाढ़े धुएँ से भरा होता है। चम्मच को फ्लास्क से बाहर निकालें, फ्लास्क में पानी डालें और फ्लास्क की गर्दन को स्टॉपर से बंद करने के बाद सामग्री को हिलाएं। धुआं धीरे-धीरे पतला होता है, पानी में घुल जाता है और अंत में पूरी तरह से गायब हो जाता है। यदि आप फ्लास्क में प्राप्त घोल में थोड़ा सा लिटमस मिलाते हैं, तो यह लाल हो जाएगा, जो फॉस्फोरिक एसिड के बनने का प्रमाण है:
आर 2 ओ 5 + जेडएन 2 ओ = 2 एच 3 पीओ 4।
विचाराधीन परिवर्तनों को पूरा करने के लिए जो प्रतिक्रियाएँ की जाती हैं वे उत्प्रेरक की भागीदारी के बिना होती हैं, यही कारण है कि उन्हें गैर-उत्प्रेरक कहा जाता है। ऊपर चर्चा की गई प्रतिक्रियाएँ केवल एक ही दिशा में आगे बढ़ती हैं, अर्थात वे अपरिवर्तनीय हैं।
आइए विश्लेषण करें कि ऊपर चर्चा की गई प्रतिक्रियाओं में कितने और कौन से पदार्थ शामिल हुए और उनमें कितने और कौन से पदार्थ बने। पहली प्रतिक्रिया में, दो सरल पदार्थों से एक जटिल पदार्थ का निर्माण हुआ, और दूसरे में, दो जटिल पदार्थों से, जिनमें से प्रत्येक में दो तत्व होते हैं, एक जटिल पदार्थ का निर्माण हुआ, जिसमें तीन तत्व शामिल थे।
किसी जटिल और सरल पदार्थ के संयोजन की प्रतिक्रिया के परिणामस्वरूप एक जटिल पदार्थ भी बन सकता है। उदाहरण के लिए, सल्फर ऑक्साइड (IV) से सल्फ्यूरिक एसिड के उत्पादन में सल्फर ऑक्साइड (VI) प्राप्त होता है:
यह प्रतिक्रिया आगे की दिशा में, यानी प्रतिक्रिया उत्पाद के निर्माण के साथ, और विपरीत दिशा में आगे बढ़ती है, यानी, प्रतिक्रिया उत्पाद का शुरुआती पदार्थों में अपघटन होता है, इसलिए, बराबर चिह्न के बजाय, वे डालते हैं उत्क्रमणीयता संकेत.
इस प्रतिक्रिया में एक उत्प्रेरक शामिल होता है - वैनेडियम (वी) ऑक्साइड वी 2 ओ 5, जो उत्क्रमणीयता चिह्न के ऊपर दर्शाया गया है:
![]()
तीन पदार्थों को मिलाकर भी एक जटिल पदार्थ प्राप्त किया जा सकता है। उदाहरण के लिए, नाइट्रिक एसिड एक प्रतिक्रिया द्वारा निर्मित होता है जिसकी योजना है:
संख्या 2 + एच 2 ओ + ओ 2 → एचएनओ 3।
आइए विचार करें कि इस रासायनिक प्रतिक्रिया की योजना को बराबर करने के लिए गुणांक का चयन कैसे करें।
नाइट्रोजन परमाणुओं की संख्या को बराबर करने की कोई आवश्यकता नहीं है: आरेख के बाएँ और दाएँ दोनों भागों में एक नाइट्रोजन परमाणु है। आइए हाइड्रोजन परमाणुओं की संख्या को बराबर करें - एसिड सूत्र से पहले हम गुणांक 2 लिखते हैं:
संख्या 2 + एच 2 ओ + ओ 2 → 2 एचएनओ 3।
लेकिन इस मामले में नाइट्रोजन परमाणुओं की संख्या की समानता का उल्लंघन किया जाएगा - एक नाइट्रोजन परमाणु बाईं ओर रहता है, और दाईं ओर दो होते हैं। आइए नाइट्रिक ऑक्साइड (IV) के सूत्र से पहले गुणांक 2 लिखें:
2NO 2 + H 2 O + O 2 → 2HNO 3.
आइए ऑक्सीजन परमाणुओं की संख्या गिनें: प्रतिक्रिया आरेख के बाईं ओर सात हैं, और दाईं ओर छह हैं। ऑक्सीजन परमाणुओं (समीकरण के प्रत्येक भाग में छह परमाणु) की संख्या को बराबर करने के लिए, याद रखें कि सरल पदार्थों के सूत्रों से पहले आप आंशिक गुणांक 1/2 लिख सकते हैं:
2NO 2 + H 2 O + 1/2O 2 → 2HNO 3.
आइए गुणांकों को पूर्णांक बनाएं। ऐसा करने के लिए, हम गुणांकों को दोगुना करके समीकरण को फिर से लिखते हैं:
4NO 2 + 2H 2 O + O 2 → 4HNO 3.
यह ध्यान दिया जाना चाहिए कि यौगिक की लगभग सभी प्रतिक्रियाएँ ऊष्माक्षेपी प्रतिक्रियाएँ हैं।
प्रयोगशाला प्रयोग संख्या 15
अल्कोहल लैंप की लौ में तांबे का कैल्सीनेशन
- आपको दिए गए तांबे के तार (प्लेट) की जांच करें और उसके स्वरूप का वर्णन करें। तार को क्रूसिबल चिमटे से पकड़कर अल्कोहल लैंप की लौ के ऊपरी हिस्से में 1 मिनट तक गर्म करें। प्रतिक्रिया स्थितियों का वर्णन करें. उस संकेत का वर्णन करें जो इंगित करता है कि रासायनिक प्रतिक्रिया हुई है। जो प्रतिक्रिया हुई उसके लिए एक समीकरण लिखें। प्रतिक्रिया की आरंभिक सामग्रियों और उत्पादों के नाम बताइए।
बताएं कि क्या प्रयोग की समाप्ति के बाद तांबे के तार (प्लेट) का द्रव्यमान बदल गया। पदार्थों के द्रव्यमान के संरक्षण के नियम के बारे में अपने ज्ञान का उपयोग करके अपने उत्तर की पुष्टि करें।
मुख्य शब्द और वाक्यांश
- संयोजन अभिक्रियाएँ वियोजन अभिक्रियाओं के विलोम हैं।
- उत्प्रेरक (एंजाइमी सहित) और गैर-उत्प्रेरक प्रतिक्रियाएं।
- संक्रमणों या बदलावों की शृंखलाएँ।
- प्रतिवर्ती एवं अपरिवर्तनीय प्रतिक्रियाएँ।
कंप्यूटर के साथ काम करें
- इलेक्ट्रॉनिक एप्लिकेशन का संदर्भ लें. पाठ्य सामग्री का अध्ययन करें और सौंपे गए कार्यों को पूरा करें।
- इंटरनेट पर ऐसे ईमेल पते खोजें जो अतिरिक्त स्रोतों के रूप में काम कर सकें जो पैराग्राफ में कीवर्ड और वाक्यांशों की सामग्री को प्रकट करते हैं। एक नया पाठ तैयार करने में शिक्षक को अपनी सहायता प्रदान करें - अगले पैराग्राफ के मुख्य शब्दों और वाक्यांशों पर एक रिपोर्ट बनाएं।
प्रश्न और कार्य

9.1. रासायनिक प्रतिक्रियाएँ क्या हैं?
आइए याद रखें कि हम प्रकृति में किसी भी रासायनिक घटना को रासायनिक प्रतिक्रिया कहते हैं। रासायनिक प्रतिक्रिया के दौरान, कुछ रासायनिक बंधन टूट जाते हैं और अन्य बनते हैं। प्रतिक्रिया के परिणामस्वरूप, कुछ रासायनिक पदार्थों से अन्य पदार्थ प्राप्त होते हैं (अध्याय 1 देखें)।
§ 2.5 के लिए अपना होमवर्क करते समय, आप रासायनिक परिवर्तनों के पूरे सेट से चार मुख्य प्रकार की प्रतिक्रियाओं के पारंपरिक चयन से परिचित हो गए, और फिर आपने उनके नाम भी प्रस्तावित किए: संयोजन, अपघटन, प्रतिस्थापन और विनिमय की प्रतिक्रियाएं।
यौगिक प्रतिक्रियाओं के उदाहरण:
सी + ओ 2 = सीओ 2; (1)
ना 2 ओ + सीओ 2 = ना 2 सीओ 3; (2)
एनएच 3 + सीओ 2 + एच 2 ओ = एनएच 4 एचसीओ 3। (3)
अपघटन प्रतिक्रियाओं के उदाहरण:
2एजी 2 ओ 4एजी + ओ 2; (4)
CaCO 3 CaO + CO 2; (5)
(एनएच 4) 2 सीआर 2 ओ 7 एन 2 + सीआर 2 ओ 3 + 4एच 2 ओ। (6)
प्रतिस्थापन प्रतिक्रियाओं के उदाहरण:
CuSO 4 + Fe = FeSO 4 + Cu; (7)
2NaI + सीएल 2 = 2NaCl + I 2; (8)
CaCO 3 + SiO 2 = CaSiO 3 + CO 2. (9)
| प्रतिक्रियाओं का आदान-प्रदान करें- रासायनिक अभिक्रियाएँ जिनमें आरंभिक पदार्थ अपने घटक भागों का आदान-प्रदान करते प्रतीत होते हैं। |
विनिमय प्रतिक्रियाओं के उदाहरण:
बा(ओएच) 2 + एच 2 एसओ 4 = बीएएसओ 4 + 2एच 2 ओ; (10)
एचसीएल + केएनओ 2 = केसीएल + एचएनओ 2; (ग्यारह)
AgNO 3 + NaCl = AgCl + NaNO 3. (12)
रासायनिक प्रतिक्रियाओं का पारंपरिक वर्गीकरण उनकी सभी विविधता को कवर नहीं करता है - चार मुख्य प्रकार की प्रतिक्रियाओं के अलावा, कई और जटिल प्रतिक्रियाएं भी हैं।
दो अन्य प्रकार की रासायनिक प्रतिक्रियाओं की पहचान उनमें दो महत्वपूर्ण गैर-रासायनिक कणों: इलेक्ट्रॉन और प्रोटॉन की भागीदारी पर आधारित है।
कुछ प्रतिक्रियाओं के दौरान, एक परमाणु से दूसरे परमाणु में इलेक्ट्रॉनों का पूर्ण या आंशिक स्थानांतरण होता है। इस मामले में, प्रारंभिक पदार्थ बनाने वाले तत्वों के परमाणुओं की ऑक्सीकरण अवस्थाएँ बदल जाती हैं; दिए गए उदाहरणों में से, ये प्रतिक्रियाएँ 1, 4, 6, 7 और 8 हैं। इन प्रतिक्रियाओं को कहा जाता है रिडॉक्स.
प्रतिक्रियाओं के दूसरे समूह में, एक हाइड्रोजन आयन (H+), यानी एक प्रोटॉन, एक प्रतिक्रियाशील कण से दूसरे में जाता है। ऐसी प्रतिक्रियाएँ कहलाती हैं अम्ल-क्षार प्रतिक्रियाएंया प्रोटॉन स्थानांतरण प्रतिक्रियाएँ.
दिए गए उदाहरणों में, ऐसी प्रतिक्रियाएँ प्रतिक्रियाएँ 3, 10 और 11 हैं। इन प्रतिक्रियाओं के अनुरूप, रेडॉक्स प्रतिक्रियाओं को कभी-कभी कहा जाता है इलेक्ट्रॉन स्थानांतरण प्रतिक्रियाएँ. आप § 2 में ओवीआर से और निम्नलिखित अध्यायों में केओआर से परिचित होंगे।
यौगिक अभिक्रियाएँ, अपघटन अभिक्रियाएँ, प्रतिस्थापन अभिक्रियाएँ, विनिमय अभिक्रियाएँ, रेडॉक्स अभिक्रियाएँ, अम्ल-क्षार अभिक्रियाएँ।
निम्नलिखित योजनाओं के अनुरूप प्रतिक्रिया समीकरण लिखें:
ए) एचजीओ एचजी + ओ 2 ( टी); बी) ली 2 ओ + एसओ 2 ली 2 एसओ 3; सी) Cu(OH) 2 CuO + H 2 O ( टी);
डी) अल + आई 2 अली 3; ई) CuCl 2 + Fe FeCl 2 + Cu; ई) एमजी + एच 3 पीओ 4 एमजी 3 (पीओ 4) 2 + एच 2 ;
जी) अल + ओ 2 अल 2 ओ 3 ( टी); i) KClO 3 + P P 2 O 5 + KCl ( टी); जे) CuSO 4 + Al Al 2 (SO 4) 3 + Cu;
एल) Fe + सीएल 2 FeCl 3 ( टी); एम) एनएच 3 + ओ 2 एन 2 + एच 2 ओ ( टी); एम) एच 2 एसओ 4 + क्यूओओ क्यूएसओ 4 + एच 2 ओ।
प्रतिक्रिया के पारंपरिक प्रकार को इंगित करें। रेडॉक्स और एसिड-बेस प्रतिक्रियाओं को लेबल करें। रेडॉक्स प्रतिक्रियाओं में, इंगित करें कि तत्वों के कौन से परमाणु अपनी ऑक्सीकरण अवस्था बदलते हैं।
9.2. रेडॉक्स प्रतिक्रियाएं
आइए लौह अयस्क से लोहे (अधिक सटीक रूप से, कच्चा लोहा) के औद्योगिक उत्पादन के दौरान ब्लास्ट फर्नेस में होने वाली रेडॉक्स प्रतिक्रिया पर विचार करें:
Fe 2 O 3 + 3CO = 2Fe + 3CO 2.
आइए हम उन परमाणुओं की ऑक्सीकरण अवस्थाएँ निर्धारित करें जो प्रारंभिक पदार्थ और प्रतिक्रिया उत्पाद दोनों बनाते हैं
| Fe2O3 | + | = | 2Fe | + |
जैसा कि आप देख सकते हैं, प्रतिक्रिया के परिणामस्वरूप कार्बन परमाणुओं की ऑक्सीकरण अवस्था बढ़ गई, लोहे के परमाणुओं की ऑक्सीकरण अवस्था कम हो गई, और ऑक्सीजन परमाणुओं की ऑक्सीकरण अवस्था अपरिवर्तित रही। नतीजतन, इस प्रतिक्रिया में कार्बन परमाणुओं का ऑक्सीकरण हुआ, यानी, उन्होंने इलेक्ट्रॉन खो दिए ( ऑक्सीकरण), और लोहे के परमाणु - कमी, यानी, उन्होंने इलेक्ट्रॉनों को जोड़ा ( बरामद) (§ 7.16 देखें)। ओवीआर को चिह्नित करने के लिए अवधारणाओं का उपयोग किया जाता है आक्सीकारकऔर संदर्भ पुस्तकें.

इस प्रकार, हमारी प्रतिक्रिया में ऑक्सीकरण करने वाले परमाणु लोहे के परमाणु हैं, और कम करने वाले परमाणु कार्बन परमाणु हैं।
हमारी प्रतिक्रिया में, ऑक्सीकरण एजेंट आयरन (III) ऑक्साइड है, और कम करने वाला एजेंट कार्बन (II) मोनोऑक्साइड है।
ऐसे मामलों में जहां ऑक्सीकरण करने वाले परमाणु और कम करने वाले परमाणु एक ही पदार्थ का हिस्सा हैं (उदाहरण: पिछले पैराग्राफ से प्रतिक्रिया 6), "ऑक्सीकरण करने वाले पदार्थ" और "घटाने वाले पदार्थ" की अवधारणाओं का उपयोग नहीं किया जाता है।
इस प्रकार, विशिष्ट ऑक्सीकरण एजेंट ऐसे पदार्थ होते हैं जिनमें परमाणु होते हैं जो इलेक्ट्रॉनों को (पूरे या आंशिक रूप से) प्राप्त करते हैं, जिससे उनकी ऑक्सीकरण अवस्था कम हो जाती है। सरल पदार्थों में से, ये मुख्य रूप से हैलोजन और ऑक्सीजन हैं, और कुछ हद तक सल्फर और नाइट्रोजन हैं। जटिल पदार्थों से - ऐसे पदार्थ जिनमें उच्च ऑक्सीकरण अवस्था में परमाणु होते हैं जो इन ऑक्सीकरण अवस्थाओं में सरल आयन बनाने के इच्छुक नहीं होते हैं: HNO 3 (N +V), KMnO 4 (Mn +VII), CrO 3 (Cr +VI), KClO 3 (Cl +V), KClO 4 (Cl +VII), आदि।
विशिष्ट कम करने वाले एजेंट ऐसे पदार्थ होते हैं जिनमें परमाणु होते हैं जो पूरी तरह या आंशिक रूप से इलेक्ट्रॉन दान करते हैं, जिससे उनकी ऑक्सीकरण अवस्था बढ़ जाती है। सरल पदार्थों में हाइड्रोजन, क्षार और क्षारीय पृथ्वी धातु और एल्यूमीनियम शामिल हैं। जटिल पदार्थों में से - एच 2 एस और सल्फाइड (एस-II), एसओ 2 और सल्फाइट्स (एस +IV), आयोडाइड्स (आई-आई), सीओ (सी +II), एनएच 3 (एन-III), आदि।
सामान्य तौर पर, लगभग सभी जटिल और कई सरल पदार्थ ऑक्सीकरण और अपचायक दोनों गुण प्रदर्शित कर सकते हैं। उदाहरण के लिए:
एसओ 2 + सीएल 2 = एस + सीएल 2 ओ 2 (एसओ 2 एक मजबूत कम करने वाला एजेंट है);
एसओ 2 + सी = एस + सीओ 2 (टी) (एसओ 2 एक कमजोर ऑक्सीकरण एजेंट है);
सी + ओ 2 = सीओ 2 (टी) (सी एक कम करने वाला एजेंट है);
C + 2Ca = Ca 2 C (t) (C एक ऑक्सीकरण एजेंट है)।
आइए उस प्रतिक्रिया पर लौटते हैं जिसकी हमने इस खंड की शुरुआत में चर्चा की थी।
| Fe2O3 | + | = | 2Fe | + |
कृपया ध्यान दें कि प्रतिक्रिया के परिणामस्वरूप, ऑक्सीकरण करने वाले परमाणु (Fe + III) कम करने वाले परमाणु (Fe 0) में बदल गए, और कम करने वाले परमाणु (C + II) ऑक्सीकरण करने वाले परमाणु (C + IV) में बदल गए। लेकिन CO2 किसी भी परिस्थिति में बहुत कमजोर ऑक्सीकरण एजेंट है, और लोहा, हालांकि यह एक कम करने वाला एजेंट है, इन परिस्थितियों में CO की तुलना में बहुत कमजोर है। इसलिए, प्रतिक्रिया उत्पाद एक दूसरे के साथ प्रतिक्रिया नहीं करते हैं, और विपरीत प्रतिक्रिया नहीं होती है। दिया गया उदाहरण सामान्य सिद्धांत का एक उदाहरण है जो ओवीआर के प्रवाह की दिशा निर्धारित करता है:
रेडॉक्स प्रतिक्रियाएं कमजोर ऑक्सीकरण एजेंट और कमजोर कम करने वाले एजेंट के गठन की दिशा में आगे बढ़ती हैं।
पदार्थों के रेडॉक्स गुणों की तुलना केवल समान परिस्थितियों में ही की जा सकती है। कुछ मामलों में, यह तुलना मात्रात्मक रूप से की जा सकती है।
इस अध्याय के पहले पैराग्राफ के लिए अपना होमवर्क करते समय, आप आश्वस्त हो गए कि कुछ प्रतिक्रिया समीकरणों (विशेषकर ओआरआर) में गुणांक का चयन करना काफी कठिन है। रेडॉक्स प्रतिक्रियाओं के मामले में इस कार्य को सरल बनाने के लिए, निम्नलिखित दो विधियों का उपयोग किया जाता है:
ए) इलेक्ट्रॉनिक संतुलन विधिऔर
बी) इलेक्ट्रॉन-आयन संतुलन विधि.
अब आप इलेक्ट्रॉन संतुलन विधि सीखेंगे, और इलेक्ट्रॉन-आयन संतुलन विधि का अध्ययन आमतौर पर उच्च शिक्षा संस्थानों में किया जाता है।
ये दोनों विधियाँ इस तथ्य पर आधारित हैं कि रासायनिक प्रतिक्रियाओं में इलेक्ट्रॉन न तो गायब होते हैं और न ही कहीं दिखाई देते हैं, अर्थात परमाणुओं द्वारा ग्रहण किए गए इलेक्ट्रॉनों की संख्या अन्य परमाणुओं द्वारा छोड़े गए इलेक्ट्रॉनों की संख्या के बराबर होती है।
इलेक्ट्रॉन संतुलन विधि में दिए गए और स्वीकृत इलेक्ट्रॉनों की संख्या परमाणुओं की ऑक्सीकरण अवस्था में परिवर्तन से निर्धारित होती है। इस विधि का उपयोग करते समय, प्रारंभिक पदार्थों और प्रतिक्रिया उत्पादों दोनों की संरचना को जानना आवश्यक है।
आइए उदाहरणों का उपयोग करके इलेक्ट्रॉनिक संतुलन पद्धति के अनुप्रयोग को देखें।
उदाहरण 1।आइए क्लोरीन के साथ लोहे की प्रतिक्रिया के लिए एक समीकरण बनाएं। यह ज्ञात है कि इस प्रतिक्रिया का उत्पाद आयरन (III) क्लोराइड है। आइए प्रतिक्रिया योजना लिखें:
Fe + सीएल 2 FeCl 3।
आइए हम प्रतिक्रिया में भाग लेने वाले पदार्थों को बनाने वाले सभी तत्वों के परमाणुओं की ऑक्सीकरण अवस्थाएँ निर्धारित करें:
लोहे के परमाणु इलेक्ट्रॉन दान करते हैं और क्लोरीन के अणु उन्हें स्वीकार करते हैं। आइए हम इन प्रक्रियाओं को व्यक्त करें इलेक्ट्रॉनिक समीकरण:
फ़े - 3 इ– = Fe +III,
सीएल2+2 इ -= 2Cl-I.
दिए गए इलेक्ट्रॉनों की संख्या प्राप्त इलेक्ट्रॉनों की संख्या के बराबर होने के लिए, पहले इलेक्ट्रॉनिक समीकरण को दो से गुणा किया जाना चाहिए, और दूसरे को तीन से गुणा किया जाना चाहिए:
| फ़े - 3 इ– = Fe +III, सीएल2+2 इ– = 2Cl –I |
2Fe - 6 इ– = 2Fe +III, 3सीएल 2 + 6 इ– = 6Cl –I. |
प्रतिक्रिया योजना में गुणांक 2 और 3 को शामिल करके, हम प्रतिक्रिया समीकरण प्राप्त करते हैं:
2Fe + 3Cl 2 = 2FeCl 3.
उदाहरण 2.आइए अतिरिक्त क्लोरीन में सफेद फास्फोरस की दहन प्रतिक्रिया के लिए एक समीकरण बनाएं। यह ज्ञात है कि फॉस्फोरस (V) क्लोराइड इन परिस्थितियों में बनता है:
| +वी-आई | ||||
| पी 4 | + | सीएल2 | पीसीएल 5. |
सफेद फॉस्फोरस अणु इलेक्ट्रॉन छोड़ते हैं (ऑक्सीकरण करते हैं), और क्लोरीन अणु उन्हें स्वीकार करते हैं (कम करते हैं):
| पी 4-20 इ– = 4P +V सीएल2+2 इ– = 2Cl –I |
1 10 |
2 20 |
पी 4-20 इ– = 4P +V सीएल2+2 इ– = 2Cl –I |
पी 4-20 इ– = 4P +V 10सीएल 2 + 20 इ– = 20Cl –I |
प्रारंभ में प्राप्त कारकों (2 और 20) में एक सामान्य भाजक था, जिसके द्वारा (प्रतिक्रिया समीकरण में भविष्य के गुणांक की तरह) उन्हें विभाजित किया गया था। प्रतिक्रिया समीकरण:
P4 + 10Cl2 = 4PCl5.
उदाहरण 3.आइए उस प्रतिक्रिया के लिए एक समीकरण बनाएं जो तब होती है जब आयरन (II) सल्फाइड को ऑक्सीजन में भूना जाता है।
प्रतिक्रिया योजना:
| +III-II | +IV-II | |||||
| + | O2 | + |
इस मामले में, लौह (II) और सल्फर (-II) परमाणु दोनों ऑक्सीकरण होते हैं। आयरन (II) सल्फाइड की संरचना में इन तत्वों के परमाणु 1:1 के अनुपात में होते हैं (सरलतम सूत्र में सूचकांक देखें)।
इलेक्ट्रॉनिक संतुलन:
| 4 | Fe+II – इ– = Fe +III एस-द्वितीय-6 इ– = एस + IV |
कुल मिलाकर वे 7 देते हैं इ – |
| 7 | O 2 + 4e – = 2O –II |
प्रतिक्रिया समीकरण: 4FeS + 7O 2 = 2Fe 2 O 3 + 4SO 2।
उदाहरण 4. आइए उस प्रतिक्रिया के लिए एक समीकरण बनाएं जो तब होती है जब आयरन (II) डाइसल्फ़ाइड (पाइराइट) को ऑक्सीजन में भूना जाता है।
प्रतिक्रिया योजना:
| +III-II | +IV-II | |||||
| + | O2 | + |
पिछले उदाहरण की तरह, यहां भी लौह (II) परमाणु और सल्फर परमाणु दोनों का ऑक्सीकरण होता है, लेकिन ऑक्सीकरण अवस्था I के साथ। इन तत्वों के परमाणुओं को 1:2 के अनुपात में पाइराइट की संरचना में शामिल किया जाता है (देखें) सरलतम सूत्र में सूचकांक)। यह इस संबंध में है कि लौह और सल्फर परमाणु प्रतिक्रिया करते हैं, जिसे इलेक्ट्रॉनिक संतुलन संकलित करते समय ध्यान में रखा जाता है:
| Fe+III - इ– = Fe +III 2एस-आई-10 इ– = 2S +IV |
कुल मिलाकर वे 11 देते हैं इ – | |
| O2+4 इ– = 2O –II |
प्रतिक्रिया समीकरण: 4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2।
ODD के और भी जटिल मामले हैं, जिनमें से कुछ से आप अपना होमवर्क करते समय परिचित हो जाएंगे।
परमाणु का ऑक्सीकरण करना, परमाणु का अपचयन करना, परमाणु का ऑक्सीकरण करना, पदार्थ का अपचयन करना, इलेक्ट्रॉनिक संतुलन विधि, इलेक्ट्रॉनिक समीकरण।
1. इस अध्याय के पाठ § 1 में दिए गए प्रत्येक ओवीआर समीकरण के लिए एक इलेक्ट्रॉनिक संतुलन संकलित करें।
2. इस अध्याय के § 1 के कार्य को पूरा करते समय आपके द्वारा खोजे गए ओआरआर के लिए समीकरण बनाएं। इस बार, ऑड्स सेट करने के लिए इलेक्ट्रॉनिक बैलेंस पद्धति का उपयोग करें। 3.इलेक्ट्रॉन संतुलन विधि का उपयोग करके, निम्नलिखित योजनाओं के अनुरूप प्रतिक्रिया समीकरण बनाएं: ए) Na + I 2 NaI;
बी) ना + ओ 2 ना 2 ओ 2;
ग) ना 2 ओ 2 + ना ना 2 ओ;
घ) अल + ब्र 2 अलब्र 3;
ई) Fe + O 2 Fe 3 O 4 ( टी);
ई) Fe 3 O 4 + H 2 FeO + H 2 O ( टी);
जी) FeO + O 2 Fe 2 O 3 ( टी);
i) Fe 2 O 3 + CO Fe + CO 2 ( टी);
जे) सीआर + ओ 2 सीआर 2 ओ 3 ( टी);
एल) सीआरओ 3 + एनएच 3 सीआर 2 ओ 3 + एच 2 ओ + एन 2 ( टी);
एम) एमएन 2 ओ 7 + एनएच 3 एमएनओ 2 + एन 2 + एच 2 ओ;
एम) एमएनओ 2 + एच 2 एमएन + एच 2 ओ ( टी);
एन) एमएनएस + ओ 2 एमएनओ 2 + एसओ 2 ( टी)
पी) पीबीओ 2 + सीओ पीबी + सीओ 2 ( टी);
ग) Cu 2 O + Cu 2 S Cu + SO 2 ( टी);
टी) CuS + O 2 Cu 2 O + SO 2 ( टी);
वाई) पीबी 3 ओ 4 + एच 2 पीबी + एच 2 ओ ( टी).
9.3. ऊष्माक्षेपी प्रतिक्रियाएँ। तापीय धारिता
रासायनिक अभिक्रियाएँ क्यों होती हैं?
इस प्रश्न का उत्तर देने के लिए, आइए याद रखें कि अलग-अलग परमाणु अणुओं में क्यों जुड़ते हैं, पृथक आयनों से एक आयनिक क्रिस्टल क्यों बनता है, और जब परमाणु का इलेक्ट्रॉन आवरण बनता है तो कम से कम ऊर्जा का सिद्धांत क्यों लागू होता है। इन सभी प्रश्नों का उत्तर एक ही है: क्योंकि यह ऊर्जावान रूप से लाभकारी है। इसका मतलब यह है कि ऐसी प्रक्रियाओं के दौरान ऊर्जा निकलती है। ऐसा प्रतीत होता है कि रासायनिक प्रतिक्रियाएँ उसी कारण से होनी चाहिए। दरअसल, कई प्रतिक्रियाएं की जा सकती हैं, जिसके दौरान ऊर्जा निकलती है। ऊर्जा उत्सर्जित होती है, आमतौर पर ऊष्मा के रूप में।
यदि एक ऊष्माक्षेपी प्रतिक्रिया के दौरान गर्मी को दूर होने का समय नहीं मिलता है, तो प्रतिक्रिया प्रणाली गर्म हो जाती है।
उदाहरण के लिए, मीथेन दहन प्रतिक्रिया में
सीएच 4 (जी) + 2ओ 2 (जी) = सीओ 2 (जी) + 2एच 2 ओ (जी)
इतनी अधिक ऊष्मा निकलती है कि मीथेन का उपयोग ईंधन के रूप में किया जाता है।
तथ्य यह है कि इस प्रतिक्रिया से गर्मी निकलती है, इसे प्रतिक्रिया समीकरण में दर्शाया जा सकता है:
सीएच 4 (जी) + 2ओ 2 (जी) = सीओ 2 (जी) + 2एच 2 ओ (जी) + क्यू।
यह तथाकथित है थर्मोकेमिकल समीकरण. यहाँ प्रतीक है "+ क्यू" इसका मतलब है कि जब मीथेन को जलाया जाता है, तो गर्मी निकलती है। इस गर्मी को कहा जाता है प्रतिक्रिया का थर्मल प्रभाव.
उत्सर्जित ऊष्मा कहाँ से आती है?
आप जानते हैं कि रासायनिक प्रतिक्रियाओं के दौरान रासायनिक बंधन टूटते हैं और बनते हैं। इस मामले में, सीएच 4 अणुओं में कार्बन और हाइड्रोजन परमाणुओं के साथ-साथ ओ 2 अणुओं में ऑक्सीजन परमाणुओं के बीच के बंधन टूट जाते हैं। इस मामले में, नए बंधन बनते हैं: सीओ 2 अणुओं में कार्बन और ऑक्सीजन परमाणुओं के बीच और एच 2 ओ अणुओं में ऑक्सीजन और हाइड्रोजन परमाणुओं के बीच। बंधनों को तोड़ने के लिए, आपको ऊर्जा खर्च करने की आवश्यकता है ("बंध ऊर्जा", "परमाणु ऊर्जा" देखें) ), और बंधन बनाते समय ऊर्जा निकलती है। जाहिर है, यदि "नए" बंधन "पुराने" बंधनों की तुलना में अधिक मजबूत हैं, तो अवशोषित होने की तुलना में अधिक ऊर्जा जारी होगी। जारी और अवशोषित ऊर्जा के बीच का अंतर प्रतिक्रिया का थर्मल प्रभाव है।
ऊष्मीय प्रभाव (ऊष्मा की मात्रा) को किलोजूल में मापा जाता है, उदाहरण के लिए:
2H 2 (g) + O 2 (g) = 2H 2 O (g) + 484 kJ।
इस संकेतन का अर्थ है कि यदि दो मोल हाइड्रोजन एक मोल ऑक्सीजन के साथ प्रतिक्रिया करके दो मोल गैसीय पानी (जलवाष्प) उत्पन्न करता है तो 484 किलोजूल ऊष्मा निकलेगी।
इस प्रकार, थर्मोकेमिकल समीकरणों में, गुणांक संख्यात्मक रूप से अभिकारकों और प्रतिक्रिया उत्पादों के पदार्थ की मात्रा के बराबर होते हैं.
प्रत्येक विशिष्ट प्रतिक्रिया का थर्मल प्रभाव क्या निर्धारित करता है?
प्रतिक्रिया का तापीय प्रभाव निर्भर करता है
ए) प्रारंभिक पदार्थों और प्रतिक्रिया उत्पादों की एकत्रीकरण अवस्था पर,
बी) तापमान पर और
ग) इस बात पर कि क्या रासायनिक परिवर्तन स्थिर आयतन पर होता है या स्थिर दबाव पर।
पदार्थों के एकत्रीकरण की स्थिति पर प्रतिक्रिया के थर्मल प्रभाव की निर्भरता इस तथ्य के कारण होती है कि एकत्रीकरण की एक स्थिति से दूसरे में संक्रमण की प्रक्रियाएं (कुछ अन्य भौतिक प्रक्रियाओं की तरह) गर्मी की रिहाई या अवशोषण के साथ होती हैं। इसे थर्मोकेमिकल समीकरण द्वारा भी व्यक्त किया जा सकता है। उदाहरण - जलवाष्प के संघनन के लिए थर्मोकेमिकल समीकरण:
एच 2 ओ (जी) = एच 2 ओ (एल) + क्यू।
थर्मोकेमिकल समीकरणों में, और, यदि आवश्यक हो, सामान्य रासायनिक समीकरणों में, पदार्थों की समग्र अवस्थाओं को अक्षर सूचकांकों का उपयोग करके दर्शाया जाता है:
(डी) - गैस,
(जी) - तरल,
(टी) या (सीआर) - ठोस या क्रिस्टलीय पदार्थ।
तापमान पर तापीय प्रभाव की निर्भरता ऊष्मा क्षमताओं में अंतर से जुड़ी होती है
प्रारंभिक सामग्री और प्रतिक्रिया उत्पाद।
चूँकि स्थिर दबाव पर एक ऊष्माक्षेपी प्रतिक्रिया के परिणामस्वरूप सिस्टम का आयतन हमेशा बढ़ता है, ऊर्जा का कुछ हिस्सा आयतन बढ़ाने के लिए काम करने पर खर्च होता है, और यदि समान प्रतिक्रिया स्थिर आयतन पर होती है तो निकलने वाली गर्मी कम होगी। .
प्रतिक्रियाओं के थर्मल प्रभावों की गणना आमतौर पर 25 डिग्री सेल्सियस पर स्थिर मात्रा में होने वाली प्रतिक्रियाओं के लिए की जाती है और प्रतीक द्वारा इंगित की जाती है क्यूओ
यदि ऊर्जा केवल ऊष्मा के रूप में जारी की जाती है, और एक रासायनिक प्रतिक्रिया स्थिर मात्रा में आगे बढ़ती है, तो प्रतिक्रिया का थर्मल प्रभाव ( क्यू वी) परिवर्तन के बराबर है आंतरिक ऊर्जा(डी यू) प्रतिक्रिया में भाग लेने वाले पदार्थ, लेकिन विपरीत संकेत के साथ:
क्यू वी = - यू.
किसी पिंड की आंतरिक ऊर्जा को अंतर-आणविक अंतःक्रियाओं, रासायनिक बंधनों, सभी इलेक्ट्रॉनों की आयनीकरण ऊर्जा, नाभिक में न्यूक्लियंस की बंधन ऊर्जा और इस शरीर द्वारा "संग्रहीत" अन्य सभी ज्ञात और अज्ञात प्रकार की ऊर्जा की कुल ऊर्जा के रूप में समझा जाता है। "-" चिन्ह इस तथ्य के कारण है कि जब गर्मी निकलती है, तो आंतरिक ऊर्जा कम हो जाती है। वह है
यू= – क्यू वी .
यदि प्रतिक्रिया स्थिर दबाव पर होती है, तो सिस्टम का आयतन बदल सकता है। वॉल्यूम बढ़ाने के लिए काम करने में आंतरिक ऊर्जा का भी हिस्सा लगता है। इस मामले में
यू = -(क्यूपी+ए) = –(क्यूपी+पीवी),
कहाँ क्यू पी- स्थिर दबाव पर होने वाली प्रतिक्रिया का थर्मल प्रभाव। यहाँ से
क्यू पी = - ऊपरवी .
के बराबर एक मान यू+पीवीनाम मिल गया एन्थैल्पी परिवर्तनऔर डी द्वारा निरूपित किया गया एच.
एच=यू+पीवी.
इस तरह
क्यू पी = - एच.
इस प्रकार, जैसे-जैसे गर्मी निकलती है, सिस्टम की एन्थैल्पी कम हो जाती है। इसलिए इस मात्रा का पुराना नाम: "ऊष्मा सामग्री"।
थर्मल प्रभाव के विपरीत, एन्थैल्पी में परिवर्तन एक प्रतिक्रिया की विशेषता है, भले ही यह स्थिर मात्रा या स्थिर दबाव पर हो। एन्थैल्पी परिवर्तन का उपयोग करके लिखे गए थर्मोकेमिकल समीकरण कहलाते हैं थर्मोडायनामिक रूप में थर्मोकेमिकल समीकरण. इस मामले में, मानक परिस्थितियों (25 डिग्री सेल्सियस, 101.3 केपीए) के तहत एन्थैल्पी परिवर्तन का मान दिया गया है, जिसे दर्शाया गया है एच ओ. उदाहरण के लिए:
2एच 2 (जी) + ओ 2 (जी) = 2एच 2 ओ (जी) एच ओ=-484 केजे;
सीएओ (सीआर) + एच 2 ओ (एल) = सीए (ओएच) 2 (सीआर) एच ओ= – 65 केजे.
प्रतिक्रिया में जारी गर्मी की मात्रा की निर्भरता ( क्यू) प्रतिक्रिया के थर्मल प्रभाव से ( क्यूओ) और पदार्थ की मात्रा ( एनबी) प्रतिक्रिया में प्रतिभागियों में से एक (पदार्थ बी - प्रारंभिक पदार्थ या प्रतिक्रिया उत्पाद) समीकरण द्वारा व्यक्त किया गया है:
यहां बी पदार्थ बी की मात्रा है, जो थर्मोकेमिकल समीकरण में पदार्थ बी के सूत्र के सामने गुणांक द्वारा निर्दिष्ट है।
काम
यदि 1694 kJ ऊष्मा उत्सर्जित हुई तो ऑक्सीजन में जलने वाले हाइड्रोजन पदार्थ की मात्रा निर्धारित करें।
समाधान
2H 2 (g) + O 2 (g) = 2H 2 O (g) + 484 kJ। |
|
|
Q = 1694 kJ, 6. क्रिस्टलीय एल्यूमीनियम और गैसीय क्लोरीन के बीच प्रतिक्रिया का थर्मल प्रभाव 1408 kJ है। इस प्रतिक्रिया के लिए थर्मोकेमिकल समीकरण लिखें और इस प्रतिक्रिया का उपयोग करके 2816 kJ गर्मी उत्पन्न करने के लिए आवश्यक एल्यूमीनियम का द्रव्यमान निर्धारित करें। 9.4. एंडोथर्मिक प्रतिक्रियाएं। एन्ट्रापी ऊष्माक्षेपी प्रतिक्रियाओं के अलावा, ऐसी प्रतिक्रियाएँ भी संभव हैं जिनमें ऊष्मा अवशोषित होती है, और यदि इसकी आपूर्ति नहीं की जाती है, तो प्रतिक्रिया प्रणाली ठंडी हो जाती है। ऐसी प्रतिक्रियाएँ कहलाती हैं एन्दोठेर्मिक. ऐसी प्रतिक्रियाओं का ऊष्मीय प्रभाव नकारात्मक होता है। उदाहरण के लिए: इस प्रकार, इन और समान प्रतिक्रियाओं के उत्पादों में बांड के निर्माण के दौरान जारी ऊर्जा प्रारंभिक पदार्थों में बांड को तोड़ने के लिए आवश्यक ऊर्जा से कम है।
आइए दो फ्लास्क लें और उनमें से एक को नाइट्रोजन (रंगहीन गैस) से भरें और दूसरे को नाइट्रोजन डाइऑक्साइड (भूरी गैस) से भरें ताकि फ्लास्क में दबाव और तापमान दोनों समान रहें। यह ज्ञात है कि ये पदार्थ एक दूसरे के साथ रासायनिक रूप से प्रतिक्रिया नहीं करते हैं। आइए फ्लास्क को उनकी गर्दन से कसकर जोड़ें और उन्हें लंबवत स्थापित करें, ताकि भारी नाइट्रोजन डाइऑक्साइड वाला फ्लास्क नीचे रहे (चित्र 9.1)। कुछ समय बाद, हम देखेंगे कि भूरे नाइट्रोजन डाइऑक्साइड धीरे-धीरे ऊपरी फ्लास्क में फैल जाता है, और रंगहीन नाइट्रोजन निचले फ्लास्क में प्रवेश कर जाता है। परिणामस्वरूप, गैसें मिश्रित हो जाती हैं और फ्लास्क की सामग्री का रंग एक समान हो जाता है। इस प्रकार,
एन्ट्रापी के बीच संबंध के समीकरण ( एस) और अन्य मात्राओं का अध्ययन भौतिकी और भौतिक रसायन विज्ञान पाठ्यक्रमों में किया जाता है। एन्ट्रापी इकाई [ एस] = 1 जे/के. जी= एच-टी एस सहज प्रतिक्रिया के लिए शर्त: जी< 0. कम तापमान पर, प्रतिक्रिया होने की संभावना निर्धारित करने वाला कारक मुख्य रूप से ऊर्जा कारक होता है, और उच्च तापमान पर यह एन्ट्रापी कारक होता है। उपरोक्त समीकरण से, विशेष रूप से, यह स्पष्ट है कि अपघटन प्रतिक्रियाएं जो कमरे के तापमान पर नहीं होती हैं (एंट्रॉपी बढ़ जाती है) ऊंचे तापमान पर क्यों होने लगती हैं। एंडोथर्मिक प्रतिक्रिया, एन्ट्रॉपी, ऊर्जा कारक, एन्ट्रॉपी फैक्टर, गिब्स ऊर्जा। 2CuO (सीआर) + सी (ग्रेफाइट) = 2Cu (सीआर) + सीओ 2 (जी) -46 kJ है. थर्मोकेमिकल समीकरण लिखें और गणना करें कि इस प्रतिक्रिया से 1 किलो तांबा उत्पन्न करने के लिए कितनी ऊर्जा की आवश्यकता होगी। सीएसीओ 3 (सीआर) = सीएओ (सीआर) + सीओ 2 (जी) - 179 केजे 24.6 लीटर कार्बन डाइऑक्साइड का निर्माण हुआ। निर्धारित करें कि कितनी ऊष्मा व्यर्थ में बर्बाद हुई। कितने ग्राम कैल्शियम ऑक्साइड बना? |