혈소판 응집 억제란 무엇입니까? 혈관 혈소판 지혈에 영향을 미치는 약물 혈소판 응집은 ca2 차단제에 의해 억제됩니다.
본 발명은 생리학, 약리학 및 의약 화학, 특히 혈소판 응집을 억제하는 개선된 방법에 관한 것입니다. 이 목표는 알려진 벤조-1,2-디티올-3-티온(BDTT) 또는 일반식의 유도체를 황 함유 화합물로 사용하는 황 함유 헤테로고리 화합물을 사용하여 혈소판 응집을 억제하는 기술된 개선된 방법에 의해 달성됩니다. 헤테로고리 화합물
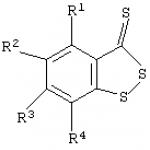
 여기서 R 1 -R 4 = H 또는 C 1-4 -알킬이다. 기술적 결과: 시험관 내에서 혈소판 응집을 보다 효과적으로 억제할 수 있게 합니다. 본 발명은 생리학, 약리학 및 의약 화학에 관한 것이며, 특히 혈소판 응집을 억제하는 개선된 방법에 관한 것입니다. 수많은 연구 결과에 따르면 혈소판 응집 증가는 다음과 같은 역할을 합니다. 많은 심혈관 질환(예: 동맥 혈전증, 심근경색, 불안정 협심증)의 발병에 중요한 역할을 합니다. 내인성 유도제(예: 아데노신-5'-디포스페이트/ADP)에 의해 유발될 수 있는 혈소판 활성화를 방지할 수 있는 화합물은 현재 지혈 시스템의 병리학적 변화에 효과적으로 영향을 주기 위해 널리 사용되고 있습니다(B.A. Sidorenko, D.V. Preobrazhensky, 항혈전제의 임상적 사용. - M., 1998) 황 함유 이환식 화합물을 사용하여 혈소판 응집을 억제하는 다양한 방법이 알려져 있습니다. 혈소판 응집, 화학식 I의 ,5,6,7-테트라히드로티에노피리딘(티클로피딘)
여기서 R 1 -R 4 = H 또는 C 1-4 -알킬이다. 기술적 결과: 시험관 내에서 혈소판 응집을 보다 효과적으로 억제할 수 있게 합니다. 본 발명은 생리학, 약리학 및 의약 화학에 관한 것이며, 특히 혈소판 응집을 억제하는 개선된 방법에 관한 것입니다. 수많은 연구 결과에 따르면 혈소판 응집 증가는 다음과 같은 역할을 합니다. 많은 심혈관 질환(예: 동맥 혈전증, 심근경색, 불안정 협심증)의 발병에 중요한 역할을 합니다. 내인성 유도제(예: 아데노신-5'-디포스페이트/ADP)에 의해 유발될 수 있는 혈소판 활성화를 방지할 수 있는 화합물은 현재 지혈 시스템의 병리학적 변화에 효과적으로 영향을 주기 위해 널리 사용되고 있습니다(B.A. Sidorenko, D.V. Preobrazhensky, 항혈전제의 임상적 사용. - M., 1998) 황 함유 이환식 화합물을 사용하여 혈소판 응집을 억제하는 다양한 방법이 알려져 있습니다. 혈소판 응집, 화학식 I의 ,5,6,7-테트라히드로티에노피리딘(티클로피딘)  혈소판 P 2T ADP 수용체의 길항제입니다(미국 특허 번호 4963559, cl. 514-301, op. 1990). 또한 칼슘 채널 차단제는 D-cis-3-acetoxy-2,3-인 것으로 나타났습니다. 화학식 II의 디히드로-5--2-(2-메톡시페닐)-1,5-벤조티아제핀-4(5H)-온 염산염(딜티아젬)
혈소판 P 2T ADP 수용체의 길항제입니다(미국 특허 번호 4963559, cl. 514-301, op. 1990). 또한 칼슘 채널 차단제는 D-cis-3-acetoxy-2,3-인 것으로 나타났습니다. 화학식 II의 디히드로-5--2-(2-메톡시페닐)-1,5-벤조티아제핀-4(5H)-온 염산염(딜티아젬)  항혈전 효과가 있습니다(A.R.Dehpour, T.Samadian 등. "ADP-유도 토끼 혈소판 모양 변화 및 응집에 대한 딜티아젬 및 베라파밀의 효과" Gen. Pharmacol, 1995, v.26, No. 6, p.1295-1299 ) 위의 화합물은 시험관 내에서 300μM 이상의 농도에서 ADP로 인한 혈소판 응집을 억제했으며 일반식 III의 벤조-1,2-디티올-3-티온(BDTT) 유도체도 알려져 있습니다.
항혈전 효과가 있습니다(A.R.Dehpour, T.Samadian 등. "ADP-유도 토끼 혈소판 모양 변화 및 응집에 대한 딜티아젬 및 베라파밀의 효과" Gen. Pharmacol, 1995, v.26, No. 6, p.1295-1299 ) 위의 화합물은 시험관 내에서 300μM 이상의 농도에서 ADP로 인한 혈소판 응집을 억제했으며 일반식 III의 벤조-1,2-디티올-3-티온(BDTT) 유도체도 알려져 있습니다.  여기서 R 1 R 4 = H 또는 C 1-6 -알킬, 벤조일, (치환된) 아미노술포닐 기 등, 유기 합성 생성물(유럽 특허 번호 0043936, op. 1981). 혈소판 응집은 연구되지 않았습니다. 설명된 것과 가장 가까운 방법은 황 함유 헤테로고리 화합물(치환된 3,4-디하이드로-1,2-디티인-2)을 이러한 세포가 포함된 배지에 도입하여 혈소판 응집을 억제하는 알려진 방법입니다. 특히, 이 방법은 화학식 IV의 3,4-디하이드로-3-비닐-1,2-디티인-2-옥사이드를 사용하여 혈소판 응집을 감소시켰습니다.
여기서 R 1 R 4 = H 또는 C 1-6 -알킬, 벤조일, (치환된) 아미노술포닐 기 등, 유기 합성 생성물(유럽 특허 번호 0043936, op. 1981). 혈소판 응집은 연구되지 않았습니다. 설명된 것과 가장 가까운 방법은 황 함유 헤테로고리 화합물(치환된 3,4-디하이드로-1,2-디티인-2)을 이러한 세포가 포함된 배지에 도입하여 혈소판 응집을 억제하는 알려진 방법입니다. 특히, 이 방법은 화학식 IV의 3,4-디하이드로-3-비닐-1,2-디티인-2-옥사이드를 사용하여 혈소판 응집을 감소시켰습니다.  상대적으로 높은 농도에서(예를 들어 주어진 화합물에 대한 시험관 조건에서 IC 50 = 100 μM) (일본 특허 02204487, C 07 D 339/08, op. 1991, Chem. Abstr., 1991, v. 114, p. 6523s - 프로토타입) 본 발명의 목적은 혈소판 응집을 억제하는 보다 효과적인 방법을 개발하는 것입니다. 이 목표는 이들 세포를 함유하는 배지에 황 함유 헤테로고리 화합물을 도입함으로써 기술된 혈소판 응집을 억제하는 방법에 의해 달성됩니다. R 1 -R 4 가 주어진 값을 갖는 위의 일반식 III의 공지된 BDTT 또는 그 유도체를 특징으로 하는 일반식 III의 화합물은 공지된 방식으로 - 상응하는 비치환 또는 치환된 o-클로로를 반응시킴으로써 얻어졌다. - 또는 알칼리 금속 알콕시드의 존재 하에 글리콜의 모노알킬 에테르 중에서 50-200℃의 온도에서 황과 함께 o-브로모벤질 클로라이드 또는 브로마이드를 설명한다. 실시예 1. 인간 혈소판의 억제. BDTT 및 그 유도체의 영향 하에서의 응집 인간 혈소판 응집에 대한 본 발명의 생성물의 효과를 잘 알려진 Born 탁도법으로 연구하였다. 이를 위해 건강한 기증자로부터 오전 8시에 채취한 정맥혈을 항응고제로 구연산나트륨을 사용하여 플라스틱 용기에 담아 실온에서 450g으로 10분간 원심분리하였다. 상등액, 즉 혈소판 풍부 혈장을 채취하여 650g에서 30분간 원심분리하여 혈소판 결핍 혈장을 얻었다. 혈소판 풍부 혈장의 혈소판 농도를 혈소판 결핍 혈장으로 희석하여 2.510 8 세포/ml로 조정하고, 생성된 현탁액을 0.5 ml 큐벳에 부었습니다. ADP를 20μM의 농도로 첨가하여 응집을 유도하였다. 각 실험에서 ADP 농도는 응집이 가역적이도록 선택되었으며 ADP 첨가 후 2분 후에 최대값이 발생하여 50%를 초과하지 않았습니다. 혈소판 현탁액의 광산란은 모스크바 주립대학교 생물학부에서 개발된 응집계를 사용하여 측정되었습니다. M.V. Lomonosov. 응집 유도제(ADP)를 첨가하기 전에 연구 중인 화합물(필요한 경우 DMSO를 최대 0.2% 함유하는 수용액 형태)을 샘플에 첨가했습니다. 1-100의 농도로. μM은 20μM ADP로 인한 혈소판 응집을 억제했으며 농도에서는 효과적인 작용이 관찰되었습니다<30 мкМ. В частности, значение концентрации, при которой достигалось полумаксимальное ингибирование, (IC 50) для БДТТ составляло 6,4 мкМ. Согласно данным прототипа, для известного аналога (3,4-дигидро-3-винил-1,2-дитиин-2-оксида) в условиях in vitro IC 50 имела значение 100 мкМ.Пример 2. Острая токсичность БДТТ и его производных.Острую токсичность соединений настоящего изобретения определяли известным способом по ЛД 50 с использованием беспородных мышей обоего пола средней массой 21 г при комнатной температуре; стандартное питание и воду давали ad libitum в течение всего эксперимента; подвижность животных не ограничивали. Растворы соединений в ДМСО вводили с помощью стерильного шприца внутрибрюшинно. После инъекции за животными вели наблюдение в течение 48 ч по истечении этого времени за мышами наблюдали дополнительно в течение 72 ч (ни одно из животных не погибло в течение дополнительного промежутка времени). Полученные результаты свидетельствуют о том, что значение ЛД 50 для БДТТ составляет >실시예 1에 제시된 데이터는 기술된 방법이 공지된 방법에 비해 시험관 내에서 혈소판 응집을 더 효과적으로 억제할 수 있음을 보여줍니다.
상대적으로 높은 농도에서(예를 들어 주어진 화합물에 대한 시험관 조건에서 IC 50 = 100 μM) (일본 특허 02204487, C 07 D 339/08, op. 1991, Chem. Abstr., 1991, v. 114, p. 6523s - 프로토타입) 본 발명의 목적은 혈소판 응집을 억제하는 보다 효과적인 방법을 개발하는 것입니다. 이 목표는 이들 세포를 함유하는 배지에 황 함유 헤테로고리 화합물을 도입함으로써 기술된 혈소판 응집을 억제하는 방법에 의해 달성됩니다. R 1 -R 4 가 주어진 값을 갖는 위의 일반식 III의 공지된 BDTT 또는 그 유도체를 특징으로 하는 일반식 III의 화합물은 공지된 방식으로 - 상응하는 비치환 또는 치환된 o-클로로를 반응시킴으로써 얻어졌다. - 또는 알칼리 금속 알콕시드의 존재 하에 글리콜의 모노알킬 에테르 중에서 50-200℃의 온도에서 황과 함께 o-브로모벤질 클로라이드 또는 브로마이드를 설명한다. 실시예 1. 인간 혈소판의 억제. BDTT 및 그 유도체의 영향 하에서의 응집 인간 혈소판 응집에 대한 본 발명의 생성물의 효과를 잘 알려진 Born 탁도법으로 연구하였다. 이를 위해 건강한 기증자로부터 오전 8시에 채취한 정맥혈을 항응고제로 구연산나트륨을 사용하여 플라스틱 용기에 담아 실온에서 450g으로 10분간 원심분리하였다. 상등액, 즉 혈소판 풍부 혈장을 채취하여 650g에서 30분간 원심분리하여 혈소판 결핍 혈장을 얻었다. 혈소판 풍부 혈장의 혈소판 농도를 혈소판 결핍 혈장으로 희석하여 2.510 8 세포/ml로 조정하고, 생성된 현탁액을 0.5 ml 큐벳에 부었습니다. ADP를 20μM의 농도로 첨가하여 응집을 유도하였다. 각 실험에서 ADP 농도는 응집이 가역적이도록 선택되었으며 ADP 첨가 후 2분 후에 최대값이 발생하여 50%를 초과하지 않았습니다. 혈소판 현탁액의 광산란은 모스크바 주립대학교 생물학부에서 개발된 응집계를 사용하여 측정되었습니다. M.V. Lomonosov. 응집 유도제(ADP)를 첨가하기 전에 연구 중인 화합물(필요한 경우 DMSO를 최대 0.2% 함유하는 수용액 형태)을 샘플에 첨가했습니다. 1-100의 농도로. μM은 20μM ADP로 인한 혈소판 응집을 억제했으며 농도에서는 효과적인 작용이 관찰되었습니다<30 мкМ. В частности, значение концентрации, при которой достигалось полумаксимальное ингибирование, (IC 50) для БДТТ составляло 6,4 мкМ. Согласно данным прототипа, для известного аналога (3,4-дигидро-3-винил-1,2-дитиин-2-оксида) в условиях in vitro IC 50 имела значение 100 мкМ.Пример 2. Острая токсичность БДТТ и его производных.Острую токсичность соединений настоящего изобретения определяли известным способом по ЛД 50 с использованием беспородных мышей обоего пола средней массой 21 г при комнатной температуре; стандартное питание и воду давали ad libitum в течение всего эксперимента; подвижность животных не ограничивали. Растворы соединений в ДМСО вводили с помощью стерильного шприца внутрибрюшинно. После инъекции за животными вели наблюдение в течение 48 ч по истечении этого времени за мышами наблюдали дополнительно в течение 72 ч (ни одно из животных не погибло в течение дополнительного промежутка времени). Полученные результаты свидетельствуют о том, что значение ЛД 50 для БДТТ составляет >실시예 1에 제시된 데이터는 기술된 방법이 공지된 방법에 비해 시험관 내에서 혈소판 응집을 더 효과적으로 억제할 수 있음을 보여줍니다.
주장하다
황 함유 복소고리 화합물로서 벤조-1,2-디티올-3-티온 및 일반식의 유도체를 사용하는 것을 특징으로 하는, 이들 세포가 포함된 배지에 황 함유 복소고리 화합물을 도입하여 혈소판 응집을 억제하는 방법  여기서 R 1 -R 4 는 H이거나 C 1-4 는 알킬입니다.
여기서 R 1 -R 4 는 H이거나 C 1-4 는 알킬입니다.
유사한 특허:
본 발명은 유기화학 및 약리학, 즉 강심 활성을 나타내는 1:3 몰비의 2-아세트산 칼륨염의 이성질체 혼합물에 관한 것이다.
지혈 시스템은 신체에서 다음과 같은 주요 기능을 수행합니다.
기관과 조직에 정상적인 혈액 공급에 필요한 액체 상태로 혈관의 혈액을 유지합니다.
혈관벽이 손상된 경우 출혈을 멈추게합니다.
출혈 중지(지혈 - 그리스어에서 유래) 헤모- 피, 정체- 중지)는 여러 메커니즘의 참여로 달성됩니다. 혈관벽이 손상된 후 혈관 경련이 발생합니다. 부상에 대한 이러한 즉각적인 반응은 작은 혈관 부상이 경미한 경우에만 출혈을 멈출 수 있습니다. 기본적으로 출혈을 멈추는 것은 혈전 형성을 통해 이루어지며, 이는 부상 부위를 닫아 혈액 손실을 방지합니다. 혈관 손상 시 이러한 국소적인 혈전(지혈 마개) 형성은 보호 반응입니다.
그러나 특정 조건에서는 혈관 내부에 혈전이 형성되어 혈관 내강을 닫고 정상적인 혈류를 방해합니다. 혈관 내 혈전 형성은 죽상동맥경화증, 혈압 상승 또는 기타 요인과 관련된 손상을 포함하여 혈관 내피의 병리학적 변화로 인해 발생할 수 있습니다. 혈전의 원인은 혈류의 비정상적인 변화(예: 속도 감소) 또는 혈전을 예방하는 특정 단백질의 결핍일 수도 있습니다.
혈전증은 혈소판 응집과 혈액 응고 (혈액 응고)라는 두 가지 주요 과정의 참여로 발생합니다.
혈소판 응집 - 이것은 혈소판이 다양한 크기와 밀도의 대기업(응집체)으로 결합된 것입니다. 이 과정은 혈관벽이 손상되면 시작됩니다. 부상 부위에서 혈소판은 먼저 폰빌레브란트 인자와 내피하층의 콜라겐에 결합합니다(발생 혈소판 접착).콜라겐과의 상호작용은 혈소판 활성화를 일으킨다(그림 27-1). 이 경우 혈소판 자체가 트롬복산 A2, ADP,
세로토닌. 혈액 응고 중에 국소적으로 생성되는 트롬빈도 혈소판 응집을 유도합니다. 또한 카테콜아민, 혈소판 활성화 인자 및 기타 내인성 물질도 응집을 유도합니다.
혈소판 응집은 혈관 내피 세포에서 생성되어 혈류로 방출되는 프로스타사이클린과 내피 이완 인자에 의해 방지됩니다. 내피 세포가 손상되면 이들 물질의 합성이 감소하고 이러한 배경에서 응집을 자극하는 물질의 효과가 지배적입니다. 결과적으로 혈소판은 응집체로 결합되어 혈소판 혈전이 형성됩니다.
이 과정에서 형성된 피브린 실 덕분에 혈소판 혈전이 더 강해집니다. 혈액 응고.이 과정의 주요 참가자는 혈액 응고 인자라고 불리는 혈장 단백질입니다.
혈장 응고 인자는 간에서 합성되어 비활성 형태로 혈액에서 순환합니다. 혈관벽이 손상되면 인자 VII가 참여하여 빠르게 활성화됩니다. 조직 인자- 다양한 세포(활성화된 내피세포 포함)에 의해 합성되며 일반적으로 혈액과 접촉되지 않는 막횡단 단백질. 내피 손상 동안 세포 표면에서 조직 인자의 발현은 Ca 2+ 이온 존재 하에서 인자 VII의 활성화(인자 VIIa로의 전환)를 상당히 가속화합니다. (조직 인자와 결합된) 인자 VIIa의 영향으로 다른 혈액 응고 인자(IX 및 X)의 순차적 활성화가 혈액 응고 단계라고 불리는 복잡한 자가촉매 시스템에서 발생합니다. 결과적으로 인자 Xa의 영향으로 트롬빈이 형성되고(인자 Ha), 이는 혈액 내에서 순환하는 수용성 단백질 피브리노겐(인자 I)을 불용성 피브린으로 전환시킵니다(그림 27-5). 피브린은 중합되어 혈소판 사이의 공간을 채워 혈소판 혈전을 강화합니다. 피브린 실은 혈전을 관통하여 혈액 내에서 순환하는 적혈구를 가두는 네트워크를 형성합니다. 적혈구가 형성됩니다.
혈액 응고는 활성 혈액 응고 인자의 천연 억제제인 물질에 의해 방해됩니다.
인자 VIIa에 의한 인자 X의 활성화가 방지됩니다. 조직 인자 경로 억제제,내피세포에서 합성
세포. 트롬빈 및 기타 활성 응고 인자(Xa, IXa XIa, XIIa)의 억제제는 다음과 같습니다. 항트롬빈 III- 헤파린 또는 헤파린 유사 물질(손상되지 않은 내피 세포 표면에 존재)과 결합하여 작용하는 혈장 내 순환 단백질. 이들 물질은 항트롬빈 III의 영향으로 혈액 응고 인자의 불활성화를 크게 가속화합니다.
트롬빈 형성에 필요한 인자 VIIIa 및 Va의 억제제 - 활성화된 단백질 C.이 단백질은 비타민 K의 참여로 간에서 합성되고 비활성 형태로 혈액에서 순환하며 손상되지 않은 내피 세포 표면의 트롬빈에 의해 활성화됩니다. 과도한 트롬빈 생성으로 인해 단백질 C 활성화가 증가합니다. 혈관벽이 손상된 부위에 국소적인 혈전이 형성될 때, 상기 억제제는 혈액을 액체 상태로 유지하는 데 도움을 주어 혈관 내부의 혈전이 성장하는 것을 방지합니다.
혈소판 응집과 혈액 응고는 서로 연관되어 있습니다. 혈전 형성 메커니즘에서 하나 또는 다른 과정의 우세는 혈관의 구경과 혈류 속도에 따라 달라집니다. 혈소판 응집은 높은 혈류량에서 혈전을 형성하는 데 더 중요합니다. 동맥에서. 혈류 속도가 낮은 정맥 혈관에서는 혈액 응고 과정이 우세합니다.
혈전의 후속 운명은 섬유소용해 시스템의 활성에 따라 달라집니다. 이 시스템이 정상적으로 작동하면 피브린은 활성제의 영향으로 비활성 전구체(플라스미노겐)로부터 형성되는 플라스민 효소의 참여로 점차적으로 용해(섬유소분해)됩니다. 플라스민의 작용은 혈액에 순환하는 항플라스민에 의해 방지됩니다. 플라스미노겐 활성화제는 특정 억제제에 의해 중화됩니다.
혈소판 응집 및 혈액 응고 과정의 방해 및/또는 섬유소 용해 시스템의 활성 증가는 출혈을 초래할 수 있으며, 이러한 과정의 과도한 활성화 또는 섬유소 용해의 억제는 혈관 내 혈전(혈전증)의 발생을 초래할 수 있습니다. 동맥 혈관의 혈전증으로 인해 조직으로의 혈류가 감소하고 허혈이 발생합니다. 허혈의 결과는 세포 사멸(괴사)입니다. 혈전증은 심근경색(관상동맥혈전증), 허혈성 뇌졸중(뇌혈관혈전증) 등 심각한 합병증을 유발할 수 있다. 정맥 혈전증은 폐색전증을 유발할 수 있습니다.
혈전증을 예방하기 위해 혈소판 응집과 혈액 응고를 억제하여 혈전 형성을 방지하는 물질을 사용합니다. 혈전증의 경우 혈전 용해를 유발하는 물질, 즉 혈전 용해제(섬유소 용해제)도 사용됩니다.
출혈을 멈추기 위해 혈액 응고를 증가시키는 약물과 섬유소 용해를 억제하는 약물이 사용됩니다. 하나 또는 다른 것의 선택은 출혈의 원인에 따라 다릅니다.
혈전 형성에 영향을 미치는 다음 약물 그룹은 실질적으로 중요합니다.
혈소판 응집을 감소시키는 물질(항혈소판제).
혈액 응고에 영향을 미치는 약물.
혈액 응고를 감소시키는 약물(항응고제).
혈액 응고를 증가시키는 약물(지혈제).
섬유소분해에 영향을 미치는 물질.
섬유소용해제(혈전용해제).
항섬유소용해제(섬유소용해 억제제).
27.1. 혈소판 응집을 감소시키는 약물(항혈소판제)
혈소판은 골수 거핵구의 조각으로 형성된 작은 디스크 모양의 혈액 요소입니다. 혈소판은 6~12일 동안 혈액 내를 순환한 후 조직 대식세포에 흡수됩니다.
혈관 내피는 혈소판의 기능적 활동에 영향을 미칩니다. 내피 세포는 프로스타사이클린(프로스타글란딘 I 2)과 산화질소(NO)로 식별되는 내피 이완 인자를 혈류로 방출합니다. 이 물질은 혈소판 응집을 방지합니다. 또한, 내피 세포는 혈액 응고를 감소시키고 혈전 용해를 촉진하는 물질을 분비합니다. 이 모든 것이 손상되지 않은 혈관 내피의 항혈전 특성을 보장합니다.
다양한 요인(기계적 외상, 감염, 혈관벽의 죽상동맥경화성 변화, 혈압 상승 등)으로 인해 발생할 수 있는 혈관 내피가 손상되면 내피의 항혈전 특성이 감소하여 형성 조건이 생성됩니다. 혈전의. 프로스타사이클린과 내피 이완 인자의 합성이 중단되어 접촉이 촉진됩니다.
내피 표면이 손상된 혈소판. 혈소판은 손상 부위에 축적되어 혈관 내피하층과 상호작용합니다. 직접적으로 또는 von Willebrand 인자(활성화된 혈소판 및 내피 세포에 의해 분비됨)를 통해 혈소판에 국한된 특정 당단백질의 참여로 콜라겐 및 내피하층의 다른 단백질에 결합합니다. 막. 폰빌레브란트 인자는 당단백질 Ib에 결합하고, 콜라겐은 혈소판막의 당단백질 Ia에 결합한다(그림 27-1 참조). 혈소판에 대한 콜라겐 (혈전 형성의 초기 단계에서 이미 국소적으로 소량으로 형성되는 트롬빈 포함)의 영향은 상태 변화, 즉 활성화를 유발합니다. 혈소판은 모양이 바뀌고(원판 모양에서 여러 과정을 거쳐 퍼져 나가게 됩니다 - 위족증) 혈관의 손상된 표면을 덮습니다.
활성화되면 혈소판은 다양한 생물학적 활성 물질을 방출하며, 활성화되지 않은 혈소판에서는 과립(α-과립, 조밀한 과립)에 위치합니다. 조밀한 과립은 혈소판 응집을 자극하는 물질인 ADP와 세로토닌의 저장소입니다. 혈소판 과립에서 이러한 물질의 방출은 콜라겐, 트롬빈 및 ADP 자체를 포함한 기타 응집 유도제가 혈소판에 작용하여 세포 내 Ca 2+ 농도가 증가한 결과 발생합니다. 혈류로 방출된 ADP는 혈소판막에 위치한 특정(퓨린성) 수용체를 자극합니다. ADP는 G-단백질 결합 수용체(P2Y12 퓨린성 수용체)를 통해 아데닐레이트 시클라제를 억제하고 cAMP 수준을 감소시켜 혈소판 세포질의 Ca 2 수준을 증가시킵니다(그림 27-2).
또한 혈소판이 활성화되면 막 인지질로부터 아라키돈산을 형성하는 데 관여하는 효소인 혈소판 막 포스포리파제 A2의 활성이 증가합니다. 혈소판에서 고리형 엔도과산화물(프로스타글란딘 G2/H2)은 먼저 시클로옥시게나제의 영향으로 아라키돈산으로부터 합성되고, 이로부터 트롬복산신-
Thetase는 혈소판 응집의 활성 자극제이자 혈관 수축 물질인 트롬복산 A2를 생성합니다. 트롬복산 A2는 일단 혈류로 방출되면 혈소판 막의 트롬복산 수용체를 자극합니다. 결과적으로 이들 수용체와 연관된 C를 통해큐 -단백질 포스포리파제 C가 활성화되고
쌀.27-1. 혈관벽 손상 중 혈소판의 접착 및 응집: EC - 내피 세포; VW - von Willebrand 요소; TxA 2 - 트롬복산 A 2; PGI 2 - 프로스타사이클린; NO - 내피 이완 인자; GP - 당단백질; GP llb/llla - 당단백질 llb/llla(출처: Katzung B.G. Bazic and Clinical Pharmacology - NY, 2001, 개정됨)
이노시톨-1,4,5-트리포스페이트는 혈소판의 세포내 저장소에서 Ca 2+의 방출을 촉진합니다(혈소판에서 칼슘 저장소의 역할은 조밀한 세뇨관 시스템에 의해 수행됨). 이는 Ca 2+ 의 세포질 농도를 증가시킵니다 (그림 27-2). Thromboxane A 2는 혈관 평활근 세포에서 Ca 2+ 농도를 증가시켜 혈관 수축을 유발합니다.

쌀. 27-2. 항혈소판제(아세틸살리실산, 티클로피딘 및 에포프로스테놀)의 작용 메커니즘: EC - 내피 세포; PL - 세포막의 인지질; AA - 아르키돈산; PLA 2 - 포스포리파제 A 2; COX - 사이클로옥시게나제; TS - 트롬복산 합성효소; PS - 프로스타사이클린 합성효소; PGG 2 /H 2 - 순환 엔도퍼옥사이드; TxA 2 - 트롬복산 A 2; PGI 2 - 프로스타사이클린; AC - 아데닐레이트 시클라제; PLS - 포스포리파제 C; IP 3 - 이노시톨-1, 4, 5-트리포스페이트
따라서 ADP와 트롬복산 A2는 혈소판 세포질의 Ca2+ 수준을 증가시킵니다. 세포질 Ca 2+는 혈소판 막의 당단백질 IIb/IIIa의 형태를 변화시켜 피브리노겐과 결합하는 능력을 얻습니다. 피브리노겐 한 분자는 당단백질 IIb/IIIa에 대한 두 개의 결합 부위를 가지므로 두 개의 혈소판을 결합할 수 있습니다(그림 27-3). 피브리노겐 가교에 의해 많은 혈소판이 결합하면 혈소판 응집체가 형성됩니다.
프로스타사이클린(프로스타글란딘 I 2)은 혈소판 응집에 반대 효과를 나타냅니다. 트롬복산, 프로스타사이클린과 마찬가지로
순환 엔도퍼옥사이드로 형성되지만 다른 효소인 프로스타사이클린 합성효소의 작용하에 형성됩니다. 프로스타사이클린은 내피 세포에 의해 합성되어 혈류로 방출되어 혈소판막의 프로스타사이클린 수용체와 Gs 단백질을 통해 이와 관련된 아데닐레이트 시클라제를 자극합니다. 그 결과, 혈소판의 cAMP 수준이 증가하고 세포질 Ca 2+ 농도가 감소합니다(그림 27-2 참조). 이는 당단백질 IIb/IIIa의 형태가 변화하는 것을 방지하고 피브리노겐과 결합하는 능력을 상실합니다. 따라서 프로스타사이클린은 혈소판 응집을 방지합니다. 프로스타사이클린의 영향으로 혈관 평활근 세포의 Ca 2+ 농도가 감소하여 혈관 확장이 발생합니다.

혈소판 응집을 일으키는 주요 사건의 순서는 다음과 같이 구분할 수 있습니다(그림 27-1 참조).
현재 임상에서 사용되는 항혈소판제 작용의 주요 초점은 트롬복산 A2 및 ADP 작용의 제거뿐 아니라 혈소판막의 당단백질 IIb/IIIa를 차단하는 것과 관련이 있습니다. 혈소판의 cAMP 농도를 증가시켜 Ca 2+ 농도를 감소시키는 다른 작용 메커니즘을 가진 물질도 사용됩니다.
혈소판 응집을 감소시키는 다음과 같은 약물 그룹이 구별됩니다.
트롬복산 A2의 합성을 억제하는 물질. - 시클로옥시게나제 억제제:
아세틸 살리실산.

계획 27.1. 혈소판 응집의 메커니즘
시클로옥시게나제 및 트롬복산 합성효소 억제제: 인도부펜.
프로스타사이클린 수용체를 자극하는 약물:
에포프로스테놀**.
혈소판에 대한 ADP의 효과를 방해하는 물질:
티클로피딘; 클로피도그렐.
혈소판 포스포디에스테라제를 억제하는 약물:
디피리다몰
혈소판막의 당단백질 IIb/IIIa를 차단하는 물질입니다.
단일클론항체: 앱시시맙.
당단백질 IIb/IIIa의 합성 차단제: 엡티피바타이드; 티로피반.
트롬복산 A2의 합성을 억제하는 제제
아세틸살리실산(아스피린*)은 잘 알려진 항염증제, 진통제, 해열제입니다. 현재 항혈소판제로 널리 사용되고 있다. 아세틸살리실산의 항혈소판 효과는 혈소판에서 트롬복산 A2 합성에 대한 억제 효과와 관련이 있습니다.
아세틸살리실산은 시클로옥시게나제를 비가역적으로 억제하여(효소의 돌이킬 수 없는 아세틸화 유발) 순환 엔도과산화물, 트롬복산 A2의 전구체 및 아라키돈산의 프로스타글란딘의 형성을 방해합니다. 따라서 아세틸살리실산의 영향으로 혈소판에서 트롬복산 A2의 합성뿐만 아니라 혈관내피세포에서 프로스타사이클린의 합성도 감소한다(그림 27-2 참조). 그러나 적절한 용량과 요법을 선택함으로써 트롬복산 A 2 의 합성에 대한 아세틸살리실산의 우선적인 효과를 달성하는 것이 가능합니다. 이는 혈소판과 내피 세포 사이의 상당한 차이 때문입니다.
혈소판(핵이 없는 세포)에는 단백질 재합성 시스템이 없으므로 사이클로옥시게나제를 합성할 수 없습니다. 따라서 이 효소의 비가역적인 억제로 인해 트롬복산 A2 합성의 중단은 혈소판의 수명 전반에 걸쳐 지속됩니다. 7-10일 이내. 새로운 혈소판의 생성으로 인해 아세틸살리실산의 항혈소판 효과는 더 짧은 시간 동안 지속되므로, 약물의 안정적인 효과(즉, 트롬복산 수치의 안정적인 감소)를 얻기 위해서는 처방을 권장합니다. 하루에 한 번.
시클로옥시게나아제는 혈관 내피 세포에서 재합성되며, 이 효소의 활성은 아세틸살리실산을 복용한 후 몇 시간 이내에 회복됩니다. 따라서 1일 1회 약을 처방할 경우 프로스타사이클린 합성의 유의한 감소는 없습니다.

또한, 아세틸살리실산의 약 30%는 간에서 1차 통과 대사를 거치므로 전신 순환계에서의 농도는 문맥 혈액에서의 농도보다 낮습니다. 결과적으로 아세틸살리실산은 전신 혈관의 내피 세포보다 문맥 혈류를 순환하는 혈소판에 더 높은 농도로 작용합니다. 따라서 혈소판에서 트롬복산 A2의 합성을 억제하려면 내피 세포에서 프로스타사이클린의 합성을 억제하는 것보다 더 적은 양의 아세틸살리실산이 필요합니다.
이러한 이유로 아세틸살리실산의 용량과 투여 빈도가 증가함에 따라 프로스타사이클린 합성에 대한 억제 효과가 더욱 두드러져 항혈소판 효과가 감소할 수 있습니다. 이러한 특징과 관련하여 항혈소판제인 아세틸살리실산은 하루에 한 번 소량(평균 100mg)으로 처방하는 것이 좋습니다.
아세틸살리실산은 항혈소판제로서 불안정 협심증, 심근경색, 허혈성 뇌졸중, 말초혈관혈전증 예방, 관상동맥우회술 및 관상동맥성형술 시 혈전 형성을 방지하기 위해 사용됩니다. 아세틸살리실산은 장기간 1일 1회 75-160mg(특정 적응증의 경우 50~325mg 범위)의 용량으로 경구 처방됩니다. 현재 의사들은 Acecardol *, Aspicor *, Cardiopyrin *, Aspirin Cardio *, Novandol *, Thrombo ACC * 등 아세틸살리실산의 항혈소판 효과는 빠르게(20~30분 이내) 나타납니다. 장용 코팅 제형은 더 천천히 작용하기 시작하지만 장기간 사용하면 그 효과는 기존 정제의 효과와 실질적으로 다르지 않습니다. 더 빠른 효과를 얻으려면 아세틸살리실산 정제를 씹어 먹어야 합니다.
아세틸살리실산의 주요 부작용은 cyclooxygenase의 억제와 관련이 있습니다. 이것은 항 분비 및 위장 보호 효과가있는 프로스타글란딘 E 2 및 I 2의 형성을 방해합니다 (위 벽 세포에 의한 염산 분비 감소, 점액 및 중탄산염 분비 증가). 결과적으로 단기간 사용하더라도 아세틸살리실산은 위와 십이지장 상피에 손상을 줄 수 있습니다(궤양 유발 효과). 장용 코팅 제형을 사용할 때 위 점막에 대한 효과는 덜 뚜렷합니다. 아세틸살리실산을 사용하면 위장 출혈 및 기타 출혈 합병증이 발생할 수 있습니다. 이러한 합병증의 위험은 아세틸살리실산을 1일 100mg 이하의 용량으로 처방할 때 더 낮습니다. COX의 선택적 억제는 아라키돈산의 전환과 기관지 수축 특성을 갖는 류코트리엔의 형성을 위한 리폭시게나제 경로의 활성화를 유도합니다. 기관지 천식 환자의 경우 아세틸살리실산이 발작(“아스피린 천식”)의 시작을 유발할 수 있습니다. 알레르기 반응이 가능합니다.
아세틸살리실산의 궤양 유발 효과를 줄이기 위해 수산화마그네슘을 함유한 복합제인 Cardiomagnyl*이 제안되었습니다. 수산화마그네슘은 위장의 염산을 중화시켜(제산 효과) 점막에 대한 손상 효과를 줄입니다. 이 약물은 허혈성 뇌졸중의 2차 예방을 포함하여 아세틸살리실산과 동일한 적응증에 사용됩니다.
인도부펜(ibustrin *)은 트롬복산 A2의 합성을 감소시키는 동시에 시클로옥시게나제 및 트롬복산 합성효소를 억제합니다. 아세틸살리실산과 달리 인도부펜은 사이클로옥시게나제를 가역적으로 억제합니다. 이 약을 복용하면 프로스타사이클린 양이 상대적으로 증가합니다(프로스타사이클린/트롬복산 A 2 비율이 증가함). 인도부펜은 혈소판 부착과 응집을 억제합니다. 사용법 및 부작용에 대한 적응증은 아세틸살리실산과 동일합니다.
프로스타사이클린 수용체를 자극하는 약물
혈소판 응집을 줄이는 또 다른 방법은 프로스타사이클린 수용체를 자극하는 것입니다. 이를 위해 그들은 다음을 사용합니다.
프로스타사이클린 준비 e p o pros teno l * . 프로스타사이클린의 효과는 혈소판뿐만 아니라 혈관의 색조에 대한 트롬복산 A2의 효과와 반대입니다. 혈관 확장과 혈압 감소를 유발합니다. 프로스타사이클린의 이러한 효과는 폐고혈압에 사용됩니다. 프로스타사이클린은 혈액에서 빠르게 파괴되므로(t 1/2 약 2분) 오랫동안 작용하지 않으므로 약물을 주입하여 투여합니다. 에포프로스테놀*은 작용 시간이 짧기 때문에 항혈소판제로 널리 사용되지는 않습니다. 에포프로스테놀의 항혈소판 효과가 활용될 수 있는 분야는 체외순환 중 혈소판 응집을 방지하는 것이다.
혈소판에 대한 ADP의 작용을 방해하는 물질
티에노피리딘 유도체인 티클로피딘(ticlid*)은 ADP로 인한 혈소판 응집을 억제합니다. 티클로피딘은 전구약물이며 항혈소판 효과는 미세소체 간 효소의 참여로 활성 대사산물의 형성과 관련됩니다. 티클로피딘 대사산물은 티올 그룹을 함유하고 있으며 이를 통해 혈소판 막의 P2Y12 퓨린성 수용체에 비가역적으로 결합합니다. 이로 인해 혈소판에 대한 ADP의 자극 효과가 제거되고 세포질 Ca 2+ 농도가 감소합니다. 그 결과, 혈소판 막에서 당단백질 IIb/IIIa의 발현과 피브리노겐과의 결합이 감소합니다(그림 27-2 참조). 되돌릴 수 없는 작용 특성으로 인해 티클로피딘은 오래 지속되는 항혈소판 효과를 나타냅니다.
티클로피딘을 지속적으로 사용하면 최대 효과는 7~11일(활성 대사체의 형성 및 작용 발달에 필요한 시간) 후에 달성되며, 약물 중단 후에도 혈소판의 전체 수명(7~10일) 동안 지속됩니다. 날).
티클로피딘은 허혈성 뇌졸중의 2차 예방, 관상동맥 우회술 및 관상동맥 스텐트 시술 시 하지의 질병을 없애는 데 있어 혈전증을 예방하기 위해 처방됩니다. 경구복용하면 효과가 있으며, 1일 2회 식사와 함께 처방한다.
티클로피딘은 부작용으로 인해 사용이 제한됩니다. 식욕부진, 메스꺼움, 구토, 설사(20%), 복통, 피부 발진(11-14%)이 나타날 수 있습니다. 유명한
죽상경화성 지질단백질의 혈장 수준이 증가합니다. 출혈은 항혈소판제를 사용할 때 흔히 나타나는 합병증입니다. 위험한 합병증은 호중구 감소증으로, 이는 치료 첫 3개월 동안 환자의 1~2.4%에서 발생합니다. 혈소판 감소증, 무과립구증 및 매우 드물게 재생 불량성 빈혈이 가능합니다. 이와 관련하여 치료 첫 달 동안 혈액 사진을 체계적으로 모니터링하는 것이 필요합니다.
클로피도그렐(Plavix*, Zilt*)은 화학 구조, 주요 효과 및 작용 메커니즘이 티클로피딘과 유사합니다. 티클로피딘과 마찬가지로 전구약물이며 간에서 전환되어 활성 대사산물을 형성합니다. 혈소판 응집의 현저한 억제는 치료 둘째 날부터 나타났으며 최대 효과는 4~7일 후에 나타납니다. 약을 중단한 후에도 효과는 7~10일간 지속됩니다. 클로피도그렐은 티클로피딘에 비해 활성이 우수합니다. 1일 75mg을 투여하면 티클로피딘을 1일 500mg 투여하는 것과 동일한 혈소판 응집 감소 및 출혈 시간 연장을 유발합니다.

클로피도그렐은 과민증의 경우 아세틸살리실산과 동일한 적응증에 사용됩니다. 1일 1회, 식사와 관계없이 경구 복용하세요. 클로피도그렐은 아세틸살리실산과 결합할 수 있는데, 그 이유는 약물이 혈소판 응집의 다양한 메커니즘을 억제하여 서로의 효과를 향상시키기 때문입니다(그러나 이 결합을 사용하면 출혈 합병증의 위험이 더 높아집니다).
티클로피딘과 비교하여 클로피도그렐의 부작용은 덜 두드러집니다(설사 - 4.5%, 발진 - 6%). 클로피도그렐의 사용은 호중구 감소증(0.1%)과 같은 심각한 합병증의 위험을 낮추고 혈소판 감소증의 발생 빈도도 낮습니다. 드문 합병증으로 티클로피딘과 마찬가지로 혈전성 혈소판 감소성 자반증이 발생할 수 있습니다.
혈소판 포스포디에스테라제 억제제
Dipyridamole(curantyl*, persantine*)은 관상동맥 확장제로 처음 제안되었습니다. 나중에 혈소판 응집을 억제하는 능력이 밝혀졌습니다. 현재 디피리다몰은 혈전증 예방을 위한 항혈소판제로 주로 사용된다. 디피리다몰의 항혈소판 효과는 혈소판의 cAMP 수준 증가와 관련이 있으며, 그 결과 세포질 Ca 2+ 농도가 감소합니다. 이는 여러 가지 이유로 발생합니다. 첫째, 디피리다몰은 cAMP를 비활성화하는 포스포디에스테라제를 억제합니다. 또한 디피리다몰은 내피세포와 적혈구의 아데노신 흡수와 대사를 억제(아데노신 탈아미노효소를 억제)하여 혈중 아데노신 농도를 증가시킨다(그림 27-4). 아데노신은 혈소판 A 2 수용체를 자극하고 이들 수용체와 관련된 아데닐레이트 사이클라제의 활성을 증가시켜 결과적으로 혈소판에서 cAMP 형성이 증가하고 세포질 Ca 2+ 수준이 감소합니다. Dipyridamole은 또한 혈관 평활근 세포의 cAMP 수준을 증가시켜 혈관 이완을 유발합니다.

디피리다몰은 허혈성 뇌졸중 및 말초 동맥 질환을 예방하는 데 사용됩니다(디피리다몰 자체는 항혈소판 효과가 약하기 때문에 주로 아세틸살리실산과 함께 사용). 하루 3~4회 식사 1시간 전에 경구로 처방됩니다. 경구 항응고제와 함께 디피리다몰은 승모판 심장 질환에서 혈전 형성을 예방하기 위해 처방됩니다.
디피리다몰 사용시 두통, 현기증, 동맥저혈압, 소화불량 증상,
피부 발진. 출혈 위험은 아세틸살리실산을 사용할 때보다 적습니다. 디피리다몰은 협심증("도둑질 증후군"일 수 있음)의 경우 금기입니다.

쌀. 27-4. 디피리다몰의 항혈소판 작용 메커니즘: EC - 내피 세포; A 2 -P - 아데노신 A 2 수용체; PDE - cAMP 포스포디에스테라제; AC - 아데닐레이트 시클라제; GP IIb/IIIa - 당단백질 IIb/IIIa
펜톡시필린(아가퓨린*, 트렌탈*)은 디피리다몰과 마찬가지로 포스포디에스테라제를 억제하고 cAMP 수준을 증가시킵니다. 결과적으로 혈소판의 세포질 Ca 2 + 수준이 감소하여 응집이 감소합니다. Pentoxifylline은 또한 다른 특성도 가지고 있습니다. 적혈구의 변형성을 증가시키고 혈액 점도를 감소시키며 혈관 확장 효과가 있어 미세 순환을 개선합니다.
펜톡시필린은 뇌혈관 사고, 다양한 원인의 말초 순환 장애, 눈의 혈관 병리학에 사용됩니다("뇌혈관 사고에 사용되는 약물" 장 참조). 가능한 부작용 : 소화 불량 증상, 현기증, 얼굴 발적, 혈압 감소, 빈맥, 알레르기 반응, 출혈. 디피리다몰과 마찬가지로 협심증 중에 발작을 유발할 수 있습니다.
혈소판막의 당단백질 IIb/IIIa를 차단하는 물질
혈소판막의 당단백질 IIb/IIIa와 직접 상호작용하고 피브리노겐과의 결합을 방해하는 이 항혈소판제 그룹은 비교적 최근에 나타났습니다.
Abciximab(reopro*) - 이 그룹의 첫 번째 약물은 "키메라" 마우스/인간 단일클론 항체(인간 Ig의 Fc 단편과 결합된 당단백질 IIb/IIIa에 대한 마우스 항체의 Fab 단편)입니다. Abciximab은 피브리노겐이 혈소판 막의 당단백질 IIb/IIIa에 결합하는 것을 비경쟁적으로 억제하여 이들의 응집을 방해합니다(그림 27-3 참조). 혈소판 응집은 단일 주사 후 48시간이 지나면 정상화됩니다. 이 약물은 관상동맥 혈관성형술 중 혈전증을 예방하기 위해 정맥 내로(주입으로) 투여됩니다. 앱식시맙을 사용하는 경우 내부(위장, 두개내, 비뇨생식기 출혈), 메스꺼움, 구토, 저혈압, 서맥, 최대 아나필락시스 쇼크까지의 알레르기 반응, 혈소판 감소증을 포함한 출혈이 가능합니다.
동일한 작용 메커니즘을 갖는 덜 알레르기성 약물에 대한 연구로 인해 당단백질 IIb/IIIa의 합성 차단제가 생성되었습니다. 바르보린(피그미 방울뱀의 독에서 분리된 펩타이드)을 기반으로 약물 e p t i fi b at i d(인테길린 *)가 얻어졌습니다. 이는 당단백질 IIb/IIIa에 직접 결합하는 피브리노겐 사슬의 아미노산 서열을 모방한 고리형 헥타펩타이드입니다. Eptifibatide는 피브리노겐이 수용체에 결합하는 것을 경쟁적으로 대체하여 가역적인 혈소판 응집 장애를 유발합니다. 약물은 주입으로 정맥 내로 투여됩니다. 항혈소판 효과는 5분 이내에 나타나며 투여 중단 후 6~12시간 후에 사라집니다. 이 약물은 경피 관상동맥 혈관성형술 중 혈전 형성 예방, 불안정 협심증, 심근경색 예방에 권장됩니다. eptifibatide 사용 시 위험한 합병증은 출혈입니다. 혈소판 감소증이 가능합니다.
티로피반(agrastat*)은 티로신의 유사체인 당단백질 IIb/IIIa의 비펩타이드 차단제입니다. eptifibatide와 마찬가지로 tirofiban은 당단백질 IIb/IIIa 수용체를 경쟁적으로 차단합니다. 약물은 정맥 내로 투여됩니다(주입). 효과 발현 속도, 작용 지속 시간 및 사용 적응증은 eptifibatide와 동일합니다. 부작용 - 출혈, 혈소판 감소증.
이 그룹에서 약물 사용 가능성을 확장하기 위해 경구 투여 시 효과적인 당단백질 IIb/IIIa 차단제(xemilofiban *, sibrafiban * 등)가 만들어졌습니다. 그러나 이러한 약물에 대한 테스트에서 효과가 충분하지 않고 부작용이 있음이 밝혀졌습니다. 심각한 혈소판 감소증의 형태.
27.2. 혈액 응고에 영향을 미치는 약물
혈관벽이 손상되면 혈소판 응집뿐만 아니라 혈액 응고도 시작됩니다. 이 과정에는 많은 알려진 요인(혈장, 조직, 혈소판)이 관여합니다. 이들 중 대부분은 비활성 상태로 순환하지만 이후 혈액 응고 과정에서 활성화되는 혈장 단백질입니다. 약물의 효과를 설명하려면 인자 VII(프로컨버틴), 인자 IX(크리스마스), 인자 X(스튜어트-프로워), 인자 II(프로트롬빈)를 언급할 필요가 있습니다. 이러한 응고 인자는 전구효소이며, 활성화되면 단백질 분해 효소(GCa, Xa 및 Na 인자)로 전환됩니다. 인자 VIII 및 V는 활성화된 후 효소(각각 인자 IXa 및 Xa)에 대한 보조 인자 단백질로 작용하여 단백질 분해 활성을 증가시킵니다.
제VII 인자는 처음에는 단백질 분해 활성이 낮지만 조직 인자(481페이지 참조)와의 상호작용으로 인해 빠르게 증가합니다. 활성화된 제VII 인자(인자 VIIa)는 조직 인자 및 Ca 2+와 함께 인자 IX 및 X의 부분적인 단백질 분해를 유발하는 복합체를 형성합니다. 인자 IXa는 차례로 인자 X를 추가로 활성화합니다(인자 Xa가 형성됨). 인자 Xa는 프로트롬빈(인자 II)에 작용하여 이를 트롬빈(인자 Ha)으로 전환합니다. 트롬빈은 피브리노겐의 부분적인 단백질 분해를 유발하여 피브린을 형성합니다(그림 27-5).
혈액 응고 인자의 단백질 분해 활성화는 Ca 2+ 이온을 통해 세포막의 음전하 인지질에 결합하면 상당히 가속화됩니다. 이러한 인지질은 Ca 2 + 이온의 참여로 응고 인자가 복합체로 조립되는 일종의 매트릭스 역할을 합니다. 동시에 이러한 복합체의 요소 활성화 속도는 10,000배 이상 증가합니다. 이러한 복합체 형성에 필요한 조건은 인자 II, VII, IX 및 X가 Ca 2 +에 결합하는 능력입니다. 이러한 요소에는 음전하가 포함되어 있습니다.
Ca 2+에 대한 결합을 보장하는 γ-카르복시글루탐산의 잔기. γ-카르복시글루탐산의 형성은 비타민 K의 참여로 간에서 발생합니다. 비타민 K 결핍으로 인해 결함이 있는 혈액 응고 인자 II, VII, IX 및 X가 혈액에 나타나 피브린 형성을 방해합니다.

쌀. 27-5. 혈관벽 손상 시 혈액 응고 활성화 계획(출처: Katzung B. G. 기본 및 임상 약리학. - NY, 2001, 개정됨): 세포막의 음전하 인지질과 관련된 혈액 응고 인자 복합체에 밑줄이 그어져 있습니다. 굵은 선. 복합체 VIIa + TF + Ca 2+는 인자 X 및 IX(TF - 조직 인자)를 활성화합니다. 복합체 IXa + VIIIa + Ca 2+는 인자 X를 추가로 활성화합니다. 복합체 Xa + Va + Ca 2+(프로트롬비나제)는 프로트롬빈이 트롬빈으로 전환되는 것을 촉진합니다. 상자에 동봉된 인자는 헤파린에 의해 억제됩니다.
γ-카르복시글루탐산 잔기를 함유하고 비타민 K의 참여로 간에서 형성되는 혈장 단백질에는 단백질 C 및 S도 포함됩니다. 활성화 후, 단백질 C(Ca)는 인자 VIIIa 및 Va의 단백질 분해 절단을 유발합니다. 이는 트롬빈 형성을 방해합니다. 단백질 S는 단백질 분해 반응에서 보조 인자로 작용합니다. 단백질 C의 활성화는 단백질 C와 트롬빈에 동시에 결합하는 트롬보모듈린 단백질을 발현하는 손상되지 않은(손상되지 않은) 내피 세포 표면의 트롬빈의 영향으로 발생합니다.
27.2.1. 항응고제(항응고제)
임상 실습에 사용되는 항응고제는 혈액 내 활성 응고 인자를 직접 억제하거나 간에서의 활성 응고 인자 형성을 방해합니다. 따라서 그들은 두 그룹으로 나뉩니다:
(혈액에 직접 작용).
- 헤파린 표준(분할되지 않음).
- 저분자량 헤파린:
에녹사파린 나트륨;
나드로파린 칼슘;
달테파린 나트륨;
레비파린나트륨.
- 헤파리노이드:
설로덱시드;
다나파로이드**.
- 항트롬빈 III 약물.
- 히루딘 준비:
레피루딘*.
- 활성화된 단백질 C:
드로트레코진 알파.
(간에서 응고인자의 합성을 억제합니다.)
- 쿠마린 유도체:
아세노쿠마롤(syncumar*);
와파린(warfarex*).
- 인단디온 유도체:
페닌디온(페닐린*).
직접 항응고제
헤파린- D-글루코사민과 D-글루쿠론산 잔기로 구성된 황산화 글리코사미노글리칸(뮤코다당류). 헤파린은 많은 조직의 비만세포에서 생산됩니다. 간, 폐, 장 점막에 다량으로 함유되어 있습니다. 의료 목적으로 헤파린은 돼지의 장 점막과 소의 폐에서 분리됩니다. 진행 중
분리를 통해 다양한 다당류 사슬 길이와 다양한 분자량(3000~40,000D)을 갖는 분획의 혼합물이 생성됩니다. 분자량이 다른 분획은 생물학적 활성과 약동학적 특성이 약간 다릅니다. 따라서, 다양한 방법과 다양한 출처에서 얻은 헤파린 제제는 서로 다른 항응고 활성을 가질 수 있으므로 생물학적 표준화를 수행할 필요가 있습니다. 헤파린의 활성은 혈액 응고 시간을 연장하는 능력에 따라 결정됩니다(표준 헤파린 1mg에는 130단위가 포함되어 있음).
헤파린은 내인성 항응고제인 항트롬빈 III과 복합체가 형성된 후에만 혈액 응고 인자에 영향을 미칩니다. 혈장 당단백질인 안티트롬빈 III는 혈액 응고 인자 IIa(트롬빈), EXa 및 Xa(XIa 및 XIIa도 포함)를 포함하는 세린 프로테아제를 억제합니다. 안티트롬빈 III 단독의 영향으로 인자 불활성화 과정은 매우 느리게 진행됩니다. 헤파린은 항트롬빈 III 분자의 형태적 변화를 일으키며, 이로 인해 이 과정이 약 1000배 가속화됩니다.

헤파린-항트롬빈 III 복합체의 주요 작용은 트롬빈과 Xa 인자에 대한 것이지만 이들 인자의 억제 메커니즘에는 약간의 차이가 있습니다. 트롬빈을 비활성화하려면 헤파린이 항트롬빈 III 분자와 트롬빈 분자 모두에 결합해야 합니다. 동시에, 헤파린-안티트롬빈 III 복합체에 의한 인자 Xa의 신속한 불활성화는 이 인자가 헤파린에 결합할 필요가 없습니다. 상대적으로 짧은 중합체 사슬(당류 단위 18개 미만)을 가진 헤파린 분획은 항트롬빈 III과 트롬빈을 동시에 결합할 수 없으므로 항트롬빈 활성을 갖지 않습니다. 이들의 작용은 주로 인자 Xa의 불활성화와 연관되어 있으며, 따라서 프로트롬빈이 트롬빈으로 전환되는 것을 방해합니다.
헤파린은 혈액 응고에 대한 효과 외에도 몇 가지 다른 효과도 있습니다. 지단백질 리파제(이 효소는 중성지방을 가수분해함)의 활성화로 인해 혈액 내 지질 수준을 감소시키고 평활근 세포의 증식을 억제합니다.
헤파린은 경구투여 시 흡수가 잘 되지 않으므로 정맥주사, 때로는 피하주사로 투여합니다. 정맥 투여 시 효과는 즉시 나타나며 2~6시간 지속된다. 피하 투여 시 헤파린은 1~2시간 후에 작용하기 시작하고 작용 지속시간은 8~12시간(1일 2~3회 처방)이다. 혈액 내 헤파린은 이를 중화시키는 단백질(혈소판 인자 4 및 기타 일부)을 포함하여 많은 단백질과 결합합니다. 혈액 내 이러한 단백질의 수치가 높으면 약물에 대한 상대적 저항성을 유발할 수 있습니다. 또한 헤파린은 대식세포 및 내피세포와 결합하여 분해(해중합)가 일어납니다. 헤파린은 또한 간에서 대사되어 신장으로 배설됩니다.
헤파린은 심부 정맥 혈전증 및 폐색전증의 예방 및 치료, 불안정 협심증 및 심근 경색, 말초 동맥 혈전증 예방, 심장 판막 교체 및 체외 순환에 사용됩니다. 헤파린은 AU(Action Unit) 단위로 투여됩니다.
헤파린 치료의 가장 흔한 합병증은 출혈이며, 이는 혈소판 기능의 억제 또는 그 수의 감소(혈소판감소증)로 인해 발생할 수 있습니다. 폰빌레브란트 인자에 대한 헤파린의 결합은 혈소판 부착 및 응집에 대한 헤파린의 억제 효과를 설명하는 것으로 보입니다. 이런 경우에는 헤파린을 중단하고, 출혈이 심할 경우에는 황산프로타민을 정맥주사하는데, 이 약은 헤파린을 불용성 복합체를 형성하여 중화시킨다.
혈소판 감소증은 헤파린을 투여받는 환자의 약 1~5%에서 치료 7~14일에 발생합니다. 이는 헤파린-혈소판 인자 4 복합체에 대한 항체(IgG)의 출현으로 인해 발생합니다. 이 복합체는 혈소판 응집 시 방출되는 혈소판 유래 당단백질인 인자 4에 의해 헤파린이 중화될 때 혈소판 막에 결합합니다. 혈소판 감소증 환자의 1% 미만은 내피 손상으로 인해 혈전증을 경험합니다.
헤파린-인자 4 복합체에 대한 항체에 의한 세포 및 혈소판 활성화 이 상태에서는 헤파린을 중단하고 혈소판 감소증을 유발하지 않는 항응고제인 다나파로이드** 및 레피루딘**을 처방해야 합니다.
헤파린을 장기간(3개월 이상) 투여하면 골다공증이 발생할 수 있습니다. 이는 임신 중에 헤파린을 처방할 때 고려하는 것이 특히 중요합니다. 부신의 알도스테론 합성 억제와 관련된 고칼륨혈증은 헤파린 치료의 매우 드문 합병증입니다.
저분자량(분별) 헤파린 분자량이 1000~10,000D(평균 4000~5000D)인 헤파린 단편으로 구성됩니다. 이는 기존의(분별되지 않은) 헤파린을 분별, 가수분해 또는 해중합하여 얻습니다. 헤파린과 같은 이러한 약물은 항트롬빈 III을 통해 응고 인자에 작용하지만 다음 특성에서 헤파린과 다릅니다.
이들은 인자 IIa보다 인자 Xa의 활성을 더 크게 억제합니다(3-4배).
피하 투여 시 생체 이용률이 더 높습니다(저분자량 헤파린 - 약 90%, 표준 헤파린 - 20%).
이 약물은 더 오랜 기간 동안 작용하므로 하루에 1-2회 투여할 수 있습니다.
이는 혈소판 인자 4에 대한 친화력이 낮기 때문에 표준 헤파린보다 혈소판 감소증을 유발할 가능성이 적습니다.
덜 일반적으로 골다공증을 유발합니다.
국내에서는 en o x a parin 나트륨(Clexane *), nadroparin 칼슘(Fraxiparin *), d alte parin 나트륨(Fragmin *), reviparin 나트륨(klivarin*)과 같은 저분자량 헤파린 제제가 사용됩니다. 이들 약물은 구성이 이질적이므로(다양한 헤파린 분획을 함유함) 물리화학적, 약동학적 특성 및 활성이 서로 다소 다릅니다.
저분자량 헤파린은 심부정맥 혈전증(특히 수술 후)의 예방 및 치료, 폐색전증 예방, 불안정 협심증 및 심근경색에 사용됩니다. 예방을 위해 저분자량 헤파린 제제가 사용됩니다.
산과 진료에서의 틱 및 혈전증 치료. 피하로만 투여됩니다. 복용량은 ME(국제 단위)로 표시됩니다.
미분획 헤파린 제제와 마찬가지로 저분자량 헤파린은 출혈을 일으킬 수 있습니다. 치료 첫날에는 중등도의 혈소판 감소증이 가능합니다. 저분자량 헤파린은 경우에 따라 간 효소의 활성을 증가시켜 알레르기 반응을 일으킬 수 있습니다. 황산프로타민은 저분자량 헤파린의 효과를 완전히 제거하지는 않습니다.
최근에는 안티트롬빈 III에 결합하여 인자 Xa의 불활성화를 가속화하는 합성 5당류인 나트륨 리눅스(sodium rinux)라는 약물이 임상 실습에 등장했습니다. 이 약은 나트륨염 형태로 생산되며 정형외과 수술 시 정맥혈전증, 폐색전증 예방에 사용된다.
헤파리노이드- 구조적으로 헤파린과 관련된 황산화 글리코사미노글리칸. 헤파린과 마찬가지로 혈액 응고 인자에 대한 항트롬빈 III의 억제 효과를 향상시킵니다. 많은 중요한 특성이 헤파린 및 저분자량 헤파린과 다르기 때문에 특수 그룹으로 분류됩니다. Danaparoid*와 sulodexide가 이 그룹에 속합니다. 이 약물은 돼지의 장 점막에서 얻습니다.
다나파로이드**(오가논**)에는 헤파란 황산염, 데르마탄 황산염 및 콘드로이틴 황산염의 혼합물이 포함되어 있습니다. Danaparoid p는 프로트롬빈보다 인자 Xa를 더 크게 억제합니다. 이 약물은 정맥 혈전증의 예방 및 치료를 위해 피하 투여됩니다. Danaparoid p는 혈소판 인자 4에 결합하지 않으며 혈소판 감소증을 유발하지 않습니다. 따라서 헤파린 치료가 혈소판 감소증으로 인해 복잡해지는 경우에 표시됩니다.
Sulodexide(Wessel Due F*)는 헤파란 황산염과 데르마탄 황산염의 혼합물로 구성됩니다. Sulodexide는 Xa 인자의 활성을 크게 감소시키며 프로트롬빈에는 거의 영향을 미치지 않습니다. 이 약물은 섬유소 용해 활성을 증가시키고 혈관 내피에 보호 효과가 있으며 지질 저하 특성을 가지고 있습니다. Sulodexide는 혈전증 위험이 높은 말초 혈관 질환에 사용됩니다. 비경구(정맥내 및 근육내) 투여용과 경구 투여용 약물의 투여 형태가 있습니다.
항트롬빈 III헤파린, 저분자량 헤파린, 헤파리노이드의 항응고 효과에 필요합니다.
유전성 항트롬빈 III 결핍의 경우, 그 약물을 정맥 주사로 사용하고 투여합니다. 헤파린을 장기간 사용하면 항트롬빈 III의 소비가 증가하여 혈액 내 농도가 현저하게 감소합니다. 이는 헤파린 치료의 효과를 감소시킵니다. 이러한 경우에는 항트롬빈 III도 투여됩니다.
히루딘- 분자량 7kDa의 단백질로 약용 거머리의 침샘에서 최초로 발견됨 히루도 메디칼리스.헤파린과 마찬가지로 히루딘은 혈액에서 직접 작용하는 항응고제이지만 헤파린과 달리 히루딘은 트롬빈을 직접 억제합니다. 즉, 항트롬빈 III의 참여 없이 트롬빈에 선택적으로 결합하여 비활성화합니다. 억제는 되돌릴 수 없습니다. 헤파린과 달리 히루딘은 혈전과 관련된 트롬빈을 억제하여 혈전의 성장을 지연시키는 능력이 있습니다. 히루딘은 혈소판 4 인자와 상호작용하지 않으므로 혈소판 감소증을 유발하지 않습니다.
hirudin - le p iru d i n *(refludan *)의 재조합 제제가 임상용으로 얻어졌습니다. 헤파린으로 인한 혈소판 감소증에서 발생할 수 있는 혈전색전성 합병증을 예방하기 위해 사용하는 것이 좋습니다. 레피루딘*은 정맥 주사로 투여됩니다. 사용 중 출혈이 발생할 수 있습니다. 히루딘 제제에는 특별한 해독제가 없습니다.
Drotrecogin alfa(Zigris*)는 활성화된 단백질 C의 재조합 제제입니다. 이는 트롬빈 형성을 억제하여 혈액 응고 인자 VIIIa 및 Va의 단백질 분해 불활성화를 유발합니다. 또한, drotrecogin은 혈장의 섬유소 용해 활성을 증가시켜 혈액에서 순환하는 플라스미노겐 활성 억제제 1형의 양을 감소시킵니다. 약물의 항염증 활성은 종양 괴사 인자 알파 방출에 대한 억제 효과와 관련이 있습니다. 단핵구에서. drotrecogin의 이러한 모든 특성은 패혈성 쇼크 치료의 효과를 결정합니다(염증 및 혈액 응고 증가가 이 질환의 주요 증상입니다). 다른 항응고제와 마찬가지로 이 약물도 출혈성 합병증을 일으킬 수 있습니다.
간접항응고제
헤파린과 달리 이러한 약물은 혈액 내 응고 인자에 직접 영향을 미치지 않습니다. 그들은 합성을 억제합니다.
비타민 K-인자 II (프로트롬빈), 인자 VII, IX 및 X에 의존하는 혈장 단백질의 간에서의 합성 (그림 27-5 참조). 비타민 K는 글루탐산 잔기의 γ-카르복실화 반응에서 보조효소 역할을 하기 때문에 기능적으로 가치 있는 인자의 형성에 필요합니다. 비타민 K의 환원형인 하이드로퀴논은 보조효소 활성을 나타냅니다. 카르복실화 동안 비타민 K-히드로퀴논은 산화되어 비활성 비타민 K-에폭사이드를 형성합니다. 간접 항응고제는 에폭사이드 환원효소와 DT-디아포라제에 의해 비활성 비타민 K-에폭사이드가 활성 비타민 K-하이드로퀴논으로 전환(환원)되는 것을 방지하여 이들 효소를 억제합니다. 따라서 이들은 비타민 K 길항제로 분류된다(그림 27-6).

쌀. 27-6.비타민 K와 간접 항응고제의 작용 메커니즘
간접 항응고제는 혈액 내 응고 인자 농도를 즉시 감소시키지 않습니다. 그들의 행동은 잠복기가 특징입니다. 따라서 아세노쿠마롤의 항응고 효과는 48시간 이상 후에 최대치에 도달합니다. 이러한 효과의 느린 전개는 이러한 약물을 투여할 때 본격적인 응고 인자가 일정 시간 동안 여전히 혈액에서 순환한다는 사실로 설명됩니다(효과의 시작 속도는 응고 인자가 지속되는 시간에 따라 결정됩니다). 프로트롬빈 복합체가 분해됩니다.) 간접항응고제의 효과는 약 2~4일 정도 지속되며 약물은 축적될 수 있습니다.

간접 항응고제는 수술 후 혈전 형성을 예방하기 위해 수술에서 혈전증 및 혈전 색전증 (심부 정맥 혈전증, 폐색전증, 심방 세동의 혈전 색전증 합병증, 심근 경색, 심장 판막 교체)의 장기 예방 및 치료에 사용됩니다. 내부로 들어갔습니다. 치료는 프로트롬빈 시간을 결정하여 혈장 내 프로트롬빈 수준을 의무적으로 모니터링하면서 수행됩니다. 이 값은 혈액 내 프로트롬빈 함량과 인자 IX 및 X에 따라 달라집니다.
간접항응고제 사용 시 가장 흔한 합병증은 출혈입니다. 아스피린*과 다른 항혈소판제를 동시에 사용하면 출혈의 위험이 증가합니다. 간접항응고제에 의한 출혈을 멈추기 위해서는 비타민 K1 제제와 프로트롬빈 복합농축액(인자 II, VII, IX, X 함유)을 투여해야 합니다. 다른 부작용도 가능합니다: 알레르기 반응, 설사, 간 기능 장애, 피부 괴사. 간접 항응고제는 임신 중에 금기입니다. 태반에 침투하여 기형 유발 효과가 있을 수 있습니다(골격 형성을 방해하기 때문에).
비타민 K 의존성 뼈 단백질인 오스테오칼신의 형성을 억제합니다. 페니디온(페닐린*)은 조혈을 억제할 수 있습니다.
27.2.2. 혈액 응고제
혈액 응고를 증가시키는 약물은 출혈을 멈추기 위해 사용되므로 지혈제(지혈제) 또는 항출혈제로 분류됩니다. 이 그룹에는 혈액 응고 인자(비타민 K 제제) 형성에 필요한 물질과 응고 인자 자체 제제가 포함됩니다.
비타민 K 제제
비타민 K는 식물에서 발견되는 비타민 K 1(필로퀴논)과 미생물(특히 인간 장내 미생물)에 의해 합성되는 화합물(메나퀴논) 그룹인 비타민 K 2의 두 가지 형태로 존재합니다. 비타민 K 1과 K 2는 2-메틸-1,4-나프토퀴논의 유도체인 지용성 화합물로, 측탄소 사슬의 길이와 성질이 다릅니다. 비타민 Kj는 합성적으로 얻어지며 그 제제는 피토메나디온으로 알려져 있습니다. 프로비타민 활성을 갖는 비타민 K의 수용성 전구체인 2-메틸-1,4-나프토퀴논(메나디온)이 합성되었습니다. 이 화합물은 비타민 K 3 라고 명명되었습니다. 비타민 K 3의 유도체인 메나디온 나트륨 바이설파이트는 의료 행위에서 b 및 k a - sol *라는 이름으로 사용됩니다.
비타민 K는 프로트롬빈(인자 II)과 혈액 응고 인자 VII, IX, X뿐만 아니라 단백질 C와 S의 간에서의 합성에 필요합니다. 비타민 K는 뼈 조직 단백질인 오스테오칼신의 합성에 참여하는 것으로 알려져 있습니다.
모든 비타민 K 의존성 단백질의 구조에는 공통된 특징이 있습니다. 이 단백질에는 Ca 2+ 이온과 결합하는 γ-카르복시글루탐산 잔기가 포함되어 있습니다. 비타민 K-히드로퀴논은 글루타민산 잔기의 γ-카르복실화 반응에서 조효소로 작용합니다(그림 27-6 참조). 비타민 K 결핍으로 인해 Ca 2+와 결합할 수 없는 혈액 응고 인자의 비활성 전구체가 나타납니다. 신체의 비타민 K 결핍은 가장 빨리 혈액 응고 장애로 이어집니다. 따라서 주요
비타민 K 결핍의 가장 초기 증상은 출혈과 출혈입니다.
비타민 K 제제는 출혈 및 신체의 비타민 K 결핍으로 인한 기타 출혈 합병증, 예를 들어 신생아 출혈 증후군을 예방하고 멈추는 데 사용됩니다. 신생아의 비타민 K 결핍은 비타민 K 1 섭취가 부족하고 비타민 K 2 를 합성하는 장내 미생물이 부족하여 발생할 수 있습니다. 이러한 합병증을 예방하려면 생후 첫 시간에 신생아에게 비타민 K1을 예방적으로 투여하는 것이 좋습니다.
비타민K 제제는 폐쇄성 황달(지용성 비타민K의 흡수에 담즙이 필요함)이나 흡수장애 증후군(스푸루, 장염, 크론병 등)에서 담즙 분비 장애로 인해 장에서 비타민K 흡수가 감소된 경우에 사용됩니다. .)
비타민K1 제제는 간접항응고제에 의한 출혈에 효과적입니다. 경구 및 정맥 주사로 천천히 투여됩니다.
비타민 K 제제는 알레르기 반응(발진, 가려움증, 홍반, 기관지 경련)을 일으킬 수 있습니다. 정맥 투여 시 아나필락시양 반응의 위험이 있습니다. 신생아에게 비타민K3 제제(비카솔*)를 사용할 경우 용혈성 빈혈 및 고빌리루빈혈증이 발생할 위험이 있습니다.
응고인자 제제
이러한 약물의 필요성은 하나 이상의 혈액 응고 인자가 부족할 때 발생합니다.
항혈우병 혈액 응고 인자 VIII(혈우병 M*, immunat* 등)은 인자 VIII의 건조 농축물입니다. 약물은 이중 바이러스 불활성화를 거친 기증자 혈장에서 얻어지며 인자 VIII의 함량에 따라 표준화됩니다. 냉동침전*보다 더 활동적이고 안전합니다.
Cryoprecipitate*는 혈장 단백질 농축물로, 제VIII인자, 폰 빌레브란트 인자, 피브로넥틴은 물론 다른 혈액 응고 인자와 소량의 피브리노겐도 포함됩니다.
이 약물은 유전성(혈우병 A) 및 후천성 제8인자 결핍증에 대해 정맥 주사로 투여됩니다. 동결침전물*,
또한 폰빌레브란트병(폰빌레브란트 인자의 유전적 결핍) 및 무섬유소원혈증에 대한 대체 요법에도 사용됩니다. 투여시 빈맥, 동맥 저혈압, 호흡 곤란, 알레르기 반응 (두드러기, 발열, 아나필락시스 쇼크) 및 적혈구 용혈의 형태로 부작용이 발생할 수 있습니다.
혈장에서 얻은 모든 응고 인자 제제에는 바이러스 감염(HIV, 간염)을 전염시킬 가능성이라는 중요한 단점이 있습니다. 현재 VIII 인자와 von Willebrand 인자의 재조합 제제가 얻어졌으며 이를 사용하면 감염 위험이 줄어듭니다.
응고 인자 약물 외에도 경증 형태의 혈우병 A 및 폰빌레브란트병의 경우 아르기닌 바소프레신 유사체인 데스모프레신이 사용됩니다. 데스모프레신은 혈장 내 폰빌레브란트 인자의 함량을 증가시켜 내피 세포로부터의 방출을 촉진하고 인자의 활성을 증가시킵니다.
Ⅷ. 약물은 비경구적으로 투여됩니다.
혈액 응고 인자 IX(agemphil B*, immunin*, octanine*)는 인자 IX가 풍부한 인간 혈장의 정제된 분획입니다. 선천성(혈우병 B) 및 후천성 제9인자 결핍증 및 간접 항응고제의 과다 복용에 사용됩니다. 부작용은 제8인자 약물과 동일합니다.
활성화된 Eptacog 알파(novoseven *)는 재조합 혈액 응고 인자 VIIa입니다. 인자 VII 및 기타 응고 인자(V, II,
IX, X).
국소적으로 작은 모세혈관과 실질 기관의 출혈을 막기 위해 트롬비나(공여 혈장에서 얻음) 약물과 지혈 스폰지(콜라겐, 젤라틴)가 사용됩니다.
자궁, 폐, 신장, 장 및 기타 출혈을 멈추기 위해 쐐기풀 잎, 야로우 허브, 후추 매듭 허브, 매듭 허브, 가막살 나무속 나무 껍질, 아르니카 꽃, 중독성 lagochilus와 같은 약용 식물 준비가 사용됩니다. 약용 식물은 주입, 팅크 및 추출물의 형태로 내부 및 국소적으로 사용됩니다.
27.3. 섬유소 용해에 영향을 미치는 약물
혈전이 형성되면 섬유소 용해 시스템이 활성화되어 섬유소의 용해(용해)와 혈전의 파괴가 보장됩니다. 이는 정상적인 혈류의 회복으로 이어집니다.
섬유소분해 과정에서 비활성 플라스미노겐은 플라스미노겐 활성화제의 참여로 플라스민(섬유소용해신)으로 전환됩니다. 플라스민은 피브린을 가수분해하여 수용성 펩타이드를 형성합니다. 플라스민은 특이성이 없으며 피브리노겐 및 기타 혈액 응고 인자를 파괴하여 출혈 위험을 증가시킵니다. 혈액 내를 순환하는 플라스민은 α 2 -항플라스민 및 기타 억제제에 의해 빠르게 비활성화되므로 일반적으로 전신 섬유소분해 효과가 없습니다. 그러나 특정 병리학적 상태나 섬유소용해제를 사용하는 경우 혈장 플라스미노겐이 과도하게 활성화되어 출혈을 일으킬 수 있습니다.
27.3.1. 섬유소용해제(혈전용해제)
섬유소 용해제는 관상동맥 혈전증(급성 심근경색), 심부 정맥 혈전증, 말초 동맥의 급성 혈전증 및 폐색전증에서 혈전을 용해시키는 데 사용됩니다.
섬유소 용해제로서 플라스미노겐을 활성화하는 약물인 스트렙토키나제 약물, 조직 플라스미노겐 활성화제 약물, 유로키나제 약물이 사용됩니다.
스트렙토키나제 약물
스트렙토키나제(카비키나제 *)는 β-용혈성 연쇄구균의 배양물에서 얻은 고도로 정제된 단백질 제제입니다. 스트렙토키나아제는 플라스미노겐과 결합해야만 단백질 분해 활성을 얻습니다. 스트렙토키나제가 투여되면 등몰의 스트렙토키나제-플라스미노겐 복합체가 형성되어 플라스미노겐이 플라스민으로 전환됩니다. 스트렙토키나아제는 혈전과 혈장 모두에서 플라스미노겐에 작용합니다(그림 27-7).
스트렙토키나아제는 관상동맥 혈전증으로 인한 급성 심근경색(대부분)에서 정맥으로 투여됩니다.
심부 정맥 혈전증, 폐색전증, 망막 혈관 혈전증의 경우 처음 3~6시간 동안 효과적입니다. 스트렙토키나아제는 ME(국제 단위) 단위로 투여됩니다.
스트렙토키나제 사용 시 빈번한 합병증은 혈액 내에서 순환하는 플라스미노겐의 활성화(결과적인 플라스민이 피브리노겐을 파괴하여 혈소판 응집을 감소시킴) 및 생리학적 혈전의 용해와 연관될 수 있는 출혈입니다. 메스꺼움, 구토, 동맥 저혈압이 발생할 수 있습니다. 항원 특성이 있기 때문에 스트렙토키나아제는 아나필락시성 쇼크를 포함한 알레르기 반응을 일으킬 수 있습니다. 약물을 반복적으로 투여하면 위험이 증가합니다. 혈액 내에서 순환하는 항체는 스트렙토키나제를 비활성화하여 치료 효과를 감소시킬 수 있습니다.
아니스트레플라제**(에미나제**)는 스트렙토키나제와 아실화된 라이신 플라스미노겐의 복합체입니다. 플라스미노겐 분자의 아실 그룹은 플라스미노겐의 활성화를 방지하는 촉매 부위를 닫습니다. 이 약물은 전구약물이며 아실 그룹이 절단된 후에만 플라스미노겐을 플라스민으로 전환하는 능력을 얻습니다. 탈아실화 속도와 그에 따른 활성 약물의 형성 시간은 아실기의 특성에 따라 다르며 40분에서 몇 시간까지 다양합니다. 아니스트레플라제**는 정맥 주사로 투여됩니다. 단일 주사 후 섬유소 용해 효과는 4-6시간 지속됩니다. 사용법 및 부작용은 스트렙토키나제와 동일합니다.
조직 플라스미노겐 활성화제 및 유로키나제 제제
조직 플라스미노겐 활성화제와 유로키나제는 주요 생리학적 플라스미노겐 활성화제입니다.
조직 플라스미노겐 활성제는 내피 세포에 의해 생산됩니다. 이는 플라스미노겐의 부분적인 단백질 분해를 유발하여 플라스민으로 전환됩니다. 조직 활성제의 독특한 특징은 플라스미노겐에 대한 효과를 수백 배 가속화하는 피브린에 대한 높은 친화력입니다. 결과적으로, 조직 활성화제는 피브린 필라멘트에 흡착된 플라스미노겐 분자를 더 높은 속도로 활성화합니다. 따라서 조직 플라스미노겐 활성화제의 작용은 혈전 섬유소에 의해 제한됩니다. 혈류에 들어가고,

쌀. 27-7.섬유소 용해제의 작용 메커니즘: tPA - 조직 플라스미노겐 활성화제; FDP - 피브리노겐 분해 산물; EC - 내피 세포; ? - 활성화; Θ - 용해
조직 활성화제는 특정 억제제와 결합하므로 혈액 내 순환하는 플라스미노겐에 거의 영향을 미치지 않으며 피브리노겐 수준을 덜 감소시킵니다.
조직 플라스미노겐 활성제의 재조합 제제는 임상 용도로 얻어졌습니다: 알테플라제(actilyse *) 및 테넥테플라제(메탈라이즈 *). 이 약물은 관상 동맥 혈전증으로 인한 급성 심근 경색 (처음 6-12 시간 동안 유효), 폐색전증의 경우 정맥 주사로 투여됩니다. 알테플라제는 혈액 내 순환하는 플라스미노겐에 거의 영향을 미치지 않음에도 불구하고, 사용 시 출혈성 합병증이 자주 발생합니다. 항원 특성이 없습니다. Tenecteplase는 혈전 섬유소에 대한 특이성을 증가시켰습니다.
유로키나아제는 신장 세포에서 생성되며 소변에서 발견됩니다. 신장에서는 단일 사슬 유로키나아제(프로우로키나아제)가 형성되며, 이는 플라스민의 영향으로 활성 형태인 이중 사슬 유로키나아제로 전환됩니다. 이중 사슬 유로키나아제는 플라스미노겐에 직접적인 활성화 효과가 있습니다(플라스미노겐과 복합체 형성이 필요하지 않음). 이중 사슬 유로키나제 제제는 인간 배아 신장 세포의 배양물에서 얻습니다. 급성 심근경색, 정맥 및 동맥 혈전증, 폐색전증에 사용됩니다. 정맥으로 투여됩니다. ME에 투여되었습니다. 조직 플라스미노겐 활성화제에 비해 유로키나제는 혈액 내에서 순환하는 플라스미노겐에 더 많이 작용하여, 결과적으로 혈액 내에서 생성된 플라스민이 피브리노겐을 분해시킵니다(그림 27-7 참조). 동시에 혈소판 응집이 감소하고 항응고 활성을 갖는 피브리노겐 분해 생성물이 형성됩니다. 주요 부작용은 출혈입니다. 항원 특성이 없습니다.
유로키나제보다 혈전 섬유소에 대해 더 큰 특이성을 나타내는 단일 사슬 유로키나제(프로로키나제)(ca p u p a z a *)의 재조합 제제가 얻어졌습니다.
27.3.2. 항섬유소용해제
항섬유소용해제는 부상, 수술, 출산, 출산 중 섬유소용해 시스템의 활동 증가로 인한 출혈을 멈추는 데 사용됩니다.
간 질환, 전립선염, 월경과다, 섬유소 용해제 과다 복용. 이러한 목적을 위해 플라스미노겐 활성화를 억제하거나 플라스민 억제제인 약물이 사용됩니다.
아미노카프로산은 플라스미노겐에 결합하여 플라스민으로의 전환을 방지합니다. 또한, 이는 플라스민이 피브린에 미치는 영향을 방해합니다. 약물은 경구 및 정맥 주사로 투여됩니다. 가능한 부작용: 동맥 저혈압, 서맥, 부정맥, 현기증, 메스꺼움, 설사. 아미노메틸벤조산(Ambene*, Pamba*)도 비슷한 효과를 갖습니다.
트라넥삼산(tranexam*, cyclocapron*)은 플라스미노겐 활성화를 억제합니다. 약물은 경구 및 정맥 주사로 투여됩니다. 아미노카프로산보다 더 효과적이며 더 오래 지속됩니다. 부작용으로는 소화불량 증상(식욕부진, 메스꺼움, 구토, 설사), 현기증, 졸음이 있습니다. 알레르기성 피부 반응이 가능합니다.
아프로티닌(Gordox*, Contrical*, Trasylol*, Ingitril*)은 플라스민 및 기타 단백질 분해 효소를 억제합니다. 약물은 정맥 내로 투여됩니다. 부작용: 동맥 저혈압, 빈맥, 메스꺼움, 구토, 알레르기 반응.
백혈구 및 적혈구에 비해 가장 작은 혈액 세포인 혈소판은 가장 중요한 기능을 수행합니다. 혈액 손실로부터 신체를 보호합니다. 혈소판 응집은 혈전 형성의 초기 단계인 세포가 서로 접착되는 과정입니다.
두 번째 단계는 손상된 혈관 벽에 혈소판이 부착되는 것입니다. 피브린 실, 기타 요소 및 새로운 부착 세포가 혈소판 덩어리 위에 쌓입니다. 그리하여 혈전은 혈관의 직경을 막아 출혈을 멈출 수 있는 크기로 성장하게 됩니다. 때로는 사람의 생명이 과정의 속도에 달려 있습니다.
혈액 응고 과정에서 혈소판 응집의 역할
혈액 응고는 여러 요인에 따라 달라집니다. 그 중 하나인 혈소판 응집은 건강한 신체에서 보호적 적응성을 갖고 있습니다. 세포는 출혈이 있는 혈관에서만 서로 달라붙습니다. 이 경우 프로세스는 긍정적인 역할을 합니다.
그러나 혈전 형성이 중요한 기관의 영양을 방해하기 때문에 바람직하지 않은 병리학 적 상태가 알려져 있습니다. 예를 들어, 심근경색, 뇌졸중, 주요 동맥의 혈전증이 있습니다. 혈소판의 응집 활동은 병리학적 변화의 측면을 취합니다. 다양한 약물의 도움으로 이에 맞서 싸워야 합니다.
좋은 혈소판 응집과 나쁜 혈소판 응집을 정량화할 실질적인 필요성이 있습니다. 이렇게 하려면 표준을 사용하고 편차를 구별해야 합니다.
정상성과 병리학을 결정하는 방법은 무엇입니까?
혈액검사로 특정인의 혈소판 응집능력을 알 수 있나요? 결국 연구를 수행하기 위해 정맥에서 혈액을 채취하고 그 순간부터 신체의 "명령"이 혈액 세포에 작용하지 않습니다. 이러한 유형의 분석을 "시험관 내(in vitro)"라고 하며 라틴어 "on glass, in a test tube(유리 위, 시험관 내)"를 문자 그대로 번역한 것입니다. 과학자들은 항상 인체에 가까운 조건에서 반응을 연구하려고 노력합니다. 이러한 방식으로 얻은 데이터만이 신뢰할 수 있는 것으로 간주되어 진단에 사용될 수 있습니다.
혈소판 능력은 유도된 응집에 의해 결정됩니다. 화학적 조성이 체내에 이물질이 아니고 혈전을 일으킬 수 있는 물질을 유도물질로 사용한다는 뜻이다. 혈관벽의 성분은 유도제로 사용됩니다: 아데노신 이인산(ADP), 리스토세틴(리스토마이신), 콜라겐, 세로토닌, 아라키돈산, 아드레날린.
자발적인 응집은 유도물질 없이 결정됩니다.
정량화 기술은 혈소판이 풍부한 혈장을 통과하는 광파를 기반으로 합니다. 응집 활성 정도는 응고 시작 전과 최대 결과를 얻은 후 플라즈마의 광밀도 차이로 연구됩니다. 처음 1분 동안의 집합 속도, 파도의 성격과 모양도 결정됩니다.
비율은 인덕터 물질과 농도에 따라 다릅니다.
ADP를 이용한 혈소판 응집은 일반적으로 콜라겐, 리스토마이신 및 아드레날린과 함께 처방되고 평가됩니다.
ADP 분석 기준은 30.7~77.7%입니다. 아드레날린에 의한 혈소판 응집량은 35%에서 92.5%까지 다양합니다. 콜라겐에 대한 연구에서 정상 수치는 46.4~93.1%로 간주됩니다.
분석 준비 규칙
혈액 응집력 검사를 받으려면 준비 규칙을 위반하면 검사가 부정확해진다는 점을 이해해야 합니다. 혈액에는 결과에 영향을 미치는 물질이 있습니다.
- 헌혈 일주일 전에는 모든 아스피린 약물, 디피리다몰, 인도메타신, 설파피리다진, 항우울제를 중단해야 합니다. 이러한 약물을 사용하면 혈전 형성이 억제(억제)됩니다. 복용을 중단할 수 없는 경우에는 실험실 기술자에게 알려야 합니다.
- 적어도 12시간 동안은 먹지 말아야 합니다. 특히 지방이 많은 음식을 섭취하면 결과에 영향을 미칩니다.
- 환자는 가능한 한 침착해야 하며 육체적인 일을 해서는 안 됩니다.
- 하루 전에는 커피, 술, 마늘을 음식에서 제외하고 담배를 피우지 마십시오.
- 활성 염증 과정이 있는 경우 분석이 수행되지 않습니다.
덩어리진 혈소판이 현미경으로 보입니다.
혈소판 응집에 대한 혈액 검사는 항응고제 치료가 필요한 경우 의사가 처방하고, 효과를 모니터링하고, 최적의 복용량을 선택하여 출혈 증가를 진단합니다.
결과 디코딩
한 번에 세 가지 표준 유도제를 사용하여 연구를 수행하고 필요한 경우 새로운 유도제를 추가하는 이유는 응고 인자 중 하나를 활성화하는 주요 메커니즘입니다. 예를 들어, 다른 인덕터와의 동역학이 없는 ADP에서 확인된 변경된 표준은 진단적 중요성을 갖습니다. 결과는 의사가 평가합니다.
혈소판 응집 감소는 다음으로 인해 발생할 수 있습니다.
- 항혈소판 요법의 성공적인 사용;
- 혈소판증이라고 불리는 질병 그룹.

집합분석장치
혈소판증의 역할
혈소판병증은 유전적이거나 다른 질병의 결과로 획득될 수 있습니다. 통계에 따르면 지구 인구의 최대 10%가 이러한 병리를 앓고 있다고 합니다. 이들 모두는 특정 물질의 축적으로 인한 혈소판 기능 장애와 관련이 있습니다.
그 결과 응고 및 혈전 형성이 일어나지 않아 작은 상처나 타박상에 출혈이 증가하게 된다(내출혈).
질병은 잇몸 출혈, 잦은 코피, 아이의 몸에 많은 타박상, 타박상으로 인한 관절 부종 등으로 이미 어린 시절에 나타납니다. 사춘기 동안 소녀들은 길고 무거운 월경을 시작합니다. 출혈은 빈혈 (빈혈)의 발생으로 이어집니다.
혈소판병증의 낮은 응집 능력은 바이러스 및 박테리아 감염, 약물 치료 및 물리 치료 절차에 의해 활성화될 수 있습니다.

코피의 80%는 혈소판증으로 인해 발생하고 20%는 ENT 기관의 질병으로 인해 발생합니다.
이차성 혈소판병증
만성 백혈병, 골수종에서는 증상이있는 (2 차) 혈소판 병증이 형성됩니다. 이 상태는 신부전(요독증)의 마지막 단계, 갑상선 기능 저하의 전형적인 증상입니다.
외과의사는 수술 중 출혈이 증가하면 혈소판병증에 직면하게 됩니다.
혈소판 응집의 증가는 다음과 같은 경우에 관찰됩니다.
- 광범위한 혈관 죽상경화증;
- 고혈압;
- 내부 장기의 경색;
- 복부 동맥의 혈전증;
- 뇌졸중;
- 진성 당뇨병
임신 중 집합체의 변화
임신 중 혈소판 응집은 정상 수치에서 벗어날 수 있습니다.
혈소판 생산이 불충분하거나 질적 구성이 위반되어 응집이 감소합니다. 이는 출혈과 타박상으로 나타납니다. 출산 중에는 대량 출혈의 가능성을 고려해야 합니다.
구토와 설사로 인한 체액 손실로 인해 중독증 동안 응집이 가장 자주 증가합니다. 혈중 농도가 증가하면 혈전 형성이 증가합니다. 이는 조기 유산으로 이어질 수 있습니다. 중등도의 과다집합은 임신 중에 정상적인 것으로 간주되며 태반 순환의 발달과 관련이 있습니다.
- 유산의 경우;
- 불임 치료;
- 피임약 복용 전과 복용 중;
- 계획된 임신 전에.
혈소판 응집 특성을 분석하면 위험을 식별하고, 질병 시 위험한 합병증을 예측하며, 신속한 예방 치료를 수행할 수 있습니다.
혈소판은 색이 없는 혈액 세포입니다. 그들은 신체에서 중요한 기능을 수행하여 혈액 손실로부터 신체를 보호합니다. 이 과정은 혈액 내 혈소판 응집이며 자체 표준 지표가 있습니다.
그것이 무엇인지 이해하려면 혈전 형성, 기존 표준 및 정상 값에서 벗어날 위험에 대한 아이디어가 필요합니다.
인체에서의 설명과 역할
조직 손상 후 혈소판이 손상된 혈관 벽에 부착됩니다. 결과적으로 세포는 서로 달라붙습니다. 시간이 지남에 따라 피브린 실, 새로 접착된 세포 및 기타 요소가 결과 덩어리에 추가됩니다.
이러한 배경에서 혈전이 자라서 크기가 커져 혈관이 막히고 출혈이 멈출 수 있습니다. 인간 생명의 보존이 때때로 그것에 달려 있기 때문에 그러한 과정의 속도는 매우 중요합니다.

혈액 응고는 다양한 요인의 영향을 받습니다. 그 중 하나가 집계입니다. 병리학적 상태가 없으면 보호 적응 기능을 수행합니다.
응집 특징은 손상된 혈관에만 세포를 접착시키는 것으로 구성됩니다. 이 경우 프로세스는 긍정적인 것으로 간주됩니다.
.jpg)
그러나 혈전증이 바람직하지 않은 상황이 있습니다. 예를 들어 뇌졸중이나 심근경색이 진단된 경우입니다.
이는 혈전 형성이 필수 기관에 필요한 물질의 정상적인 흐름을 방해한다는 사실로 설명됩니다.
이 경우 혈소판은 병리학적 과정의 측면을 취합니다.. 표준에서의 편차는 약물의 도움을 통해서만 처리될 수 있습니다.
정상 지표와 비정상 지표를 식별하기 위해서는 긍정 및 부정 집계에 대한 정량적 분석이 필요합니다.
종류
의료 행위에는 유형별로 특정 분류가 있습니다. 여기에는 다음이 포함됩니다.

- 중간 정도의 집계. 주로 임신 중에 진단됩니다. 이 상태는 태반 순환에 의해 유발될 수 있습니다.
- 자발적인 집계. 감지에는 인덕터가 필요하지 않습니다. 응집 활동을 감지하기 위해 혈액을 시험관에 붓고 특수 장치에 넣고 37도까지 가열합니다.
- 유도된 집계. 연구를 수행하기 위해 유도물질이 혈장에 추가됩니다. 이 경우 ADP, 콜라겐, 리스토마이신 및 아드레날린으로 응집이 발생합니다. 이 방법은 혈액액의 특정 병리를 진단하는 데 필요한 경우에 사용됩니다.
- 응집이 증가하면 혈전 형성이 촉진됩니다. 이 병리학적 상태의 특징적인 증상은 무감각과 부기입니다.
- 감소된 응집은 순환계 기능에 장애가 발생한 경우 가장 자주 감지됩니다. 혈소판 수가 감소하면 다양한 출혈이 유발됩니다. 월경주기 동안 공정한 성관계에서 발생합니다.
응집의 증가와 감소는 모두 인체 건강에 위험합니다. 그러므로 혈액 내 혈소판 수치를 정기적으로 모니터링해야 합니다.
지표 편차의 증상
과다 응집은 혈액 점도 증가와 흐름 속도 감소를 동반하여 모든 인간 시스템과 기관에 부정적인 영향을 미칩니다.
그러나 뚜렷한 응집이 정상적인 현상인 경우 병리학적 상태가 있으며 이는 응고 지표에 대한 지속적인 연구를 거부하는 이유로 간주되지 않습니다.
이러한 질병에는 다음이 포함됩니다.
- 혈압 증가;
- 당뇨병;
- 암;
- 혈관 병리학.
과다집합과 지원 부족을 시기 적절하게 감지하면 심장 마비, 뇌졸중 및 정맥 혈전증이 발생할 수 있습니다.
응집 지표의 감소는 혈종 형성으로 나타나는 내부 출혈을 포함하여 장기간의 출혈을 동반합니다.
표준은 무엇입니까
성인과 어린이의 혈소판 수치 기준은 약간 다릅니다. 지표의 최적 값은 아래 표에 나와 있습니다.
일반적인 집계 값에 대해 이야기하면 25-75%가 됩니다. 이 경우 혈소판은 편차 없이 서로 붙어 있어 인체에 위협이 되지 않습니다.
어떤 연구가 진행되고 있나요?
혈소판 응집 분석기는 전체 혈구 수를 측정하는 것입니다. 그러나 보다 정확한 결과를 제공하는 다른 연구도 있습니다. 주요 방법에는 다음 테스트가 포함됩니다.
.jpg)
- Lee-White에 따르면;
- 응고조영술.
그들의 본질은 응집을 억제하는 특수 물질이 혈액에 첨가된다는 사실에 있습니다..
이러한 구성 요소는 인체에 포함된 물질과 유사하여 혈전을 유발합니다. 이러한 구성요소를 인덕터라고 합니다.
분석 준비
분석을 수행하기 전에 특정 준비를 거쳐야 합니다. 결과를 최대한 정확하게 얻으려면 혈액액에 부정적인 영향을 미칠 수 있는 물질이 포함되어서는 안 됩니다.
준비 활동:
- 분석 일주일 전, 일부 아스피린 약물은 사용이 혈전 형성을 억제하므로 제외됩니다. 이러한 약물을 취소할 수 없는 경우 연구를 수행하는 실험실 기술자에게 알려야 합니다.
- 12시간 동안 음식 섭취를 중단해야 합니다. 특히 지방 함량이 높은 제품도 결과에 부정적인 영향을 미칩니다.
- 신체적, 정서적 스트레스를 피하십시오.
- 낮에는 알코올 음료, 커피, 마늘, 담배를 피우지 마십시오.
활성 염증 과정이 있으면 분석이 연기됩니다.
수행
혈액 샘플링은 아침 7시에서 10시 사이에 수행됩니다. 연구는 공복에서만 수행될 수 있습니다. 정수를 마시는 것이 허용됩니다.
지혈 검사를 실시하려면 정맥에서 혈액을 채취합니다. 이러한 목적으로 일회용 주사기가 사용됩니다. 그 후, 물질을 4% 구연산나트륨 용액이 들어 있는 응집계에 넣습니다. 그런 다음 용기를 여러 번 뒤집습니다. 그 후, 추가 검사를 위해 혈액 튜브를 실험실로 보냅니다.
결과 디코딩
연구 중에 사용된 물질을 고려하여 분석이 해독됩니다. 이를 위해 획득된 지표를 아래에 제시된 정상 값과 비교합니다.
표준에 비해 증가가 관찰되면 과다집합이 진단됩니다. 다음과 같은 병리학적 상태에서 발생할 수 있습니다.
.jpg)
- 백혈병;
- 위장관 또는 신장의 병리;
- 죽상경화증;
- 당뇨병;
- 고혈압;
- 부패;
- 림프육아종증.
편차가 아래쪽으로 향하면 저집합이 진단됩니다. 이는 혈액병리 또는 항혈소판제 치료로 인해 발생할 수 있습니다.
백분율은 인덕터 물질이 추가된 후 플라즈마의 빛 투과율 수준을 나타냅니다. 혈소판 수치가 낮으면 이 지표는 100%이고 높으면 0입니다.
임산부의 응집 특징
임신 중에는 표준 편차가 허용되며, 이 기간 동안의 범위는 30~60%입니다.
혈소판이 부족하거나 출혈과 타박상으로 나타나는 질적 구성에 변화가 있는 경우 분해가 관찰될 수 있습니다.
환자가 구토나 설사로 인해 체액이 많이 손실되는 중독증 중에 응집이 증가합니다. 혈중 농도가 증가하면 혈전 형성이 증가합니다. 이것은 조기 유산을 위협합니다.
값을 어떻게 정규화할 수 있나요?
혈액 응고 장애가 진단되면 즉시 병리학 적 상태를 제거하기위한 조치를 취해야합니다. 응집이 증가하면 혈전증이 발생할 수 있고, 감소하면 무겁고 위험한 출혈이 발생할 수 있습니다.
과다집합 발달의 초기 단계에서 전문가들은 혈액을 묽게 만드는 약물을 처방합니다. 일반 아스피린은 작업에 대처할 수 있습니다.
추가 검사 결과에 따라 다음과 같이 처방되는 경우가 많습니다.
.jpg)
- 진통제;
- 노보카인 차단;
- 혈관 확장을 촉진하는 약물;
- 빠른 응고를 방지하는 항응고제.
때로는 전통적인 방법이 그다지 효과적이지 않습니다. 그러한 치료는 주치의와 합의해야 함을 기억할 가치가 있습니다.
입증된 요리법은 다음과 같습니다.
- 끓인 물 200ml에 스위트 클로버 한 스푼을 넣고 30분간 우려냅니다. 준비된 혼합물을 하루에 여러 번 사용하십시오. 치료 과정은 한 달입니다.
- 생강과 녹차를 같은 양 (티스푼)으로 끓는 물 1.5 리터를 끓입니다. 계피를 조금 추가합니다. 1/4시간 동안 방치하고 하루 종일 복용하십시오.
- 매일 갓 짜낸 오렌지 주스를 마셔보세요. 호박과 같은 양으로 섞을 수 있습니다.
적절한 영양섭취를 유지하는 것도 중요합니다. 다이어트에는 다음이 포함되어야 합니다.
- 감귤류;
- 생강;
- 마늘;
- 빨간색과 녹색 야채;
- 해물.
혈액 응고가 좋지 않은 경우 약을 복용해서는 안됩니다. 혈액액을 묽게 만드는 것. 과정 과정이 고급 형태를 얻은 경우 치료 조치는 고정 조건에서만 수행됩니다.
다음 약물이 처방됩니다.

- 이모신트;
- 아미노카프로산 및 트라넥삼산;
- ATP 주입;
식단에는 메밀죽, 달걀, 사탕무, 당근, 석류, 쇠고기 간, 붉은 고기가 포함되어야 합니다.
혈액을 정상적인 상태로 유지하려면 음주 요법을 엄격하게 준수해야합니다. 하루에 최소 1.5 리터의 깨끗한 물이 표준으로 간주됩니다. 음식은 신선하고 균형이 잡혀야 합니다.
영양 규칙을 준수하는 것은 인체의 많은 질병을 예방하는 것입니다. 신체 활동도 마찬가지로 중요한 역할을 합니다. 그들은 신체를 강화할뿐만 아니라 모든 내부 과정을 정상화하는 데 도움이됩니다.
집계 지표의 편차를 적시에 진단하면 많은 질병과 합병증을 예방할 수 있습니다. 혈소판 응집 수준을 정기적으로 모니터링해야 합니다.
혈소판은 혈액 응고를 담당하는 작은 혈액 세포입니다. 출혈이 발생하면 혈액 손실을 막는 데 도움이 됩니다.
상처가 생기면 혈소판이 상처 부위로 이동합니다. 여기서 그들은 손상된 혈관의 벽에 부착되어 출혈이 멈춥니다. 이 과정을 혈소판 응집이라고 합니다.
혈소판 응집은 혈액 세포가 서로 접착되어 손상된 혈관 벽에 고정되는 과정입니다. 이렇게 하면 출혈이 멈춥니다. 그러나 이러한 과정은 신체에 위험할 수도 있습니다. 이 경우 혈전이 형성되어 어떤 상황에서는 심장 마비와 뇌졸중을 일으킬 수 있습니다. 이는 혈소판이 과도하게 활성화되어 응집이 너무 빨리 일어나는 경우 발생할 수 있습니다.
또한 느린 과정은 신체에 좋은 것을 약속하지 않습니다. 이 경우 혈소판 부착이 느려 혈액 응고 불량이 발생할 수 있습니다. 이 병리학은 빈혈을 유발합니다. 혈액응고가 좋지 않으면 출혈을 멈추기가 어려워 건강에 문제가 생기고 심지어 사망에 이를 수도 있다. 이런 일이 발생하지 않도록 하려면 혈액 내 혈소판 수준과 서로 달라붙는 능력을 모니터링해야 합니다.
임신 중 혈소판 응집 과정
 임신 중에 혈소판 응집이 정상적으로 진행되는 것이 매우 중요합니다. 과정이 너무 느리게 진행되면 출산 중이나 산후 기간에 자궁 출혈이 발생하여 여성이 사망할 수 있습니다. 또한, 임신 중에 혈소판 응집이 빠르게 발생하면 혈전이 형성될 수 있으며, 이로 인해 임신 중 어느 단계에서든 혈소판 응집이 중단될 수 있습니다.
임신 중에 혈소판 응집이 정상적으로 진행되는 것이 매우 중요합니다. 과정이 너무 느리게 진행되면 출산 중이나 산후 기간에 자궁 출혈이 발생하여 여성이 사망할 수 있습니다. 또한, 임신 중에 혈소판 응집이 빠르게 발생하면 혈전이 형성될 수 있으며, 이로 인해 임신 중 어느 단계에서든 혈소판 응집이 중단될 수 있습니다.
미리 임신 계획을 세우고 건강을 관리한다면 이런 상황을 피할 수 있습니다. 임신 전부터 혈소판의 상태를 파악하고, 필요한 경우 상황을 바로잡기 위한 조치를 취하는 것이 필요합니다. 임신을 계획하지 않은 경우 초기 단계에 등록하면 응집 병리를 피할 수 있습니다. 그런 다음 의사는 필요한 검사를 처방하고 혈소판의 병리학 적 상태가 발견되면 제거하는 데 도움을 줄 것입니다.
혈액 내 정상적인 혈소판 수
혈소판 수치의 상태를 알기 위해서는 정상 수치에 대한 아이디어가 필요합니다.
집계율에 대해 이야기하면 25-75%입니다. 이 경우 혈소판 접착 과정이 잘 진행되며 건강에 해를 끼치 지 않습니다.
표준에서 벗어난 것이 관찰되면 상황을 수정하는 데 도움이 되는 적절한 치료가 처방됩니다.혈소판 응집에 대한 혈액 검사
유도응집이라 불리는 혈액 검사는 혈소판 상태를 연구하는 데 도움이 됩니다. 이 경우 환자의 정맥에서 혈액을 채취하여 특수 물질과 혼합합니다. 이러한 물질은 응집 과정에 참여하는 신체 세포의 구성과 유사한 구성을 가지고 있습니다. 다음 물질은 인덕터로 가장 자주 사용됩니다.
- 아데노신 이인산염(ADP);
- 콜라겐;
- 세로토닌;
- 리스토세틴;
- 아드레날린;
- 아라키돈산.
가장 일반적인 절차는 ADP를 이용한 혈소판 응집입니다. 연구를 수행하려면 특별한 장치가 사용됩니다. 혈소판 응집 분석기라고 합니다. 그것의 도움으로 혈액이 응고되기 전과 이 과정이 완료된 후에 광파가 혈액을 통과합니다. 그런 다음 결과가 평가됩니다.
테스트 준비
 결과를 최대한 정확하게 얻으려면 혈액 검사를 받을 때 다음 규칙을 따라야 합니다.
결과를 최대한 정확하게 얻으려면 혈액 검사를 받을 때 다음 규칙을 따라야 합니다.
- 연구는 공복에 수행됩니다. 이 경우 검사 12시간 전부터 식사를 중단해야 합니다. 이 경우 깨끗한 정수물을 마실 수 있습니다.
- 검사 7일 전부터 특정 약물에 대한 약물 치료를 중단해야 합니다. 이것이 가능하지 않은 경우 분석을 수행하는 의사에게 알려야 합니다.
- 분석 며칠 전에는 스트레스가 많은 상황과 신체 활동을 피해야 합니다.
- 커피, 흡연, 음주, 마늘 섭취는 24시간 전부터 중단해야 합니다.
- 신체에서 염증 과정이 발생하면 연구를 수행할 수 없습니다.
분석에 대한 적응증
 귀하는 수시로 귀하의 주도로 혈소판 응집 검사를 받을 수 있습니다.
귀하는 수시로 귀하의 주도로 혈소판 응집 검사를 받을 수 있습니다. 유도 응집 분석 결과 해석
지표의 해석은 연구가 수행된 수단에 따라 달라집니다. 이를 위해 데이터를 표준과 비교합니다.
결과가 정상에서 벗어나면 혈소판 응집 증가가 진단됩니다. 이 상태는 다음과 같은 경우에 발생합니다. 
- 고혈압;
- 죽상경화증;
- 백혈병;
- 진성 당뇨병;
- 위장관 또는 신장의 종양성 질환;
- 림프육아종증;
- 부패;
- 비장의 수술적 제거.
혈소판 응집이 증가하면 심장 마비, 뇌졸중, 혈전증 및 혈전에 의한 혈관 막힘으로 인한 사망이 발생할 수 있습니다.
결과가 표준에서 벗어나 감소하는 방향으로 벗어나면 혈전증 집합이 감소한 것으로 진단됩니다. 이것은 ~ 때문이다:
- 혈액질환;
- 혈소판증;
- 항혈소판제 사용.
응집이 감소하면 용기가 취약해집니다. 또한, 출혈을 멈추는 과정이 어려워 사망에 이를 수도 있다.
집계 프로세스를 줄이는 수단
일부 에이전트는 집계 프로세스를 억제합니다. 이러한 약물에는 항혈소판제가 포함됩니다. 혈소판 응집 억제제에는 아세틸살리실산, 이부스트린, 미크리스틴 등과 같은 약물이 포함됩니다. 이러한 약물은 특정 질병의 치료를 위해 처방됩니다. 그러나 응집 과정이 표준에서 크게 벗어나는 경우 억제제 약물은 그러한 결과를 초래하지 않는 다른 약물로 대체되어야 합니다. 이것이 가능하지 않은 경우 의사는 응집을 촉진하는 특수 약물을 처방할 수 있습니다.
집계가 증가하거나 감소하면 모두 심각한 결과를 초래할 수 있습니다. 그러므로 그러한 상황은 무시할 수 없습니다. 이런 경우에는 의사와 상담하여 적절한 치료를 처방해야 합니다.