Функциональные участки трнк. Строение и функции трнк, особенности аминокислотной активации
70-90Н | вторичная стр-ра- клеверный лист | CCA 3" const для всех tRNA |к концевому аденозину присоед акта |
наличие тимина, псевдоуридина-пси, дигироуридина ДГУ в D-петле - защита от рибонуклеаз? долгоживущие | Разнообразие первичных структур tРНК - 61+1 - по кол-ву кодонов + формилметиониновая tРНК, у кот антикодон такой же, как у метиониновой tРНК. Разнообразие третичных структур - 20 (по кол-ву аминокислот) | рекогниция - образование ковалентной связи м-у tРНК и актой | аминоацил-тРНК-синтетазы присоединяют акты к тРНК
Функция тРНК заключается в переносе аминокислот из цитоплазмы в рибосомы, в которых происходит синтез белков.
тРНК связывающие одну аминокислоту называются изоакцепторными.
Всего в клетке одновременно существует 64 различных тРНК.
Каждая тРНК спаривается только со своим кодоном.
Каждая тРНК распознает свой собственный кодон без участия аминокислоты. Связавшиеся с тРНК аминокислоты химически модифицировали, после чего анализировали получившийся полипептид, который содержал модифицированную аминокислоту. Цистеинил-тРНКCys (R=CH2-SH) восстанавливали до аланил-тРНКCys (R=CH3).
Большинство тРНК, не зависимо от их нуклеотидной последовательности, имеют вторичную структуру в форме клеверного листа из-за наличия в ней трех шпилек.
Особенности структуры тРНК
На 3"-конце молекулы всегда находятся четыре неспаренных нуклеотида, причем три из них – это обязательно ССА. 5"- и 3"-концы цепи РНК образуют акцепторный стебель. Цепи удерживают-ся вместе благодаря комплементарному спарива-нию семи нуклеотидов 5"-конца с семью нуклеотида-ми, находящимися вблизи 3"-конца. 2. У всех моле-кул имеется шпилька T?C, обозначаемая так пото-му, что она содержит два необычных остатка: рибо-тимидин (Т) и псевдоуридин (?). Шпилька состоит из двухцепочечного стебля из пяти спаренных осно- ваний, включая пару G-C, и петли длиной семь нуклеотидов. Тринуклеотид Т?С всегда расположен
в одном и том же месте петли. 3. В антикодоновой шпильке стебель всегда представлен семью спарен-
ными основаниями. Триплет, комплементарный родственному кодону,– антикодон – находится в пет-
ле, состоящей из семи нуклеотидов. С 5"-конца антикодон фланкируют инвариантный остаток ура-
цила и модифицированный цитозин, а к его 3"-концу примыкает модифицированный пурин, как правило
аденин. 4. Еще одна шпилька состоит из стебля длиной три-четыре пары нуклеотидов и петли варь-
ирующего размера, часто содержащей урацил в вос-становленной форме – дигидроурацил (DU). Наиболее сильно варьируют нуклеотидные по-следовательности стеблей, число нуклеотидов меж-ду антикодоновым стеблем и стеблем Т?С (вариа-бельная петля), а также размер петли и локализация остатков дигидроурацила в DU-петле.
[Сингер, 1998].
Третичная структура тРНК
L-образная структура.
Присоединение аминокислот к тРНК
Для того чтобы аминокислота могла образовывать полипептидную цепь она должна присоединиться к тРНК с помощью фермента аминоацил-тРНК-синтетазы. Этот фермент образует ковалентную связь между карбоксильной группой аминокислоты и гидроксильной группой рибозы на 3’-конце тРНК при участии АТФ. Аминоацил-тРНК-синтетаза узнает специфический кодон не из-за наличия антикодона на тРНК, а по наличию специфического сайта узнавания на тРНК.
Всего в клетке имеется 21 различных аминоацил-тРНК-синтетаз.
Присоединение происходит в две стадии:
1. Карбоксильная группа аминокислоты присоединяется к а-фосфату АТФ. Полученный нестабильный аминоацил-аденилат стабилизируется связываясь с ферментом.
2. Перенос аминоацильной группы аминоацил-аденилата на 2’ или 3’-OH-группу концевой рибозы тРНК
Некоторые аминоацил-тРНК-синтетазы состоят из одной полипептидной цепи, другие – из двух или четырех идентичных цепей, каждая молекулярной массой от 35 до 115 кДа. Некоторые димерные и тетрамерные ферменты состоят из субъединиц двух типов. Четкой корреляции между размером молекулы фермента или характером его субъединичной структуры и специфичностью не существует.
Специфичность фермента определяется его прочным связыванием с акцепторным концом тРНК, DU-участком и вариабельной петлей. Некоторые ферменты, по-видимому, не распознают антикодоновый триплет и катализируют реакцию аминоацетилирования даже при измененном антикодоне. Однако отдельные ферменты проявляют пониженную активность по отношению к таким модифицированным тРНК и при замене антикодона присоединяют не ту аминокислоту.
70-90н | вторичная стр-ра- клеверный лист | CCA 3" const для всех tRNA |к концевому аденозину присоед акта |
наличие тимина, псевдоуридина-пси, дигироуридина ДГУ в D-петле - защита от рибонуклеаз? долгоживущие | Разнообразие первичных структур tРНК - 61+1 - по кол-ву кодонов + формилметиониновая tРНК, у кот антикодон такой же, как у метиониновой tРНК. Разнообразие третичных структур - 20 (по кол-ву аминокислот)
Имеются два вида тРНК связывающие метионин тРНКFMet и тРНКMMet у прокариот и, тРНКIMetи тРНКMMet - у эукариот. К каждой тРНК добавляется метионин с помощью соответствующих аминоацил-тРНК-синтетез. метионин присоединенный к тРНКFMet и тРНКIMet формилируется ферментом метионил-тРНК-трансформилазой до Fmet-тРНКFMet. тРНК нагруженные формилметионином узнают инициаторный кодон AUG.
Литература:
К сожалению, список литературы отсутствует.
Учебника. Несмотря на то, что тРНК значительно мельче, рассказ о ее строении, особенностях и функционировании заслуживает отдельной главы.
Итак, тРНК является «адаптером», который одним своим концом распознает трехбуквенную последовательность генетического кода, сопоставляя ей единственную соответствующую аминокислоту, закрепленную на другом конце тРНК. На прикасающемся к матричной РНК конце транспортной РНК находятся 3 нуклеотида, образующие антикодон . Только в случае комплементарности антикодона к участку мРНК транспортная РНК может к ней присоединиться. Но даже в этом случае тРНК не может присоединиться к мРНК самостоятельно, ей необходима помощь рибосомы, которая является местом их взаимодействия, а также активным участником трансляции. Например, именно рибосома создает связи между принесенными тРНК аминокислотами, формируя протеиновую цепочку.
Особенности строения тРНК обусловлены генетическим кодом, то есть правилами построения протеина по гену, которые транспортная РНК прочитывает. Этот код работает в каждом из живущих на Земле существ: создание вируса записано теми же трехбуквенными кодонами, которые используются для записи «инструкции по сборке» дельфина. Экспериментально проверено, что гены одного живого существа, помещенные в клетку другого, отлично копируются и транслируются в протеины, не отличимые от воспроизводящихся в клетках хозяина генов. На единообразии генетического кода основано производство колониями модифицированных кишечных палочек инсулина и многих других человеческих ферментов, использующихся в качестве лекарств для людей, чей организм не способен их вырабатывать, или вырабатывает недостаточно. Несмотря на очевидную разницу между человеком и кишечной палочкой, протеины человека легко создаются по его чертежам с помощью копировального аппарата кишечной палочки. Неудивительно, что транспортные РНК разных существ отличаются весьма незначительно.

Каждый кодон из этого списка, за исключением трех стоп-кодонов , дающих сигнал о завершении трансляции, должен распознаваться транспортной РНК. Узнавание осуществляется с помощью присоединения к матричной РНК антикодона, который может связаться только с одним кодоном из списка, поэтому тРНК может распознать только один кодон. А значит, в клетке существует как минимум 61 вид этих молекул. На самом деле их даже больше, так как в некоторых ситуациях для считывания матричной РНК недостаточно просто иметь нужный антикодон: требуется выполнение других условий, в соответствии с которыми создается особая, модифицированная тРНК.
На первый взгляд, такое разнообразие тРНК должно существенно осложнять процесс трансляции: ведь каждая из этих молекул будет проверять подставленный ей рибосомой кодон матричной РНК на соответствие своему антикодону — казалось бы, столько бессмысленной механической работы, столько впустую затраченного времени и энергии. Но в результате эволюции сформировались также и клеточные механизмы, предотвращающие эту проблему. Например, количество тРНК каждого вида в клетке соответствует тому, как часто аминокислота, несомая этим видом, встречается в строящихся протеинах. Есть аминокислоты, которые редко используются клеткой, а есть часто использующиеся, и если бы количество несущих их тРНК было одинаковым, это значительно осложнило бы сборку протеинов. Поэтому «редких» аминокислот и соответствующих им тРНК в клетке мало, а часто встречающиеся производятся в большом количестве.

При таком разнообразии молекул тРНК все они очень похожи, поэтому рассматривая их строение и функции, в основном мы будем изучать общие для всех видов черты. Если взглянуть на трехмерную схему тРНК, она кажется плотным нагромождением атомов. Кажется невероятным, что эта сложнозакрученная молекула получена в результате сворачивания длинной цепи нуклеотидов, но именно так она и образуется.
Можно проследить этапы ее образования, начиная с самого первого: составления РНК-полимеразой последовательности нуклеотидов в соответствии с геном, содержащим информацию о данной транспортной РНК. Порядок следования друг за другом этих нуклеотидов и их количество называется первичной структурой тРНК . Получается, что именно первичная структура тРНК закодирована в гене, прочитываемом РНК-полимеразой. Вообще первичной структурой называют последовательность сравнительно простых молекул одного типа, из которых составлена более сложная, свернутая молекула-полимер. Например, первичной структурой молекулы протеина является простая последовательность составляющих ее аминокислот.

Любая цепочка нуклеотидов не может находиться в клетке в развернутом состоянии, просто вытянувшись в линию. На краях нуклеотидов находится слишком много положительно и отрицательно заряженных частей, которые легко образуют водородные связи друг с другом. Про то, как такие же связи образуются между нуклеотидами двух молекул ДНК, соединяя их в двойную спираль, рассказано в , а за подробностями о водородных связях можно залезть в . Водородные связи менее прочны, чем связи между атомами в молекулах, но их достаточно для того, чтобы причудливо скрутить нить тРНК и держать ее в таком положении. Сначала эти связи образуются только между некоторыми нуклеотидами, сворачивая тРНК в фигуру наподобие листа клевера. Результат этого начального свертывания называют вторичной структурой тРНК . На схеме слева видно, что только некоторые нуклеотиды связываются водородными связями, а другие остаются неспаренными, образуя кольца и петли. Различия между вторичной структурой разных видов тРНК обусловлены различиями в их первичной структуре. Проявляется это в разной длине «клеверных листов» или «стебелька» за счет разной длины исходной цепочки нуклеотидов.
Другим отличием первичной структуры разных тРНК является то, что только в некоторых позициях у них стоят одни и те же нуклеотиды (на схеме вверху они отмечены первыми буквами своих названий), большинство же нуклеотидов у разных тРНК отличаются друг от друга. Приведенная выше схема является общей для всех тРНК, поэтому отличающиеся нуклеотиды отмечены числами.
Главными функциональными частями тРНК являются:
=) антикодон , то есть последовательность нуклеотидов, комплементарная единственному кодону матричной РНК, находящаяся на антикодоновой шпильке
=) акцепторный конец , к которому может быть присоединена аминокислота. Он находится с противоположной стороны от антикодоновой шпильки.
В реальности ни одна тРНК не выглядит так, как на схеме вторичной структуры, потому что для ее образования соединились между собой только некоторые нуклеотиды, а остальные остались неспаренными. За счет образования водородных связей между нуклеотидами из разных частей листа клевера он сворачивается дальше в гораздо более сложную третичную структуру в форме буквы L. Ты можешь понять, как именно изогнулись разные части вторичной структуры для образования третичной, сопоставив цвета на их схемах ниже. Антикодоновая шпилька, обозначенная голубым и серым цветами, остается внизу (стоит помнить, что это «внизу» является условным: удобно изображать тРНК именно в такой пространственной ориентации в схемах трансляции белка), а акцепторный конец (желтого цвета) загнут в сторону.

Именно так выглядит тРНК, готовая к присоединению аминокислоты. Самостоятельно соединиться с аминокислотой тРНК не способна, для этого требуется участие специального фермента: аминоацил-тРНК-синтетазы . Число видов синтетаз в клетке совпадает с числом видов тРНК.
Единообразие формы всех видов тРНК необходимо для того, чтобы рибосома могла распознавать любую из них, способствовать их стыковке с мРНК, перемещать внутри себя из одного сайта в другой. Если бы разные виды тРНК существенно отличались друг от друга, это чрезвычайно затруднило бы работу рибосомы, критически снизив скорость синтеза протеина. Естественный отбор таким образом направлен на то, чтобы сделать тРНК похожими друг на друга. Но вместе с тем есть и другой фактор, требующий существования заметных различий между разными видами тРНК: ведь необходимо распознать каждый вид и прикрепить к нему единственную, соответствующую ему аминокислоту. Очевидно, что эти отличия должны быть хоть и заметными, но не слишком существенными, так что работа по распознаванию видов тРНК превращается в ювелирный процесс. И именно его осуществляют аминоацил-тРНК-синтетазы: каждая из них может связаться только с одной из 20 аминокислот и присоединить ее именно к тем видам тРНК, которые этой аминокислоте соответствуют. Из таблицы с генетическим кодом видно, что каждая аминокислота кодируется несколькими последовательностями нуклеотидов, поэтому например все четыре тРНК с антикодонами CGA, CGG, CGU и CGC будут распознаваться одной и той же синтетазой, присоединяющей к ним аланин. Такие обрабатываемые одной синтетазой тРНК называются родственными .
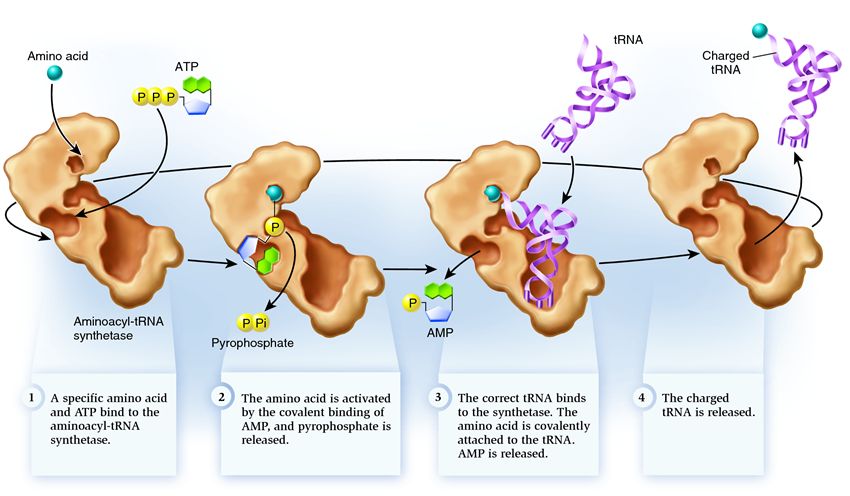
Синтетаза принадлежит к группе ферментов, чья функция заключается в связывании с отдельно существующими молекулами и объединении их в одну:
1 . синтетаза соединяет аминокислоту и молекулу АТФ. От АТФ отрываются две фосфатные группы, высвобождая энергию, необходимую для следующих действий. Остающийся от разрушенной молекулы аденозинмонофосфат (АМФ) присоединяется к аминокислоте, подготовив ее к соединению с акцепторной шпилькой.
2 . синтетаза присоединяет к себе одну из соответствующих этой аминокислоте родственных тРНК.

На этом этапе происходит проверка соответствия транспортной РНК синтетазе. Существует несколько способов распознавания, и в каждой синтетазе имеется уникальная их комбинация. Во взаимодействии синтетазы и тРНК участвует как минимум один нуклеотид антикодона. Так же требует проверки акцепторная шпилька: определяется наличие на ней специфических нуклеотидов, общих для соответствующих нужной аминокислоте родственных тРНК. Нуклеотиды других частей тРНК тоже могут участвовать в проверке соответствия, соединяясь с определенными местами синтетазы. Неправильная тРНК может совпадать с нужной по каким-то параметрам, но из-за неполного совпадения будет присоединяться к синтетазе медленно и неплотно, легко отваливаясь. А правильная тРНК прилипнет к синтетазе быстро и крепко, в результате чего структура синтетазы меняется, запуская процесс аминоацилирования , то есть присоединения аминокислоты к тРНК.

3 . аминоацилирование заключается в замене присоединенной к аминокислоте молекулы АМФ на молекулу тРНК. После этой замены АМФ покидает синтетазу, а тРНК задерживается для последней проверки аминокислоты. Если присоединенная аминокислота опознается как неправильная, она будет отсоединена от тРНК, место аминокислоты в синтетазе опустеет, и туда сможет присоединиться другая молекула. Новая аминокислота пройдет стадии соединения с АТФ и тРНК, и тоже подвергнется проверке. Если же ошибок допущено не было, заряженная аминокислотой тРНК освобождается: она готова сыграть свою роль в трансляции протеина. А синтетаза готова присоединить новые аминокислоту и тРНК, и цикл начнется заново.
От правильности работы аминоацил-тРНК-синтетазы зависит многое: если на этом этапе произойдет сбой, то к тРНК будет присоединена неверная аминокислота. И она будет встроена в растущий на рибосоме протеин, ведь тРНК и рибосома не имеют функции проверки соответствия кодона и аминокислоты. Последствия ошибки могут быть незначительными или катастрофическими, и в ходе естественного отбора существа с ферментами, не имеющими функции таких проверок, были вытеснены более приспособленными, имеющими различные варианты установления соответствия между аминокислотой и тРНК. Поэтому в современных клетках синтетаза соединяется с неверной аминокислотой в среднем в одном случае из 50 тысяч, а с ошибочной тРНК всего лишь один раз на 100 тысяч присоединений.

Некоторые аминокислоты отличаются друг от друга всего лишь несколькими атомами. Если взглянуть на их схемы, становится очевидно, что вероятность перепутать аргинин с аланином гораздо меньше, чем принять изолейцин за лейцин или валин. Поэтому у каждой синтетазы, связывающейся с одной из похожих друг на друга аминокислот, имеются дополнительные механизмы проверки. Вот пример такого приспособления у изолейцин-тРНК-синтетазы:

У каждой синтетазы существует синтетический центр , в котором происходит присоединение аминокислоты к тРНК. Акцепторная шпилька тРНК, захваченной синтетазой, попадает именно туда, так же как и аминокислота, готовая вступить в реакцию с ней. Работа некоторых синтетаз заканчивается сразу после соединения аминокислоты и тРНК. Но Ile-тРНК-синтетаза имеет повышенную вероятность совершения ошибок из-за существования других похожих на изолейцин аминокислот. Поэтому у нее есть еще и коррекционный центр : из названия понятно, какую роль он играет в процессе соединения тРНК и аминокислоты. На рисунке справа видно, что положение конца акцепторной шпильки тРНК в синтетическом центре Ile-тРНК-синтетазы придает этой шпильке неестественный изгиб. Тем не менее, синтетаза удерживает тРНК в таком положении до момента присоединения к ней аминокислоты. После того, как это соединение произошло, необходимость нахождения акцепторной шпильки в синтетическом центре исчерпана, и тРНК распрямляется, попадая своим концом с насаженной на него аминокислотой в коррекционный центр.

Конечно же, синтетический центр тоже играет свою роль в отсеивании не подходящих синтетазе аминокислот. Чтобы попасть в него, молекуле необходимо отвечать ряду условий, в том числе иметь подходящий размер. Несмотря на то, что лейцин и изолейцин содержат одно и то же количество атомов, из-за различий в пространственной структуре лейцин крупнее. Поэтому он не может проникнуть в синтетический центр, размеры которого соответствуют более компактному изолейцину, и просто отскакивает от Ile-тРНК-синтетазы.
Но вот валин, являющийся самой мелкой из этих трех молекул со схожей атомной структурой, легко занимает место изолейцина в синтетическом центре, и синтетаза присоединяет его к тРНК. Именно в этом случае вступает в игру коррекционный центр синтетазы. Если распрямляющаяся акцепторная шпилька заряжена верно и несет изолейцин, то она не может протиснуться внутрь коррекционного центра: он просто слишком мал для этой молекулы. Таким образом, распрямившуюся тРНК больше ничто не держит, и она отсоединяется от синтетазы. А вот если к тРНК присоединен валин, он проскальзывает в коррекционный центр, тем самым удерживая соединенную с ним тРНК в синтетазе. Такое излишне длительное нахождение тРНК внутри является для синтетазы сигналом ошибки, меняя ее пространственную конфигурацию. В результате этого:
=) валин отсоединяется от тРНК и удаляется из синтетазы
=) акцепторная шпилька возвращается в синтетический центр, ожидая присоединения к аминокислоте
=) синтетаза связывается с новой аминокислотой, «заряжает» ей тРНК и снова проверяет, был ли использован для этого именно изолейцин.
Схожий механизм двойного распознавания используется и другими синтетазами.
Физико-химические свойства ДНК
Различные факторы, нарушающие водородные связи (повышение температуры выше 80 С, изменение рН и ионной силы, действие мочевины и др.), вызывают денатурацию ДНК, т.е. изменение пространственного расположения цепей ДНК без разрыва ковалентных связей. Двойная спираль ДНК при денатурации полностью или частично разделяется на составляющие цепи. Денатурация ДНК сопровождается усилением оптического поглощения в УФ области пуриновых и пиримидиновых оснований. Это явление называют гиперхромным эффектом . При денатурации уменьшается также высокая вязкость, присущая растворам нативной ДНК. При восстановлении первоначальной двухспиральной структуры ДНК, в результате ренатурации, поглощение при 260 нм азотистыми основаниями вследствие их «экранированности» уменьшается. Это явление называют гипохромным эффектом .
«Расплетение» каждой ДНК на составляющие ее цепи осуществляется в пределах определенного интервала температур. Средняя точка этого интервала называется температурой плавления. Температура плавления ДНК зависит в стандартных условиях (определенная рН и ионная сила) от соотношения азотистых оснований. Г-Ц пары, содержащие три водородные связи, более прочные, поэтому, чем больше в ДНК содержание Г-Ц пар, тем выше температура плавления.
Функции ДНК . В последовательности нуклеотидов молекулах ДНК закодирована генетическая информация. Основными функциями ДНК являются, во-первых, обеспечение воспроизводства самой себя в ряду клеточных поколений и поколений организмов, во-вторых, обеспечение синтеза белков. Эти функции обусловлены тем, что молекулы ДНК служат матрицей в первом случае для репликации, т.е. копирования информации в дочерних молекулах ДНК, во втором – для транскрипции, т.е. для перекодирования информации в структуру РНК.
Рис. 5 Кривая плавления (денатурации ДНК)
Комплементарные цепи ДНК, разделенные при денатурации, при определенных условиях могут вновь соединиться в двойную спираль. Этот процесс называется РЕНАТУРАЦИЕЙ. Если денатурация произошла не полностью и хотя бы несколько оснований не утратили взаимодействия водородными связями, ренатурация протекает очень быстро.
В цитоплазме клеток содержатся три основных функциональных вида РНК. Это матричные РНК – мРНК, выполняющие функции матриц белкового синтеза, рибосомные РНК – рРНК, выполняющие роль структурных компонентов рибосом, и транспортные РНК – тРНК, участвующие в трансляции (переводе) информации мРНК в последовательность аминокислот в белке.
В таблице 2 представлены отличия ДНК от РНК по строению, локализации в клетке и функциям.
Таблица 2 Отличия ДНК от РНК
Транспортная РНК, тРНК -рибонуклеиновая кислота, функцией которой является транспортировка АК к месту синтеза белка. Имеет типичную длину от 73 до 93 нуклеотидов и размеры около 5 нм. тРНК также принимают непосредственное участие в наращивании полипептидной цепи, присоединяясь - будучи в комплексе с аминокислотой - к кодону мРНК и обеспечивая необходимую для образования новой пептидной связи конформацию комплекса. Для каждой аминокислоты существует своя тРНК. тРНК является одноцепочечной РНК, однако в функциональной форме имеет конформацию «клеверного листа». АК ковалентно присоединяется к 3"-концу молекулы с помощью специфичного для каждого типа тРНК фермента аминоацил-тРНК-синтетазы. На участке C находится антикодон, соответствующий АК-те. тРНК синтезируются обычной РНК-полимеразой в случае прокариот и РНК-полимеразой III в случае эукариот. Транскрипты генов тРНК подвергаются многостадийному процессингу, который приводит к формированию типичной для тРНК пространственной структуры.
Процессинг тРНК включает 5 ключевых этапов:
удаление 5"-лидерной нуклеотидной последовательности;
удаление 3"-концевой последовательности;
добавление последовательности CCA на 3"-конец;
вырезание интронов (у эукариот и архей);
модификации отдельных нуклеотидов.
Транспорт тРНК осущ-ся по Ran-зависимому пути при участии транспортного фактора экспортина t, кот.распознаёт характерную вторичную и третич.стр-ру зрелой тРНК: короткие двуспиральные участки и правильно процессированные 5"- и 3"-концы. Такой механизм обеспечивает экспорт из ядра только зрелых тРНК.
62. Трансляция – узнавание кодона мРНК
Трансляция – это осуществляемый рибосомами синтез белка из аминокислот на матрице мРНК (или и РНК). Cоставляющие элементы процесса трансляции: аминокислоты, тРНК, рибосомы, мРНК, ферменты для аминоацилирования тРНК, белковые факторы трансляции (белковые факторы инициации, элонгации, терминации - специфические внерибосомные белки, необходимые для процессов трансляции), источники энергии АТФ и ГТФ, ионы магния (стабилизируют структуру рибосом). В синтезе белка участвует 20 аминокислот. Чтобы аминокислота «узнала» свое место в будущей полипепетидной цепи, она должна связаться с транспортной РНК (тРНК), выполняющей адапторную функцию. Затем тРНК, связавшаяся с аминокислотой «узнает» соответствующий кодон на мРНК. Узнавание кодона мРНК:
Взаимодействие кодон - антикодон основано на принципах комплементарности и антипараллельности:
3’----Ц - Г- А*------5’ Антикодон тРНК
5’-----Г- Ц- У*------3’ Кодон мРНК
Гипотеза качания (wobble) была предложена Ф. Криком:
3′- основание кодона мРНК имеет нестрогое спаривание с 5′- основанием антикодона тРНК: например, У (мРНК) может взаимодействовать с А и Г (тРНК)
Некоторые тРНК могут спариваться с более, чем одним кодоном.
63. Характеристика составляющих элементов процесса трансляции. Трансляция (translatio-перевод)- процесс синтеза белка из аминокислот на матрице информационной (матричной) РНК (иРНК, мРНК), осуществляемый рибосомой.
Синтез белка является основой жизнедеятельности клетки. Для осуществления этого процесса в клетках всех организмов имеются спец.органеллы-рибосомы - рибонуклеопротеидные комплексы, построенные из 2 субъединиц: большой и малой. Функция рибосом заключается в узнавании трёхбуквенных (трехнуклеотидных) кодонов мРНК, сопоставлении им соответствующих антикодонов тРНК, несущих аминокислоты , и присоединении этих аминокислот к растущей белковой цепи. Двигаясь вдоль молекулы мРНК, рибосома синтезирует белок в соответствии с информацией, заложенной в молекуле мРНК.
Для узнавания АК-т в клетке имеются специальные «адаптеры», молекулы транспортной РНК (тРНК). Эти молекулы, имеющие форму клеверного листа, имеют участок (антикодон), комплементарный кодону мРНК, а также другой участок, к которому присоединяется аминокислота, соответствующая этому кодону. Присоединение аминокислот к тРНК осуществляется в энерго-зависимой реакции ферментами аминоацил-тРНК-синтетазами, а получившаяся молекула называется аминоацил-тРНК. Таким образом, специфичность трансляции определяется взаимодействием между кодоном мРНК и антикодоном тРНК, а также специфичностью аминоацил-тРНК-синтетаз, присоединяющих аминокислоты строго к соответствующим им тРНК (например, кодону GGU будет соответствовать тРНК, содержащая антикодон CCA, а к этой тРНК будет присоединяться только АК глицин).
Прокариотическая рибосома
5S и 23S рРНК 16S рРНК
34 белка 21 белок
Рибосомы прокариот имеют константу седиментации 70S, отчего получили название 70S-частиц. Они построены из двух неодинаковых субчастиц: 30S- и 50S-субъединиц. Каждая субъединица представляет комплекс рРНК и рибосомных белков.
30S-частица содержит одну молекулу 16S-рРНК и в большинстве случаев по одной молекуле белка из более 20 видов (21) . 50S-субъединица состоит из двух молекул рРНК (23S и 5S). В ее состав входят более 30 различных белков (34), также представленных, как правило, одной копией. Большая часть рибосомальных белков выполняет структурную функцию.
Эукариотическая рибосома
5S; 5,8S и 28S рРНК 18S рРНК
не менее 50 белков не менее 33 белков
Рибосома состоит из большой и малой субъединиц. Основу структуры каждой субъединицы составляет сложн образом свернутая рРНК. К каркасу из рРНК прикрепл рибосомн белки.
Коэффициент седиментации полной эукариотической рибосомы составляет около 80 единиц Сведберга (80S), а коэффициент седиментации ее субчастиц составляет 40S и 60S.
Меньшая 40S-субчастица состоит из одной молекулы 18S-рРНК и 30-40 белковых молекул. Большая 60S-субчастица содержит три типа рРНК с коэффициентами седиментации 5S, 5,8S и 28S и 40-50 белков (например, рибосомы гепатоцитов крысы включают 49 белков).
Функциональные участки рибосом
Р – пептидильный участок для пептидил тРНК
А – аминоацильный участок для аминоацил тРНК
Е – участок для выхода тРНК из рибосомы
Рибосома содержит 2 функциональных участка для взаимодействия с тРНК: аминоацильный (акцепторный) и пептидильный (донорный). Аминоацил-тРНК попадает в акцепторный участок рибосомы и взаимодействует с образованием водородных связей между триплетами кодона и антикодона. После образования водородных связей система продвигается на 1 кодон и оказывается в донорном участке. Одновременно в освободившемся акцепторном участке оказывается новый кодон, и к нему присоединяется соответствующий аминоацил-т-РНК.
Рибосомы: строение, финкция
Рибосомы являются цитоплазматическими центрами биосинтеза белка. Они состоят из большой и малой субъединиц, различающихся коэффициентами седиментации (скоростью осаждения при центрифугировании), выражаемые в единицах Сведберга – S.
Рибосомы присутствуют в клетках как эукариот, так и прокариот, поскольку выполняют важную функцию в биосинтезе белков. В каждой клетке имеются десятки, сотни тысяч (до нескольких миллионов) этих мелких округлых органоидов. Это округлая рибонуклеопротеиновая частица. Диаметр ее составляет 20-30 нм. Состоит рибосома из большой и малой субъединиц, различающихся коэффициентами седиментации (скоростью осаждения при центрифугировании), выражаемые в единицах Сведберга – S. Эти субъединицы объединяются в присутствии нити м-РНК (матричной, или информационной, РНК). Комплекс из группы рибосом, объединенных одной молекулой м-РНК наподобие нитки бус, называется полисомой . Эти структуры либо свободно расположены в цитоплазме, либо прикреплены к мембранам гранулярной ЭПС (в обоих случаях на них активно протекает синтез белка).
Полисомы гранулярной ЭПС образуют белки, выводимые из клетки и используемые для нужд всего организма (например, пищеварительные ферменты, белки женского грудного молока). Кроме этого, рибосомы присутствуют на внутренней поверхности мембран митохондрий, где также принимают активное участие в синтезе белковых молекул.
Важная роль в процессе использования наследственной информации клеткой принадлежит транспортной РНК (тРНК). Доставляя необходимые аминокислоты к месту сборки пептидных цепей, тРНК выполняет функцию трансляционного посредника.
Молекулы тРНК представляют собой полинуклеотидные цепи, синтезируемые на определенных последовательностях ДНК. Они состоят из относительно небольшого числа нуклеотидов -75-95. В результате комплементарного соединения оснований, которые находятся в разных участках полинуклеотидной цепи тРНК, она приобретает структуру, напоминающую по форме лист клевера (рис. 3.26).
Рис. 3.26. Строение типичной молекулы тРНК.
В ней выделяют четыре главные части, выполняющие различные функции. Акцепторный «стебель» образуется двумя комплементарно соединенными концевыми частями тРНК. Он состоит из семи пар оснований. 3′-конец этого стебля несколько длиннее и формирует одноцепочечный участок, который заканчивается последовательностью ЦЦА со свободной ОН-группой. К этому концу присоединяется транспортируемая аминокислота. Остальные три ветви представляют собой комплементарно спаренные последовательности нуклеотидов, которые заканчиваются неспаренными участками, образующими петли. Средняя из этих ветвей - антикодоновая - состоит из пяти пар нуклеотидов и содержит в центре своей петли антикодон. Антикодон - это три нуклеотида, комплементарные кодону мРНК, который шифрует аминокислоту, транспортируемую данной тРНК к месту синтеза пептида.
Между акцепторной и антикодоновой ветвями располагаются две боковые ветви. В своих петлях они содержат модифицированные основания - дигидроуридин (D-петля) и триплет TψC, где \у - псевдоуриаин (Т^С-петля).
Между аитикодоновой и Т^С-ветвями содержится дополнительная петля, включающая от 3-5 до 13-21 нуклеотидов.
В целом различные виды тРНК характеризуются определенньм постоянством нуклеотидной последовательности, которая чаще всего состоит из 76 нуклеотидов. Варьирование их числа связано главным образом с изменением количества нуклеотидов в дополнительной петле. Комплементарные участки, поддерживающие структуру тРНК, как правило, консервативны. Первичная структура тРНК, определяемая последовательностью нуклеотидов, формирует вторичную структуру тРНК, имеющую форму листа клевера. В свою очередь, вторичная структура обусловливает трехмерную третичную структуру, для которой характерно образование двух перпендикулярно расположенных двойных спиралей (рис. 3.27). Одна из них образована акцепторной и ТψС-ветвями, другая -антикодоновой и D-ветвями.
На конце одной из двойных спиралей располагается транспортируемая аминокислота, на конце другой - антикодон. Эти участки оказываются максимально удаленными друг от друга. Стабильность третичной структуры тРНК поддерживается благодаря возникновению дополнительных водородных связей между основаниями полинуклеотидной цепи, находящимися в разных ее участках, но пространственно сближенных в третичной структуре.
Различные виды тРНК имеют сходную третичную структуру, хотя и с некоторыми вариациями.
Рис. 3.27. Пространственная организация тРНК:
I -вторичная структура тРНК в виде «клеверного листа», определяемая ее первичной структурой (последовательностью нуклеотидов в цепи);
II - двумерная проекция третичной структуры тРНК;
III - схема укладки молекулы тРНК в пространстве
ПРИЛОЖЕНИЕ (на случай, если кто-то это не понимает)
Зубцы молнии — нуклеотиды (Аденин-Тимин/Урацил/, Гуанин-Цитазин). Вся молния — ДНК.

Чтобы передать информацию с ДНК надо разорвать 2 нити. Связь между А-Т и Г-Ц — водородная, поэтому легко разрывается ферментом Геликаза:

Чтобы не образовывались узлы (Как пример скрутил полотенце):



Чтобы цепочка не скручивалась одну нить ДНК в точке начала репликации разрезает Топоизомераза.

Когда одна нить свободна — вторая может легко вращаться вокруг своей оси, тем самым снимая напряжение во время "раскручивания". Узлы не появляются, экономится энергия.
Затем, чтобы начать собирать РНК необходима РНК затравка. Белок, который собирает мРНК не может просто так собрать первый нуклеотид, ему нужен кусок РНК чтобы начать (там подробно написано, потом выпишу). Этот кусок называется РНК затравка. И к нему уже этот белок присоединяет первый нуклеотид.


При описании строения нуклеиновых кислот учитывают различные уровни организации макромолекул: первичную и вторичную структуру.
Первичная структура нуклеиновых кислот – это нуклеотидный состав и определенная последовательность нуклеотидных звеньев в полимерной цепи.
Вторичная структура РНК. Молекула рибонуклеиновой кислоты построена из одной полинуклеотидной цепи.
Вторичная структура рнк
Отдельные участки цепи РНК образуют спирализованные петли — "шпильки", за счёт водородных связей между комплементарными азотистыми основаниями A-U и G-C. Участки цепи РНК в таких спиральных структурах антипараллельны, но не всегда полностью комплементарны, в них встречаются неспаренные нуклеотидные остатки или даже одноцепочечные петли, не вписывающиеся в двойную спираль. Наличие спирализованных участков характерно для всех типов РНК.
Основная роль РНК – непосредственное участие в биосинтезе белка.
Известны три вида клеточных РНК, которые отличаются по местоположению в клетке, составу, размерам и свойствам, определяющим их специфическую роль в образовании белковых макромолекул:
— информационные (матричные) РНК передают закодированную в ДНК информацию о структуре белка от ядра клетки к рибосомам, где и осуществляется синтез белка; первичная структура всех мРНК, независимо от уникальности их кодирующей последовательности, имеет одинаковое строение 5′- и З’-концов.
Так, на 5′- конце присутствует модифицированный нуклеотид 7-метилгуанозин-5′-трифосфат (кэп). Несколько десятков нуклеотидов отделяют кэп от инициирующего кодона, обычно это триплет -AUG-. За кодирующим участком следует один из терминирующих кодонов -UGA-, -UUA-, -UAG-. На 3′-конце большинства мРНК присутствует последовательность нуклеотидов из 100-200 аденозинмонофосфатных остатков.
— транспортные РНК собирают аминокислоты в цитоплазме клетки и переносят их в рибосому; молекулы РНК этого типа "узнают" по соответствующим участкам цепи информационной РНК, какие аминокислоты должны участвовать в синтезе белка.
Пространственную структуру любых тРНК, независимо от различий в последовательности нук-леотидов, описывают универсальной моделью "клеверного листа". В каждой молекуле тРНК есть участки цепи, не участвующие в образовании водородных связей между нуклеотидными остатками.
К ним, в частности, относят участок, ответственный за связывание с аминокислотой на 3′-конце молекулы и антикодон — специфический триплет нуклеотидов, взаимодействующий комплементарно с кодоном мРНК.
— рибосомные РНК обеспечивают синтез белка определенного строения, считывая информацию с информационной (матричной) РНК. рРНК образуют комплексы с белками, которые называют рибосомами.
Каждая рибосома состоит из двух субъединиц — малой (40S) и большой (60S). Субъединицы рибосом различаются не только набором рРНК, но и количеством и структурой белков.
Дата публикования: 2015-02-03; Прочитано: 2729 | Нарушение авторского права страницы

РНК - полимер, мономерами которой являются рибонуклеотиды.
В отличие от ДНК, РНК образована не двумя, а одной полинуклеотидной цепочкой (исключение - некоторые РНК-содержащие вирусы имеют двухцепочечную РНК). Нуклеотиды РНК способны образовывать водородные связи между собой. Цепи РНК значительно короче цепей ДНК.
Мономер РНК - нуклеотид (рибонуклеотид) - состоит из остатков трех веществ: 1) азотистого основания, 2) пятиуглеродного моносахарида (пентозы) и 3) фосфорной кислоты. Азотистые основания РНК также относятся к классам пиримидинов и пуринов.
Пиримидиновые основания РНК - урацил, цитозин, пуриновые основания - аденин и гуанин.
31. Типы РНК и особенности ее структуры
Моносахарид нуклеотида РНК представлен рибозой.
Выделяют три вида РНК: 1) информационная (матричная) РНК - иРНК (мРНК), 2) транспортная РНК - тРНК, 3) рибосомная РНК - рРНК.
Все виды РНК представляют из себянеразветвленные полинуклеотиды, имеют специфическую пространственную конформацию и принимают участие в процессах синтеза белка.
Информация о строении всех видов РНК хранится в ДНК. Процесс синтеза РНК на матрице ДНК принято называть транскрипцией.

Транспортные РНК содержат обычно 76 (от 75 до 95) нуклеотидов; молекулярная масса - 25 000–30 000.
На долю тРНК приходится около 10% от общего содержания РНК в клетке. Функции тРНК: 1) транспорт аминокислот к месту синтеза белка, к рибосомам, 2) трансляционный посредник. В клетке встречается около 40 видов тРНК, каждый из них имеет характерную только для него последовательность нуклеотидов. При этом у всех тРНК имеется несколько внутримолекулярных комплементарных участков, из-за которых тРНК приобретают конформацию, напоминающую по форме лист клевера.
У любой тРНК есть петля для контакта с рибосомой (1), антикодоновая петля (2), петля для контакта с ферментом (3), акцепторный стебель (4), антикодон (5). Аминокислота присоединяется к 3′-концу акцепторного стебля. Антикодон - три нуклеотида, ʼʼопознающиеʼʼ кодон иРНК.
Следует подчеркнуть, что конкретная тРНК может транспортировать строго определенную аминокислоту, соответствующую ее антикодону. Специфичность соединения аминокислоты и тРНК достигается благодаря свойствам фермента аминоацил-тРНК-синтетаза.
Рибосомные РНК содержат 3000–5000 нуклеотидов; молекулярная масса - 1 000 000–1 500 000.
На долю рРНК приходится 80–85% от общего содержания РНК в клетке. В комплексе с рибосомными белками рРНК образует рибосомы - органоиды, осуществляющие синтез белка. В эукариотических клетках синтез рРНК происходит в ядрышках. Функции рРНК: 1) необходимый структурный компонент рибосом и, таким образом, обеспечение функционирования рибосом; 2) обеспечение взаимодействия рибосомы и тРНК; 3) первоначальное связывание рибосомы и кодона-инициатора иРНК и определение рамки считывания, 4) формирование активного центра рибосомы.
Информационные РНК разнообразны по содержанию нуклеотидов и молекулярной массе (от 50 000 до 4 000 000).
На долю иРНК приходится до 5% от общего содержания РНК в клетке. Функции иРНК: 1) перенос генетической информации от ДНК к рибосомам, 2) матрица для синтеза молекулы белка, 3) определение аминокислотной последовательности первичной структуры белковой молекулы.
Читайте также
Строение РНК – полимер, мономерами которого служат нуклеотиды.
Три азотистых основания те же, что в составе ДНК (аденин, гуанин, цитозин); четвертое — урацил — присутствует в молекуле РНК вместо тимина. Нуклеотиды РНК содержат вместо дизоксирибозы рибозу. В цепочке РНК…
три основных вида РНК: информационная (иРНК), или матричная (мРНК), рибосомная (рРНК), и транспортная (тРНК). Они различаются по величине молекул и функциям. Все типы РНК синтезируются на ДНК при участии ферментов - РНК-полимераз. Информационная РНК состав-ляет 2-3 % всей клеточной РНК, рибосомная - 80-85, транс-портная - около 15 %.
иРНК .
она считывает наследст-венную информацию с участка ДНК и в форме скопиро-ванной последовательности азотистых оснований переносит ее в рибосомы, где происходит синтез определенного белка. Каждая из молекул иРНК по порядку расположения нуклеотидов и по размеру соответствует гену в ДНК, с которого она была транс-крибирована. В среднем иРНК содержит 1500 нуклеотидов (75- 3000). Каждый триплет (три нуклеотида) на иРНК называется кодоном. От кодона зависит, какая аминокислота встанет в дан-ном месте при синтезе белка.
(тРНК) обладает относительно невысокой молекулярной массой порядка 24-29 тыс.
Д и содер-жит в молекуле от 75 до 90 нуклеотидов. До 10 % всех нуклеоти-дов тРНК приходится на долю минорных оснований, что, по-ви-димому, защищает ее от действия гидролитических ферментов.Роль тРНК заключается в том, что они переносят аминокис-лоты к рибосомам и участвуют в процессе синтеза белка. Каждая аминокислота присоединяется к определенной тРНК. Ряд ами-нокислот обладает более одной тРНК. К настоящему времени обнаружено более 60 тРНК, которые отличаются между собой первичной структурой (последовательностью оснований).
Вто-ричная структура у всех тРНК представлена в виде клеверного листа с двухцепочным стеблем и тремя одноцепочными). На конце одной из цепей находится акцепторный участок - триплет ЦЦА, к аденину которого присоединяется специфическая аминокислота.
(рРНК) . Они содержат 120-3100 нуклеотидов. Рибосомная РНК накапливается в ядре, в ядрышках.
В ядрышки из цитоплазмы транспортируются рибосомные белки, и там происходит спонтанное образование субчастиц рибосом путем объединения белков с соответствующими рРНК. Субчастицы рибосомы вместе или врозь транспортируются через поры ядерной мембраны в цитоплазму.Рибосомы представляют собой органеллы величиной 20- 30 нм.
Они построены из двух субчастиц разного размера и формы. На определенных стадиях белкового синтеза в клетке происходит разделение рибосом на субчастицы.
Рибосомная РНК служит как бы каркасом рибосом и способствует первоначальному связыванию иРНК с рибосомой в процессе биосинтеза белка.
Вопрос 6 Связи, формирующие первичную и вторичную структуры ДНК и РНК. Виды РНК
Генетический код- свойственный всем живым организмам способ кодирования аминокислотной последовательности белков при помощи последовательности нуклеотидов.
Свойства: 1) ге-нетический код триплетный (каждая аминокислота кодируется тремя нуклеотидами); 2) неперекрывающийся (соседние триплеты не имеют общих нуклеотидов); 3) вырожденный (за исключением метионина и триптофана все аминокислоты имеют более одного кодона); 4) универсальный (в основном одинаков для всех живых организмов); 5) в кодонах для одной аминокислоты первые два нуклеотида, как правило, одинаковы, а третий варьирует; 6) имеет линейный порядок считывания и характеризуется колине-арностью, т.
е. совпадением порядка расположения кодонов в иРНК с порядком расположения аминокислот в синтезирующей-ся полипептидной цепи.
Дата публикования: 2014-12-08; Прочитано: 11268 | Нарушение авторского права страницы
studopedia.org — Студопедия.Орг — 2014-2018 год.(0.001 с)…
В цитоплазме клеток содержатся три основных функциональных вида РНК:
- матричные РНК (мРНК), выполняющие функции матриц белкового синтеза;
- рибосомные РНК (рРНК), выполняющие роль структурных компо-нентов рибосом;
- транспортные РНК (тРНК), участвующие в трансляции (переводе) информации мРНК в последовательность аминокислот молекулы белка.
В ядре клеток обнаруживают ядерную РНК, составляющую от 4 до 10% от суммарной клеточной РНК.
Основная масса ядерной РНК представлена высо-комолекулярными предшественниками рибосомных и транспортных РНК. Предшественники высокомолекулярных рРНК (28 S, 18 S и 5 S РНК) в основ-ном локализуются в ядрышке.
РНК является основным генетическим материалом у некоторых вирусов животных и растений (геномные РНК). Для большинства РНК вирусов харак-терна обратная транскрипция их РНК генома, направляемая обратной транскриптазой.
Все рибонуклеиновые кислоты представляют собой полимеры рибонуклеотидов, соединенных, как в молекуле ДНК, 3′,5′-фосфорнодиэфирными свя-зями.
В отличие от ДНК, имеющей двухцепочечную структуру, РНК представ-ляет собой одноцепочечные линейные полимерные молекулы.
Строение мРНК. мРНК - наиболее гетерогенный в отно-шении размеров и стабильности класс РНК.
Строение тРНК .
Транспортные РНК выполняют функ-ции посредников (адаптеров) в ходе трансляции мРНК. На их долю приходится примерно 15% суммарной кле-точной РНК. Каждой из 20 протеиногенных аминокислот соответствует своя тРНК. Для некоторых аминокис-лот, кодируемых двумя и более кодонами, существуют несколько тРНК.
тРНК представляют собой сравнительно небольшие одноцепочечные мо-лекулы, состоящие из 70-93 нуклеотидов. Их молекулярная масса составляет (2,4-3,1) .104 кДа.
Вторичная структура тРНК формируется за счет образования максималь-ного числа водородных связей между внутримолекулярными комплементар-ными парами азотистых оснований.
В результате образования этих связей полинуклеотидная цепь тРНК закручивается с образованием спирализованных ветвей, заканчивающихся петлями из неспаренных нуклеотидов. Пространст-венное изображение вторичных структур всех тРНК имеет форму клеверного листа.
В «клеверном листе» различают четыре обязательные ветви, более длин-ные тРНК, кроме того, содержат короткую пятую (дополнительную) ветвь.
Адапторную функцию тРНК обеспечивают акцепторная ветвь, к 3′-концу которой присоединяется эфирной связью аминокислотный остаток, и про-тивостоящая акцепторной ветви антикодоновая ветвь, на вершине которой находится петля, содержащая антикодон.
Антикодон представляет собой спе-цифический триплет нуклеотидов, который комплементарен в антипарал-лельном направлении кодону мРНК, кодирующему соответствующую амино-кислоту.
Т-Ветвь, несущая петлю псевдоуридина (ТyС-петлю), обеспечивает взаи-модействие тРНК с рибосомами.
Д-ветвь, несущая дегидроуридиновую пет-лю, обеспечивает взаимодействие тРНК с соответствующей аминоацил-тРНК-синтетазой.

Вторичная структура тРНК
Функции пятой дополнительной ветви пока мало исследованы, вероятнее всего она уравнивает длину разных молекул тРНК.
Третичная структура тРНК очень компактна и образуется путем сбли-жения отдельных ветвей клеверного листа за счет дополнительных водород-ных связей с образованием L-образной структуры «локтевого сгиба».
Транспортные РНК, строение и функциональный механизм.
При этом акцепторное плечо, связывающее ами-нокислоту, оказывается расположенным на одном конце молекулы, а анти-кодон - на другом.

Третичная структура тРНК (по А.С. Спирину)
Строение рРНК и рибосом . Рибосомные РНК формируют основу, с которой связываются специфические белки при образовании рибо-сом. Рибосомы - это нуклеопротеиновые органеллы, обеспечивающие синтез белка на мРНК.
Число рибосом в клет-ке очень велико: от 104 у прокариот до 106 у эукариот. Локализуются рибосомы главным об-разом в цитоплазме, у эукариот, кроме того, в ядрышке, в матриксе митохондрий и строме хлоропластов. Рибосомы состоят из двух субчас-тиц: большой и малой. По размерам и молеку-лярной массе все изученные рибосо-мы делят на 3 группы - 70S рибосомы прокариот (S-коэффициент седиментации), состоящие из малой 30S и большой 50S субчас-тиц; 80S рибосомы эукариот, состоящие из 40S малой и 60S большой субчастиц.
Малая субчастица 80S рибосом образована одной молекулой рРНК (18S) и 33 молекулами различных белков.
Большая субчастица обра-зована тремя молекулами рРНК (5S, 5,8S и 28S) и примерно 50 белками.
Вторичная структура рРНК образуется за счет коротких двуспиральных участков молекулы - шпилек (около 2/3 рРНК), 1/3 - представлена однотяжевыми участками, богаты-ми пуриновыми нуклеотидами.
Социальные кнопки для Joomla
Основу жизни образуют белки. Функции их в клетке очень разнообразны. Однако белки «не умеют» размножаться. А вся информация о строении белков содержится в генах (ДНК).
У высших организмов белки синтезируются в цитоплазме клетки, а ДНК сокрыта за оболочкой ядра. Поэтому ДНК непосредственно не может быть матрицей для синтеза белка. Эту роль выполняет другая нуклеиновая кислота – РНК.
Молекула РНК представляет собой неразветвленный полинуклеотид, обладающий третичной структурой.
Она образована одной полинуклеотидной цепочкой, и, хотя входящие в ее состав комплементарные нуклеотиды также способны образовывать между собой водородные связи, эти связи возникают между нуклеотидами одной цепочки. Цепи РНК значительно короче цепей ДНК. Если содержание ДНК в клетке относительно постоянно, то содержание РНК сильно колеблется. Наибольшее количество РНК в клетках наблюдается во время синтеза белка.
РНК принадлежит главная роль в передаче и реализации наследственной информации.
В соответствии с функцией и структурными особенностями различают несколько классов клеточных РНК.
Существует три основных класса клеточных РНК.
- Информационная (иРНК), или матричная (мРНК). Ее молекулы наиболее разнообразны по размерам, молекулярной массе (от 0,05х106 до 4х106) и стабильности.
Составляют около 2% от общего количества РНК в клетке. Все иРНК являются переносчиками генетической информации из ядра в цитоплазму, к месту синтеза белка. Они служат матрицей (рабочим чертежом) для синтеза молекулы белка, так как определяют аминокислотную последовательность (первичную структуру) белковой молекулы.

- Рибосомальные РНК (рРНК).
Составляют 80–85% от общего содержания РНК в клетке.
31. Строение РНК. Типы РНК, особенности строения и функции. Вторичная структура т-РНК
Рибосомальная РНК состоит из 3–5 тыс. нуклеотидов. Она синтезируется в ядрышках ядра. В комплексе с рибосомными белками рРНК образует рибосомы – органоиды, на которых происходит сборка белковых молекул. Основное значение рРНК состоит в том, что она обеспечивает первоначальное связывание иРНК и рибосомы и формирует активный центр рибосомы, в котором происходит образование пептидных связей между аминокислотами в процессе синтеза полипептидной цепи.
- Транспортные РНК (тРНК).
Молекулы тРНК содержат обычно 75-86 нуклеотидов. Молекулярная масса молекул тРНК около 25 тыс. Молекулы тРНК играют роль посредников в биосинтезе белка – они доставляют аминокислоты к месту синтеза белка, то есть на рибосомы. В клетке содержится более 30 видов тРНК. Каждый вид тРНК имеет характерную только для него последовательность нуклеотидов.
Однако у всех молекул имеется несколько внутримолекулярных комплементарных участков, благодаря наличию которых все тРНК имеют третичную структуру, напоминающую по форме клеверный лист.
Вторичная структура РНК – характерна для тРНК, одноцепочечная, по форме напоминает «клеверный лист».
Включает:
- сравнительно короткие двойные спирали – стебли,
- однотяжевые участки – петли.
Имеется 4 стебля (акцепторный, антикодоновый, дигидроуридиловый, псевдоуридиловый) и 3 петли.

«Стебель-петля» - элемент вторичной структуры РНК, схематично

«Псевдоузел» - элемент вторичной структуры РНК, схематично

Акцепторный стебель – содержит 3’- и 5’- концы полинуклеотидной цепи, 5’-конец заканчивается остатком гуаниловой кислоты, 3’-конец – триплетом ЦЦА и служит для образования сложноэфирной связи с АК.
Антикодоновый стебель узнает свой кодон на и-РНК в рибосомах по принципу комплементарности.
Псевдоуридиловый стебель служит для прикрепления к рибосоме.
Дигидроуридиловый стебель служит для связи с аминоацил-тРНК-синтетазой.
Социальные кнопки для Joomla