V-A grupas elementu vispārīgie raksturojumi. V grupas P elementi Galvenās apakšgrupas 5. grupas elementu maksimālā valence
Elementu līdzības:
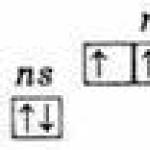
Identiska atomu ārējā elektroniskā slāņa struktūra ns 2 np 3;
P-elementi;
Augstāks ciems O. vienāds ar +5;
Apakšējā s. O. vienāds ar -3 (neraksturīgi Sb un Bi).
V grupas galvenās apakšgrupas elementiem dažkārt tiek lietots grupas nosaukums “pnictogens”, kas ieviests pēc analoģijas ar terminiem “halogēni” un “halkogēni” un iegūts no elementu fosfora P un slāpekļa N simboliem.
Atomu valences stāvokļi
P, As, Sb, Bi atomiem ir iespējami 2 valences stāvokļi:
Pamata ns 2 np 3
Ragveida ns 1 np 3 nd 1
Atšķirība starp slāpekli un citiem apakšgrupas elementiem
1. Tā kā slāpekļa atomā ārējā elektroniskā slānī nav d-orbitāļu, slāpekļa atoma veidoto kovalento saišu skaits saskaņā ar apmaiņas mehānismu nevar būt lielāks par 3.
2. Vientuļa elektronu pāra klātbūtne slāpekļa atoma 2s apakšlīmenī dod iespēju izveidot kovalento saiti, izmantojot donora-akceptora mehānismu. Tādējādi N augstākā valence ir IV.
3. Savienojumos ar skābekli slāpeklim ir oksidācijas pakāpes +1, +2, +3, +4, +5.
Elementu un to veidoto vielu īpašību vertikālas izmaiņas
Atšķirībā no halogēniem un halkogēniem, V grupas galvenajā apakšgrupā elementu un to veidojošo vienkāršo vielu īpašībās notiek krasākas izmaiņas, palielinoties kodola lādiņam un atomu rādiusam:
Elementu un to veidoto vienkāršo vielu īpašību vertikālas izmaiņas |
|||||
nemetāli |
metāls ar dažām nemetāliskuma pazīmēm |
||||
Oksīdi un hidroksīdi |
Slāpeklis un tā skābekļa savienojumi tiek aplūkoti atsevišķi vairāku atšķirību dēļ. |
||||
E 2 O 3 un attiecīgie hidroksīdi |
P 2 O 3 (P 4 O 6) skābes oksīds |
Kā 2 O 3 skābs oksīds ar amfoteritātes pazīmēm |
Sb 2 O 3 amfoteriskais oksīds |
Bi 2 O 3 bāzes oksīds |
|
E 2 O 5 un attiecīgie hidroksīdi |
P 2 O 5 (P 4 O 10) skābes oksīds |
Kā 2 O 5 skābes oksīds |
Sb 2 O 5 skābes oksīds |
Bi 2 O 5 amfotēriski trausli |
|
HPO 3 (H 3 PO 4) |
|||||
vājas skābes |
|||||
Skābju īpašības vājina |
|||||
Pamatīpašības ir uzlabotas |
|||||
Ūdeņraža savienojumi EN 3
V grupas galvenās apakšgrupas elementi ar ūdeņradi veido gaistošus savienojumus, kas ir indīgas gāzes ar raksturīgu smaku. Tie ir spēcīgi reducējoši līdzekļi. Atšķirībā no VII un VI grupas nemetālu ūdeņraža savienojumiem, tie ūdens šķīdumos neveido H+ jonus, t.i., tiem nav skābu īpašību.
5. ELEMENTU GRUPAS VISPĀRĪGAIS RAKSTUROJUMS.
Periodiskās tabulas galvenajā apakšgrupā V 0 01 F ietilpst slāpeklis, fosfors, arsēns, antimons un bismuts. Šos elementus, kuru atoma ārējā slānī ir pieci elektroni, raksturo vispārīgi
tāpat kā nemetāli. Tomēr to spēja piesaistīt elektronus ir daudz mazāk izteikta nekā atbilstošajiem VI un VII grupas elementiem. Piecu ārējo elektronu klātbūtnes dēļ šīs apakšgrupas elementu augstākā pozitīvā oksidēšanās ir -5, bet negatīvā - 3. Salīdzinoši zemākas elektronegativitātes dēļ attiecīgo elementu saite ar ūdeņradi ir mazāk polāra nekā saite ar VI un VII grupas elementu ūdeņradi. Tāpēc šo elementu ūdeņraža savienojumi neizslēdz ūdeņraža jonus H ūdens šķīdumā, un tādējādi tiem nav skābu īpašību. Slāpekļa apakšgrupas elementu fizikālās un ķīmiskās īpašības mainās ar
0 0 1 Sērijas numura palielināšana tādā pašā secībā, kāda tika novērota
0 0 1 Iepriekš aplūkotajām grupām, Bet tā kā nemetāliskās īpašības izteiktas ar
vājāks nekā skābeklim un īpaši fluoram, tad šo īpašību pavājināšanās, pārejot uz 0 0 1 F, ietver metālisko īpašību parādīšanos un palielināšanos.
Pēdējie jau ir manāmi arsēnā, antimonam abas īpašības ir aptuveni vienādas, un bismutā metāliskās īpašības dominē pār nemetāliskajām. ELEMENTU APRAKSTS. SLĀPEKLIS(no grieķu ázōos — nedzīvs, lat. Nitrogenium), N, ķīmiskais elements V
Mendeļejeva periodiskās sistēmas grupas, atomskaitlis 7, atommasa 14,0067; bezkrāsaina gāze, bez smaržas un garšas. Vēsturiska atsauce. Slāpekļa savienojumi - salpeteris, slāpekļskābe, amonjaks - bija
zināms ilgi pirms slāpekļa ražošanas brīvā stāvoklī. 1772. gadā D. Raterfords, stikla zvanā sadedzināt fosforu un citas vielas, parādīja, ka pēc sadegšanas paliekošā gāze, ko viņš nosauca par “smacējošo gaisu”, neatbalsta elpošanu un degšanu. 1787. gadā A. Lavuazjē konstatēja, ka “vitālās” un “nosmacošās” gāzes, kas veido gaisu, ir vienkāršas vielas, un ierosināja nosaukumu “slāpeklis”. 1784. gadā G. Kavendišs parādīja, ka slāpeklis ir daļa no salpetras; No šejienes cēlies latīņu nosaukums slāpeklis (no vēlā latīņu nitrum — salpetrs un grieķu gennao — es dzemdēju, es ražoju), ko 1790. gadā ierosināja J. A. Chaptal. Līdz 19. gadsimta sākumam. Tika noskaidrota slāpekļa ķīmiskā inerce brīvā stāvoklī un tā ekskluzīvā loma savienojumos ar citiem elementiem kā saistītais slāpeklis. Kopš tā laika gaisa slāpekļa “saistīšana” ir kļuvusi par vienu no svarīgākajām ķīmijas tehniskajām problēmām. Izplatība dabā. Slāpeklis ir viens no visizplatītākajiem elementiem
Zeme un tās lielākā daļa (apmēram 4´1015 T) ir koncentrēts atmosfērā brīvā stāvoklī. Gaisā brīvā slāpekļa (N2 molekulu veidā) ir 78,09% pēc tilpuma (vai 75,6% pēc masas), neskaitot tā nelielos piemaisījumus amonjaka un oksīdu veidā. Vidējais slāpekļa saturs litosfērā ir 1,9´10-3 masas%. Dabīgie slāpekļa savienojumi. - amonija hlorīds NH4Cl un dažādi nitrāti (sk.
Salpetra.) Lieli salpetra uzkrājumi ir raksturīgi sausam tuksneša klimatam (Čīle, Vidusāzija). Ilgu laiku nitrāts bija galvenais slāpekļa piegādātājs rūpniecībai (tagad amonjaka rūpnieciskā sintēze no gaisa slāpekļa un ūdeņraža ir primāra nozīme slāpekļa fiksācijā). Nelielos daudzumos fiksētais slāpeklis ir atrodams oglēs (1-2,5%) un eļļā (0,02-1,5%), kā arī upju, jūru un okeānu ūdeņos. Slāpeklis uzkrājas augsnēs (0,1%) un dzīvos organismos (0,3%).
Lai gan nosaukums "slāpeklis" nozīmē "dzīvību neuzturošs", patiesībā tas ir būtisks dzīvības elements. Dzīvnieku un cilvēku olbaltumvielas satur 16 - 17% slāpekļa. Gaļēdāju organismos proteīns veidojas, pateicoties patērētajām proteīna vielām, kas atrodas zālēdāju dzīvnieku organismos un augos. Augi sintezē olbaltumvielas, asimilējot augsnē esošās slāpekļa vielas, galvenokārt neorganiskās. Ievērojams slāpekļa daudzums augsnē nonāk, pateicoties slāpekli fiksējošiem mikroorganismiem, kas spēj pārvērst brīvo slāpekli no gaisa slāpekļa savienojumos. Dabā notiek slāpekļa cikls, kurā galvenā loma ir
mikroorganismi - nitrofē, denitrofējas, slāpekli piesaista u.c. Taču, augiem no augsnes izsūcot milzīgu daudzumu fiksētā slāpekļa (īpaši ar intensīvu lauksaimniecību), augsnēs trūkst slāpekļa. Slāpekļa deficīts lauksaimniecībai raksturīgs gandrīz visās valstīs, slāpekļa deficīts vērojams arī lopkopībā (“olbaltumvielu bads”). Augsnēs, kurās trūkst slāpekļa, augi slikti attīstās. Slāpekļa mēslojums un dzīvnieku barošana ar proteīnu ir vissvarīgākie lauksaimniecības veicināšanas līdzekļi. Cilvēka saimnieciskā darbība izjauc slāpekļa ciklu. Tādējādi kurināmā dedzināšana bagātina atmosfēru ar slāpekli, un rūpnīcas, kas ražo mēslojumu, saista slāpekli no gaisa. Mēslošanas līdzekļu un lauksaimniecības produktu transportēšana pārdala slāpekli uz zemes virsmas. Slāpeklis ir ceturtais visbiežāk sastopamais elements Saules sistēmā (pēc ūdeņraža,
hēlijs un skābeklis). Izotopi, atoms, molekula. Dabiskais slāpeklis sastāv no diviem stabiliem izotopiem: 14N
(99,635%) un 15N (0,365%). 15N izotops tiek izmantots ķīmiskajos un bioķīmiskos pētījumos kā iezīmēts atoms. No mākslīgajiem slāpekļa radioaktīvajiem izotopiem 13N ir visilgākais pussabrukšanas periods (T1/2 - 10,08 min), pārējās ir ļoti īslaicīgas. Atmosfēras augšējos slāņos kosmiskā starojuma neitronu ietekmē 14N pārvēršas radioaktīvajā oglekļa izotopā 14C. Šo procesu izmanto arī kodolreakcijās, lai iegūtu 14C. Slāpekļa atoma ārējais elektronu apvalks. sastāv no 5 elektroniem (viens vientuļš pāris un trīs nesapāroti - 2. konfigurācija s 22lpp 3). Visbiežāk slāpeklis. savienojumos tas ir 3-kovalents nepāra elektronu dēļ (kā amonjakā NH3). Vientuļa elektronu pāra klātbūtne var izraisīt citas kovalentās saites veidošanos, un slāpeklis kļūst par 4-kovalentu (tāpat kā amonija jonā NH4+). Slāpekļa oksidācijas pakāpe svārstās no +5 (N205) līdz -3 (NH3). Normālos apstākļos brīvā stāvoklī slāpeklis veido N2 molekulu, kur N atomi ir savienoti ar trīs kovalentām saitēm. Slāpekļa molekula ir ļoti stabila: tās disociācijas enerģija atomos ir 942,9 kJ/mol (225,2 kcal/mol), tāpēc pat ar t aptuveni 3300°C slāpekļa disociācijas pakāpe. ir tikai aptuveni 0,1%. Fizikālās un ķīmiskās īpašības. Slāpeklis ir nedaudz vieglāks par gaisu; blīvums 1,2506 Kilograms/
m3(pie 0°C un 101325 n/m2 vai 760 mmHg Art.), tpl-209,86°C, uzvāra-195,8?C. A. sašķidrinās ar grūtībām: tā kritiskā temperatūra ir diezgan zema (-147,1 ° C), un tā kritiskais spiediens ir augsts 3,39 Mn/m2 (34,6 kgf/cm2); šķidrā slāpekļa blīvums 808 kg (m3. Slāpeklis ūdenī šķīst mazāk nekā skābeklis: 0°C temperatūrā 1 m3 H2O izšķīst 23.3 G slāpeklis. Slāpeklis dažos ogļūdeņražos šķīst vairāk nekā ūdenī. Tikai ar aktīviem metāliem, piemēram, litiju, kalciju, magniju, slāpekli
mijiedarbojas, uzkarsējot līdz salīdzinoši zemai temperatūrai. Slāpeklis reaģē ar lielāko daļu citu elementu augstā temperatūrā un katalizatoru klātbūtnē. Slāpekļa savienojumi ar skābekli N2O, NO, N2O3, NO2 un N2O5 ir labi izpētīti. No tiem elementu tiešās mijiedarbības laikā (4000°C) veidojas NO oksīds, kas, atdziestot, viegli oksidējas tālāk par NO2 dioksīdu. Atmosfēras izplūdes laikā gaisā veidojas slāpekļa oksīdi. Tos var iegūt arī, pakļaujot slāpekļa un skābekļa maisījumu jonizējošam starojumam. Kad slāpeklis N2O3 un
Slāpekļa anhidrīdi N2O5 attiecīgi ražo slāpekļskābi HNO2 un slāpekļskābi HNO3, veidojot sāļus - nitrītus un nitrātus. Slāpeklis savienojas ar ūdeņradi tikai augstā temperatūrā un katalizatoru klātbūtnē, un veidojas amonjaks NH3. Papildus amonjakam ir zināmi arī daudzi citi slāpekļa savienojumi ar ūdeņradi, piemēram, hidrazīns H2N-NH2, diimīds HN-NH, slāpekļskābe HN3(H-N-NºN), oktazons N8H14 utt.; Lielākā daļa slāpekļa un ūdeņraža savienojumu tiek izolēti tikai organisko atvasinājumu veidā. Slāpeklis tieši neiedarbojas ar halogēniem, tāpēc visi slāpekļa halogenīdi tiek iegūti tikai netieši, piemēram, slāpekļa fluorīds NF3-, fluoram reaģējot ar amonjaku. Parasti slāpekļa halogenīdi ir zemas stabilitātes savienojumi (izņemot NF3); Slāpekļa oksihalogenīdi ir stabilāki - NOF, NOCI, NOBr, N02F un NO2CI. Slāpeklis arī nesavienojas tieši ar sēru; slāpekļa sēru N4S4 iegūst šķidrā sēra reakcijas ar amonjaku rezultātā. Karstam koksam reaģējot ar slāpekli, veidojas cianogēns (CN).;. Karsējot slāpekli ar acetilēnu C2H2 līdz 1500°C, var iegūt ūdeņraža cianīdu HCN. Slāpekļa mijiedarbība ar metāliem augstās temperatūrās izraisa nitrīdu veidošanos (piemēram, Mg3N2). Kad parastais slāpeklis tiek pakļauts elektriskām izlādei [spiediens 130 - 270 n/m2(1- 2
mmHg)] vai B, Ti, Mg un Ca nitrīdu sadalīšanās laikā, kā arī elektrisko izlāžu laikā gaisā var veidoties aktīvais slāpeklis, kas ir slāpekļa molekulu un atomu maisījums ar paaugstinātu enerģijas rezervi. Atšķirībā no molekulārā slāpekļa, aktīvais slāpeklis ļoti enerģiski mijiedarbojas ar skābekli, ūdeņradi, sēra tvaikiem, fosforu un dažiem metāliem. Slāpeklis ir daļa no daudziem svarīgiem organiskiem savienojumiem (amīniem,
aminoskābes, nitro savienojumi utt.). Kvīts un pieteikums. Laboratorijā slāpekli var viegli iegūt ar
karsējot koncentrētu amonija nitrīta šķīdumu: NH4NO2 - N2 + 2H2O. Slāpekļa ražošanas tehniskā metode ir balstīta uz iepriekš sašķidrināta gaisa atdalīšanu, kas pēc tam tiek pakļauts destilācijai. Lielāko daļu iegūtā brīvā slāpekļa izmanto rūpnieciskiem nolūkiem
amonjaka ražošana, ko pēc tam ievērojamos daudzumos pārstrādā slāpekļskābē, mēslošanas līdzekļos, sprāgstvielās utt. Papildus tiešai amonjaka sintēzei no elementiem 1905. gadā tika izstrādāta cianamīda metode, kuras pamatā ir fakts, ka 1000 °C temperatūrā kalcijs karbīds (iegūst, karsējot kaļķu un ogļu maisījumu elektriskajā krāsnī) reaģē ar brīvo slāpekli: CaC2 + N2 = CaCN2 + C. Iegūtais kalcija cianamīds pārkarsēta ūdens tvaiku ietekmē sadalās, izdalot amonjaku:
CaCN+3H2O=CaCO3+2NH3.
Brīvais slāpeklis tiek izmantots daudzās nozarēs: kā inerta vide dažādos ķīmiskos un metalurģijas procesos, brīvas vietas aizpildīšanai dzīvsudraba termometros, uzliesmojošu šķidrumu sūknēšanai u.c. Šķidrais slāpeklis tiek izmantots dažādās aukstumiekārtās. To uzglabā un transportē tērauda Dewar traukos, slāpekļa gāzi saspiestā veidā - balonos. Plaši tiek izmantoti daudzi slāpekļa savienojumi, fiksētā slāpekļa ražošana sāka strauji attīstīties pēc 1. pasaules kara un tagad ir sasniegusi milzīgus apmērus.
Fosfors(lat. Fosfors), P, Mendeļejeva periodiskās sistēmas V grupas ķīmiskais elements, atomskaitlis 15, atommasa 30,97376, nemetāls. Dabiskais fosfors sastāv no viena stabila izotopa 31P; tika iegūti seši mākslīgie radioaktīvie izotopi: 28P ( T1/2 - 6,27 sek), 29P ( T1/2 - 4,45 sek); 30P ( T1/2 - 2,55 min), 31P ( T1/2
14,22 dienas), 32P ( T1/2 - 25 dienas), 33P ( T1/2 - 12,5 sek). 32P ir vislielākā vērtība , kam piemīt ievērojama b-starojuma enerģija un ko izmanto ķīmiskajos un bioķīmiskos pētījumos kā iezīmētu atomu. Vēsturiska atsauce. Saskaņā ar dažiem literatūras datiem, iegūšanas metode
Fosfors jau bija zināms arābiem. 12. gadsimta alķīmiķi. Bet par vispārpieņemtu fosfora atklāšanas datumu tiek uzskatīts 1669. gads, kad H. Brends (Vācija), urīna iztvaicēšanas sausos atlikumus kalcinējot ar smiltīm un pēc tam destilējot bez gaisa piekļuves, ieguva vielu, kas spīd tumšs, vispirms saukts par “auksto uguni”, bet vēlāk par fosforu no grieķu valodas. fosfors - gaismas. Drīz viņam kļuva zināma fosfora iegūšanas metode. ķīmiķi - I. Krafts, I. Kunkels; 1682. gadā šī metode tika publicēta. 1743. gadā A. S. Marggrafs izstrādāja šādu metodi fosfora iegūšanai: svina hlorīda un urīna maisījumu iztvaicē līdz sausumam un karsēja, līdz beidzās gaistošo produktu izdalīšanās; atlikumu sajauca ar pulverveida kokoglēm un destilē māla retortē; Fosfora tvaiki, kas kondensēti uztvērējā ar ūdeni. Vienkāršāko metodi fosfora iegūšanai, kalcinējot kaulu pelnus ar akmeņoglēm, tikai 1771. gadā ierosināja K. Šēle. Fosfora elementāro dabu noteica A. Lavuazjē. 19. gadsimta 2. pusē. radās rūpnieciskā fosfora ražošana no fosforītiem retortes krāsnīs; 20. gadsimta sākumā. tās nomainīja elektriskās krāsnis. Izplatība dabā. Vidējais fosfora saturs zemes garozā (klarks) -
9,3×10-2% no svara; vidējos iežos 1,6×10-1, bāziskos iežos 1,4×10-1, mazāk granītos un citos skābos magmatiskos iežos - 7×10-2 un vēl mazāk ultrabāziskajos iežos (mantijā) - 1, 7×10-2% ; nogulumiežu iežos no 1,7×10-2 (smilšakmeņi) līdz 4×10-2% (karbonāta ieži). Fosfors piedalās magmatiskajos procesos un enerģiski migrē biosfērā. Abi procesi ir saistīti ar tā lielajiem uzkrājumiem, veidojot rūpnieciskās apatītu un fosforītu nogulsnes . Fosfors ir ārkārtīgi svarīgs biogēns elements, ko uzkrāj daudzi organismi. Daudzi fosfora koncentrācijas procesi zemes garozā ir saistīti ar biogēno migrāciju. Fosfors ir viegli nogulsnēts no ūdeņiem nešķīstošu minerālu veidā vai uztverts ar dzīvām vielām. Tāpēc jūras ūdens satur tikai 7 × 10-6% fosfora. Ir zināmi aptuveni 180 fosfora minerāli, galvenokārt dažādi fosfāti, no kuriem visizplatītākie ir kalcija fosfāti. . Fizikālās īpašības. Elementārais fosfors pastāv vairāku veidu formā
allotropās modifikācijas, no kurām galvenās ir balta, sarkana un melna. Baltais fosfors ir vaskaina, caurspīdīga viela ar raksturīgu smaržu, kas veidojas fosfora tvaiku kondensācijas rezultātā. Baltais fosfors piemaisījumu klātbūtnē - sarkanā fosfora, arsēna, dzelzs u.c. pēdas. - krāsots dzeltenā krāsā, tātad komerciāls baltais fosfors. sauc par dzeltenu. Ir divas baltā fosfora formas: a- un b-forma. a- modifikācija apzīmē kubiskās sistēmas kristālus ( A- 18,5); blīvums 1,828 g/cm3, t pl 44,1 °C, t kip 280,5 °C, saplūšanas siltums 2,5 kJ/mol P4 (0.6 kcal/mol P4), iztvaikošanas siltums 58.6 kJ/mol P4(14.0 kcal/mol P4) , tvaika spiediens pie 25 °C 5.7 n/m2 (0,043 mmHg Art.). Lineārās izplešanās koeficients temperatūras diapazonā no 0 līdz 44 °C ir 12,4 × 10-4 , siltumvadītspēja 0,56 otrdien/(m×K) 25 °C temperatūrā. Baltā fosfora elektriskās īpašības. tuvu dielektriķiem: joslas sprauga aptuveni 2,1 ev, elektriskā pretestība 1,54×1011 ohm× cm, diamagnētiskā, īpatnējā magnētiskā jutība - 0,86×10-6. Brinela cietība 6 Mn/m2 (0,6 kgf/mm2). Baltā fosfora a-forma labi šķīst oglekļa disulfīdā, mazāk labi šķidrā amonjakā, benzolā, tetrahloroglekā utt. Pie -76,9 °C un 0,1 spiediena Mn/m2(1kgf/cm2) a-forma pārvēršas par zemas temperatūras b-formu (blīvums 1,88 g/cm3). Palielinoties spiedienam līdz 1200 Mn/m2(12 tūkst kgf/cm2) pāreja notiek 64,5 °C temperatūrā. b-forma - kristāli ar dubultlaušanu, to struktūra nav galīgi noteikta. Baltais fosfors ir indīgs: gaisā aptuveni 40 °C temperatūrā
pašaizdegas, tāpēc jāuzglabā zem ūdens (šķīdība ūdenī 25 °C temperatūrā 3,3 × 10-4%) . Karsējot balto fosforu bez piekļuves gaisam 250-300 °C vairākas stundas, iegūst sarkano fosforu. Pāreja ir eksotermiska, to paātrina ultravioletie stari, kā arī piemaisījumi (jods, nātrijs, selēns). Parastais komerciālais sarkanais fosfors ir gandrīz pilnīgi amorfs; ir krāsa no tumši brūnas līdz purpursarkanai. Ilgstoši karsējot, tas var neatgriezeniski pārveidoties vienā no kristāliskajām formām (triklīniskā, kubiskā utt.) ar dažādām īpašībām: blīvums no 2,0 līdz 2,4 g/cm 3,t pl no 585 līdz 610 °C pie vairāku desmitu atmosfēru spiediena, sublimācijas temperatūra no 416 līdz 423 °C, elektriskā pretestība no 109 līdz 1014 ohm× cm. Sarkanais fosfors gaisā spontāni neaizdegas; līdz 240-250 °C temperatūrai, bet no berzes vai trieciena pašaizdegas; nešķīst ūdenī, kā arī benzolā, oglekļa disulfīdā u.c., šķīst fosfora tribromīdā. Sublimācijas temperatūrā sarkanais fosfors pārvēršas tvaikos, atdzesējot, veidojot galvenokārt balto fosforu. Kad balto fosforu uzkarsē līdz 200-220 °C zem spiediena (1,2-1,7) × 103 Mn/m 2
[(12-17) × 103 kgf / cm 2] veidojas melnais fosfors. Šo pārveidošanu var veikt bez spiediena, bet dzīvsudraba un neliela daudzuma melnā fosfora kristālu (sēklu) klātbūtnē 370 °C temperatūrā 8 dienas Melnais fosfors ir ortorombiskas struktūras kristāls ( A -3,31 , b - 4,38 , Ar-10.50), režģis veidots no šķiedrainiem slāņiem ar raksturīgu fosforu. atomu piramīdveida izkārtojums, blīvums 2.69 g/cm3, t pl aptuveni 1000 °C zem spiediena 1,8×103 Mn/m2(18 × 103 kgf/cm2). Pēc izskata melnais fosfors ir līdzīgs grafītam; pusvadītājs: joslas sprauga 0,33 ev 25 °C temperatūrā; īpatnējā elektriskā pretestība ir 1,5 ohm× cm, elektriskās pretestības temperatūras koeficients ir 0,0077, diamagnētiskā, īpatnējā magnētiskā jutība ir 0,27×10-6. Karsējot līdz 560-580 °C zem savu tvaiku spiediena, tas pārvēršas sarkanajā fosforā. Melnais fosfors ir mazaktīvs un aizdedzinot grūti aizdegas, tāpēc to var droši apstrādāt gaisā. Fosfora atomu rādiuss ir 1,34, jonu rādiuss: P5 + 0,35, P3 + 0,44, P3- 1,86.
Fosfora atomi apvienojas, veidojot diatomiskas (P2), tetraatomiskas (P4) un polimēru molekulas. Visstabilākās polimēru molekulas normālos apstākļos ir tās, kas satur garas savstarpēji savienotu P4 tetraedru ķēdes. Šķidrā, cietā (baltais fosfors) un tvaikos, kas ir zemāks par 800 °C, fosfors sastāv no P4 molekulām. Temperatūrā virs 800 °C P4 molekulas sadalās par P2 , kas savukārt temperatūrā virs 2000 °C sadalās atomos. Tikai baltais fosfors sastāv no P4 molekulām, visas pārējās modifikācijas ir polimēri. Ķīmiskās īpašības. Fosfora atoma ārējo elektronu konfigurācija 3 s2 3p3, V
savienojumiem raksturīgākie oksidācijas stāvokļi ir + 5, + 3 un - 3. Tāpat kā slāpeklis, arī fosfors savienojumos galvenokārt ir kovalents. Ir ļoti maz jonu savienojumu, piemēram, fosfīdu Na3P un Ca3P2. Atšķirībā no slāpekļa, fosforā ir brīvas 3 d- orbitāles ar diezgan zemu enerģiju, kas rada iespēju palielināt koordinācijas skaitu un veidot donora-akceptora saites. Fosfors ir ķīmiski aktīvs, baltajam fosforam ir vislielākā aktivitāte;
sarkanais un melnais fosfors ir daudz pasīvāks ķīmiskajās reakcijās. Baltā fosfora oksidēšana notiek, izmantojot ķēdes reakcijas mehānismu. Fosfora oksidēšanos parasti pavada hemiluminiscence. Fosforam sadegot skābekļa pārpalikumā, deficīta gadījumā veidojas pentoksīds P4O10 (vai P2O5), galvenokārt trioksīds P4O6 (vai P2O3). P4O7, P4O8 esamība tvaikos ir spektroskopiski pierādīta , P2O6, PO un citi fosfora oksīdi. Fosfora pentoksīdu ražo rūpnieciskā mērogā, sadedzinot elementāro fosforu sausā gaisa pārpalikumā. Sekojoša P4O10 hidratācija noved pie orto-(H3PO4) un poli-(H) veidošanās. n+2 P n O3 P+ 1) fosforskābes. Izņemot
Turklāt fosfors veido fosforskābi H3PO3, fosforskābi H4P2O6 un hipofosforskābi H3PO2, kā arī perskābes: perfosforskābi H4P2O8 un monoperfosforskābi H3PO5. Fosforskābju sāļus plaši izmanto , mazākā mērā - fosfīti un hipofosfīti. Fosfors savienojas tieši ar visiem halogēniem, lai atbrīvotu lielu
siltuma daudzums un trihalogenīdu (PX3, kur X ir halogēns), pentahalīdu (PX5) un oksihalogenīdu (piemēram, POX3) veidošanās . Fosforam saplūstot ar sēru temperatūrā zem 100 °C, veidojas cieti šķīdumi uz fosfora un sēra bāzes, un virs 100 °C notiek eksotermiska reakcija, veidojot kristāliskus sulfīdus P4S3, P4S5, P4S7, P4S10, no kuriem tikai P4S5 karsējot sadalās P4S3. virs 200 °C un P4S7, un pārējais kūst bez sadalīšanās. Ir zināmi šādi fosfora oksisulfīdi: P2O3S2, P2O3S3, P4O4S3, P6O10S5 un P4O4S3. Fosfors, salīdzinot ar slāpekli, ir mazāk spējīgs veidot savienojumus ar ūdeņradi. Fosfora hidrogēnfosfīnu PH3 un difosfīnu P2H4 var iegūt tikai netieši. No fosfora un slāpekļa savienojumiem zināmi nitrīdi PN, P2N3, P3N5 - cietas, ķīmiski stabilas vielas, kas iegūtas, izlaižot slāpekli ar fosfora tvaikiem caur elektrisko loku; polimēru fosfonitrila halogenīdi - (PNX2)n (piemēram, polifosfonitrila hlorīds) , iegūts, dažādos apstākļos reaģējot pentahalīdiem ar amonjaku; amidoimidofosfāti ir savienojumi, parasti polimēri, kas satur P-NH-P saites kopā ar P-O-P saitēm. Temperatūrā virs 2000°C fosfors reaģē ar oglekli, veidojot
PC3 karbīds ir viela, kas nešķīst parastos šķīdinātājos un nesadarbojas ne ar skābēm, ne ar sārmiem. Sildot ar metāliem, fosfors veido fosfīdus. Fosfors veido daudzus fosfororganiskos savienojumus. Kvīts. tiek veikta elementārā fosfora ražošana
tā elektrotermiskā reducēšana no dabīgiem fosfātiem (apatītiem vai fosforītiem) 1400-1600 °C temperatūrā ar koksu silīcija dioksīda (kvarca smilšu) klātbūtnē:
2Ca3(PO4)2 + 10C + n SiO2 = P4 + 10CO + 6CaO× n SiO2 iepriekš sasmalcināta un bagātināta fosforu saturoša rūda tiek sajaukta
noteiktas attiecības ar silīcija dioksīdu un koksu un ievietotas elektriskā krāsnī. Silīcija dioksīds ir nepieciešams, lai samazinātu reakcijas temperatūru, kā arī palielinātu tās ātrumu, saistot reducēšanas procesā izdalīto kalcija oksīdu kalcija silikātā, kas nepārtraukti tiek noņemts kā izkausēti izdedži. Sārņos nonāk arī alumīnija, magnija, dzelzs un citu piemaisījumu silikāti un oksīdi, kā arī ferofosfors (Fe2P, FeP, Fe3P), kas veidojas, daļai reducētās dzelzs mijiedarbojoties ar fosforu. Ferofosfors, kā arī neliels daudzums tajā izšķīdušo mangāna fosfīdu un citu metālu tiek izņemts no elektriskās krāsns, jo tie uzkrājas turpmākai izmantošanai īpašu tēraudu ražošanā. Fosfora tvaiki kopā ar gāzveida blakusproduktiem atstāj elektrisko krāsni.
produkti un gaistošie piemaisījumi (CO, SiF4, PH3, ūdens tvaiki, organisko lādiņu piemaisījumu pirolīzes produkti u.c.) 250-350 °C temperatūrā. Pēc attīrīšanas no putekļiem fosforu saturošas gāzes tiek nosūtītas uz kondensācijas iekārtām, kurās zem ūdens vismaz 50 °C temperatūrā tiek savākts šķidrais tehniskais baltais fosfors. Tiek izstrādātas metodes fosfora iegūšanai, izmantojot gāzveida
reducētājus, plazmas reaktorus, lai intensificētu ražošanu, paaugstinot temperatūru līdz 2500-3000 °C, t.i., augstāku par dabisko fosfātu un reducējošo gāzu (piemēram, metāna) disociācijas temperatūru, ko izmanto kā transportgāzi zemas temperatūras plazmā.
Pieteikums. Lielākā daļa saražotā fosfora tiek pārstrādāta fosforskābē un fosfora mēslošanas līdzekļos un uz tā bāzes iegūtos tehniskajos sāļos (fosfātos). . Balto fosforu izmanto aizdedzes un dūmu čaulās, bumbās; sarkans
fosfors - sērkociņu ražošanā. Fosforu izmanto krāsaino metālu sakausējumu ražošanā kā deoksidējošu līdzekli. Līdz 1% fosfora ievadīšana palielina sakausējumu, piemēram, fekrāla un hromāla, karstumizturību. Fosfors ir iekļauts dažās bronzās, jo palielina to plūstamību un izturību pret nodilumu. Pusvadītāju materiālu ražošanā un leģēšanā izmanto metālu fosfīdus, kā arī dažus nemetālus (B, Si, As u.c.). Fosforu daļēji izmanto hlorīdu un sulfīdu ražošanai, kas kalpo par izejmateriālu fosforu saturošu plastifikatoru (piemēram, trikrezilfosfāta, tributilfosfāta u.c.), medikamentu, fosfororganisko pesticīdu ražošanā, kā arī izmanto kā piedevas smērvielām. un degvielu. Drošības pasākumi. Baltais fosfors un tā savienojumi ir ļoti toksiski. Strādā ar
fosfors prasa rūpīgu iekārtu blīvēšanu; uzglabāt balto fosforu. jāatrodas zem ūdens vai hermētiski noslēgtā metāla traukā. Strādājot ar fosforu, stingri jāievēro drošības noteikumi. Fosfors organismā. Fosfors ir viens no svarīgākajiem biogēnajiem elementiem,
nepieciešami visu organismu dzīvībai. Tas atrodas dzīvās šūnās orto- un pirofosforskābes un to atvasinājumu veidā, kā arī ir daļa no nukleotīdiem, nukleīnskābēm, fosfoproteīniem, fosfolipīdiem, ogļhidrātu fosfora esteriem, daudziem koenzīmiem un citiem organiskiem savienojumiem. Fosfora atomi, tāpat kā sēra atomi, to ķīmiskās struktūras īpatnību dēļ spēj veidot ar enerģiju bagātas saites augstas enerģijas savienojumos; adenozīntrifosforskābe (ATP), kreatīnfosfāts uc Bioloģiskās evolūcijas procesā tieši fosfora savienojumi kļuva par galvenajiem, universālajiem ģenētiskās informācijas un enerģijas nesēju glabātājiem visās dzīvajās sistēmās. Dr. Fosfora savienojumu svarīgā loma organismā ir saistīta ar to, ka fosforilatlikuma () fermentatīvā pievienošana dažādiem organiskiem savienojumiem (fosforilēšana) kalpo kā “pāreja” to dalībai vielmaiņā un, gluži pretēji, šķelšanās. fosforil atlikums (defosforilēšana) izslēdz šos savienojumus no aktīvās apmaiņas. Fosfora metabolisma enzīmi - kināzes, fosforilāzes un fosfatāzes. Aknām ir galvenā loma fosfora savienojumu pārveidošanā dzīvnieku un cilvēku organismā. Fosfora savienojumu metabolismu regulē hormoni un D vitamīns. Fosfora saturs (mg uz 100 G sausna) augu audos - 230-350,
jūras dzīvnieki - 400-1800, sauszemes dzīvnieki - 1700-4400, baktērijas - apmēram 3000; cilvēka organismā īpaši daudz fosfora ir kaulaudos (nedaudz vairāk par 5000), smadzeņu audos (apmēram 4000) un muskuļos (220-270). Cilvēka ikdienas nepieciešamība pēc fosfora ir 1-1,2 G(bērniem tas ir augstāks nekā pieaugušajiem). No pārtikas produktiem visbagātākie ar fosforu ir siers, gaļa, olas, pākšaugi (zirņi, pupas u.c.). Fosfora līdzsvars organismā ir atkarīgs no vispārējā vielmaiņas stāvokļa. Fosfora metabolisma pārkāpums izraisa dziļas bioķīmiskas izmaiņas, galvenokārt enerģijas metabolismā. Ja organismā trūkst fosfora, dzīvniekiem un cilvēkiem attīstās osteoporoze un citas kaulu slimības, bet augiem rodas fosfora bads. . Fosfora avots dzīvajā dabā ir tā neorganiskie savienojumi, kas atrodas augsnē un izšķīdināti ūdenī. Fosforu no augsnes ekstrahē augi šķīstošo fosfātu veidā. Dzīvnieki parasti saņem pietiekami daudz fosfora ar uzturu. Pēc organismu nāves fosfors atkal nonāk augsnē un grunts nogulumos, tādējādi piedaloties. vielu ciklā. Fosfora svarīgā loma vielmaiņas procesu regulēšanā nosaka daudzu dzīvo šūnu enzīmu sistēmu augsto jutību pret fosfororganisko savienojumu darbību. Šo apstākli izmanto medicīnā zāļu izstrādē, lauksaimniecībā fosfora ražošanā
mēslošanas līdzekļiem, kā arī efektīvu insekticīdu izveidē. Daudzi fosfora savienojumi ir ārkārtīgi toksiski, un dažus fosfororganiskos savienojumus var klasificēt kā ķīmiskās kaujas vielas (sarīns, somans, tabuns). Fosfora radioaktīvo izotopu 32P plaši izmanto bioloģijā un medicīnā kā indikatoru visu veidu vielmaiņas un enerģijas pētījumos dzīvos organismos. . Fosforu saturošas zāles (adenozīntrifosforskābe,
fitīns, kalcija glicerofosfāts, fosfēns u.c.), ietekmē galvenokārt audu vielmaiņas procesus un tiek izmantoti muskuļu, nervu sistēmas, tuberkulozes, uztura zuduma, anēmijas uc gadījumos. Fosfora radioaktīvos izotopus izmanto kā izotopu indikatorus. pētīt vielmaiņu, slimību diagnostiku, kā arī audzēju staru terapijai .
Arsēns(lat. Arsenicum), As, Mendeļejeva periodiskās sistēmas V grupas ķīmiskais elements, atomskaitlis 33, atommasa 74,9216; tērauda pelēki kristāli. Elements sastāv no viena stabila izotopa 75As. Vēsturiska atsauce. Dabiski savienojumi arsēns ar sēru (orpiments As2S3,
realgar As4S4) bija zināmas antīkās pasaules tautām, kuras izmantoja šos minerālus kā zāles un krāsas. Bija zināms arī arsēna sulfīdu sadedzināšanas produkts - arsēna (III) oksīds As2O3 (“baltais arsēns”). Nosaukums arsenikón ir atrodams jau Aristotelī; tas ir atvasināts no grieķu valodas. ársen - spēcīgs, drosmīgs un kalpo arsēna savienojumu apzīmēšanai (pamatojoties uz to spēcīgo ietekmi uz ķermeni). Tiek uzskatīts, ka krievu nosaukums cēlies no “peles” (pēc arsēna preparātu izmantošanas peļu un žurku iznīcināšanai). Arsēna ražošana brīvā stāvoklī tiek attiecināta uz Albertu Magnusu (ap 1250. gadu). 1789. gadā A. Lavuazjē iekļāva arsēnu ķīmisko elementu sarakstā. Izplatība dabā. Vidējais arsēna saturs zemes garozā (klarks)
1,7·10-4% (pēc masas), šādos daudzumos tas ir lielākajā daļā magmatisko iežu. Tā kā arsēna savienojumi ir gaistoši augstā temperatūrā, elements neuzkrājas magmatisko procesu laikā; tas koncentrējas, izgulsnējot no karstiem dziļūdeņiem (kopā ar S, Se, Sb, Fe, Co, Ni, Cu un citiem elementiem). Vulkānu izvirdumu laikā arsēns tā gaistošo savienojumu veidā nonāk atmosfērā. Tā kā arsēns ir daudzvērtīgs, tā migrāciju lielā mērā ietekmē redoksvide. Zemes virsmas oksidējošos apstākļos veidojas arsenāti (As5+) un arsenīti (As3+). Tie ir reti minerāli, kas atrodami tikai arsēna atradņu apgabalos. Vietējais arsēns un As2+ minerāli ir vēl retāk sastopami. No daudzajiem arsēna minerāliem (apmēram 180) tikai arsenopirītam FeAsS ir galvenā rūpnieciskā nozīme. Neliels arsēna daudzums ir nepieciešams dzīvībai. Tomēr depozīta jomās
arsēns un jauno vulkānu darbība, augsnes dažviet satur līdz 1% arsēna, kas saistīts ar mājlopu slimībām un veģetācijas bojāeju. Arsēna uzkrāšanās īpaši raksturīga stepju un tuksnešu ainavām, kuru augsnēs arsēns ir neaktīvs. Mitrā klimatā arsēnu viegli izskalo no augsnes. Dzīvajā vielā arsēna ir vidēji 3·10-5%, upēs 3·10-7%. Atnesa arsēnu
upes ieplūst okeānā, tas salīdzinoši ātri nosēžas. Jūras ūdenī arsēna ir tikai 1·10-7%, bet mālos un slānekļos tas ir 6,6·10-4%. Nogulumiežu dzelzsrūdas un feromangāna mezgliņi bieži ir bagātināti ar arsēnu.
Fizikālās un ķīmiskās īpašības. Arsēnam ir vairākas alotropiskas modifikācijas. Normālos apstākļos visstabilākais ir tā sauktais metāliskais jeb pelēkais arsēns (a-As) – tēraudpelēka trausla kristāliska masa; svaigi saplīstot, tam ir metālisks spīdums gaisā, tas ātri izbalē, jo ir pārklāts ar plānu As2O3 plēvi. Pelēkā arsēna kristāliskais režģis ir romboedrisks ( A- 4,123 Å, leņķis a - 54о10", X- 0,226), slāņveida. Blīvums 5,72 g/cm3(pie 20°C), elektriskā pretestība 35·10-8 ohm× m, vai 35·10-6 ohm× cm, elektriskās pretestības temperatūras koeficients 3,9·10-3 (0о-100 оC), Brinela cietība 1470 Mn/ m2 vai 147 kgf/mm2(3-4 pēc Mosa); Arsēns ir diamagnētisks. Atmosfēras spiedienā arsēns sublimējas 615 °C temperatūrā bez kušanas, jo trīskāršais punkts (sk. fāzes diagrammu) a-As atrodas 816 °C un 36 spiedienā. plkst. Arsēna tvaiki sastāv no As4 molekulām līdz 800?C, virs 1700?C - tikai As2. Arsēna tvaikiem kondensējoties uz virsmas, ko atdzesē šķidrs gaiss, veidojas dzeltens arsēns - caurspīdīgi, mīksti kristāli kā vasks, ar blīvumu 1,97 g/cm3, pēc īpašībām līdzīgas baltajam fosforam. Gaismā vai zemā karstumā tas pārvēršas pelēkā arsēnā. Ir zināmas arī stiklveida amorfās modifikācijas: melnais arsēns un brūnais arsēns, kas, karsējot virs 270 C, pārvēršas par pelēko M. Arsēna atoma ārējo elektronu konfigurācija 3 d 104s 24lpp 3. Arsēns savienojumos
ir oksidācijas pakāpes + 5, + 3 un - 3. Pelēkais arsēns ir daudz mazāk ķīmiski aktīvs nekā fosfors. Karsējot gaisā virs 400°C, arsēns sadedzina, veidojot As2O3. Arsēns savienojas tieši ar halogēniem; normālos apstākļos AsF5 ir gāze; AsF3, AsCl3, AsBr3 - bezkrāsaini, ļoti gaistoši šķidrumi; AsI3 un As2l4 ir sarkani kristāli. Karsējot arsēnu un sēru, tiek iegūti sulfīdi: oranži sarkans As4S4 un citrondzeltens As2S3. Gaiši dzeltenais sulfīds As2S5 tiek izgulsnēts, ievadot H2S ar ledu atdzesētā arsēnskābes (vai tās sāļu) šķīdumā kūpošā sālsskābē: 2H3AsO4 + 5H2S = As2S5 + 8H2O; Apmēram 500°C temperatūrā tas sadalās As2S3 un sērā. Visi M. sulfīdi nešķīst ūdenī un atšķaidītās skābēs. Spēcīgi oksidētāji (HNO3 + HCl, HCl + KClO3 maisījumi) pārvērš tos H3AsO4 un H2SO4 maisījumā. As2S3 sulfīds viegli šķīst amonija un sārmu metālu sulfīdos un polisulfīdos, veidojot skābju sāļus - tioarsēna H3AsS3 un tioarsēna H3AsS4. Ar skābekli arsēns rada oksīdus: oksīdu M. (III) As2O3 - arsēna anhidrīdu un oksīdu M. (V) As2O5 - arsēna anhidrīdu. Pirmais no tiem veidojas skābekļa iedarbībā uz metālu vai tā sulfīdiem, piemēram, 2As2S3 + 9O2 - 2As2O3 + 6SO2. As2O3 tvaiki kondensējas bezkrāsainā stiklveida masā, kas laika gaitā kļūst necaurspīdīga, veidojoties maziem kubiskiem kristāliem, blīvums 3,865 g/cm3. Tvaika blīvums atbilst formulai As4O6: virs 1800?C tvaiki sastāv no As2O3. Pie 100 Gūdens šķīst 2.1 G As2O3 (pie 25oC). M. oksīds (III) ir amfoterisks savienojums ar pārsvaru skābām īpašībām. Ir zināmi sāļi (arsenīti), kas atbilst ortoarsēnskābēm H3AsO3 un metaarsenskābēm HAsO2; pašas skābes nav iegūtas. Ūdenī šķīst tikai sārmu metālu un amonija arsenīti. As2O3 un arsenīti parasti ir reducētāji (piemēram, As2O3 + 2I2 + 5H2O - 4HI + 2H3AsO4), bet var būt arī oksidētāji (piemēram, As2O3 + 3C - 2As + 3CO). Arsēna (V) oksīdu iegūst, karsējot arsēnskābi H3AsO4 (apmēram
200oC). Tas ir bezkrāsains un sadalās aptuveni 500°C temperatūrā As2O3 un O2. Arsēnskābi iegūst, iedarbojoties ar koncentrētu HNO3 uz As vai As2O3. Arsēnskābes sāļi (arsenāti) nešķīst ūdenī, izņemot sārmu metālu un amonija sāļus. Ir zināmi sāļi, kas atbilst ortoarsēna H3AsO4, metaarseniskā HAsO3 un piroarsēna H4As2O7 skābēm; pēdējās divas skābes netika iegūtas brīvā stāvoklī. Leģējot ar metāliem, arsēns pārsvarā veido savienojumus (arsenīdus).
Kvīts un pieteikums. Arsēnu rūpnieciski iegūst, karsējot arsēna pirītus:
FeAsS - FeS + As vai (retāk) As2O3 reducēšana ar akmeņoglēm. Abi procesi tiek veikti retortēs no
ugunsizturīgs māls, kas savienots ar uztvērēju arsēna tvaiku kondensācijai. Arsēna anhidrīdu iegūst, oksidējot arsēna rūdas, vai kā blakusproduktu, apgrauzdējot polimetāla rūdas, kuras gandrīz vienmēr satur arsēnu. Oksidatīvās grauzdēšanas laikā veidojas As2O3 tvaiki, kas kondensējas savākšanas kamerās. Neapstrādāts As2O3 tiek attīrīts ar sublimāciju 500–600 °C temperatūrā. Attīrītu As2O3 izmanto arsēna un tā preparātu ražošanai.
Svinā, ko izmanto šautenes šāvienu ražošanai, ievada nelielas arsēna piedevas (0,2-1,0% no svara) (arsēns palielina izkausētā svina virsmas spraigumu, kā rezultātā šāviens iegūst sfērisku formu; arsēns nedaudz palielina cietību no svina). Kā daļējs antimona aizstājējs arsēns ir iekļauts dažos babitos un apdrukas sakausējumos. Tīrs arsēns nav indīgs, bet visi tā savienojumi, šķīst ūdenī vai spēj
iedziļināties šķīdumā kuņģa sulas ietekmē, ārkārtīgi indīgs; Īpaši bīstams ir arsēna ūdeņradis. No ražošanā izmantotajiem arsēna savienojumiem arsēna anhidrīds ir toksiskākais. Gandrīz visas krāsaino metālu sulfīdu rūdas, kā arī dzelzs (sēra) pirīts satur arsēna piejaukumu. Tāpēc to oksidatīvās grauzdēšanas laikā kopā ar sēra dioksīdu SO2 vienmēr veidojas As2O3; Lielākā daļa no tā kondensējas dūmu kanālos, bet, ja nav attīrīšanas iekārtu vai tās efektivitāte ir zema, rūdas apdedzināšanas krāšņu izplūdes gāzes aizvada ievērojamu daudzumu As2O3. Tīrs arsēns, lai gan tas nav indīgs, vienmēr ir pārklāts ar toksiska As2O3 pārklājumu, ja to uzglabā gaisā. Ja nav pienācīgas ventilācijas, metālu (dzelzs, cinka) kodināšana ar rūpniecisko sērskābi vai sālsskābi, kas satur arsēnu, ir ārkārtīgi bīstama, jo tā rada arsēna ūdeņradi. Arsēns organismā. Kā mikroelements arsēns ir visuresošs
dzīvajā dabā. Vidējais arsēna saturs augsnēs ir 4·10-4%, augu pelnos - 3·10-5%. Arsēna saturs jūras organismos ir lielāks nekā sauszemes organismos (zivīs 0,6-4,7 mg 1 Kilograms jēlviela uzkrājas aknās). Vidējais arsēna saturs cilvēka organismā ir 0,08-0,2 mg/kg. Asinīs arsēns koncentrējas sarkanajās asins šūnās, kur tas saistās ar hemoglobīna molekulu (un globīna frakcijā ir divreiz vairāk nekā hema). Lielākais tā daudzums (uz 1 G audi) atrodas nierēs un aknās. Daudz arsēna atrodams plaušās un liesā, ādā un matos; salīdzinoši maz - cerebrospinālajā šķidrumā, smadzenēs (galvenokārt hipofīzē), dzimumdziedzeros u.c.. Audos arsēns ir atrodams galvenajā proteīna frakcijā, daudz mazāk skābē šķīstošajā frakcijā, un tiek konstatēta tikai neliela daļa no tā. lipīdu frakcijā. Arsēns piedalās redoksreakcijās: komplekso ogļhidrātu oksidatīvā sadalīšanā, fermentācijā, glikolīzē uc Arsēna savienojumus bioķīmijā izmanto kā specifiskus enzīmu inhibitorus vielmaiņas reakciju pētīšanai. Arsēns medicīnā. Organiskie arsēna savienojumi (aminarsons, miarsenols,
novarsenāls, osarsols) lieto galvenokārt sifilisa un vienšūņu slimību ārstēšanai. Kā vispārēji stiprinoši un tonizējoši līdzekļi tiek noteikti arsēna neorganiskie preparāti - nātrija arsenīts (nātrija arsēnskābe), kālija arsēns (kālija arsēnskābe), arsēna anhidrīds As2O3. Lietojot lokāli, neorganiskie arsēna preparāti var izraisīt nekrotizējošo efektu bez iepriekšēja kairinājuma, padarot šo procesu gandrīz nesāpīgu; šī īpašība, kas ir visizteiktākā As2O3, tiek izmantota zobārstniecībā
zobu pulpas iznīcināšana. Psoriāzes ārstēšanai izmanto arī neorganisko arsēna preparātus. Mākslīgi iegūti radioaktīvie izotopi M. 74As (T1/2 - 17,5 dienas) un 76As (T1/2
26,8 h) tiek izmantoti diagnostikas un terapeitiskos nolūkos. Ar to palīdzību tiek noskaidrota smadzeņu audzēju atrašanās vieta un noteikta to izņemšanas radikalitātes pakāpe. Radioaktīvo arsēnu dažkārt izmanto asins slimībām utt. Saskaņā ar Starptautiskās radiācijas aizsardzības komisijas ieteikumiem
maksimāli pieļaujamais 76As saturs organismā 11 Mccurie. Saskaņā ar PSRS pieņemtajiem sanitārajiem standartiem maksimālā pieļaujamā 76As koncentrācija ūdenī un atklātos rezervuāros ir 1·10-7 kirī/l, darba telpu gaisā 5·10-11 kirī/l. Visi arsēna preparāti ir ļoti indīgi. Akūtas saindēšanās gadījumā tiek novērotas stipras sāpes vēderā, caureja un nieru bojājumi; Iespējams sabrukums un krampji. Hroniskas saindēšanās gadījumā visbiežāk sastopami kuņģa-zarnu trakta traucējumi, elpceļu gļotādu katars (faringīts, laringīts, bronhīts), ādas bojājumi (ekzantēma, melanoze, hiperkeratoze), jutīguma traucējumi; iespējama aplastiskās anēmijas attīstība. Saindēšanās ārstēšanā ar arsēna preparātiem vislielākā nozīme ir unitiolam. Būtu jācenšas novērst rūpnieciskās saindēšanās gadījumus
galvenokārt par tehnoloģiskā procesa mehanizāciju, blīvēšanu un putekļu noņemšanu, radot efektīvu ventilāciju un nodrošinot darbiniekus ar individuālajiem aizsardzības līdzekļiem pret putekļu iedarbību. Nepieciešamas regulāras darbinieku medicīniskās pārbaudes. Sākotnējās medicīniskās pārbaudes tiek veiktas, pieņemot darbā, un darbiniekiem - reizi sešos mēnešos.
ANTIMONS(lat. Stibium), Sb, Mendeļejeva periodiskās sistēmas V grupas ķīmiskais elements; atomskaitlis 51, atommasa 121,75; Metāls ir sudrabaini balts ar zilganu nokrāsu. Dabā ir zināmi divi stabili izotopi: 121Sb (57,25%) un 123Sb (42,75%). No mākslīgi iegūtajiem radioaktīvajiem izotopiem nozīmīgākais ir 122Sb ( T 1/2 - 2,8 cym), 124Sb ( T 1/2 - 60,2 cym) un 125Sb ( T 1/2 - 2 gadi).
Vēsturiska atsauce. Antimons ir zināms kopš seniem laikiem. Austrumu valstīs to izmantoja aptuveni 3000. gadā pirms mūsu ēras. e. kuģu izgatavošanai. Senajā Ēģiptē jau 19. gs. BC e. Uzacu melnošanai tika izmantots antimona spīduma pulveris (dabisks Sb2S3), ko sauc par mesten vai kātu. Senajā Grieķijā tas bija pazīstams kā stími un stíbi, tāpēc latīņu stibium. Apmēram 12-14 gs. n. e. parādījās nosaukums antimonijs. 1789. gadā A. Lavuazjē iekļāva antimonu ķīmisko elementu sarakstā, ko sauc par antimoine (mūsdienu angļu antimons, spāņu un itāļu antimonio, vācu Antimon). Krievu "antimons" nāk no turku sürme; tas apzīmēja svina spīduma pulveri PbS, ko izmantoja arī uzacu melnināšanai (saskaņā ar citiem avotiem "antimons" - no persiešu valodas surme - metāls). Detalizētu antimona un tā savienojumu īpašību un ražošanas metožu aprakstu pirmo reizi sniedza alķīmiķis Vasilijs Valentīns (Vācija) 1604. gadā. Izplatība dabā. Vidējais antimona saturs zemes garozā (klarkā) 5 ×10-5
% pēc svara. Antimons ir izkliedēts magmā un biosfērā. No karstajiem pazemes ūdeņiem tas koncentrējas hidrotermālās atradnēs. Ir zināmas pašas antimona nogulsnes, kā arī antimona-dzīvsudraba, antimona-svina, zelta-antimona un antimona-volframa nogulsnes. No 27 antimona minerāliem stibnītam (Sb2S3) ir liela rūpnieciska nozīme. . Pateicoties tā afinitātei ar sēru, antimons bieži tiek atrasts kā piemaisījums arsēna, bismuta, niķeļa, svina, dzīvsudraba, sudraba un citu elementu sulfīdos. Fizikālās un ķīmiskās īpašības. Antimons ir zināms kristāliskā un trīs
amorfās formas (sprādzienbīstamas, melnas un dzeltenas). Sprādzienbīstams antimons (blīvums 5,64-5,97 g/cm 3) eksplodē uz jebkura kontakta: veidojas šķīduma elektrolīzes laikā
SbCl3; melns (blīvums 5.3 g/cm 3) - ar ātru antimona tvaiku dzesēšanu; dzeltens - kad skābeklis tiek nodots sašķidrinātā SbH3. Dzeltenais un melnais antimons ir nestabils zemā temperatūrā, tie pārvēršas par parastu antimonu. Stabilākais kristāliskais antimons , kristalizējas trigonālajā sistēmā, A - 4,5064 ; blīvums 6,61-6,73 g/cm 3(šķidrums - 6,55 g/cm 3); t mp 630,5 °C; t kip1635-1645 °C; īpatnējā siltumietilpība pie 20-100 °C 0,210 kJ/(kg × UZ ) ; siltumvadītspēja pie 20 °C 17.6 W/M× K. Lineārās izplešanās temperatūras koeficients polikristāliskajam C. 11,5 × 10-6 pie 0-100 °C; monokristālam a1 - 8,1 × 10-a2 - 19,5 × 10-6 pie 0-400 °C, elektriskā pretestība (20 °C) (43,045 × 10-6 ohm× cm). Antimons ir diamagnētisks, īpatnējā magnētiskā jutība ir -0,66 ×10-6. Atšķirībā no vairuma metālu, antimons ir trausls, viegli sadalās pa šķelšanās plaknēm, sasmalcina pulverī un nevar tikt kalts (dažreiz to klasificē kā pusmetālu) . Mehāniskās īpašības ir atkarīgas no metāla tīrības. Brinela cietība lietam metālam 325-340 Mn/m 2 (32,5-34,0 kgf/mm 2); elastības modulis 285-300; stiepes izturība 86,0 Mn/m 2 (8,6 kgf/mm 2). Sb5s25r3 atoma ārējo elektronu konfigurācija. Savienojumos tas uzrāda galvenokārt +5, +3 un -3 oksidācijas pakāpes. Ķīmiski antimons ir neaktīvs. Neoksidējas gaisā līdz
kušanas temperatūra. Antimons nereaģē ar slāpekli un ūdeņradi. Ogleklis nedaudz izšķīst izkausētā antimonā. Metāls aktīvi mijiedarbojas ar hloru un citiem halogēniem, veidojot antimona halogenīdus. Reaģē ar skābekli temperatūrā virs 630 °C, veidojot Sb2O3 . Sakausējot ar sēru, tiek iegūti antimona sulfīdi, un tas arī mijiedarbojas ar fosforu un arsēnu. Antimons ir izturīgs pret ūdeni un atšķaidītām skābēm. Koncentrētas sālsskābes un sērskābes lēnām izšķīdina antimonu, veidojot SbCl3 hlorīdu un Sb2 (SO4)3 sulfātu; koncentrēta slāpekļskābe oksidē antimonu par augstāku oksīdu, kas veidojas hidratēta savienojuma veidā xSb2O5 ×yH2O. Praktiski interesanti ir slikti šķīstošie antimonskābes sāļi - antimonāti (MeSbO3 × 3H2O, kur Me ir Na, K) un neizolētas metaantimonskābes sāļi - metaantimonīti (MeSbO2 × 3H2O), kuriem piemīt reducējošas īpašības. S. savienojas ar metāliem, veidojot antimonīdus. Kvīts. Antimonu iegūst ar pirometalurģiskām un hidrometalurģiskām metodēm
koncentrātu vai rūdas apstrāde, kas satur 20-60% Sb. Pirometalurģiskās metodes ietver nogulsnēšanu un reducēšanas kausēšanu. Izejvielas nokrišņu kausēšanai ir sulfīdu koncentrāti; procesa pamatā ir antimona pārvietošana no tā sulfīda ar dzelzi: Sb2S3 + 3Fe Û 2Sb + 3FeS. Dzelzs tiek ievadīts lādiņā lūžņu veidā. Kausēšanu veic reverberējošās vai īsas rotācijas bungu krāsnīs 1300-1400 °C temperatūrā. Antimona reģenerācija neapstrādātā metālā ir vairāk nekā 90%. Antimona reducējošā kausēšana balstās uz tā oksīdu reducēšanu līdz metāliem ar kokogles vai akmeņogļu putekļiem un atkritumiežu izsārņošanu. Pirms reducēšanas kausēšanas tiek veikta oksidatīvā grauzdēšana 550 °C temperatūrā ar gaisa pārpalikumu. Plēnes sastāvā ir negaistošs antimona tetroksīds. Elektriskās krāsnis var izmantot gan nokrišņu, gan reducēšanas kausēšanai. Hidrometalurģiskā metode antimona iegūšanai sastāv no diviem posmiem: izejmateriāla apstrāde ar sārmaina sulfīda šķīdumu, antimona pārvietošana šķīdumā antimona skābju un sulfosāļu sāļu veidā un antimona atdalīšana. elektrolīze. Rupjš antimons, atkarībā no izejmateriāla sastāva un ražošanas metodes, satur no 1,5 līdz 15% piemaisījumu: Fe, As, S uc Lai iegūtu tīru antimonu, tiek izmantota pirometalurģiska vai elektrolītiskā attīrīšana. Pirometalurģiskās attīrīšanas laikā dzelzs un vara piemaisījumi tiek noņemti sēra savienojumu veidā, ievadot antimonu (crudum) - Sb2S3 - antimona kausējumā, pēc tam arsēnu (nātrija arsenāta veidā) un sēru atdala, pūšot gaisu zem ūdens. sodas izdedži. Elektrolītiskās attīrīšanas laikā ar šķīstošu anodu rupjš antimons tiek attīrīts no dzelzs, vara un citiem metāliem, kas paliek
elektrolīts (Cu, Ag, Au paliek dūņās). Elektrolīts ir šķīdums, kas sastāv no SbF3, H2SO4 un HF. Piemaisījumu saturs rafinētā antimonā nepārsniedz 0,5-0,8%. Lai iegūtu augstas tīrības pakāpes antimonu, tiek izmantota zonas kausēšana inertas gāzes atmosfērā vai antimonu iegūst no iepriekš attīrītiem savienojumiem - trioksīda vai trihlorīda. Pieteikums. Antimonu galvenokārt izmanto svina un alvas sakausējumu veidā
akumulatoru plāksnēm, kabeļu apvalkiem, gultņiem (babbitt) , sakausējumi, ko izmanto drukāšanā (hart) , uc Šādiem sakausējumiem ir paaugstināta cietība, nodilumizturība un izturība pret koroziju. Luminiscences spuldzēs Sb tiek aktivizēts ar kalcija halofosfātu. Antimons ir iekļauts pusvadītāju materiālos kā piemaisījums germānijam un silīcijam, kā arī antimonīdos (piemēram, InSb). Radioaktīvo izotopu 12Sb izmanto g-starojuma un neitronu avotos. Antimons organismā. Antimona saturs (uz 100 G sausna) atrodas
augi 0,006 mg, jūras dzīvniekiem 0,02 mg, sauszemes dzīvniekiem 0,0006 mg. Antimons nonāk dzīvnieku un cilvēku organismā caur elpošanas sistēmu vai kuņģa-zarnu traktu. Tas izdalās galvenokārt ar fekālijām un nelielos daudzumos ar urīnu. Antimona bioloģiskā loma nav zināma. Tas selektīvi koncentrējas vairogdziedzerī, aknās un liesā. Eritrocītos antimons uzkrājas pārsvarā oksidācijas stāvoklī + 3, asins plazmā - oksidācijas stāvoklī + 5. Maksimāli pieļaujamā koncentrācija C. 10-5 - 10-7 G par 100 G sausu drānu. Augstākās koncentrācijās šis elements inaktivē vairākus lipīdu, ogļhidrātu un olbaltumvielu metabolisma enzīmus (iespējams, sulfhidrilgrupu bloķēšanas rezultātā). . Medicīnas praksē tiek izmantoti antimona preparāti (soliusurmīns utt.).
galvenokārt leišmaniozes un dažu helmintiāžu (piemēram, šistosomiāzes) ārstēšanai. Antimons un tā savienojumi ir indīgi. Kausējot koncentrātu, iespējama saindēšanās
antimona rūdas un antimona sakausējumu ražošanā. Akūtas saindēšanās gadījumā - augšējo elpceļu, acu un ādas gļotādu kairinājums. Var attīstīties dermatīts, konjunktivīts uc Ārstēšana: pretlīdzekļi (unitiols), diurētiskie līdzekļi un sviedrēšanas līdzekļi uc Profilakse: ražošanas mehanizācija. procesi, efektīva ventilācija utt.
BISMUTS(lat. Bismuts), Bi, V periodiskās grupas ķīmiskais elements
Mendeļejeva sistēma; atomskaitlis 83, atommasa 208,980; sudrabaini pelēks metāls ar sārtu nokrāsu. Dabīgais bismuts sastāv no viena stabila izotopa 209Bi. V. bija pazīstams 15-16 gadsimtā, bet ilgu laiku tika uzskatīts par alvas veidu,
svins vai antimons. Bismuts tika atzīts par neatkarīgu metālu 18. gadsimta vidū. Franču ķīmiķis A. Lavuazjē to iekļāva vienkāršo ķermeņu sarakstā. Nosaukuma "bismuts" izcelsme nav noskaidrota. Bismuta saturs zemes garozā ir 2·10-5 masas %. Bismuts dabiski sastopams
daudzu minerālu veidā, no kuriem nozīmīgākie ir bismuta spīdums Bi2S3, vietējais bismuts Bi, bismīts Bi2O3 u.c. Lielākos daudzumos, bet nelielās koncentrācijās, bismuts kā izomorfs piemaisījums atrodams svinā-cinkā, varā, molibdēnā -kobalta un alvas-volframa rūdas. Apmēram 90% no globālā patēriņa sedz saistītā bismuta ražošana polimetālu rūdu pārstrādes laikā. Fizikālās un ķīmiskās īpašības. Bismutam ir romboedrisks režģis ar
periodā a- 4,7457 A un leņķis α-57?14 " 13"" . Blīvums 9,80 g/cm 3; t pl 271,3°C; t temperatūra 1560 °C. Īpatnējā siltumietilpība (20 °C) 123,5 J/kg K (0,0294 kal/g· AR); termiskais koeficients
lineārā izplešanās istabas temperatūrā 13,3·10-6; siltumvadītspēja (20°C) 8.37 W/(m·UZ) ; elektriskā pretestība (20°C) 106,8 10-8 ohm· m(106,8·10-6 ohm· cm). Bismuts ir diamagnētiskākais metāls. Īpatnējā magnētiskā jutība ir -1,35·10-6. Magnētiskā lauka ietekmē bismuta elektriskā pretestība palielinās lielākā mērā nekā citiem metāliem, ko izmanto spēcīgu magnētisko lauku indukcijas mērīšanai. Bismuta termiskās neitronu uztveršanas šķērsgriezums ir mazs (34 10-31 m 2 vai 0,034 kūts). Istabas temperatūrā bismuts ir trausls, viegli sadalās pa šķelšanās plaknēm un porcelāna javā tiek samalts pulverī. Kalšana 120-150°C temperatūrā; ar karsto presēšanu (pie 240-250°C) var izgatavot stiepli ar diametru līdz 0,1 mm, kā arī plāksnes ar biezumu 0,2-0,3 mm. Brinela cietība 93 Mn/m 2 (9,3 kgf/mm 2), saskaņā ar Mosa 2.5. Kūstot V. samazinās tilpums par 3,27%. Bismuts ir stabils sausā gaisā, bet mitrā gaisā tā virsma
oksidēšanās. Sildot virs 1000°C, tas sadeg ar zilganu liesmu, veidojot Bi2O3 oksīdu . Sprieguma virknē bismuts atrodas starp ūdeņradi un varu, tāpēc tas nešķīst atšķaidītā sērskābē un sālsskābē; izšķīšana koncentrētā sērskābē un slāpekļskābē notiek līdz ar SO2 un atbilstošo slāpekļa oksīdu izdalīšanos. Bismuta valences vērtība ir 2, 3 un 5. Bismuta savienojumi ar zemāku valenci
ir bāzes raksturs, augstākie ir skābi. No skābekļa savienojumiem pasaulē svarīgākais ir trioksīds Bi2O3, kas karsējot maina savu dzelteno krāsu uz sarkanbrūnu. Bi2O3 izmanto bismuta sāļu iegūšanai. Atšķaidītos šķīdumos bismuta sāļi hidrolizējas. BiCl3 hlorīds tiek hidrolizēts ar oksihlorīda BiOCl nogulsnēšanos, Bi nitrātu (NO3)3 - ar galvenā sāls BiONO3·BiOOH izgulsnēšanos. Tā attīrīšanai tiek izmantota V. sāļu hidrolīzes spēja. 5-valentā bismuta savienojumus ir grūti iegūt; tie ir spēcīgi oksidētāji. KBiO3 sāls (atbilst anhidrīdam Bi2O5) veidojas brūni sarkanu nogulšņu veidā uz platīna anoda KOH, KCl un Bi2O3 suspensijas maisījuma viršanas šķīduma elektrolīzes laikā. Bismuts viegli savienojas ar halogēniem un sēru. Kad skābes iedarbojas uz bismuta un magnija sakausējumu, veidojas bismuts (bismuta ūdeņradis) BiH3; Atšķirībā no arsīna AsH3, bismutīns ir nestabils savienojums un nav iegūts tīrā veidā (bez liekā ūdeņraža). Ar dažiem metāliem (svins, kadmijs, alva) bismuts veido zemas kušanas eitektiku; ar nātriju, kāliju, magniju un kalciju - intermetāliski savienojumi, kuru kušanas temperatūra ir ievērojami augstāka par sākotnējo komponentu kušanas temperatūru. Bismuts nesadarbojas ar izkausētu alumīniju, hromu un dzelzi. Kvīts un pieteikums. Galvenais bismuta daudzums tiek ražots kā blakusprodukts
neapstrādāta svina (werkbley) uguns attīrīšana. Pirometalurģiskā metode ir balstīta uz bismuta spēju veidot ugunsizturīgus intermetāliskus savienojumus ar K, Na, Mg un Ca. Norādītos metālus pievieno izkausētajam svinam un no kausējuma atdala iegūtos cietos savienojumus ar V. (sārām). Ievērojams daudzums bismuta tiek iegūts no dūņām, kas radušās svina elektrolītiskās attīrīšanas hidrofluorsilicic šķīdumā, kā arī no putekļiem un nogulsnēm, kas rodas vara ražošanā. Bismutu saturošus sārņus un dūņas kausē zem sārmainiem sārņiem. Iegūtais neapstrādātais metāls satur As, Sb, Cu, Pb, Zn, Se, Te, Ag un dažu citu elementu piemaisījumus. Bismuta kausēšana no savām rūdām tiek veikta nelielā mērogā. Sulfīdu rūdas apstrādā, kausējot ar nokrišņiem ar dzelzs lūžņiem. No oksidētām rūdām zelts tiek reducēts ar akmeņoglēm zem zemas kušanas plūsmas slāņa. Rupja ūdens tīrīšanai tos izmanto atkarībā no piemaisījumu sastāva.
dažādas metodes: zeigerizācija, oksidatīvā attīrīšana sārmainā plūsmā, saplūšana ar sēru uc Visgrūtāk atdalāmais svina piemaisījums tiek noņemts (līdz 0,01%), izpūšot hloru cauri izkausētajam metālam. Komerciālais bismuts satur
99,9-99,98% parasto metālu. V. augstas tīrības pakāpes iegūst zonu pārkristalizācijā kvarca laivās inertās gāzes atmosfērā. Ievērojams daudzums bismuta tiek izmantots zemas kušanas temperatūras sakausējumu, kas satur svinu, alvu, kadmiju, pagatavošanai, ko izmanto zobu protezēšanā, klišeju izgatavošanai no koka matricām, kā kausējamos vāciņus automātiskajās ugunsdzēsības ierīcēs, lodējot vāciņus uz bruņas caurdurošiem šāviņiem utt. Izkausēts bismuts var kalpot kā dzesēšanas šķidrums kodolreaktoros. Bismuta patēriņš savienojumos ar Te par
termoelektriskie ģeneratori. Šie savienojumi, pateicoties siltumvadītspējas, elektrovadītspējas un termoelektromotīves spēka labvēlīgajai kombinācijai, ļauj ar augstu efektivitāti (~7%) pārvērst siltumenerģiju elektroenerģijā. Bismuta pievienošana nerūsējošajiem tēraudiem uzlabo to apstrādājamību. Bismuta savienojumus izmanto stikla ražošanā, keramikā, farmācijā
nozare. Šķīstošie bismuta sāļi ir indīgi un tiem ir līdzīga iedarbība kā dzīvsudrabam.
Literatūra
1. Kaitīgās vielas rūpniecībā, saskaņā ar vispārīgo. ed. N. V. Lazareva, 6. izd., 2. daļa, Ļeņingrada, 1971. gads.
2. Ivanovs V.V. Elementu ekoloģiskā ģeoķīmija. 3. Pētījumi jaunas tehnoloģijas radīšanas jomā antimona un tā ražošanai
savienojumi, krājumā: Antimona ķīmija un tehnoloģija, Francija, 1965. 4. Īsa ķīmiskā enciklopēdija, 5. sēj., M., 1967; 5. Nekrasov B.V., Vispārīgās ķīmijas pamati, 1. sēj., M., 1965; 6. Pogodin S.A., Arsēns, grāmatā: Brief Chemical Encyclopedia, Vol 3, M., 1964 7. Remy G., Course of Inorganic chemy, trans. no vācu val., 1. sēj., M., 1963. lpp. 700-712; 8. Tomsons J. G., Bismuts, tulk. [no angļu val.], L., 1932; 9. Shiyanov A.G., Antimona ražošana, M., 1961; Metalurģijas pamati, 5. sēj., M.,
1968. gads; 10. Saistītā slāpekļa ķīmija un tehnoloģija, [M.-L.], 1934; KHE, 1. sēj., M., 1961.
Slāpekļa apakšgrupa sastāv no pieciem elementiem: slāpekļa, fosfora, arsēna, antimona un bismuta. Tie ir D.I. Mendeļejeva periodiskās sistēmas V grupas p-elementi.
Ārējā enerģijas līmenī šo elementu atomi satur piecus elektronus, kuriem ir ns2np3 konfigurācija un kas ir sadalīti šādi:

Tāpēc augstākais šo elementu oksidācijas līmenis ir +5, zemākais ir -3, un raksturīgs arī +3.
Trīs nepāra elektronu klātbūtne ārējā līmenī norāda uz to, ka neuzbudinātā stāvoklī elementu atomu valence ir 3. Slāpekļa atoma ārējais līmenis sastāv tikai no diviem apakšlīmeņiem - 2s un 2p. Šīs apakšgrupas atlikušo elementu atomos ir brīvas d-apakšlīmeņa šūnas ārējos enerģijas līmeņos. Līdz ar to viens no ārējā līmeņa s-elektroniem, ierosinot, var pāriet uz tā paša līmeņa d-apakšlīmeni, kas noved pie 5 nepāra elektronu veidošanās.

fosfora ārējais elektronu apvalks (neuzbudināts atoms)

ierosināta fosfora atoma ārējais elektronu apvalks.
Tādējādi fosforam, arsēnam, antimonam un bismutam ierosinātā stāvoklī ir 5 nepāra elektroni, un to valence šajā stāvoklī ir 5.
Slāpekļa atomā elektronu šādā veidā ierosināt nav iespējams, jo otrajā līmenī nav d-apakšlīmeņa. Tāpēc slāpeklis nevar būt piecvērtīgs, bet tas var veidot ceturto kovalento saiti ar donora-akceptora mehānismu, pateicoties vientuļajam elektronu pārim 2s2. Slāpekļa atomam ir iespējams arī cits process. Kad tiek noņemts viens no diviem 2s elektroniem, slāpeklis kļūst par atsevišķi lādētu četrvērtīgu jonu N+.

No slāpekļa līdz bismutam palielinās atomu rādiusi un samazinās jonizācijas potenciāls. Neitrālu atomu reducējošās īpašības palielinās no N līdz Bi, un oksidējošās īpašības vājinās (sk. 21. tabulu).
Ar ūdeņradi, slāpekli, fosforu un arsēnu veidojas polāri savienojumi RH3, kam ir negatīvs oksidācijas stāvoklis -3. RH3 molekulām ir piramīdas forma. Šajos savienojumos elementu saites ar ūdeņradi ir stiprākas nekā atbilstošajos skābekļa apakšgrupas un īpaši halogēna apakšgrupas elementu savienojumos. Tāpēc slāpekļa apakšgrupas elementu ūdeņraža savienojumi ūdens šķīdumos neveido ūdeņraža jonus.

Ar skābekli slāpekļa apakšgrupas elementi veido oksīdus ar vispārējo formulu R2O3 un R2O5. Oksīdi atbilst skābēm HRO2 un HRO3 (un ortoskābēm H3RO4, izņemot slāpekli). Apakšgrupas ietvaros oksīdu raksturs mainās šādi: N2O3 - skābs oksīds; Р4О6 - vāji skābs oksīds; As2O3 ir amfoterisks oksīds ar dominējošām skābām īpašībām; Sb2O3 ir amfoterisks oksīds ar pārsvaru pamata īpašībām; Bi2O3 ir galvenais oksīds. Tādējādi oksīdu ar sastāvu R2O3 un R2O5 skābās īpašības samazinās, palielinoties elementa atomu skaitam.
Kā redzams no tabulas. 21, apakšgrupā no slāpekļa līdz bismutam nemetāliskās īpašības samazinās un metāliskās īpašības palielinās. Antimonā šīs īpašības izpaužas vienādi, slāpeklī dominē metāliskās īpašības; Fosfors, arsēns un antimons veido vairākus alotropus savienojumus.
Slāpeklis.
Kvīts
Laboratorijās to var iegūt amonija nitrīta sadalīšanās reakcijā:
Reakcija ir eksotermiska, izdalot 80 kcal (335 kJ), tāpēc trauks ir jāatdzesē, kamēr tā notiek (lai gan amonija nitrīts ir jāuzsilda, lai sāktu reakciju).
Praksē šo reakciju veic, uzkarsētam piesātinātam amonija sulfāta šķīdumam pa pilienam pievienojot piesātinātu nātrija nitrīta šķīdumu, un amonija nitrīts, kas veidojas apmaiņas reakcijas rezultātā, acumirklī sadalās.
Šajā gadījumā izdalītā gāze ir piesārņota ar amonjaku, slāpekļa oksīdu (I) un skābekli, no kā to attīra, secīgi laižot cauri sērskābes, dzelzs (II) sulfāta šķīdumiem un virs karsta vara. Pēc tam slāpekli žāvē.
Vēl viena laboratorijas metode slāpekļa iegūšanai ir kālija dihromāta un amonija sulfāta maisījuma karsēšana (attiecībā 2:1 pēc svara). Reakcija notiek saskaņā ar vienādojumiem:
Tīrāko slāpekli var iegūt, sadaloties metālu azīdiem:
Tā saukto “gaisa” jeb “atmosfēras” slāpekli, tas ir, slāpekļa maisījumu ar cēlgāzēm, iegūst, gaisam reaģējot ar karstu koksu, kas rada tā saukto “ģeneratoru” jeb “gaisa” gāzi – izejvielu. ķīmiskajai sintēzei un degvielai. Ja nepieciešams, slāpekli no tā var atdalīt, absorbējot oglekļa monoksīdu.
Molekulārais slāpeklis tiek ražots rūpnieciski, frakcionēti destilējot šķidru gaisu. Šo metodi var izmantot arī “atmosfēras slāpekļa” iegūšanai. Plaši tiek izmantotas arī slāpekļa iekārtas un stacijas, kurās izmanto adsorbcijas un membrānas gāzu atdalīšanas metodi.
Viena no laboratorijas metodēm ir amonjaka izvadīšana pār vara (II) oksīdu ~700 °C temperatūrā:
Amonjaku ņem no tā piesātinātā šķīduma, karsējot. CuO daudzums ir 2 reizes lielāks nekā aprēķināts. Tūlīt pirms lietošanas slāpekli attīra no skābekļa un amonjaka, laižot pāri vara un tā oksīdam (II) (arī ~700 °C), pēc tam žāvē ar koncentrētu sērskābi un sausu sārmu. Process ir diezgan lēns, taču tas ir tā vērts: iegūtā gāze ir ļoti tīra.
Attēlā 15.12. attēlā parādīta piecu V grupas elementu atrašanās vieta periodiskajā tabulā. Tie visi ir p-elementi, un to atomu ārējam apvalkam ir raksturīga elektronu konfigurācija. Tabulā 15.10 norādītas dažas V grupas elementu īpašības. Pārejot uz šīs grupas apakšdaļu, tās elementu īpašības mainās no nemetāla uz metālisku. Slāpeklis un fosfors ir tipiski nemetāli. Arsēnam un antimonam ir metāliska rakstura pazīmes, un bismuts ir metāls.
SLĀPEKLIS UN FOSFORS
Šie ir divi svarīgākie elementi V grupā.
Normālos apstākļos slāpeklis ir gāze, kas sastāv no divatomu

Rīsi. 15.12. V grupas elementu izvietojums periodiskajā tabulā.
15.10. tabula. V grupas elementu īpašības

molekulas Tas ir bezkrāsains, bez smaržas un garšas, un tam nav manāmas reaktivitātes.
Fosfors pastāv trīs allotropās formās, no kurām divas visizplatītākās ir sarkanais fosfors un mazāk stabilais baltais fosfors. Šo allotropu struktūra tika apspriesta sektā. 3.2. Tabulā 15.11 salīdzinātas dažas sarkanā un baltā fosfora īpašības.
Lai gan slāpeklis ir viens no elektronnegatīvākajiem elementiem (sk. 2.2. tabulu), tam ir salīdzinoši zema reaktivitāte. Iemesls ir tāds, ka tā diatomiskās molekulas ir nepolāras un trīskāršā saite starp diviem atomiem
Tabula 15.11. Baltā un sarkanā fosfora īpašības


Rīsi. 15.13. Slāpekļa atoma četras hibrīdas orbitāles.
Tajos esošajam slāpeklim ir ļoti augsta izturība. Šīs saites entalpija ir + 944 kJ/mol.
Gan slāpeklis, gan fosfors var iekļūt savos savienojumos ar oksidācijas pakāpi no -3 līdz 4-5. Piemēram, amonjakā slāpekļa oksidācijas pakāpe ir +3, bet nitrātu jonā tā oksidācijas pakāpe ir -1-5.
Abu šo elementu atomi spēj piesaistīt trīs elektronus, kas noved pie to ārējā apakščaulas piepildīšanas; kā rezultātā veidojas nitrīdjoni un fosfīdu joni Tomēr abi elementi mēdz veidot kovalentus savienojumus. Šajā gadījumā to atomi veido četras hibrīda -orbitāles, katrai no kurām ir tetraedriska orientācija (15.13. att.). Trīs no šīm orbitālēm satur vienu elektronu. Tieši šie elektroni tiek dalīti, veidojot kovalentās saites ar citu atomu elektroniem. Ceturtajā orbitālē ir vientuļš elektronu pāris. To var izmantot, lai izveidotu koordinācijas (donora-akceptora) saiti. Piemēram, amonija jonā vientuļais slāpekļa pāris pārklājas ar ūdeņraža jona brīvo orbitāli.
ns 2 np 3.
SLĀPEKLIS un tā savienojumi
Dabā tas ir atrodams brīvā formā (saturs gaisā - 78 tilpuma%), minerālvielu veidā (sālspeters), eļļā, augu un dzīvnieku olbaltumvielās.
Fizikālās īpašības
Normālos apstākļos N2 ir bezkrāsaina, bez smaržas un garšas gāze.
t o kip. = -195,8 o C.
Slāpekļa iegūšana:
a) rūpniecībā - gaisa sašķidrināšana,
b) laboratorijā: NH 4 NO 2 ® N 2 + H 2 O.
Slāpekļa un tā savienojumu ķīmiskās īpašības.
Molekulārā slāpekļa ķīmiskā aktivitāte ir ļoti zema, jo pateicoties trīskāršajai kovalentajai saitei, molekula ir ļoti spēcīga (E saite = 946 kJ/mol). Tomēr slāpeklim ir zināmi daudzi dažādi savienojumi, kuros tam ir oksidācijas pakāpes -3, -2, -1, +1, +2, +3, +4, +5.
Slāpekļa savienojumi ar negatīvu oksidācijas pakāpi.
3
1)NH 3 – amonjaks– bezkrāsaina gāze ar asu smaku, viegli sašķidrināma.
Amonjaka ražošana:
a) N 2 + 3H 2 « 2NH 3 (Kat: Fe, Al 2 O 3, K 2 O)
b) 2NH4CI + Ca(OH)2 = CaCI2 + 2NH3 + 2H2O
Amonjaka ķīmiskās īpašības:
a) NH 3 + H 2 O « NH 4 OH (maksimālā koncentrācija = 25%)
b) NH 3 + HCI « NH 4 CI (atbilstošs mehānisms: NH 3 + H + = NH 4 +)
c) degšana notiek atšķirīgi atkarībā no skābekļa daudzuma:
4NH 3 + 3O 2 (nedēļa) = 2N 2 + 6H 2 O
4NH3 + 5О 2(g) = 2NO+ 6H2O
d) OVR amonjaks vienmēr ir reducētājs:
3CuO + 2NH3 = 3Cu + N2 + 3H2O
2) NH 4 OH – amonija hidroksīds- vāja bāze, nestabila, labi veido sarežģītus savienojumus (amonjaku):
Cu(OH)2 + 4NH4OH = (OH)2 + 4H2O
3) Amonija sāļi:
a) šķīdumiem hidrolīzes rezultātā ir viegli skāba reakcija:
NH 4 CI + HON « NH 4 OH + HCI (NH 4 + + HON « NH 4 OH + H +)
b) amonija sāļu termiskā sadalīšanās notiek atšķirīgi atkarībā no anjona rakstura: ja anjons ir oksidētājs, tad sadalīšanās reakcija ir neatgriezeniska:
NH 4 CI « NH 3 + HCl
NH4NO3 = N2O+2H2O
4) Amīdi veidojas, kad H atomus amonjakā aizstāj ar metālu:
2K + 2NH3 = 2KNH2 + H2
5) Nitrīdi pazīstami ar metāliem un nemetāliem un atkarībā no to rakstura sadalās atšķirīgi:
a) Li 3 N + 3 H 2 O = 3 LiOH + NH 3
Ca3N2 + 6HCI = 3CaCI2 + 2NH3
b) CI 3 N + 6 HCI = 3 HCIO + NH 3
Oksidācijas stāvoklis - 2
N 2 H 4 – hidrazīns(diamīds) ir bezkrāsains šķidrums, labs šķīdinātājs, mazāk stabils nekā amonjaks.
Hidrazīna sagatavošana:
2NH3 + NaCIO = N 2 H 4 + NaCI + H 2 O
Hidrazīna ķīmiskās īpašības:
N 2 H 4 + H 2 O « + +OH -
H 2 O « 2+ +OH -
b) sadeg līdz slāpeklim: N 2 H 4 + O 2 = N 2 + 2H 2 O
c) Spēcīgs reducētājs: N 2 H 4 + 2H 2 O 2 = N 2 + 4H 2 O
Oksidācijas stāvoklis - 1
NH 2 OH – hidroksilamīns, balta kristāliska viela, ieņem starpstāvokli starp H 2 O 2 un hidrazīnu N 2 H 4.
Hidroksilamīna sagatavošana:
HNO3 + 6H = NH2OH + 2H2O
Hidroksilamīna ķīmiskās īpašības:
a) Ūdens šķīdumi – vājas bāzes:
NH 2 OH + H 2 O « + + OH -
b) Hidroksilamonija sāļus (stabilus) dod ar skābēm:
NH 2 OH + HCl = + + CI -
c) sadalās (disproporcijas reakcija):
3NH2OH = NH3 + N2 + 3H2O
d) Tāpat kā H 2 O 2, atkarībā no vides tam piemīt redoksu dualitāte:
labi: 2NH 2OH + 4FeSO 4 + 3H 2 SO 4 = 2Fe 2 (SO 4) 3 + (NH 4) 2 SO 4 + 2H 2 O
atjaunots: 2NH2OH + I2 + 2KOH = N2 + 2KI + 4H2O
Svarīgākie slāpekļa savienojumi ar pozitīviem s. O.
Oksidācijas stāvoklis + 3
1) N 2 O 3- slāpekļa oksīds (III) vai "slāpekļa anhidrīds" ir nestabils zilganzaļš šķidrums:
a) N 2 O 3 ® NO 2 (brūna gāze ar asu smaku) + NO (bezkrāsaina gāze);
b) ar ūdeni veido nestabilu skābi: N 2 O 3 + H 2 O « 2 HNO 2
2) HNO2- slāpekļskābe (vidēja stipruma):
HNO 2 « H + + NO 2 - (K = 5,1 . 10 -4).
3) Nitrīti– slāpekļskābes sāļi, tāpat kā citi N+3 savienojumi redoksreakcijās, uzrāda dualitāti:
labi: KNO 2 + NH 3 = N 2 + H 2 O
atjaunots: KNO 2 + H 2 O 2 = KNO 3 + H 2 O
Maksimālais oksidācijas stāvoklis + 5
1) N 2 O 5- slāpekļa oksīds (V) vai "slāpekļa anhidrīds" ir bezkrāsaina kristāliska viela; Izšķīdinot ūdenī, tas dod skābi.
2) HNO3– slāpekļskābe, stipra: HNO 3 ® H + + NO 3 - .
3) Nitrāti– slāpekļskābes sāļi:
a) laboratorijā jūs varat iegūt N 2 O termiskās sadalīšanās reakcijā: NH 4 NO 3 ® N 2 O + H 2 O;
b) metālu nitrāti atkarībā no metāla stāvokļa aktivitāšu virknē sadalās dažādi:
pa kreisi Mg: nitrāts ® nitrīts + O 2
Mg – Cu: nitrāts ® metāla oksīds + NO 2 + O 2
pa labi Cu: nitrāts ® metāls + NO 2 + O 2 .
4) visi N +5 savienojumi ir spēcīgi oksidētāji; slāpekļskābes mijiedarbība ar metāliem:
a) neviens metāls neizdala ūdeņradi no HNO 3;
b) pie normālas t o metāli Al, Zn, Cr, Fe, Pb, Au, Pt tiek pasivēti;
c) karsējot, tas mijiedarbojas ar lielāko daļu metālu, un jo aktīvāks ir metāls un jo atšķaidītāka skābe, jo spēcīgāka ir N +5 samazināšana:
neaktīvs Meh: Cu + 4HNO 3 (konc.) = Cu (NO 3) 2 + 2NO 2 + 2H 2 O
3Cu + 8HNO 3 (dil.) = 3Cu(NO 3) 2 + 2NO + 4H 2 O
aktīviem. Meh: 4Ca + 10HNO3(konc.) = 4Ca(NO3)2 + N2O + 5H2O
5Ca + 12HNO3 (atšķaidīts) = 5Ca(NO3)2 + N2 + 6H2O
4Ca + 9HNO 3 (ultra atšķaidījums) = 4Ca(NO 3) 2 + NH 3 (vai NH 4 NO 3) + 3H 2 O
FOSFORS un tā savienojumi
Dabā tas ir atrodams: a) minerālvielu (fosforītu un apatītu) veidā, b) augu un dzīvnieku olbaltumvielās, c) smadzeņu audos un kaulos.
Fizikālās īpašības
Allotropēns:
A) baltais fosfors(P 4) – tetraedriska struktūra, indīgs, tumsā spīd, šķīst ogļskābā disulfīdā; uzglabāšanas laikā tas pamazām pārvēršas sarkanajā fosforā, tāpēc tiek uzglabāts zem ūdens;
b) sarkanais fosfors(P 2 n – polimērs) – ir vairākas struktūras formas, netoksisks, nešķīst oglekļa disulfīdā, stabils uzglabāšanas laikā, mazāk reaģējošs;
V) melnais fosfors– piramīdveida struktūra, slāņaina, līdzīga grafītam, pusvadītājs.
Fosfora iegūšana:
Fosforīta minerālu kalcinē ar koksu un smiltīm:
Ca 3 (PO 4) + 5C + 3 SiO 2 = 3CaSiO 3 + 2P + 5CO
Fosfora un tā savienojumu ķīmiskās īpašības.
Fosfora ķīmiskā aktivitāte mainās atkarībā no tā alotropās modifikācijas. Galvenie oksidācijas stāvokļi: -3, +1, +3, +5.
1) Fosfora reakcijas ar vienkāršām vielām:
atjaunojošas īpašības: a)P + O 2 ® P 2 O 3, P 2 O 5;
b) P + CI 2 ® PCI 3, PCI 5; c) 2P + 3S ® P 2 S 3
Oksidējošās īpašības: a) 2P + 3H 2 ® 2РН 3, b) 2P + 3Ca ® Ca 3 P 2
2) Fosfora reakcijas ar sarežģītām vielām:
a) nenotiek reakcija ar ūdeni,
b) 2P + 5H 2 SO 4 (konc.) ® 2H 3 PO 4 + 5SO 2 + 2H 2 O,
c) P + HNO 3 (konc.) ® H 3 PO 4 + NO (vai NO 2).
3)Minimālais oksidācijas stāvoklis - 3
A) PH 3- fosfīns, indīga gāze ar ķiploku smaržu,
apgaismots: 2РH 3 + 4О 2 = Р 2 О 5 + 3H 2 O,
ar dažām skābēm dod fosfonija sāļus: РH 3 + HI = РH 4 I
b) metālu fosfīdi– jonovalenti savienojumi
Mg 3 P 2 + 6 H 2 O = Mg(OH) 2 + 2РН 3,
Ca 3P 2 + 6HCI = CaCI 2 + 2PH 3.
4)Oksidācijas stāvoklis + 1
H 3 PO 2 vai H[PO 2 H 2 ] – hipofosforskābe, stipra; sāļi ir hipofosfīti, labi šķīstoši, labi reducētāji.
5)Oksidācijas stāvoklis + 3
a) P 2 O 3 – fosfora anhidrīds, ir vairākas modifikācijas (P 2 O 3) n, bezkrāsaini indīgi kristāli;
b) H 3 PO 3 vai H 2 [PO 3 H] – fosforskābe, vidēja stiprība;
c) fosfīta sāļi, šķīst tikai sārmu metālos (K 2 [PO 3 H]),
PCI 3 + CI 2 = PCI 5,
PCI 3 + O 2 = PCI 3,
PCI 3 + HCI ® N.
6)Maksimālais oksidācijas stāvoklis +5
a) P 2 O 5 – fosfora anhidrīds, balts pulveris, ar modifikāciju (P 2 O 5) 2, spēcīgs ūdeni atdalošs līdzeklis: P 2 O 5 + 2H 2 O = 2HPO 3;
b) HPO 3 - meta, H 4 P 2 O 7 - piro, H 3 PO 4 - ortofosforskābe, vidēja stiprība;
c) meta-, piro-, ortofosfāta sāļi;
d) halogenīdi ir diezgan aktīvi:
PCI 5 + 4H 2 O = H 3 PO 4 + 5 HCI,
RF 5 + HF = N.
APAKŠGRUPAS VISPĀRĪGĀS RAKSTUROJUMS
7 N, 15 P, 33 As, 51 Sb, 83 Bi. Apakšgrupā no augšas uz leju metāliskās īpašības dabiski palielinās, un tas atbilst savienojumu elementu oksidācijas pakāpju vērtībām, kā arī dažām fizikālajām īpašībām. Lai gan P, As un Sb allotropija rada zināmas grūtības, apvienojot fiziskās īpašības vienā tabulā:
11. tabula
Piektās grupas elementu īpašības, galvenās apakšgrupas
Ķīmiskās īpašības
1. Ar vienkāršām vielām tie veido dažādus savienojumus, kam piemīt dažādas redoksu īpašības:
a) atjaunojošas īpašības
2P + 3Cl 2 = 2PCl 3 (vai PCl 5);
4As + 5O 2 = 2As 2 O 5;
2Bi + 3Cl 2 = 2BiCl 3.
b) Oksidējošās īpašības
2P + 3Ca = Ca3P2;
2As + 3Mg = Mg 3As 2.
2. Tie reaģē ar skābēm atšķirīgi atkarībā no apakšgrupas elementa rakstura:
2P + 5H2SO4 = 2H3PO4 + 5SO2 + 2H2O;
3As + 5HNO3 + 2H2O = 3H3AsO4 + 5NO;
3Sb + 5HNO3 = 3HSbO3 + 5NO + H2O;
2Sb + 6H 2SO 4 konc. = Sb2(SO4)3 + 3SO2 + 6H2O;
Bi + 4HNO 3 = Bi(NO 3) 3 + NO + 2H 2 O.
Jāatceras, ka aktivitāšu rindā aiz ūdeņraža parādās arsēna apakšgrupas elementi.
3. Savienojumu hidrolīze notiek dažādos veidos:
a) PCl3 + 3H2O = H3PO3 + 3HCl;
BiCl 3 + H 2 O ® BiOCl ¯ + 2HCl.
(SbCl 3) (SbOCl)
b) NaNO 2 + H 2 O Û HNO 2 + NaOH;
K 3 PO 4 + H 2 O Û K 2 HPO 4 + KOH;
K 3 AsO 4 + H 2 O Û K 2 HAsO 4 + KOH.
4. Elementu skābju-bāzes īpašību izmaiņas izpaužas dažādi
12. tabula
Piektās apakšgrupas elementu svarīgākie savienojumi
5. Savienojumu redoksspēja ir atkarīga no elementa oksidācijas pakāpes:
A) E-3– reducējošie līdzekļi
2NH3 + 6KМnO4 + 6KOH = 6K 2MnO4 + N2 + 6H2O;
2PH 3 + 4O 2 = P 2 O 5 + 3H 2 O.
oksidētāji:
2KNO2 + 4H2S = 3S + N2 + K2S + 4H2O
E +3 2BiCl 3 + 3SnCl 2 + 18KOH = 2Bi + 3K 2 SnO 3 + 12KCl + 9H 2 O.
reducējošie līdzekļi:
10KNO2 +4KМnO4 +11H2SO4 =10HNO3 +4MnSO4 +7K2SO4 +6H2O
V) E +5 – oksidētāji
Na 3 SbO 4 + 2 NaJ + H 2 SO 4 = Na 3 SbO 3 + J 2 + Na 2 SO 4 + H 2 O.
6. grupas elementi. (Halkogēni)
Elektroniskā apvalka struktūra: ... ns 2 np 4.
8 O, 16 S, 34 Se, 52 Te, 84 Po (radioaktīvs).
SKĀBEKLIS un tā savienojumi
Visizplatītākais elements uz Zemes: 21% (pēc tilpuma) gaisā, daļa no H 2 O, minerālvielas un organiskās vielas.
Fizikālās īpašības
Pastāv vielu veidā:
a) “skābeklis” O 2 – gāze bez krāsas, garšas, smaržas, netoksiska; t° vāra. = -183°C; ;
b) “ozons” O 3 – zila gāze ar asu smaku, indīga, ļoti spēcīgs oksidētājs; t° vāra. = -111,8°C.
Ķīmiskās īpašības
1. Tikai vienā reakcijā skābeklis ir reducētājs:
О 2 + 2F 2 = 2OF 2 ().
2. Visos citos gadījumos skābeklis ir oksidētājs, īpaši, ja tas ir atomu stāvoklī:
a) Vienkāršu vielu oksidēšana
2H2 + O2 = 2H2O;
S + O2 = SO2;
2Ca + O 2 = 2CaO.
b) Sarežģītu vielu oksidēšana
R2O3 + O2 = R2O5;
2SO 2 + O 2 = 2SO 3;
2PCl 3 + O 2 = 2POCl 3.
c) Sarežģītu neorganisku vielu sadedzināšana
2H 2 S + O 2 nepietiekams = 2S + 2H2O;
2H 2S + 3O 2 g. = 2SO 2 + 2H 2 O.
d) Organisko vielu sadedzināšana
CH4 + 2O2 = CO2 + 2H2O;
C 2H 5OH + 3O 2 = 2CO 2 + 3H 2 O.
SĒRS un tā savienojumi
Dabā sastopams savā dzimtajā formā; minerālvielu veidā (sulfīdi, sulfāti); eļļā; olbaltumvielās.
Fizikālās īpašības
Ciets, trausls, dzeltens, nešķīst ūdenī, bet šķīst oglekļa disulfīdā un anilīnā. Allotrops: rombiskais sērs (a-forma); monoklīnisks (b - sērs); plastmasa utt. Visstabilākā modifikācija ir a (t° pl. » 113°C), tai piedēvēts sastāvs S 8.
Ķīmiskās īpašības
Savienojumiem, kuriem ir dažādas oksidācijas pakāpes, ir dažādas redoksspējas.
13. tabula
Svarīgākie sēra savienojumi
1. Sērs, mijiedarbojoties ar sarežģītiem savienojumiem, dažādos veidos maina savu oksidācijas pakāpi:
a) S + 2H 2 SO 4 konc. = 3SO2 + 2H2O ();
b) S + 6HNO 3 konc. = H2SO4 + 6NO2 + 2H2O ();
c) 3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
disproporcijas reakcija
2. Savienojumi S-2
A) H2S– sērūdeņradis, indīga gāze ar puvušu olu smaržu, spēcīgs reducētājs: 2H 2 S + O 2 = 2S + 2H 2 O;
H 2S + Cl 2 = 2HCl + S.
b) H 2 S šķīdums – vāja skābe
H 2 S Û N + + HS - (K 1 = 6 × 10 -8).
c) sāļi – sulfīdi; sārmu un sārmzemju metālu sāļi labi šķīst un hidrolizējas; p- un d-metālu sulfīdi praktiski nešķīst.
G) Sulfīdi metālu izstāde galvenais daba:
K 2 S + H 2 O Û KHS + KOH;
Eksponēti nemetālu sulfīdi skābs daba:
SiS 2 + 3H 2 O = H 2 SiO 3 + 2H 2 S.
d) Tiosoli: līdzīgi parastajiem sāļiem, kuros O atomi ir aizstāti ar S:
Na 2 S + CS 2 = Na 2 CS 3 – nātrija tiokarbonāts;
Na 2 CS 3 + 2 HCl = 2 NaCl + H 2 CS 3
nestabils
e) Polisulfīdi: sērs, tāpat kā skābeklis peroksīdos, var veidot sāļus: Na 2 S šķīdums + ´S = Na 2 S n - nātrija polisulfīds (satur sulfīdu tiltus - S - S - S - S -).
3. S+4 savienojumi
a) SO 2 – sēra dioksīds ar asu smaku, indīgs;
b) SO 2 šķīdums - sērskābe H 2 SO 3, vidēja stipruma
H2SO3Û H+ + HSO3- (K1 = 1,3 × 10-2);
c) Sāļi – sulfīti, labi hidrolizējas
Na 2 SO 3 + H 2 O Û NaHSO 3 + NaOH.
d) Redoksreakcijās visiem šiem savienojumiem ir dualitāte:
SO2 + 2H2S = 3S + 2H2O;
2SO 2 + O 2 = 2SO 3.
e) tionilhlorīds: SOCl 2
SOCl 2 + 2H 2 O = H 2 SO 3 + 2HCl.
4. S+6 savienojumi
A) SO 3– sērskābes anhidrīds; alotropisks, spēcīgs oksidētājs. Ļoti enerģiski reaģē ar ūdeni
SO 3 + H 2 O ® H 2 SO 4 + 89,1 kJ/mol;
b) H2SO4– sērskābe, bezkrāsains eļļains šķidrums; stiprs.
H 2 SO 4 konc. – ļoti spēcīgs oksidētājs; pārogļo papīru, cukuru, koku:
C + 2H 2 SO 4 konc. = CO 2 + 2SO 2 + 2H 2 O.
Atsevišķi tā uzvedība ar metāliem:
parastā temperatūrā tas nesadarbojas ar daudziem metāliem (“pasivē” Cr, Fe, Al, Zn, ...);
paaugstinātā līmenī tas reaģē ar gandrīz visiem metāliem, izņemot Au un Pt.
Tas ir ļoti labs ūdens attīrīšanas līdzeklis, jo... ar ūdeni veido hidrātus H 2 SO 4 × nH 2 O:
V) Sāļi: vidējs – K 2 SO 4 (sulfāti);
skābs – KHSO 4 (ūdeņraža sulfāti);
vitriols – CuSO 4 × 5H 2 O; ZnSO4 × 7H2O;
alauns – dubultsāļi, kristālhidrāti
KAl(SO4)2 × 12H2O; NH4Fe(SO4)2 × 12H2O.
G) Oleum– SO 3 šķīdums H 2 SO 4, kamēr reakcija notiek daļēji
2SO 3 + H 2 O = H 2 S 2 O 7 pirosulfurskābe.
d) Sulfurilhlorīds SO2Cl2
SO 2 Cl 2 + 2H 2 O = H 2 SO 4 + 2HCl.
e) Peroksosulfurskābes– satur peroksīda tiltus
H 2 SO 5 – peroksomonasērs,
H 2 S 2 O 8 – peroksodisērs;
spēcīgi oksidētāji.
un) Tiosulfāti– satur sēru dažādos oksidācijas pakāpēs: S +6 un S -2; S-2 klātbūtnes dēļ savienojumi ir spēcīgi reducējoši līdzekļi.
Na2S2O3 + Br2 + H2O = 2HBr + S + Na2SO4.
Atbilstošā skābe H 2 S 2 O 3 (tiosulfurskābe) ir nestabila:
Na 2 S 2 O 3 + H 2 SO 4 = Na 2 SO 4 + H 2 S 2 O 3.
7.a grupas elementi. (Halogēni )
Elektroniskā apvalka struktūra: ... ns 2 np 5.
9 F, 17 Cl, 35 Br, 53 J, 85 At (radioaktīvs). Brīvā stāvoklī tie pastāv diatomu molekulu formā.
Fizikālās īpašības
Indīga, ar asu smaku F 2 – gaiši dzeltena gāze, viršanas temperatūra. = -188,2°C;
Cl 2 – zaļi dzeltena gāze; t° vāra. = -34,1°C;
Br 2 – sarkans šķidrums; t° vāra. = 59,2°C;
J 2 – violetie kristāli; t° vāra. = +185,5°C.
Ķīmiskās īpašības
1) Visaktīvākais ir F 2, tā atmosfērā deg pat stikls un ūdens:
2F 2 + SiO 2 = SiF 4 + O 2;
2F 2 + 2H 2 O = 4HF + O 2.
2) Augšup esošie halogēni (kā spēcīgāki oksidētāji) izspiež pakārtotos no dažādiem savienojumiem:
F 2 + 2KCl (KBr, KJ) = 2KF + Cl 2 (Br 2, J 2).
3) Halogēnus izšķīdinot ūdenī un sārmu šķīdumos, rodas disproporcijas reakcijas; Atkarībā no temperatūras tiek iegūti dažādi reakcijas produkti:
Cl 2 + H 2 O = HCl + HClO;
Cl 2 + 2NaOH = NaCl + NaClO;
4) Ūdeņraža halogenīdi– tās visas ir bezkrāsainas gāzes (HF, pateicoties ūdeņraža saitēm, veido asociētās vielas H x F x).
Sērijā: HF – HCl – HBr – HJ samazinās saites stiprība un palielinās reducējošās īpašības:
MnO 2 + 4HCl = Cl 2 + MnCl 2 + 2H 2 O ().
5) Izšķīdinot ūdenī, iegūst stipras skābes; HJ ir spēcīgākais (izņemot vāju fluorūdeņražskābi:
H 2 F 2 Û H + + HF 2 -)
6) Halogenīdi elementiem ir atšķirīgs skābju-bāzes raksturs, kas izpaužas:
a) hidrolīzes reakcijās
AlCl 3 + H 2 O Û AlOHCl 2 + HCl;
PBr3 + 3H2O = H3PO3 + 3HBr.
b) kompleksās veidošanās reakcijās
2NaF + SiF 4 ® Na 2;
vairākiem ligandiem F - ; Cl - ; Br - ; J - kompleksu stabilitāte samazinās.
7) Halogēni augstākās oksidācijas pakāpēs
a) oksīdi: Cl2O; (ClO 2) 2; (ClO 3) 2; Cl2O7;
b) skābes: HClO; HClO2; HClO3; HClO4;
vairākām skābēm ® stiprība palielinās, skābēm un to sāļiem vienā un tajā pašā sērijā oksidējošās īpašības samazinās.
c) skābes un to sāļi karsējot sadalās:
d) savienojumi starp halogēniem: daudzi no tiem ir zināmi; Sastāvs atbilst elementu novietojumam periodiskajā tabulā (vairāk elektronnegatīvu elementu parādās formulu beigās):
ClF, BrF, JF; ClF 3, JF 3; ClF 5, ClOF 3; BrF 7, JO 3 F utt.;
ir skāba rakstura: JF 7 + 4H 2 O = 7HF + HJO 4;
ClO 3 F + 2NaOH = NaClO 4 + NaF + H 2 O.
Jautājumi materiāla konsolidēšanai:
1. Kāda viela veidojas, arsēnam reaģējot ar koncentrētu slāpekļskābi - a)Аs(NO3)3? b) H 3 AsO 4? c) Kā 2 O 3?
2.Kāda viela reaģē ar koncentrētu skābi, izdalot brīvo hloru – a)CaCl 2? b) MnO 2? c) CrC13?