tRNS funkcionālie reģioni. tRNS struktūra un funkcijas, aminoskābju aktivācijas pazīmes
70-90N | sekundārā lapa - āboliņa lapa | CCA 3" konst. visai tRNS |
timīna, pseidouridīna-psi, digirouridīna DGU klātbūtne D-cilpā - aizsardzība pret ribonukleāzēm? ilgmūžīgs | Dažādas tRNS primārās struktūras - 61 + 1 - pēc kodonu skaita + formilmetionīna tRNS, kaķa antikodons ir tāds pats kā metionīna tRNS. Terciāro struktūru daudzveidība - 20 (pēc aminoskābju skaita) | atpazīšana - kovalentās saites veidošanās m-y tRNS un akts | aminoacil-tRNS sintetāzes piesaista tRNS
tRNS funkcija ir pārnest aminoskābes no citoplazmas uz ribosomām, kurās notiek olbaltumvielu sintēze.
tRNS, kas saistās ar vienu aminoskābi, sauc par izoakceptoriem.
Kopumā šūnā vienlaikus pastāv 64 dažādas tRNS.
Katrs tRNS savienojas pāros tikai ar savu kodonu.
Katra tRNS atpazīst savu kodonu bez aminoskābes iesaistīšanas. Ar tRNS saistītās aminoskābes tika ķīmiski modificētas, pēc tam tika analizēts iegūtais polipeptīds, kas satur modificēto aminoskābi. Cisteinil-tRNACys (R = CH2-SH) tika reducēts uz alanil-tRNACys (R = CH3).
Lielākajai daļai tRNS, neatkarīgi no to nukleotīdu secības, ir āboliņa lapas formas sekundārā struktūra, jo tajās ir trīs matadatas.
tRNS strukturālās iezīmes
3 "molekulas galā" vienmēr atrodas četri nesapāroti nukleotīdi, un trīs no tiem obligāti ir CCA. RNS ķēdes 5" un 3" gali veido akceptora stublāju. Ķēdes tiek turētas kopā, pateicoties komplementāram savienojumam. septiņi nukleotīdi 5" - beigas ar septiņiem nukleotīdiem, kas atrodas netālu no 3 "gala. 2. Visām molekulām ir T?C matadata, tā apzīmēta, jo tajā ir divi neparasti atlikumi: ribotimidīns (T) un pseidouridīns (? Matadata sastāv no dubultās - piecām pārī savienotām bāzēm, ieskaitot G-C pāri, un septiņu nukleotīdu garuma cilpu.
tajā pašā cilpas punktā. 3. Antikodona matadatā stublāju vienmēr attēlo pāru saime
pamatojums. Triplets, kas komplementārs saistītajam kodonam, antikodonam, atrodas cilpā.
le, kas sastāv no septiņiem nukleotīdiem. Nemainīgs ura-
cils un modificēts citozīns, un modificēts purīns, kā likums, pievienojas tā 3" galam
adenīns. 4. Vēl viena matadata sastāv no trīs līdz četriem nukleotīdu pāriem gara kātiņa un mainīgas cilpas.
izmēra, kas bieži satur uracilu reducētā veidā - dihidrouracilu (DU). Visspēcīgāk atšķiras stublāju nukleotīdu sekvences, nukleotīdu skaits starp antikodona stumbru un T?C cilpu (mainīgā cilpa), kā arī cilpas izmērs un dihidrouracila atlieku lokalizācija DU cilpā.
[Dziedātājs, 1998].
tRNS terciārā struktūra
L veida struktūra.
Aminoskābju piesaiste tRNS
Lai aminoskābe veidotu polipeptīda ķēdi, tai jābūt pievienotai tRNS ar enzīmu aminoacil-tRNS sintetāzi. Šis enzīms, piedaloties ATP, veido kovalento saiti starp aminoskābju karboksilgrupu un ribozes hidroksilgrupu tRNS 3' galā. Aminoacil-tRNS sintetāze atpazīst specifisku kodonu nevis tāpēc, ka uz tRNS atrodas antikodons, bet gan pēc noteiktas atpazīšanas vietas tRNS.
Kopumā šūnā ir 21 dažāda aminoacil-tRNS sintetāze.
Pievienošanās notiek divos posmos:
1. Aminoskābes karboksilgrupa ir piesaistīta ATP a-fosfātam. Iegūtais nestabilais aminoaciladenilāts tiek stabilizēts, saistoties ar fermentu.
2. Aminoaciladenilāta aminoacilgrupas pārnešana uz tRNS terminālās ribozes 2' vai 3'-OH grupu.
Dažas aminoacil-tRNS sintetāzes sastāv no vienas polipeptīda ķēdes, savukārt citas sastāv no divām vai četrām identiskām ķēdēm, katras ar molekulmasu no 35 līdz 115 kDa. Daži dimēriskie un tetrameriskie enzīmi sastāv no divu veidu apakšvienībām. Nav skaidras korelācijas starp fermenta molekulas lielumu vai tās apakšvienības struktūras raksturu un specifiku.
Fermenta specifiku nosaka tā stiprā saistīšanās ar tRNS akceptora galu, DU reģionu un mainīgo cilpu. Šķiet, ka daži fermenti neatpazīst antikodona tripletu un katalizē aminoacetilācijas reakciju pat tad, ja antikodons tiek mainīts. Tomēr daži fermenti uzrāda samazinātu aktivitāti attiecībā uz šādām modificētām tRNS un, aizstājot antikodonu, pievieno nepareizu aminoskābi.
70-90n | sekundārā lapa - āboliņa lapa | CCA 3" konst. visai tRNS |
timīna, pseidouridīna-psi, digirouridīna DGU klātbūtne D-cilpā - aizsardzība pret ribonukleāzēm? ilgmūžīgs | Dažādas tRNS primārās struktūras - 61 + 1 - pēc kodonu skaita + formilmetionīna tRNS, kaķa antikodons ir tāds pats kā metionīna tRNS. Terciāro struktūru daudzveidība - 20 (atbilstoši aminoskābju skaitam)
Ir divu veidu tRNS saistošs metionīns tRNAFMet un tRNAMMet prokariotos un tRNAIMet un tRNAMMet eikariotos. Katrai tRNS pievieno metionīnu, izmantojot atbilstošu aminoacil-tRNS sintēzi. tRNAFMet un tRNAIMet piesaistīto metionīnu veido enzīms metionil-tRNS-transformilāze uz Fmet-tRNAFMet. tRNS, kas ielādētas ar formilmetionīnu, atpazīst iniciācijas kodonu AUG.
Literatūra:
Diemžēl bibliogrāfijas nav.
Mācību grāmata. Neskatoties uz to, ka tRNS ir daudz mazāka, stāsts par tās struktūru, īpašībām un darbību ir pelnījis atsevišķu nodaļu.
Tātad tRNS ir “adapteris”, kas vienā galā atpazīst ģenētiskā koda trīs burtu secību, saskaņojot to ar vienīgo atbilstošo aminoskābi, kas fiksēta tRNS otrā galā. Pārneses RNS beigās, kas pieskaras ziņojuma RNS, veidojas 3 nukleotīdi. antikodons. Tikai tad, ja antikodons ir komplementārs ar mRNS reģionu, tam var pievienoties pārneses RNS. Bet pat šajā gadījumā tRNS nevar pievienoties mRNS pati par sevi, tai nepieciešama ribosomu palīdzība, kas ir to mijiedarbības vieta, kā arī aktīvs translācijas dalībnieks. Piemēram, tā ir ribosoma, kas rada saites starp aminoskābēm, ko ienes tRNS, veidojot olbaltumvielu ķēdi.
tRNS strukturālās iezīmes nosaka ģenētiskais kods, tas ir, noteikumi proteīna konstruēšanai atbilstoši gēnam, ko nolasa pārneses RNS. Šis kods darbojas ikvienā dzīvā radībā uz Zemes: vīrusa radīšana ir ierakstīta tajos pašos trīs burtu kodonos, kas tiek izmantoti delfīna "salikšanas instrukciju" rakstīšanai. Eksperimentāli ir pārbaudīts, ka vienas dzīvas būtnes gēni, kas ievietoti citas dzīvās būtnes šūnā, tiek lieliski kopēti un pārvērsti proteīnos, kas nav atšķirami no gēniem, kas vairojas saimniekorganisma šūnās. Ģenētiskā koda vienveidība ir pamats modificēto E. coli ražošanai ar insulīna un daudzu citu cilvēka enzīmu kolonijām, kuras tiek izmantotas kā zāles cilvēkiem, kuru organisms nespēj tos ražot vai ražot nepietiekami. Neskatoties uz acīmredzamo atšķirību starp cilvēkiem un E. coli, cilvēka proteīnus ir viegli izveidot no cilvēka rasējumiem, izmantojot E. coli kopētāju. Nav pārsteidzoši, ka dažādu radījumu pārneses RNS atšķiras ļoti maz.

Katrs kodons no šī saraksta, izņemot trīs stopkodoni, kas signalizē par tulkošanas pabeigšanu, ir jāatpazīst pārneses RNS. Atpazīšana tiek veikta, pievienojot antikodonu ziņojuma RNS, kas var saistīties tikai ar vienu kodonu no saraksta, tāpēc tRNS var atpazīt tikai vienu kodonu. Tas nozīmē, ka šūnā ir vismaz 61 šo molekulu veids. Faktiski to ir vēl vairāk, jo dažās situācijās ziņojuma RNS nolasīšanai nepietiek tikai ar pareizo antikodonu: ir nepieciešami citi nosacījumi, saskaņā ar kuriem tiek izveidota īpaša, modificēta tRNS.
No pirmā acu uzmetiena šādai tRNS daudzveidībai vajadzētu ievērojami sarežģīt tulkošanas procesu: galu galā katra no šīm molekulām pārbaudīs matricas RNS kodonu, ko to aizstāj ribosoma, vai tas atbilst tā antikodonam - šķiet, ka tik daudz bezjēdzīga mehāniskā darba. , tik daudz iztērēta laika un enerģijas. Bet evolūcijas rezultātā ir izveidojušies arī šūnu mehānismi, kas novērš šo problēmu. Piemēram, katras sugas tRNS daudzums šūnā atbilst tam, cik bieži šīs sugas pārnēsātā aminoskābe tiek atrasta būvējamajos proteīnos. Ir aminoskābes, kuras šūna izmanto reti, un ir tādas, kuras izmanto bieži, un, ja to tRNS skaits būtu vienāds, tas ievērojami sarežģītu proteīnu montāžu. Tāpēc šūnā ir maz “reto” aminoskābju un tām atbilstošo tRNS, un bieži sastopamās tiek ražotas lielos daudzumos.

Ar tik daudzveidīgām tRNS molekulām tās visas ir ļoti līdzīgas, tādēļ, ņemot vērā to uzbūvi un funkcijas, galvenokārt pētīsim visām sugām kopīgās pazīmes. Kad paskatās uz tRNS 3D izkārtojumu, tas izskatās kā blīva atomu kaudze. Šķiet neticami, ka šī sarežģīti saritinātā molekula ir garas nukleotīdu ķēdes locīšanas rezultāts, taču tā veidojas.
Ir iespējams izsekot tā veidošanās posmiem, sākot no paša pirmā: nukleotīdu secības apkopošana ar RNS polimerāzi saskaņā ar gēnu, kas satur informāciju par šo pārneses RNS. Tiek izsaukta secība, kādā šie nukleotīdi seko viens otram un to skaits tRNS primārā struktūra. Izrādās, ka tā ir tRNS primārā struktūra, kas ir kodēta gēnā, ko nolasa RNS polimerāze. Kopumā primārā struktūra ir salīdzinoši vienkāršu viena veida molekulu secība, no kurām sastāv sarežģītāka, salocīta polimēra molekula. Piemēram, proteīna molekulas primārā struktūra ir tās sastāvā esošo aminoskābju vienkārša secība.

Neviena nukleotīdu ķēde šūnā nevar būt nesalocītā stāvoklī, vienkārši izstiepta līnijā. Nukleotīdu malās ir pārāk daudz pozitīvi un negatīvi lādētu daļu, kas savā starpā viegli veido ūdeņraža saites. Ir aprakstīts, kā veidojas vienas un tās pašas saites starp divu DNS molekulu nukleotīdiem, savienojot tās dubultā spirālē, un jūs varat iegūt sīkāku informāciju par ūdeņraža saitēm. Ūdeņraža saites ir mazāk spēcīgas nekā saites starp atomiem molekulās, taču ar tām pietiek, lai sarežģīti savītu tRNS pavedienu un noturētu to šajā pozīcijā. Sākumā šīs saites veidojas tikai starp dažiem nukleotīdiem, saliekot tRNS āboliņa lapas formā. Šīs sākotnējās locīšanas rezultāts tiek saukts sekundārā struktūra tRNS. Diagramma kreisajā pusē parāda, ka tikai daži nukleotīdi ir saistīti ar ūdeņraža saitēm, bet citi paliek nesapāroti, veidojot gredzenus un cilpas. Atšķirības starp dažādu veidu tRNS sekundāro struktūru ir saistītas ar atšķirībām to primārajā struktūrā. Tas izpaužas dažādos "āboliņa lapu" vai "kātiņu" garumos, jo sākotnējās nukleotīdu ķēdes garums atšķiras.
Vēl viena atšķirība dažādu tRNS primārajā struktūrā ir tāda, ka tikai dažās pozīcijās tiem ir vienādi nukleotīdi (iepriekš redzamajā diagrammā tie ir atzīmēti ar to nosaukumu pirmajiem burtiem), savukārt lielākā daļa nukleotīdu dažādās tRNS atšķiras viens no otra. Iepriekš minētā shēma ir kopīga visām tRNS, tāpēc dažādi nukleotīdi ir atzīmēti ar cipariem.
Galvenās tRNS funkcionālās daļas ir:
=) antikodons, tas ir, nukleotīdu secība, kas ir komplementāra vienam vēstneša RNS kodonam, kas atrodas antikodona matadata
=) akceptora beigas kam var pievienot aminoskābi. Tas atrodas antikodona matadata pretējā pusē.
Patiesībā neviena tRNS neizskatās tā, kā sekundārās struktūras diagrammā, jo tikai daži nukleotīdi savienojās kopā, lai to izveidotu, bet pārējie palika nesapāroti. Sakarā ar ūdeņraža saišu veidošanos starp nukleotīdiem no dažādām āboliņa lapas daļām, tas salokās tālāk daudz sarežģītākā terciārā struktūra L formā. Varat precīzi saprast, kā dažādas sekundārās struktūras daļas izliekas, veidojot terciāro struktūru, saskaņojot krāsas to diagrammās tālāk. Antikodona matadata, kas apzīmēta zilā un pelēkā krāsā, paliek apakšā (ir vērts atcerēties, ka šī “apakša” ir nosacīta: proteīnu translācijas shēmās ir ērti attēlot tRNS šajā telpiskajā orientācijā), bet akceptora gals (dzeltens) ir saliekts uz sāniem.

Šādi izskatās tRNS, kad tā ir gatava pievienot aminoskābi. tRNS pati nespēj apvienoties ar aminoskābi, tam ir nepieciešama īpaša fermenta līdzdalība: aminoacil-tRNS sintetāzes. Sintetāzes tipu skaits šūnā sakrīt ar tRNS tipu skaitu.
Visu veidu tRNS formas viendabība ir nepieciešama, lai ribosoma spētu atpazīt jebkuru no tām, atvieglotu to savienošanu ar mRNS un pārvietotos sevī no vienas vietas uz otru. Ja dažādi tRNS veidi būtiski atšķirtos viens no otra, tas padarītu ribosomas darbu ārkārtīgi sarežģītu, kritiski samazinot olbaltumvielu sintēzes ātrumu. Tādējādi dabiskās atlases mērķis ir padarīt tRNS līdzīgas viena otrai. Bet tajā pašā laikā ir vēl viens faktors, kas prasa ievērojamas atšķirības starp dažādiem tRNS veidiem: galu galā ir jāatpazīst katrs tips un jāpievieno tam vienīgā atbilstošā aminoskābe. Acīmredzot šīm atšķirībām jābūt pamanāmām, taču ne pārāk būtiskām, lai tRNS sugu atpazīšanas darbs pārvērstos par rotaslietas procesu. Un tieši to veic aminoacil-tRNS sintetāzes: katra no tām var saistīties tikai ar vienu no 20 aminoskābēm un pievienot to tieši tiem tRNS veidiem, kas atbilst šai aminoskābei. No tabulas ar ģenētisko kodu var redzēt, ka katru aminoskābi kodē vairākas nukleotīdu sekvences, tāpēc, piemēram, visas četras tRNS ar antikodoniem CGA, CGG, CGU un CGC tiks atpazītas ar vienu un to pašu sintetāzi, kas piesaista alanīnu. viņiem. Tādas tRNS, ko apstrādā viena sintetāze, sauc saistīti.
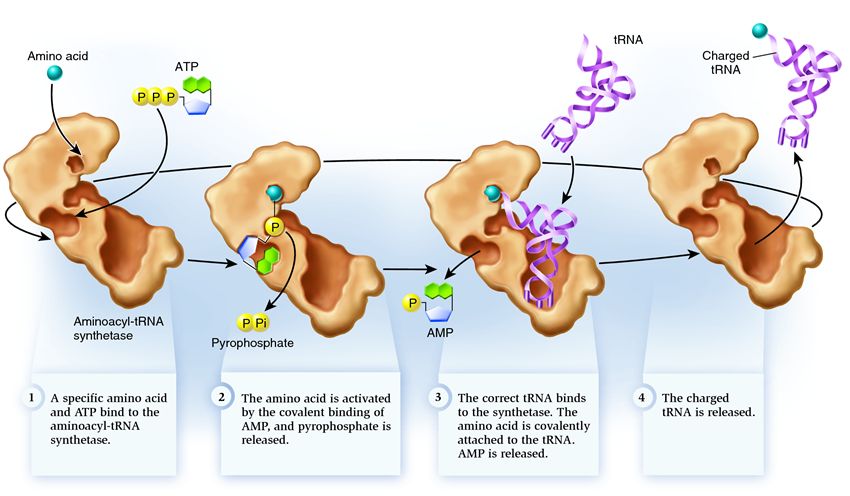
Sintetāze pieder pie enzīmu grupas, kuras funkcija ir saistīties ar atsevišķi esošām molekulām un apvienot tās vienā:
1 . sintetāze savieno aminoskābi un ATP molekulu. Divas fosfātu grupas atdalās no ATP, atbrīvojot enerģiju, kas nepieciešama šādām darbībām. Adenozīna monofosfāts (AMP), kas paliek no iznīcinātās molekulas, pievienojas aminoskābei, sagatavojot to savienojumam ar akceptora matadatu.
2 . sintetāze piesaista sev vienu no radniecīgām tRNS, kas atbilst šai aminoskābei.

Šajā posmā tiek pārbaudīta pārneses RNS atbilstība sintetāzei. Ir vairāki atpazīšanas veidi, un katrai sintetāzei ir unikāla to kombinācija. Sintetāzes un tRNS mijiedarbībā ir iesaistīts vismaz viens antikodona nukleotīds. Jāpārbauda arī akceptora matadata: uz tās tiek noteikti specifiski nukleotīdi, kas ir kopīgi radniecīgām tRNS, kas atbilst vēlamajai aminoskābei. Nukleotīdi no citām tRNS daļām var piedalīties arī saskaņošanā, saistoties ar noteiktām sintetāzes vietām. Nepareizā tRNS var kaut kādā veidā sakrist ar vēlamo, taču nepilnīgas atbilstības dēļ tā lēni un brīvi pievienosies sintetāzei, viegli nokrītot. Un pareizā tRNS ātri un stingri pielips pie sintetāzes, kā rezultātā mainās sintetāzes struktūra, uzsākot procesu aminoacilēšana , tas ir, aminoskābes piesaiste tRNS.

3 . aminoacilēšana sastāv no AMP molekulas, kas pievienota aminoskābei, aizstāšanā ar tRNS molekulu. Pēc šīs nomaiņas AMP atstāj sintetāzi, un tRNS tiek aizturēta, lai veiktu pēdējo aminoskābju pārbaudi. Ja pievienotā aminoskābe tiek atpazīta par nepareizu, tā tiks atdalīta no tRNS, aminoskābes vieta sintetāzē būs tukša un tur var pievienoties cita molekula. Jaunā aminoskābe izies savienojuma posmus ar ATP un tRNS, kā arī tiks pārbaudīta. Ja netika pieļautas kļūdas, ar aminoskābēm uzlādētā tRNS tiek atbrīvota: tā ir gatava spēlēt savu lomu olbaltumvielu translācijā. Un sintetāze ir gatava pievienot jaunas aminoskābes un tRNS, un cikls sāksies no jauna.
Daudz kas ir atkarīgs no pareizas aminoacil-tRNS sintetāzes darbības: ja šajā posmā notiek kļūme, tad tRNS tiks pievienota nepareiza aminoskābe. Un tas tiks iebūvēts proteīnā, kas aug uz ribosomas, jo tRNS un ribosomai nav kodona un aminoskābes atbilstības pārbaudes funkcijas. Kļūdas sekas var būt nelielas vai katastrofālas, un dabiskās atlases rezultātā radības ar fermentiem, kurām nav šādu pārbaužu funkcijas, ir aizstātas ar vairāk pielāgojamiem radījumiem ar dažādām aminoskābju un tRNS saskaņošanas iespējām. Tāpēc mūsdienu šūnās sintetāze apvienojas ar nepareizo aminoskābi vidēji vienā gadījumā no 50 tūkstošiem un ar nepareizu tRNS tikai vienu reizi 100 tūkstošos pielikumu.

Dažas aminoskābes atšķiras viena no otras tikai ar dažiem atomiem. Ja paskatās uz to shēmām, kļūst skaidrs, ka arginīna sajaukšanas ar alanīnu iespējamība ir daudz mazāka nekā izoleicīna jaukšanas ar leicīnu vai valīnu. Tāpēc katrai sintetāzei, kas saistās ar kādu no viena otrai līdzīgām aminoskābēm, ir papildu pārbaudes mehānismi. Šeit ir piemērs šādai adaptācijai izoleicīna-tRNS sintetāzē:

Katrai sintēzei ir sintētiskais centrs kurā aminoskābe ir pievienota tRNS. Tur nonāk sintetāzes notvertās tRNS akceptora matadata, kā arī aminoskābe, kas ir gatava ar to reaģēt. Dažu sintetāžu darbs beidzas uzreiz pēc aminoskābes un tRNS savienošanās. Bet Ile-tRNS sintetāzei ir lielāka iespēja kļūdīties, jo pastāv citas izoleicīnam līdzīgas aminoskābes. Tāpēc arī viņai ir korekcijas centrs: no nosaukuma ir skaidrs, kāda loma tam ir tRNS un aminoskābju savienošanas procesā. Labajā pusē redzamais attēls parāda, ka tRNS akceptora matadatas gala novietojums Ile-tRNS sintetāzes sintētiskajā centrā piešķir šai matadatai nedabisku izliekumu. Tomēr sintetāze notur tRNS šajā pozīcijā, līdz tai ir pievienota aminoskābe. Pēc tam, kad šis savienojums ir noticis, nepieciešamība atrast akceptora matadata sintētiskajā centrā ir izsmelta, un tRNS iztaisnojas, nokļūstot korekcijas centrā ar tai pievienoto aminoskābi.

Protams, sintētiskajam centram ir arī nozīme sintetāzei nepiemērotu aminoskābju izsijāšanā. Lai tajā iekļūtu, molekulai ir jāatbilst vairākiem nosacījumiem, tostarp tai ir jābūt pareizam izmēram. Neskatoties uz to, ka leicīns un izoleicīns satur vienādu atomu skaitu, telpiskās struktūras atšķirību dēļ leicīns ir lielāks. Tāpēc tas nevar iekļūt sintētiskajā centrā, kura izmērs atbilst kompaktākajam izoleicīnam, un vienkārši atlec no Ile-tRNS sintetāzes.
Bet valīns, kas ir mazākā no šīm trim molekulām ar līdzīgu atomu struktūru, viegli ieņem izoleicīna vietu sintētiskajā centrā, un sintetāze pievieno to tRNS. Šajā gadījumā tiek izmantots sintetāzes korekcijas centrs. Ja iztaisnošanas akceptora matadata ir pareizi uzlādēta un satur izoleicīnu, tad tā nevar izspiesties korekcijas centra iekšpusē: tā vienkārši ir pārāk maza šai molekulai. Tādējādi iztaisnoto tRNS vairs nekas netur, un tā tiek atdalīta no sintetāzes. Bet, ja valīns ir pievienots tRNS, tas ieslīd korekcijas centrā, tādējādi saglabājot tRNS savienotu ar to sintetāzē. Šāda pārmērīgi ilga tRNS uzturēšanās iekšienē ir sintetāzes kļūdas signāls, mainot tās telpisko konfigurāciju. Rezultātā:
=) valīns tiek atdalīts no tRNS un izņemts no sintetāzes
=) akceptora matadata atgriežas sintētiskajā vietā, gaidot piesaisti aminoskābei
=) sintetāze saistās ar jaunu aminoskābi, “uzlādē” ar to tRNS un vēlreiz pārbauda, vai šim nolūkam nav izmantots izoleicīns.
Līdzīgu dubultās atpazīšanas mehānismu izmanto arī citas sintetāzes.
DNS fizikālās un ķīmiskās īpašības
Dažādi faktori, kas sarauj ūdeņraža saites (temperatūras paaugstināšanās virs 80 C, pH un jonu stipruma izmaiņas, urīnvielas darbība u.c.) izraisa DNS denaturāciju, t.i. izmaiņas DNS ķēžu telpiskajā izkārtojumā, nepārraujot kovalentās saites. DNS dubultspirāle denaturācijas laikā tiek pilnībā vai daļēji sadalīta tās sastāvdaļu ķēdēs. DNS denaturāciju papildina optiskās absorbcijas palielināšanās purīna un pirimidīna bāzu UV reģionā. Šo fenomenu sauc hiperhromisks efekts . Denaturācija samazina arī augsto viskozitāti, kas raksturīga dabiskajiem DNS šķīdumiem. Atjaunojot sākotnējo divpavedienu DNS struktūru, renaturācijas rezultātā slāpekļa bāzu absorbcija pie 260 nm samazinās to "aizsardzības" dēļ. Šo fenomenu sauc hipohromisks efekts .
Katras DNS "attīšana" tās sastāvdaļu ķēdēs tiek veikta noteiktā temperatūras diapazonā. Šī intervāla viduspunktu sauc par kušanas temperatūru. DNS kušanas temperatūra standarta apstākļos (noteikts pH un jonu stiprums) ir atkarīga no slāpekļa bāzu attiecības. G-C pāri, kas satur trīs ūdeņraža saites, ir spēcīgāki, tāpēc, jo augstāks ir G-C pāru saturs DNS, jo augstāka ir kušanas temperatūra.
DNS funkcijas. Nukleotīdu secībā DNS molekulās tiek kodēta ģenētiskā informācija. Galvenās DNS funkcijas ir, pirmkārt, nodrošināt pašas vairošanos virknē šūnu paaudžu un organismu paaudžu, un, otrkārt, nodrošināt proteīnu sintēzi. Šīs funkcijas ir saistītas ar to, ka DNS molekulas pirmajā gadījumā kalpo kā matrica replikācijai, t.i. informācijas kopēšana meitas DNS molekulās, otrajā - transkripcijai, t.i. pārkodēt informāciju RNS struktūrā.
Rīsi. 5 Kušanas līkne (DNS denaturācija)
Denaturācijas laikā atdalītās komplementārās DNS virknes noteiktos apstākļos var atkal savienoties dubultā spirālē. Šo procesu sauc par RENATURĀCIJU. Ja denaturācija nav notikusi pilnībā un vismaz dažas bāzes nav zaudējušas mijiedarbību ar ūdeņraža saitēm, renaturācija notiek ļoti ātri.
Šūnu citoplazmā ir trīs galvenie RNS funkcionālie veidi. Tās ir ziņojuma RNS - mRNS, kas darbojas kā proteīnu sintēzes veidnes, ribosomu RNS - rRNS, kas darbojas kā ribosomu strukturālās sastāvdaļas, un pārnes RNS - tRNS, kas iesaistītas mRNS informācijas translācijā (translācijā) proteīna aminoskābju secībā.
2. tabulā parādītas atšķirības starp DNS un RNS struktūras, lokalizācijas šūnā un funkciju ziņā.
2. tabula DNS un RNS atšķirības
Pārnes RNS, tRNS-ribonukleīnskābe, kuras funkcija ir transportēt AA uz olbaltumvielu sintēzes vietu. Tā tipiskais garums ir no 73 līdz 93 nukleotīdiem un apmēram 5 nm. tRNS ir arī tieši iesaistītas polipeptīdu ķēdes augšanā, pievienojoties - esot kompleksā ar aminoskābi - ar mRNS kodonu un nodrošinot kompleksa konformāciju, kas nepieciešama jaunas peptīdu saites veidošanai. Katrai aminoskābei ir sava tRNS. tRNS ir vienpavedienu RNS, bet funkcionālajā formā tai ir āboliņa lapas konformācija. AA kovalenti pievienojas molekulas 3" galam, izmantojot enzīmu aminoacil-tRNS sintetāzi, kas ir raksturīgs katram tRNS veidam. Vietā C atrodas antikodons, kas atbilst AA-te. tRNS sintezē parastā RNS polimerāze. prokariotu un RNS polimerāzes III palīdzību eikariotu gadījumā tRNS gēnu transkripti tiek pakļauti daudzpakāpju apstrādei, kas noved pie tRNS raksturīgas telpiskas struktūras veidošanās.
tRNS apstrāde ietver 5 galvenos soļus:
5" līdera nukleotīdu secības noņemšana;
3'-gala secības noņemšana;
CCA secības pievienošana 3" galā;
intronu izgriešana (eikariotos un arhejās);
atsevišķu nukleotīdu modifikācijas.
tRNS transportēšana tiek veikta pa Ran atkarīgu ceļu, piedaloties transporta faktoram eksportin t, kas atpazīst nobriedušai tRNS raksturīgo sekundāro un terciāro str-ru: īsas divpavedienu sekcijas un pareizi apstrādātas 5 "- un 3" beidzas. Šis mehānisms nodrošina, ka no kodola tiek eksportētas tikai nobriedušas tRNS.
62. Tulkošana - mRNS kodona atpazīšana
Tulkošana ir proteīnu sintēze, ko veic ribosomas no aminoskābēm uz mRNS (vai un RNS) veidnes. Translācijas procesa sastāvdaļas: aminoskābes, tRNS, ribosomas, mRNS, enzīmi tRNS aminoacilēšanai, proteīnu translācijas faktori (olbaltumvielu iniciācijas, pagarinājuma, terminācijas faktori - specifiski ekstraribosomu proteīni, kas nepieciešami translācijas procesiem), ATP un GTP enerģijas avoti. , magnija joni (stabilizē ribosomu struktūru). Olbaltumvielu sintēzē piedalās 20 aminoskābes. Lai aminoskābe “atpazītu” savu vietu topošajā polipeptīdu ķēdē, tai jāsaistās ar pārneses RNS (tRNS), kas veic adaptera funkciju. tRNS, kas saistās ar aminoskābi, pēc tam atpazīst atbilstošo kodonu uz mRNS. mRNS kodona atpazīšana:
Kodona un antikodona mijiedarbības pamatā ir komplementaritātes un pretparalēlisma principi:
3'----C - G-A*------5' tRNS antikodons
5'-----G-C-Y*------3' mRNS kodons
Šūpošanās hipotēzi ierosināja F. Kriks:
MRNS kodona 3'-bāzei nav stingra savienojuma pārī ar tRNS antikodona 5'-bāzi: piemēram, Y (mRNS) var mijiedarboties ar A un G (tRNS)
Dažas tRNS var savienoties pārī ar vairāk nekā vienu kodonu.
63. Tulkošanas procesa veidojošo elementu raksturojums. Translācija (translatio-translation) ir proteīnu sintēzes process no aminoskābēm uz informatīvās (matricas) RNS (mRNS, mRNS) matricas, ko veic ribosoma.
Olbaltumvielu sintēze ir šūnu dzīvības pamats. Lai veiktu šo procesu visu organismu šūnās, ir īpašas organellas - ribosomas- ribonukleoproteīnu kompleksi, kas veidoti no 2 apakšvienībām: lielas un mazas. Ribosomu funkcija ir atpazīt trīs burtus (trīs nukleotīdus) kodoni mRNS, salīdzinot tos ar atbilstošajiem tRNS antikodoniem, kas nes aminoskābes, un šo aminoskābju pievienošana augošajai olbaltumvielu ķēdei. Pārvietojoties pa mRNS molekulu, ribosoma sintezē proteīnu saskaņā ar informāciju, kas atrodas mRNS molekulā.
AK-t atpazīšanai šūnā ir īpaši "adapteri", pārnes RNS molekulas(tRNS). Šīm āboliņa formas molekulām ir vieta (antikodons), kas ir komplementāra mRNS kodonam, kā arī cita vieta, kurai pievienota šim kodonam atbilstošā aminoskābe. Aminoskābju piesaisti tRNS veic no enerģijas atkarīgā reakcijā ar enzīmu aminoacil-tRNS sintetāzes palīdzību, un iegūto molekulu sauc par aminoacil-tRNS. Tādējādi translācijas specifiku nosaka mijiedarbība starp mRNS kodonu un tRNS antikodonu, kā arī aminoacil-tRNS sintetāžu specifika, kas aminoskābes piesaista stingri tām atbilstošajām tRNS (piemēram, GGU kodons atbildīs tRNS, kas satur CCA antikodonu un tikai AK glicīnu).
prokariotu ribosoma
5S un 23S rRNS 16S rRNS
34 vāveres 21 vāveres
Prokariotu ribosomu sedimentācijas konstante ir 70S, tāpēc tās sauc par 70S daļiņām. Tie ir veidoti no divām dažādām apakšvienībām: 30S un 50S apakšvienībām. Katra apakšvienība ir rRNS un ribosomu proteīnu komplekss.
30S daļiņa satur vienu 16S rRNS molekulu un vairumā gadījumu vienu proteīna molekulu no vairāk nekā 20 sugām (21). 50S apakšvienība sastāv no divām rRNS molekulām (23S un 5S). Tas sastāv no vairāk nekā 30 dažādiem proteīniem (34), ko parasti pārstāv arī viens eksemplārs. Lielākā daļa ribosomu proteīnu veic strukturālu funkciju.
eikariotu ribosoma
5S; 5,8S un 28S rRNS 18S rRNS
vismaz 50 proteīni vismaz 33 proteīni
Ribosoma sastāv no lielām un mazām apakšvienībām. Katras apakšvienības struktūras pamatā ir sarežģīti salocīta rRNS. Ribosomu proteīni tika pievienoti rRNS sastatnēm.
Pilnīgas eikariotu ribosomas sedimentācijas koeficients ir aptuveni 80 Svedberga vienības (80S), un tās apakšdaļiņu sedimentācijas koeficients ir 40S un 60S.
Mazākā 40S apakšvienība sastāv no vienas 18S rRNS molekulas un 30-40 olbaltumvielu molekulām. Lielajā 60S apakšvienībā ir trīs veidu rRNS ar sedimentācijas koeficientiem 5S, 5,8S un 28S un 40-50 proteīniem (piemēram, žurku hepatocītu ribosomas ietver 49 proteīnus).
Ribosomu funkcionālie reģioni
P - peptidila vieta peptidil-tRNS
A - aminoacila vieta aminoacil-tRNS
E - vieta tRNS atbrīvošanai no ribosomas
Ribosomā ir 2 funkcionālas vietas mijiedarbībai ar tRNS: aminoacils (akceptors) un peptidils (donors). Aminoacil-tRNS iekļūst ribosomas akceptora vietā un mijiedarbojas, veidojot ūdeņraža saites starp kodona un antikodona tripletiem. Pēc ūdeņraža saišu veidošanās sistēma virzās uz priekšu par 1 kodonu un nonāk donora vietā. Tajā pašā laikā atbrīvotajā akceptora vietā parādās jauns kodons, un tam tiek pievienota atbilstošā aminoacil-t-RNS.
Ribosomas: struktūra, funkcija
Ribosomas ir olbaltumvielu biosintēzes citoplazmas centri. Tās sastāv no lielām un mazām apakšvienībām, kas atšķiras pēc sedimentācijas koeficientiem (sedimentācijas ātrums centrifugēšanas laikā), kas izteiktas Svedberg - S vienībās.
Ribosomas atrodas gan eikariotu, gan prokariotu šūnās, jo tām ir svarīga funkcija. olbaltumvielu biosintēze. Katrā šūnā ir desmitiem, simtiem tūkstošu (līdz pat vairākiem miljoniem) šo mazo noapaļoto organellu. Tā ir noapaļota ribonukleoproteīna daļiņa. Tās diametrs ir 20-30 nm. Ribosoma sastāv no lielām un mazām apakšvienībām, kas atšķiras pēc sedimentācijas koeficientiem (sedimentācijas ātrums centrifugēšanas laikā), kas izteiktas Svedberga vienībās - S. Šīs apakšvienības tiek apvienotas m-RNS (matricas jeb informatīvās, RNS) virknes klātbūtnē. Tiek saukts ribosomu grupas komplekss, ko apvieno viena mRNS molekula, piemēram, lodīšu virkne. polisoma. Šīs struktūras ir vai nu brīvi izvietotas citoplazmā, vai pievienotas granulētās ER membrānām (abos gadījumos uz tām aktīvi notiek proteīnu sintēze).
Granulētās ER polisomas veido olbaltumvielas, kas tiek izvadītas no šūnas un tiek izmantotas visa organisma vajadzībām (piemēram, gremošanas enzīmi, cilvēka mātes piena olbaltumvielas). Turklāt ribosomas atrodas uz mitohondriju membrānu iekšējās virsmas, kur tās arī aktīvi piedalās olbaltumvielu molekulu sintēzē.
Pārneses RNS (tRNS) spēlē svarīgu lomu procesā, kurā šūna izmanto iedzimto informāciju. Nogādājot nepieciešamās aminoskābes peptīdu ķēžu montāžas vietā, tRNS darbojas kā translācijas starpnieks.
tRNS molekulas ir polinukleotīdu ķēdes, kas sintezētas uz specifiskām DNS sekvencēm. Tie sastāv no salīdzinoši neliela nukleotīdu skaita -75-95. Bāžu komplementāras savienojuma rezultātā, kas atrodas dažādās tRNS polinukleotīdu ķēdes daļās, tā iegūst struktūru, kas pēc formas atgādina āboliņa lapu (3.26. att.).
Rīsi. 3.26. Tipiskas tRNS molekulas struktūra.
Tam ir četras galvenās daļas, kas veic dažādas funkcijas. akceptētājs"Kābiņu" veido divas savstarpēji savienotas tRNS gala daļas. Tas sastāv no septiņiem bāzes pāriem. Šī kāta 3'-gals ir nedaudz garāks un veido vienpavedienu reģionu, kas beidzas ar CCA secību ar brīvu OH grupu. Šim galam ir pievienota transportējama aminoskābe. Atlikušās trīs filiāles ir komplementāras pārī savienotas nukleotīdu sekvences, kas beidzas ar nepāra sekvencēm, kas veido cilpas. Šo zaru vidus - antikodons - sastāv no pieciem nukleotīdu pāriem un satur antikodonu savas cilpas centrā. Antikodons ir trīs nukleotīdi, kas komplementāri mRNS kodonam, kas kodē aminoskābi, ko šī tRNS transportē uz peptīdu sintēzes vietu.
Starp akceptora un antikodona zariem ir divi sānu zari. To cilpās tie satur modificētas bāzes - dihidrouridīnu (D-cilpa) un TψC tripletu, kur \y ir pseidouriaīns (T^C-cilpa).
Starp aitikodona un T^C zariem ir papildu cilpa, kas ietver no 3-5 līdz 13-21 nukleotīdu.
Kopumā dažādiem tRNS veidiem ir raksturīga noteikta nukleotīdu secības noturība, kas visbiežāk sastāv no 76 nukleotīdiem. To skaita izmaiņas galvenokārt ir saistītas ar nukleotīdu skaita izmaiņām papildu cilpā. Papildu reģioni, kas atbalsta tRNS struktūru, parasti tiek saglabāti. tRNS primārā struktūra, ko nosaka nukleotīdu secība, veido tRNS sekundāro struktūru, kurai ir āboliņa lapas forma. Savukārt sekundārā struktūra izraisa trīsdimensiju terciāro struktūru, kurai raksturīga divu perpendikulāru dubultspirāļu veidošanās (3.27. att.). Vienu no tiem veido akceptora un TψC zari, otru - antikodons un D zari.
Vienas dubultspirāles galā atrodas transportētā aminoskābe, otras galā ir antikodons. Šīs teritorijas atrodas visattālāk viena no otras. tRNS terciārās struktūras stabilitāte tiek saglabāta, jo starp polinukleotīdu ķēdes bāzēm parādās papildu ūdeņraža saites, kas atrodas dažādās tās daļās, bet terciārajā struktūrā ir telpiski tuvu.
Dažādiem tRNS veidiem ir līdzīga terciārā struktūra, lai gan ar dažām variācijām.
Rīsi. 3.27. tRNS telpiskā organizācija:
I - tRNS sekundārā struktūra "āboliņa lapas" formā, ko nosaka tās primārā struktūra (nukleotīdu secība ķēdē);
II - tRNS terciārās struktūras divdimensiju projekcija;
III - tRNS molekulas izkārtojums telpā
PIELIKUMS (ja kāds to nesaprot)
Zibens zobi - nukleotīdi (Adenine-Thymine / Uracil /, Guanine-Citazine). Viss zibens ir DNS.

Lai pārsūtītu informāciju no DNS, ir jāpārrauj 2 pavedieni. Saite starp A-T un G-C ir ūdeņradis, tāpēc to viegli pārrauj enzīms Helicase:

Lai neveidotos mezgli (Piemēram, es saviju dvieli):



Topoizomerāze nogriež vienu DNS virkni replikācijas sākumpunktā, lai ķēde nevērptos.

Kad viens pavediens ir brīvs, otrs var viegli griezties ap savu asi, tādējādi mazinot spriedzi "attīšanas" laikā. Mezgli neparādās, tiek taupīta enerģija.
Pēc tam ir nepieciešams RNS primer, lai sāktu savākt RNS. Proteīns, kas montē mRNS, nevar vienkārši salikt pirmo nukleotīdu, tam ir nepieciešams RNS gabals, lai sāktu (tur tas ir rakstīts detalizēti, es to izrakstīšu vēlāk). Šo gabalu sauc par RNS primer. Un šis proteīns jau piestiprina tam pirmo nukleotīdu.


Aprakstot nukleīnskābju struktūru, tiek ņemti vērā dažādi makromolekulu organizācijas līmeņi: primārā un sekundārā struktūra.
Nukleīnskābju primārā struktūra ir nukleotīdu sastāvs un noteikta nukleotīdu vienību secība polimēra ķēdē.
RNS sekundārā struktūra. Ribonukleīnskābes molekula ir veidota no vienas polinukleotīdu ķēdes.
RNS sekundārā struktūra
Atsevišķi RNS ķēdes posmi veido spiralizētas cilpas - "matadatas", pateicoties ūdeņraža saitēm starp komplementārajām slāpekļa bāzēm A-U un G-C. RNS ķēdes sekcijas šādās spirālveida struktūrās ir pretparalēlas, bet ne vienmēr pilnīgi komplementāras, tās satur nesapārotas nukleotīdu atliekas vai pat vienpavedienu cilpas, kas neietilpst dubultā spirālē. Spiralizētu reģionu klātbūtne ir raksturīga visiem RNS veidiem.
RNS galvenā loma ir tieša līdzdalība olbaltumvielu biosintēzē.
Ir zināmi trīs šūnu RNS veidi, kas atšķiras pēc atrašanās vietas šūnā, sastāva, izmēra un īpašībām, kas nosaka to specifisko lomu olbaltumvielu makromolekulu veidošanā:
- informatīvās (matricas) RNS pārraida DNS kodētu informāciju par proteīna struktūru no šūnas kodola uz ribosomām, kur notiek proteīna sintēze; visu mRNS primārajai struktūrai neatkarīgi no to kodēšanas secības unikalitātes ir vienāda 5'- un 3'-galu struktūra.
Tātad 5'-galā ir modificēts 7-metilguanozīna-5'-trifosfāta nukleotīds (vāciņš). Vairāki desmiti nukleotīdu atdala vāciņu no iniciācijas kodona, parasti -AUG- tripleta. Kodējošajam reģionam seko viens no beigu kodoniem -UGA-, -UUA-, -UAG-. Lielākajai daļai mRNS 3' galā ir 100-200 adenozīna monofosfāta atlikumu nukleotīdu secība.
- pārneses RNS savāc aminoskābes šūnas citoplazmā un pārnes tās uz ribosomu; Šāda veida RNS molekulas "uzzina" no atbilstošajām RNS ziņojuma ķēdes sekcijām, kurām aminoskābēm ir jāpiedalās proteīnu sintēzē.
Jebkuras tRNS telpisko struktūru neatkarīgi no nukleotīdu secības atšķirībām apraksta universālais āboliņa lapas modelis. Katrai tRNS molekulai ir ķēdes posmi, kas nav iesaistīti ūdeņraža saišu veidošanā starp nukleotīdu atlikumiem.
Tie jo īpaši ietver vietu, kas ir atbildīga par saistīšanos ar aminoskābi molekulas 3' galā un antikodonu, īpašu nukleotīdu tripletu, kas mijiedarbojas komplementāri ar mRNS kodonu.
- ribosomu RNS nodrošina noteiktas struktūras proteīnu sintēzi, informācijas nolasīšanu no informācijas (matricas) RNS. rRNS veido kompleksus ar proteīniem, ko sauc par ribosomām.
Katra ribosoma sastāv no divām apakšvienībām – mazas (40S) un lielas (60S). Ribosomu apakšvienības atšķiras ne tikai ar rRNS komplektu, bet arī ar proteīnu skaitu un struktūru.
Publicēšanas datums: 2015-02-03; Lasīts: 2729 | Lapas autortiesību pārkāpums

RNS ir polimērs, kura monomēri ir ribonukleotīdi.
Atšķirībā no DNS, RNS veido nevis divas, bet viena polinukleotīdu ķēde (izņēmums - dažiem RNS saturošiem vīrusiem ir divpavedienu RNS). RNS nukleotīdi spēj viens ar otru veidot ūdeņraža saites. RNS ķēdes ir daudz īsākas nekā DNS ķēdes.
RNS monomērs – nukleotīds (ribonukleotīds) – sastāv no trīs vielu atliekām: 1) slāpekļa bāzes, 2) piecu oglekļa monosaharīda (pentozes) un 3) fosforskābes. RNS slāpekļa bāzes pieder arī pirimidīnu un purīnu klasēm.
RNS pirimidīna bāzes - uracils, citozīns, purīna bāzes - adenīns un guanīns.
31. RNS veidi un struktūras īpatnības
RNS nukleotīdu monosaharīdu attēlo riboze.
Ir trīs RNS veidi: 1) informācijas (matricas) RNS - mRNS (mRNS), 2) pārneses RNS - tRNS, 3) ribosomu RNS - rRNS.
Visi RNS veidi ir nesazaroti polinukleotīdi, tiem ir specifiska telpiskā konformācija un tie piedalās proteīnu sintēzes procesos.
Informācija par visu veidu RNS struktūru tiek glabāta DNS. RNS sintēzes procesu uz DNS veidnes parasti sauc par transkripciju.

Pārneses RNS parasti satur 76 (no 75 līdz 95) nukleotīdus; molekulmasa - 25 000-30 000.
tRNS veido aptuveni 10% no kopējā RNS satura šūnā. tRNS funkcijas: 1) aminoskābju transportēšana uz proteīnu sintēzes vietu, uz ribosomām, 2) translācijas mediators. Šūnā atrodami aptuveni 40 tRNS veidi, katram no tiem ir tikai tai raksturīga nukleotīdu secība. Tajā pašā laikā visām tRNS ir vairāki intramolekulāri komplementāri reģioni, kuru dēļ tRNS iegūst konformāciju, kas pēc formas atgādina āboliņa lapu.
Jebkurai tRNS ir cilpa saskarei ar ribosomu (1), antikodona cilpa (2), cilpa kontaktam ar enzīmu (3), akceptora kāts (4) un antikodons (5). Aminoskābe ir pievienota akceptora kāta 3' galam. Antikodons - trīs nukleotīdi, kas "atpazīst" mRNS kodonu.
Jāuzsver, ka konkrēta tRNS var transportēt stingri noteiktu aminoskābi, kas atbilst tās antikodonam. Aminoskābju un tRNS savienojuma specifika tiek panākta, pateicoties enzīma aminoacil-tRNS sintetāzes īpašībām.
Ribosomu RNS satur 3000–5000 nukleotīdu; molekulmasa - 1 000 000-1 500 000.
rRNS veido 80–85% no kopējā RNS satura šūnā. Kompleksā ar ribosomu proteīniem rRNS veido ribosomas - organellus, kas veic olbaltumvielu sintēzi. Eikariotu šūnās rRNS sintēze notiek kodolā. rRNS funkcijas: 1) nepieciešamā ribosomu strukturālā sastāvdaļa un līdz ar to ribosomu funkcionēšanas nodrošināšana; 2) ribosomas un tRNS mijiedarbības nodrošināšana; 3) sākotnējā ribosomas un mRNS iniciatora kodona saistīšanās un nolasīšanas rāmja noteikšana, 4) ribosomas aktīvā centra veidošanās.
Messenger RNS atšķiras pēc nukleotīdu satura un molekulmasas (no 50 000 līdz 4 000 000).
MRNS daļa veido līdz 5% no kopējā RNS satura šūnā. MRNS funkcijas: 1) ģenētiskās informācijas pārnešana no DNS uz ribosomām, 2) matrica proteīna molekulas sintēzei, 3) proteīna molekulas primārās struktūras aminoskābju secības noteikšana.
Izlasi arī
RNS ir polimērs, kura monomēri ir nukleotīdi.
Trīs slāpekļa bāzes ir tādas pašas kā DNS (adenīns, guanīns, citozīns); ceturtais – uracils – atrodas RNS molekulā timīna vietā. RNS nukleotīdi satur ribozi, nevis dezoksiribozi. RNS ķēdē...
trīs galvenie RNS veidi: informatīvs(mRNS), vai matrica(mRNS), ribosomāls(rRNS) un transports(tRNS). Tie atšķiras pēc molekulārā izmēra un funkcijām. Visu veidu RNS tiek sintezētas uz DNS, piedaloties fermentiem - RNS polimerāzēm. Messenger RNS veido 2-3% no visas šūnu RNS, ribosomu - 80-85, transports - aptuveni 15%.
mRNS.
tas nolasa iedzimtu informāciju no DNS segmenta un nokopētas slāpekļa bāzu secības veidā pārnes to uz ribosomām, kur tiek sintezēts noteikts proteīns. Katra no mRNS molekulām nukleotīdu secībā un pēc izmēra atbilst gēnam DNS, no kura tā tika transkribēta. Vidēji mRNS satur 1500 nukleotīdus (75-3000). Katru mRNS tripletu (trīs nukleotīdus) sauc par kodonu. Tas ir atkarīgs no kodona, kura aminoskābe parādīsies noteiktā vietā proteīnu sintēzes laikā.
(tRNS) ir salīdzinoši zema molekulmasa, aptuveni 24-29 tūkstoši.
D un satur no 75 līdz 90 nukleotīdiem molekulā. Līdz 10% no visiem tRNS nukleotīdiem ir nelielas bāzes, kas, acīmredzot, pasargā to no hidrolītisko enzīmu iedarbības.TRNS loma ir tāda, ka tie pārnes aminoskābes uz ribosomām un piedalās olbaltumvielu sintēzes procesā. Katra aminoskābe piesaistās noteiktai tRNS. Vairākām aminoskābēm ir vairāk nekā viena tRNS. Līdz šim ir atklātas vairāk nekā 60 tRNS, kas atšķiras pēc to primārās struktūras (bāzes secības).
Visu tRNS sekundārā struktūra ir attēlota āboliņa lapas formā ar divpavedienu kātu un trim vienpavedienu). Vienas ķēdes galā atrodas akceptora vieta - CCA triplets, pie kura adenīna ir piesaistīta specifiska aminoskābe.
(rRNS). Tie satur 120-3100 nukleotīdus. Ribosomu RNS uzkrājas kodolā, kodolos.
Ribosomu proteīni no citoplazmas tiek transportēti uz kodoliem, un tur notiek spontāna ribosomu subdaļiņu veidošanās, savienojot olbaltumvielas ar atbilstošo rRNS. Ribosomas apakšdaļiņas tiek transportētas kopā vai atsevišķi caur kodola membrānas porām citoplazmā. Ribosomas ir organellas, kuru izmērs ir 20-30 nm.
Tie ir veidoti no divām dažāda izmēra un formas apakšdaļiņām. Atsevišķos olbaltumvielu sintēzes posmos šūnā ribosomas tiek sadalītas apakšdaļiņās.
Ribosomu RNS kalpo kā ribosomu ietvars un veicina sākotnējo mRNS saistīšanos ar ribosomu proteīnu biosintēzes laikā.
6. jautājums Saites, kas veido DNS un RNS primāro un sekundāro struktūru. RNS veidi
Ģenētiskais kods ir veids, kā kodēt proteīnu aminoskābju secību, izmantojot nukleotīdu secību, kas raksturīga visiem dzīviem organismiem.
Īpašības: 1) ģenētiskais kods trijnieks(katru aminoskābi kodē trīs nukleotīdi); 2) nepārklājas(kaimiņu trīnīšiem nav kopīgu nukleotīdu); 3) deģenerēts(izņemot metionīnu un triptofānu, visām aminoskābēm ir vairāk nekā viens kodons); 4) universāls(pārsvarā visiem dzīviem organismiem tas pats); 5) vienas aminoskābes kodonos pirmie divi nukleotīdi parasti ir vienādi, bet trešais mainās; 6) ir lineāra nolasīšanas secība un to raksturo kolinearitāte, t.
e) mRNS kodonu secības sakritība ar aminoskābju secību sintezētajā polipeptīdu ķēdē.
Publicēšanas datums: 2014-12-08; Lasīts: 11268 | Lapas autortiesību pārkāpums
studopedia.org — Studopedia.Org — 2014-2018. (0,001 s) ...
Šūnu citoplazmā ir trīs galvenie funkcionālie RNS veidi:
- Messenger RNS (mRNS), kas darbojas kā proteīnu sintēzes veidnes;
- ribosomu RNS (rRNS), kas darbojas kā ribosomu strukturālās sastāvdaļas;
- pārnes RNS (tRNS), kas iesaistītas mRNS informācijas translācijā (translācijā) proteīna molekulas aminoskābju secībā.
Šūnu kodolā atrodas kodola RNS, kas veido no 4 līdz 10% no kopējās šūnu RNS.
Kodola RNS lielāko daļu veido ribosomu un pārneses RNS lielmolekulārie prekursori. Augstas molekulmasas rRNS prekursori (28 S, 18 S un 5 S RNS) galvenokārt lokalizēti kodolā.
RNS ir galvenais ģenētiskais materiāls dažos dzīvnieku un augu vīrusos (genomiskā RNS). Lielākajai daļai RNS vīrusu ir raksturīga to RNS genoma reversā transkripcija, ko vada reversā transkriptāze.
Visas ribonukleīnskābes ir ribonukleotīdu polimēri, kas līdzīgi kā DNS molekulā ir savienoti ar 3',5'-fosforodiestera saitēm.
Atšķirībā no DNS, kurai ir divpavedienu struktūra, RNS ir vienpavedienu lineāra polimēra molekula.
mRNS struktūra. mRNS ir neviendabīgākā RNS klase izmēra un stabilitātes ziņā.
tRNS struktūra.
Pārneses RNS darbojas kā mediatori (adapteri) mRNS translācijas laikā. Tie veido aptuveni 15% no kopējās šūnu RNS. Katrai no 20 proteīnogēnajām aminoskābēm ir sava tRNS. Dažām aminoskābēm, kuras kodē divi vai vairāki kodoni, ir vairākas tRNS.
tRNS ir salīdzinoši mazas vienpavedienu molekulas, kas sastāv no 70–93 nukleotīdiem. To molekulmasa ir (2,4-3,1) ,104 kDa.
tRNS sekundārā struktūra veidojas, veidojot maksimālo ūdeņraža saišu skaitu starp intramolekulāriem komplementāriem slāpekļa bāzu pāriem.
Šo saišu veidošanās rezultātā tRNS polinukleotīdu ķēde savērpjas, veidojot spiralizētus zarus, kas beidzas ar nesapārotu nukleotīdu cilpām. Visu tRNS sekundāro struktūru telpiskajam attēlam ir āboliņa lapas forma.
"Āboliņā" izšķir četras obligātas zari, garākas tRNS, turklāt satur īsu piekto (papildu) zaru.
tRNS adaptera funkciju nodrošina akceptora atzars, kura 3'-galam ar ētera saiti ir pievienots aminoskābes atlikums, un pretī akceptora zaram atrodas antikodona atzars, kura augšpusē atrodas cilpa, kas satur antikodons.
Antikodons ir specifisks nukleotīdu triplets, kas ir komplementārs pretparalēlā virzienā ar mRNS kodonu, kas kodē atbilstošo aminoskābi.
T-zars, kas nes pseidouridīna cilpu (TyC-cilpa), nodrošina tRNS mijiedarbību ar ribosomām.
D-zars, kas nes dehidrouridīna cilpu, nodrošina tRNS mijiedarbību ar atbilstošo aminoacil-tRNS sintetāzi.

tRNS sekundārā struktūra
Piektās papildu filiāles funkcijas joprojām ir slikti izprotamas, visticamāk, tas izlīdzina dažādu tRNS molekulu garumu.
tRNS terciārā struktūra ir ļoti kompakta un veidojas, apvienojot atsevišķus āboliņa lapas zarus papildu ūdeņraža saišu dēļ, veidojot L-veida "elkoņa līkuma" struktūru.
Transporta RNS, struktūra un funkcionālais mehānisms.
Šajā gadījumā akceptora roka, kas saista aminoskābi, atrodas vienā molekulas galā, bet antikodons atrodas otrā.

tRNS terciārā struktūra (saskaņā ar A.S. Spirin)
rRNS un ribosomu struktūra. Ribosomu RNS veido mugurkaulu, pie kura saistās specifiski proteīni, veidojot ribosomas. Ribosomas ir nukleoproteīnu organellas, kas nodrošina proteīnu sintēzi no mRNS.
Ribosomu skaits šūnā ir ļoti liels: no 104 prokariotiem līdz 106 eikariotiem. Ribosomas ir lokalizētas galvenokārt citoplazmā, eikariotos, turklāt kodolā, mitohondriju matricā un hloroplastu stromā. Ribosomas sastāv no divām apakšdaļiņām: lielām un mazām. Pēc izmēra un molekulmasas visas pētītās ribosomas ir sadalītas 3 grupās - prokariotu 70S ribosomas (S-sedimentācijas koeficients), kas sastāv no mazām 30S un lielām 50S apakšdaļiņām; 80S eikariotu ribosomas, kas sastāv no 40S mazām un 60S lielām apakšvienībām.
Mazo 80S ribosomu apakšvienību veido viena rRNS molekula (18S) un 33 dažādu proteīnu molekulas.
Lielo apakšvienību veido trīs rRNS molekulas (5S, 5,8S un 28S) un aptuveni 50 proteīni.
RRNS sekundārā struktūra veidojas īsu divpavedienu molekulas posmu dēļ - matadatas (apmēram 2/3 rRNS), 1/3 - ir attēlotas ar vienpavedienu sekcijām, kas bagātas ar purīna nukleotīdiem.
Joomla sociālās pogas
Olbaltumvielas veido dzīvības pamatu. Viņu funkcijas šūnā ir ļoti dažādas. Tomēr olbaltumvielas "nevar" vairoties. Un visa informācija par olbaltumvielu struktūru ir ietverta gēnos (DNS).
Augstākajos organismos olbaltumvielas tiek sintezētas šūnas citoplazmā, un DNS slēpjas aiz kodola apvalka. Tāpēc DNS nevar tieši kalpot par proteīnu sintēzes veidni. Šo lomu veic cita nukleīnskābe - RNS.
RNS molekula ir nesazarots polinukleotīds ar terciāru struktūru.
To veido viena polinukleotīdu ķēde, un, lai gan tajā iekļautie komplementārie nukleotīdi spēj arī savā starpā veidot ūdeņraža saites, šīs saites rodas starp vienas ķēdes nukleotīdiem. RNS ķēdes ir daudz īsākas nekā DNS ķēdes. Ja DNS saturs šūnā ir relatīvi nemainīgs, tad RNS saturs ļoti svārstās. Lielākais RNS daudzums šūnās tiek novērots proteīnu sintēzes laikā.
RNS spēlē lielu lomu iedzimtas informācijas pārraidē un ieviešanā.
Saskaņā ar funkciju un strukturālajām iezīmēm izšķir vairākas šūnu RNS klases.
Ir trīs galvenās šūnu RNS klases.
- Informācijas (mRNS) vai matricas (mRNS). Tās molekulas ir visdažādākās izmēra, molekulmasas (no 0,05x106 līdz 4x106) un stabilitātes ziņā.
Tie veido apmēram 2% no kopējā RNS daudzuma šūnā. Visas mRNS ir ģenētiskās informācijas nesēji no kodola uz citoplazmu, līdz proteīnu sintēzes vietai. Tie kalpo kā matrica (darba zīmējums) proteīna molekulas sintēzei, jo nosaka proteīna molekulas aminoskābju secību (primāro struktūru).

- Ribosomu RNS (rRNS).
Tie veido 80–85% no kopējā RNS satura šūnā.
31.RNS uzbūve. RNS veidi, struktūras īpatnības un funkcijas. tRNS sekundārā struktūra
Ribosomu RNS sastāv no 3–5 tūkstošiem nukleotīdu. Tas tiek sintezēts kodola kodolos. Kompleksā ar ribosomu proteīniem rRNS veido ribosomas - organellus, uz kurām tiek samontētas olbaltumvielu molekulas. Galvenā rRNS nozīme ir tāda, ka tā nodrošina sākotnējo mRNS un ribosomas saistīšanos un veido ribosomas aktīvo centru, kurā polipeptīdu ķēdes sintēzes laikā starp aminoskābēm veidojas peptīdu saites.
- Pārnes RNS (tRNS).
tRNS molekulas parasti satur 75-86 nukleotīdus. tRNS molekulu molekulmasa ir aptuveni 25 tūkstoši.tRNS molekulas spēlē starpnieku lomu proteīnu biosintēzē - tās piegādā aminoskābes uz olbaltumvielu sintēzes vietu, tas ir, uz ribosomām. Šūna satur vairāk nekā 30 veidu tRNS. Katram tRNS veidam ir sava unikāla nukleotīdu secība.
Tomēr visām molekulām ir vairāki intramolekulāri komplementāri reģioni, kuru klātbūtnes dēļ visām tRNS ir terciārā struktūra, kas pēc formas atgādina āboliņa lapu.
RNS sekundārā struktūra- raksturīga tRNS, vienpavediena, veidota kā "āboliņa lapa".
Ietilpst:
- salīdzinoši īsas dubultspirāles - kāti,
- vienpavediena sekcijas - cilpas.
Ir 4 stublāji (akceptors, antikodons, dihidrouridils, pseidouridils) un 3 cilpas.

"Stem-cilpa" - shematiski RNS sekundārās struktūras elements

"Pseidoknots" - shematiski RNS sekundārās struktūras elements

Akceptora kāts satur polinukleotīdu ķēdes 3'- un 5'-galus, 5'-gals ar guanilskābes atlikumu, 3'-gals ir CCA triplets un kalpo, lai veidotu estera saiti ar AA.
Antikodona kāts atpazīst savu kodonu uz mRNS ribosomās pēc komplementaritātes principa.
Pseidouridila kāts kalpo, lai pievienotos ribosomai.
Dihidrouridila stublājs kalpo, lai saistīties ar aminoacil-tRNS sintetāzi.
Joomla sociālās pogas





