Kegunaan oksigen merupakan presentasi pelajaran kimia (kelas 8) dengan topik tersebut. Presentasi dengan topik "penggunaan oksigen" b) penguraian air
1 slide
Presentasi disiapkan oleh Roxana Smirnova, siswa kelas 9 Lyceum Otradnoye.

2 geser
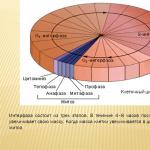
Oksigen sebagai suatu unsur. 1. Unsur oksigen berada pada golongan VI, subkelompok utama, periode II, nomor urut No. 8, 2. Struktur atom: P11 = 8; n01 = 8; ē = 8 valensi II, bilangan oksidasi -2 (jarang +2; +1; -1). 3. Bagian dari oksida, basa, garam, asam, zat organik, termasuk organisme hidup - hingga 65% berat.

3 geser
Oksigen sebagai suatu unsur. Oksigen adalah unsur paling umum di planet kita. Berdasarkan beratnya, ia menyumbang sekitar setengah dari total massa seluruh elemen kerak bumi. Komposisi udara: O2 – 20-21%; N2 – 78%; CO2 – 0,03%, sisanya berasal dari gas inert, uap air, dan pengotor. 4. Di kerak bumi, massanya 49%, di hidrosfer - 89% massa. 5. Terdiri dari udara (dalam bentuk zat sederhana) – 20-21% volume. 6. Termasuk dalam sebagian besar mineral dan batuan (pasir, tanah liat, dll). Tersusun dari udara (berupa zat sederhana). 7. Unsur penting bagi semua organisme, ditemukan di sebagian besar zat organik, terlibat dalam banyak proses biokimia yang menjamin perkembangan dan berfungsinya kehidupan. 8. Oksigen ditemukan pada tahun 1769-1771. Ahli kimia Swedia K.-V. Scheele

4 geser
Properti fisik. Oksigen merupakan unsur nonlogam yang aktif secara kimia dan merupakan unsur paling ringan dari golongan kalkogen. Zat sederhana oksigen dalam kondisi normal adalah gas yang tidak berwarna, tidak berasa dan tidak berbau, molekulnya terdiri dari dua atom oksigen, oleh karena itu disebut juga dioksigen. Oksigen cair berwarna biru muda, sedangkan oksigen padat berwarna kristal biru muda.

5 geser
Sifat kimia. Dengan non-logam C + O2 CO2 S + O2 SO2 2H2 + O2 2H2O Dengan zat kompleks 4FeS2 + 11O2 2Fe2O3 + 8SO2 2H2S + 3O2 2SO2 + 2H2O CH4 + 2O2 CO2 + 2H2O Dengan logam 2Mg + O2 2MgO 2Cu + O2 –t 2CuO Interaksi zat dengan oksigen disebut oksidasi. Semua unsur bereaksi dengan oksigen kecuali Au, Pt, He, Ne dan Ar; dalam semua reaksi (kecuali interaksi dengan fluor), oksigen adalah zat pengoksidasi. 1. Tidak stabil: O3 O2 + O 2. Oksidator kuat: 2KI + O3 + H2O 2KOH + I2 + O2 Menghitamkan pewarna, memantulkan sinar UV, menghancurkan mikroorganisme.

6 geser
Metode memperoleh. Metode industri (distilasi udara cair). Metode laboratorium (penguraian beberapa zat yang mengandung oksigen) 2KClO3 –t ;MnO2 2KCl + 3O2 2H2O2 –MnO2 2H2O + O2

7 geser
Memeriksa oksigen yang dikumpulkan. Memperoleh 3O2 2O3 Saat terjadi badai petir (di alam), (di laboratorium) dalam ozonizer kalium permanganat bila dipanaskan: 2KMnO4 –t K2MnO4 + MnO2 + O2 Penguraian garam ini terjadi bila dipanaskan di atas 2000 C.

8 geser
Aplikasi oksigen: Banyak digunakan dalam bidang kedokteran dan industri. Selama penerbangan di ketinggian, pilot dilengkapi dengan perangkat oksigen khusus. Untuk banyak penyakit paru-paru dan jantung, serta selama operasi, oksigen diberikan untuk dihirup dari bantalan oksigen. Kapal selam disuplai dengan oksigen dalam silinder. Pembakaran bahan lepas yang mudah terbakar yang diresapi dengan oksigen cair disertai dengan ledakan, yang memungkinkan penggunaan oksigen dalam operasi peledakan. Oksigen cair digunakan dalam mesin jet, pengelasan autogenous dan pemotongan logam, bahkan di bawah air.
Geser 2
OKSIGEN
Oksigen adalah unsur ke-16 dari subkelompok utama golongan VI, periode kedua sistem periodik unsur kimia D.I. Mendeleev, dengan nomor atom 8. Dilambangkan dengan simbol O (lat. Oxygenium). Oksigen merupakan unsur nonlogam yang aktif secara kimia dan merupakan unsur paling ringan dari golongan kalkogen. Zat sederhana oksigen dalam kondisi normal adalah gas yang tidak berwarna, tidak berasa dan tidak berbau, molekulnya terdiri dari dua atom oksigen (rumus O2), oleh karena itu disebut juga dioksigen. Oksigen cair berwarna biru muda, sedangkan oksigen padat berwarna kristal biru muda.
Geser 3
Secara resmi diyakini bahwa oksigen ditemukan oleh ahli kimia Inggris Joseph Priestley pada tanggal 1 Agustus 1774 dengan menguraikan oksida merkuri dalam wadah yang tertutup rapat (Priestley mengarahkan sinar matahari ke senyawa ini menggunakan lensa yang kuat). Namun, Priestley pada awalnya tidak menyadari bahwa ia telah menemukan zat baru yang sederhana; ia percaya bahwa ia telah mengisolasi salah satu bagian penyusun udara (dan menyebut gas ini sebagai “udara dephlogisticated”). Priestley melaporkan penemuannya kepada ahli kimia Perancis terkemuka Antoine Lavoisier. Pada tahun 1775, A. Lavoisier menetapkan bahwa oksigen merupakan komponen udara, asam dan ditemukan di banyak zat. Beberapa tahun sebelumnya (tahun 1771), oksigen diperoleh oleh ahli kimia Swedia Karl Scheele. Dia mengkalsinasi sendawa dengan asam sulfat dan kemudian menguraikan oksida nitrat yang dihasilkan. Scheele menyebut gas ini sebagai “udara api” dan menggambarkan penemuannya dalam sebuah buku yang diterbitkan pada tahun 1777 (tepatnya karena buku tersebut diterbitkan lebih lambat dari Priestley yang mengumumkan penemuannya, maka Priestley dianggap sebagai penemu oksigen). Scheele pun melaporkan pengalamannya kepada Lavoisier. Sebuah langkah penting yang berkontribusi pada penemuan oksigen adalah karya ahli kimia Perancis Pierre Bayen, yang menerbitkan karya tentang oksidasi merkuri dan penguraian oksida selanjutnya. Akhirnya, A. Lavoisier akhirnya menemukan sifat gas yang dihasilkan, dengan menggunakan informasi dari Priestley dan Scheele. Karyanya sangat penting karena berkat teori flogiston yang dominan saat itu dan menghambat perkembangan ilmu kimia, digulingkan. Lavoisier melakukan eksperimen pada pembakaran berbagai zat dan menyangkal teori flogiston, menerbitkan hasil berat unsur yang terbakar. Berat abu melebihi berat asli unsur, yang memberi Lavoisier hak untuk menyatakan bahwa selama pembakaran terjadi reaksi kimia (oksidasi) suatu zat, dan oleh karena itu massa zat asli bertambah, yang menyangkal teori flogiston. . Dengan demikian, penghargaan atas penemuan oksigen sebenarnya dimiliki oleh Priestley, Scheele, dan Lavoisier. PENEMUAN OKSIGEN
Geser 4
Geser 5
Penggunaan oksigen Penggunaan oksigen secara luas dalam industri dimulai pada pertengahan abad ke-20, setelah penemuan turboexpander - alat untuk pencairan dan pemisahan. Pemanfaatan oksigen sangat beragam dan didasarkan pada sifat kimianya. Industri kimia dan petrokimia. Oksigen digunakan untuk mengoksidasi reaktan awal, menghasilkan asam nitrat, etilen oksida, propilen oksida, vinil klorida dan senyawa basa lainnya. Selain itu, dapat digunakan untuk meningkatkan produktivitas insinerator sampah. Industri minyak dan gas. Meningkatkan produktivitas proses perengkahan minyak, pengolahan senyawa beroktan tinggi, injeksi ke dalam reservoir untuk meningkatkan energi perpindahan.
Geser 6
Penerapan oksigen
Industri kaca. Tungku peleburan kaca menggunakan oksigen untuk meningkatkan pembakaran. Selain itu, digunakan untuk mengurangi emisi nitrogen oksida ke tingkat yang aman. Industri pulp dan kertas. Oksigen digunakan dalam delignifikasi, alkoholisasi dan proses lainnya. Dalam pengobatan, oksigen medis disimpan dalam tabung gas logam bertekanan tinggi (untuk gas terkompresi atau cair) berwarna biru dengan berbagai kapasitas dari 1,2 hingga 10,0 liter di bawah tekanan hingga 15 MPa (150 atm) dan digunakan untuk memperkaya campuran gas pernapasan. dalam peralatan anestesi, jika terjadi masalah pernapasan, untuk meredakan serangan asma bronkial, menghilangkan hipoksia yang berasal dari mana pun, untuk penyakit dekompresi, untuk mengobati patologi saluran pencernaan dalam bentuk koktail oksigen. Untuk penggunaan individu, wadah karet khusus - bantalan oksigen - diisi dari silinder dengan oksigen medis. Inhaler oksigen berbagai model dan modifikasi digunakan untuk mensuplai oksigen atau campuran oksigen-udara secara bersamaan kepada satu atau dua korban di lapangan atau di rumah sakit. Keunggulan alat penghirup oksigen adalah adanya kondensor-pelembab campuran gas yang memanfaatkan kelembapan udara yang dihembuskan. Untuk menghitung jumlah oksigen yang tersisa di dalam silinder dalam liter, tekanan dalam silinder dalam atmosfer (menurut pengukur tekanan peredam) biasanya dikalikan dengan kapasitas silinder dalam liter. Misalnya pada silinder berkapasitas 2 liter, pengukur tekanan menunjukkan tekanan oksigen 100 atm. Volume oksigen dalam hal ini adalah 100×2 = 200 liter.
Gas itu patut mendapat kejutan - Ini sedang digunakan sekarang Untuk memotong logam, dalam pembuatan baja Dan di tanur sembur yang kuat. Pilot membawanya ke ketinggian. Kapal selam membawanya. Anda mungkin sudah dapat menebaknya, Gas apa ini...
Oksigen


Topik pelajaran: Oksigen. Kuitansi. Properti.
Tujuan pelajaran: Pelajari sejarah penemuan, metode utama produksi dan sifat oksigen.
Rencana belajar:
- Arti oksigen. Peran biologis.
2. Prevalensi di alam.
3. Sejarah penemuan.
4. Kedudukan unsur oksigen pada PSHE D.I. Mendeleev.
5. Properti fisik.
6. Memperoleh oksigen
7. Sifat kimia.
8. Penggunaan oksigen.



Joseph Priestley
(1743 – 1794)
Karl Scheele
(1742 – 1786)
Antoine Lavoisier
(1743 – 1794)


T = – 1 83 °C
T = –219 °C
Cairan berwarna biru pucat
Gas, tidak berwarna, tidak berbau, tidak berasa, sedikit larut dalam air
Kristal biru
Lebih berat dari udara.

Ringan, klorofil
6СО 2 + 6 jam 2 TENTANG
DENGAN 6 N 12 TENTANG 6 + 6O 2

Pencairan udara di bawah tekanan pada T = – 1 83 °C

Dengan represi V udara
Dengan memindahkan air

Dekomposisi air
H 2 HAI H 2 + HAI 2
Dekomposisi hidrogen peroksida
H 2 HAI 2 H 2 O+O 2
Penguraian kalium permanganat
KMnO 4 K 2 MnO 4 +MnO 2 + HAI 2
kalium permanganat
kalium manganat
Penguraian kalium klorat (kalium klorat)
KClO 3 KCl + O 2
Oksigen diperoleh di laboratorium melalui penguraian senyawa yang mengandung oksigen

Dengan zat sederhana:
Dengan non-logam:
S+O 2 JADI 2
P+O 2 P 2 HAI 5
Dengan logam:
Mg+O 2 MgO
Fe+O 2 Fe 3 HAI 4 (FeO Fe 2 HAI 3 )
Ketika zat sederhana berinteraksi dengan oksigen, oksida terbentuk

Pikirkan dan jawab
A
1
B
2
V
3
G
4
D
5

Pikirkan dan jawab
- Ilmuwan yang terlibat dalam produksi dan studi oksigen:
a) Dmitry Ivanovich Mendeleev;
b) Joseph Priestley;
c) Antoine Laurent Lavoisier;
d) Karl Scheele;
d) Mikhail Vasilyevich Lomonosov

Pikirkan dan jawab
2. Tiga labu berbeda berisi udara, karbon dioksida, dan oksigen. Anda dapat mengenali masing-masing gas:
a) membandingkan massa labu berisi gas
b) menggunakan serpihan yang membara
c) dengan kelarutan gas dalam air
d) melalui bau
e) dengan bantuan zat lain

Pikirkan dan jawab
3. Di laboratorium, oksigen diperoleh:
a) pencairan udara
b) penguraian air
c) penguraian kalium permanganat
d) dari hidrogen peroksida
e) oksidasi zat

Pikirkan dan jawab
4. Oksigen dapat dikumpulkan dengan menggantikan air karena:
a) lebih ringan dari udara
b) sangat larut dalam air
c) lebih berat dari udara
d) sukar larut dalam air
D ) tidak memiliki warna, bau, rasa

Pikirkan dan jawab
5. Kita berbicara tentang oksigen sebagai zat sederhana:
a) oksigen merupakan bagian dari air;
b) oksigen sulit larut dalam air;
c) oksigen mendukung respirasi dan pembakaran;
d) merupakan komponen udara;
e) merupakan bagian dari karbon dioksida.

A
1
2
B
V
3
G
4
D
5

Ar(O)=16 bukan logam B= II
T = – 1 83 °C
Cairan berwarna biru pucat
Aku Neme
T = –219 °C
di industri: pendingin udara ke -183 °C
oksidasi
E X TENTANG pada
Kristal biru
di laboratorium:
H 2 O H 2 O 2 KMnO 4 KClO 3
Metode pengumpulan:
Perpindahan udara
Perpindahan air

Pekerjaan rumah
§3 2–34
"3" - Dengan. 111 pertanyaan 1,2
"4" - Dengan. 111 pertanyaan 3.4
"5" - Dengan. 111 pertanyaan 5.6
Tugas: Diketahui bahwa tubuh manusia mengandung 65% oksigen menurut beratnya. Hitung berapa banyak oksigen dalam tubuh Anda.
Tugas kreatif:
Buatlah teka-teki silang, rebus, VOC dengan topik “Oksigen”

Oksigen Oksigen adalah unsur subkelompok utama golongan keenam, periode kedua sistem periodik unsur kimia D.I. Mendeleev, dengan nomor atom 8. Dilambangkan dengan simbol O (lat. Oxygenium). Oksigen adalah non-logam yang aktif secara kimia dan merupakan unsur paling ringan dari kelompok kalkogen. Zat sederhana oksigen (nomor CAS :) dalam kondisi normal adalah gas yang tidak berwarna, tidak berasa dan tidak berbau, yang molekulnya terdiri dari dua atom oksigen (rumus O 2), oleh karena itu disebut juga dioksigen. Oksigen cair berwarna biru muda.
Ada bentuk oksigen alotropik lainnya, misalnya ozon (nomor CAS :) dalam kondisi normal, gas biru dengan bau tertentu, molekulnya terdiri dari tiga atom oksigen (rumus O 3).

Sejarah penemuan Secara resmi diyakini bahwa oksigen ditemukan oleh ahli kimia Inggris Joseph Priestley pada tanggal 1 Agustus 1774 dengan menguraikan merkuri oksida dalam wadah yang tertutup rapat (Priestley mengarahkan sinar matahari ke senyawa ini menggunakan lensa yang kuat). 2HgO (t) 2Hg + O 2

Namun, Priestley pada awalnya tidak menyadari bahwa ia telah menemukan zat baru yang sederhana; ia percaya bahwa ia telah mengisolasi salah satu bagian penyusun udara (dan menyebut gas ini sebagai “udara dephlogisticated”). Priestley melaporkan penemuannya kepada ahli kimia Perancis terkemuka Antoine Lavoisier. Pada tahun 1775, A. Lavoisier menetapkan bahwa oksigen merupakan komponen udara, asam dan ditemukan di banyak zat.

Beberapa tahun sebelumnya (tahun 1771), oksigen diperoleh oleh ahli kimia Swedia Karl Scheele. Dia mengkalsinasi sendawa dengan asam sulfat dan kemudian menguraikan oksida nitrat yang dihasilkan. Scheele menyebut gas ini sebagai “udara api” dan menjelaskan penemuannya dalam sebuah buku yang diterbitkan pada tahun 1777 (tepatnya karena buku tersebut diterbitkan lebih lambat dari Priestley yang mengumumkan penemuannya, maka Priestley dianggap sebagai penemu oksigen). Scheele pun melaporkan pengalamannya kepada Lavoisier.


Akhirnya, A. Lavoisier akhirnya menemukan sifat gas yang dihasilkan, dengan menggunakan informasi dari Priestley dan Scheele. Karyanya sangat penting karena berkat teori flogiston yang dominan saat itu dan menghambat perkembangan ilmu kimia, digulingkan. Lavoisier melakukan eksperimen pada pembakaran berbagai zat dan menyangkal teori flogiston, menerbitkan hasil berat unsur yang terbakar. Berat abu melebihi berat asli unsur, yang memberi Lavoisier hak untuk menyatakan bahwa selama pembakaran terjadi reaksi kimia (oksidasi) suatu zat, dan oleh karena itu massa zat asli bertambah, yang menyangkal teori flogiston. . Dengan demikian, penghargaan atas penemuan oksigen sebenarnya dimiliki oleh Priestley, Scheele, dan Lavoisier.

Asal usul nama Kata oksigen (juga disebut "larutan asam" pada awal abad ke-19) sampai batas tertentu muncul dalam bahasa Rusia karena M.V. Lomonosov, yang memperkenalkan kata "asam", bersama dengan neologisme lainnya; dengan demikian, kata “oksigen”, pada gilirannya, merupakan penelusuran dari istilah “oksigen” (Prancis l "oxygène), dikemukakan oleh A. Lavoisier (Yunani όξύγενναω dari ξύς “asam” dan γενναω “melahirkan”), yaitu diterjemahkan sebagai “menghasilkan asam ", karena arti aslinya adalah "asam", yang sebelumnya berarti oksida, disebut oksida menurut tata nama internasional modern.

Keberadaannya di alam Oksigen adalah unsur paling melimpah di Bumi; bagiannya (dalam berbagai senyawa, terutama silikat) menyumbang sekitar 47,4% massa kerak bumi padat. Laut dan perairan tawar mengandung oksigen terikat dalam jumlah besar 88,8% (berat), di atmosfer kandungan oksigen bebas 20,95% volume dan 23,12% massa. Lebih dari 1.500 senyawa di kerak bumi mengandung oksigen. Oksigen adalah bagian dari banyak zat organik dan terdapat di semua sel hidup. Berdasarkan jumlah atom dalam sel hidup sekitar 25%, dan berdasarkan fraksi massa sekitar 65%.

Perolehan Saat ini, dalam industri, oksigen diperoleh dari udara. Laboratorium menggunakan oksigen yang diproduksi secara industri, disuplai dalam silinder baja dengan tekanan sekitar 15 MPa. Metode laboratorium yang paling penting untuk produksinya adalah elektrolisis larutan alkali dalam air. Oksigen dalam jumlah kecil juga dapat diperoleh dengan mereaksikan larutan kalium permanganat dengan larutan hidrogen peroksida yang diasamkan. Pabrik oksigen yang beroperasi berdasarkan teknologi membran dan nitrogen juga terkenal dan berhasil digunakan dalam industri. Ketika dipanaskan, kalium permanganat KMnO 4 terurai menjadi kalium manganat K 2 MnO 4 dan mangan dioksida MnO 2 dengan pelepasan gas oksigen O 2 secara bersamaan: 2KMnO 4 K2MnO 4 + MnO 2 + O 2

Dalam kondisi laboratorium juga diperoleh dengan dekomposisi katalitik hidrogen peroksida H 2 O 2: 2H 2 O 2 2H 2 O + O 2 Katalisnya adalah mangan dioksida (MnO 2) atau sepotong sayuran mentah (mengandung enzim yang mempercepat dekomposisi hidrogen peroksida). Oksigen juga dapat diperoleh dengan dekomposisi katalitik kalium klorat (garam Berthollet) KClO 3: 2KClO 3 2KCl + 3O 2 Selain metode laboratorium di atas, oksigen diperoleh dengan metode pemisahan udara di pabrik pemisahan udara dengan kemurnian hingga 99,9999% pada O2.

Sifat Fisika Dalam kondisi normal, oksigen adalah gas yang tidak berwarna, tidak berasa, dan tidak berbau. 1 liternya berbobot 1,429 g. Sedikit larut dalam air (4,9 ml/100g pada 0 °C, 2,09 ml/100g pada 50 °C) dan alkohol (2,78 ml/100g pada 25 °C). Ia larut dengan baik dalam perak cair (22 volume O 2 dalam 1 volume Ag pada 961 °C). Bersifat paramagnetik. Ketika gas oksigen dipanaskan, terjadi disosiasi reversibel menjadi atom: pada 2000 °C 0,03%, pada 2600 °C 1%, 4000 °C 59%, 6000 °C 99,5%. Oksigen cair (titik didih 182,98 °C) adalah cairan berwarna biru pucat. Diagram fase O 2 Oksigen padat (titik leleh 218,79 °C) kristal biru. Enam fase kristal diketahui, tiga di antaranya ada pada tekanan 1 atm:

α-O 2 ada pada suhu di bawah 23,65 K; kristal biru cerah termasuk dalam sistem monoklinik, parameter sel a=5.403 Å, b=3.429 Å, c=5.086 Å; β=132.53° β-O 2 berada pada kisaran suhu 23.65 hingga 43.65 K; kristal biru pucat (dengan meningkatnya tekanan warnanya berubah menjadi merah muda) memiliki kisi rhombohedral, parameter sel a=4,21 Å, α=46,25° γ-O 2 ada pada suhu dari 43,65 hingga 54,21 K; kristal biru pucat memiliki simetri kubik, parameter kisi a=6,83 Å

Tiga fase lagi terbentuk pada tekanan tinggi: kisaran suhu δ-O 2 hingga 300 K dan tekanan 6-10 GPa, kristal oranye; tekanan ε-O 2 dari 10 hingga 96 GPa, warna kristal dari merah tua hingga hitam, sistem monoklinik; Tekanan ζ-O 2 lebih dari 96 GPa, keadaan logam dengan karakteristik kilau logam, pada suhu rendah berubah menjadi keadaan superkonduktor.

Sifat kimia Zat pengoksidasi kuat, berinteraksi dengan hampir semua unsur, membentuk oksida. Keadaan oksidasi 2. Biasanya, reaksi oksidasi berlangsung dengan pelepasan panas dan dipercepat dengan meningkatnya suhu. Contoh reaksi yang terjadi pada suhu kamar: 4K + O 2 2K 2 O 2Sr + O 2 2SrO Mengoksidasi senyawa yang mengandung unsur dengan bilangan oksidasi tidak maksimum: 2NO + O 2 2NO 2


Oksigen tidak mengoksidasi Au dan Pt, halogen dan gas inert. Oksigen membentuk peroksida dengan bilangan oksidasi 1. Misalnya, peroksida diperoleh dari pembakaran logam alkali dalam oksigen: 2Na + O 2 Na 2 O 2 Beberapa oksida menyerap oksigen: 2BaO + O 2 2BaO 2

Menurut teori pembakaran yang dikembangkan oleh A. N. Bach dan K. O. Engler, oksidasi terjadi dalam dua tahap dengan terbentuknya senyawa perantara peroksida. Senyawa antara ini dapat diisolasi, misalnya bila nyala api pembakaran hidrogen didinginkan dengan es, bersama dengan air maka terbentuklah hidrogen peroksida: H 2 + O 2 H 2 O 2 Superoksida mempunyai bilangan oksidasi 1/2, yaitu yaitu, satu elektron untuk dua atom oksigen (ion O 2 -). Ini diperoleh dengan mereaksikan peroksida dengan oksigen pada tekanan dan suhu tinggi: Na 2 O 2 + O 2 2NaO 2 Ozonida mengandung ion O 3 - dengan bilangan oksidasi 1/3. Hal ini diperoleh melalui aksi ozon pada hidroksida logam alkali: KOH(padat) + O 3 KO 3 + KOH + O 2 Ion dioksigenil O 2 + memiliki bilangan oksidasi +1/2. Diperoleh dari reaksi: PtF 6 + O 2 O 2 PtF 6

Oksigen fluorida Oksigen difluorida, bilangan oksidasi OF 2 +2, diperoleh dengan melewatkan fluor melalui larutan alkali: 2F 2 + 2NaOH OF 2 + 2NaF + H 2 O Oksigen monofluorida (Dioksidifluorida), O 2 F 2, tidak stabil, bilangan oksidasi + 1. Itu diperoleh dari campuran fluor dan oksigen dalam lucutan pijar pada suhu 196 °C. Dengan melewatkan lucutan pijar melalui campuran fluor dan oksigen pada tekanan dan suhu tertentu, diperoleh campuran oksigen fluorida yang lebih tinggi O 3 F 2, O 4 F 2, O 5 F 2 dan O 6 F 2. Oksigen mendukung proses tersebut respirasi, pembakaran, dan pembusukan. Dalam bentuk bebasnya, unsur ini terdapat dalam dua modifikasi alotropik: O 2 dan O 3 (ozon).

Aplikasi Kimia, petrokimia: Penciptaan lingkungan inert dalam wadah, pemadaman api nitrogen, pembersihan dan pengujian jaringan pipa, regenerasi katalis, pengemasan produk dalam lingkungan nitrogen, intensifikasi proses oksidasi, pelepasan metana, hidrogen, karbon dioksida.








Geser 1
Presentasi kimia dengan topik: “Penggunaan oksigen”
siswa kelas ____ ________ ______

Geser 6
Cornelius Drebbel
Fakta menariknya adalah untuk pertama kalinya oksigen tidak diisolasi oleh ahli kimia. Hal ini dilakukan oleh penemu kapal selam K. Drebbel pada awal abad ke-17. Gas ini ia gunakan untuk bernapas di dalam perahu saat terendam air. Namun karya penemunya dirahasiakan. Oleh karena itu, karya K. Drebbel tidak berperan besar dalam perkembangan ilmu kimia.

Geser 7
Penemu oksigen
Joseph Priestley Karl Scheele Antoine Lavoisier

Geser 10
Penggunaan oksigen Penggunaan oksigen secara luas dalam industri dimulai pada pertengahan abad ke-20, setelah penemuan turboexpander - alat untuk pencairan dan pemisahan. Pemanfaatan oksigen sangat beragam dan didasarkan pada sifat kimianya. Industri kimia dan petrokimia. Oksigen digunakan untuk mengoksidasi reaktan awal, menghasilkan asam nitrat, etilen oksida, propilen oksida, vinil klorida dan senyawa basa lainnya. Selain itu, dapat digunakan untuk meningkatkan produktivitas insinerator sampah. Industri minyak dan gas. Meningkatkan produktivitas proses perengkahan minyak, pengolahan senyawa beroktan tinggi, injeksi ke dalam reservoir untuk meningkatkan energi perpindahan.

Geser 11
Penerapan oksigen
Industri metalurgi dan pertambangan. Oksigen digunakan dalam produksi baja konverter, peledakan oksigen dalam tanur tinggi, ekstraksi emas dari bijih, produksi ferroalloy, peleburan nikel, seng, timbal, zirkonium dan logam non-besi lainnya, reduksi langsung besi, pengupasan api pada pelat di pengecoran, pengeboran api pada batuan keras.

Geser 12
Pengelasan dan pemotongan logam. Oksigen dalam silinder banyak digunakan untuk pemotongan api dan pengelasan logam, untuk pemotongan logam plasma dengan presisi tinggi.

Geser 13
Peralatan militer. Di ruang hiperbarik, untuk mengoperasikan mesin diesel di bawah air, bahan bakar untuk mesin roket. Digunakan dalam peralatan menyelam, luar angkasa, dan pemadam kebakaran.