Qu’est-ce que l’inhibition de l’agrégation plaquettaire ? Médicaments affectant l’hémostase vasculaire des plaquettes L’agrégation plaquettaire est inhibée par un bloqueur du Ca2
L'invention concerne le domaine de la physiologie, de la pharmacologie et de la chimie médicinale, en particulier un procédé amélioré pour inhiber l'agrégation plaquettaire. Cet objectif est atteint grâce au procédé amélioré décrit d'inhibition de l'agrégation plaquettaire à l'aide de composés hétérocycliques contenant du soufre, qui consiste à utiliser du benzo-1,2-dithiol-3-thione (BDTT) connu ou ses dérivés de formule générale comme contenant du soufre. composés hétérocycliques
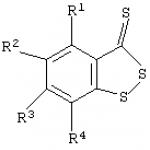
 où R 1 -R 4 =H ou C 1-4 -alkyle. Résultat technique : permet d'inhiber plus efficacement l'agrégation plaquettaire in vitro. L'invention concerne la physiologie, la pharmacologie et la chimie médicinale, en particulier un procédé amélioré pour inhiber l'agrégation plaquettaire. Les résultats de nombreuses études indiquent que l'agrégation plaquettaire accrue joue un rôle. rôle clé dans la pathogenèse de nombreuses maladies cardiovasculaires (par exemple, thrombose artérielle, infarctus du myocarde, angine instable). Les composés qui peuvent empêcher l'activation plaquettaire, qui peut être provoquée par des inducteurs endogènes (par exemple, l'adénosine-5'-diphosphate/ADP), sont actuellement largement utilisés pour influencer efficacement les changements pathologiques dans le système hémostatique (B.A. Sidorenko, D. .V. Preobrazhensky. Utilisation clinique de médicaments antithrombotiques. - M., 1998). Diverses méthodes d'inhibition de l'agrégation plaquettaire utilisant des composés bicycliques contenant du soufre sont ainsi connues pour la prévention. agrégation plaquettaire, 5,6,7-tétrahydrothiénopyridine (ticlopidine) de formule I.
où R 1 -R 4 =H ou C 1-4 -alkyle. Résultat technique : permet d'inhiber plus efficacement l'agrégation plaquettaire in vitro. L'invention concerne la physiologie, la pharmacologie et la chimie médicinale, en particulier un procédé amélioré pour inhiber l'agrégation plaquettaire. Les résultats de nombreuses études indiquent que l'agrégation plaquettaire accrue joue un rôle. rôle clé dans la pathogenèse de nombreuses maladies cardiovasculaires (par exemple, thrombose artérielle, infarctus du myocarde, angine instable). Les composés qui peuvent empêcher l'activation plaquettaire, qui peut être provoquée par des inducteurs endogènes (par exemple, l'adénosine-5'-diphosphate/ADP), sont actuellement largement utilisés pour influencer efficacement les changements pathologiques dans le système hémostatique (B.A. Sidorenko, D. .V. Preobrazhensky. Utilisation clinique de médicaments antithrombotiques. - M., 1998). Diverses méthodes d'inhibition de l'agrégation plaquettaire utilisant des composés bicycliques contenant du soufre sont ainsi connues pour la prévention. agrégation plaquettaire, 5,6,7-tétrahydrothiénopyridine (ticlopidine) de formule I.  étant un antagoniste des récepteurs plaquettaires P2T ADP (brevet américain n° 4963559, cl. 514-301, op. 1990). Il a également été démontré que l'inhibiteur des canaux calciques est le D-cis-3-acétoxy-2,3-. Chlorhydrate de dihydro-5--2 -(2-méthoxyphényl)-1,5-benzothiazépine-4(5H)-one (diltiazem) de formule II
étant un antagoniste des récepteurs plaquettaires P2T ADP (brevet américain n° 4963559, cl. 514-301, op. 1990). Il a également été démontré que l'inhibiteur des canaux calciques est le D-cis-3-acétoxy-2,3-. Chlorhydrate de dihydro-5--2 -(2-méthoxyphényl)-1,5-benzothiazépine-4(5H)-one (diltiazem) de formule II  a un effet antithrombotique (A.R.Dehpour, T.Samadian et al. «Effets du diltiazem et du vérapamil sur le changement de forme et l'agrégation des plaquettes de lapin induites par l'ADP» Gen. Pharmacol, 1995, v.26, n° 6, p.1295-1299 ). Les composés ci-dessus, in vitro, ont inhibé l'agrégation plaquettaire provoquée par l'ADP à une concentration > 300 µM de benzo-1,2-dithiol-3-thione (BDTT) et ses dérivés de formule générale III sont connus.
a un effet antithrombotique (A.R.Dehpour, T.Samadian et al. «Effets du diltiazem et du vérapamil sur le changement de forme et l'agrégation des plaquettes de lapin induites par l'ADP» Gen. Pharmacol, 1995, v.26, n° 6, p.1295-1299 ). Les composés ci-dessus, in vitro, ont inhibé l'agrégation plaquettaire provoquée par l'ADP à une concentration > 300 µM de benzo-1,2-dithiol-3-thione (BDTT) et ses dérivés de formule générale III sont connus.  où R 1 R 4 = H ou un groupe alkyle en C 1-6 , benzoyle, aminosulfonyle (substitué), etc., en tant que produits de synthèse organique (brevet européen n° 0043936, op. 1981). l'agrégation plaquettaire n'a pas été étudiée. La méthode la plus proche de ce qui est décrit est la méthode connue d'inhibition de l'agrégation plaquettaire en introduisant dans le milieu contenant ces cellules des composés hétérocycliques soufrés - 3,4-dihydro-1,2-dithiine-2 substitués. -oxydes. En particulier, cette méthode a conduit à une diminution de l'agrégation plaquettaire à l'aide du 3,4-dihydro-3-vinyl-1,2-dithiine-2-oxyde de formule IV.
où R 1 R 4 = H ou un groupe alkyle en C 1-6 , benzoyle, aminosulfonyle (substitué), etc., en tant que produits de synthèse organique (brevet européen n° 0043936, op. 1981). l'agrégation plaquettaire n'a pas été étudiée. La méthode la plus proche de ce qui est décrit est la méthode connue d'inhibition de l'agrégation plaquettaire en introduisant dans le milieu contenant ces cellules des composés hétérocycliques soufrés - 3,4-dihydro-1,2-dithiine-2 substitués. -oxydes. En particulier, cette méthode a conduit à une diminution de l'agrégation plaquettaire à l'aide du 3,4-dihydro-3-vinyl-1,2-dithiine-2-oxyde de formule IV.  à des concentrations relativement élevées (par exemple, dans des conditions in vitro pour un composé donné, IC 50 = 100 µM) (brevet japonais 02204487, C 07 D 339/08, op. 1991, Chem. Abstr., 1991, v. 114, p. 6523s - prototype). Le but de l'invention est de développer une méthode plus efficace d'inhibition de l'agrégation plaquettaire. Ce but est atteint par la méthode décrite d'inhibition de l'agrégation plaquettaire en introduisant des composés hétérocycliques soufrés dans le milieu contenant ces cellules, caractérisé en ce que le BDTT connu ou ses dérivés de formule générale III ci-dessus, où R 1 -R 4 ont les valeurs indiquées. Les composés de formule générale III ont été obtenus d'une manière connue - en faisant réagir le o-chloro correspondant non substitué ou substitué. - ou du chlorure ou bromure d'o-bromobenzyle avec du soufre à une température de 50-200C dans un environnement d'éther monoalkylique de glycol en présence d'un alcoxyde de métal alcalin. L'invention décrite est illustrée par les exemples suivants. Exemple 1. Inhibition des plaquettes humaines. agrégation sous l'influence du BDTT et de ses dérivés. L'effet des produits de la présente invention sur l'agrégation plaquettaire humaine a été étudié par la méthode turbidimétrique bien connue de Born. Pour cela, du sang veineux prélevé à 8 heures du matin sur des donneurs sains a été centrifugé à 450 g à température ambiante dans un récipient en plastique pendant 10 minutes, en utilisant du citrate de sodium comme anticoagulant. Le surnageant, c'est-à-dire le plasma riche en plaquettes, a été collecté et centrifugé à 650 g pendant 30 minutes pour obtenir un plasma pauvre en plaquettes. La concentration en plaquettes dans le plasma riche en plaquettes a été ajustée à 2,510 cellules/ml par dilution avec du plasma pauvre en plaquettes, et la suspension résultante a été versée dans une cuvette de 0,5 ml. L'agrégation a été induite en ajoutant de l'ADP à une concentration de 20 µM. La concentration d'ADP a été sélectionnée dans chaque expérience de manière à ce que l'agrégation soit réversible et que le maximum se produise 2 minutes après l'ajout d'ADP, sans dépasser 50 %. La diffusion de la lumière d'une suspension de plaquettes a été mesurée à l'aide d'un agrégomètre développé à la Faculté de biologie de l'Université d'État de Moscou. M.V. Lomonossov. Le composé étudié (sous forme d'une solution aqueuse, si nécessaire, contenant du DMSO jusqu'à 0,2 %) a été ajouté à l'échantillon avant d'ajouter l'inducteur d'agrégation (ADP) aux produits de la présente invention à une concentration de 1 à 100. μM a inhibé l'agrégation plaquettaire provoquée par 20 μM d'ADP, tandis qu'une action efficace a été observée à la concentration<30 мкМ. В частности, значение концентрации, при которой достигалось полумаксимальное ингибирование, (IC 50) для БДТТ составляло 6,4 мкМ. Согласно данным прототипа, для известного аналога (3,4-дигидро-3-винил-1,2-дитиин-2-оксида) в условиях in vitro IC 50 имела значение 100 мкМ.Пример 2. Острая токсичность БДТТ и его производных.Острую токсичность соединений настоящего изобретения определяли известным способом по ЛД 50 с использованием беспородных мышей обоего пола средней массой 21 г при комнатной температуре; стандартное питание и воду давали ad libitum в течение всего эксперимента; подвижность животных не ограничивали. Растворы соединений в ДМСО вводили с помощью стерильного шприца внутрибрюшинно. После инъекции за животными вели наблюдение в течение 48 ч по истечении этого времени за мышами наблюдали дополнительно в течение 72 ч (ни одно из животных не погибло в течение дополнительного промежутка времени). Полученные результаты свидетельствуют о том, что значение ЛД 50 для БДТТ составляет >100 mg/kg, et pour ses dérivés pas inférieur à 50 mg/kg. Les données présentées dans l'exemple 1 montrent que la méthode décrite permet d'inhiber l'agrégation plaquettaire in vitro plus efficacement par rapport à la méthode connue.
à des concentrations relativement élevées (par exemple, dans des conditions in vitro pour un composé donné, IC 50 = 100 µM) (brevet japonais 02204487, C 07 D 339/08, op. 1991, Chem. Abstr., 1991, v. 114, p. 6523s - prototype). Le but de l'invention est de développer une méthode plus efficace d'inhibition de l'agrégation plaquettaire. Ce but est atteint par la méthode décrite d'inhibition de l'agrégation plaquettaire en introduisant des composés hétérocycliques soufrés dans le milieu contenant ces cellules, caractérisé en ce que le BDTT connu ou ses dérivés de formule générale III ci-dessus, où R 1 -R 4 ont les valeurs indiquées. Les composés de formule générale III ont été obtenus d'une manière connue - en faisant réagir le o-chloro correspondant non substitué ou substitué. - ou du chlorure ou bromure d'o-bromobenzyle avec du soufre à une température de 50-200C dans un environnement d'éther monoalkylique de glycol en présence d'un alcoxyde de métal alcalin. L'invention décrite est illustrée par les exemples suivants. Exemple 1. Inhibition des plaquettes humaines. agrégation sous l'influence du BDTT et de ses dérivés. L'effet des produits de la présente invention sur l'agrégation plaquettaire humaine a été étudié par la méthode turbidimétrique bien connue de Born. Pour cela, du sang veineux prélevé à 8 heures du matin sur des donneurs sains a été centrifugé à 450 g à température ambiante dans un récipient en plastique pendant 10 minutes, en utilisant du citrate de sodium comme anticoagulant. Le surnageant, c'est-à-dire le plasma riche en plaquettes, a été collecté et centrifugé à 650 g pendant 30 minutes pour obtenir un plasma pauvre en plaquettes. La concentration en plaquettes dans le plasma riche en plaquettes a été ajustée à 2,510 cellules/ml par dilution avec du plasma pauvre en plaquettes, et la suspension résultante a été versée dans une cuvette de 0,5 ml. L'agrégation a été induite en ajoutant de l'ADP à une concentration de 20 µM. La concentration d'ADP a été sélectionnée dans chaque expérience de manière à ce que l'agrégation soit réversible et que le maximum se produise 2 minutes après l'ajout d'ADP, sans dépasser 50 %. La diffusion de la lumière d'une suspension de plaquettes a été mesurée à l'aide d'un agrégomètre développé à la Faculté de biologie de l'Université d'État de Moscou. M.V. Lomonossov. Le composé étudié (sous forme d'une solution aqueuse, si nécessaire, contenant du DMSO jusqu'à 0,2 %) a été ajouté à l'échantillon avant d'ajouter l'inducteur d'agrégation (ADP) aux produits de la présente invention à une concentration de 1 à 100. μM a inhibé l'agrégation plaquettaire provoquée par 20 μM d'ADP, tandis qu'une action efficace a été observée à la concentration<30 мкМ. В частности, значение концентрации, при которой достигалось полумаксимальное ингибирование, (IC 50) для БДТТ составляло 6,4 мкМ. Согласно данным прототипа, для известного аналога (3,4-дигидро-3-винил-1,2-дитиин-2-оксида) в условиях in vitro IC 50 имела значение 100 мкМ.Пример 2. Острая токсичность БДТТ и его производных.Острую токсичность соединений настоящего изобретения определяли известным способом по ЛД 50 с использованием беспородных мышей обоего пола средней массой 21 г при комнатной температуре; стандартное питание и воду давали ad libitum в течение всего эксперимента; подвижность животных не ограничивали. Растворы соединений в ДМСО вводили с помощью стерильного шприца внутрибрюшинно. После инъекции за животными вели наблюдение в течение 48 ч по истечении этого времени за мышами наблюдали дополнительно в течение 72 ч (ни одно из животных не погибло в течение дополнительного промежутка времени). Полученные результаты свидетельствуют о том, что значение ЛД 50 для БДТТ составляет >100 mg/kg, et pour ses dérivés pas inférieur à 50 mg/kg. Les données présentées dans l'exemple 1 montrent que la méthode décrite permet d'inhiber l'agrégation plaquettaire in vitro plus efficacement par rapport à la méthode connue.
Réclamer
Procédé pour inhiber l'agrégation plaquettaire par introduction de composés hétérocycliques soufrés dans un milieu contenant ces cellules, caractérisé en ce qu'on utilise comme composés hétérocycliques soufrés la benzo-1,2-dithiol-3-thione et ses dérivés de formule générale  où R 1 à R 4 représente H ou C 1 à 4 représente un groupe alkyle.
où R 1 à R 4 représente H ou C 1 à 4 représente un groupe alkyle.
Brevets similaires :
L'invention concerne le domaine de la chimie organique et de la pharmacologie, à savoir un mélange d'isomères du sel de potassium de l'acide 2-acétique dans un rapport molaire de 1:3, présentant une activité cardiotonique.
Le système d'hémostase remplit les fonctions principales suivantes dans le corps :
Maintient le sang dans les vaisseaux à l'état liquide, ce qui est nécessaire à l'apport sanguin normal aux organes et aux tissus ;
Permet d'arrêter le saignement en cas de lésion de la paroi vasculaire.
Arrêter le saignement (hémostase - du grec hémo- sang, stase- stop) est réalisé avec la participation de plusieurs mécanismes. Après avoir endommagé la paroi vasculaire, un vasospasme se produit. Cette réponse immédiate à une blessure peut arrêter le saignement uniquement lorsque les blessures aux petits vaisseaux sont mineures. Fondamentalement, l’arrêt du saignement est obtenu grâce à la formation de caillots sanguins, qui empêchent la perte de sang en fermant le site de la blessure. Une telle formation locale de caillots sanguins (bouchons hémostatiques) en cas de lésions vasculaires est une réaction protectrice.
Cependant, dans certaines conditions, des caillots sanguins se forment à l’intérieur des vaisseaux, fermant leur lumière et empêchant la circulation sanguine normale. La formation de thrombus intravasculaire peut survenir lors de modifications pathologiques de l'endothélium vasculaire, notamment de dommages associés à l'athérosclérose, à une augmentation de la pression artérielle ou à d'autres facteurs. La cause des caillots sanguins peut également être des modifications anormales du flux sanguin (par exemple, une diminution de sa vitesse) ou une carence de certaines protéines qui empêchent la formation de caillots sanguins.
La thrombose survient avec la participation de deux processus principaux : l'agrégation plaquettaire et la coagulation sanguine (hémocoagulation).
Agrégation plaquettaire - c'est la combinaison de plaquettes en conglomérats (agrégats) de différentes tailles et densités. Ce processus est initié lorsque la paroi vasculaire est endommagée. Sur le site de la lésion, les plaquettes se lient d'abord au facteur von Willebrand et au collagène de la couche sous-endothéliale (cela se produit adhésion plaquettaire). L'interaction avec le collagène provoque l'activation des plaquettes (Fig. 27-1). Dans ce cas, les plaquettes elles-mêmes deviennent des sources de substances stimulant l'agrégation, comme le thromboxane A2, l'ADP,
la sérotonine. La thrombine, qui se forme localement lors de la coagulation sanguine, induit également l'agrégation plaquettaire. De plus, les catécholamines, le facteur d'activation plaquettaire et certaines autres substances endogènes sont des inducteurs d'agrégation.
L'agrégation plaquettaire est empêchée par la prostacycline et le facteur relaxant endothélial, qui sont produits par les cellules endothéliales vasculaires et libérés dans la circulation sanguine. Lorsque les cellules endothéliales sont endommagées, la synthèse de ces substances diminue et dans ce contexte, l'effet des substances qui stimulent l'agrégation domine. En conséquence, les plaquettes se combinent en agrégats à partir desquels se forme un thrombus plaquettaire.
Le thrombus plaquettaire devient plus fort grâce aux fils de fibrine qui se forment au cours du processus la coagulation du sang. Les principaux acteurs de ce processus sont les protéines du plasma sanguin appelées facteurs de coagulation sanguine.
Les facteurs plasmatiques de la coagulation sont synthétisés dans le foie et circulent dans le sang sous une forme inactive. Lorsque la paroi vasculaire est endommagée, le facteur VII est rapidement activé avec la participation facteur tissulaire- une protéine transmembranaire synthétisée par diverses cellules (y compris les cellules endothéliales activées) et qui n'entre normalement pas en contact avec le sang. L'expression du facteur tissulaire à la surface cellulaire lors d'une lésion endothéliale accélère considérablement l'activation du facteur VII (sa transformation en facteur VIIa) en présence d'ions Ca 2+. Sous l'influence du facteur VIIa (en combinaison avec le facteur tissulaire), l'activation séquentielle d'autres facteurs de coagulation sanguine (IX et X) se produit dans un système autocatalytique complexe appelé cascade de coagulation sanguine. En conséquence, sous l'influence du facteur Xa, il se forme de la thrombine (facteur Ha), qui convertit la protéine soluble fibrinogène (facteur I) circulant dans le sang en fibrine insoluble (Fig. 27-5). La fibrine polymérise et, remplissant l'espace entre les plaquettes, renforce le thrombus plaquettaire. Les fils de fibrine pénètrent dans le caillot sanguin et forment un réseau qui emprisonne les globules rouges circulant dans le sang. Un caillot de sang rouge se forme.
La coagulation sanguine est neutralisée par des substances qui sont des inhibiteurs naturels des facteurs actifs de la coagulation sanguine.
L'activation du facteur X par le facteur VIIa est empêchée inhibiteur de la voie du facteur tissulaire, synthétisé par endothélial
cellules. Un inhibiteur de la thrombine et de certains autres facteurs actifs de la coagulation (Xa, IXa, XIa, XIIa) est antithrombine III- une protéine circulant dans le plasma sanguin qui agit en association avec l'héparine ou des substances analogues à l'héparine (présentes à la surface des cellules endothéliales intactes). Ces substances accélèrent considérablement l'inactivation des facteurs de coagulation sanguine sous l'influence de l'antithrombine III.
Inhibiteur des facteurs VIIIa et Va nécessaires à la formation de thrombine - protéine C activée. Cette protéine est synthétisée dans le foie avec la participation de la vitamine K, circule dans le sang sous une forme inactive et est activée par la thrombine à la surface des cellules endothéliales intactes. L'activation de la protéine C augmente avec la génération excessive de thrombine. Lorsque des caillots sanguins locaux se forment sur le site de lésion de la paroi vasculaire, les inhibiteurs ci-dessus aident à maintenir le sang à l'état liquide, empêchant ainsi la croissance d'un caillot sanguin à l'intérieur du vaisseau.
L'agrégation plaquettaire et la coagulation sanguine sont interdépendantes. La prédominance de l'un ou l'autre processus dans le mécanisme de formation du thrombus dépend du calibre du vaisseau et de la vitesse du flux sanguin. L'agrégation plaquettaire est d'une plus grande importance pour la formation de caillots sanguins à des débits sanguins élevés, c'est-à-dire dans les artères. Dans les vaisseaux veineux, où la vitesse du flux sanguin est faible, le processus de coagulation sanguine prédomine.
Le sort ultérieur du thrombus dépend de l'activité du système fibrinolytique. Si ce système fonctionne normalement, la fibrine se dissout progressivement (fibrinolyse) avec la participation de l'enzyme plasmine, qui se forme à partir d'un précurseur inactif (plasminogène) sous l'influence d'activateurs. L'action de la plasmine est empêchée par les antiplasmines circulant dans le sang. Les activateurs du plasminogène sont neutralisés par des inhibiteurs spécifiques.
Une perturbation des processus d'agrégation plaquettaire et de coagulation sanguine et/ou une activité accrue du système fibrinolytique peuvent entraîner des saignements, et une activation excessive de ces processus ou une inhibition de la fibrinolyse peut conduire à l'apparition de caillots sanguins intravasculaires (thrombose). En raison de la thrombose des vaisseaux artériels, le flux sanguin vers les tissus diminue et une ischémie se développe. La conséquence de l'ischémie est la mort cellulaire (nécrose). La thrombose peut entraîner des complications aussi graves qu'un infarctus du myocarde (thrombose de l'artère coronaire), un accident vasculaire cérébral ischémique (thrombose vasculaire cérébrale), etc. La thrombose veineuse peut provoquer une embolie pulmonaire.
Pour prévenir la thrombose, on utilise des substances qui inhibent l'agrégation plaquettaire et la coagulation sanguine, empêchant ainsi la formation de caillots sanguins. Pour la thrombose, des substances qui provoquent la lyse des caillots sanguins sont également utilisées - des agents thrombolytiques (fibrinolytiques).
Pour arrêter le saignement, des agents augmentant la coagulation sanguine et des agents inhibant la fibrinolyse sont utilisés. Le choix de l'un ou l'autre dépend de la cause du saignement.
Les groupes de médicaments suivants qui affectent la formation de thrombus sont d'une importance pratique.
Agents qui réduisent l'agrégation plaquettaire(agents antiplaquettaires).
Médicaments qui affectent la coagulation du sang.
Médicaments qui réduisent la coagulation sanguine (anticoagulants).
Médicaments qui augmentent la coagulation sanguine (hémostatiques).
Agents affectant la fibrinolyse.
Agents fibrinolytiques (thrombolytiques).
Agents antifibrinolytiques (inhibiteurs de la fibrinolyse).
27.1. MÉDICAMENTS QUI RÉDUISENT L'AGRÉGATION DES PLAQUETTES (ANTI-PLAQUETTES)
Les plaquettes sont de petits éléments sanguins en forme de disque formés sous forme de fragments de mégacaryocytes de moelle osseuse. Les plaquettes circulent dans le sang pendant 6 à 12 jours et sont ensuite absorbées par les macrophages tissulaires.
L'endothélium vasculaire influence l'activité fonctionnelle des plaquettes. Les cellules endothéliales libèrent de la prostacycline (prostaglandine I 2) et du facteur relaxant endothélial, identifié avec l'oxyde nitrique - NO, dans la circulation sanguine. Ces substances empêchent l'agrégation plaquettaire. De plus, les cellules endothéliales sécrètent des substances qui réduisent la coagulation sanguine et favorisent la lyse des caillots. Tout cela garantit les propriétés antithrombogènes de l'endothélium vasculaire intact.
Lorsque l'endothélium vasculaire est endommagé, ce qui peut être causé par divers facteurs (traumatisme mécanique, infections, modifications athéroscléreuses de la paroi vasculaire, augmentation de la pression artérielle, etc.), les propriétés antithrombogènes de l'endothélium sont réduites, ce qui crée des conditions pour la formation d'un caillot de sang. La synthèse de la prostacycline et du facteur relaxant endothélial est perturbée, ce qui facilite le contact
plaquettes dont la surface endothéliale est endommagée. Les plaquettes s'accumulent sur le site de la lésion et interagissent avec le sous-endothélium vasculaire : directement ou via le facteur von Willebrand (sécrété par les plaquettes activées et les cellules endothéliales), elles se lient au collagène et à d'autres protéines du sous-endothélium avec la participation de glycoprotéines spécifiques localisées dans la plaquette. membrane. Le facteur von Willebrand se lie à la glycoprotéine Ib et le collagène à la glycoprotéine Ia de la membrane plaquettaire (voir Fig. 27-1). L'impact du collagène (ainsi que de la thrombine, qui se forme localement en petites quantités dès le stade initial de la formation du thrombus) sur les plaquettes provoque un changement de leur état - activation. Les plaquettes changent de forme (de forme discale, elles s'étalent avec de nombreux processus - pseudopodes) et recouvrent la surface endommagée du vaisseau.
Lorsqu'elles sont activées, les plaquettes libèrent diverses substances biologiquement actives qui, dans les plaquettes non activées, sont situées dans des granules (granules α, granules denses). Les granules denses sont un réservoir de substances qui stimulent l'agrégation plaquettaire : l'ADP et la sérotonine. La libération de ces substances à partir des granules plaquettaires résulte d'une augmentation de la concentration intracellulaire de Ca 2+ due à l'action du collagène, de la thrombine et d'autres inducteurs d'agrégation, y compris l'ADP lui-même, sur les plaquettes. L'ADP libéré dans le sang stimule des récepteurs spécifiques (purinergiques) localisés dans la membrane plaquettaire. Grâce aux récepteurs couplés aux protéines G (récepteurs purinergiques P2Y 12), l'ADP provoque une inhibition de l'adénylate cyclase et une diminution des taux d'AMPc, ce qui entraîne une augmentation des taux de Ca 2 dans le cytoplasme des plaquettes (Fig. 27-2).
De plus, lorsque les plaquettes sont activées, l'activité de la phospholipase membranaire A2 des plaquettes, une enzyme impliquée dans la formation de l'acide arachidonique à partir des phospholipides membranaires, augmente. Dans les plaquettes, les endoperoxydes cycliques (prostaglandines G2/H2) sont d'abord synthétisés à partir de l'acide arachidonique sous l'influence de la cyclooxygénase, puis à partir d'eux, avec la participation de la thromboxanesine-
La thétase produit du thromboxane A 2, un stimulateur actif de l'agrégation plaquettaire et un vasoconstricteur. Une fois libéré dans la circulation sanguine, le thromboxane A 2 stimule les récepteurs du thromboxane sur les membranes plaquettaires. De ce fait, via C associé à ces récepteurs q -les protéines phospholipase C sont activées et la formation de
Riz.27-1. Adhésion et agrégation des plaquettes lors de lésions de la paroi vasculaire : EC - cellule endothéliale ; VW - facteur von Willebrand ; TxA 2 - thromboxane A 2; PGI 2 - prostacycline ; NON - facteur relaxant endothélial ; GP - glycoprotéines; GP llb/llla - glycoprotéines llb/llla (Tiré de : Katzung B.G. Bazic and Clinical Pharmacology - NY, 2001, tel que modifié)
l'inositol-1,4,5-triphosphate, qui favorise la libération de Ca 2+ du dépôt intracellulaire de plaquettes (le rôle du dépôt de calcium dans les plaquettes est assuré par un système de tubules denses). Cela conduit à une augmentation de la concentration cytoplasmique de Ca 2+ (Fig. 27-2). Le thromboxane A 2 provoque une augmentation de la concentration de Ca 2+ dans les cellules musculaires lisses vasculaires, ce qui entraîne une vasoconstriction.

Riz. 27-2. Mécanismes d'action des agents antiplaquettaires (acide acétylsalicylique, ticlopidine et époprosténol) : EC - cellule endothéliale ; PL - phospholipides des membranes cellulaires ; AA - acide archidonique; PLA 2 - phospholipase A 2; COX - cyclooxygénase; TS - thromboxane synthétase ; PS - prostacycline synthétase ; PGG 2 /H 2 - endoperoxydes cycliques ; TxA 2 - thromboxane A 2; PGI 2 - prostacycline ; AC - adénylate cyclase ; PLS - phospholipase C ; IP 3 - inositol-1, 4, 5-triphosphate
Ainsi, l'ADP et le thromboxane A 2 augmentent le niveau de Ca 2+ dans le cytoplasme des plaquettes. Le Ca 2+ cytoplasmique provoque une modification de la conformation des glycoprotéines IIb/IIIa dans la membrane plaquettaire, ce qui leur permet d'acquérir la capacité de se lier au fibrinogène. Une molécule de fibrinogène possède deux sites de liaison pour les glycoprotéines IIb/IIIa et peut ainsi unir deux plaquettes (Fig. 27-3). La jonction de nombreuses plaquettes par des ponts fibrinogènes conduit à la formation d'agrégats plaquettaires.
La prostacycline (prostaglandine I 2) a l'effet inverse sur l'agrégation plaquettaire. Comme le thromboxane, la prostacycline
est formé d'endoperoxydes cycliques, mais sous l'action d'une autre enzyme - la prostacycline synthétase. La prostacycline est synthétisée par les cellules endothéliales et libérée dans la circulation sanguine, où elle stimule les récepteurs de la prostacycline dans la membrane plaquettaire et l'adénylate cyclase qui leur est associée via la protéine G s. En conséquence, le niveau d'AMPc dans les plaquettes augmente et la concentration de Ca 2+ cytoplasmique diminue (voir Fig. 27-2). Cela empêche la conformation des glycoprotéines IIb/IIIa de changer et elles perdent leur capacité à se lier au fibrinogène. Ainsi, la prostacycline empêche l'agrégation plaquettaire. Sous l'influence de la prostacycline, la concentration de Ca 2+ dans les cellules musculaires lisses vasculaires diminue, ce qui conduit à une vasodilatation.

La séquence suivante des principaux événements conduisant à l'agrégation plaquettaire peut être distinguée (voir Diagramme 27-1).
Le principal objectif de l'action des agents antiplaquettaires, actuellement utilisés dans la pratique clinique, est associé à l'élimination de l'action du thromboxane A 2 et de l'ADP, ainsi qu'au blocage des glycoprotéines IIb/IIIa des membranes plaquettaires. Des substances ayant un mécanisme d'action différent sont également utilisées, qui augmentent la concentration d'AMPc dans les plaquettes et, par conséquent, réduisent la concentration de Ca 2+ dans celles-ci.
On distingue les groupes d'agents suivants qui réduisent l'agrégation plaquettaire.
Agents qui inhibent la synthèse du thromboxane A2. - Inhibiteurs de la cyclooxygénase :
l'acide acétylsalicylique.

Schéma 27.1. Mécanisme d'agrégation plaquettaire
Inhibiteurs de la cyclooxygénase et de la thromboxane synthétase : indobufène.
Agents qui stimulent les récepteurs de la prostacycline :
époprosténol**.
Agents qui interfèrent avec l'effet de l'ADP sur les plaquettes :
la ticlopidine; clopidogrel.
Agents qui inhibent la phosphodiestérase plaquettaire :
dipyridamole
Agents qui bloquent les glycoprotéines IIb/IIIa des membranes plaquettaires.
Des anticorps monoclonaux: abciximab.
Bloqueurs synthétiques des glycoprotéines IIb/IIIa : l'eptifibatide; tirofiban.
Agents qui inhibent la synthèse du thromboxane A 2
L'acide acétylsalicylique (aspirine*) est un agent anti-inflammatoire, analgésique et antipyrétique bien connu. Actuellement largement utilisé comme agent antiplaquettaire. L'effet antiplaquettaire de l'acide acétylsalicylique est associé à son effet inhibiteur sur la synthèse du thromboxane A 2 dans les plaquettes.
L'acide acétylsalicylique inhibe de manière irréversible la cyclooxygénase (provoque une acétylation irréversible de l'enzyme) et perturbe ainsi la formation d'endoperoxydes cycliques, précurseurs du thromboxane A2 et des prostaglandines de l'acide arachidonique. Par conséquent, sous l'influence de l'acide acétylsalicylique, non seulement la synthèse du thromboxane A 2 dans les plaquettes diminue, mais également la synthèse de la prostacycline dans les cellules endothéliales vasculaires (voir Fig. 27-2). Cependant, en sélectionnant les doses et le schéma thérapeutique appropriés, il est possible d'obtenir un effet préférentiel de l'acide acétylsalicylique sur la synthèse du thromboxane A 2 . Cela est dû à des différences significatives entre les plaquettes et les cellules endothéliales.
Les plaquettes - cellules anucléées - n'ont pas de système de resynthèse des protéines et ne sont donc pas capables de synthétiser la cyclooxygénase. Ainsi, avec une inhibition irréversible de cette enzyme, la perturbation de la synthèse du thromboxane A2 persiste tout au long de la vie plaquettaire, c'est-à-dire dans les 7 à 10 jours. En raison de la formation de nouvelles plaquettes, l'effet antiplaquettaire de l'acide acétylsalicylique dure moins longtemps et, par conséquent, pour obtenir un effet stable du médicament (c'est-à-dire une diminution stable des taux de thromboxane), il est recommandé de le prescrire. une fois par jour.
La cycloxygénase est resynthétisée dans les cellules endothéliales vasculaires et l'activité de cette enzyme est restaurée quelques heures après la prise d'acide acétylsalicylique. Par conséquent, lors de la prescription du médicament une fois par jour, il n'y a pas de réduction significative de la synthèse des prostacyclines.

De plus, environ 30 % de l'acide acétylsalicylique subit un métabolisme de premier passage dans le foie, de sorte que sa concentration dans la circulation systémique est inférieure à celle dans le sang porte. En conséquence, l'acide acétylsalicylique agit sur les plaquettes circulant dans la circulation sanguine porte à des concentrations plus élevées que sur les cellules endothéliales des vaisseaux systémiques. Par conséquent, pour supprimer la synthèse du thromboxane A2 dans les plaquettes, des doses d'acide acétylsalicylique plus faibles sont nécessaires que pour supprimer la synthèse de la prostacycline dans les cellules endothéliales.
Pour ces raisons, avec une augmentation de la dose et de la fréquence d'administration de l'acide acétylsalicylique, son effet inhibiteur sur la synthèse des prostacyclines devient plus prononcé, ce qui peut entraîner une diminution de l'effet antiplaquettaire. En relation avec ces caractéristiques, il est recommandé de prescrire l'acide acétylsalicylique en tant qu'agent antiplaquettaire à petites doses (en moyenne 100 mg) une fois par jour.
En tant qu'agent antiplaquettaire, l'acide acétylsalicylique est utilisé pour l'angor instable, pour la prévention de l'infarctus du myocarde, des accidents vasculaires cérébraux ischémiques et de la thrombose des vaisseaux périphériques, pour prévenir la formation de caillots sanguins lors du pontage aorto-coronarien et de l'angioplastie coronarienne. L'acide acétylsalicylique est prescrit par voie orale à des doses de 75 à 160 mg (pour certaines indications - dans la plage de doses de 50 à 325 mg) une fois par jour pendant une longue période. Actuellement, les médecins disposent de préparations d'acide acétylsalicylique destinées à la prévention de la thrombose, qui contiennent 50 à 325 mg de substance active, notamment des comprimés entérosolubles - Acecardol*, Aspicor*, Cardiopyrin*, Aspirin Cardio*, Novandol*, Thrombo ACC*, etc. L'effet antiplaquettaire de l'acide acétylsalicylique se produit rapidement (dans les 20 à 30 minutes). Les formes posologiques à enrobage entérosoluble commencent à agir plus lentement, mais avec une utilisation à long terme, leur efficacité n'est pratiquement pas différente de celle des comprimés conventionnels. Pour obtenir un effet plus rapide, les comprimés d'acide acétylsalicylique doivent être mâchés.
Les principaux effets secondaires de l'acide acétylsalicylique sont associés à l'inhibition de la cyclooxygénase. Cela perturbe la formation des prostaglandines E 2 et I 2, qui ont un effet antisécrétoire et gastroprotecteur (diminuent la sécrétion d'acide chlorhydrique par les cellules pariétales de l'estomac, augmentent la sécrétion de mucus et de bicarbonates). En conséquence, même en cas d'utilisation à court terme, l'acide acétylsalicylique peut endommager l'épithélium de l'estomac et du duodénum (effet ulcérogène). L'effet sur la muqueuse gastrique est moins prononcé lors de l'utilisation de formes posologiques à enrobage entérosoluble. Lors de l'utilisation d'acide acétylsalicylique, des saignements gastro-intestinaux et d'autres complications hémorragiques sont possibles. Le risque de telles complications est plus faible lorsque l’acide acétylsalicylique est prescrit à une dose de 100 mg/jour ou moins. L'inhibition sélective de la COX conduit à l'activation de la voie de la lipoxygénase pour la conversion de l'acide arachidonique et la formation de leucotriènes, qui ont des propriétés bronchoconstrictrices. Chez les patients souffrant d'asthme bronchique, l'acide acétylsalicylique peut provoquer l'apparition d'une crise (« asthme à l'aspirine »). Des réactions allergiques sont possibles.
Pour réduire l'effet ulcérogène de l'acide acétylsalicylique, une association médicamenteuse Cardiomagnyl* contenant de l'hydroxyde de magnésium a été proposée. L'hydroxyde de magnésium neutralise l'acide chlorhydrique dans l'estomac (effet antiacide), réduisant ainsi son effet néfaste sur la membrane muqueuse. Le médicament est utilisé pour les mêmes indications que l'acide acétylsalicylique, notamment pour la prévention secondaire des accidents vasculaires cérébraux ischémiques.
L'indobufène (ibustrine*) réduit la synthèse du thromboxane A 2, tout en inhibant simultanément la cyclooxygénase et la thromboxane synthétase. Contrairement à l'acide acétylsalicylique, l'indobufène provoque une inhibition réversible de la cyclooxygénase. Lors de la prise de ce médicament, il y a une augmentation relative de la quantité de prostacycline (le rapport prostacycline/thromboxane A 2 augmente). L'indobufène inhibe l'adhésion et l'agrégation plaquettaires. Les indications d'utilisation et les effets secondaires sont les mêmes que pour l'acide acétylsalicylique.
Agents qui stimulent les récepteurs de la prostacycline
Une autre façon de réduire l’agrégation plaquettaire consiste à stimuler les récepteurs de la prostacycline. A cet effet, ils utilisent
préparation de prostacycline e p o pro s t e n o l * . L'effet de la prostacycline est opposé à l'effet du thromboxane A 2 non seulement sur les plaquettes, mais également sur le tonus vasculaire. Cela provoque une vasodilatation et une diminution de la pression artérielle. Cet effet de la prostacycline est utilisé dans l'hypertension pulmonaire. Étant donné que la prostacycline est rapidement détruite dans le sang (t 1/2 environ 2 minutes) et n'agit donc pas longtemps, le médicament est administré par perfusion. En raison de sa courte action, l’époprosténol* n’a pas été largement utilisé comme agent antiplaquettaire. Un domaine d'utilisation possible de l'effet antiplaquettaire de l'époprosténol est la prévention de l'agrégation plaquettaire lors de la circulation extracorporelle.
Agents qui interfèrent avec l'action de l'ADP sur les plaquettes
La ticlopidine (ticlid*), un dérivé de la thiénopyridine, inhibe l'agrégation plaquettaire provoquée par l'ADP. La ticlopidine est un promédicament ; son effet antiplaquettaire est associé à la formation d'un métabolite actif avec la participation d'enzymes hépatiques microsomales. Le métabolite ticlopidine contient des groupes thiol, par lesquels il se lie de manière irréversible aux récepteurs purinergiques P2Y 12 de la membrane plaquettaire. Cela conduit à l'élimination de l'effet stimulant de l'ADP sur les plaquettes et à une diminution de la concentration de Ca 2+ cytoplasmique dans celles-ci. En conséquence, l'expression des glycoprotéines IIb/IIIa dans la membrane plaquettaire et leur liaison au fibrinogène diminuent (voir Fig. 27-2). En raison du caractère irréversible de son action, la ticlopidine a un effet antiplaquettaire de longue durée.
L'effet maximal avec une utilisation constante de ticlopidine est obtenu après 7 à 11 jours (le temps nécessaire à la formation et au développement de l'action du métabolite actif) et après l'arrêt du médicament, il persiste pendant toute la durée de vie des plaquettes (7 à 10 jours).
La ticlopidine est prescrite pour la prévention secondaire des accidents vasculaires cérébraux ischémiques, pour prévenir la thrombose dans les maladies oblitérantes des membres inférieurs, lors du pontage aorto-coronarien et de la pose de stents des artères coronaires. Le médicament est efficace lorsqu'il est pris par voie orale, prescrit 2 fois par jour avec les repas.
L'utilisation de la ticlopidine est limitée en raison de ses effets secondaires. Perte d'appétit possible, nausées, vomissements, diarrhée (20 %), douleurs abdominales, éruptions cutanées (11-14 %). Noté
augmentation du taux plasmatique de lipoprotéines athérogènes. Le saignement est une complication courante lors de l’utilisation d’agents antiplaquettaires. Une complication dangereuse est la neutropénie, qui survient au cours des trois premiers mois de traitement chez 1 à 2,4 % des patients. Une thrombocytopénie, une agranulocytose et très rarement une anémie aplasique sont possibles. A cet égard, pendant les premiers mois de traitement, une surveillance systématique du bilan sanguin est nécessaire.
Le clopidogrel (Plavix*, Zilt*) est similaire à la ticlopidine en termes de structure chimique, d'effets principaux et de mécanisme d'action. Comme la ticlopidine, c'est un promédicament qui subit une conversion dans le foie pour former un métabolite actif. Une inhibition significative de l'agrégation plaquettaire a été constatée dès le deuxième jour de traitement, l'effet maximum étant atteint après 4 à 7 jours. Après l'arrêt du médicament, son effet dure 7 à 10 jours. Le clopidogrel est supérieur à la ticlopidine en termes d'activité : à une dose quotidienne de 75 mg, il provoque la même diminution de l'agrégation plaquettaire et un allongement du temps de saignement que la ticlopidine à une dose quotidienne de 500 mg.

Le clopidogrel est utilisé pour les mêmes indications que l'acide acétylsalicylique, en cas d'intolérance. Prendre par voie orale 1 fois par jour, quels que soient les repas. Le clopidogrel peut être associé à l'acide acétylsalicylique, car les médicaments inhibent différents mécanismes d'agrégation plaquettaire et renforcent donc l'effet de chacun (cependant, avec cette association, le risque de complications hémorragiques est plus élevé).
Par rapport à la ticlopidine, les effets secondaires du clopidogrel sont moins prononcés (diarrhée - 4,5 %, éruption cutanée - 6 %). L'utilisation du clopidogrel est associée à un risque plus faible de complication aussi grave que la neutropénie (0,1 %) et la thrombocytopénie survient moins fréquemment. Comme complication rare, comme avec la ticlopidine, un purpura thrombocytopénique thrombotique peut se développer.
Inhibiteurs de la phosphodiestérase plaquettaire
Le dipyridamole (curantyl*, persantine*) a été proposé pour la première fois comme dilatateur coronarien. Plus tard, sa capacité à inhiber l’agrégation plaquettaire a été révélée. Actuellement, le dipyridamole est principalement utilisé comme agent antiplaquettaire pour la prévention de la thrombose. L'effet antiplaquettaire du dipyridamole est associé à une augmentation du taux d'AMPc dans les plaquettes, ce qui entraîne une diminution de la concentration de Ca 2+ cytoplasmique dans celles-ci. Cela se produit pour plusieurs raisons. Premièrement, le dipyridamole inhibe la phosphodiestérase, qui inactive l'AMPc. De plus, le dipyridamole inhibe l'absorption de l'adénosine par les cellules endothéliales et les érythrocytes ainsi que son métabolisme (inhibe l'adénosine désaminase), augmentant ainsi le taux d'adénosine dans le sang (Fig. 27-4). L'adénosine stimule les récepteurs plaquettaires A 2 et augmente l'activité de l'adénylate cyclase associée à ces récepteurs, en conséquence, la formation d'AMPc dans les plaquettes augmente et le niveau de Ca 2+ cytoplasmique diminue. Le dipyridamole augmente également les niveaux d'AMPc dans les cellules musculaires lisses vasculaires, provoquant une vasorelaxation.

Le dipyridamole est utilisé pour prévenir les accidents vasculaires cérébraux ischémiques, ainsi que pour les maladies des artères périphériques (principalement en association avec l'acide acétylsalicylique, car le dipyridamole lui-même a un faible effet antiplaquettaire). Prescrit par voie orale 3 à 4 fois par jour 1 heure avant les repas. En association avec des anticoagulants oraux, le dipyridamole est prescrit pour prévenir la formation de caillots sanguins en cas de cardiopathie mitrale.
Lors de l'utilisation du dipyridamole, des maux de tête, des étourdissements, une hypotension artérielle, des symptômes dyspeptiques,
éruptions cutanées. Le risque de saignement est moindre qu'avec l'utilisation d'acide acétylsalicylique. Le dipyridamole est contre-indiqué en cas d’angine de poitrine (possible « syndrome du vol »).

Riz. 27-4. Mécanisme d'action antiplaquettaire du dipyridamole : CE - cellule endothéliale ; A 2 -P - récepteur de l'adénosine A 2 ; PDE - AMPc phosphodiestérase ; AC - adénylate cyclase ; GP IIb/IIIa - glycoprotéines IIb/IIIa
La pentoxifylline (agapurine*, trental*), comme le dipyridamole, inhibe la phosphodiestérase et augmente les taux d'AMPc. En conséquence, le niveau de Ca 2 + cytoplasmique dans les plaquettes diminue, ce qui entraîne une diminution de leur agrégation. La pentoxifylline possède également d'autres propriétés : elle augmente la déformabilité des globules rouges, réduit la viscosité du sang et a un effet vasodilatateur, améliorant la microcirculation.
La pentoxifylline est utilisée dans les accidents vasculaires cérébraux, les troubles circulatoires périphériques d'origines diverses et les pathologies vasculaires des yeux (voir chapitre « Médicaments utilisés dans les accidents vasculaires cérébraux »). Effets secondaires possibles : symptômes dyspeptiques, vertiges, rougeur du visage, ainsi qu'une diminution de la tension artérielle, tachycardie, réactions allergiques, saignements. Comme le dipyridamole, il peut provoquer des crises lors d'angine de poitrine.
Agents bloquant les glycoprotéines IIb/IIIa des membranes plaquettaires
Ce groupe d'agents antiplaquettaires, qui interagissent directement avec les glycoprotéines IIb/IIIa des membranes plaquettaires et perturbent leur liaison au fibrinogène, est apparu relativement récemment.
Abciximab (reopro*) - le premier médicament de ce groupe est un anticorps monoclonal « chimérique » de souris/humain (fragment Fab d'anticorps de souris contre les glycoprotéines IIb/IIIa combiné avec le fragment Fc d'Ig humaine). L'abciximab inhibe de manière non compétitive la liaison du fibrinogène aux glycoprotéines IIb/IIIa de la membrane plaquettaire, perturbant ainsi leur agrégation (voir Fig. 27-3). L'agrégation plaquettaire se normalise 48 heures après une seule injection. Le médicament est administré par voie intraveineuse (sous forme de perfusion) pour prévenir la thrombose lors de l'angioplastie des artères coronaires. Lors de l'utilisation de l'abciximab, des saignements sont possibles, notamment internes (gastro-intestinaux, intracrâniens, saignements des voies génito-urinaires), des nausées, des vomissements, une hypotension, une bradycardie, des réactions allergiques pouvant aller jusqu'au choc anaphylactique, une thrombocytopénie.
La recherche de médicaments moins allergènes ayant le même mécanisme d’action a conduit à la création de bloqueurs synthétiques des glycoprotéines IIb/IIIa. À base de barborine (un peptide isolé du venin du serpent à sonnettes pygmée), le médicament e p t i f i b a t i d (intégriline *) a été obtenu - un hectapeptide cyclique qui imite la séquence d'acides aminés de la chaîne du fibrinogène, qui se lie directement aux glycoprotéines IIb/IIIa. L'eptifibatide déplace de manière compétitive le fibrinogène de sa liaison aux récepteurs, provoquant un trouble réversible de l'agrégation plaquettaire. Le médicament est administré par voie intraveineuse sous forme de perfusion ; l'effet antiplaquettaire apparaît dans les 5 minutes et disparaît 6 à 12 heures après l'arrêt de l'administration. Le médicament est recommandé pour la prévention de la formation de thrombus lors d'une angioplastie coronarienne percutanée, pour l'angor instable et pour la prévention de l'infarctus du myocarde. Une complication dangereuse lors de l’utilisation de l’eptifibatide est le saignement ; une thrombocytopénie est possible.
Le tirofiban (agrastat*) est un bloqueur non peptidique des glycoprotéines IIb/IIIa, un analogue de la tyrosine. Comme l'eptifibatide, le tirofiban bloque de manière compétitive les récepteurs des glycoprotéines IIb/IIIa. Le médicament est administré par voie intraveineuse (perfusion). La rapidité d'action, la durée d'action et les indications d'utilisation sont les mêmes que pour l'eptifibatide. Effets secondaires - saignements, thrombocytopénie.
Pour élargir les possibilités d'utilisation des médicaments de ce groupe, des bloqueurs des glycoprotéines IIb/IIIa ont été créés, efficaces lorsqu'ils sont administrés par voie orale - xemilofiban*, sibrafiban*, etc. Cependant, les tests de ces médicaments ont révélé leur efficacité insuffisante et un effet secondaire dans le forme de thrombocytopénie sévère.
27.2. MÉDICAMENTS AFFECTANT LA COAGULATION DU SANG
Les dommages à la paroi vasculaire déclenchent non seulement l'agrégation des plaquettes, mais également la coagulation du sang. De nombreux facteurs connus (plasma, tissus, plaquettes) sont impliqués dans ce processus. La plupart d’entre elles sont des protéines plasmatiques qui circulent à l’état inactif, mais qui sont ensuite activées au cours du processus de coagulation sanguine. Pour expliquer l'effet des médicaments, il faut mentionner le facteur VII (proconvertine), le facteur IX (Noël), le facteur X (Stuart-Prower), le facteur II (prothrombine). Ces facteurs de coagulation sont des proenzymes et, lorsqu'ils sont activés, se transforment en enzymes protéolytiques (facteurs GCa, Xa et Na). Les facteurs VIII et V, après activation, agissent comme protéines cofacteurs pour les enzymes (facteurs IXa et Xa, respectivement), augmentant leur activité protéolytique.
Le facteur VII a initialement une faible activité protéolytique, mais en raison de son interaction avec le facteur tissulaire (voir p. 481), elle augmente rapidement. Le facteur VII activé (facteur VIIa), avec le facteur tissulaire et Ca 2+, forme un complexe qui provoque une protéolyse partielle des facteurs IX et X. Le facteur IXa, à son tour, active en outre le facteur X (le facteur Xa est formé). Le facteur Xa agit sur la prothrombine (facteur II) et la convertit en thrombine (facteur Ha). La thrombine provoque une protéolyse partielle du fibrinogène pour former de la fibrine (Fig. 27-5).
L'activation protéolytique des facteurs de coagulation sanguine est considérablement accélérée s'ils se lient via les ions Ca 2+ aux phospholipides chargés négativement des membranes cellulaires. Ces phospholipides agissent comme une sorte de matrice sur laquelle les facteurs de coagulation sont assemblés en complexes avec la participation d'ions Ca 2 +. Dans le même temps, le taux d'activation des facteurs dans ces complexes augmente de 10 000 fois ou plus. Une condition nécessaire à la formation de tels complexes est la capacité des facteurs II, VII, IX et X à se lier au Ca 2 +. Ces facteurs contiennent des charges négatives
résidus d'acides γ-carboxyglutamique, qui assurent leur liaison au Ca 2+. La formation d'acides γ-carboxyglutamique se produit dans le foie avec la participation de la vitamine K. En cas de carence en vitamine K, des facteurs de coagulation sanguine défectueux II, VII, IX et X apparaissent dans le sang, ce qui perturbe la formation de fibrine.

Riz. 27-5. Schéma d'activation de la coagulation sanguine en cas de lésion de la paroi vasculaire (Tiré de : Katzung B. G. Pharmacologie fondamentale et clinique. - NY, 2001, tel que modifié) : les complexes de facteurs de coagulation sanguine associés aux phospholipides chargés négativement des membranes cellulaires sont soulignés par un ligne grasse. Le complexe VIIa + TF + Ca 2+ active les facteurs X et IX (TF - facteur tissulaire). Le complexe IXa + VIIIa + Ca 2+ active en outre le facteur X. Le complexe Xa + Va + Ca 2+ (prothrombinase) favorise la conversion de la prothrombine en thrombine. Les facteurs encadrés sont inhibés par l'héparine
Les protéines du plasma sanguin, qui contiennent des résidus d'acide γ-carboxyglutamique et se forment dans le foie avec la participation de la vitamine K, comprennent également les protéines C et S. Après activation, la protéine C (Ca) provoque le clivage protéolytique des facteurs VIIIa et Va. Cela conduit à une perturbation de la formation de thrombine. La protéine S agit comme cofacteur dans les réactions de protéolyse. L'activation de la protéine C se produit sous l'influence de la thrombine à la surface de cellules endothéliales intactes (non endommagées) qui expriment la protéine thrombomoduline, qui se lie simultanément à la protéine C et à la thrombine.
27.2.1. Anticoagulants (anticoagulants)
Les anticoagulants utilisés en pratique clinique inhibent les facteurs actifs de la coagulation directement dans le sang ou interfèrent avec leur formation dans le foie. Ils sont donc divisés en 2 groupes :
(agir directement dans le sang).
- Étalon d'héparine(non fractionné).
- Héparines de bas poids moléculaire :
énoxaparine sodique;
Nadroparine calcique ;
Daltéparine sodique ;
Reviparine sodique.
- Héparinoïdes :
Sulodexide;
Danaparoid**.
- Médicament antithrombine III.
- Préparations d'hirudine :
Lépirudine*.
- Protéine C activée :
Drotrécogine alfa.
(inhiber la synthèse des facteurs de coagulation dans le foie).
- Dérivés de la coumarine :
Acénocoumarol (syncumar*) ;
Warfarine (warfarex*).
- Dérivés de l'indanedione :
Phénindione (phényline*).
Anticoagulants directs
Héparine- glycosaminoglycane sulfaté (mucopolysaccharide), constitué de résidus D-glucosamine et acide D-glucuronique. L'héparine est produite par les mastocytes dans de nombreux tissus ; il est contenu en grande quantité dans le foie, les poumons et la muqueuse intestinale. À des fins médicales, l'héparine est isolée de la muqueuse intestinale des porcs et des poumons des bovins. En cours
l'isolement produit un mélange de fractions avec différentes longueurs de chaîne polysaccharidique et différents poids moléculaires (de 3 000 à 40 000 D). Les fractions de poids moléculaires différents diffèrent légèrement en termes d'activité biologique et de propriétés pharmacocinétiques. Par conséquent, les préparations d'héparine obtenues par différentes méthodes et à partir de différentes sources peuvent avoir une activité anticoagulante différente, ce qui nécessite leur standardisation biologique. L'activité de l'héparine est déterminée par sa capacité à prolonger le temps de coagulation sanguine (1 mg d'héparine standard contient 130 unités).
L'héparine n'a un effet sur les facteurs de coagulation sanguine qu'après la formation d'un complexe avec l'anticoagulant endogène antithrombine III. L'antithrombine III, une glycoprotéine du plasma sanguin, inhibe les sérine protéases, qui comprennent les facteurs de coagulation sanguine IIa (thrombine), EXa et Xa (ainsi que XIa et XIIa). Le processus d'inactivation du facteur sous l'influence de l'antithrombine III seule se déroule très lentement. L'héparine provoque des changements conformationnels dans la molécule d'antithrombine III, ce qui conduit à une accélération de ce processus d'environ 1 000 fois.

L'action principale du complexe héparine-antithrombine III est dirigée contre la thrombine et le facteur Xa, mais les mécanismes d'inhibition de ces facteurs présentent quelques différences. Pour inactiver la thrombine, l'héparine doit se lier à la fois à la molécule d'antithrombine III et à la molécule de thrombine. Parallèlement, l'inactivation rapide du facteur Xa par le complexe héparine-antithrombine III ne nécessite pas la liaison de ce facteur à l'héparine. Les fractions d'héparine avec une chaîne polymère relativement courte (moins de 18 unités saccharidiques) ne peuvent pas lier simultanément l'antithrombine III et la thrombine et n'ont donc pas d'activité antithrombine. Leur action est principalement associée à l'inactivation du facteur Xa et donc à la perturbation de la conversion de la prothrombine en thrombine.
En plus de son effet sur la coagulation sanguine, l'héparine a également d'autres effets : elle réduit le taux de lipides dans le sang grâce à l'activation de la lipoprotéine lipase (cette enzyme hydrolyse les triglycérides) et supprime la prolifération des cellules musculaires lisses.
L'héparine est mal absorbée lorsqu'elle est administrée par voie orale, elle est donc administrée par voie intraveineuse, parfois sous-cutanée. Lorsqu'elle est administrée par voie intraveineuse, l'effet se produit immédiatement et dure 2 à 6 heures. Lorsqu'elle est administrée par voie sous-cutanée, l'héparine commence à agir après 1 à 2 heures, la durée d'action est de 8 à 12 heures (prescrite 2 à 3 fois par jour). L'héparine présente dans le sang se lie à de nombreuses protéines, y compris celles qui la neutralisent (facteur plaquettaire 4 et quelques autres). Des niveaux élevés de ces protéines dans le sang peuvent provoquer une relative résistance au médicament. De plus, l'héparine se lie aux macrophages et aux cellules endothéliales et sa dégradation (dépolymérisation) se produit. L'héparine est également métabolisée dans le foie et excrétée par les reins.
L'héparine est utilisée pour la prévention et le traitement de la thrombose veineuse profonde et de l'embolie pulmonaire, de l'angine instable et de l'infarctus du myocarde, pour la prévention de la thrombose des artères périphériques, pour le remplacement des valvules cardiaques et la circulation extracorporelle. L'héparine est dosée en unités d'action (UA).
Les complications les plus courantes du traitement par héparine sont les saignements, qui peuvent être provoqués par une inhibition de la fonction plaquettaire ou une diminution de leur nombre (thrombocytopénie). La liaison de l'héparine au facteur von Willebrand semble expliquer son effet inhibiteur sur l'adhésion et l'agrégation plaquettaires. Dans de tels cas, l'héparine est arrêtée et, en cas de saignement grave, du sulfate de protamine est également administré par voie intraveineuse, qui neutralise l'héparine en formant un complexe insoluble.
La thrombocytopénie survient aux jours 7 à 14 du traitement chez environ 1 à 5 % des patients recevant de l'héparine. Elle est provoquée par l'apparition d'anticorps (IgG) dirigés contre le complexe héparine-facteur 4 plaquettaire. Ce complexe se lie à la membrane plaquettaire lors de la neutralisation de l'héparine par le facteur 4, une glycoprotéine dérivée des plaquettes qui est libérée lors de l'agrégation plaquettaire. Moins de 1 % des patients atteints de thrombocytopénie présentent une thrombose due à des lésions endothéliales
cellules et activation des plaquettes par les anticorps du complexe héparine-facteur 4. Cette affection nécessite l'arrêt de l'héparine et la nomination d'anticoagulants n'entraînant pas de thrombocytopénie : danaparoïde** et lépirudine**.
Avec une administration à long terme d'héparine (plus de 3 mois), l'ostéoporose peut se développer. Ceci est particulièrement important à prendre en compte lors de la prescription d'héparine pendant la grossesse. L'hyperkaliémie associée à l'inhibition de la synthèse de l'aldostérone dans les glandes surrénales est une complication assez rare du traitement par l'héparine.
Héparines de bas poids moléculaire (fractionnées) sont constitués de fragments d'héparine d'un poids moléculaire de 1 000 à 10 000 D (en moyenne 4 000 à 5 000 D). Ils sont obtenus par fractionnement, hydrolyse ou dépolymérisation de l'héparine conventionnelle (non fractionnée). Ces médicaments, comme l'héparine, agissent sur les facteurs de coagulation via l'antithrombine III, mais diffèrent de l'héparine par les propriétés suivantes :
Ils inhibent davantage l'activité du facteur Xa que le facteur IIa (3 à 4 fois) ;
Ils ont une plus grande biodisponibilité lorsqu'ils sont administrés par voie sous-cutanée (héparines de bas poids moléculaire - environ 90 %, héparine standard - 20 %) ;
Ils agissent pendant une période plus longue, ce qui leur permet d'être administrés 1 à 2 fois par jour ;
Ils ont moins d'affinité pour le facteur plaquettaire 4 et sont donc moins susceptibles de provoquer une thrombocytopénie que l'héparine standard ;
Cause moins fréquemment l’ostéoporose.
Dans la pratique domestique, les préparations suivantes d'héparines de bas poids moléculaire sont utilisées : enoxa parine sodique (Clexane*), nadroparine calcique (Fraxiparine*), d alte parine sodique (Fragmin*), reviparine sodique (klivarin*). Ces médicaments sont de composition hétérogène (contiennent différentes fractions d'héparine), ils diffèrent donc quelque peu les uns des autres par leurs propriétés et leur activité physicochimiques, pharmacocinétiques.
Les héparines de bas poids moléculaire sont utilisées pour la prévention et le traitement de la thrombose veineuse profonde (en particulier après une intervention chirurgicale), pour prévenir l'embolie pulmonaire, ainsi que pour l'angor instable et l'infarctus du myocarde. Les préparations d'héparine de bas poids moléculaire sont indiquées pour la prophylaxie
tics et thérapie de la thrombose en pratique obstétricale. Administré uniquement par voie sous-cutanée. La posologie est indiquée en ME (unités internationales).
Les héparines de bas poids moléculaire, comme les préparations d'héparine non fractionnées, peuvent provoquer des saignements. Dans les premiers jours de traitement, une thrombocytopénie modérée est possible. Les héparines de bas poids moléculaire augmentent dans certains cas l'activité des enzymes hépatiques et peuvent provoquer des réactions allergiques. Le sulfate de protamine n'élimine pas complètement les effets des héparines de bas poids moléculaire.
Récemment, le médicament fo n d a p a - sodium rinux - un pentasaccharide synthétique qui, en se liant à l'antithrombine III, accélère l'inactivation du facteur Xa, est apparu dans la pratique clinique. Le médicament est produit sous forme de sel de sodium et est utilisé pour la prévention de la thrombose veineuse et de l'embolie pulmonaire en chirurgie orthopédique.
Héparinoïdes- les glycosaminoglycanes sulfatés, structurellement apparentés aux héparines. Comme l'héparine, ils renforcent l'effet inhibiteur de l'antithrombine III sur les facteurs de coagulation sanguine. Par de nombreuses caractéristiques importantes, elles diffèrent de l'héparine et des héparines de bas poids moléculaire, elles sont donc classées dans un groupe spécial. Le danaparoïde* et le sulodexide appartiennent à ce groupe. Ces médicaments sont obtenus à partir de la muqueuse intestinale du porc.
Le Danaparoid** (organon**) contient un mélange d'héparane sulfate, de dermatan sulfate et de chondroïtine sulfate. Le danaparoïde p inhibe le facteur Xa de manière plus significative que la prothrombine. Le médicament est administré par voie sous-cutanée pour la prévention et le traitement de la thrombose veineuse. Le danaparoïde p ne se lie pas au facteur plaquettaire 4 et ne provoque pas de thrombocytopénie. Par conséquent, il est indiqué dans les cas où le traitement par héparine est compliqué par une thrombocytopénie.
Le sulodexide (Wessel Due F*) est constitué d'un mélange d'héparane sulfate et de dermatan sulfate. Le sulodexide réduit largement l'activité du facteur Xa, avec peu d'effet sur la prothrombine. Le médicament augmente l'activité fibrinolytique, a un effet protecteur sur l'endothélium vasculaire et possède des propriétés hypolipémiantes. Le sulodexide est indiqué dans les maladies vasculaires périphériques présentant un risque accru de thrombose. Il existe des formes posologiques du médicament pour l'administration parentérale (intraveineuse et intramusculaire) et pour l'administration orale.
Antithrombine IIInécessaire à l'effet anticoagulant de l'héparine, des héparines de bas poids moléculaire et des héparinoïdes.
En cas de déficit héréditaire en antithrombine III, son médicament est utilisé et administré par voie intraveineuse. Avec l'utilisation à long terme de l'héparine, la consommation d'antithrombine III augmente, de sorte que sa concentration dans le sang diminue considérablement. Cela réduit l'efficacité du traitement par l'héparine. Dans de tels cas, l'antithrombine III est également administrée.
Hirudine- une protéine d'un poids moléculaire de 7 kDa, découverte pour la première fois dans les glandes salivaires des sangsues médicinales Hirudo médicinalis. L'hirudine, comme l'héparine, est un anticoagulant qui agit directement dans le sang, mais contrairement à l'héparine, l'hirudine inhibe directement la thrombine : elle s'y lie sélectivement et l'inactive sans la participation de l'antithrombine III. L'inhibition est irréversible. Contrairement à l'héparine, l'hirudine a la capacité d'inhiber la thrombine associée au caillot sanguin et ainsi de retarder la croissance du caillot sanguin. L'hirudine n'interagit pas avec le facteur plaquettaire 4 et ne provoque donc pas de thrombocytopénie.
Une préparation recombinante d'hirudine - le pirudi n* (refludan*) a été obtenue pour un usage clinique. Il est recommandé de l'utiliser pour prévenir d'éventuelles complications thromboemboliques en cas de thrombopénie provoquée par l'héparine. La lépirudine* est administrée par voie intraveineuse. Des saignements peuvent survenir pendant l'utilisation. Il n'existe pas d'antidote spécifique pour les préparations d'hirudine.
La drotrécogine alfa (Zigris*) est une préparation recombinante de protéine C activée. Elle inhibe la formation de thrombine, provoquant une inactivation protéolytique des facteurs VIIIa et Va de la coagulation sanguine. De plus, la drotrécogine augmente l'activité fibrinolytique du plasma sanguin, réduisant ainsi la quantité d'inhibiteur de l'activateur du plasminogène de type 1 circulant dans le sang. La présence d'une activité anti-inflammatoire dans le médicament est associée à son effet inhibiteur sur la libération du facteur de nécrose tumorale alpha. à partir de monocytes. Toutes ces propriétés de la drotrécogine déterminent son efficacité dans le traitement du choc septique (l'inflammation et l'augmentation de la coagulation sanguine sont les principaux symptômes de cette affection). Comme les autres anticoagulants, le médicament peut entraîner des complications hémorragiques.
Anticoagulants indirects
Ces médicaments, contrairement à l’héparine, n’affectent pas directement les facteurs de coagulation présents dans le sang. Ils inhibent la synchronisation
synthèse dans le foie de protéines plasmatiques sanguines dépendantes de la vitamine K - facteur II (prothrombine), facteurs VII, IX et X (voir Fig. 27-5). La vitamine K est nécessaire à la formation de facteurs fonctionnellement précieux, car elle agit comme un coenzyme dans la réaction de γ-carboxylation des résidus d'acide glutamique. La forme réduite de vitamine K, l'hydroquinone, présente une activité coenzymatique. Au cours de la carboxylation, la vitamine K-hydroquinone est oxydée pour former de la vitamine K-époxyde inactive. Les anticoagulants indirects empêchent la conversion (réduction) de la vitamine K-époxyde inactive en vitamine K-hydroquinone active par l'époxyde réductase et la DT-diaphorase, inhibant ainsi ces enzymes. Ils sont donc classés parmi les antagonistes de la vitamine K (Fig. 27-6).

Riz. 27-6.Le mécanisme d'action de la vitamine K et des anticoagulants indirects
Les anticoagulants indirects ne réduisent pas immédiatement la concentration de facteurs de coagulation dans le sang. Leur action est caractérisée par une période de latence. Ainsi, l'effet anticoagulant de l'acénocoumarol atteint sa valeur maximale après 48 heures ou plus. Ce lent développement de l'effet s'explique par le fait que lors de l'administration de ces médicaments, des facteurs de coagulation à part entière circulent encore pendant un certain temps dans le sang (la vitesse d'apparition de l'effet est déterminée par le temps pendant lequel les facteurs de coagulation de le complexe prothrombique est dégradé). L'effet des anticoagulants indirects dure environ 2 à 4 jours, les médicaments sont capables de s'accumuler.

Les anticoagulants indirects sont utilisés pour la prévention et le traitement à long terme de la thrombose et de la thromboembolie (thrombose veineuse profonde, embolie pulmonaire, complications thromboemboliques de la fibrillation auriculaire, infarctus du myocarde, remplacement de valvules cardiaques), dans la pratique chirurgicale pour prévenir la formation de thrombus en période postopératoire. Entré à l'intérieur. Le traitement est effectué sous surveillance obligatoire du taux de prothrombine dans le plasma sanguin en déterminant le temps de prothrombine - un indicateur dont la valeur dépend de la teneur en prothrombine dans le sang et des facteurs IX et X.
Les complications les plus courantes lors de l’utilisation d’anticoagulants indirects sont les saignements. Le risque de saignement augmente avec l'utilisation simultanée d'aspirine* et d'autres agents antiplaquettaires. Pour arrêter les saignements causés par les anticoagulants indirects, des préparations de vitamine K1 et un concentré de complexe prothrombique (contient les facteurs II, VII, IX et X) doivent être administrés. D'autres effets secondaires sont possibles : réactions allergiques, diarrhée, dysfonctionnement hépatique, nécrose cutanée. Les médicaments anticoagulants indirects sont contre-indiqués pendant la grossesse : ils pénètrent dans le placenta et peuvent avoir un effet tératogène (perturber la formation du squelette, car
inhibent la formation d'ostéocalcine, une protéine osseuse dépendante de la vitamine K). La phénindione (phéniline*) peut provoquer une inhibition de l'hématopoïèse.
27.2.2. Agents de coagulation sanguine
Les médicaments qui augmentent la coagulation sanguine sont utilisés pour arrêter les saignements. Ils sont donc classés comme agents hémostatiques (hémostatiques) ou agents antihémorragiques. Ce groupe comprend les substances nécessaires à la formation des facteurs de coagulation sanguine (préparations de vitamine K) et les préparations des facteurs de coagulation eux-mêmes.
Préparations de vitamine K
La vitamine K existe sous deux formes - la vitamine K 1 (phylloquinone), présente dans les plantes, et la vitamine K 2 - un groupe de composés (ménaquinones) synthétisés par des micro-organismes (en particulier la microflore intestinale humaine). Les vitamines K 1 et K 2 sont des composés liposolubles, dérivés de la 2-méthyl-1,4-naphtoquinone, différant par la longueur et la nature de la chaîne carbonée latérale. La vitamine K j est obtenue par synthèse, sa préparation est connue sous le nom de phytoménadione. Un précurseur hydrosoluble de la vitamine K, la 2-méthyl-1,4-naphtoquinone (ménadione), a été synthétisé et possède une activité provitaminique. Ce composé a été nommé vitamine K 3 . Un dérivé de la vitamine K 3 - le bisulfite de sodium ménadione - est utilisé dans la pratique médicale sous le nom de b et k a - sol*.
La vitamine K est nécessaire à la synthèse dans le foie de la prothrombine (facteur II) et des facteurs de coagulation sanguine VII, IX et X, ainsi que des protéines C et S. La vitamine K est connue pour participer à la synthèse de la protéine du tissu osseux, l'ostéocalcine.
La structure de toutes les protéines dépendantes de la vitamine K a une caractéristique commune : ces protéines contiennent des résidus d'acide γ-carboxyglutamique qui se lient aux ions Ca 2+. La vitamine K-hydroquinone fonctionne comme un coenzyme dans la réaction de γ-carboxylation des résidus d'acide glutamique (voir Fig. 27-6). En cas de carence en vitamine K, des précurseurs inactifs de facteurs de coagulation sanguine apparaissent, incapables de lier le Ca 2+. Une carence en vitamine K dans le corps entraîne le plus rapidement une altération de l'hémocoagulation. Par conséquent, le principal
et les premières manifestations d’une carence en vitamine K sont des saignements et des hémorragies.
Les préparations de vitamine K sont utilisées pour prévenir et arrêter les saignements et autres complications hémorragiques causées par une carence en vitamine K dans le corps, par exemple le syndrome hémorragique des nouveau-nés. La carence en vitamine K chez les nouveau-nés peut être causée à la fois par un apport insuffisant en vitamine K 1 et par l'absence de microflore intestinale qui synthétise la vitamine K 2 . Pour prévenir de telles complications, il est recommandé d'administrer prophylactiquement de la vitamine K 1 aux nouveau-nés dans les premières heures de leur vie.
Les préparations de vitamine K sont indiquées en cas de diminution de l'absorption de la vitamine K dans l'intestin en raison d'une altération de la sécrétion biliaire en cas d'ictère obstructif (la bile est nécessaire à l'absorption de la vitamine K liposoluble) ou de syndrome de malabsorption (en cas de sprue, d'entérocolite, de maladie de Crohn, etc. .)
Les préparations de vitamine K 1 sont efficaces contre les saignements causés par les anticoagulants indirects. Ils sont administrés lentement par voie orale et intraveineuse.
Les préparations de vitamine K peuvent provoquer des réactions allergiques (éruption cutanée, démangeaisons, érythème, bronchospasme). Lorsqu'il est administré par voie intraveineuse, il existe un risque de réactions anaphylactoïdes. Lors de l'utilisation de préparations de vitamine K 3 (Vikasol*) chez les nouveau-nés, il existe un risque de développer une anémie hémolytique et une hyperbilirubinémie.
Préparations de facteurs de coagulation
Le besoin de tels médicaments se fait sentir lorsqu'un ou plusieurs facteurs de coagulation sanguine sont déficients.
Le facteur VIII antihémophilique de la coagulation sanguine (hémophile M*, immunat*, etc.) est un concentré sec de facteur VIII. Les médicaments sont obtenus à partir de plasma sanguin de donneur ayant subi une double inactivation virale et sont standardisés en fonction de la teneur en facteur VIII. Ils sont plus actifs et plus sûrs que le cryoprécipité*.
Le cryoprécipité* est un concentré de protéines plasmatiques sanguines, qui comprend le facteur VIII, le facteur von Willebrand, la fibronectine, ainsi que, dans une moindre mesure, d'autres facteurs de coagulation sanguine et de petites quantités de fibrinogène.
Les médicaments sont administrés par voie intraveineuse en cas de déficit héréditaire (hémophilie A) et acquis en facteur VIII. Cryoprécipité*,
en outre, il est utilisé pour le traitement substitutif de la maladie de von Willebrand (déficit héréditaire en facteur de von Willebrand) et de l'afibrinogénémie. Lors de l'administration, des effets indésirables sont possibles sous forme de tachycardie, d'hypotension artérielle, d'essoufflement, de réactions allergiques (urticaire, fièvre, choc anaphylactique), ainsi que d'hémolyse des globules rouges.
Toutes les préparations de facteurs de coagulation obtenues à partir du plasma sanguin présentent un inconvénient important : la possibilité de transmettre des infections virales (VIH, hépatite). Actuellement, des préparations recombinantes de facteur VIII et de facteur von Willebrand ont été obtenues, dont l'utilisation réduit le risque d'infection.
En plus des médicaments à base de facteurs de coagulation, pour les formes légères d'hémophilie A et de maladie de von Willebrand, l'analogue de l'arginine vasopressine, la desmopressine, est utilisé. La desmopressine augmente la teneur en facteur von Willebrand dans le plasma sanguin, favorisant sa libération par les cellules endothéliales, et augmente l'activité du facteur
VIII. Le médicament est administré par voie parentérale.
Le facteur IX de la coagulation sanguine (agemphil B*, immunine*, octanine*) est une fraction purifiée du plasma humain enrichi en facteur IX. Utilisé en cas de déficit congénital (hémophilie B) et acquis en facteur IX, ainsi qu'en cas de surdosage d'anticoagulants indirects. Les effets secondaires sont les mêmes que ceux des médicaments à base de facteur VIII.
Eptacog alpha activé (novoseven*) est un facteur VIIa recombinant de la coagulation sanguine. Utilisé en cas de déficit en facteur VII et autres facteurs de coagulation (V, II,
IX, X).
Localement, pour arrêter les saignements des petits capillaires et des organes parenchymateux, on utilise le médicament thrombine (obtenu à partir du plasma sanguin d'un donneur), ainsi que des éponges hémostatiques (collagène, gélatine).
Pour arrêter les saignements utérins, pulmonaires, rénaux, intestinaux et autres, des préparations de plantes médicinales sont utilisées : feuilles d'ortie, herbe d'achillée millefeuille, herbe de renouée poivrée, herbe de renouée, écorce de viorne, fleurs d'arnica, lagochilus enivrant. Les plantes médicinales sont utilisées sous forme d’infusions, de teintures et d’extraits par voie interne et topique.
27.3. MÉDICAMENTS AFFECTANT LA FIBRINOLYSE
Lorsque des caillots sanguins se forment, le système fibrinolytique est activé, ce qui assure la dissolution (lyse) de la fibrine et la destruction du caillot sanguin. Cela conduit au rétablissement d’un flux sanguin normal.
Au cours du processus de fibrinolyse, le plasminogène inactif est converti en plasmine (fibrinolysine) avec la participation d'activateurs du plasminogène. La plasmine hydrolyse la fibrine pour former des peptides solubles. La plasmine n'a pas de spécificité et provoque également la destruction du fibrinogène et de certains autres facteurs de coagulation sanguine, ce qui augmente le risque de saignement. La plasmine circulant dans le sang est rapidement inactivée par l'α 2 -antiplasmine et d'autres inhibiteurs et n'a donc normalement pas d'effet fibrinogénolytique systémique. Cependant, dans certaines conditions pathologiques ou lors de l'utilisation d'agents fibrinolytiques, une activation excessive du plasminogène plasmatique est possible, pouvant provoquer des saignements.
27.3.1. Agents fibrinolytiques (thrombolytiques)
Les agents fibrinolytiques sont utilisés pour dissoudre les caillots sanguins en cas de thrombose coronarienne (infarctus aigu du myocarde), de thrombose veineuse profonde, de thrombose aiguë des artères périphériques et d'embolie pulmonaire.
En tant qu'agents fibrinolytiques, des médicaments qui activent le plasminogène sont utilisés : médicaments streptokinase, médicament activateur tissulaire du plasminogène, médicaments urokinase.
Médicaments streptokinases
La streptokinase (cabikinase*) est une préparation protéique hautement purifiée obtenue à partir d'une culture de streptocoque β-hémolytique. La streptokinase n'acquiert une activité protéolytique qu'en association avec le plasminogène. Lorsque la streptokinase est administrée, un complexe streptokinase-plasminogène équimolaire se forme, convertissant le plasminogène en plasmine. La streptokinase agit sur le plasminogène à la fois dans le caillot sanguin et dans le plasma sanguin (Fig. 27-7).
La streptokinase est administrée par voie intraveineuse en cas d'infarctus aigu du myocarde provoqué par une thrombose des vaisseaux coronaires (la plupart
efficace pendant les 3 à 6 premières heures), pour la thrombose veineuse profonde, l'embolie pulmonaire et la thrombose vasculaire rétinienne. La streptokinase est dosée en ME (unités internationales).
Les complications fréquentes lors de l'utilisation de la streptokinase sont les saignements, qui peuvent être associés à la fois à l'activation du plasminogène circulant dans le sang (la plasmine résultante détruit le fibrinogène, entraînant une réduction de l'agrégation plaquettaire) et à la dissolution des caillots sanguins physiologiques. Des nausées, des vomissements et une hypotension artérielle sont possibles. En raison de la présence de propriétés antigéniques, la streptokinase peut provoquer des réactions allergiques, notamment un choc anaphylactique. Leur danger augmente avec l'administration répétée du médicament. Les anticorps circulant dans le sang peuvent inactiver la streptokinase et réduire l'efficacité du traitement.
L'anistreplase ** (eminase**) est un complexe de streptokinase et de lysine plasminogène acylée. Le groupe acyle de la molécule de plasminogène ferme le site catalytique, ce qui empêche l'activation du plasminogène. Le médicament est un promédicament et n'acquiert la capacité de convertir le plasminogène en plasmine qu'après le clivage du groupe acyle. La vitesse de désacylation et, par conséquent, le temps de formation du médicament actif dépendent de la nature du groupe acyle et peuvent aller de 40 minutes à plusieurs heures. L'anistreplase** est administré par voie intraveineuse. Après une seule injection, l'effet fibrinolytique dure 4 à 6 heures. Les indications d'utilisation et les effets secondaires sont les mêmes que pour la streptokinase.
Activateurs tissulaires du plasminogène et préparations d'urokinase
L'activateur tissulaire du plasminogène et l'urokinase sont les principaux activateurs physiologiques du plasminogène.
L'activateur tissulaire du plasminogène est produit par les cellules endothéliales. Il provoque une protéolyse partielle du plasminogène, entraînant sa conversion en plasmine. Une caractéristique distinctive de l'activateur tissulaire est sa forte affinité pour la fibrine, qui accélère des centaines de fois son effet sur le plasminogène. En conséquence, l’activateur tissulaire active à un rythme plus élevé les molécules de plasminogène adsorbées sur les filaments de fibrine. Ainsi, l’action de l’activateur tissulaire du plasminogène est limitée par la fibrine du thrombus. Entrer dans la circulation sanguine,

Riz. 27-7.Mécanisme d'action des agents fibrinolytiques : tPA - activateur tissulaire du plasminogène ; FDP - produits de dégradation du fibrinogène ; EC - cellule endothéliale ; ? - Activation; Θ - lyse
l'activateur tissulaire se lie à un inhibiteur spécifique, il a donc peu d'effet sur le plasminogène circulant dans le sang et réduit dans une moindre mesure les taux de fibrinogène.
Des préparations recombinantes d'activateur tissulaire du plasminogène ont été obtenues pour un usage clinique : altéplase (actilyse*) et ténectéplase (metalise*). Les médicaments sont administrés par voie intraveineuse pour l'infarctus aigu du myocarde provoqué par une thrombose des vaisseaux coronaires (efficace dans les 6 à 12 premières heures), pour l'embolie pulmonaire. Malgré le fait que l'altéplase ait peu d'effet sur le plasminogène circulant dans le sang, des complications hémorragiques surviennent souvent lors de son utilisation. Il n'a aucune propriété antigénique. La ténectéplase a une spécificité accrue pour la fibrine du thrombus.
L'urokinase est produite par les cellules rénales et se trouve dans l'urine. Dans les reins, il se forme une urokinase à chaîne unique (prourokinase) qui, sous l'influence de la plasmine, est convertie en une forme active - l'urokinase à double chaîne. L'urokinase à double chaîne a un effet activateur direct sur le plasminogène (la formation d'un complexe avec le plasminogène n'est pas nécessaire). La préparation d'urokinase à double chaîne est obtenue à partir d'une culture de cellules rénales embryonnaires humaines. Utilisé pour l'infarctus aigu du myocarde, la thrombose veineuse et artérielle, l'embolie pulmonaire. Administré par voie intraveineuse. Dosé en MOI. Par rapport à l'activateur tissulaire du plasminogène, l'urokinase agit dans une plus grande mesure sur le plasminogène circulant dans le sang, de sorte que la plasmine formée dans le sang provoque la dégradation du fibrinogène (voir Fig. 27-7). Dans le même temps, l'agrégation plaquettaire diminue et des produits de dégradation du fibrinogène se forment, qui ont une activité anticoagulante. Les principaux effets secondaires sont les saignements. N'a pas de propriétés antigéniques.
Une préparation recombinante d'urokinase à chaîne unique (prourokinase) - c a p up l a z a * - a été obtenue, qui présente une plus grande spécificité pour la fibrine du thrombus que l'urokinase.
27.3.2. Agents antifibrinolytiques
Les médicaments antifibrinolytiques sont utilisés pour arrêter les saignements causés par une activité accrue du système fibrinolytique lors de blessures, d'interventions chirurgicales, d'accouchements,
maladies du foie, prostatite, ménorragie, ainsi qu'un surdosage de médicaments fibrinolytiques. À ces fins, des médicaments qui inhibent l'activation du plasminogène ou sont des inhibiteurs de la plasmine sont utilisés.
L'acide aminocaproïque se lie au plasminogène et empêche sa conversion en plasmine. De plus, il interfère avec l’effet de la plasmine sur la fibrine. Le médicament est administré par voie orale et intraveineuse. Effets secondaires possibles : hypotension artérielle, bradycardie, arythmies, vertiges, nausées, diarrhée. L'acide aminométhylbenzoïque (Ambene*, Pamba*) a un effet similaire.
L'acide tranexamique (tranexam*, cyclocapron*) inhibe l'activation du plasminogène. Le médicament est administré par voie orale et intraveineuse. Il est plus efficace que l'acide aminocaproïque et dure plus longtemps. Les effets secondaires comprennent des symptômes dyspeptiques (anorexie, nausées, vomissements, diarrhée), des étourdissements, une somnolence ; des réactions allergiques cutanées sont possibles.
L'aprotinine (Gordox*, Contrical*, Trasylol*, Ingitril*) inhibe la plasmine et d'autres enzymes protéolytiques. Le médicament est administré par voie intraveineuse. Effets secondaires : hypotension artérielle, tachycardie, nausées, vomissements, réactions allergiques.
Les plaquettes, les plus petites cellules sanguines (par rapport aux leucocytes et aux globules rouges), remplissent la fonction la plus importante : elles protègent l'organisme contre la perte de sang. L'agrégation plaquettaire est le processus de collage des cellules, étape initiale de la formation d'un caillot sanguin.
La deuxième étape est la fixation des plaquettes à la paroi du vaisseau endommagé. Des fils de fibrine, d'autres éléments et de nouvelles cellules adhérentes se superposent à la masse plaquettaire. Ainsi, le thrombus grossit jusqu'à atteindre une taille capable de bloquer le diamètre du vaisseau et d'arrêter le saignement. Parfois, la vie d’une personne dépend de la rapidité du processus.
Le rôle de l'agrégation plaquettaire dans le processus de coagulation sanguine
La coagulation du sang dépend de nombreux facteurs. L’un d’eux, l’agrégation plaquettaire, dans un corps sain, est de nature protectrice et adaptative. Les cellules se collent uniquement dans un vaisseau qui saigne. Dans ce cas, le processus joue un rôle positif.
Mais il existe des conditions pathologiques connues dans lesquelles la formation de caillots sanguins est indésirable, car elle entraîne une perturbation de la nutrition des organes vitaux. Par exemple, en cas d'infarctus du myocarde, d'accident vasculaire cérébral, de thrombose des artères principales. L'activité d'agrégation des plaquettes prend le parti des changements pathologiques. Il faut lutter contre cela à l’aide de divers médicaments.
Il existe un besoin pratique de quantifier la bonne et la mauvaise agrégation plaquettaire. Pour ce faire, vous devez utiliser la norme et distinguer les écarts.
Comment déterminer la normalité et la pathologie ?
Un test sanguin peut-il montrer la capacité d’agrégation plaquettaire d’une personne en particulier ? Après tout, pour mener l’étude, on prélève du sang dans une veine, et à partir de ce moment, les « ordres » du corps n’agissent plus sur les cellules sanguines. Ce type d'analyse est appelé « in vitro », traduction littérale du latin « sur verre, dans un tube à essai ». Les scientifiques tentent toujours d’étudier la réaction dans des conditions proches du corps humain. Seules les données ainsi obtenues peuvent être considérées comme fiables et utilisées dans le diagnostic.
Les capacités plaquettaires sont déterminées par l'agrégation induite. Cela signifie que des substances qui ne sont pas étrangères au corps dans leur composition chimique et qui peuvent provoquer des caillots sanguins sont utilisées comme substance inductrice. Des composants de la paroi vasculaire sont utilisés comme inducteurs : adénosine diphosphate (ADP), ristocétine (ristomycine), collagène, sérotonine, acide arachidonique, adrénaline.
L'agrégation spontanée est déterminée sans inducteurs.
Les techniques de quantification reposent sur le passage d’ondes lumineuses à travers un plasma sanguin riche en plaquettes. Le degré d'activité d'agrégation est étudié par la différence de densité lumineuse du plasma avant le début de la coagulation et après l'obtention du résultat maximum. Le taux d'agrégation dans la première minute, la nature et la forme des vagues sont également déterminés.
Le taux dépend de la substance inductrice et de sa concentration.
L'agrégation plaquettaire avec l'ADP est généralement prescrite et évaluée en association avec le collagène, la ristomycine et l'adrénaline.
La norme d'analyse avec ADP est de 30,7 à 77,7 %. Le taux d'agrégation plaquettaire avec l'adrénaline varie de 35 à 92,5 %. Dans une étude avec le collagène, les valeurs normales sont considérées comme comprises entre 46,4 et 93,1 %.
Règles de préparation à l'analyse
Pour effectuer un test sanguin sur la capacité d'agrégation, vous devez comprendre que le test sera inexact si les règles de préparation ne sont pas respectées. Il y aura des substances dans le sang qui affecteront le résultat.
- Une semaine avant le don de sang, tous les médicaments à base d'aspirine, le dipyridamole, l'indométacine, la sulfapyridazine et les antidépresseurs doivent être arrêtés. L'utilisation de ces médicaments inhibe (supprime) la formation de thrombus. Si vous ne pouvez pas arrêter de le prendre, vous devez en informer le technicien de laboratoire.
- Vous ne devez pas manger pendant au moins 12 heures ; les aliments gras que vous consommez affectent particulièrement vos résultats.
- Le patient doit être aussi calme que possible et ne pas effectuer de travail physique.
- La veille, excluez le café, l'alcool, l'ail des aliments et ne fumez pas.
- L'analyse n'est pas effectuée s'il existe un processus inflammatoire actif.
Les plaquettes agglomérées sont visibles au microscope
Un test sanguin d'agrégation plaquettaire est prescrit par un médecin si un traitement par anticoagulants est nécessaire, en surveillant leur efficacité, en sélectionnant la posologie optimale, pour diagnostiquer une augmentation des saignements.
Décoder les résultats
Les raisons de mener des études avec trois inducteurs standards à la fois et, si nécessaire, d'en ajouter de nouveaux, sont le mécanisme prédominant d'activation de l'un des facteurs de coagulation. La norme altérée identifiée, par exemple avec l'ADP en l'absence de dynamique avec d'autres inducteurs, a une signification diagnostique. Les résultats sont évalués par un médecin.
Une diminution de l’agrégation plaquettaire peut être causée par :
- utilisation réussie du traitement antiplaquettaire ;
- un groupe de maladies appelées thrombocytopathies.

Appareil d'analyse d'agrégation
Le rôle de la thrombocytopathie
Les thrombocytopathies peuvent être héréditaires ou acquises à la suite d'autres maladies. Les statistiques indiquent que jusqu'à 10 % de la population mondiale souffre de cette pathologie. Tous sont associés à un dysfonctionnement des plaquettes lors de l'accumulation de certaines substances.
En conséquence, la coagulation et la formation de caillots sanguins ne se produisent pas, ce qui entraîne une augmentation des saignements dans les petites plaies et contusions (hémorragie interne).
Les maladies apparaissent déjà dans l’enfance avec des saignements des gencives, des saignements de nez fréquents, de nombreuses ecchymoses sur le corps de l’enfant, un gonflement des articulations dû à des ecchymoses. Durant la puberté, les filles commencent à avoir des règles longues et abondantes. Le saignement conduit au développement d'une anémie (anémie).
Une faible capacité d'agrégation dans la thrombocytopathie peut être activée par des infections virales et bactériennes, des médicaments et des procédures physiothérapeutiques.

Les saignements de nez sont causés dans 80 % des cas par une thrombocytopathie et seulement 20 % par des maladies des organes ORL.
Thrombocytopathies secondaires
Des thrombocytopathies symptomatiques (secondaires) se forment dans la leucémie chronique, le myélome. Cette condition est typique du stade final de l'insuffisance rénale (urémie), une diminution de la fonction thyroïdienne.
Les chirurgiens sont confrontés à des thrombocytopathies en cas d'augmentation des saignements lors d'interventions chirurgicales.
Une augmentation de l’agrégation plaquettaire est observée avec :
- athérosclérose vasculaire généralisée;
- hypertension;
- infarctus des organes internes;
- thrombose des artères abdominales;
- accident vasculaire cérébral;
- diabète sucré
Modifications de l'agrégation pendant la grossesse
L'agrégation plaquettaire pendant la grossesse peut s'écarter des valeurs normales.
L'agrégation est réduite en raison d'une production insuffisante de plaquettes ou d'une violation de leur composition qualitative. Cela se manifeste par des saignements et des ecchymoses. Lors de l'accouchement, la possibilité de saignements massifs doit être prise en compte.
L'agrégation est augmentée le plus souvent au cours de la toxicose en raison de la perte de liquide due aux vomissements et à la diarrhée. Une augmentation de la concentration sanguine entraîne une augmentation de la formation de thrombus. Cela peut conduire à une fausse couche précoce. Une hyperagrégation modérée est considérée comme normale pendant la grossesse et est associée au développement de la circulation placentaire.
- en cas de fausse couche ;
- traitement de l'infertilité;
- avant et pendant la prise de contraceptifs ;
- avant une grossesse planifiée.
L'analyse des propriétés d'agrégation plaquettaire nous permet d'identifier les risques, de prédire les complications dangereuses des maladies et d'effectuer rapidement un traitement préventif.
Les plaquettes sont des cellules sanguines incolores. Ils remplissent une fonction importante dans le corps, en le protégeant de la perte de sang. Ce processus est l'agrégation des plaquettes dans le sang, il possède ses propres indicateurs standards.
Pour comprendre de quoi il s'agit, vous devez avoir une idée de la formation d'un caillot sanguin, des normes existantes et du danger d'écarts par rapport aux valeurs normales.
Description et rôle dans le corps humain
Après une lésion tissulaire, les plaquettes se fixent aux parois du vaisseau endommagé. En conséquence, les cellules se collent les unes aux autres. Au fil du temps, des fils de fibrine, de nouvelles cellules collées et d'autres éléments s'ajoutent à la masse résultante.
Dans ce contexte, un caillot sanguin se développe et atteint de grandes tailles, ce qui peut entraîner le blocage du vaisseau et l'arrêt du saignement. La rapidité d'un tel processus est très importante, car la préservation de la vie humaine en dépend parfois.

La coagulation du sang est influencée par un grand nombre de facteurs. L'un d'eux est l'agrégation. En l'absence de conditions pathologiques, il remplit une fonction adaptative protectrice.
Les caractéristiques d'agrégation consistent en le collage des cellules uniquement dans le vaisseau endommagé. Dans ce cas, le processus est considéré comme positif.
.jpg)
Cependant, il existe des situations dans lesquelles la thrombose n'est pas souhaitable. Par exemple, si un accident vasculaire cérébral ou un infarctus du myocarde est diagnostiqué.
Cela s'explique par le fait que la formation de caillots sanguins empêche le flux normal des substances nécessaires vers les organes vitaux.
Dans ce cas, les plaquettes prennent le parti des processus pathologiques. Les écarts par rapport à la norme ne peuvent être traités qu'à l'aide de médicaments.
Pour identifier les indicateurs normaux des indicateurs anormaux, il est nécessaire de procéder à une analyse quantitative de l'agrégation positive et négative.
Types
Dans la pratique médicale, il existe une certaine classification des agrégations par type. Ceux-ci inclus:

- Agrégation modérée. Elle est diagnostiquée principalement pendant la grossesse. La condition peut être déclenchée par la circulation placentaire.
- Agrégation spontanée. Un inducteur n’est pas requis pour la détection. Pour détecter l'activité d'agrégation, le sang est versé dans un tube à essai placé dans un appareil spécial, où il est chauffé à 37 degrés.
- Agrégation induite. Pour mener l'étude, des inducteurs sont ajoutés au plasma. Dans ce cas, l'agrégation se produit avec l'ADP, le collagène, la ristomycine et l'adrénaline. Cette méthode est utilisée dans les cas où il est nécessaire de diagnostiquer certaines pathologies du liquide sanguin.
- Une agrégation accrue favorise la formation de caillots sanguins. Les symptômes caractéristiques de cet état pathologique sont un engourdissement et un gonflement.
- Une agrégation réduite est le plus souvent détectée en cas de troubles du fonctionnement du système circulatoire. Une diminution du nombre de plaquettes provoque divers saignements. Cela se produit chez le beau sexe pendant le cycle menstruel.
L'augmentation et la diminution de l'agrégation sont dangereuses pour la santé humaine. Par conséquent, le taux de plaquettes dans le sang doit être régulièrement surveillé.
Symptômes d'écarts par rapport aux indicateurs
L'hyperagrégation s'accompagne d'une augmentation de la viscosité du sang et d'une diminution de la vitesse de son écoulement, ce qui affecte négativement tous les systèmes et organes humains.
Cependant, il existe des conditions pathologiques dans lesquelles une agrégation prononcée est un phénomène normal, ce qui n'est pas considéré comme une raison pour refuser l'étude constante des indicateurs de coagulation.
Ces maladies comprennent :
- augmentation de la pression artérielle;
- diabète;
- cancer;
- pathologies vasculaires.
La détection intempestive de l'hyperagrégation et le manque d'assistance peuvent conduire au développement d'une crise cardiaque, d'un accident vasculaire cérébral et d'une thrombose veineuse.
Une diminution des indicateurs d'agrégation s'accompagne d'hémorragies prolongées, notamment internes, qui se manifestent par la formation d'hématomes.
Quelle est la norme
Les normes de taux de plaquettes chez un adulte et chez un enfant seront légèrement différentes. Les valeurs optimales des indicateurs sont présentées dans le tableau ci-dessous.
Si nous parlons de valeurs d'agrégation normales, elles seront alors de 25 à 75 pour cent. Dans ce cas, les plaquettes se collent sans déviations et ne constituent pas une menace pour le corps humain.
Quelles recherches sont menées ?
L'analyseur d'agrégation plaquettaire est une formule sanguine complète. Cependant, il existe d’autres études qui fournissent des résultats plus précis. Les principales méthodes comprennent les tests suivants :
.jpg)
- selon Lee-White ;
- coagulogramme.
Leur essence réside dans le fait que des substances spéciales sont ajoutées au sang qui inhibent l'agrégation..
Ces composants sont similaires aux substances contenues dans le corps humain, qui provoquent la formation de caillots sanguins. Ces composants sont appelés inducteurs.
Préparation à l'analyse
Avant d'effectuer l'analyse, il est nécessaire de subir une certaine préparation. Pour que les résultats soient aussi précis que possible, le liquide sanguin ne doit pas contenir de substances susceptibles d'avoir un effet négatif sur celui-ci.
Activités préparatoires :
- Une semaine avant l'analyse, certains médicaments à base d'aspirine sont exclus, car leur utilisation supprime la formation de thrombus. S'il n'est pas possible d'annuler ces médicaments, le technicien de laboratoire qui effectue l'étude doit en être informé.
- Vous devez arrêter de manger pendant 12 heures. Les produits, en particulier ceux à haute teneur en matières grasses, affectent également négativement les résultats.
- Évitez le stress physique et émotionnel.
- Pendant la journée, ne prenez pas de boissons alcoolisées, de café, d'ail et ne fumez pas.
L'analyse est reportée en cas de processus inflammatoire actif.
Réalisation
Le prélèvement sanguin est effectué le matin, entre 7 heures et 10 heures. L'étude ne peut être réalisée qu'à jeun. Il est permis de boire de l'eau plate.
Pour effectuer un hémotest, du liquide sanguin est prélevé dans une veine. Une seringue jetable est utilisée à ces fins. Le matériau est ensuite placé dans un agrégomètre contenant une solution de citrate de sodium à 4 %. Ensuite, le récipient est retourné plusieurs fois. Ensuite, le tube de sang est envoyé au laboratoire pour des tests plus approfondis.
Décoder les résultats
En tenant compte de la substance utilisée lors de l'étude, l'analyse est déchiffrée. Pour ce faire, les indicateurs obtenus sont comparés aux valeurs normales présentées ci-dessous.
Si une augmentation par rapport à la norme est observée, une hyperagrégation est diagnostiquée. Cela peut survenir dans des conditions pathologiques telles que :
.jpg)
- leucémie;
- pathologies du tractus gastro-intestinal ou des reins ;
- athérosclérose;
- diabète;
- hypertension artérielle;
- état septique;
- lymphogranulomatose.
Si les écarts sont à la baisse, une hypoagrégation est diagnostiquée. Elle peut être causée par des pathologies sanguines ou par un traitement par des agents antiplaquettaires.
Le pourcentage indique le niveau de transmission de la lumière du plasma après que la substance inductrice y soit ajoutée. Si le nombre de plaquettes est faible, ce chiffre est de 100 pour cent, et s'il est élevé, il est nul.
Caractéristiques de l'agrégation chez les femmes enceintes
Pendant la grossesse, des écarts par rapport à la norme sont autorisés, qui varient de 30 à 60 pour cent pendant cette période.
Une désagrégation peut être observée en cas de manque de plaquettes, ainsi qu'en cas de modification de leur composition qualitative, qui se manifeste par des saignements et des ecchymoses.
Une agrégation accrue se produit pendant la toxicose, lorsque le patient subit une perte importante de liquide à la suite de vomissements ou de diarrhée. Une augmentation de la concentration sanguine provoque une formation accrue de caillots sanguins. Cela menace une fausse couche précoce.
Comment normaliser les valeurs ?
Si un trouble de la coagulation sanguine est diagnostiqué, il est nécessaire de prendre immédiatement des mesures pour éliminer l'état pathologique. Une augmentation de l'agrégation peut entraîner une thrombose et une diminution peut entraîner des saignements abondants et dangereux.
Aux premiers stades du développement de l'hyperagrégation, les spécialistes prescrivent des médicaments capables de fluidifier le sang. L'aspirine ordinaire peut faire face à cette tâche.
Sur la base des résultats d'un examen complémentaire, les éléments suivants sont souvent prescrits :
.jpg)
- analgésiques;
- blocage de la novocaïne ;
- médicaments favorisant la vasodilatation;
- anticoagulants, qui empêchent une coagulation rapide.
Parfois, les méthodes traditionnelles ne sont pas moins efficaces. Il convient de rappeler qu'un tel traitement doit être convenu avec le médecin traitant.
Parmi les recettes éprouvées figurent les suivantes :
- Versez une cuillère à soupe de mélilot dans 200 ml d'eau bouillie et laissez infuser 30 minutes. Utilisez le mélange préparé par jour en plusieurs doses. La durée du traitement est d'un mois.
- Préparez un litre et demi d'eau bouillante en quantités égales (une cuillère à café) de gingembre et de thé vert. Ajoutez une pincée de cannelle. Laisser poser un quart d'heure et prendre tout au long de la journée.
- Buvez du jus d'orange fraîchement pressé tous les jours. Peut être mélangé à parts égales avec de la citrouille.
Il est également important de maintenir une bonne alimentation. Le régime doit inclure :
- agrumes;
- gingembre;
- ail;
- légumes rouges et verts ;
- fruit de mer.
Si votre sang coagule mal, vous ne devez pas prendre de médicaments. qui fluidifie le liquide sanguin. Si le processus a acquis une forme avancée, les mesures thérapeutiques ne sont effectuées que dans des conditions stationnaires.
Les médicaments suivants sont prescrits :

- Émosint ;
- Acide aminocaproïque et tranexamique ;
- Injection d'ATP ;
Le régime doit inclure de la bouillie de sarrasin, des œufs, des betteraves et des carottes, de la grenade, du foie de bœuf et de la viande rouge.
Pour maintenir le sang dans un état normal, il est nécessaire de respecter strictement le régime de consommation d'alcool. Au moins un litre et demi d'eau propre est considéré comme la norme par jour. La nourriture doit être fraîche et équilibrée.
Le respect des règles nutritionnelles constitue la prévention de nombreuses maladies du corps humain. L'activité physique joue également un rôle tout aussi important. Ils aident non seulement à renforcer le corps, mais également à normaliser tous les processus internes.
Avec un diagnostic rapide des écarts dans les indicateurs d'agrégation, de nombreuses maladies et complications peuvent être évitées. Le niveau d’agrégation plaquettaire doit être surveillé régulièrement.
Les plaquettes sont de petites cellules sanguines responsables de la coagulation du sang. Ils aident à arrêter la perte de sang en cas de saignement.
Lorsqu'une blessure survient, les plaquettes se déplacent vers la zone blessée. Ici, ils sont attachés à la paroi du vaisseau endommagé, ce qui entraîne l'arrêt du saignement. Ce processus est appelé agrégation plaquettaire.
L'agrégation plaquettaire est un processus par lequel les cellules sanguines adhèrent les unes aux autres et se fixent sur la paroi du vaisseau blessé. Cela arrête le saignement. Cependant, un tel processus peut aussi être dangereux pour l’organisme. Dans ce cas, un caillot sanguin se forme et peut, dans certaines circonstances, provoquer une crise cardiaque et un accident vasculaire cérébral. Cela peut se produire si les plaquettes sont hyperactives et que leur agrégation se produit trop rapidement.
De plus, le processus lent ne promet rien de bon pour le corps. Dans ce cas, une mauvaise coagulation sanguine peut survenir en raison de la lente adhésion des plaquettes. Cette pathologie provoque une anémie. Si la coagulation du sang est mauvaise, il est difficile d’arrêter le saignement, ce qui peut entraîner des problèmes de santé, voire la mort. Pour éviter que cela ne se produise, il est nécessaire de surveiller le niveau de plaquettes dans le sang et leur capacité à se coller.
Le processus d'agrégation plaquettaire pendant la grossesse
 Il est extrêmement important que l'agrégation plaquettaire se déroule normalement pendant la grossesse. Si le processus se déroule trop lentement, des saignements de l'utérus peuvent survenir pendant l'accouchement ou pendant la période post-partum, pouvant entraîner la mort de la femme. De plus, si l'agrégation plaquettaire se produit rapidement pendant la grossesse, des caillots sanguins peuvent se former, ce qui peut entraîner son interruption à tout moment pendant la grossesse.
Il est extrêmement important que l'agrégation plaquettaire se déroule normalement pendant la grossesse. Si le processus se déroule trop lentement, des saignements de l'utérus peuvent survenir pendant l'accouchement ou pendant la période post-partum, pouvant entraîner la mort de la femme. De plus, si l'agrégation plaquettaire se produit rapidement pendant la grossesse, des caillots sanguins peuvent se former, ce qui peut entraîner son interruption à tout moment pendant la grossesse.
Vous pouvez éviter cette situation si vous planifiez votre grossesse et prenez soin de votre santé à l'avance. Il est nécessaire, avant même la conception, de connaître l'état des plaquettes et, si nécessaire, de prendre des mesures pour corriger la situation. Si la grossesse n'a pas été planifiée, la pathologie de l'agrégation peut être évitée en s'inscrivant à un stade précoce. Ensuite, le médecin prescrira les tests nécessaires et aidera à se débarrasser de l'état pathologique des plaquettes s'il en est détecté.
Numération plaquettaire normale dans le sang
Pour connaître l’état du taux de plaquettes, il faut avoir une idée de leur taux normal.
Si nous parlons du taux de regroupement, il est alors de 25 à 75 %. Dans ce cas, le processus de collage des plaquettes se déroule bien et ne présente aucun risque pour la santé.
Si des écarts par rapport à la norme sont observés, un traitement approprié est alors prescrit pour aider à corriger la situation.Test sanguin pour l'agrégation plaquettaire
Un test sanguin appelé agrégation induite permet d’étudier l’état des plaquettes. Dans ce cas, le sang est prélevé dans la veine du patient et mélangé à des substances spéciales. Ces agents ont une composition similaire à celle des cellules du corps qui participent au processus d’agrégation. Les substances suivantes sont le plus souvent prises comme inducteurs :
- adénosine diphosphate (ADP);
- collagène;
- la sérotonine ;
- la ristocétine;
- adrénaline;
- l'acide arachidonique.
La procédure la plus couramment pratiquée est l’agrégation plaquettaire avec l’ADP. Pour réaliser l'étude, un appareil spécial est utilisé. C'est ce qu'on appelle un analyseur d'agrégation plaquettaire. Avec son aide, des ondes lumineuses traversent le sang avant qu'il ne commence à coaguler et une fois ce processus terminé. Ensuite, le résultat est évalué.
Préparation aux tests
 Pour garantir que le résultat soit le plus précis possible, vous devez suivre les règles suivantes lors de la prise de sang :
Pour garantir que le résultat soit le plus précis possible, vous devez suivre les règles suivantes lors de la prise de sang :
- L'étude est réalisée à jeun. Dans ce cas, vous devez arrêter de manger 12 heures avant le test. Dans ce cas, vous pouvez boire de l’eau plate et propre.
- 7 jours avant le test, vous devez arrêter le traitement médicamenteux avec certains médicaments. Si cela n'est pas possible, vous devez en informer le médecin qui effectue l'analyse.
- Quelques jours avant l'analyse, il faut éviter les situations stressantes et l'activité physique.
- Vous devez arrêter de boire du café, de fumer, de boire de l'alcool et de l'ail 24 heures à l'avance.
- La recherche ne peut être effectuée si un processus inflammatoire se produit dans le corps.
Indications d'analyse
 Vous pouvez effectuer de temps à autre un test d’agrégation plaquettaire de votre propre initiative.
Vous pouvez effectuer de temps à autre un test d’agrégation plaquettaire de votre propre initiative. Interprétation du résultat de l'analyse de l'agrégation induite
L'interprétation des indicateurs dépend des moyens par lesquels l'étude a été menée. Pour ce faire, les données sont comparées à la norme.
Si les résultats s'écartent de la norme vers le haut, une augmentation de l'agrégation plaquettaire est diagnostiquée. Cette condition se produit lorsque : 
- hypertension artérielle;
- athérosclérose;
- leucémie;
- diabète sucré;
- maladies oncologiques du tractus gastro-intestinal ou des reins;
- lymphogranulomatose;
- état septique;
- ablation chirurgicale de la rate.
L'agrégation accrue des plaquettes peut entraîner une crise cardiaque, un accident vasculaire cérébral, une thrombose et la mort en raison du blocage d'un vaisseau par un thrombus.
Si les résultats s'écartent de la norme vers une diminution, une agrégation réduite de thrombose est alors diagnostiquée. Cela est dû à:
- maladies du sang;
- thrombocytopathie;
- utilisation d'agents antiplaquettaires.
Avec une agrégation réduite, les vaisseaux deviennent fragiles. De plus, le processus d'arrêt du saignement est difficile, ce qui peut entraîner la mort.
Moyens qui réduisent le processus d’agrégation
Certains agents inhibent le processus d'agrégation. Ces médicaments comprennent des agents antiplaquettaires. Les inhibiteurs de l'agrégation plaquettaire comprennent des médicaments tels que l'acide acétylsalicylique, l'ibustrine, la micristine et d'autres. Ces médicaments sont prescrits pour le traitement de certaines maladies. Cependant, si le processus d'agrégation s'écarte fortement de la norme, les médicaments inhibiteurs doivent alors être remplacés par d'autres agents qui n'entraînent pas de telles conséquences. Si cela n'est pas possible, le médecin peut alors prescrire des médicaments spéciaux favorisant l'agrégation.
L’augmentation ou la diminution de l’agrégation peut avoir des conséquences désastreuses. De telles situations ne peuvent donc être ignorées. Dans de tels cas, vous devez consulter un médecin pour vous prescrire un traitement approprié.